Thuốc kháng vitamin K đã được tìm ra từ hơn 60 năm và đã được dùng để điều trị chống đông từ hơn 40 năm nay 1. Các thuốc kháng vitamin K là những dẫn xuất coumarin, gồm warfarin, acenocoumarol, phenprocoumon và ethylbiscoumacetate. Các thuốc kháng vitamin K ức chế enzym vitamin K-epoxide-reductase và vitamin K-reductase, qua đó ức chế sự chuyển vitamin K dạng oxy hóa thành vitamin K dạng khử. Hậu quả của sự thiếu hụt vitamin K dạng khử là suy giảm phản ứng carboxyl hóa biến tiền yếu tố đông máu (chưa có hoạt tính) thành yếu tố đông máu có hoạt tính 2. Như vậy, cơ chế tác dụng của thuốc kháng vitamin K là ức chế sự tổng hợp dạng có hoạt tính của các yếu tố đông máu phụ thuộc vitamin K (gồm yếu tố II, VII, IX và X).
Chỉ định dùng thuốc kháng vitamin K gồm: ngừa đột quị và thuyên tắc mạch hệ thống trong bệnh van 2 lá hậu thấp, ở bệnh nhân rung nhĩ, ngừa huyết khối van tim nhân tạo và phòng ngừa thứ phát thuyên tắc huyết khối tĩnh mạch (huyết khối tĩnh mạch sâu và thuyên tắc động mạch phổi). Hiện nay INR được xem là xét nghiệm chuẩn để đánh giá mức độ chống đông bằng thuốc kháng vitamin K 2. Vì không thể có được một giá trị INR cố định trong suốt quá trình điều trị dài hạn, các hướng dẫn thực hành thường đưa ra một khoảng INR cần đạt (2,5 – 3,5 đối với người mang van tim nhân tạo cơ học và 2 – 3 trong những trường hợp còn lại). Liều thuốc kháng vitamin K được điều chỉnh để đạt INR trong khoảng này. Duy trì INR trong một khoảng nào đó là một công việc rất khó khăn. INR có thể dao động (dù liều thuốc kháng vitamin K không đổi) do những thay đổi của lượng vitamin K trong khẩu phần ăn (các loại thức ăn chứa nhiều vitamin K gồm bắp cải, bông cải, cải xoăn, rau diếp, rau bina, gan bò, gan heo), do thay đổi của chức năng gan, do tương tác thuốc (thuốc kháng vitamin K tương tác với rất nhiều thuốc) hoặc do bệnh nhân không tuân trị 2. Trên thực tế, để duy trì INR trong một khoảng đích cần thực hiện xét nghiệm này một cách định kỳ, không thưa hơn một lần mỗi tháng và mỗi khi có phối hợp thêm một thuốc có thể tương tác với thuốc kháng vitamin K. Ngoài ra, cần coi trọng việc huấn luyện, giáo dục bệnh nhân. Gần đây hãng Roche Diagnostics giới thiệu một dụng cụ đo INR trên máu mao mạch trích từ đầu ngón tay (tương tự như dụng cụ đo đường huyết mao mạch). Dụng cụ này (mang tên CoaguChek) cho phép đơn giản hóa việc theo dõi INR, bệnh nhân có thể dùng nó để tự theo dõi và điều chỉnh liều thuốc kháng vitamin K tại nhà. Một nghiên cứu phân nhóm ngẫu nhiên trên 737 bệnh nhân cho thấy tự theo dõi INR và điều chỉnh liều thuốc tại nhà với dụng cụ CoaguChek giúp đạt hiệu quả chống đông và độ an toàn tương đương điều trị chống đông qui ước tại phòng khám 3.
Nói chung, thuốc kháng vitamin K có nhiều nhược điểm như: bắt đầu tác dụng chậm, cách theo dõi điều trị phức tạp, khoảng trị liệu hẹp, tương tác với nhiều loại thức ăn và thuốc. Từ đầu thế kỷ này các nhà nghiên cứu đã tìm cách phát triển những thuốc chống đông uống mới không có các nhược điểm nêu trên. 2 nhóm thuốc đã được đưa vào dùng trong lâm sàng là nhóm ức chế trực tiếp thrombin và nhóm ức chế trực tiếp Xa.
THUỐC ỨC CHẾ TRỰC TIẾP THROMBIN
Nhóm thuốc ức chế trực tiếp thrombin gồm những thuốc dùng đường tiêm truyền (như hirudin, argatroban và bivalirudin) và thuốc dùng đường uống 4. Có 2 thuốc ức chế trực tiếp thrombin dùng đường uống đã được nghiên cứu là ximelagatran và dabigatran, tuy nhiên chỉ có dabigatran là được đưa vào dùng trong lâm sàng. Trong 2 nghiên cứu SPORTIF (Stroke Prevention Using an Oral Thrombin Inhibitor in Atrial Fibrillation) III và SPORTIF V, ximelagatran có hiệu quả tương đương warfarin trong việc ngăn ngừa đột quị và thuyên tắc mạch hệ thống ở bệnh nhân rung nhĩ 5,6. Tuy nhiên tổng hợp số liệu của 2 nghiên cứu này cho thấy tỉ lệ bệnh nhân có nồng độ alanine aminotransferase huyết thanh tăng ít nhất gấp 3 lần giới hạn trên ở nhóm ximelagatran cao hơn đáng kể so với ở nhóm warfarin (6,1% so với 0,8%). Trên cơ sở này, Cơ quan quản lý thực phẩm và thuốc Hoa Kỳ (Food and Drug Administration – FDA) đã không cấp phép lưu hành cho ximelagatran.
Dabigatran có dạng bào chế là dabigatran etexilate. Sau khi hấp thu qua đường uống, dabigatran etexilate được chuyển thành dabigatran là dạng có hoạt tính dưới tác dụng của enzym esterase trong huyết thanh. Dabigatran được thải khoảng 80% ở thận và có bán thời gian loại thải là 12-17 giờ 4. Dabigatran có những ưu điểm sau so với thuốc kháng vitamin K: bắt đầu tác dụng sớm (0,5-2 giờ) sau khi uống, không tương tác với thức ăn, không chuyển hóa bởi hệ CYP450 ở gan (do đó nguy cơ tương tác thuốc được giảm thiểu), dùng với liều cố định mà không cần phải theo dõi xét nghiệm đông máu 4,7. Khác với ximelagatran, dabigatran không ảnh hưởng đến nồng độ aminotransferase huyết thanh.
Dabigatran đã được nghiên cứu trong 2 chỉ định. Chỉ định thứ nhất là phòng ngừa đột quị và thuyên tắc mạch hệ thống ở bệnh nhân rung nhĩ. Nghiên cứu giúp xác định vị trí của dabigatran trong chỉ định này là RE-LY (Randomized Evaluation of Long-term Anticoagulation Therapy) 8. RE-LY là một thử nghiệm lâm sàng phân nhóm ngẫu nhiên thực hiện trên 18.113 bệnh nhân rung nhĩ kèm ít nhất một tình trạng sau: tiền sử đột quị hoặc cơn thiếu máu não thoáng qua, phân suất tống máu thất trái dưới 40%, có triệu chứng suy tim từ độ II trở lên theo phân độ NYHA (New York Heart Association) trong vòng 6 tháng trước, và tuổi ít nhất là 75 hoặc tuổi 65-74 kèm đái tháo đường, tăng huyết áp hoặc bệnh mạch vành. Tiêu chuẩn loại trừ gồm: bệnh van tim nặng, đột quị trong vòng 14 ngày hoặc đột quị nặng trong vòng 6 tháng trước, độ thanh thải creatinine dưới 30 ml/phút, bệnh gan tiến triển và có thai. Bệnh nhân tham gia nghiên cứu có tuổi trung bình 71,5, nam giới chiếm tỉ lệ 64%, 20% đã từng bị đột quị hoặc cơn thiếu máu não thoáng qua và gần 17% đã từng bị nhồi máu cơ tim. Tỉ lệ rung nhĩ kịch phát (paroxysmal)/dai dẳng (persistent)/thường trực (permanent) là 32%/33%/35%. Bệnh nhân được phân ngẫu nhiên vào 1 trong 3 nhóm: nhóm dùng dabigatran 110 mg x 2/ngày, nhóm dùng dabigatran 150 mg x 2/ngày và nhóm dùng warfarin (với liều được điều chỉnh để đạt INR trong khoảng 2-3). Thời gian theo dõi trung vị là 2 năm. Tiêu chí đánh giá chính về hiệu quả là đột quị hoặc thuyên tắc mạch hệ thống. Tiêu chí đánh giá chính về tính an toàn là chảy máu nặng (chảy máu khiến hemoglobin giảm ít nhất 20 g/l, phải truyền ít nhất 2 đơn vị máu, hoặc chảy máu có triệu chứng vào một vùng hoặc cơ quan quan trọng).
Kết quả RE-LY cho thấy tần suất đột quị/thuyên tắc mạch hệ thống là 1,69%/năm ở nhóm warfarin, 1,53%/năm ở nhóm dabigatran 110 mg (nguy cơ tương đối so với warfarin 0,91; Khoảng tin cậy 95% 0,74 đến 1,11) và 1,11%/năm ở nhóm dabigatran 150 mg (nguy cơ tương đối so với warfarin 0,66; Khoảng tin cậy 95% 0,53 đến 0,82; P < 0,001). Trên hình 1 là các đường Kaplan-Meier biểu diễn tần suất dồn của biến cố đột quị/thuyên tắc mạch hệ thống của 3 nhóm. Tần suất chảy máu nặng là 3,36%/năm ở nhóm warfarin, 2,71%/năm ở nhóm dabigatran 110 mg (p = 0,003 so với warfarin) và 3,11%/năm ở nhóm dabigatran 150 mg (p = 0,31 so với warfarin). Tần suất tử vong do mọi nguyên nhân là 4,13%/năm ở nhóm warfarin, 3,75%/năm ở nhóm dabigatran 110 mg (p = 0,13 so với warfarin) và 3,64%/năm ở nhóm dabigatran 150 mg (p = 0,051 so với warfarin). Nói tóm lại, nghiên cứu RE-LY chứng tỏ ở bệnh nhân rung nhĩ (chủ yếu không do bệnh van tim): (1) Dabigatran 110 mg x 2/ngày có hiệu quả tương đương warfarin trong việc ngăn ngừa đột quị/thuyên tắc mạch hệ thống và ít gây chảy máu nặng hơn; (2) Dabigatran 150 mg x 2/ngày có hiệu quả cao hơn warfarin trong việc ngăn ngừa đột quị/thuyên tắc mạch hệ thống nhưng gây chảy máu nặng tương đương warfarin.
Dựa vào kết quả RE-LY, ngày 19/10/2010 FDA đã chấp thuận cho dùng dabigatran với liều 150 mg x 2/ngày (75 mg x 2/ngày nếu độ lọc cầu thận trong khoảng 15-30 ml/phút) để ngừa đột quị và thuyên tắc mạch hệ thống ở người rung nhĩ không do bệnh van tim 9. Đầu tháng 8/2011 này, Cơ quan quản lý dược phẩm châu Âu (European Medicines Agency) cũng đã chấp thuận cho dùng dabigatran (cả 2 liều 110 mg x 2/ngày và 150 mg x 2/ngày, liều 110 mg x 2/ngày ưu tiên cho người trên 80 tuổi hoặc có nguy cơ chảy máu cao) trong chỉ định trên 10.
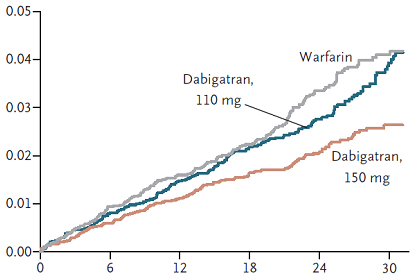
Hình 1: Tần suất dồn theo thời gian (tháng) của biến cố đột quị/thuyên tắc mạch hệ thống ở các nhóm warfarin, dabigatran 110 mg và dabigatran 150 mg trong nghiên cứu RE-LY.
Chỉ định thứ hai của dabigatran là phòng ngừa tiên phát và thứ phát thuyên tắc huyết khối tĩnh mạch. Vị trí của dabigatran trong phòng ngừa tiên phát thuyên tắc huyết khối tĩnh mạch được xác định bởi 2 nghiên cứu: nghiên cứu RE-MODEL thực hiện trên 2101 bệnh nhân được thay khớp gối toàn phần và nghiên cứu RE-NOVATE thực hiện trên 3494 bệnh nhân được thay khớp háng toàn phần 11,12. Trong 2 thử nghiệm lâm sàng này, bệnh nhân được phân ngẫu nhiên cho dùng enoxaparin tiêm dưới da 40 mg/ngày hoặc dabigatran uống 150 mg/ngày hoặc 220 mg/ngày (bắt đầu 1-4 giờ sau mổ). Kết quả RE-MODEL và RE-NOVATE được nêu trên bảng 1. Kết quả này chứng tỏ dabigatran có hiệu quả và tính an toàn tương đương với enoxaparin trong phòng ngừa tiên phát thuyên tắc huyết khối tĩnh mạch sau các phẫu thuật chỉnh hình lớn.
Bảng 1: Hiệu quả và tính an toàn của dabigatran so với enoxaparin trong phòng ngừa tiên phát thuyên tắc huyết khối tĩnh mạch sau các phẫu thuật chỉnh hình lớn 11,12.
|
|
RE-MODEL |
RE-NOVATE |
||||
|
E |
D 150 |
D 220 |
E |
D 150 |
D 220 |
|
|
Thuyên tắc huyết khối tĩnh mạch / chết mọi nguyên nhân (%) |
37,7 |
40,5 |
36,4 |
6,7 |
8,6 |
6,0 |
|
Chảy máu nặng (%) |
1,3 |
1,3 |
1,5 |
1,6 |
1,3 |
2,0 |
Ghi chú: E: enoxaparin; D 150: dabigatran 150 mg/ngày; D 220: dabigatran 220 mg/ngày. Khác biệt giữa các nhóm không có ý nghĩa thống kê.
Vị trí của dabigatran trong phòng ngừa thứ phát thuyên tắc huyết khối tĩnh mạch được xác định bởi nghiên cứu RE-COVER 13. RE-COVER là một thử nghiệm lâm sàng phân nhóm ngẫu nhiên, mù đôi, đa trung tâm. Đối tượng nghiên cứu là 2539 bệnh nhân thuyên tắc huyết khối tĩnh mạch cấp. Tiêu chuẩn loại trừ gồm: triệu chứng kéo dài hơn 14 ngày, thuyên tắc động mạch phổi gây rối loạn huyết động hoặc phải điều trị bằng thuốc tiêu sợi huyết, nguy cơ chảy máu cao, bệnh gan với nồng độ aminotransferase huyết thanh hơn 2 lần giới hạn trên, độ thanh thải creatinine dưới 30 ml/phút, có thai, triển vọng sống dưới 6 tháng. Bệnh nhân được điều trị bằng thuốc chống đông dạng tiêm (heparin không phân đoạn truyền tĩnh mạch hoặc heparin trọng lượng phân tử thấp tiêm dưới da) trong thời gian trung vị 9 ngày, sau đó được phân ngẫu nhiên cho dùng dabigatran 150 mg x 2/ngày hoặc warfarin (liều được điều chỉnh để đạt INR trong khoảng 2-3). Thời gian điều trị là 6 tháng. Tiêu chí đánh giá chính là thuyên tắc huyết khối tĩnh mạch có triệu chứng hoặc chết liên quan với thuyên tắc huyết khối tĩnh mạch sau 6 tháng.
Kết quả RE-COVER cho thấy tần suất các biến cố thuộc tiêu chí đánh giá chính của 2 nhóm không khác biệt (2,4% trong nhóm dabigatran và 2,1% trong nhóm warfarin) và tần suất chảy máu nặng của 2 nhóm cũng không khác biệt (1,6% trong nhóm dabigatran và 1,9% trong nhóm warfarin). Tần suất chảy máu nói chung (cả nặng lẫn nhẹ) trong nhóm dabigatran thấp hơn có ý nghĩa so với nhóm warfarin (16,1% so với 21,9%, p < 0,001) nhưng bù lại tần suất rối loạn dạ dày trong nhóm dabigatran cao hơn so với nhóm warfarin (3,1% so với 0,7%, p < 0,001) (Rối loạn dạ dày có liên quan với sự hiện diện của lõi acid tartaric trong thành phần viên thuốc, nhằm làm tăng sự hòa tan và hấp thu của dabigatran etexilate trong ống tiêu hóa).
Dabigatran etexilate có biệt dược là Pradaxa do công ty Boehringer-Ingelheim bào chế. Pradaxa đã được cấp phép lưu hành tại Việt Nam từ tháng 12/2010 cho chỉ định phòng ngừa thuyên tắc huyết khối tĩnh mạch sau phẫu thuật thay khớp gối và khớp háng và dự kiến đến tháng 10/2011 sẽ có hàng tại Việt Nam (viên 75 mg và 110 mg).
THUỐC ỨC CHẾ TRỰC TIẾP Xa
Các thuốc ức chế trực tiếp Xa gắn (có đảo ngược) vào vị trí hoạt động của yếu tố Xa, ức chế trực tiếp yếu tố Xa mà không cần sự tham gia của antithrombin trong huyết tương 14. Có nhiều thuốc ức chế trực tiếp Xa đã được nghiên cứu, tuy nhiên hiện nay chỉ có 2 thuốc được đưa vào dùng trong lâm sàng là rivaroxaban (biệt dược Xarelto của công ty Bayer) và apixaban (biệt dược Eliquis, do 2 công ty Pfizer và Bristol-Myers Squibb hợp tác bào chế). Các đặc điểm dược lý của 2 thuốc này được nêu trên bảng 2. Cả 2 thuốc này đều được dùng với liều cố định và không phải theo dõi điều trị bằng xét nghiệm đông máu.
Bảng 2: Các đặc điểm dược lý của rivaroxaban và apixaban 14.
|
|
Rivaroxaban |
Apixaban |
|
Độ khả dụng sinh học (%) |
80 |
60 |
|
Bán thời gian loại thải (giờ) |
7 – 11 |
12 |
|
Đào thải ở thận (%) |
66* |
25 |
|
Cách dùng |
Liều cố định, uống 1 lần/ngày |
Liều cố định, uống 2 lần/ngày |
|
Tương tác thuốc |
Các thuốc ức chế mạnh CYP3A4 và P-glycoprotein† |
Các thuốc ức chế mạnh CYP3A4† |
Ghi chú: *Một nửa lượng rivaroxaban đào thải ở thận là ở dạng không đổi và một nửa là ở dạng các chất chuyển hóa không có hoạt tính; † Các thuốc ức chế mạnh CYP3A và P-glycoprotein gồm các thuốc chống nấm có gốc azole (ketoconazole, itraconazole, voriconazole, posaconazole) và các thuốc ức chế protease như ritonavir. Các thuốc ức chế mạnh CYP3A4 gồm các thuốc chống nấm có gốc azole, các kháng sinh macrolide (như clarithromycin) và các thuốc ức chế protease như atanazavir.
Rivaroxaban đã được nghiên cứu trong 2 chỉ định chính. Chỉ định thứ nhất là phòng ngừa và điều trị thuyên tắc huyết khối tĩnh mạch. Vị trí của rivaroxaban trong phòng ngừa tiên phát thuyên tắc huyết khối tĩnh mạch sau các phẫu thuật chỉnh hình lớn được xác định bởi chương trình nghiên cứu RECORD (Regulation of Coagulation in Major Orthopedic Surgery Reducing the Risk of DVT and PE) gồm 4 nghiên cứu được đánh số từ RECORD 1 đến RECORD 4. Hai nghiên cứu được tiến hành trên bệnh nhân thay khớp háng toàn phần là RECORD 1 (n = 4541) và RECORD 2 (n = 2509) 15,16. Trong 2 nghiên cứu này, rivaroxaban uống (10 mg/ngày, bắt đầu 6-8 giờ sau khi đóng da, thời gian dùng 31-39 ngày sau mổ) được so sánh với enoxaparin tiêm dưới da (liều 40 mg/ngày, thời gian dùng 31-39 ngày trong RECORD 1 và 10-14 ngày trong RECORD 2). Kết quả 2 nghiên cứu này cho thấy rivaroxaban giảm có ý nghĩa thuyên tắc huyết khối tĩnh mạch so với enoxaparin và không tăng nguy cơ chảy máu nặng. Hai nghiên cứu được tiến hành trên bệnh nhân thay khớp gối toàn phần là RECORD 3 (n = 2531) và RECORD 4 (n = 3148) 17,18. Trong 2 nghiên cứu này, rivaroxaban uống (10 mg/ngày, bắt đầu 6-8 giờ sau khi đóng da, thời gian dùng 10-14 ngày sau mổ) được so sánh với enoxaparin tiêm dưới da (liều 40 mg/ngày trong RECORD 3 và 30 mg x 2/ngày trong RECORD 4, thời gian dùng 10-14 ngày). Kết quả 2 nghiên cứu này cho thấy rivaroxaban giảm có ý nghĩa thuyên tắc huyết khối tĩnh mạch so với enoxaparin và không tăng nguy cơ chảy máu nặng. Bảng 3 tóm tắt kết quả của chương trình nghiên cứu RECORD.
Bảng 3: Kết quả chương trình nghiên cứu RECORD 15-18.
|
|
Thuyên tắc huyết khối tĩnh mạch hoặc chết do mọi nguyên nhân (%) |
Chảy máu nặng (%) |
||
|
|
Enoxaparin |
Rivaroxaban |
Enoxaparin |
Rivaroxaban |
|
RECORD 1 |
3,7 |
1,1* |
0,1 |
0,3 |
|
RECORD 2 |
9,3 |
2,0* |
< 0,1 |
< 0,1 |
|
RECORD 3 |
18,9 |
9,6* |
0,5 |
0,6 |
|
RECORD 4 |
10,1 |
6,9† |
0,3 |
0,7 |
Ghi chú: *p < 0,001 so với nhóm enoxaparin; †p = 0,012 so với nhóm enoxaparin.
Rivaroxaban cũng được nghiên cứu trong phòng ngừa tiên phát thuyên tắc huyết khối tĩnh mạch ở bệnh nhân nội khoa qua thử nghiệm lâm sàng MAGELLAN (Multicenter, rAndomized, parallel Group Efficacy and safety study for the prevention of VTE in hospitalized medically iLL patients comparing rivaroxabAN with enoxaparin). Trong MAGELLAN, 8101 bệnh nhân nội khoa nặng đang nằm viện được phân ngẫu nhiên cho dùng rivaroxaban uống (10 mg/ngày trong 35 ngày) hoặc enoxaparin tiêm dưới da (40 mg/ngày trong 10 ngày). Kết quả ban đầu của MAGELLAN cho thấy rivaroxaban giảm nguy cơ thuyên tắc huyết khối tĩnh mạch so với enoxaparin (tần suất thuyên tắc huyết khối tĩnh mạch sau 35 ngày là 4,4% ở nhóm rivaroxaban và 5,7% ở nhóm enoxaparin, p = 0,02) nhưng làm tăng nguy cơ chảy máu (tần suất chảy máu sau 10 ngày là 2,8% so với 1,2%, p < 0,0001, và sau 35 ngày là 4,1% so với 1,7%, p < 0,0001) 19.
Vị trí của rivaroxaban trong điều trị thuyên tắc huyết khối tĩnh mạch cấp và phòng ngừa thứ phát được xác định bởi chương trình nghiên cứu EINSTEIN gồm 3 thử nghiệm lâm sàng: EINSTEIN-DVT thực hiện trên bệnh nhân huyết khối tĩnh mạch sâu cấp, EINSTEIN-PE thực hiện trên bệnh nhân thuyên tắc động mạch phổi cấp và EINSTEIN-EXTENSION thực hiện trên bệnh nhân thuyên tắc huyết khối tĩnh mạch đã được điều trị bằng thuốc chống đông uống trong 6-12 tháng. Trong 2 thử nghiệm lâm sàng đầu, bệnh nhân được phân ngẫu nhiên vào nhóm rivaroxaban uống (15 mg x 2/ngày trong 3 tuần, sau đó 20 mg 1 lần/ngày trong 3, 6 hoặc 12 tháng) hoặc nhóm điều trị chứng (enoxaparin tiêm dưới da 1 mg/kg x 2/ngày trong ít nhất 5 ngày, kèm warfarin hoặc acenocoumarol uống bắt đầu 48 giờ sau phân nhóm ngẫu nhiên, liều được điều chỉnh để đạt INR 2-3). Trong EINSTEIN-EXTENSION những bệnh nhân đã được điều trị bằng rivaroxaban hoặc thuốc kháng vitamin K trong 6-12 tháng được phân ngẫu nhiên cho dùng rivaroxaban (20 mg 1 lần/ngày) hoặc placebo thêm 6-12 tháng nữa. Tiêu chí đánh giá chính là thuyên tắc huyết khối tĩnh mạch tái phát có triệu chứng (là phối hợp các biến cố huyết khối tĩnh mạch sâu và thuyên tắc động mạch phổi gây chết hoặc không). Kết quả của EINSTEIN-DVT và EINSTEIN-EXTENSION được công bố năm 2010. ENSTEIN-DVT cho thấy rivaroxaban có hiệu quả tương đương điều trị chứng trong phòng ngừa thuyên tắc huyết khối tĩnh mạch tái phát (tần suất các biến cố là 2,1% ở nhóm rivaroxaban và 3,0% ở nhóm điều trị chứng) và nguy cơ chảy máu cũng tương đương (tần suất chảy máu là 8,1% ở cả 2 nhóm) 20. Còn theo kết quả của EINSTEIN-EXTENSION, rivaroxaban có hiệu quả cao hơn placebo trong phòng ngừa thuyên tắc huyết khối tĩnh mạch tái phát (tần suất các biến cố là 1,3% ở nhóm rivaroxaban và 7,1% ở nhóm placebo, p < 0,001) và nguy cơ chảy máu nặng tương đương (0,7% so với 0%, p = 0,11) 20.
Chỉ định được nghiên cứu thứ 2 của rivaroxaban là phòng ngừa đột quị và thuyên tắc mạch hệ thống ở bệnh nhân rung nhĩ không do bệnh van tim. Nghiên cứu xác định vị trí của rivaroxaban trong chỉ định này là ROCKET AF (Rivaroxaban Once Daily Oral Direct Factor Xa Inhibition Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation) 21. ROCKET AF là một thử nghiệm lâm sàng phân nhóm ngẫu nhiên mù đôi thực hiện trên 14.264 bệnh nhân rung nhĩ không do bệnh van tim có tiền sử đột quị, cơn thiếu máu não thoáng qua, thuyên tắc mạch hệ thống hoặc ít nhất 2 trong số các yếu tố sau: suy tim hoặc phân suất tống máu thất trái ≤ 35%, tăng huyết áp, tuổi ≥ 75, đái tháo đường. Bệnh nhân tham gia nghiên cứu có tuổi trung vị 73, nữ giới chiếm tỉ lệ gần 40%, 55% đã từng bị đột quị hoặc cơn thiếu máu não thoáng qua hoặc thuyên tắc mạch hệ thống và 17% đã từng bị nhồi máu cơ tim. Tỉ lệ rung nhĩ kịch phát (paroxysmal) /dai dẳng (persistent) là 18%/82%. Bệnh nhân được phân ngẫu nhiên vào 1 trong 2 nhóm: nhóm rivaroxaban (liều 20 mg/ngày, hoặc 15 mg/ngày nếu độ thanh thải creatinine trong khoảng 30-49 ml/phút) hoặc nhóm warfarin (liều được điều chỉnh để đạt INR trong khoảng 2-3). Thời gian theo dõi trung vị là 707 ngày. Tiêu chí đánh giá chính về hiệu quả là phối hợp các biến cố đột quị (dạng thiếu máu cục bộ hoặc xuất huyết) và thuyên tắc mạch hệ thống. Tiêu chí đánh giá chính về tính an toàn là chảy máu.
Kết quả ROCKET AF cho thấy tần suất các biến cố thuộc tiêu chí đánh giá chính của 2 nhóm rivaroxaban và warfarin không khác biệt (2,1%/năm so với 2,4%/năm, p = 0,12). Trên hình 2 là tần suất dồn đột quị hoặc thuyên tắc mạch hệ thống của 2 nhóm rivaroxaban và warfarin trong ROCKET AF. Tần suất chảy máu của 2 nhóm cũng không khác biệt (14,9%/năm ở nhóm rivaroxaban và 14,5%/năm ở nhóm warfarin, p = 0,44). Tuy nhiên tần suất chảy máu trong hộp sọ của nhóm rivaroxaban thấp hơn có ý nghĩa (0,5% so với 0,7%, p = 0,02) và tần suất chảy máu gây chết của nhóm rivaroxaban cũng thấp hơn có ý nghĩa (0,2% so với 0,5%, p = 0,003).
Rivaroxaban hiện đã được cấp phép lưu hành tại Việt Nam cho chỉ định phòng ngừa thuyên tắc huyết khối tĩnh mạch sau phẫu thuật thay khớp gối và khớp háng (viên 10 mg).
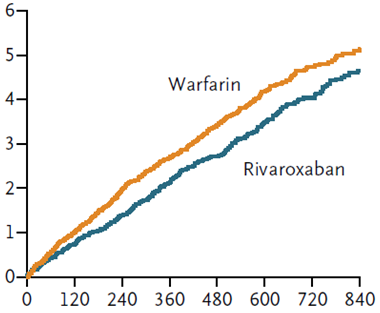
Hình 2: Tần suất dồn theo thời gian (ngày) của biến cố đột quị/thuyên tắc mạch hệ thống ở nhóm warfarin và nhóm rivaroxaban trong nghiên cứu ROCKET AF.
So với rivaroxaban, apixaban có ít dữ liệu lâm sàng hơn. Kết quả chương trình nghiên cứu ADVANCE (Apixaban for the Prevention of Thrombosis-related Events) cho thấy apixaban uống (2,5 mg x 2/ngày) có hiệu quả phòng ngừa tiên phát thuyên tắc huyết khối tĩnh mạch tương đương enoxaparin liều 30 mg x 2/ngày và cao hơn enoxaparin liều 40 mg/ngày trong phẫu thuật thay khớp gối 22,23. Apixaban cũng được nghiên cứu trong chỉ định phòng ngừa đột quị và thuyên tắc mạch hệ thống ở bệnh nhân rung nhĩ qua thử nghiệm lâm sàng AVERROES (Apixaban Versus Acetylsalicylic Acid to Prevent Stroke in Atrial Fibrillation Patients Who Have Failed or Are Unsuitable for Vitamin K Antagonist Treatment) 24. Trong thử nghiệm lâm sàng phân nhóm ngẫu nhiên mù đôi này, 5599 bệnh nhân rung nhĩ không thích hợp với điều trị bằng thuốc kháng vitamin K được phân ngẫu nhiên cho dùng apixaban (5 mg x 2/ngày) hoặc aspirin (81-324 mg/ngày). Kết quả AVERROES cho thấy apixaban giảm có ý nghĩa đột quị và thuyên tắc mạch hệ thống so với aspirin (mức giảm 55%, p < 0,001) và không tăng nguy cơ chảy máu nặng 24.
Phòng ngừa thứ phát các biến cố thiếu máu cục bộ sau hội chứng mạch vành cấp là một hướng nghiên cứu mới về vai trò của các thuốc ức chế trực tiếp Xa. Tuy nhiên kết quả của nghiên cứu APPRAISE-2 về vấn đề này đã gây thất vọng cho y giới 25. Trong thử nghiệm lâm sàng phân nhóm ngẫu nhiên mù đôi này, bệnh nhân mới bị hội chứng mạch vành cấp (trong vòng 7 ngày) được cho dùng thêm apixaban (5 mg x 2/ngày) hoặc placebo ngoài liệu pháp kháng tiểu cầu chuẩn. APPRAISE-2 đã phải kết thúc sớm sau khi tuyển được 7392 bệnh nhân, với lý do là apixaban không giảm các biến cố thiếu máu cục bộ (nhồi máu cơ tim, đột quị dạng thiếu máu cục bộ hoặc chết do nguyên nhân tim mạch) và còn làm tăng đáng kể nguy cơ chảy máu, đặc biệt là chảy máu trong hộp sọ và chảy máu gây chết 25.
TƯƠNG LAI CỦA ĐIỀU TRỊ CHỐNG ĐÔNG BẰNG THUỐC UỐNG
Với những tính năng vượt trội về mặt dược lý và những chứng cứ tích lũy từ các thử nghiệm lâm sàng đã thực hiện và đang tiến hành, các thuốc chống đông uống mới nhiều khả năng sẽ thay thế dần liệu pháp chống đông cổ điển trong một số chỉ định. Đầu tiên là phòng ngừa tiên phát thuyên tắc huyết khối tĩnh mạch sau phẫu thuật thay khớp háng và khớp gối: Dabigatran, rivaroxaban và apixaban đều là liệu pháp thay thế ưu việt hơn so với enoxaparin tiêm dưới da. Chỉ định thứ hai là phòng ngừa thứ phát thuyên tắc huyết khối tĩnh mạch: Cả dabigatran lẫn rivaroxaban đều có thể thay thế thuốc kháng vitamin K. Cuối cùng là phòng ngừa đột quị và thuyên tắc mạch hệ thống ở bệnh nhân rung nhĩ không do bệnh van tim: Cả dabigatran lẫn rivaroxaban đều có thể thay thế thuốc kháng vitamin, riêng dabigatran đã được các cơ quan quản lý dược chấp thuận cho dùng trong chỉ định này. Ưu điểm của các thuốc chống đông uống mới so với thuốc kháng vitamin K đã quá rõ ràng, trở ngại duy nhất để các thuốc này thay thế hoàn toàn thuốc kháng vitamin K trong các chỉ định nêu trên chính là giá thành.
Ngoài dabigatran, rivaroxaban và apixaban hiện có một số thuốc chống đông uống mới khác đang được nghiên cứu ở pha II hoặc pha III. Trong nhóm ức chế trực tiếp thrombin có AZD0837(của AstraZeneca) đang được nghiên cứu ở pha III, còn trong nhóm ức chế trực tiếp Xa có edoxaban (của Daiichi Sankyo) đang được nghiên cứu ở pha III và betrixaban (của Merck), YM150 (của Astellas Pharma) và TAK442 (của Takeda) đang được nghiên cứu ở pha II 14.
Có một câu hỏi thú vị được nhiều nhà nghiên cứu nêu ra: Thuốc ức chế trực tiếp thrombin và thuốc ức chế trực tiếp Xa, thuốc nào tốt hơn? Lời giải đáp cho câu hỏi này sẽ không có trong tương lai gần vì các hãng dược phẩm sẽ không chấp nhận rủi ro (về mặt thương mại) để tài trợ cho những nghiên cứu so sánh đối đầu thuốc thuộc 2 nhóm này.
Thuốc kháng vitamin K hiện vẫn còn chỉ định không thể thay thế trong phòng ngừa đột quị và thuyên tắc mạch hệ thống ở người bệnh van 2 lá và trong phòng ngừa huyết khối van tim nhân tạo. Chúng ta hy vọng trong tương lai sẽ có những nghiên cứu giúp xác lập vị trí của các thuốc chống đông uống mới trong những “thành trì cuối cùng” này của thuốc kháng vitamin K.
TÀI LIỆU THAM KHẢO
1) Hirsh J. Oral anticoagulant drugs. N Engl J Med 1991;324:1865-1875.
2) Ansell J, Hirsh J, Hylek E, et al. Pharmacology and management of the vitamin K antagonists: American College of Chest Physicians evidence-based clinical practice guidelines (8th edition). Chest 2008;133:160S-198S.
3) Menendez-Jandula B, Souto JC, Oliver A, et al. Comparing self-management of oral anticoagulant therapy with clinic management. A randomized trial. Ann Intern Med 2005;142:1-10.
4) Di Nisio M, Middeldorp S, Buller HR. Direct thrombin inhibitors. N Engl J Med 2005;353:1028-1040.
5) Olsson SB. Stroke prevention with the oral direct thrombin inhibitor ximelagatran compared with warfarin in patients with non-valvular atrial fibrillation (SPORTIF III): randomised controlled trial. Lancet 2003;362:1691-1698.
6) Albers GW, Diener HC, Frison L, et al. Ximelagatran vs warfarin for stroke prevention in patients with nonvalvular atrial fibrillation: a randomized trial. JAMA 2005;293:690-698.
7) Hirsh J, O’Donnell M, Eikelboom JW. Beyond unfractionated heparin and warfarin. Current and future advances. Circulation 2007;116:552-560.
8) Connolly SJ, Ezekowitz MD, Yusuf S, et al, and the RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009;361:1139-1151.
9) Beasley BN, Unger EF, Temple R. Anticoagulant options – Why the FDA approved a higher but not a lower dose of dabigatran. N Engl J Med 2011;364:1788-1790.
11) Eriksson BI, Dahl OE, Rosencher N, et al, for the RE-MODEL Study Group. Dabigatran etexilate versus enoxaparin for the prevention of venous thromboembolism after total knee replacement: The RE-MODEL randomized trial. J Thromb Haemost 2007;5:2178-2185.
12) Eriksson BI, Dahl OE, Rosencher N, et al. Dabigatran etexilate versus enoxaparin for prevention of venous thromboembolism after total hip replacement: A randomised, double-blind, non-inferiority trial. Lancet 2007;370:949-956.
13) Schulman S, Kearon C, Kakkar AK, et al, for the RE-COVER Study Group. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N Engl J Med 2009;361:2342-2352.
14) Eikelboom JW, Weitz JI. New anticoagulants. Circulation 2010;121:1523-1532.
15) Eriksson BI, Borris LC, Friedman RJ, et al. Rivaroxaban versus enoxaparin for thromboprophylaxis after hip arthroplasty. N Engl J Med 2008;358:2765-2775.
16) Kakkar AK, Brenner B, Dahl OE, et al. Extended duration rivaroxaban versus short-term enoxaparin for the prevention of venous thromboembolism after total hip arthroplasty: a double-blind, randomised controlled trial. Lancet 2008;372:31-39.
17) Lassen MR, Ageno W, Borris LC, et al. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty. N Engl J Med 2008;358:2776-2786.
18) Turpie AG, Lassen MR, Davidson BL, et al. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty (RECORD 4): a randomised trial. Lancet 2009;373:1673-1680.
19) MAGELLAN: Rivaroxaban prevents VTE in medical patients, but bleeding an issue. www.theheart.org/article/1207331.do
20) The EINSTEIN Investigators. Oral rivaroxaban for symptomatic venous thromboembolism. N Engl J Med 2010;363:2499-2510.
21) Patel MR, Mahaffey KW, Garg J, et al, and the ROCKET AF Steering Committee, for the ROCKET AF Investigators. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011 (10.1056/NEJMoa1009638)
22) Lassen MR, Raskob GE, Gallus A, et al. Apixaban or enoxaparin for thromboprophylaxis after knee replacement. N Engl J Med 2009;361:594-604.
23) Lassen MR, Raskob GE, Gallus A, et al. Apixaban versus enoxaparin for thromboprophylaxis after knee replacement (ADVANCE-2): a randomised double blind trial. Lancet 2010;375:807-815.
24) Connolly SJ, Eikelboom J, Joyner C, et al, for the AVERROES Steering Committee and Investigators. Apixaban in patients with atrial fibrillation. N Engl J Med 2011 (10.1056/NEJMoa1007432)
25) Alexander JH, Lopes RD, James S, et al, for the APPRAISE-2 Investigators. Apixaban with antiplatelet therapy after acute coronary syndrome. N Engl J Med 2011 (10.1056/NEJMoa1105819)







