BS. TRẦN MINH ĐỨC
BS. CK II. NGUYỄN THANH HIỀN
Chú thích:
ACC/AHA: American College Cardiology/American Heart Association: Trường môn Tim Hoa Kỳ/Hội Tim Hoa Kỳ.
ACCF/AHA: American College of Cardiology Foundation/ American Heart Association: Hội Tim của Trường Môn Hoa Kỳ/Hội Tim Hoa Kỳ
AMI: Acute Myocardial Infraction: Nhồi máu cơ tim cấp.
BN: Bệnh nhân.
CMR: Cardiac Magnetic Resonance: Cộng hưởng từ tim.
CRP: C-reactive protein: Protein hoạt hóa C.
CT: Computer Tomography: Chụp cắt lớp vi tính.
DAPT: Dual Antiplatelet Therapy: Kháng kết tập tiểu cầu kép.
DOAC: Direct OAC: Kháng đông đường uống trực tiếp.
HK: Huyết khối.
HFrEF: Heart Failure with reduced Ejection Fraction: Suy tim với phân suất tống máu giảm.
INR: International Normalized Ratio: Tỷ số bình thường hóa quốc tế.
LGE: Late Gadolium Enhancement: Tăng tín hiệu muộn.
LV: Left Ventricular: Thất trái.
LVEF: Left Ventricular Ejection fraction: Phân suất tống máu thất trái.
MACEs: Major Adverse Cardiovascular Events: Những biến cố tim mạch chính.
MI: Myocardial Infraction: Nhồi máu cơ tim.
OAC: Oral Anticoagulant: Kháng đông đường uống.
PCI: Percutaneous Coronary Intervention: Can thiệp mạch vành qua da.
STEMI: ST segment Elevation Myocardial Infraction: Nhồi máu cơ tim có ST chênh lên.
TIA: Transient Ischemic Attack: Cơn thoáng thiếu máu não.
TTE: Transthoracic Echocardiography: Siêu âm tim qua thành ngực.
TTR: Time in Therapetic Range: Thời gian trong ngưỡng điều trị.
VKA: Vitamin K antagonist: Kháng vitamin K.
- Mở đầu
Hiện nay, tần suất huyết khối (HK) thất trái (left ventricular-LV) sau nhồi máu cơ tim cấp (acute myocardial infraction-AMI) đã giảm đáng kể, đó là nhờ nhiều tiến bộ trong kỷ nguyên can thiệp mạch vành qua da (percutaneous coronary intervention-PCI) và nhiều thuốc kháng đông mới ra đời, tuy nhiên, HK LV vẫn là một biến chứng nguy hiểm vì gây biến cố thuyên tắc hệ thống và đột quỵ lấp mạch. Những hướng dẫn của Hoa Kỳ hiện nay khuyến cáo sử dụng thuốc đối kháng vitamin K (vitamin K antagonist-VKA) hơn là thuốc kháng đông đường uống trực tiếp (direct oral anticoagulants-DOACs) trong việc phòng chống biến cố thuyên tắc cho bệnh nhân HK LV. Bên cạnh đó, những dữ liệu đối với những bệnh BNđược PCI và sử dụng kháng đông đường uống vì những chỉ định khác (ví dụ rung nhĩ, van tim cơ học), có sự gia tăng nguy cơ chảy máu khi phối hợp kháng đông đường uống (oral anticoagulants-OACs) và kháng kết tập tiểu cầu kép (dual antiplatelet therapy-DAPT). Và, những bằng chứng hiện nay cho thấy liệu trình phối hợp 1 kháng kết tập tiểu cầu+ DOAC có thể là hợp lý, tuy nhiên vẫn chưa có những thử nghiệm ngẫu nhiên cho liệu trình này. Mục tiêu của bài viết này là tổng hợp y văn về dịch tễ, sinh lý bệnh, chẩn đoán, quản lý, điều trị và theo dõi HK sau AMI[2].
- Dịch tễ học.
Tần suất HK LV sau AMI khác nhau trong các báo cáo tùy thuộc vào hình ảnh học được dùng để chẩn đoán, mốc thời gian và tần suất tầm soát. Trong kỷ nguyên tiêu sợi huyết, nếu được sử dụng siêu âm tim 2 chiều, tần suất là 17% (n=12/70), trong đó MI thành trước có tới 34-57%. Vào những năm 1980, với sự ra đời của PCI, tần suất HK LV giảm (hình 1). Trong một phân tích tổng hợp năm 2016, đánh giá 10.076 BN nhồi máu cơ tim cấp có ST chênh lên (ST-segment elevation-STEMI), tần suất HK LV được chẩn đoán bằng siêu âm tim là 3% (n=202/7471), trong đó có 9% là MI thành trước. Tuy nhiên, sự hiện diện của HK LV có thể bị bỏ sót qua siêu âm qua tim thành ngực (transthoracic echocardiography-TTE) chuẩn. Thật vậy, đánh giá 200 BN STEMI được PCI nguyên phát, được thực hiện cộng hưởng từ tim (cardiac magnetic resonance-CMR) và siêu âm tim không có cản quang, Delewi và cộng sự cho thấy tần suất có thể cao hơn: 9% ở tất cả BN và 14% ở BN MI thành trước. Trong 17 BN được chẩn đoán bằng CMR, chỉ có 4 trường hợp là phát hiện qua TTE. Nếu CMR được theo dõi sau 4 tháng, có 6% BN (12/194) được chẩn đoán có HK LV, và kết quả là, tần suất cộng dồn là 15% và 25% đối với MI thành trước[5].
Do có những hạn chế của TTE và điều kiện thực hiệnđược CMR trong kỷ nguyên tiêu sợi huyết, tần suất HK LV có lẽ cao hơn trong những báo cáo trước đó. Tuy nhiên, có những yếu tố góp phần làm giảm tần suất, bao gồm (1) sử dụng nhanh chóng và sớm PCI làm giảm kích thước nhồi máu (2) dùng những thuốc ảnh hưởng lên con đường hoạt hóa hệ thần kinh thể dịch chống tái cấu trúc LV (3) càng ngày càng ít BN chuyển từ AMI sang hội chứng vành mạn (4) sử dụng phối hợp các thuốc chống thuyên tắc HK (hình 1)[5].
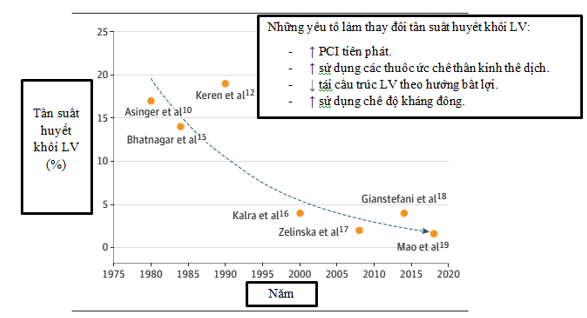
Hình 1: Tần suất HK LV được phát hiện bằng siêu âm tim theo xu hướng thời gian.[5]
Tuy nhiên, thật không may, tần suất thuyên tắc HK hệ thống vẫn còn cao. Trong một phân tích tổng hợp năm 1993, tần suất chiếm 9%, sử dụng kháng đông làm giảm 33% nguy cơ tuyệt đối. Nghiên cứu của Maniwa và cộng sự năm 2018, trong 5 năm theo dõi 92 BN, có 16% xảy ra biến cố thuyên tắc hệ thống. Trong 84 BN được điều trị warfarin, có 34 BN đạt được thời gian trong ngưỡng điều trị (time in therapeutic range-TTR) tối thiểu là 50%, và tần suất HKlà 3%. Ngược lại, những BN có TTR<50%, tần suất là 19%[5].
- Sinh lý bệnh của sự hình thành HK LV.
Trên cơ sở dựa trên tam giác Virchow, sinh lý bệnh của việc hình thành HK LV là sự tương tác của 3 yếu tố: (1) tình trạng ứ trệ do suy giảm chức năng của thất, (2) tổn thương nội mạc, (3) viêm/tăng đông (hình 2). Những yếu tố có liên quan góp phần thúc đẩy HK phụ thuộc nguyên nhân của rối loạn chức năng cơ tim và thời gian. Mặc dù tổn thương nội mạc cơ tim theo vùng và phản ứng viêm, có thể là những yếu tố nổi bật sau AMI, tình trạng ứ trệ do giảm toàn bộ chức năng LV là yếu tố chìa khóa trong bệnh cơ tim dãn nở[1].
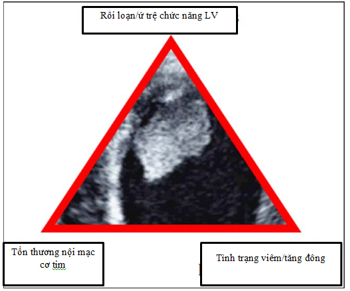
Hình 2: Rối loạn/ứ trệ chức năng LV, tổn thương nội mạc cơ tim, tình trạng viêm/tăng đông (tam giác Virchow) là những yếu tố thúc đẩy hình thành HK LV[1].
- Giảm co bóp LV: tình trạng ứ trệ dòng máu ở vùng cơ tim không co bóp đóng vai trò quan trọng cho việc hình thành HK. BN có phân suất tống máu giảm (LVEF) lúc ra viện có yếu tố nguy cơ cao hơn so với chức năng LV bình thường. BN có HK LV thường có giảm vận động vùng nặng hơn so với BN không có HK[4].
- Tổn thương nội mạc cơ tim: BN STEMI có HK LV nhiều hơn so với Non-STEMI (43.1% so với 5%). Acar và cộng sự quan sát thấy ở BN có HK, nồng độ đỉnh CK-MB và troponin cao hơn so với BN không có (nồng độ đỉnh trung bình troponin: 32.63 so với 18.7ng/mL, CK-MB: 245.47 so với 167.37 U/L). MI đến trễ (sau 12h), tái tưới máu muộn, dòng chảy TIMI 0 hoặc 1 trước can thiệp là những yếu tố nguy cơ cho HK LV[4].
- Tăng đông: BN MI có HK LV thường có bất thường huyết học. Thể tích tiểu cầu trung bình (9.03fl so với 8.06fl, P=0.0001), số lượng hồng cầu (14,010 so với 11,300 mcg/L, P=0.0001). Thể tích hồng cầu trung bình là yếu tố nguy cơ độc lập cho việc hình thành HK LV. Shacham và cộng sự cho thấy các chỉ dấu viêm huyết thanh như protein hoạt hóa C (CRP) ở BN có HK cao hơn so với không có (48 so với 8.4mg/L). CRP và fibrinogen là những yếu tố nguy cơ dự báo sớm cho việc hình thành HK LV ở BN STEMI thành trước[4].
Thông thường, HK được hình thành trong một môi trường có rối loạn chức năng LV ý nghĩa với phân suất tống máu LV thấp (LVEF). Sau MI thành trước, LVEF giảm là một yếu tố nguy cơ có ý nghĩa cho việc hình thành HK, mà chủ yếu hình thành ở những vùng phình, giảm động, vô động, loạn động vùng mỏm. Rối loạn LV theo vùng, những kiểu lưu lượng năng lượng bất thường hoặc giảm trong LV có thể dự đoán nguy cơ hình thành HK ngay cả khi có rối loạn chức năng LV nhẹ hoặc vừa phải[1].
Trong trường hợp AMI, mức độ nghiêm trọng và tổn thương làm tăng nguy cơ hình thành HK LV. Những bạch cầu đơn nhân hoặc đa nhân trung tính đóng vai trò cho sự chữa lành sau AMI, bên cạnh đó, những nghiên cứu sơ bộ trước đó cho rằng những thay đổi trong việc biểu lộ tế bào đơn nhân qua việc tái cấu trúc bên ngoài tế bào bị tổn thương (bất thường trong việc sản xuất collagen type 1), mất tính nguyên vẹn nội mạc cơ tim kéo dài dự đoán cho việc hình thành HK LV[1].
- Hình ảnh học trong HK LV.
- Siêu âm tim qua thành ngực (TTE):
Sự phát hiện chính xác HK LV có liên quan một cách trực tiếp đến việc điều trị và kết cục lâm sàng. TTE là kỹ thuật hình ảnh chuẩn cho việc phát hiện HK LV. Sử dụng chất cản quang trong lúc siêu âm tim có thể tăng gấp đôi khả năng phát hiện HK LV, đó là trong những trường hợp vô động hoặc loạn động vùng trước mỏm hoặc những trường hợp nghi ngờ thuyên tắc từ tim[1]. Mức độ nghiêm trọng của bất thường chuyển động vùng được đánh giá bằng TTE được đề xuất như là một xét nghiệm tầm soát trước khi đi đến CMR. Sử dụng thang điểm chuyển động vùng mỏm, Weinsalf và cộng sự cho thấy thang điểm cao (≥7 điểm đối với có sử dụng chất cản quang, ≥5 điểm đối với không sử dụng chất cản quang) có độ nhạy gần 100% và giá trị tiên đoán âm 100% cho việc phát hiện HK LV. Những nhóm BN này có chỉ định CMR mà không cần thêm các xét nghiệm không cần thiết khác. Siêu âm tim qua thực quản thường không cải thiện được trong việc quan sát HK LV, do nằm phía trước, đặc biệt có loạn động mỏm hoặc bệnh cơ tim dãn nở làm cửa sổ qua dạ dày và thực quản quan sát rất hạn chế, và do đó không được đưa ra là lựa chọn thứ hai trong việc đánh giá HK LV[2].
- Chụp cắt lớp điện toán tim (cardiac computerized tomography-CT).
Những dữ liệu trong việc sử dụng chụp cắt lớp điện toán tim (cardiac computerized tomography) trong việc phát hiện HK LV còn giới hạn trong báo cáo ca hoặc hàng loạt ca nhỏ. Không có những nghiên cứu cho thấy vai trò của CT tim trong đánh giá HK LV[1].
Chụp CT mạch vành tim có sử dụng cản quang có thể phát hiện HK<1mm, đánh giá hình thái học LV, nhanh chóng, chi phí thấp[2].
- Cộng hưởng từ tim (CMR).
Hình ảnh tăng tín hiệu muộn (LGE) trong CMR có giá trị trong đánh giá kết cục thuyên tắc ngắn hạn (6 tháng) và trung hạn (3.3 năm). Những nghiên cứu sử dụng CMR như tiêu chuẩn đánh giá cho thấy siêu âm tim có độ nhạy thấp trong việc đánh giá HK LV. Một phân tích tổng hợp của 3 nghiên cứu bao gồm tổng cộng 431 BN STEMI cho thấy siêu âm có độ nhạy 29% cho việc phát hiện HK. Mặc dù dùng chất cản quang có thể tăng độ nhạy, tuy nhiên vẫn thấp hơn so với CMR. HK được phát hiện bằng CMR nhưng không quan sát thấy trên siêu âm thì nhỏ hơn và là HK cơ[1].
Tính ưu việt của LGE trên CMR không chỉ đơn giản là hình ảnh học giải phẫu với độ phân giải cao, mà là đặc trưng về mô học của HK trên CMR: thiếu phân bố mạch máu và không có LGE, dễ dàng phân biệt nó với mô cơ tim xung quanh (hình 3)[1].
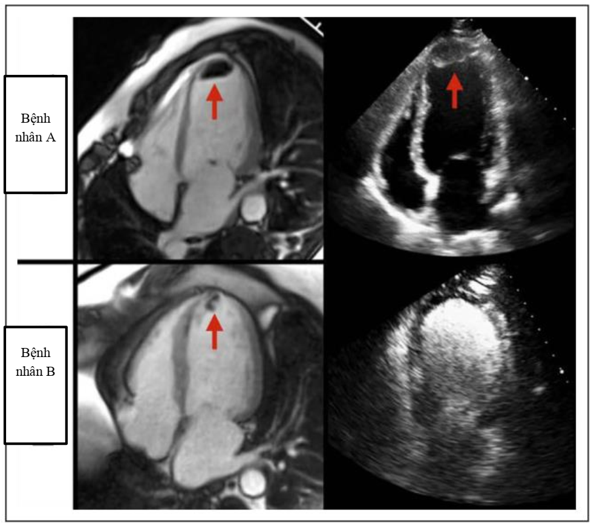
Hình 3: Ví dụ về HK LV (mũi tên) được quan sát thấy trên CMR và siêu âm tim trên BN A hoặc chỉ trên CMR ở BN B[1].
Những yếu tố nguy cơ trên CMR làm tăng nguy cơ hình thành HK là: rối loạn chức năng tâm thu LV nặng, gánh nặng xơ cơ tim cao, bất thường chuyển động vùng mỏm sau AMI, tiền căn biến cố HK thuyên tắc cấp tính từ tim, và phình LV[1].
Hiện tại còn ít dữ liệu cho rằng việc phát hiện HK trên CMR nhưng không thấy trên siêu âm tim liệu có thể cải thiện kết cục lâm sàng. Trong một phân tích không ngẫu nhiên của 110 BN có HK LV phát hiện trên CMR nhưng không thấy trên siêu âm tim (89% đã được bắt đầu hoặc tiếp tục điều trị kháng đông), không có sự khác biệt thống kê về kết cục thuyên tắc ở cả nhóm CMR và siêu âm tim. Và vẫn chưa biết được rằng, ở nhóm BN có HK phát hiện trên CMR nhưng không thấy trên siêu âm tim liệu có nguy cơ thuyên tắc cao hơn so với nhóm được phát hiện trên cả CMR và siêu âm tim[1].
CMR được đề nghị trong những trường hợp (1): vẫn còn có sự nghi ngờ HK LV (2) hoặc có biến cố thuyên tắc HK nghĩ là từ tim, mặc dù siêu âm tim không thấy (ngay cả siêu âm tim có cản quang)[1].
Bảng 1: Những phương pháp hình ảnh học dùng để chẩn đoán HK LV[5].
| Phương pháp sử dụng | % | ||||
| Độ nhạy | Độ đặc hiệu | Giá trị tiên đoán | Tài liệu tham khảo | ||
| Dương | Âm | ||||
| Siêu âm tim qua thành ngực không có chất cản quang, số lượng mẫu (%) | 21-35 | 95-98 | 67 | 94 | Delewi et al, Srichai et al, Weinsaft et al |
| Siêu âm tim qua thành ngực có chất cản quang, số lượng mẫu (%) | 9 (64) | 174 (99) | 9 (82) | 174 (97) | Weinsaft et al |
| Siêu âm tim qua thực quản, số lượng mẫu (%) | 39 (39) | 232 (97) | 39 (87) | 232 (79) | Srichai et al |
| Hình ảnh học cộng hưởng từ tim tăng tín hiệu muộn | 82-88 | 99-100 | 100 | 98 | Delewi et al, Srichai et al |
- Chụp cắt lớp phát xạ positron.
Chụp cắt lớp phát xạ positron (positron emission tomography-PET) với mục tiêu là phát hiện sự hình thành HK LV, hứa hẹn là kỹ thuật cho chúng ta hiểu hơn về sự phát triển HK và biến cố mạch máu não. Với việc sử dụng đồng vị phóng xạ 18F-GP1, gắn kết thụ thể glycoprotein IIb/IIIa, cho thấy tín hiệu cao hiện diện ở vùng hình thành HK và những khu vực xảy ra biến cố thuyên tắc mạch máu não và mạch vành (hình 4)[2].
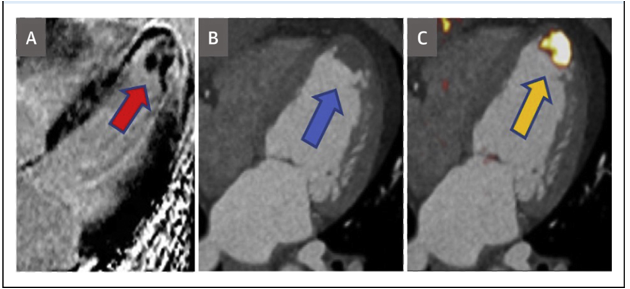
Hình 4: Những hình ảnh học được dùng để đánh giá HK LV sau AMI[2]
(A) Hình ảnh LGE trên CMR cho thấy HK ở mỏm LV (mũi tên đỏ, khiếm khuyến dạng đổ đầy màu đen) trên vùng nhồi máu cơ tim vùng mỏm xuyên thành có tắc nghẽn vi mạch. (B) chụp CT mạch vành có cản quang cho thấy có HK nhỏ ở mỏm (mũi tên xanh). (C) dùng đồng vị phóng xạ 18F-GP1, gắn kết thụ thể glycoprotein IIb/IIIa bằng PET.
Trong thực hành lâm sàng hiện nay, tùy điều kiện từng nơi mà chung ta sử dụng các biện pháp cho phù hợp (bảng 1). Trong hoàn cảnh hiện nay, chúng ta thường sử TTE là bước đầu tiên. Nếu không rõ nên thực hiện TEE hoặc gửi đến cơ sở có điều kiện làm MRI tim để xác định chẩn đoán.
- Thời điểm sử dụng hình ảnh học cho chẩn đoán.
Trong một báo cáo với 92 BNAMI thành trước được điều trị chống thuyên tắc HK bao gồm aspirin, heparin (5000 đơn vị tiêm dưới da 2 lần/ngày), và tiêu sợi huyết, có 30 BN được xác định là có HK LV bằng TTE (27% trong 24 giờ đầu tiên, 57% trong 48-72 giờ, 75% ở thời điểm 1 tuần, 96% ở thời điểm 2 tuần sau MI). Trong một báo cáo khác với 198 BN có AMI, trước khi ra viện (10.6±4.1 ngày sau MI), tần suất HK LV 31% đối với MI thành trước (38/124 BN), và không có trường hợp nào ở MI thành dưới (0/74 BN). Báo cáo Healing and Early Afterload Reducing Therapy (HEART) đánh giá tần suất HK LV ở BN MI (có 97% được điều trị tái tưới máu): 0.6% ở ngày 1, 3.7% ở ngày 14, 2.5% ở ngày 90. Một báo cáo khác cho thấy tần suất HK cao nhất ở ngày 8-15 sau MI (40%). Nếu sử dụng CMR, tần suất là <5% ở ngày 0-2, 10% ở ngày 3-5, và 25% ở ngày 9-12. Hầu hết các dữ liệu cho rằng HK LV chủ yếu phát hiện trong 2 tuần đầu sau MI. Và đối với BN có yếu tố nguy cơ cao, cần thiết phải lặp lại hình ảnh học sau 2 tuần nếu không phát hiện HK trong 48 giờ đầu sau MI. Những dữ liệu này cũng đưa ra khả năng cho việc đánh giá thấp tần suất HK LV có thể là do ra viện sớm, thiếu theo dõi bằng hình ảnh học ở BN ngoại trú. Thực tế, trong báo cáo ở 1 trung tâm, có 35% BN được điều trị chống đông không có sử dụng hình ảnh học cho việc theo dõi, từ đó đặt ra câu hỏi, có bao nhiêu BN có nguy cơ cao nhưng không có HK LV được theo dõi bằng hình ảnh học[2]?
- Tầm soát HK LV sau AMI.
CMR vẫn đóng vai trò quan trọng trong chẩn đoán, tuy nhiên do chi phí và khả năng sẵn có làm giới hạn việc thực hiện. Và, TTE thường quy được thực hiện trong vòng 24 giờ đầu tiên nhập viện nếu BN có nguy cơ cao (MI thành trước, diện rộng hoặc chậm trễ tái tưới máu). Nếu (1) vùng mỏm có cửa sổ khảo sát kém, (2) bất thường vận động vùng mỏm hoặc thành trước (3) chỉ số vận động mỏm cao (≥5 đối với siêu âm không có cản quang), siêu âm tim có cản quang hoặc CMR nên được xem xét tùy thuộc vào khả năng sẵn có và nguồn lực tại cơ sở y tế[1], [5].
- Phòng ngừa HK LV sau AMI.
HK LV là một biến chứng của MI, đặc biệt là STEMI thành trước mỏm đi kèm với bất thường chuyển động vùng, là một yếu tố nguy cơ dự đoán biến cố thuyên tắc. Sự phối hợp của các chiến lược tái tưới máu nhanh chóng, bắt đầu là tiêu sợi huyết và theo sau là PCI là điều trị chuẩn trong điều trị STEMI, điều này làm giảm nguy cơ, nhưng không loại bỏ hoàn toàn sự tạo thành HK LV[1], 2], [5].
Những bằng chứng của việc điều trị kháng đông trong việc ngăn chặn HK LV thì còn giới hạn và cũ. Trong một phân tích tổng hợp từ 4 nghiên cứu nhỏ trong kỷ nguyên tái tưới máu (trước những năm 1980), trị liệu gồm kháng đông với heparin truyền tĩnh mạch, VKA, hoặc cả hai, những tác nhân làm giảm tần suất HK LV (tỷ số chênh odd ratio (OR) là 0.32 (95% CI, 0.2-0.52), và những nghiên cứu này không đủ mạnh để xác định rằng những điều trị này có làm giảm MACEs hoặc biến cố thuyên tắc hệ thống. Lưu ý rằng, những BN trong nghiên cứu này không được điều trị tái tưới máu (PCI hoặc tiêu sợi huyết), ức chế P2Y12, và hiếm khi nhận được aspirin. Và thời gian điều trị kháng đông thì ngắn (chỉ trong thời gian nằm viện). Sau đó, năm 1997, 1 thử nghiệm ngẫu nhiên của việc điều trị dalteparin ở BN MI thành trước được điều trị tiêu sợi huyết làm giảm biến cố cộng dồn HK LV và thuyên tắc hệ thống, nhưng làm tăng tỷ lệ chảy máu, mà không làm giảm thuyên tắc động mạch hoặc tử vong. Những BN tham gia nghiên cứu thì nhận được điều trị aspirin (nhưng không có ức chế P2Y12), và thời gian điều trị P2Y12 thì ngắn (thời gian theo dõi trung bình: 9 ngày)[1], [2], [5].
Vẫn chưa có những thử nghiệm ngẫu nhiên được công bố liên quan đến vấn đề liều đủ kháng đông có ngăn ngừa HK LV trên BN MI trong kỷ nguyên tái tưới máu. Nhiều nghiên cứu quan sát hiện nay cho thấy thêm kháng đông vào DAPT để ngăn chặn hình thành HK LV, nhưng không làm giảm MACEs, mà thậm chí còn tăng biến cố xuất huyết lớn. Tuy nhiên, những nghiên cứu quan sát này có nhiều sai lệch, nhất là sai lệch chỉ định. Bên cạnh đó, những nghiên cứu trong việc phối hợp kháng đông và kháng kết tập tiểu cầu ở những BN có chỉ định khác cho việc sử dụng OAC (thường gặp là rung nhĩ) làm tăng nguy cơ chảy máu lên nhiều lần[1], [2], [5].
Những nghiên cứu lâm sàng mang tính lịch sử cho rằng kháng đông trong thời gian ngắn có thể làm giảm nguy cơ hình thành HK LV ở BN MI thành trước, mặc dù những nghiên cứu này không đủ sức mạnh để xác định liệu kháng đông phòng ngừa có làm giảm nguy cơ thuyên tắc HK hệ thống hoặc MACEs. Hướng dẫn 2013 của ACC/AHA về STEMI, dựa trên mức độ bằng chứng C, chỉ định nhóm IIb (có thể xem xét) cho việc kháng đông phòng ngừa trên BN STEMI và vô động hoặc loạn động thành trước có yếu tố nguy cơ hình thành HK LV, với thời gian điều trị giới hạn 3 tháng. Trong những y văn hiện tại, chúng tôi tìm thấy ít dữ liệu ủng hộ rõ ràng sử dụng kháng đông thường quy trong kỷ nguyên tái tưới máu, đặt stent mạch vành, sử dụng kháng kết tập tiểu cầu kép, cũng như việc ủng hộ thời gian điều trị đặc hiệu trong 3 tháng. Do vậy, những yếu tố nguy cơ trong việc hình thành HK LV, nguy cơ chảy máu trong việc sử dụng kháng đông, kháng tiểu cầu, sự lựa chọn của BN đóng một vai trò quan trọng trong việc quyết định bắt đầu sử dụng kháng đông phòng ngừa[1], [2], [5].
Gần đây, một thử nghiệm ngẫu nhiên, nhãn mở, đơn trung tâm với cỡ mẫu nhỏ với 279 BN được thử nghiệm sử dụng liều thấp kháng đông (rivaroxaban 2.5 mg* 2 lần/ngày trong 30 ngày) thêm vào DAPT làm giảm nguy cơ hình thành HK LV so với một mình DAPT. Thêm liều thấp rivaroxaban so với không điều trị làm giảm nguy cơ thành lập HK (0.7% so với 8.6%, tỉ số nguy cơ, 0.08 [95% CI, 0.01-0.62], cũng như những biến cố lâm sàng bất lợi, mà không làm tăng nguy cơ chảy máu. Bên cạnh đó có những mặt hạn chế của nghiên cứu này (đơn trung tâm, nhãn mở), có 16.5% BN dừng tham gia nghiên cứu, và >75% có LVEF>45%[1], [2], [5].
Mặc dù việc sử dụng thường quy kháng đông trong lâm sàng chưa có những dữ liệu ủng hộ, cần xem xét những lợi ích nguy cơ trên từng BN một cách thận trọng. Nếu có chỉ định, chúng tôi nhất trí thời gian sử dụng 1-3 tháng bởi vì nguy cơ hình thành HK cao nhất trong 1 tháng sau MI, và sau đó giảm dần[1], [2], [5].
Yếu tố nguy cơ của việc hình thành HK LV cao nhất là trong 2 tuần, và nhiều nghiên cứu cho thấy CMR và siêu âm tim làm tăng tần suất phát hiện nếu được thực hiện trong vòng 1 đến 2 tuần sau MI (so với được thực hiện những ngày đầu tiên sau MI). Do đó, đối với những BN MI có vô động hoặc loạn động thành trước mỏm nếu siêu âm tim không thấy trong những ngày đầu và kháng đông chưa có kế hoạch sử dụng, cần thiết phải theo dõi tiếp sau đó bằng siêu âm tim có cản quang (hoặc CMR nếu chất lượng hình ảnh kém). Thời gian có thể giới hạn trước khi ra viện đối với BNnằm viện kéo dài (>3-7 ngày) hoặc sau vài tuần (với BN xuất viện trong 3 ngày). Hiện tại, vẫn chưa có những dữ liệu nghiên cứu cho rằng chiến lược lặp lại hình ảnh học có thể làm giảm biến cố thuyên tắc HK[1], [2], [5].
- Điều trị thuyên tắc HK sau AMI.
HK LV có thể xảy ra trong vòng 24 giờ sau AMI. Một nghiên cứu theo dõi bằng cách thực hiện siêu âm tim cho thấy HK xảy ra nhiều nhất trong 2 tuần. BN phát hiện HK sau ra viện thường có LVEF kém. Vùng vô động thường có HK thoái triển nhiều hơn so với vùng loạn động hoặc giả phình[1], [2].
Có thể suy luận rằng HK LV có vai trò bảo vệ vùng cơ tim bị nhồi máu bằng cách hỗ trợ cơ học và tránh vỡ LV. HK dính chặt vùng cơ tim, thúc đẩy xơ hóa, tránh sự lan rộng vùng nhồi máu, phục hồi độ dày thành cơ tim, và cuối cùng là, chỗ phình bị giảm, đưa đến co bóp cơ tim đồng bộ hơn. Tuy nhiên, sự lan rộng vùng nhồi máu xảy ra rất sớm, trước khi HK tổ chức hóa để ngăn chặn phình và vỡ cơ tim[3].
HK LV chủ yếu hình thành ở mỏm, tuy nhiên có 11% ở vách, 3% ở thành sau dưới[3].
Sự hình thành HK sau AMI làm tăng 5.5 lần nguy cơ hình thành biến cố thuyên tắc huyết khối so với không có HK. Nếu không điều trị, tỷ lệ thuyên tắc HK hệ thống và đột quỵ hằng năm là 10-15%. HK có cuống và di động có khả năng gây thuyên tắc nhiều hơn so với HK không di động, calci hóa, dạng phiến (là huyết khối trong cơ (dạng phiến dát mỏng) nếu bờ liên tục với vùng cơ tim kế cận, đối ngược với dạng cuống nếu nó phân biệt rõ với nội mạc tim kế cận và nhô vào lòng LV)[1].Huyết khối trong cơ LV thường không phát hiện bằng siêu âm tim mà không tiêm tĩnh mạch chất cản quang (ví dụ: Definity, Optison, Lumason). Mặc dù chất cản quang tăng độ nhạy, tuy nhiên nó khó phát hiện huyết khối nhỏ nằm ở vùng mỏm vô động. Hình ảnh LGE trên CMR có độ nhạy và độ đặc hiệu tốt nhất cho huyết khối dạng này (hình 5)[1].

Hình 5: Ví dụ về huyết khối cơ (phiến mỏng) ở vùng mỏm LV (mũi tên) được quan sát thấy trên CMR tăng tín hiệu gadolium, vùng cơ tim màu trắng xung quanh là vùng bị nhồi máu.
Vai trò của điều trị nội khoa trong việc làm giảm tần suất HK LV vẫn chưa được hiểu rõ. Khuyến cáo hiện nay trong việc điều trị AMI bao gồm chẹn beta giao cảm và ức chế men chuyển, với mục tiêu làm giảm tổn thương cơ tim và giảm tỷ lệ tử vong. Trong thử nghiệm GISSI-3, so sánh giữa 2 nhóm được điều trị chẹn beta và không, kết luận là không có sự khác biệt về tỷ lệ HK LV, điều đó cũng tương tự ở nhóm được và không được điều trị aspirin, nitrate, lisinopril. Điều thú vị là, nhiều nghiên cứu báo cáo rằng tần suất HK lại cao hơn ở nhóm điều trị chẹn beta, có thể là do tác động giảm co bóp cơ tim, gây ứ trệ dòng máu. Trong thử nghiệm ngẫu nhiên, Johannessen và cộng sự cho thấy ở nhóm BN STEMI thành trước điều trị chẹn beta có tần suất HK cao hơn, và tương tự trong nghiên cứu của Turpen và cộng sự[3],[4].
Những bằng chứng giới hạn cho rằng điều trị kháng đông có khả năng thoái triển HK và làm giảm biến cố thuyên tắc so với không điều trị. Một thử nghiệm nhỏ ngẫu nhiên đối chứng mù đôi cho thấy khả năng thoái triển hoàn toàn HK LV xảy ra thường hơn ở BN nhận warfarin so với không sử dụng hoặc điều trị kháng tiểu cầu (60% so với 10%, P<0.01). Sự thoái triển HK xảy ra thường gặp ở BN sử dụng liều cao aspirin (600 mg) so với không sử dụng (45% so với 10%, P<0.01). Trong phân tích tổng hợp của 7 nghiên cứu quan sát bao gồm 270 BN MI thành trước và HK LV, kháng đông hệ thống làm giảm biến cố thuyên tắc (OR 0.14, 95% CI 0.04-0.52). Trong những nghiên cứu gần đây, thời gian đạt ngưỡng điều trị càng lớn (TTR) thì càng ít biến cố thuyên tắc HK hệ thống hơn (TTR≥50%, 2.9%, TTR<50%, 19%, P=0.036)[1], [2].
Thời gian điều trị tối ưu cho HK LV sau MI thì không chắc chắn, không có thử nghiệm đối chứng ngẫu nhiên đánh giá thời gian thay đổi điều trị. Hướng dẫn 2013 của ACC/AHA về STEMI giới hạn điều trị kháng đông trong 3 tháng, mặc dù đó là ý kiến chuyên gia hơn là dựa trên dữ liệu thử nghiệm lâm sàng[1], [2].
Cho tới khi có dữ liệu mới xuất hiện, chúng tôi khuyến khích lặp lại hình ảnh học giống như (hoặc tốt hơn) 3 tháng trước đó. Nếu có sự thoái triển của HK, có thể tạm ngưng OAC ở thời điểm này. Bởi vì yếu tố nguy cơ tái phát cao nhất của HK LV trong vòng 3 tháng đầu sau MI, việc ngưng sớm dựa trên sự thoái triển của HK có thể đưa ra một đánh giá sai lầm nếu chỉ đánh giá đơn độc hình ảnh học nếu chức năng LV vẫn còn giảm và bất thường rối loạn vận động vùng vẫn còn hiện hữu. Tuy nhiên, nếu hình ảnh học tim mạch được thực hiện 3 tháng trước vì chỉ định khác (xem xét cho việc cấy máy khử rung tim), việc ngưng sớm kháng đông có thể hợp lý nếu HK bị thoái triển, chức năng LV và bất thường vận động vùng cải thiện (không có vô động hoặc loạn động kéo dài)[1], [2], [5].
HK LV có thể phát triển ở BN không có biến cố MI gần đây (>3 tháng) hay là bệnh cơ tim thiếu máu cục bộ. Không có dữ liệu lâm sàng cho thời gian điều trị kháng đông ở những trường hợp này. Có một đồng thuận của các nhóm tác giả trong bài viết này khuyến cáo kháng đông (VKA hoặc DOAC) có thể xem xét trong 3 đến 6 tháng. Cần phải cá thể hóa trong từng trường hợp, liệu rằng kháng đông có thể kéo dài không hạn định hay không, xem xét những yếu tố: môi trường cho việc tạo lập HK còn hiện diện, chức năng LV có cải thiện, nguy cơ chảy máu, khả năng dung nạp OAC[1], [2], [5].
Tổng hợp lại, kháng đông điều trị nên bắt đầu cho việc điều trị HK LV sau AMI, thời gian điều trị thường là 3 tháng, theo sau đó là việc theo dõi bằng hình ảnh học từ thời điểm này. Đối với BN có tiền căn MI, kháng đông điều trị 3-6 tháng, và cần cá thể hóa nếu thời gian điều trị là lâu dài.
- DOAC như là một phương pháp thay thế Warfarin trong điều trị HK LV.
VKA, mà ưu thế là warfarin, được sử dụng rộng rãi trong phòng ngừa và điều trị HK LV, tuy nhiên, điểm bất lợi là cần phải có chế độ ăn phù hợp, thường xuyên theo dõi INR, chú ý tương tác thuốc-thuốc, thuốc-thức ăn, và điều này đặt ra nhiều thách thức cho người bệnh. Thất bại để duy trì INR trong ngưỡng điều trị (TTR<50%) làm tăng yếu tố nguy cơ đột quỵ ở BN có HK LV, điều đó làm nổi bật vai trò của DOAC trong điều trị rung nhĩ và HK thuyên tắc tĩnh mạch. Trong thực hành lâm sàng, các nhà lâm sàng sử dụng DOAC để điều trị HK LV từ dữ liệu rút ra từ việc điều trị rung nhĩ và thuyên tắc HK tĩnh mạch[1].
Hướng dẫn của ACC/AHA 2013 về STEMI khuyến cáo thuốc kháng đông được lựa chọn điều trị HK LV là VKA chứ không là DOAC, mặc dù khuyến cáo này đã công bố hơn thập kỷ. Hướng dẫn của hội Tim châu Âu 2017 về STEMI nhấn mạnh kháng đông được chỉ định trong trường hợp này, chứ không nhắc đến cụ thể VKA hay DOAC. Hướng dẫn AHA/ASA 2021 về đột quỵ, dựa trên 2 nghiên cứu hồi cứu, khuyến cáo nhóm IIb cho DOAC trong điều trị HK LV, do tính an toàn và lợi ích giảm nguy cơ HK tái phát là không chắc chắn. Và cho tới thời điểm này, rất ít hướng dẫn trả lời câu hỏi liệu kháng đông DOAC có thể thay thế warfarin được hay không ?[1], [2]
Nhiều nghiên cứu hồi cứu, thử nghiệm ngẫu nhiên, phân tích tổng hợp, mặc dù cỡ mẫu nhỏ cho thấy DOAC không dưới warfarin trong điều trị HK LV. Một phân tích tổng hợp của ba thử nghiệm ngẫu nhiên có đối chứng, bao gồm 139 BN, cho thấy rằng DOAC không thua kém VKA trong việc giảm tử vong, đột quỵ, thoái triển HK LV. Phân tích sổ bộ cũng cho thấy DOAC cũng có ít biến cố chảy máu hơn (2.86% của DOAC so với 13.2% warfarin; OR, 0.16 [95% CI, 0.02-0.82]). Một phân tích tổng hợp thứ hai, bao gồm 8 nghiên cứu ngẩu nhiên và không ngẫu nhiên gồm 1200 BN cũng cho thấy DOAC không thua kém VKA, và biến cố chảy máu ít hơn. Một phân tích tổng hợp khác, bao gồm 2 thử nghiệm ngẫu nhiên và 16 nghiên cứu đoàn hệ của 2666 BN, DOAC làm giảm có ý nghĩa thống kê đột quỵ so với VKA (OR, 0.63 [95% CI, 0.42-0.96], P=0.03). Tuy nhiên lại không có sự có ý nghĩa thống kê về tỷ lệ tử vong, chảy máu, biến cố thuyên tắc hệ thống, cũng như kết cục cộng dồn của đột quỵ, sự thoái triển LV và thuyên tắc hệ thống. Một phân tích tổng hợp của 8 nghiên cứu hồi cứu và dữ liệu sổ bộ của 1955 BN cho thấy DOAC không thua kém, và tối thiểu là hiệu quả như VKA trong điều trị, tuy nhiên những lợi ích khác thì không thấy, bao gồm biến cố chảy máu. Một phân tích tổng hợp của 12 nghiên cứu bao gồm 2322 BN cho thấy không có sự khác biệt giữa thoái triển LV và biến cố chảy máu giữa 2 nhóm. Và kết luận lại là, DOAC cũng tốt như VKA trong cân bằng phòng ngừa biến cố thiếu máu và chảy máu[1], [2].
Một phân tích tổng hợp bao gồm thử nghiệm lâm sàng ngẫu nhiên, nghiên cứu tiến cứu và hồi cứu từ lúc bắt đầu thực hiện phân tích đến 19/02/2022, dữ liệu sổ bộ từ 21 nghiên cứu gồm 3057 BN có HK LV, trong đó 824 BN điều trị DOAC và 2233 điều trị VKA. Thời gian theo dõi trung bình (theo dữ liệu từ 19 nghiên cứu) là 12 tháng (khoảng tứ phân vị, 6-24 tháng). Thời gian điều trị kháng đông trung bình mỗi nhóm (rút ra từ 4 nghiên cứu) là 222 ngày (khoảng tứ phân vị 125.2-417 ngày) cho DOAC và 345.5 ngày (khoảng tứ phân vị 253-575 ngày) cho VKA. Phân tích tổng hợp này cho thấy không có sự khác biệt về hiệu quả và tính an toàn trong điều trị đột quỵ và thuyên tắc hệ thống (OR, 0.94 [95% CI, 0.7-1.25]; P=0.65, hình 6), cũng như là tử vong do mọi nguyên nhân (OR, 0.92 [95% CI, 0.64–1.30]; P=0.63), sự thoái triển HK LV (OR, 1.21 [95% CI, 0.89–1.64];P=0.22), và các biến cố chảy máu (OR, 0.79 [95% CI,0.56–1.11]; P=0.17). Những phân tích tổng hợp độc lập với chỉ một thử nghiệm lâm sàng ngẫu nhiên có đối chứng hoặc đi kèm với nghiên cứu tiến cứu cũng không có sự khác biệt hiệu quả điều trị giữa 2 nhóm[1].
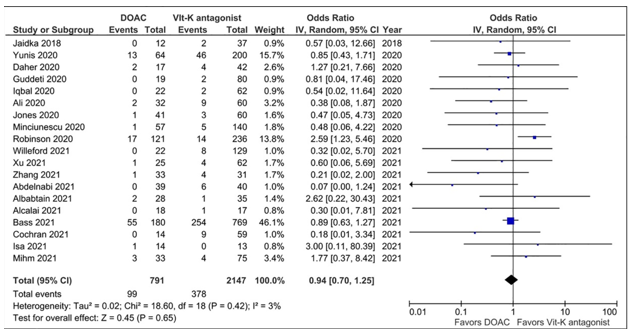
Hình 6: Cập nhật phân tích tổng hợp những nghiên cứu ngẫu nhiên so sánh warfarin và DOAC, với biến cố đột quỵ và thuyên tắc hệ thống[1] (Chụp từ tài liệu gốc)
Không khuyến cáo sử dụng DOAC trong bệnh thận mạn giai đoạn cuối. Và do thế, việc sử dụng OAC cần cá thể hóa từng trường hợp.
- OAC ở BN điều trị kháng kết tập tiểu cầu.
Phối hợp điều trị OAC và kháng kết tập tiểu cầu làm tăng nguy cơ chảy máu có ý nghĩa. Hơn thập kỷ qua, nhiều nghiên cứu đã đề ra chiến lược tốt nhất trong việc sử dụng OAC và kháng tiểu cầu sau PCI. Dựa trên kết quả của những nghiên cứu, khuyến cáo, hướng dẫn hiện nay, khi BN có chỉ định kháng đông được PCI, sau 1 đến 4 tuần điều trị bộ 3 (OAC+DAPT), sau đó xuống thang với một OAC (DOAC) và 1 kháng kết tập tiểu cầu P2Y12 (thường là clopidogrel) được ưu tiên chọn lựa lâu dài[1], [2].
- DAPT cho việc phòng ngừa HK LV.
Lý do chọn kháng đông điều trị HK LV là dựa vào cơ chế sinh lý bệnh. Không có nghiên cứu ngẫu nhiên nào đánh giá vai trò của kháng tiểu cầu cho việc phòng và điều trị HK LV sau AMI. Những phân tích dựa trên dữ liệu của BN MI cấp thành trước có vô động hoặc loạn động vùng mỏm (siêu âm tim được thực hiện trong vòng 7 ngày từ lúc nhập viện), những BN sử dụng warfarin+ DAPT (trong đó có clopidogrel) thì có biến cố tim mạch cộng dồn thiếu máu và chảy máu lớn hơn so với điều trị DAPT đơn thuần (trong đó có clopidogrel), và chỉ có 1 biến cố đột quỵ thiếu máu xảy ra ở mỗi nhóm. Những nghiên cứu quan sát cho thấy sử dụng ticagrelor thì ít biến cố HK LV hơn so với clopidogrel. Một nghiên cứu khác so sánh chiến lược điều trị DAPT (có ticagrelor) so với điều trị bộ ba thuốc ở BN STEMI thành trước có rối loạn vùng mỏm được PCI tiên phát, kết luận của nghiên cứu là không có sự khác biệt biến cố cộng dồn thiếu máu và chảy máu, mặc dù chỉ có 1 BN ghi nhận đột quỵ và TIA. Hiện tại chưa có đủ dữ liệu để kết luận liệu DAPT đơn thuần hoặc chỉ sử dụng ticagrelor trong việc điều trị BN có nguy cơ hình thành HK LV[1].
- Những khuyến cáo trong việc phòng ngừa và điều trị HK LV (bảng 2)[2], [5].
Bảng 2. Khuyến cáo của các hiệp hội Tim mạch trong điều trị HK LV sau NMCT
| Hướng dẫn | Khuyến cáo | INR mục tiêu | Thời gian điều trị, tháng | Nhóm khuyến cáo | Mức độ chứng cứ |
| Phòng ngừa | |||||
| ACCF/AHA STEMI 2013 | Kháng đông có thể xem xét ở BN STEMI đi kèm vô động/loạn động vùng mỏm, thành trước | INR=2-2.5 khi phối hợp DAPT | 3 | IIb | C |
| AHA/ASA phòng chống đột quỵ 2014 | Kháng vitamin K có thể xem xét ở những BN có đột quỵ thiếu máu hoặc TIA với STEMI đi kèm vô động/loạn động vùng mỏm, thành trước | 2.5 (2-3) | 3 | IIb | C |
| ESC STEMI 2017 | Không khuyến cáo | NA | NA | NA | NA |
| Điều trị | |||||
| ACCF/AHA STEMI 2013 | Kháng vitamin K có thể xem xét ở BN STEMI có HK cơ không triệu chứng | INR=2-2.5 khi phối hợp DAPT | 3 | IIa | C |
| AHA/ASA phòng chống đột quỵ 2014 | Kháng vitamin K có thể xem xét ở những BN có đột quỵ thiếu máu hoặc TIA với STEMI đi kèm HK cơ | 2.5 (2-3) | 3 | I | C |
| ESC STEMI 2017 | Kháng đông uống có thể xem xét, cần siêu âm tim lặp lại, đánh giá nguy cơ chảy máu và sự cần thiết sử dụng kháng kết tập tiểu cầu đồng thời | Không có dữ liệu | 6 | IIa | C |
Năm 2022, trên tạp chí JACC, Camaj A và cộng sự đã đề xuất một lưu đồ trong tiếp cận chẩn đoán và quản lý huyết khối LV sau AMI. Trong trường hợp có huyết khối vẫn còn dù điều trị kháng đông 3 tháng, Levine và cộng sự cho rằng cần đánh giá bản chất huyết khối để quyết định hướng xử trí tiếp theo (hình 7).[1,2]
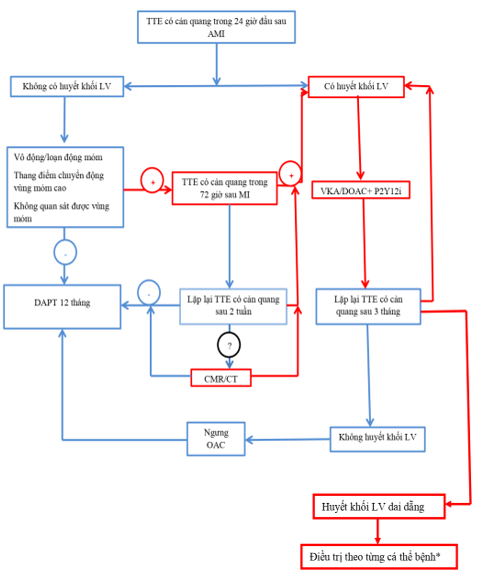
Hình 7. Lưu đồ tiếp cận chẩn đoán và điều trị HK LV sau AMI theo Camaj A và Levine GN[1], [2].
* Nếu huyết khối là dạng cuống hoặc di động: có thể thay thế loại OAC khác hoặc chuyển sang LMWH. Nếu huyết khối cơ (dạng phiến mong), tổ chức hóa, calci hóa, có thể xem xét ngưng kháng đông.
Tất cả BN có AMI nên được đánh giá bằng TTE có cản quang trong 24 giờ đầu. Nếu có HK LV, lộ trình điều trị bao gồm 1 ức chế P2Y12 và VKA bắc cầu với heparin đến khi INR=2-3 để giảm nguy cơ chảy máu, sau đó lặp lại hình ảnh học sau 3 tháng. Dựa trên những kinh nghiệm BNrung nhĩ được PCI, INR có thể thu hẹp trong khoảng 2-2.5 khi phối hợp điều trị bộ 3 (DAPT+VKA), mặc dù khó đạt được. Thời gian điều trị cần phải đánh giá dựa trên từng ca, phụ thuộc vào nguy cơ thiếu máu và chảy máu, sự phục hồi LV. Trong trường hợp không dung nạp VKA, DOAC có thể thay thế. OAC có thể ngưng và khởi động điều trị kháng kết tập tiểu cầu sau 3 tháng nếu hình ảnh học không có HK tồn lưu và chức năng LV được cải thiện. Nếu HK còn hiện hữu, vẫn tiếp tục OAC và lặp lại hình ảnh học sau 3 tháng[1], [2], [5].
Nếu BN có MI diện lớn, bất thường chuyển động vùng trước mỏm, STEMI liên quan LAD có giảm phân suất tống máu, siêu âm tim có cản quang nên được thực hiện trong 72 giờ sau PCI. Nếu không có, tiếp tục sử dụng DAPT và lặp lại siêu âm sau 1-2 tuần. Ở một số trung tâm thường sử dụng CMR, tuy nhiên nên sử dụng trong trường hợp TTE có echo kém hoặc vùng mỏm khó quan sát[1],[2], [5].
KẾT LUẬN
Việc chẩn đoán và quản lý HK LV sau AMI vẫn là một câu hỏi hóc búa mặc dù có nhiều tiến bộ y học. Việc chẩn đoán sớm đóng vai trò quan trọng trong việc phòng ngừa biến cố thuyên tắc HK, cũng như phương tiện và thời điểm để chẩn đoán. Vai trò của DOAC vẫn còn giới hạn, và VKA vẫn còn đóng vai trò quan trọng trong điều trị. Các bác sĩ thực hành lâm sàng cần cá thể hóa trong việc tầm soát, theo dõi và điều trị HK LV, cân bằng nguy cơ thiếu máu và chảy máu. Một chiến lược điều trị dựa trên tam giác Virchow (giảm tổn thương cơ tim, đáp ứng viêm, phòng chống tái cấu trúc cơ tim) có nhiều điều hứa hẹn trong tương lai.
TÀI LIỆU THAM KHẢO
- GN Levine, et al, Management of Patients at Risk for and With Left Ventricular Thrombus: A Scientific Statement From the American Heart Association, Circulation 2022 Oct 11;146(15):e205-e223.doi: 10.1161/CIR.0000000000001092.
- A Camaj, et al, Left Ventricular Thrombus Following Acute Myocardial Infarction: JACC State-of-the-Art Review, J Am Coll Cardiol 2022 Mar 15;79(10):1010-1022. doi: 10.1016/j.jacc.2022.01.011.
- R Delewi, et al, Left ventricular thrombus formation after acute myocardial infarction, 2012 Dec; 98(23): 1743–1749.
- F Habash, et al, Challenges in management of left ventricular thrombus, Ther Adv Cardiovasc Dis.2017 Aug; 11(8): 203–213.
- McCarthy CP, Vaduganathan M, McCarthy KJ, Januzzi JL Jr, Bhatt DL, McEvoy JW. Left ventricular thrombus after acute myocardial infarction: screening, prevention, and treatment. JAMA Cardiol. 2018;3:642–649. doi: 10.1001/jamacardio.2018.1086.







