Bệnh thận mạn đang là một thách thức lớn đối với ngành y tế trên toàn cầu, không chỉ do nguy cơ tiến triển đến bệnh thận giai đoạn cuối mà còn do nguy cơ tim mạch quan trọng đối với người bệnh.
TS. Hồ Huỳnh Quang Trí
Viện Tim TP HCM
NGUY CƠ TIM MẠCH TRONG BỆNH THẬN MẠN
Bệnh thận mạn đang là một thách thức lớn đối với ngành y tế trên toàn cầu, không chỉ do nguy cơ tiến triển đến bệnh thận giai đoạn cuối mà còn do nguy cơ tim mạch quan trọng đối với người bệnh.Thật vậy, bệnh thận giai đoạn cuối là biến chứng dễ thấy nhất của bệnh thận mạn, tuy nhiên các biến chứng tim mạch lại là các biến chứng đáng ngại nhất vì nhiều người bệnh thận mạn chết vì các biến chứng tim mạch trước khi kịp mắc bệnh thận giai đoạn cuối.1 Cách đây 10 năm, Tổ chức Thận Quốc gia Hoa Kỳ (National Kidney Foundation) đã đưa ra một cách phân loại bệnh thận mạn mà đến nay vẫn được dùng phổ biếnvì nó rất hữu ích cho việc tầm soát phát hiện sớm những bệnh nhân có rối loạn chức năng thận. Theo phân loại của Tổ chức Thận Quốc gia Hoa Kỳ, bệnh thận mạn được chia thành 5 giai đoạn: Giai đoạn 1 tương ứng với mức lọc cầu thận bình thường (≥ 90 ml/phút/1,73 m2) nhưng trong nước tiểu đã có những bất thường (ví dụ albumin niệu vi lượng hoặc albumin niệu lượng lớn), các giai đoạn 2-4 tương ứng với mức độ nặng của bệnh tăng dần (mức lọc cầu thận giảm từ 60-89 xuống 30-59 rồi 15-29 ml/phút/1,73 m2) và giai đoạn 5 tương ứng với bệnh thận giai đoạn cuối (lọc cầu thận dưới 15 ml/phút/1,73 m2 hoặc phải lọc thận định kỳ).2 Cách phân loại này đã được áp dụng vào điều tra NHANES lần 3 (Third National Health and Nutrition Examination Survey) và cho thấy tần suất lưu hành bệnh thận mạn trong dân số Hoa Kỳ trưởng thành là 10,8% (khoảng 19,2 triệu người).3 Cách phân loại này cũng đã được áp dụng vào nghiên cứu PREVEND (Prevention of Renal and Vascular End-stage Disease) và cho thấy tần suất lưu hành bệnh thận mạn trong dân số người Hà Lan trưởng thành là 12%.4 Nếu ngoại suy các kết quả này cho dân số trưởng thành trên toàn thế giới, có thể ước tính số người bệnh thận mạn là nhiều trăm triệu.
Phân loại của Tổ chức Thận Quốc gia Hoa Kỳ cũng rất hữu ích cho việc đánh giá nguy cơ tim mạch của người bệnh thận mạn. Một nghiên cứu sổ bộ rất lớn mang tên Kaiser Permanente Renal Registry thực hiện trên hơn 1 triệu người trưởng thành ở Hoa Kỳ cho thấy nếu lấy những người có lọc cầu thận ≥ 60 ml/phút/1,73 m2(không có bệnh thận hoặc bệnh thận mạn giai đoạn 1-2) làm chuẩn so sánh, những người có lọc cầu thận dưới mức này có nguy cơ chết và bị biến cố tim mạch tăng rất rõ rệt, và lọc cầu thận càng thấp thì nguy cơ càng tăng nhiều (bảng 1).5 Gần đây hơn, Lee M. (Trung tâm Đột quị, Viện Đại học California, Hoa Kỳ) và cộng sự đã tập hợp số liệu của 33 nghiên cứu đoàn hệ tiến cứu và thử nghiệm lâm sàng nhằm đánh giá ảnh hưởng của chức năng thận trên nguy cơ đột quị trong tương lai. Phân tích của nhóm tác giả này cho thấy khi lọc cầu thận giảm dưới 60 ml/phút/1,73 m2, nguy cơ đột quị trong tương lai tăng 43% (KTC 95%: 31% đến 57%; P < 0,001).6 Đặc biệt, ở người Châu Á nguy cơ đột quị tăng nhiều hơn so với người không phải Châu Á (mức tăng 96% so với 26%, trị số p phản ánh tính không đồng nhất < 0,001).
Bảng 1: Tỉ số nguy cơ hiệu chỉnh (kèm khoảng tin cậy 95%) của chết do mọi nguyên nhân, biến cố tim mạch nặng và nhập viện do mọi nguyên nhân tùy theo mức lọc cầu thận.
|
Lọc cầu thận ước tính (ml/phút/1,73 m2) |
Chết do mọi nguyên nhân |
Biến cố tim mạch nặng |
Nhập viện do mọi nguyên nhân |
|
≥ 60* |
1,0 |
1,0 |
1,0 |
|
45 – 59 |
1,2 (1,1 – 1,2) |
1,4 (1,4 – 1,5) |
1,1 (1,1 – 1,1) |
|
30 – 44 |
1,8 (1,7 – 1,9) |
2,0 (1,9 – 2,1) |
1,5 (1,5 – 1,5) |
|
15 – 29 |
3,2 (3,1 – 3,4) |
2,8 (2,6 – 2,9) |
2,1 (2,0 – 2,2) |
|
< 15 |
5,9 (5,4 – 6,5) |
3,4 (3,1 – 3,8) |
3,1 (3,0 – 3,3) |
*Nhóm này được lấy làm nhóm tham chiếu.
HƯỚNG DẪN ĐIỀU TRỊ VÀ THỰC TẾ LÂM SÀNG
Nhận thức được tầm quan trọng của mức lọc cầu thận đối với tiên lượng của người bệnh thận mạn, trong Hướng dẫn 2011 về điều trị rối loạn lipid máu, các chuyên gia của Hội Tim mạch Châu Âu và Hội Xơ vữa động mạch Châu Âu đã xếp những người có bệnh thận mạn từ vừa đến nặng (lọc cầu thận dưới 60 ml/phút/1,73 m2) vào nhóm nguy cơ rất cao.7 Đối với những người có nguy cơ tim mạch rất cao, ngưỡng bắt đầu dùng thuốc hạ cholesterol là LDL-C ≥ 70 mg/dl và mục tiêu LDL-C cần đạt là dưới 70 mg/dl (hoặc giảm LDL-C ít nhất 50% so với ban đầu nếu không đạt được trị số dưới 70 mg/dl).
Nói chung hướng dẫn của các hội chuyên khoa luôn đề ra mục tiêu rất rõ ràng, tuy vậy giữa hướng dẫn và thực tế luôn có khoảng cách, nhiều bệnh nhân nguy cơ cao hoặc rất cao có LDL-C vượt xa so với trị số được khuyến cáo.Nghiên cứu CEPHEUS khu vực châu Âu (CEntralized Pan-European survey on tHE Undertreatment of hypercholeSterolemia) cho thấy 42,6% bệnh nhân đang điều trị bằng thuốc hạ lipid máu ở châu Âu không đạt mục tiêu LDL-C.8 Ở Hoa Kỳ điều trị rối loạn lipid máu đã đạt nhiều tiến bộ trong thời gian gần đây, tuy nhiên chỉ có 30% bệnh nhân mạch vành có kèm ít nhất 2 yếu tố nguy cơ chính khác (tức là thuộc nhóm nguy cơ rất cao) đạt mục tiêu LDL < 70 mg/dl.9,10 Gần đây có nghiên cứu CEPHEUS khu vực châu Á (CEPHEUS Pan-Asian) được thực hiện nhằm xác định tỉ lệ bệnh nhân đang dùng thuốc hạ lipid máu đạt được mục tiêu LDL-C theo hướng dẫn của Chương trình Giáo dục Cholesterol Quốc gia Hoa Kỳ (National Cholesterol Education Program – Adult Treatment Panel III) (bản cập nhật 2004) ở các nước Châu Á.CEPHEUS khu vực châu Á là một nghiên cứu điều tra cắt ngang, tiền cứu, đa quốc gia, thực hiện tại 405 trung tâm ở Hàn Quốc, Đài Loan, Thái Lan, Indonesia, Phi-líp-pin, Malaysia, Việt Nam và Hong Kong.11 Kết quả nghiên cứu này cho thấy chỉ có 49,1% bệnh nhân đạt được mục tiêu LDL-C. Điều đáng lo ngại là mức nguy cơ của bệnh nhân càng cao thì tỉ lệ đạt mục tiêu LDL-C càng thấp. Ở nhóm bệnh nhân nguy cơ rất cao chỉ có 34,9% đạt được mục tiêu LDL-C. Riêng ở Việt Nam, tỉ lệ đạt được mục tiêu LDL-C tính chung là 40,1% và tính riêng ở những người nguy cơ rất cao là 27,6%.
TÁC ĐỘNG KÉP TRÊN CHOLESTEROL: MỘT TIẾP CẬN MỚI
Có một số lý do khiến cho việc đạt mục tiêu LDL-C trên thực tế còn chưa cao. Lý do thứ nhất là sự “trì trệ lâm sàng” của các bác sĩ điều trị (biết bệnh nhân chưa đạt mục tiêu LDL-C nhưng vẫn không điều chỉnh việc kê toa). Lý do thứ hai là sự tuân trị kém của một số bệnh nhân. Một lý do nữa cũng không kém phần quan trọng là sự giới hạn về hiệu lực hạ LDL-C của các thuốc nhóm statin: Khi tăng liều statin lên gấp đôi thì hiệu lực hạ LDL-C chỉ tăng thêm khoảng 6%, và như vậy để hạ LDL-C thêm khoảng 20% thì phải tăng liều statin lên gấp 8 lần, một điều không phải lúc nào cũng thực hiện được. Ngay cả khi dùng 2 statin có hiệu lực mạnh nhất ở liều tối đa (atorvastatin 80 mg hoặc rosuvastatin 40 mg), vẫn còn nhiều bệnh nhân nguy cơ cao hoặc rất cao chưa đạt mục tiêu điều trị. Trong nghiên cứu SATURN (Study of Coronary Atheroma by Intravascular Ultrasound: Effect of Rosuvastatin versus Atorvastatin) thực hiện trên 1039 người bệnh mạch vành, tỉ lệ đạt mục tiêu LDL-C dưới 70 mg/dl là 72% với rosuvastatin 40 mg/ngày và 56% với atorvastatin 80 mg/ngày, có nghĩa là có từ 28% đến 44% bệnh nhân vẫn chưa đạt mức LDL-C dưới 70 mg/dl dù đã dùng statin với liều tối đa.12
Sự xuất hiện của ezetimibegiúp các bác sĩ điều trị có được một tiếp cận mới trong kiểm soát LDL-C. Ezetimibe là một thuốc có tác dụng ngăn sự hấp thu ở ruột của cholesterol trong thức ăn và mật qua cơ chế ức chế protein Niemann-Pick C1 Like 1 (NPC1L1) trong các tế bào biểu mô được bao phủ vi mao của hỗng tràng. Phối hợp ezetimibe với statin giúp hạ LDL-C rất mạnh vì ức chế cả hấp thu cholesterol ở ruột lẫn tổng hợp cholesterol ở gan. Dạng kết hợp simvastatin với ezetimibe được Merck bào chế, có tên biệt dược là Vytorin, mỗi viên gồm ezetimibe 10 mg kết hợp với simvastatin 10 mg, 20 mg, 40 mg hoặc 80 mg (hàm lượng 10 mg ezetimibe + 80 mg simvastatin được dùng hạn chế cho những người đã từng dùng simvastatin 80 mg và dung nạp tốt). Nghiên cứu của Davidson và cộng sự trên bệnh nhân tăng cholesterol nguyên phát (LDL-C trong khoảng 145 đến 250 mg/dl) cho thấy so với simvastatin đơn trị, ezetimibe phối hợp simvastatin giảm LDL-C thêm 13,8%, tăng HDL-C 2,4% và giảm TG 7,5%.13 Điểm đáng lưu ý là phối hợp 10 mg ezetimibe với 10 mg simvastatin giúp hạ LDL-C 46%, tương đương với simvastatin 80 mg đơn trị. Điều đó có nghĩa là thay vì tăng liều simvastatin lên gấp 8 lần (kèm theo đó là tăng nguy cơ tác dụng ngoại ý), chỉ cần phối hợp thêm ezetimibe 10 mg là đạt hiệu lực hạ LDL-C tương đương.
Nghiên cứu SANDS (Stop Atherosclerosis in Native Diabetics Study)thực hiện trên bệnh nhân đái tháo đường týp 2 so sánh ảnh hưởng của 2 chiến lược điều trị trên tiến triển của bề dày thành động mạch cảnh. Chiến lược thứ nhất là kiểm soát cholesterol tích cực để đạt mục tiêu LDL-C ≤ 70 mg/dl và non-HDL-C ≤ 100 mg/dl bằng statin (có thể phối hợp ezetimibe nếu statin đơn trị không đạt mục tiêu) và chiến lược thứ hai là kiểm soát cholesterol qui ước để đạt mục tiêu LDL-C ≤ 100 mg/dl và non-HDL-C ≤ 130 mg/dl.14 Trong số những bệnh nhân được kiểm soát cholesterol tích cực có khoảng một phần ba có dùng thêm ezetimibe. Kết quả SANDS cho thấy bề dày thành động mạch cảnh giảm có ý nghĩa sau 36 tháng ở những bệnh nhân được kiểm soát tích cực cholesterol, trong khi đó bề dày thành động mạch cảnh lại tăng ở những người được kiểm soát cholesterol qui ước. Bảng 2 biểu diễn thay đổi của bề dày thành động mạch cảnh (tính bằng mm) sau 36 tháng điều trị ở các nhóm. Nhìn vào bảng này ta thấy ở những người được kiểm soát cholesterol tích cực, nhóm dùng statin phối hợp ezetimibe có bề dày thành động mạch cảnh giảm nhiều hơn so với nhóm dùng statin đơn trị (tuy sự khác biệt không có ý nghĩa thống kê), và thay đổi bề dày thành động mạch cảnh của cả 2 nhóm này đều khác biệt rất có ý nghĩa so với nhóm kiểm soát cholesterol qui ước. Kết quả SANDS chứng tỏ kiểm soát cholesterol tích cực (bằng statin ± ezetimibe) giúp chặn đứng và gây thoái triển xơ vữa động mạch trong động mạch cảnh của bệnh nhân đái tháo đường týp 2 và phối hợp ezetimibe là một lựa chọn điều trị rất hữu ích dành cho những bệnh nhân không đạt mục tiêu LDL-C với đơn trị bằng statin.
Bảng 2:Thay đổi bề dày thành động mạch cảnh (mm) sau 36 tháng điều trị.
|
Kiểm soát cholesterol qui ước (n = 204) |
Kiểm soát cholesterol tích cực |
Khác biệt giữa các nhóm (mm) |
|||
|
Statin + eze (n = 69) |
Statin đơn trị (n = 154) |
Statin + eze so với statin đơn trị |
Statin + eze so với kiểm soát qui ước |
Statin đơn trị so với kiểm soát qui ước |
|
|
+0,039 |
-0,025 |
-0,012 |
0,01 (p = 0,999) |
0,06 (p = 0,001) |
0,05 (p = 0,001) |
Ghi chú:eze = ezetimibe.
NGHIÊN CỨU SHARP: CỘT MỐC QUAN TRỌNG
Như đã trình bày ở trên, những người bệnh thận mạn từ vừa đến nặng (lọc cầu thận dưới 60 ml/phút/1,73 m2) có nguy cơ tim mạch rất cao. Tuy nhiên hạ LDL-C cho những người này có ngăn ngừa được các biến cố tim mạch hay không là một câu hỏi chưa có lời giải đáp cho đến khi kết quả của nghiên cứu SHARP (Study of Heart and Renal Protection) được công bố năm 2011. SHARP là một thử nghiệm lâm sàng phân nhóm ngẫu nhiên mù đôi thực hiện trên những người bệnh thận mạn tuổi ≥ 40. Bệnh nhân phải có creatinin/huyết tương ≥ 1,7 mg/dl (nếu là nam) hoặc ≥ 1,5 mg/dl (nếu là nữ) ở ít nhất 2 lần đo hoặc đang lọc thận mạn (thận nhân tạo hoặc thẩm phân phúc mạc ngoại trú). Một tiêu chuẩn chọn bệnh nữa là không có tiền sử nhồi máu cơ tim hoặc tái tưới máu mạch vành. Bệnh nhân được phân ngẫu nhiên cho dùng phối hợp simvastatin 20 mg + ezetimibe 10 mg/ngày hoặc placebo. Tiêu chí đánh giá chính là phối hợp các biến cố xơ vữa động mạch quan trọng: nhồi máu cơ tim không chết, chết do bệnh mạch vành, đột quị không phải xuất huyết và thủ thuật hoặc phẫu thuật tái tưới máu động mạch.15
Tổng cộng có 9270 người được tuyển vào nghiên cứu, 4650 người được phân cho dùng phối hợp simvastatin + ezetimibe và 4620 người được phân cho dùng placebo. Tuổi trung bình của bệnh nhân là 62, nam giới chiếm tỉ lệ 63%, bệnh nhân đái tháo đường chiếm tỉ lệ 23%. 67% bệnh nhân không lọc thận mạn (lọc cầu thận trung bình của những người này là 26,6 ml/phút/1,73 m2, trong số này 80% có albumin niệu) và 33% bệnh nhân phải lọc thận mạn (gồm 27% chạy thận nhân tạo định kỳ và 6% thẩm phân phúc mạc ngoại trú). Trị số trung bình của LDL ban đầu là 2,77 mmol/l. Thời gian theo dõi trung vị là 4,9 năm.
Kết quả SHARP cho thấy phối hợp simvastatin + ezetimibe hạ LDL 0,85 mmol/l và giảm 17% (p = 0,0021) các biến cố xơ vữa động mạch quan trọng so với placebo. Trên hình 1 là tần suất dồn các biến cố xơ vữa động mạch quan trọng của 2 nhóm simvastatin + ezetimibe và placebo. Phối hợp simvastatin + ezetimibe giảm rất rõ rệt đột quị dạng thiếu máu cục bộ và tái tưới máu mạch vành. Bảng 3 tóm tắt tần suất từng biến cố ở 2 nhóm. Tần suất các biến cố ngoại ý (bệnh cơ, viêm gan, sỏi mật, ung thư) rất thấp và không khác biệt giữa 2 nhóm.
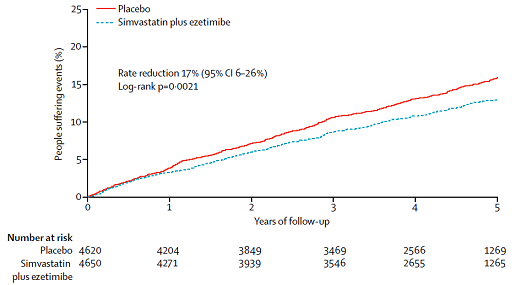
Hình 1:Tần suất dồn các biến cố xơ vữa động mạch quan trọng ở nhóm placebo (đường trên) và nhóm simvastatin + ezetimibe (đường dưới) trong nghiên cứu SHARP.
Bảng 3: Tần suất các biến cố lâm sàng trong nghiên cứu SHARP.
|
|
Simvastatin-ezetimibe (n = 4650) |
Placebo (n = 4620) |
Tỉ số nguy cơ (KTC 95%) |
Trị số p |
|
Biến cố mạch vành NMCT không chết Chết do bệnh mạch vành |
213 (4,6%) 134 (2,9%) 91 (2,0%) |
230 (5,0%) 159 (3,4%) 90 (1,9%) |
0,92 (0,76-1,11) 0,84 (0,66-1,05) 1,01 (0,75-1,35) |
0,12 0,95 0,37 |
|
Đột quị không xuất huyết Dạng thiếu máu cục bộ Dạng không rõ |
131 (2,8%) 114 (2,5%) 18 (0,4%) |
174 (3,8%) 157 (3,4%) 19 (0,4%) |
0,75 (0,60-0,94) 0,72 (0,57-0,92) 0,94 (0,49-1,79) |
0,01 0,0073 0,85 |
|
Tái tưới máu Động mạch vành Ngoài động mạch vành |
284 (6,1%) 149 (3,2%) 154 (3,3%) |
352 (7,6%) 203 (4,4%) 169 (3,7%) |
0,79 (0,68-0,93) 0,73 (0,59-0,90) 0,90 (0,73-1,12) |
0,0036 0,0027 0,36 |
Kết quả SHARP rất ấn tượng, tuy nhiên có một câu hỏi được đặt ra là liệu ezetimibe có góp phần vào lợi ích lâm sàng của việc hạ LDL-C được ghi nhận trong SHARP hay không? Để trả lời câu hỏi này cần phải xem lại kết quả của phân tích gộp CTT (Cholesterol Treatment Trialists’ Collaboration) năm 2010. 16 Nhóm nghiên cứu CTT tổng hợp số liệu của 26 thử nghiệm lâm sàng phân nhóm ngẫu nhiên gồm 21 thử nghiệm lâm sàng so sánh statin với chứng và 5 thử nghiệm lâm sàng so sánh statin liều cao với statin liều thông thường (tổng cộng gần 170.000 người tham gia). Kết quả phân tích gộp cho thấy ứng với một mức hạ LDL-C là 1,0 mmol/l, tần suất các biến cố xơ vữa động mạch quan trọng giảm 22% (p < 0,0001). Đường biểu diễn mối tương quan giữa mức hạ LDL-C và mức giảm các biến cố xơ vữa động mạch quan trọng trong phân tích gộp CTT được thể hiện trên hình 2. Khi chồng kết quả của SHARP lên đồ thị này, ta thấy kết quả SHARP (giảm các biến cố xơ vữa động mạch quan trọng 17% ứng với một mức hạ LDL-C 0,85 mmol/l hay 32 mg/dl) rất phù hợp với kết quả chung của CTT. Từ phân tích này, có thể kết luận là ezetimibe có góp phần vào lợi ích lâm sàng của điều trị hạ LDL-C được ghi nhận trong SHARP vì dùng ezetimibe phối hợp simvastatin mới đạt được một mức hạ LDL-C như vậy.
SHARP đánh dấu một cột mốc quan trọng trong điều trị bệnh thận mạn, chứng tỏ có thể phòng ngừa hữu hiệu các biến cố xơ vữa động mạch quan trọng và cải thiện dự hậu của người bệnh thận mạn vừa-nặng bằng phối hợp simvastatin + ezetimibe.
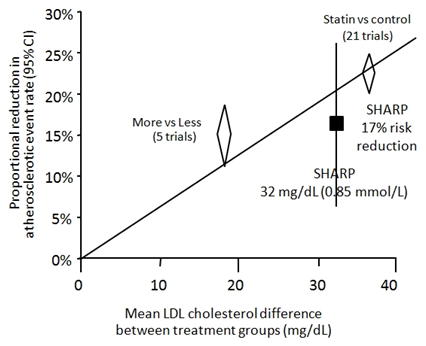
Hình 2: Tương quan giữa mức hạ LDL-C (mg/dl, trên trục hoành) và mức giảm các biến cố xơ vữa động mạch quan trọng (tỉ lệ %, trên trục tung) trong phân tích gộp CTT. Hình vuông màu đen biểu diễn kết quả của nghiên cứu SHARP (mức giảm nguy cơ 17% ứng với mức hạ LDL-C 32 mg/dl, vạch đứng biểu diễn khoảng tin cậy 95% của mức giảm nguy cơ).
KẾT LUẬN
Hiện nay, giữa hướng dẫn điều trị và thực tế lâm sàng vẫn còn một khoảng cách lớn. Nhiều bệnh nhân nguy cơ từ cao đến rất cao có LDL-C chưa được kiểm soát, một phần là do hiệu lực giới hạn của các thuốc nhóm statin. Phối hợp ezetimibe với statin là một tiếp cận mới giúp đạt mục tiêu điều trị hữu hiệu hơn statin đơn trị. Kết quả nghiên cứu SHARP là một bằng chứng thuyết phục về lợi ích lâm sàng của tiếp cận này trong bệnh thận mạn. Những người bệnh thận mạn từ vừa đến nặng (đối tượng được tuyển vào SHARP) có nguy cơ tim mạch rất cao, do đó mọi liệu pháp giúp cải thiện dự hậu tim mạch của những người này, bao gồm phối hợp simvastatin + ezetimibe, xứng đáng chiếm một vị trí quan trọng trong các phác đồ điều trị.
TÀI LIỆU THAM KHẢO
1) National Kidney Foundation Task Force on Cardiovascular Disease. Controlling the epidemic of cardiovascular disease in chronic renal disease: What do we know? What do we need to learn? Where do we go from here? Am J Kidney Dis 1998;32:853-906.
2) National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis 2002;39:S1-S266.
3) Coresh J, Astor BC, Greene T, Eknoyan G, Levey AS. Prevalence of chronic kidney disease and decreased kidney function in the adult US population: Third National Health and Nutrition Examination Survey. Am J Kidney Dis 2003;41:1-12.
4) De Zeeuw D, Hillege HL, de Jong PE. The kidney, a cardiovascular risk marker, and a new target for therapy. Kidney Int 2005;68(suppl 98):S25-S29.
5) Go AS, Chertow GM, Fan D, et al. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med 2004;351:1296-1305.
6) Lee M, Saver JL, Chang KH, et al. Low glomerular filtration rate and risk of stroke: metaanalysis. BMJ 2010;341;c4249.
7) The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). ESC/EAS Guidelines for the management of dyslipidaemias. Eur Heart J 2011;32:1769-1818.
8) Hermans MP, Castro Cabezas M, Ferrieres J, et al. Centralized Pan-European survey on the undertreatment of hypercholesterolemia (CEPHEUS): overall findings from eight countries. Curr Med Res Opin 2010;26:445-454.
9) Santos RD, Waters DD, Tarasenko L, et al. Low- and high-density lipoprotein cholesterol goal attainment in dyslipidemic women: The Lipid Treatment Assessment Project (L-TAP) 2. Am Heart J 2009;158:860-866.
10) Waters DD, Brotons C, Chiang CW, et al. Lipid Treatment Assessment Project 2: a multinational survey to evaluate the proportion of patients achieving low-density lipoprotein cholesterol goals. Circulation 2009;120:28-34.
11) Park JE, Chiang CE, Munawar M, et al. Lipid-lowering treatment in hypercholesterolaemic patients: the CEPHEUS Pan-Asian survey. Eur J Cardiovasc Prev Rehab, published online 7 March 2011. DOI: 10.1177/1741826710397100.
12) Nicholls SJ, Ballantyne CM, Barter PJ, et al. Effect of two intensive statin regimens on progression of coronary disease. N Engl J Med 2011;365:2078-2087.
13) Davidson MH, McGarry T, Bettis R, et al, on behalf of the Ezetimibe Study Group. Ezetimibe coadministered with simvastatin in patients with primary hypercholesterolemia. J Am Coll Cardiol 2002;40:2125-2134.
14) Fleg JL, Mete M, Howard BV, et al. Effect of statins alone versus statins plus ezetimibe on carotid atherosclerosis in type 2 diabetes. The SANDS (Stop Atherosclerosis in Native Diabetics Study) trial. J Am Coll Cardiol 2008;52:2198-2205).
15) Baigent C, Landray MJ, Reith C, et al, on behalf of the SHARP Investigators. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet 2011;377:2181-2192.
16) Cholesterol Treatment Trialists (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170 000 participants in 26 randomised trials. Lancet 2010;376:1670-1681.







