BS. NGUYỄN THANH HIỀN
BS. NGUYỄN TRẦN THU THỦY
BS. TRẦN DŨ ĐẠI
MỞ ĐẦU
Suy tim (ST) đã được công nhân là một trong những gánh nặng sức khoẻ cộng đồng toàn cầu. Suy tim làm ảnh hưởng đến 2–3% dân số người trưởng thành ở các nước phương Tây và là nguyên nhân nhập viện phổ biến ở những người trên 60 tuổi. Người ta ước tính rằng ST làm tiêu tốn khoảng 9 tỷ euro/năm cho ngân sách chăm sóc sức khoẻ của Châu Âu (1).
Sung huyết, liên quan đến quá tải áp lực và/hoặc thể tích, là nền tảng của sinh lý bệnh, biểu hiện lâm sàng và tiên lượng của ST, không phụ thuộc vào loại ST (khi so sánh ST có phân suất tống máu (PSTM) giảm so với ST PSTM bảotồn). Cụ thể hơn, sự tăng dịch thấm do tăng áp lực mao mạch phổi dẫn đến tăng nước ngoại bào phổi gây ra phù phổi và khó thở nguy kịch ở những bệnh nhân ST.Tiếp theo là sung huyết hệ thống có thể xảy ra, thường gây phù nề ruột và giảm hấp thu các thuốc điều trị suy tim theo khuyến cáo, bao gồm cả nhóm lợi tiểu (LT) quai.Tình trạng này thường biểu hiện, về mặt lâm sàng, với những mức độ khác nhau như phù chi dưới, tràn dịch màng phổi và tăng cân một cách đáng kể. Sung huyết hệ thống diễn tiến xấu đi là một trong những nguyên nhân chính khiến bệnh nhân ST phải nhập viện và có những kết cục xấu sau đó (2). Điều trị nền tảng cho tình trạng ST xấu đi là LT quai đường tĩnh mạch, thông thường được chỉ định trong suốt thời gian nằm viện từ 5 – 15 ngày phụ thuộc vào độ nặng của đợt sung huyết và khả năng chăm sóc y tế khác nhau tuỳ vùng miền (3). Điều quan trọng là những bệnh nhân nhập viện vì tình trạng ST xấu đi có nguy cơ tái nhập viện cao, lên đến 50% trong vòng 6 tháng (4). Tái nhập viện nhiều lần gây ảnh hưởng nghiêm trọng đến chất lượng cuộc sống. Thêm vào đó, bản thân việc nhập viện có thể liên quan đến các biến chứng do việc điều trị cũng như tình trạng suy dinh dưỡng, nhiễm trùng…, đặc biệt trên những bệnh nhân lớn tuổi. Nếu như có thể được lựa chọn, nhiều bệnh nhân mắc các bệnh mạn tính, baogồm ST, ưa thích được điều trị tại nhà hơn, nhất là trong và sau mùa dịch COVID-19 (5).
Dân số bệnh nhân ST dự kiến sẽ gia tăng đáng kể trong những thập kỷ tới khiến cho áp lực lên hệ thống chăm sóc y tế cần thiết cho những bệnh nhân ST này chắc chắn tăng cao. Tại Châu Âu, một bệnh nhân ST mạn có diễn tiến xấu cần thời gian nằm viện trung bình khoảng 8 ngày trong đơn vị chăm sóc tích cực với các bác sĩ và y tá túc trực 24/7, điều này giải thích phần lớn cho nguyên nhân giá chi trả cho dịch vụ y tế trên những bệnh nhân này khá cao. Tại Mỹ trong vòng 10 năm qua đã phát triển chương trình chăm sóc lưu động (ngoại trú) cho những bệnh nhân ST mạn có diễn tiến xấu (ngay cả khi chươngtrình này vẫn chưa được đồng nhất giữa các trung tâm y tế/khu vực vùng miền), trong khi đó tại Châu Âu (cùng với một số cơ sở y tế tại Mỹ) chủ yếu quản lý bệnh nhân ST mạn có diễn tiến xấu kiểu “cổ điển”. Việc áp dụng các phương pháp tiếp cận mới để quản lý bệnh nhân ST mạn có diễn tiến xấu về cơ bản giúp làm giảm đáng kể “gánh nặng” của việc chẩn đoán đối với các hệ thống chăm sóc sức khoẻ đồng thời giúp cải thiện chất lượng cuộc sống cho bệnh nhân (6). Việc ủng hộ các phương pháp tiếp cận bệnh ST mạn có diễn tiến xấu này đem lại lợi ích cho cả bệnh nhân và nhà cung cấp dịch vụ chăm sóc y tế.
Bài báo này nhằm giúp cung cấp kiến thức cần thiết và các hướng dẫn thực hành giúp các bác sĩ lâm sàng tiếp cận bệnh nhân điều trị tại các cơ sở y tế ngoại trú hoặc tại nhà.Trên cơ sở đó, chúng tôi xem xét đến cơ sở sinh lý của liệu pháp điều trị LT, và liệu trình quản lý phù hợp nhất cho bệnh nhân ST mạn có diễn tiến xấu trong tìnhtrạng cấp cứu cũng như các thiết kế chăm sóc y tế phù hợp.
I. CƠ SỞ SINH LÝ BỆNH LIÊN QUAN ĐẾN THUỐC LỢI TIỂU
Bệnh nhân ST mạn có diễn tiến xấu thường bị sung huyết trên lâm sàng do quá tải thể tích bởi cơ chế giữ natri và nước mạn tính trong các khoang nội mạch và ngoại mạch. Do đó, trong bệnh cảnh cấp cứu, điều quan trọng là các bác sĩ lâm sàng phải có kiến thức vững chắc về cách sử dụng và phối hợp các loại thuốc LT khác nhóm với nhau, lưu ý rằng cho đến nay chỉ có một số ít nghiên cứu cung cấp bằng chứng cho việc sử dụng nhóm thuốc LT một cách tốt nhất. Mục tiêu của liệu pháp LT là: (1) đạt được hiệu quả giảm sung huyết, (2) duy trì đủ áp lực tưới máu thận và các cơ quan. Điều quan trọng khi sử dụng thuốc LT trên bệnh nhân ST mạn có diễn tiến xấu là hiểu được động học của chúng. Trong thực hành thường quy, nhiều bệnh nhân đang được điều trị suy tim với các thuốc theo khuyến cáo, sau đó giảm liều thuốc hoặc ngưng sử dụng thuốc do nhận định sai lầm của bác sĩ khi thấy tình trạng chức năng thận xấu đi mà không cố gắng tăng liều thuốc – về cơ bản – hoặc kết hợp với thuốc LT để giảm sung huyết hoàn toàn. Vì vậy, điều quan trọng là (1) xác định liều tải tối ưu thuốc LT, (2) nhanh chóng đánh giá đáp ứng của bệnh nhân đối với thuốc LT, (3) tăng liều trong trường hợp không đáp ứng đủ để ức chế nephron liên tục. Những bệnh nhân ST mạn có diễn tiến xấu thường đến khám trong tình trạng phối hợp vừa quá tải thể tích, vừa phù mô kẽ và ruột, suy chức năng thận và giảm tưới máu các cơ quan, dẫn đến suy giảm độ sinh khả dụng của thuốc cũng như đáp ứng với điều trị LT. Thêm vào đó, sự hoạt hoá hệ thống renin –angiotensin – aldosterone làm cho bệnh nhân kháng với thuốc lợi tiểu đường uống, tăng nồng độ ure nitrogen máu – chất gián tiếp kích hoạt hệ RAAS – cũng có thể xảy ra, gây ra tình trạng tương tự như ST mạn diễn tiến xấu (7,8).
Các đặc tính dược lý chính (bao gồm cả vị trí tác dụng) của các nhóm thuốc LT khác nhau được trình bày trong Bảng 1 và hình 1 (5). Trong bài này, chúng tôi sẽ không đề cập đến việc sử dụng acetazolamide tĩnh mạch và amiloride, vì hiện nay các thuốc này không có sẵn trong thực hành lâm sàng tại Việt nam
Nhóm thuốc LT mạnh nhất là nhóm lợi tiểu quai, tác động trên ST mạn có diễn tiến xấu với đường cong liều đáp ứng được trình bày trong hình 2. Trong tình trạng ST mạn có diễn tiến xấu đi và hậu quả là giảm độ sinh khả dụng của thuốc LT quai đường uống, các khuyến cáo hướng dẫn bác sĩ lâm sàng sử dụng LT quai đường tĩnh mạch để đạt được liều thải natri trần một cách nhanh chóng và hiệu quả hơn. Có rất nhiều thuốc LT quai khác nhau, và có dược động học và độ sinh khả dụng khác nhau (7,8); nhưng tại Việt nam, chúng ta chỉ có một loại duy nhất là furosemide. Nên trong bài này, chúng tôi không đề cập đến các thuốc LT quai khác.
Thuốc LT nhóm thiazide-like có thể được sử dụng cho những bệnh nhân ST nặng đáp ứng kém với thuốc LT quai trong chiến lược phong tỏa nephron tuầntự. Các thuốc LT này kích thích tác dụng thải natri của thuốc LT quai (Hình 1) và metolazone đường uống và đường tĩnh mạch vẫn có hiệu quả đối với những bệnh nhân độ lọc cầu thận thấp (<30 ml / phút / 1,73 m2). Tác dụng này có thể làm tăng đáng kể LT và cần theo dõi kali và natri huyết thanh chặt chẽ (5,7,8).
Thuốc kháng Aldosterone (Mineralocortioid receptor antagonist – MRAs) là thuốc dùng điều trị suy tim PSTM giảm với mức chứng cứ IA. Tuy nhiên việc sử dụng thuốc này trong ST cấp còn hạn chế. MRAs có thể hữu ích trong việc ngăn chặn tình trạng giảm Kali máu khi dùng liều cao LT quai. Theo quan điểm của các chuyên gia cũng như kinh nghiệm của chúng tôi là nên dùng phối hợp sớm và bắt đầu bằng liều thấp (25 mg) để ngăn giảm Kali máu do điều trị, có thể giúp tăng hiệu quả của việc điều trị LT đặc biệt ở những bệnh nhân có chức năng thận ổn định, Kali máu không cao (<5 mEq/l), có cổ chướng. Trong quá trình điều trị, cần theo dõi sát tình trạng tăng Kali máu để kịp thời ngưng thuốc. Vì tác dụng của spironolactone MRA xảy ra 48-72 giờ sau khi uống (Bảng 1), eplerenone hoặc canrenoate potassium có thể được ưu tiên trong bối cảnh ST mạn có diễn tiến xấu. Trong thử nghiệm ATHENA-HF, sử dụng spironolactone100mg/ngày được coi là an toàn và không gây tăng kali máu hoặc độ lọc cầu thận diễn tiến xấu (nhưng không cải thiện kết cục có thể do thời gian theo dõi ngắn và dược động học chậm của spironolactone) (5,7,8).
Bảng 1: Đặc điểm dược lý chính của các thuốc lợi tiểu
FENa, phân suất thải Na (fractional excretion of sodium); HCTZ, hydrochlorothiazide; IV, tĩnh mạch; NA, không có số liệu; PO, uống; RAAS, renin–angiotensin–aldosterone system; SGLT2i, sodium–glucose cotransporter 2 inhibitor.
Cuối cùng, đánh giá đáp ứng với thuốc LT là rất quan trọng trong thực hành thường quy. Các dấu hiệu lâm sàng về tình trạng sung huyết, lượng nước tiểu, cân nặng và chức năng thận có độ nhạy hạn chế đối với việc hướng dẫn liệu pháp LT. Theo dõi natri niệu là một chỉ số đơn giản về đáp ứng với thuốc LT có liên quan đến tiên lượng và có khả năng trở thành một công cụ hữu ích để hướng dẫn thực hành thường quy khi điều trị bằng thuốc LT. Đo liên tục nồng độ peptide lợi tiểu natri (BNP) thường được sử dụng ở các cơ sở y tế của Hoa Kỳ để theo dõi tình trạng sung huyết, và hiện nay xét nghiệm này có thể thực hiện tại nhà. Việc sử dụng siêu âm, bao gồm đánh giá liên tục đường Kerley – B ở phổi, tĩnh mạch chủ dưới hoặc đường kính tĩnh mạch cảnh, hoặc dòng chảy tĩnh mạch thượng thận cũng cho thấy tiềm năng hữu ích trong bệnh cảnh này (5,9,10).
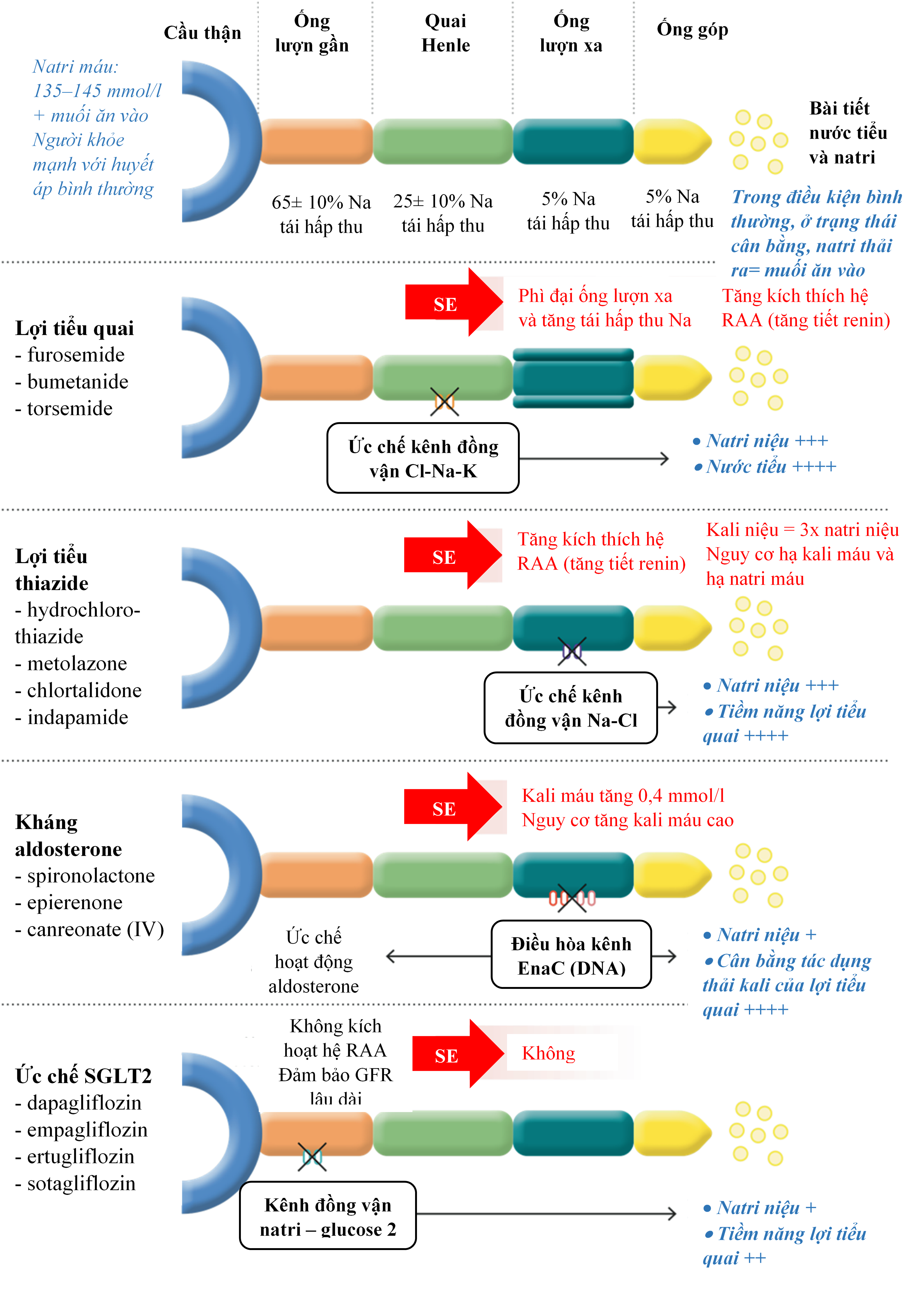
Hình 1: Ảnh hưởng của các nhóm thuốc LT trong hoạt động bài tiết nước tiểu và natri lên vị trí của các nephron và kênh ion đích. Cl, chloride; ENaC, kênh natri thượng bì (epithelial sodium channel); GFR, độ lọc cầu thận (glomerular filtration rate); K, potassium; IV, tĩnh mạch; Na, sodium; RAAS, renin–angiotensin–aldosterone system; SE, tác dụng phụ; SGLT2, sodium–glucose cotransporter 2.
Kháng lợi tiểu
Có nhiều định nghĩa khác nhau về kháng LT tuy nhiên chưa có tiêu chuẩn định lượng thống nhất. Định nghĩa chung kháng LT là tình trạng thất bại khi điều trị giảm sung huyết với nồng độ Natri niệu thấp (< 50 mEq/l) mặc khi đã sử dụng liều LT tối đa. Một số tiêu chuẩn định lượng được một số tác giả đưa ra như sau (11):
- Thất bại trong việc giảm 0.5–1kg/ngày dẫn đến bệnh nhân vẫn trong tình trạng sung huyết.
- Phân suất thải Natri (FENa)<0.2% khi đang dùng lợi tiểu.
- Natri niệu < 50 mEq/l và tỉ số Natri/Kali niệu < 1.0
- Không kèm tình trạng thiếu dịch trong lòng mạch, không dùng NSAIDs và đã hạn chế muối ăn
Như đã lưu ý, tình trạng kháng thuốc LT thường gặp ở những người bị ST có diễn tiến xấu, và tương ứng với tình trạng giảm nhạy cảm với thuốc LT dẫn đến giảm bài niệu. Kháng thuốc LT dẫn tới dịch chuyển của đường cong liều-đáp ứng sang phải đối với tốc độ bài tiết natri với việc giảm tốc độ bài tiết Natri (Hình 2). Hơn nữa, kháng thuốc LT liên quan đến ST có diễn tiến xấu là một chỉ số của ST nặng tiến triển (vì hiệu quả kém có thể tạo thuận lợi cho ST diễn tiến xấu) và nhu cầu về các liệu pháp điều trị tích cực hơn. Thuốc LT quai và thiazide có thể giúp giảm triệu chứng ngay lập tức, mặc dù không nhất thiết làm giảm tỷ lệ tử vong của bệnh nhân. Ngược lại, dữ liệu nhất quán từ nhiều nghiên cứu cho thấy liều lượng lớn thuốc LT và / hoặc nhu cầu tăng cường điều trị bằng thuốc LT có liên quan đến tăng tỷ lệ tử vong trong ST, phản ánh mức độ nghiêm trọng của suy tim sung huyết và rối loạn chức năng tim tiến triển là những nguyên nhân dẫn đến dự hậu kém (5,12).
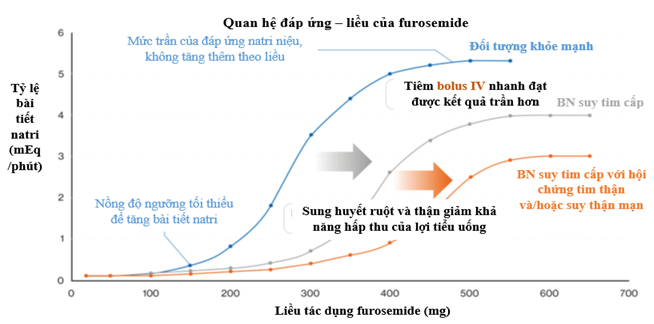
Hình 2: Sự thay đổi trong liên quan đáp ứng – liều của furosemide ở bệnh nhân suy tim mạn. Chức năng thận (được đo bằng eGFR) có ảnh hưởng quan trọng đến đường cong đáp ứng – liều của furosemide: Cần liều cao hơn cho eGFR thấp. Đây là lí do cơ bản cho sự di chuyển sang bên phải hình quan sát ở bệnh nhân suy tim mạn với hội chứng tim thận và/hoặc suy thận mạn (đường cong màu cam).
Tác động của các liệu pháp y tế theo khuyến cáo đối với suy tim sung huyết.
Điều trị theo các phác đồ khuyến cáo có thể kém hiệu quả trong tình trạng sung huyết dai dẳng và sung huyết quá mức, do các ảnh hưởng liên quan đến chức năng thận và huyết áp. Một số nghiên cứu đã tập trung vào sự tương tác giữa việc sử dụng thuốc LT và các loại thuốc sử dụng trong ST có PSTM giảm. Trong một phân tích hậu kỳ của thử nghiệm EPHESUS, liều LT quai được giảm đáng kể khi bệnh nhân dùng phối hợp với eplerenone trong quá trình theo dõi, trong khi lợi ích của eplerenone không phụ thuộc vào liều thuốc LT (13). Trong một phân tích hậu kỳ của thử nghiệm PARADIGM-HF, những bệnh nhân ngẫu nhiên dùng sacubitril/valsartan có tỷ lệ sử dụng thuốc LT sau đó thấp hơn, với việc tăng liều LT quai ít hơn và giảm liều thường xuyên hơn so với những người dùng enalapril. Hiệu quả điều trị của sacubitril/valsartan để giảm số lần nhập viện xuất hiện trong vòng 30 ngày, và trong số những bệnh nhân nhập viện trong PARADIGM-HF, khả năng tái nhập viện thấp hơn ở những người được điều trị bằng sacubitril/valsartan. Thải natri cũng được tạo ra bởi sacubitril thông qua con đường peptid lợi tiểu natri (14). Những kết quả này đã đưa ra khuyến cáo trong tất cả các thử nghiệm tiếp theo đánh giá sacubitril/valsartan (bao gồm cả PIONEER-HF) để xem xét giảm liều thuốc LT quai. Hơn nữa, ở những bệnh nhân bị ST cấp tính được ngẫu nhiên dùng sacubitril/valsartan trong thử nghiệm PIONEER-HF, việc tái nhập viện vì ST đã giảm đáng kể (tỷ số nguy cơ [HR] 0.61; p = 0.02). Tác động này của sacubitril / valsartan đối với các biến chứng sung huyết có thể liên quan đến tác dụng khiêm tốn của sacubitril để thúc đẩy bài niệu natri thông qua việc tăng nồng độ peptit lợi tiểu natri (15). Hỗ trợ kết quả gián tiếp từ PARADIGM-HF, Desai và cộng sự đã báo cáo sớm về việc giảm đáng kể áp lực động mạch phổi ở những người được điều trị bằng sacubitril/valsartan (n = 96) so với nhóm đối chứng 406 bệnh nhân (−2.9 mmHg; p < 0.001); mức giảm áp lực động mạch phổi trung bình là lớn nhất ở những người có áp lực cơ bản ≥ 30mmHg (16). Không có dữ liệu sẵn có nào cho thấy sacubitril/valsartan có tác dụng LT trên bệnh nhân ST mạn có diễn tiến xấu cần điều trị ngoại trú cấp cứu. Tuy nhiên, những phân tích gần đây này phù hợp với phân tích tổng hợp các thử nghiệm cũ hơn tập trung vào các chất ức chế RAAS cho thấy rằng những loại thuốc sau này có một tác dụng điều trị sung huyết đáng kể và có thể có lợi cho những người bị biến chứng sung huyết.
Trong 2 năm qua, nhóm thuốc ức chế SGLT2 đã được chứng minh là cải thiện các kết quả liên quan đến suy tim. Những thuốc này gây bài niệu và glucose niệu đáng kể, đặc biệt khi kết hợp với thuốc LT quai (Hình 1), làm giảm thể tích máu và huyết tương. Điều quan trọng là, các chất ức chế SGLT2 có tác dụng trên ống lượn gần, dẫn đến sự dịch chuyển chất lỏng trong ống từ đoạn gần sang đoạn xa của nephron. Sự thay đổi này có thể làm tăng bài niệu tùy thuộc vào khả năng giữ natri của các đoạn xa này (tức là tình trạng thể tích, kích hoạt hệ thần kinh, sử dụng thuốc LT). Tác dụng LT natri này không liên quan đến bất kỳ tình trạng mất điện giải đáng kể, rối loạn chức năng thận hoặc hoạt hóa thần kinh. Điều quan trọng là hiệu quả, khả năng dung nạp và tính an toàn của thuốc ức chế SGLT2 không bị ảnh hưởng khi điều trị đồng thời (hoặc phụ thuộc liều lượng) với thuốc LT thông thường. Cuối cùng, để phù hợp với tác động của việc ức chế neprilysin đối với áp lực động mạch phổi, Nassif và cộng sự đã báo cáo tương tự về hiệu quả điều trị trung bình trong 12 tuần là -1.7mmHg (p = 0.02) đối với áp lực động mạch phổi trung bình ở những bệnh nhân được điều trị bằng empagliflozin so với giả dược. Thử nghiệm sử dụng thuốc ức chế SGLT2 ở bệnh nhân kháng thuốc LT đang được tiến hành (DAPA-RESIST, NCT04860011). Ngoài ra, các chất ức chế SGLT2 đã đượcbáo cáo gần đây có liên quan với kết quả lâm sàng tổng thể tốt hơn đối với bệnh cảnh ST mạn có diễn tiến xấu trong thử nghiệm EMPULSE. Kết quả khả quan này trong ST cấp tính, trong đó sung huyết là một vấn đề chính, song song với kết quả được báo cáo của thử nghiệm SOLOIST -WHF, trong đó tỷ lệ có biến cố chính ở bệnh nhân được điều trị ngẫu nhiên với sotagliflozin thấp hơn 30% so với nhóm giả dược (HR 0,67; KTC 95% 0,52 – 0,85; p <0,001). Hiệu quả và độ an toàn của Dapagliflozin trong ST cấp tính sẽ được đánh giá thêm trong thử nghiệm DICTATE-AHF đang diễn ra. Đáng chú ý, các chất ức chế SGLT2 tỏ ra có hiệu quả ở bệnh nhân ST có PSTM bảo tồn: trong thử nghiệm EMPEROR-Preservedvà Deliver, tổng số lần nhập viện do ST được báo cáo ở nhóm dùng empagliflozin và dapagliflozin đã giảm đáng kể khoảng 27% (17, 18). Điều quan trọng là, tất cả những quan sát này đều có được từ việc theo dõi lâm sàng và theo dõi xét nghiệm sinh hoá cho phép điều chỉnh liều LT quai theo tình trạng của bệnh nhân và không có dữ liệu sẵn có nào tập trung vào việc sử dụng các chất ức chế SGLT2 cụ thể ở những bệnh nhân bị ST nặng có diễn tiến xấu, tuy nhiên tính an toàn/hiệu quả của chúng đối với những người bị sung huyết đang cho thấy kết quả đầy hứa hẹn.
II. XÁC ĐỊNH BỆNH NHÂN ĐỦ ĐIỀU KIỆN ĐỂ ĐIỀU TRỊ LỢI TIỂU TĨNH MẠCH
Việc xác định những bệnh nhân mắc ST mạn có diễn tiến xấu có nhiều khả năng được hưởng lợi hơn khi điều trị ngoại trú bằng thuốc LT đường tĩnh mạch vẫn chưa được ghi chép đầy đủ cho đến nay. Chúng tôi đề xuất một cách tiếp cận sử dụng thuốc LT tĩnh mạch trong cơ sở ngoại trú (Hình 3) cùng với các yếu tố được xem xét để lựa chọn bệnh nhân đủ tiêu chuẩn (Bảng 2) (5).
Bảng 2: Những yếu tố xem xét điều trị lợi tiểu tĩnh mạch ngoại trú
eGFR, độ lọc cầu thận ước tính; NYHA, Phân độ suy tim theo Hiệp hội Tim mạch New York; SaO2, độ bão hòa oxy máu động mạch.
- Các tình huống lâm sàng không phù hợp với chiến lược lợi tiểu tĩnh mạch ngoại trú
Những bệnh nhân bị ST nặng (tức là những bệnh nhân có PXTM thất trái giảm rõ rệt [LVEF] và NYHA ≥ III nên được điều trị tại bệnh viện, vì những bệnh nhân này thường cần yêu cầu làm rõ thêm chẩn đoán và tiên lượng bằng các kiểm tra, xét nghiệm thường được thực hiện tại bệnh viện cũng như đòi hỏi các biện pháp điều trị tích cực hơn.
Thứ hai, những bệnh nhân có dấu hiệu sốc/cung lượng tim thấp, mức độ bão hòa oxy thấp (độ bão hòa oxy ngoại vi <92%) và/hoặc các triệu chứng khi nghỉ ngơi (NYHA độ IV) cũng phải được điều trị tại bệnh viện. Những trường hợp này cần xác định các yếu tố khởi phát cụ thể và có khả năng gây tử vong của tình trạng xấu đi trên lâm sàng, ví dụ như rối loạn nhịp nhanh trên thất, thuyên tắc phổi hoặc hội chứng mạch vành cấp tính và cần được xử trí ngay tại bệnh viện. Tuy nhiên, chiến lược điều trị này không loại trừ việc xuất viện sớm với xử trí LT tĩnh mạch ngoại trú sau đó (19,20).
- Các tình huống lâm sàng có nhiều khả năng phù hợp với chương trình lợi tiểu tĩnh mạch ngoại trú
Các đợt ST mạn diễn tiến xấu rất phổ biến, và là nguyên nhân thường gặp nhất của nhập viện vì ST (65% trường hợp trong Khảo sát EuroHeart II – điều trị suy tim thất bại). Các triệu chứng và dấu hiện của sung huyết kháng trị, mặc dù đã sử dụng thuốc LT quai đường uống liều cao, là mối quan tâm lớn đối với bệnh nhân ST nặng. Thật vậy, những bệnh nhân này đại diện cho đối tượng mục tiêu chính của điều trị ngoại trú bằng thuốc LT tĩnh mạch, vì họ phải dành một lượng lớn thời gian trong bệnh viện, điều này làm giảm chất lượng cuộc sống và liên quan đến chi phí điều trị đáng kể. Các đối tượng cụ thể này tương ứng với dân số được nhóm Bệnh viện Brigham và Phụ nữ nhắm đến trong nghiên cứu về kinh nghiệm ban đầu sử dụng thuốc LT tĩnh mạch ngoại trú: hầu hết (80%) có các triệu chứng nhẹ – trung bình, với liều LT duy trì trung bình là 240mg furosemide đường uống.
Tương tự, cách tiếp cận này đã được đề xuất ở những bệnh nhân mắc chứng bệnh amyloidosis tim, nhóm bệnh nhân này cũng trải qua nhiều đợt ST mạn có diễn tiến xấu và chất lượng cuộc sống kém.
Nhóm thứ ba là ở những bệnh nhân được cấy thiết bị CardioMEMS, vì nó cho phép phát hiện sớm tình trạng tăng áp lực phổi, qua đó có khả năng điều chỉnh liều và chế độ LT tĩnh mạch đặc biệt hiệu quả (19,21,22).
Điều quan trọng là một số lượng lớn nhiều bệnh nhân cảm thấy bệnh chưa đủ nặng để yêu cầu nhập viện. Tuy nhiên, việc điều trị của họ chỉ dựa vào thuốc lợi tiểu đường uống là rất rắc rối và có thể không hiệu quả. Do đó, có một ‘vùng xám’ gồm những bệnh nhân quá “ốm” (ill) không thể quản lý bằng thuốc LT đường uống nhưng không đủ “ốm” để cần đến phòng cấp cứu. Trong các tình huống ‘vùng xám’ này, chiến lược LT tĩnh mạch ngoại trú tại địa phương có thể được chấp nhận và có hiệu quả để cải thiện tình trạng tắc nghẽn trước khi nó đạt đến ngưỡng nhập viện.
Trong mọi trường hợp, cần đánh giá cẩn thận đáp ứng lâm sàng đối với các đợt điều trị LT tĩnh mạch, thông qua một phác đồ quản lý bệnh tại địa phương chuyên dụng, có sự tham gia của một hoặc một số chuyên gia chăm sóc sức khỏe sau: y tá điều trị suy tim, y tá địa phương, bác sĩ đa khoa và bác sĩ tim mạch.
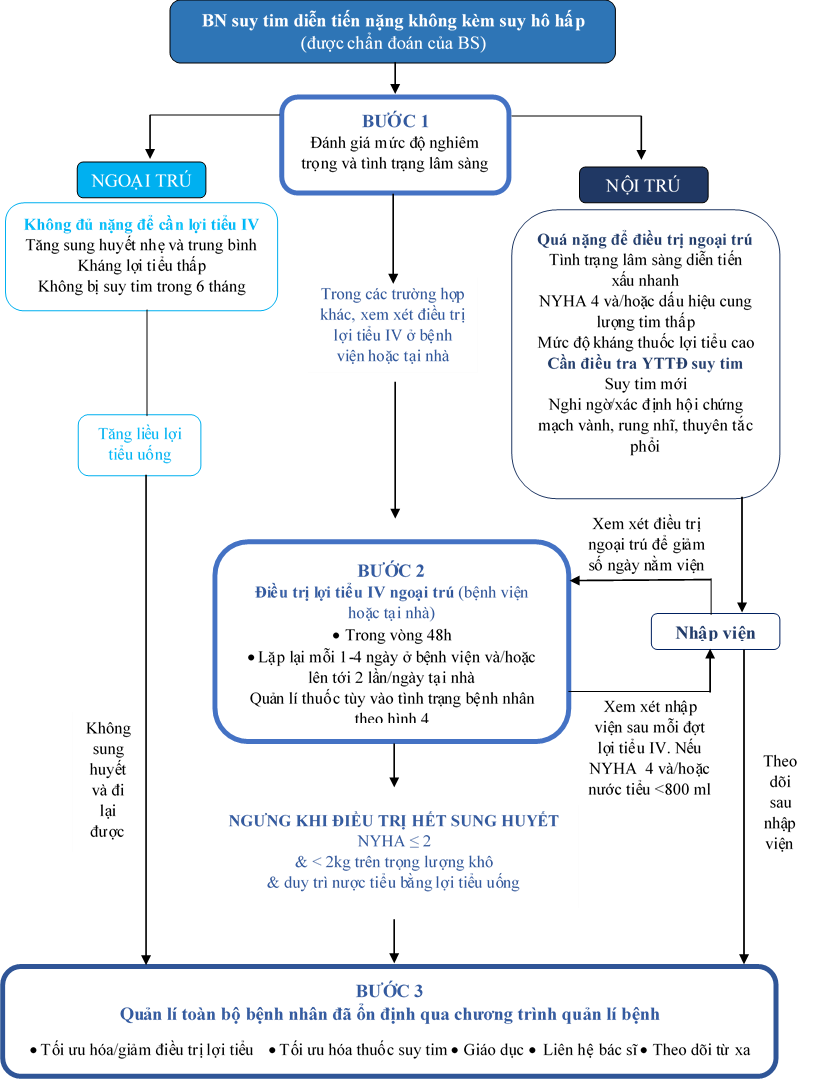
Hình 3: Sơ đồ sử dụng LT tĩnh mạch ngoại trú. NYHA: New York Heart Association: Hội tim New York. YTTĐ: yều tố thúc đẩy
III. THUỐC LỢI TIỂU TRONG CƠ SỞ CẤP CỨU – CÁCH TIẾN HÀNH?
Phác đồ được xuất bản bởi Buckley và cộng sự (được điều chỉnh trong Hình 4) đã được sử dụng cho hơn 250 bệnh nhân và tạo nền tảng tốt cho các chiến lược thực hiện. Một số tác giả đã sử dụng, và với một số điều chỉnh/sửa đổi cho phù hợp với điều kiện từng nơi, chúng tôi xin phép giới thiệu để các đồng nghiệp tham khảo (19,23).
Tóm lại, các bước điều trị LT bao gồm truyền thuốc LT tĩnh mạch trong 3 giờ, được thực hiện trong ngày hoặc điều trị ngày hôm sau. Phương pháp tiếp cận dược lý phụ thuộc vào liều LT duy trì: bệnh nhân có liều duy trì LT đường uống cao nhất sẽ nhận được thuốc LT tĩnh mạch cao nhất (và có thể dùng đồng thời với thuốc LT như thiazide). Nói chung, liều hydrochlorothiazide từ 12.5 đến 50mg/lần được sử dụng; metolazone 2.5 đến 5mg có thể có hiệu quả ở những người có mức lọc cầu thận ước tính < 30ml/phút/1.73m2. Ở những bệnh nhân này, cũng có thể tiêm metolazone hoặc chlorothiazide tĩnh mạch; tuy nhiên uống thiazide được ưa thích hơn. Nếu sử dụng, nên sử dụng thiazide đường uống 30 phút trước khi dùng thuốc LT quai tĩnh mạch. Ở các nước Âu, Mỹ, thiazide đôi khi được thay thế bằng lợi tiểu MRA tĩnh mạch liều cao. Ưu điểm chính của MRA trong trường hợp này là bù đắp các chuyển động cơ bản của kháng thuốc LT, tức là hạn chế tác dụng cường hệ RAAS – trái ngược hẳn với thiazide làm tăng thêm hoạt hóa RAAS (19). Tại Việt nam, chúng ta chỉ có thể sử dụng thuốc uống. Acetazolamide là một lựa chọn khác để xem xét trong phong tỏa nephron nhiều vị trí. Trong môi trường ‘bệnh viện tại nhà’, chỉ sử dụng thuốc LT quai tiêm tĩnh mạch một lần hoặc chia thành hai lần một ngày.
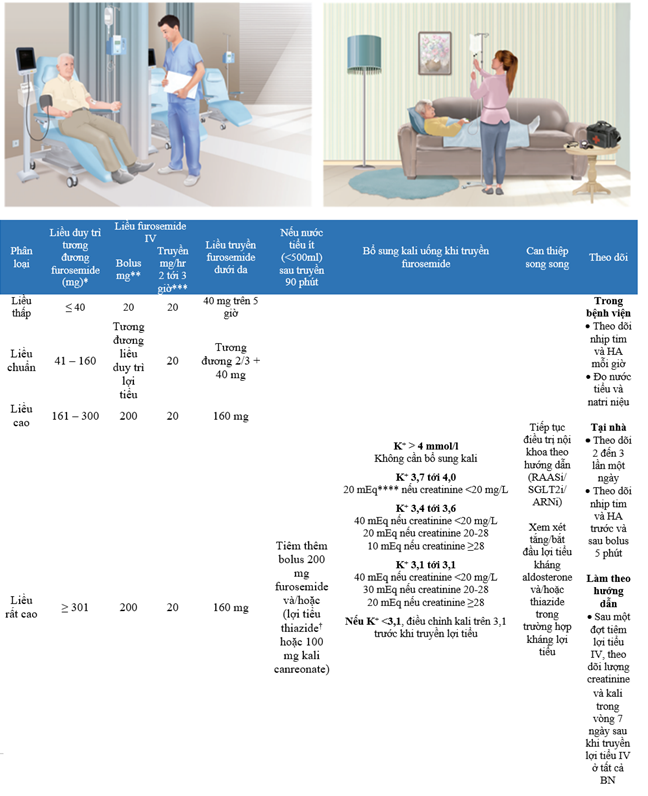
Hình 4: Giao thức dùng LT tĩnh mạch cho BN ngoại trú dựa trên liều duy trì lợi tiểu quai. Những liều trên chỉ là hướng dẫn chung cần phải điều chỉnh tùy theo chức năng thận. BN với eGFR <30 ml/phút/1,73m2 thường cần liều LT cao hơn (gấp đôi). Liều furosemide tĩnh mạch tùy thuộc vào liều duy trì LT tại nhà. Thuốc truyền được theo dõi trên 3 tiếng. Chỉ ở tình huống bệnh viện điều trị ban ngày mới có thể tiêm tĩnh mạch. * Tổng liều hằng ngày thể hiện bằng số miligram furosemide uống. ** Truyền bolus, xem xét chỉ định liều cao hơn cho BN có eGFR thấp. † Metolazone, 1,25 mg đến 10 mg. *** Thông thường khó có thể truyền thuốc tại nhà. **** 10 mEq tương đương với 400 mg ion kali và 760 mg kali chlorua.
Gần đây, dạng furosemide tiêm dưới da đã được phát triển. Các mũi tiêm dưới da này đặc biệt hữu ích trong các cơ sở tại nhà vì chúng chỉ đòi hỏi cung ứng đủ thuốc và không gây trở ngại/bất tiện cho việc tiêm tĩnh mạch nhiều lần (24).
Khi điều trị, cần xem xét cẩn thận tình trạng rối loạn kali máu sau khi dùng thuốc TM tĩnh mạch. Với phác đồ này, chỉ những bệnh nhân có lượng kali trước LT quai đường tĩnh mạch> 4 mEq/L (bất kể chức năng thận) hoặc bệnh nhân có K+> 3.7 nếu creatinin từ 2.0 mg/dl (175 μmol/L) trở lên sẽ không được bổ sung kali trong các đợt điều trị lợi tiểu tĩnh mạch (Hình 4). Những bệnh nhân có kali huyết thanh thấp có thể thêm MRA bất cứ khi nào có thể. Những bệnh nhân được điều trị bằng thuốc LT tĩnh mạch có thể phải tăng liều thuốc LT đường uống trong những tuần tiếp theo, điều này có thể làm giảm nồng độ kali huyết thanh hơn nữa.
Cần nhớ là không nên ngưng các thuốc điều trị suy tim theo hướng dẫn trong thời gian dùng LT tĩnh mạch này, trừ khi xảy ra hạ huyết áp có triệu chứng, vì như chúng ta đã biết, RAAS là động lực chính giúp giữ natri/nước.
Có ít dữ liệu đánh giá số ngày dùng thuốc LT tĩnh mạch tối ưu. Vì vậy, cần tiến hành tái khám rất sớm để bác sĩ điều trị đánh giá hiệu quả lâm sàng của các đợt tiêm truyền tĩnh mạch (lý tưởng là trong vòng 48 – 72 giờ). Nếu tình trạng sung huyết đáng kể vẫn tiếp diễn, bệnh nhân cần các đợt điều trị bổ sung. Trong hầu hết các trường hợp, nếu tình trạng lâm sàng xấu đi hoặc giảm hiệu quả lợi tiểu, nên gửi bệnh nhân nhập viện. Ngưỡng chung để ngừng sử dụng thuốc LT tĩnh mạch cấp cứu lặp đi lặp lại nêu trong hình 3, và bao gồm kết hợp đáp ứng lâm sàng, đánh giá khách quan và xét nghiệm (có thể bao gồm định lượng peptide natrilợi tiểu) (5).
IV. TỔ CHỨC Y TẾ NHƯ THẾ NÀO ĐỂ THỰC HIỆN THÀNH CÔNG THUỐC LỢI TIỂU TĨNH MẠCH NGOẠI TRÚ?
Bệnh viện tại nhà (Hospital at home)
“Bệnh viện tại nhà” hoặc “nhập viện tại nhà” có thể được sử dụng sau khi chăm sóc tại bệnh viện. Cách tiếp cận này có thể giúp giảm thời gian nằm viện, vì bệnh nhân sẽ được theo dõi chặt chẽ trong điều kiện tại nhà sau thời gian nhập viện ban đầu ngắn. Trong thời gian suy tim, ngoài việc sử dụng thuốc LT tĩnh mạch, có thể xác định các hành vi nguy cơ cao hạn chế hiệu quả chăm sóc ST (vì tại nhà là nơi chăm sóc).
Không phải tất cả bệnh nhân đều đủ điều kiện cho phương pháp tiếp cận này. Việc lựa chọn bệnh nhân bắt đầu bằng đánh giá độ tuổi và các yếu tố xã hội liên quan đến bệnh nhân, (các) nhân viên chăm sóc, bác sĩ chăm sóc và, nếu có, y tá và nhân viên xã hội. Bước thứ hai là xác định ai sẽ chịu trách nhiệm điều trị cho bệnh nhân- bác sĩ đa khoa hoặc bác sĩ tim mạch của bệnh nhân.
Theo kinh nghiệm của các tác giả, sự thành công của chiến lược này sau khi điều trị tại bệnh viện của bệnh nhân ST có diễn tiến xấu dựa vào đánh giá điều dưỡng hàng ngày (cân nặng, huyết áp, nhịp tim, đo oxy và các triệu chứng), xét nghiệm sinh hoá tại nhà và điện tâm đồ, truy cập từ xa vào tình trạng bệnh nhân trực tuyến, kê đơn từ xa được bảo đảm, trực điều dưỡng chặt chẽ, dịch vụ y tế theo cuộc gọi và quy trình tư vấn khẩn cấp hoặc nhập viện lại.
Hiệu quả của chiến lược đối với điều trị ST gần đây đã được xem xét một cách có hệ thống bởi Qaddoura và cộng sự. Kết luận của phân tích tổng hợp này là chỉ có một số lượng hạn chế (ba thử nghiệm với tổng số 203 bệnh nhân và ba nhóm thuần tập với tổng số 329 bệnh nhân) có chất lượng khiêm tốn, trong đó chăm sóc tại nhà dường như làm tăng thời gian giữa hai lần tái nhập viện, giảm chi phí điều trị, và cải thiện chất lượng cuộc sống. Mặc dù có những thử nghiệm sau này, các thử nghiệm lớn hơn như SAFE-HOME (NCT03156686) và FIL-EAS (NCT04878263) vẫn cần thiết để tích lũy bằng chứng xác thực (25-27).
Bệnh viện điều trị ban ngày (Day hospital)
Phần lớn kinh nghiệm lâm sàng đã được công bố về thuốc LT tĩnh mạch ngoại trú hiện có nguồn gốc từ cơ sở bệnh viện điều trị ban ngày. Địa điểm dành cho bệnh nhân ngoại trú này cho phép truyền thuốc lợi tiểu tĩnh mạch trong 3 giờ, điều này rõ ràng là không thể thực hiện được trong bối cảnh tham vấn, yêu cầu không gian và nguồn lực chuyên dụng. Cần có một y tá sẽ tận tâm theo dõi dịch truyền của bệnh nhân mỗi giờ, cũng như xác định lượng nước tiểu, và natri niệu, đồng thời thực hiện các xét nghiệm máu nếu cần. Trong môi trường bệnh viện ban ngày, nhờ sự theo dõi chặt chẽ của y tá, những bệnh nhân có lượng nước tiểu ít chúng ta nên phối hợp sớm thêm thiazide hoặc MRA trong nửa sau của đợt truyền dịch.
Vào cuối buổi điều trị, tình trạng của bệnh nhân được đánh giá lại để xác định liệu việc truyền tĩnh mạch có đủ hiệu quả để bệnh nhân xuất viện hay không và lập kế hoạch cho những lần truyền tiếp theo. Thông thường, cần 2-3 lần truyền trong tuần đầu tiên điều trị ST có diễn tiến xấu để giải quyết sung huyết và cải thiện tình trạng lâm sàng. Ở những trường hợp nghiêm trọng hơn, có thể cần phải truyền liên tục thuốc LT tĩnh mạch trong 6 giờ, điều này sẽ được bệnh nhân cảm nhận ít tiêu cực hơn nhiều so với việc nhập viện thông thường phải nằm viện qua đêm. Trong những ngày tiếp theo, theo dõi từ xa ngắn hạn sẽ hữu ích để xác minh tác động thuận lợi của chiến lược LT liều tấn công. Xét nghiệm BNP lặp lại cũng có thể hữu ích để theo dõi tình trạng sung huyết.
Cơ sở bệnh viện ban ngày còn có các lợi ích bổ sung khác. Ví dụ, nó có thể ủng hộ phương pháp tiếp cận đa ngành và trong quá trình quản lý tại bệnh viện ban ngày, bệnh nhân có thể được chăm sóc bởi các y tá giáo dục trị liệu, chuyên gia dinh dưỡng và các chuyên gia chăm sóc sức khỏe khác để được tư vấn thêm và đánh giá lại nhằm ngăn ngừa các đợt sung huyết tiếp theo.
Để được sử dụng một cách hiệu quả, như trong trường hợp nhập viện tại nhà, cơ sở này phải dễ dàng tiếp cận với những bệnh nhân đủ điều kiện. Thông thường, các buổi điều trị trong ngày tại bệnh viện nên được thực hiện trong vòng 24 đến 48 giờ kể từ khi xác định được ST diễn tiến xấu mức độ trung bình trong quá trình tư vấn tại phòng khám suy tim, trong các chương trình quản lý bệnh hoặc theo dõi tại nhà. Để tối đa hóa hiệu quả, cần tối ưu hoá liên kết phối hợp giữa bệnh viện ban ngày và các cơ sở khác, có thể được bao gồm trong cùng một tổ chức/mạng lưới lớn. Sự tích hợp này là rất quan trọng vì cần theo dõi chặt chẽ sau khi truyềntĩnh mạch để xác định xem có cần thực hiện thêm các phiên điều trị khác hay không. Vì với ST diễn tiến xấu ‘cổ điển’ cần yêu cầu nhập viện, nên các đợt sung huyết có xu hướng tái phát. Những lần tái phát này cần được quản lý nhanh chóng trong các phiên điều trị bổ sung trong ngày tại bệnh viện, trong một mạng lưới chăm sóc sức khỏe có tổ chức (5,19).
V. XỬ TRÍ SAU KHI ĐIỀU TRỊ BẰNG THUỐC LỢI TIỂU TĨNH MẠCH NGOẠI TRÚ
1. Tối ưu hóa điều trị ST có PSTM giảm
Điều trị nội khoa được coi là điều trị nền tảng đối với tất cả các bệnh nhân suy tim PSTM giảm và cần phải được tối ưu hóa trước khi xuất viện hay sau mỗi đợt mất bù. Tác động trên hệ thống Renin-angiotensin-aldosterone (RAAS) và hệ thống thần kinh thể dịch khác bằng các thuốc ức chế men chuyển (ACE-I) hoặc ức chế thụ thể neprilysin angiotensin (ARNI), chẹn beta giao cảm và thuốc đối kháng aldosterone (MRA) giúp giảm tử vong, giảm nguy cơ nhập viện vì suy tim, giảm triệu chứng suy tim ở người bệnh suy tim có PSTM giảm. Những nhóm thuốc này được coi là nền tảng trong điều trị nội khoa, với sự phối hợp giữa 3 nhóm ACE-I hoặc ARNI với chẹn beta giao cảm và MRA được khuyến cáo, trừ những trường hợp có chống chỉ định hoặc bệnh nhân không dung nạp được thuốc. Trong thực hành lâm sàng, bác sĩ lâm sàng cần điều chỉnh liều các nhóm thuốc này tới liều thuốc tối đa mà bệnh nhân có thể dung nạp được. Trong khuyến cáo mới nhất hiện nay, ARNI được ưu tiên hơn ACE-I đặc biệt ở những trường hợp đã sử dụng ACE-I, chẹn beta giao cảm và MRA nhưng vẫn còn triệu chứng. Tuy nhiên, ARNI hoàn toàn có thể được chỉ định khởi trị suy tim thay thế vị trí của nhóm ACE-I. Nhóm thuốc ức chế thụ thể Angiotensin (ARB) vẫn đóng một vai trò nhất định trong những trường hợp người bệnh không dung nạp được với ACEI hoặc ARNI.
Nhóm thuốc ức chế kênh đồng vận chuyển Natri-glucose tại ống thận (SGLT2) nên có tác dụng giảm tái hấp thu/tăng thải glucose và natri. Hai thuốc trong nhóm này là Dapagliflozin hoặc Empagliflozin được khuyến cáo đưa vào điều trị nền tảng suy tim PSTM giảm cùng với các nhóm ACE-I/ARNI/chẹn beta giao cảm/MRA nhằm làm giảm tỉ lệ tử vong do tim mạch và giảm nguy cơ suy tim mất bù. Trừ trường hợp có chống chỉ định hoặc bệnh nhân không thể dung nạp, Dapagliflozin hoặc Empagliflozin nên được chỉ định cho tất cả người bệnh suy tim PXTM giảm, kết hợp cùng các nhóm thuốc ACE-I/ARNI/chẹn beta giao cảm và MRA, bất kể có kèm theo tình trạng đái tháo đường hay không (hình 5) (28,29).
Trong tháng đầu tiên sau khi dùng thuốc lợi tiểu tĩnh mạch, các bác sĩ hoặc y tá điều trị ST đánh giá hàng tuần để điều chỉnh liều thuốc LT và tối ưu hóa /điều chỉnh phác đồ điều trị.
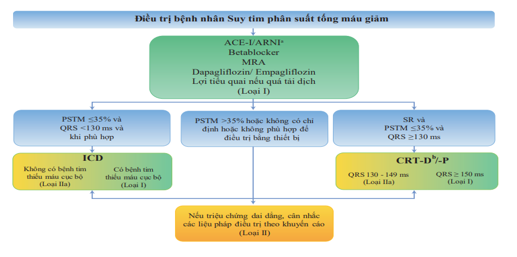
Hình 5. Quy trình điều trị suy tim phân suất tống máu giảm (28).
a: Thay thế cho ACE-I; b: Khi phù hợp
2. Tối ưu hoá điều trị ST có PSTM bảo tồn và ST có PSTM giảm nhẹ
Điều quan trọng là bệnh nhân ST PSTM bảo tồn và PSTM giảm bị ảnh hưởng tương tự bởi các đợt ST diễn tiến xấu và các chiến lược LT trong các phòng khám cấp cứu dường như có lợi ích tương tự đối với cả hai nhóm bệnh nhân. Tối ưu hóa y tế được khuyến khích cho bệnh nhân ST PSTM bảo tồn (LVEF ≥50%) hoặc ST với PSTM giảm nhẹ (LVEF 41% – 49%) sau khi bị sung huyết. Khởi trị hoặc tăng liều MRA trong bệnh cảnh này có thể có kết quả tốt hơn và nên được xem xét ở bệnh nhân ST PSTM bảo tồn. Trong nghiên cứu PARAGON-HF, sử dụng sacubitril/valsartan cho bệnh nhân LVEF ≥45% có liên quan đến việc giảm số lần nhập viện do ST ở bệnh nhân LVEF <55% và phụ nữ.Trong thử nghiệm EMPEROR-Preserved, empagliflozin làm giảm 27% số lần nhập viện do ST (p <0,001) ở những bệnh nhân có LVEF> 40% (19,30).
3. Làm thế nào để giảm liều thuốc lợi tiểu sau khi tăng tạm thời trong thời gian bệnh nhân điều trị ngoại trú?
Mặc dù đã biết tầm quan trọng của thuốc LT quai trong quản lý ST và các tác dụng ngoại ý liên quan, nhưng chúng ta rất ít nỗ lực tập trung vào việc “tối ưu hóa” thuốc LT. Một số công cụ có thể giúp tối ưu hóa điều trị LT, bao gồm theo dõi peptide bài niệu natri, theo dõi từ xa áp lực động mạch phổi, hình ảnh siêu âm của tĩnh mạch chủ dưới, nhưng trong thực hành thường quy, đánh giá lâm sàng đơn thuần được sử dụng trong đại đa số các trường hợp. Bước đầu tiên phải xác định xem liều trước đó có được coi là đúng hay không hay liệu có cần phải dùng liều cao hơn hay không. Nếu liều trước đó không ngăn ngừa được ST diễn tiến xấu, nên duy trì LT liều cao hơn trong ít nhất 3–4 tuần. Tăng cường điều trị theo khuyến cáo cuối cùng sẽ giúp hạ liều của thuốc LT quai (22,31).
VI. CÁC RÀO CẢN ĐỐI VỚI VIỆC THỰC HIỆN CÁC TỔ CHỨC CHĂM SÓC SỨC KHỎE NÀY
Có một số rào cản hiện có cần vượt qua khi áp dụng các lộ trình quản lý bệnh nhân mới này:
(1) Bằng chứng thử nghiệm lâm sàng hạn chế (mặc dù được sử dụng nhiều hơn trong các nghiên cứu quan sát) để ghi lại hiệu quả hoặc tính tương đương của các phương pháp điều trị thay thế này.
(2) Xác nhận thêm các quy trình sử dụng thuốc LT và các thuốc liên quan: xác nhận liều lượng, tiếp cận đường tĩnh mạch, tính chu kỳ, theo dõi lâm sàng và xét nghiệm sinh hoá máu.
- (3) Sự chứng thực chính thức của các nhà cung cấp bảo hiểm chăm sóc sức khỏe: những lộ trình này cần được tài trợ (và có thể được thúc đẩy) bởi khu vực bảo hiểm y tế.
(4) Cách tiếp cận chính thức đối với trách nhiệm y tế. Trong môi trường ngoại trú, việc xác định ai là bác sĩ chịu trách nhiệm quản lý bệnh nhân có thể không đơn giản hơn so với môi trường nội trú.
(5) Quy trình chính thức hóa 24/7 để quản lý ‘cấp cứu’ bởi các bộ phận khẩn cấp.
(6) Truyền và trao đổi dữ liệu sức khỏe giữa các nhà cung cấp dịch vụ chăm sóc sức khỏe khác nhau.
Hạn chế chính của việc triển khai phương pháp được đề xuất ở đây có thể là sự tích hợp thực tế của nó trong môi trường chăm sóc sức khỏe tức thì của bệnh nhân. Chăm sóc cấp cứu có thể không thực hiện được hoặc không thực tế nếu mạng lưới y tế địa phương không đủ tin cậy hoặc không đủ điều kiện để thực hiện việc quản lý như vậy. Các yêu cầu tối thiểu để thực hiện quản lý điều trị đường tĩnh mạch ngoại trú có thể bao gồm: (1) bác sĩ lâm sàng có sẵn để đánh giá lại lâm sàng, điều chỉnh điều trị và phân loại đối với việc nhập viện hoặc thăm khám khẩn cấp tại các phòng khám ST, (2) y tá có sẵn tại nhà để lấy mẫu / xét nghiệm máu, lâm sàng đánh giá (cân nặng, dấu hiệu sinh tồn), (3) hỗ trợ xã hội (chẳng hạn như bữa ăn tại nhà), và (4) sự liên kết trực tiếp của các chuyên gia này với nhóm suy tim tận tâm.Tất cả phải được kết nối hiệu quả thông qua một khuôn khổ phối hợp chăm sóc sức khỏe, lý tưởng là luôn sẵn sàng 24/7, nhưng thực tế hơn là hoạt động trong giờ bình thường. Quan trọng là, một số vấn đề này có thể được giảm bớt bằng cách theo dõi từ xa, ví dụ: để biết những thay đổi về cân nặng hoặc các triệu chứng, và trao quyền cho bệnh nhân.
VII. KẾT LUẬN
Áp lực gia tăng đối với các hệ thống chăm sóc sức khỏe sẽ ngăn cản việc tiếp tục điều trị tất cả các đợt ST diễn tiến xấu với thời gian nhập viện kéo dài. Do đó, cả bệnh nhân và nhà cung cấp dịch vụ chăm sóc sức khỏe đều có lợi ích chung là ủng hộ các phương pháp điều trị ngoại trú cung cấp thuốc LT qua đường tĩnh mạch để cải thiện tình trạng sung huyết và chất lượng cuộc sống, đồng thời tiết kiệm chi phí và nguồn lực. Các thử nghiệm trong tương lai sẽ làm rõ tính an toàn và hiệu quả của các mô hình chăm sóc này và xác định bệnh nhân có nhiều khả năng đạt được lợi ích hơn. Có khả năng việc cung cấp thuốc LT qua đường tĩnh mạch ngoại trú sẽ sớm không còn là một lựa chọn, mà là một tiêu chuẩn mới.
TÀI LIỆU THAM KHẢO
- Véronique L. Roger. Epidemiology of Heart Failure. Circulation Research Volume 128, Issue 10, 14 May 2021; Pages 1421-1434
- Harjola VP, Mullens W, Banaszewski M, Bauersachs J, Brunner-La Rocca HP, Chioncel O, et al. Organ dysfunction, injury and failure in acute heart failure: from pathophysiology to diagnosis and management. A review on behalf of the Acute Heart Failure Committee of the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur J Heart Fail. 2017;19:821–36.
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, Coats AJ, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2016;18:891–975
- Maggioni AP, Dahlstrom U, Filippatos G, Chioncel O, Crespo Leiro M, Drozdz J, et al. EURObservational research Programme: regional differences and 1-year follow-up results of the Heart Failure Pilot survey (ESC-HF pilot). Eur J Heart Fail. 2013;15:808–17
- N et al. Practical outpatient management of worsening chronic heart failure. European Journal of Heart Failure (2022) 24, 750–761.
- Wierda E, Dickhoff C, Handoko ML, Oosterom L, Kok WE, Rover Y, et al. Outpatient treatment of worsening heart failure with intravenous and subcutaneous diuretics: a systematic review of the literature. ESC Heart Fail. 2020;7:892–902
- Mullens W, Damman K, Harjola VP, Mebazaa A, Brunner-La Rocca HP, Martens P, et al. The use of diuretics in heart failure with congestion – a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2019;21: 137–55.
- Felker GM, Ellison DH, Mullens W, Cox ZL, Testani JM. Diuretic therapy for patients with heart failure: JACC state-of-the-art review. J Am Coll Cardiol. 2020; 75: 1178–95.
- Biegus J, Zymlinski R, Testani J, Marciniak D, Zdanowicz A, Jankowska EA, et al. Renal profiling based on estimated glomerular filtration rate and spot urine sodium identifies high-risk acute heart failure patients. Eur J Heart Fail. 2021; 23: 729–39.
- Pellicori P, Platz E, Dauw J, Maaten JM, Martens P, Pivetta E, et al. Ultrasound imaging of congestion in heart failure: examinations beyond the heart. Eur J Heart Fail. 2021;23:703–12
- Nguyễn Thanh Hiền và CS: Chiến lược lợi tiểu trong suy tim. In “NHỮNG VẤN ĐỀ TIM MẠCH QUAN TRỌNG TRONG THỰC HÀNH LÂM SÀNG”. 2022 NXB Y HOC: 264-280.
- Madelaire C, Gustafsson F, Stevenson LW, Kristensen SL, Køber L, Andersen J, et al. One-year mortality after intensification of outpatient diuretic therapy. J Am Heart Assoc. 2020;9:e016010
- Ferreira JP, Eschalier R, Duarte K, Damman K, Gustafsson F, Schou M, et al. Reduced diuretic dose in patients treated with eplerenone: data from the EPHESUS trial. Circ Heart Fail. 2020;13:e006597.
- Vardeny O, Claggett B, Kachadourian J, Desai AS, Packer M, Rouleau J, et al. Reduced loop diuretic use in patients taking sacubitril/valsartan compared with enalapril: the PARADIGM-HF trial. Eur J Heart Fail. 2019;21:337–41
- Velazquez EJ, Morrow DA, DeVore AD, Duffy CI, Ambrosy AP, McCague K, et al. PIONEER-HF Investigators. Angiotensin-neprilysin inhibition in acute decompensated heart failure. N Engl J Med. 2019;380:539–48
- Desai AS, Heywood JT, Rathman L, Abraham WT, Adamson P, Brett ME, et al. Early reduction in ambulatory pulmonary artery pressures after initiation of sacubitril/valsartan. Circ Heart Fail. 2021; 14:e008212.
- Nguyễn thanh Hiền, Nguyễn Trần Thu Thủy: THUỐC ỨC CHẾ SGLT2: TRỤ CỘT MỚI TRONG PHÁC ĐỒ ĐIỀU TRỊ SUY TIM. Chuyên đề tim mạch học. tháng 7/2022
- SD et al: Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction (DELIVER Trial). 2022. DOI: 10.1056/NEJMoa2206286
- Buckley LF, Carter DM, Matta L, Cheng JW, Stevens C, Belenkiy RM, et al. Intravenous diuretic therapy for the management of heart failure and volume overload in a multidisciplinary outpatient unit. JACC Heart Fail. 2016; 4: 1–8.
- Greene SJ, Mentz RJ, Felker GM. Outpatient worsening heart failure as a target for therapy: a review. JAMA Cardiol. 2018; 3: 252–9.
- Vaishnav J, Hubbard A, Chasler JE, Lepley D, Cuomo K, Riley S, et al. Management of heart failure in cardiac amyloidosis using an ambulatory diuresis clinic. Am Heart J. 2021; 233: 122–31.
- Abraham WT, Adamson PB, Bourge RC, Aaron MF, Costanzo MR, Stevenson LW, et al.; CHAMPION Trial Study Group. Wireless pulmonary artery haemodynamic monitoring in chronic heart failure: a randomised controlled trial. Lancet. 2011; 377: 658–66.
- Pacho C, Domingo M, Nunez R, Lupón J, Moliner P, de Antonio M, et al. Early postdischarge STOP-HF-Clinic reduces 30-day readmissions in old and frail patients with heart failure. Rev Esp Cardiol (Engl Ed). 2017; 70: 631–8.
- Sica DA, Muntendam P, Myers RL, ter Maaten JM, Sale ME, de Boer RA, et al. Subcutaneous furosemide in heart failure: pharmacokinetic characteristics of a newly buffered solution. JACC Basic Transl Sci. 2018;3:25–34
- Mendoza H, Martin MJ, Garcia A, Aros F, Aizpuru F, Regalado De Los Cobos J, et al. ‘Hospital at home’ care model as an effective alternative in the management of decompensated chronic heart failure. Eur J Heart Fail. 2009;11: 1208–13
- Van Spall HGC, Rahman T, Mytton O, Ramasundarahettige C, Ibrahim Q, Kabali C, et al. Comparative effectiveness of transitional care services in patients discharged from the hospital with heart failure: a systematic review and network meta-analysis. Eur J Heart Fail. 2017;19:1427–43.
- Qaddoura A, Yazdan-Ashoori P, Kabali C, Thabane L, Haynes RB, Connolly SJ, et al. Efficacy of hospital at home in patients with heart failure: a systematic review and meta-analysis. PLoS One. 2015; 10: e0129282.
- KHUYẾN CÁO CỦA HỘI TIM MẠCH QUỐC GIA VỀ CHẨN ĐOÁN VÀ ĐIỀU TRỊ SUY TIM CẤP VÀ SUY TIM MẠN (2022)
- 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure
- Vaduganathan M, Cunningham JW, Claggett BL, Causland FM, Barkoudah E, Finn P, et al. Worsening heart failure episodes outside a hospital setting in heart failure with preserved ejection fraction: the PARAGON-HF trial. JACC Heart Fail. 2021; 9:374–82.
Pruett AE, Lee AK, Patterson JH, Schwartz TA, Glotzer JM, Adams KF Jr. Evolution of biomarker guided therapy for heart failure: current concepts and trial evidence. Curr Cardiol Rev. 2015; 11:80–9.







