BS. TRẦN ĐĂNG KHƯƠNG*
BS. NGUYỄN THANH HIỀN
*Khoa Nội Tim mạch, Bệnh viện Đại học Y Dược TP.HCM
Đánh giá nguy cơ ở bệnh nhân rung nhĩ là một phần quan trọng trong thực hành lâm sàng hằng ngày. Vì vậy, việc hiểu rõ các bằng chứng và hướng dẫn hiện tại là rất quan trọng để đưa ra chiến lược điều trị tối ưu ở những bệnh nhân này. Rung nhĩ là rối loạn nhịp tim mạn tính thường gặp nhất. Chúng ta đã biết rung nhĩ làm tăng nguy cơ đột quỵ, vì vậy trong điều trị rung nhĩ toàn diện cần phải có phần đánh giá nguy cơ đột quỵ một cách kỹ càng và chính xác. Những bệnh nhân không nằm trong nhóm nguy cơ thấp cần được sử dụng kháng đông để lảm giảm nguy cơ đột quỵ. Tuy nhiên, việc sử dụng kháng đông lại làm tăng nguy cơ xuất huyết. Đa số những biến cố xuất huyết thường là do đa cơ chế và một vài trường hợp có thể đem lại hậu quả nghiêm trọng. Do vậy, cần phải cân nhắc kỹ lưỡng và điều trị tốt các yếu tố nguy cơ thay đổi được trước khi sử dụng kháng đông cho bệnh nhân.
Nhìn chung, việc đánh giá nguy cơ đột quỵ và xuất huyết càng ngày càng phức tạp do sự xuất hiện không ngừng của các bằng chứng mới. Điều này thách thức các bác sĩ lâm sàng cần phải cập nhật liên tục các bằng chứng mới và cân nhắc sự tương tác lẫn nhau giữa các yếu tố nguy cơ. Bài tổng quan hệ thống này không thể trình bày hết lượng bằng chứng khổng lồ về rung nhĩ. Mục đích của chúng tôi là bàn luận những khái niệm mới và những bàn cãi xoay quanh những bằng chứng hiện tại của các yếu tố nguy cơ liên quan đến đột quỵ và xuất huyết.
ĐÁNH GIÁ NGUY CƠ ĐỘT QUỴ
Nói chung, rung nhĩ làm tăng tỉ lệ đột quỵ lên gấp 5 lần và kết cục của đột quỵ thường nặng nề hơn ở những bệnh nhân có rung nhĩ cả về lâm sàng và hình ảnh học. Nhiều yếu tố về mặt lâm sàng, điện học, sinh học và di truyền đã cho thấy có thể dự báo được nguy cơ đột quỵ ở bệnh nhân có rung nhĩ.
Tại thời điểm hiện tại, đa số các hướng dẫn lâm sàng đều khuyến cáo sử dụng thang điểm CHA2DS2-VASc để quyết định việc sử dụng kháng đông ở bệnh nhân rung nhĩ (bảng 1). Công cụ này xuất hiện vào năm 2006 và đã được cải tiến chủ yếu tập trung vào việc nhận ra được nhóm có nguy cơ thấp và thang điểm này đã được kiểm duyệt qua nhiều nghiên cứu đoàn hệ về rung nhĩ[9]. Nói chung, điểm càng cao thì nguy cơ đột quỵ hằng năm càng cao. Bệnh nhân có nguy cơ thấp được định nghĩa là 1 điểm đối với nữ giới và 0 điểm đối với nam, tỉ lệ đột quỵ ở nhóm này là <1% mỗi năm. Những hướng dẫn hiện tại khuyến cáo nên sử dụng kháng đông ở những bệnh nhân còn lại, đây là nhóm cho thấy lợi ích từ việc dự phòng đột quỵ vượt trội so với những nguy cơ do kháng đông gây ra.
Những nghiên cứu cũ cho thấy tình trạng “rung nhĩ đơn độc” có nguy cơ đột quỵ hằng năm khoảng 1%. Tuy nhiên những nghiên cứu mới hơn cho rằng tỉ lệ đột quỵ ở những bệnh nhân nguy cơ thấp này là < 1% mỗi năm, những bệnh nhân nguy cơ thấp được định nghĩa là < 65 tuổi và không có bất kỳ yếu tố nguy cơ đột quỵ nào[28]
Bảng 1: Thang điểm CHA2DS2-VASc [20]
| Thang điểm CHA2DS2-VASc:
các yếu tố nguy cơ và định nghĩa từng yếu tố |
Điểm | Những lưu ý | |
| C | Suy tim sung huyết:
Dấu hiệu suy tim trên lâm sàng, hoặc các bằng chứng khách quan giảm chức năng thất trái trung bình đến nặng, bệnh cơ tim phì đại |
1 | Suy tim mất bù gần đây bất kể phân suất tống máu thất trái (nghĩa là bao gồm suy tim phân suất tống máu giảm và bảo tồn), hoặc có bằng chứng giảm trung bình đến nặng chức năng tâm thu thất trái trên phương tiện hình ảnh học tim mạch; bệnh cơ tim phì đại là yếu tố nguy cơ cao của đột quỵ và OAC có lợi để ngừa đột quỵ trong trường hợp này. |
| H | Tăng huyết áp:
Hoặc đang điều trị tăng huyết áp |
1 | Tiền căn tăng huyết áp gây ra những thay đổi về mạch máu dễ xuất hiện đột quỵ, huyết áp kiểm soát tốt hôm nay chưa chắc đã được kiểm soát tốt trước đó. Huyết áp tối ưu để làm giảm thấp nhấp nguy cơ đột quỵ thiếu máu, tử vong và các biến cố tim mạch khác là 120 – 129/ < 80 mmHg |
| A | Tuổi ³ 75 | 2 | Tuổi là một yếu tố nguy cơ mạnh của đột quỵ, các nghiên cứu cho thấy nguy cơ tăng nhanh từ sau 65 tuổi, mối quan hệ giữa tuổi và nguy cơ đột quỵ là một đường tăng liên tục, tuy nhiên để đơn giản hóa, trong thực hành lâm sàng từ 65 – 74 tuổi được cho 1 điểm, ³ 75 tuổi được cho 2 điểm. |
| D | Đái tháo đường
Đang điều trị thuốc uống hoặc insulin hoặc đường huyết đói > 125 mg/dl (7 mmol/l) |
1 | Tiểu đường đã được xác định là yếu tố nguy cơ đột quỵ, gần đây người ta nhận thấy rằng thời gian bị đái tháo đường cũng có liên quan với nguy cơ đột quỵ (đái tháo đường càng lâu năm, nguy cơ đột quỵ và huyết khối hệ thống càng cao), tổn thương cơ quan đích cũng có liên quan với nguy cơ đột quỵ. Cả đái tháo đường type 1 và 2 đều có nguy cơ thuyên tắc huyết khối như nhau, tuy nhiên ở bệnh nhân < 65 tuổi, nguy cơ có vẻ cao hơn ở nhóm đái tháo đường type 2 |
| S | Đột quỵ
Tiền căn đột quỵ, thoáng thiếu máu não hoặc huyết khối hệ thống |
2 | Tiền căn đột quỵ, huyết khối hệ thống và thiếu máu não thoáng qua làm tăng tỉ lệ đột quỵ thiếu máu đáng kể nên được cho 2 điểm. Mặc dù đa số bị loại khỏi các nghiên cứu RCT, bệnh nhân rung nhĩ có xuất huyết nội sọ (kể cả xuất huyết não) có nguy cơ rất cao bị đột quỵ thiếu máu sau này, những nghiên cứu quan sát gần đây cho thấy những bệnh nhân này vẫn có lợi ích khi được sử dụng kháng đông. |
| V | Bệnh mạch máu
Chụp mạch vành hẹp đáng kể, tiền căn nhồi máu cơ tim, bệnh mạch máu chi dưới, mảng xơ vữa động mạch chủ |
1 | Bệnh mạch máu (PAD hoặc nhồi máu cơ tim) làm tăng 17 – 22 % nguy cơ, đặc biệt nhóm dân số châu Á. Chụp mạch vành hẹp đáng kể cũng là yếu tố nguy cơ độc lập của đột quỵ thiếu máu ở bệnh nhân rung nhĩ. Mảng xơ vữa phức tạp ở động mạch chủ xuống là dấu hiệu của bệnh mạch máu nặng và cũng là yếu tố dự đoán đột quỵ thiếu máu |
| A | Tuổi từ 65 – 74 | 1 | Đã được trình bày ở trên, những dữ liệu ở châu Á cho thấy nguy cơ đột quỵ bắt đầu tăng từ 50 – 55 tuổi trở lên và chúng ta nên dùng thang điểm CHA2DS2-VASc có hiệu chỉnh về tuổi cho dân số châu Á |
| Sc | Giới tính | 1 | Đây là yếu tố hiệu chỉnh hơn là một yếu tố nguy cơ |
- Những yếu tố nguy cơ lâm sàng.
Rung nhĩ là một bệnh do đa nguyên nhân và thường xảy ra kèm với nhiều bệnh đồng mắc khác. Những bệnh đồng mắc này là những yếu tố nguy cơ xuất hiện rung nhĩ và có thể làm nặng nề hơn những biến chứng của rung nhĩ. Phân tích gộp từ 5 nghiên cứu RCT đã cho thấy tiền căn đột quỵ, cơn thiếu máu não thoáng qua (TIA), tuổi cao, tăng huyết áp, đái tháo đường và suy tim sung huyết là những yếu tố nguy cơ độc lập dự báo đột quỵ ở bệnh nhân rung nhĩ[40]. Tiền căn đột quỵ hoặc thiếu máu não thoáng qua là yếu tố dự báo đột quỵ mạnh nhất, với nguy cơ xuất hiện đột quỵ mỗi năm >5%. Tuổi thọ càng tăng (theo mỗi thập kỷ), tăng huyết áp và đái tháo đường làm tăng nguy cơ đột quỵ từ 1.5 – 2 lần. Trong nghiên cứu của tác giả Olesen và cộng sự đã cho thấy rằng suy tim, tiền căn đột quỵ và bệnh mạch máu là những yếu tố dự báo độc lập của đột quỵ và huyết khối hệ thống ở bệnh nhân rung nhĩ dưới 65 tuổi[33]. Một nghiên cứu tiến cứu ở Thụy Sỹ đã tìm ra bệnh mạch máu ngoại biên, nhồi máu cơ tim cũ, giới nữ, tiền căn huyết khối, xuất huyết não, tăng huyết áp, đái tháo đường làm tăng nguy cơ huyết khối hệ thống[9]. Những tình trạng bệnh được nhắc đến ở trên làm tăng nguy cơ đột quỵ thông qua nhiều cơ chế khác nhau, trong đó có một phần là làm thúc đẩy quá trình tái cấu trúc nhĩ trái. Ngoài ra cũng có thể do những bệnh này vốn có sinh lý bệnh là quá trình tăng đông.
Một nghiên cứu ở Đan Mạch trên 239 671 bệnh nhân cho thấy nữ giới có tỉ lệ đột quỵ và huyết khối hệ thống cao hơn nam giới[30]. Tuy nhiên khi phân tích sâu hơn người ta nhận thấy rằng đối với điểm CHA2DS2-VASc 0 và 3 điểm, nguy cơ đột quỵ là không khác nhau ở hai giới, ở thang điểm CHA2DS2-VASc cao hơn thì sự khác biệt bắt đầu xuất hiện. Nghiên cứu kết luận rằng giới nữ làm tăng nguy cơ đột quỵ chỉ khi nào kèm thêm ³ 2 yếu tố nguy cơ không liên quan đến giới tính. Vì vậy, mặc dù giới nữ vẫn được xem là một yếu tố quan trọng trong đánh giá nguy cơ đột quỵ ở bệnh nhân rung nhĩ, chúng ta nên hiểu rằng một mình giới nữ không quyết định việc sử dụng kháng đông, chỉ nên xem đó như một yếu tố hiệu chỉnh và phải phối hợp thêm với nhiều yếu tố khác. Chính vì vậy trong guideline của ESC, ngưỡng CHA2DS2-VASc chỉ định kháng đông của giới nữ lớn hơn nam giới một điểm.
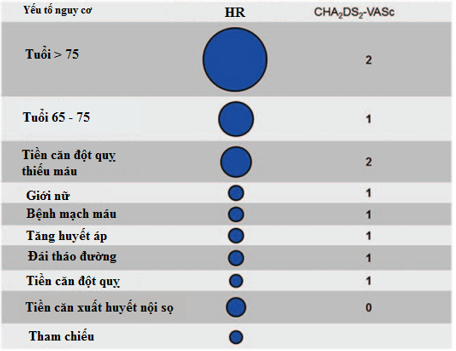
Hình 1: Nguy cơ đột quỵ của từng yếu tố trong thang điểm CHA2DS2-VASc [21]
Một điều quan trọng chúng ta nên để ý rằng mỗi một yếu tố trong thang điểm CHA2DS2-VASc có nguy cơ đột quỵ khác nhau mặc dù chúng có bằng điểm nhau đi chăng nữa. Hay nói cách khác, để ước tính nguy cơ đột quỵ, chúng ta không nên chỉ nhìn vào điểm số CHA2DS2-VASc, mà còn phải xét đến các thành phần tạo nên số điểm đó. Bảng trên cho chúng ta thấy tuy có cùng một số điểm, nhưng nguy cơ đột quỵ của mỗi yếu tố là hoàn toàn khác nhau (Hình 1)
- Những yếu tố nguy cơ về mặt điện học.
Nhiều chỉ dấu điện học có khả năng dự báo kết cục đột quỵ. Ảnh hưởng của loại rung nhĩ lên nguy cơ đột quỵ còn nhiều tranh cãi, các nghiên cứu trước đây cho thấy rung nhĩ kịch phát và vĩnh viễn đều có nguy cơ đột quỵ và huyết khối hệ thống như nhau. Tuy nhiên, một bài tổng quan hệ thống gần đây gồm 12 nghiên cứu với số lượng bệnh nhân khoảng 100.000 đã cho thấy rung nhĩ vĩnh viễn và rung nhĩ kéo dài làm tăng nguy cơ đột quỵ lên 1,38 lần so với nhóm rung nhĩ kịch phát sau khi đã được phân tích đa biến[11]. Kết quả này một lần nữa được ủng hộ bởi nghiên cứu ENGAGE AF-TIMI 48, nghiên cứu này cho thấy các biến cố về huyết khối ở bệnh nhân rung nhĩ kịch phát thấp hơn so với rung nhĩ dai dẳng[27]. Không có sự khác biệt về nguy cơ huyết khối giữa rung nhĩ dai dẳng và rung nhĩ vĩnh viễn trong nghiên cứu. Tóm lại, theo những bằng chứng hiện tại, rung nhĩ dai dẳng dường như có nguy cơ đột quỵ cao hơn. Tuy nhiên, vẫn chưa rõ liệu phần nguy cơ tăng lên có thể là do bệnh nền gây ra rung nhĩ hay do bản thân của loại rung nhĩ gây nên.
Phương pháp chẩn đoán rung nhĩ đã phát triển đáng kể trong thập niên vừa qua. Trước đây rung nhĩ chủ yếu được phát hiện qua đo ECG 12 chuyển đạo thông thường, ngày nay các thiết bị cấy ghép đã làm xuất hiện một khái niệm và xu hướng mới có tên “rung nhĩ phát hiện bởi thiết bị cấy ghép”. Xu hướng này đã dẫn đến sự ra đời của một thuật ngữ mới “cơn tần số nhĩ cao (AHRE) và rung nhĩ dưới lâm sàng (SCAF)”. Những sự thay đổi này làm lóe lên một câu hỏi vậy cơn AHRE/SCAF kéo dài bao lâu thì đủ để chẩn đoán, gánh nặng của chúng ở mức độ nào thì đủ để cho thấy việc dùng kháng đông có lợi? Gần đây ESC đã đưa ra hướng dẫn về vấn đề này. Những cơn AHRE ngắn < 10 – 20 giây/ngày thường không có ý nghĩa lâm sàng và cũng không có bằng chứng cho thấy chúng có liên quan với những cơn AHRE dài hơn hay làm tăng nguy cơ đột quỵ và huyết khối hệ thống. Tuy nhiên những cơn AHRE/SCAF dài hơn (tối thiểu khoảng 5 – 6 phút/ngày) làm tăng nguy cơ xuất hiện rung nhĩ trên lâm sàng, tăng nguy cơ xuất hiện các kết cục tim mạch bất lợi, tăng tử vong do nguyên nhân tim mạch. Nói chung, nguy cơ đột quỵ của AHRE vẫn thấp hơn so với rung nhĩ trên lâm sàng. Việc sử dụng kháng đông đường uống ở nhóm bệnh nhân này vẫn chưa rõ ràng, các bằng chứng hiện tại chưa đủ để ủng hộ việc sử dụng kháng đông thường quy. Tuy nhiên, chúng ta nên cân nhắc sử dụng kháng đông ở nhóm bệnh nhân có gánh nặng AHRE/SCAF cao và có nguy cơ đột quỵ theo thang điểm CHA2DS2-VASc cũng ở mức cao (bảng 2)[20].
Bảng 2: Hướng dẫn điều trị AHRE/SCAF theo ESC 2020 [20]
| Nguy cơ đột quỵ
Gánh nặng AHRE/SCAF |
Nguy cơ thấp
CHA2DS2-VASc 0 (nam) 1(nữ) |
Có 1 yếu tố nguy cơ CHA2DS2-VASc 1 (nam) 2 (nữ) | Nguy cơ cao CHA2DS2-VASc ³ 2 (nam) ³ 3 (nữ) |
| AHRE/SCAF ngắn, gánh nặng trong ngày thấp | Không cần theo dõi thêm | Cần theo dõi các vấn đề:
– Cơn AHRE/SCAF kéo dài hơn không ? – Tiến triển thành rung nhĩ trên lâm sàng ? |
|
| AHRE/SCAF dài hơn (³ 1 giờ và < 24 giờ) | Cần theo dõi các vấn đề:
– Cơn AHRE/SCAF kéo dài hơn ? – Tiến triển thành rung nhĩ trên lâm sàng ? – Phân tầng nguy cơ có thay đổi không ? |
Cân nhắc sử dụng OAC ở bệnh nhân có nguy cơ đột quỵ cao hoặc rất cao và lợi ích mang lại nhiều hơn nguy cơ. | |
| AHRE/SCAF kéo dài (³ 24 giờ) | |||
Ngoài ra có những yếu tố khác cần được cân nhắc kỹ khi điều trị những bệnh nhân có gánh nặng rung nhĩ cao. Các phương pháp điều trị hiện tại có thể làm giảm gánh nặng rung nhĩ ở một số bệnh nhân thích hợp, tuy nhiên việc cố gắng chuyển nhịp xoang không phải là không có nguy cơ. Nghiên cứu FibStroke đã cho thấy chuyển nhịp bằng điện học hay bằng thuốc có mối liên quan với việc xuất hiện đột quỵ thiếu máu[36]. Vì đa số biến cố đột quỵ xảy ra ở bệnh nhân được chuyển nhịp bằng điện học, nên có thể nói rằng việc chuyển nhịp bằng điện học có thể làm di chuyển những huyết khối đã xuất hiện từ trước đi ra khỏi nhĩ trái và vào tuần hoàn hệ thống. Tuy nhiên, nhiều biến cố đột quỵ xảy ra sau khi chuyển nhịp tới 2 ngày. Vì vậy có thể có những yếu tố khác liên quan. Hơn nữa, đã có những biến cố đột quỵ xảy ra ở cả những bệnh nhân tự chuyển nhịp. Nguyên nhân có thể do sự đờ của cơ nhĩ sau chuyển nhịp bất kể là chuyển nhịp bằng phương pháp nào.
Trước đây người ta nghĩ rằng hình dạng của sóng rung nhĩ trên ECG có thể hữu ích trong việc đánh giá nguy cơ đột quỵ. Một nghiên cứu gồm 811 bệnh nhân, Yilmaz đã chia rung nhĩ ra thành rung nhĩ sóng to và rung nhĩ sóng nhỏ dựa vào ECG bề mặt, và nghiên cứu cho thấy rung nhĩ sóng lớn làm tăng nguy cơ đột quỵ[44]. Tác giả định nghĩa rung nhĩ sóng lớn là sóng nhĩ có chiều cao lớn hơn 1 mm tính từ dường đẳng điện, còn chiều cao sóng nhỏ hơn 1mm hoặc không thấy thì được xếp là rung nhĩ sóng nhỏ. Ngày nay vẫn chưa có đủ bằng chứng chắc chắn để ủng hộ việc này. Tuy nhiên, nếu nó thật sự có ý nghĩa, thì đây là một công cụ khá đơn giản, dễ sử dụng để cung cấp thêm thông tin cho các quyết định lâm sàng.
- Các dấu chỉ sinh học
Nhiều dấu chỉ sinh học bao gồm máu, nước tiểu, các số đo về giải phẫu đã được nghiên cứu trong rung nhĩ và chúng cho thấy có thể cải thiện khả năng tiên đoán đột quỵ. Các nghiên cứu đã chỉ ra rằng ở những bệnh nhân đã có chỉ định sử dụng kháng đông theo thang điểm CHA2DS2-VASc, chúng có thể dự báo những bệnh nhân có nguy cơ không đáp ứng tốt với thuốc kháng đông. Đối với những bệnh nhân được xếp vào nhóm có nguy cơ đột quỵ thấp hoặc chỉ định kháng đông chưa rõ ràng, những dấu chỉ sinh học này đóng vai trò như những yếu tố bổ sung giúp bác sĩ nhận ra đâu thực sự là những bệnh nhân có nguy cơ thấp và những bệnh nhân nào nên được sử dụng kháng đông mặc dù điểm CHA2DS2-VASc không cao.
3.1 Dấu chỉ sinh học máu.
Về cơ bản, xét nghiệm máu được chia ra thành xét nghiệm liên quan chức năng tim (troponins và natriuretic peptides), đông máu (d-dimer, von willebrand factor, solube E-selectin, và P-selectin), yếu tố viêm (interleukin 6 và CRP) hoặc những yếu tố khác (ví dụ như chức năng thận)
3.1.1 Chức năng tim
Troponin và peptide lợi niệu natri là những xét nghiệm thường được dùng nhất. Nhiều nghiên cứu trước đây đã chứng minh chúng có giá trị trong các bệnh tim mạch như nhồi máu cơ tim, suy tim. Các nghiên cứu sau này còn cho thấy nồng độ của các chất này có thể cải thiện khả năng dự đoán kết cục đột quỵ ở bệnh nhân rung nhĩ. Nghiên cứu RE-LY đã cho thấy nồng độ troponin I và NT-proBNP tăng trong máu rất thường gặp ở bệnh nhân rung nhĩ[17]. Cả hai chất này đều có liên quan độc lập đến việc tăng nguy cơ rung nhĩ, mối liên quan còn theo mức độ, có nghĩa là nồng độ cao sẽ làm tăng nguy cơ đột quỵ hơn so với nồng độ thấp. Khi chia nồng độ NT-proBNP ra làm tứ phân vị, người ta nhận thấy tứ phân vị cao nhất làm tăng 2,4 lần nguy cơ đột quỵ so với tứ phân vị thấp nhất và tam phân vị cao nhất của troponin I làm tăng nguy cơ đột quỵ gấp 2 lần so với tam phân vị thấp nhất. Có nhiều cơ chế giải thích vấn đề này. Ở bệnh nhân rung nhĩ, không giống như suy tim, BNPs có thể tiết ra từ tâm nhĩ. Bằng chứng ủng hộ cho điều này là việc phục hồi nút xoang có liên quan đến việc nồng độ peptide lợi niệu natri giảm nhanh và đáng kể. Tăng nồng độ peptide lợi niệu natri phản ánh mức độ căng của tâm nhĩ. Vì vậy chỉ số này cho thấy mức độ rối loạn hoạt động chức năng của tâm nhĩ và có liên hệ với nguy cơ tạo thành huyết khối. Trong khi đó, troponins được giải phóng từ cơ tim bị tổn thương sẽ dẫn đến trạng thái tăng đông. Hơn nữa tăng troponins máu có liên quan đến việc suy giảm chức năng nhĩ trái, điều này đã được đánh giá thông qua MRI tim.
3.1.2 Chức năng thận.
Suy giảm chức năng thận là một yếu tố dự báo mạnh của đột quỵ và huyết khối hệ thống trong nghiên cứu ROCKET AF và ATRIA, chỉ đứng sau tiền căn đột quỵ hoặc TIA[37]. Thật vậy, bệnh nhân rung nhĩ đang sử dụng các phương pháp thay thế thận có tỉ lệ đột quỵ cao gấp 9,8 lần so với bệnh nhân rung nhĩ không suy thận[43]. Bệnh thận mạn làm kích hoạt quá trình tăng đông, ảnh hưởng của nó là lên cả 3 yếu tố trong tam giác Virchow. Suy giảm chức năng thận đã được chứng minh là có mối liên quan với sự tăng ứ đọng máu trong nhĩ trái, ảnh hưởng chức năng nội mạc và làm kích hoạt tiểu cầu. Hơn nữa, bệnh thận mạn có mối liên quan với tình trạng tăng các yếu tố tiền đông máu và các dấu chỉ sinh học viêm.
Trước đây, người ta cho rằng bệnh thận mạn là một yếu tố nguy cơ và có thể làm cải thiện độ chính xác của các mô hình phân tầng nguy cơ rung nhĩ. Tuy nhiên, khi thực hiện các nghiên cứu sâu hơn người ta nhận thấy nó không làm tăng thêm khả năng phân tầng nguy cơ của thang điểm CHADS2 và CHA2DS2-VASc. Vì vậy, hiện nay chưa đủ bằng chứng để chứng minh lợi ích của việc đưa bệnh thận mạn vào thang điểm CHA2DS2-VASc. Điều này có thể giải thích bởi lý do là bản thân bệnh thận mạn đã có mối liên quan với tất cả các yếu tố trong thang điểm CHA2DS2-VASc nên khi đưa nó vào không làm cải thiện thêm khả năng dự báo đột quỵ và huyết khối hệ thống.
3.1.3 Đông máu.
Nguy cơ đột quỵ ở bệnh nhân rung nhĩ có mối liên quan mạnh với quá trình đông máu, đặc biệt là tình trạng tăng đông. Tuy nhiên quá trình đông máu phức tạp và bao gồm nhiều con đường khác nhau. Do đó, điều quan trọng là chúng ta phải biết được con đường nào là có liên quan đến rung nhĩ. D-dimer là một mảnh protein nhỏ được thải ra từ quá trình tiêu sợi huyết. Một nghiên cứu tiến cứu được tiến hành trên 509 bệnh nhân rung nhĩ đã cho thấy D-dimer < 150ng/ml làm tăng đáng kể nguy cơ thuyên tắc huyết khối so với nhóm bệnh nhân có D-dimer > 150ng/ml, 0,7% mỗi năm so với 3,8% mỗi năm[31]. Những nghiên cứu khác cũng cho kết quả tương tự. Trái lại, You và cộng sự đã cho thấy D-dimer không phải là yếu tố nguy cơ độc lập của đột quỵ thiếu máu ở bệnh nhân rung nhĩ mặc dù có sự liên quan dương giữa nồng độ D-dimer và thang điểm đột quỵ (CHADS2 và CHA2DS2-VASc). Tuy nhiên, nghiên cứu này là nghiên cứu hồi cứu và chỉ nhận các bệnh nhân chưa sử dụng kháng đông[45]. Nói chung, các bác sĩ lâm sàng có thể cân nhắc sử dụng D-dimer để hỗ trợ cho việc phân tầng nguy cơ đột quỵ ở bệnh nhân rung nhĩ.
Yếu tố Von Willebrand là một glycoprotein có vai trò trong quá trình đông máu. Nhiều nghiên cứ cho thấy tăng nồng độ vWF có mối liên quan với tình trạng tăng đông ở bệnh nhân rung nhĩ. Tuy nhiên, các nghiên cứu liên quan tới vWF lấy kết cục chính là suy tim và tử vong do mọi nguyên nhân. Do đó, khó có thể rút ra được kết luận vững chắc từ các nghiên cứu này. Trong số những nghiên cứu xem đột quỵ là kết cục chính, có hai nghiên cứu cho thấy nồng độ vWF cao có liên quan đến việc tăng nguy cơ đột quỵ[23],[38]. Nghiên cứu của Ancedy và cộng sự cho thấy rằng mặc dù có mối liên hệ giữa tăng nồng độ vWF và tăng nguy cơ biến cố gộp gồm tử vong do mọi nguyên nhân và đột quỵ, nhưng kết quả này không còn có ý nghĩa thống kê khi đánh giá một mình kết cục đột quỵ[1]. Tóm lại, vai trò của vWF trong việc phân tầng nguy cơ đột quỵ cần phải được nghiên cứu thêm.
3.1.4 Yếu tố viêm: IL6 và CRP trong một vài nghiên cứu đã cho thấy có mối liên quan tới việc tăng nguy cơ đột quỵ và huyết khối hệ thống ở bệnh nhân rung nhĩ, tuy nhiên việc áp dụng lâm sàng vẫn còn hạn chế chủ yếu là do sự mâu thuẫn về kết quả giữa các nghiên cứu.
3.2. Dấu chỉ sinh học trong nước tiểu
Một vài dấu chỉ sinh học trong nước tiểu có thể được sử dụng để phân tầng nguy cơ đột quỵ ở bệnh nhân rung nhĩ. Trong nghiên cứu ATRIA, sự hiện diện của protein niệu làm tăng 1,5 lần nguy cơ huyết khối thuyên tắc[12]. Hơn nữa, một nghiên cứu hồi cứu cho thấy nồng độ albumin trong nước tiểu cao có mối liên quan với việc tăng tỉ lệ thuyên tắc huyết khối ở những bệnh nhân mới chẩn đoán rung nhĩ[16]. Những cơ chế có thể giải thích là: albumin niệu phản ánh giai đoạn sớm của bệnh thận mạn mà bệnh thận mạn là một yếu tố nguy cơ của đột quỵ; albumin niệu gây ra sự mất cân bằng tự nhiên giữa các yếu tố đông máu và các yếu tố kháng đông, giống như trong hội chứng thận hư.
3.3. Các dấu ấn về cấu trúc
Rung nhĩ gây ra sự biến đổi đáng kể lên cấu trúc nhĩ trái, bao gồm tái cấu trúc nhĩ và hiện tượng này có thể quan sát bằng nhiều phương pháp chẩn đoán hình ảnh khác nhau. Một vài dạng thay đổi trong cấu trúc nhĩ có khả năng dự đoán nguy cơ đột quỵ ở bệnh nhân rung nhĩ, nguyên nhân có thể do các dạng cấu trúc này làm xuất hiện quá trình đông máu bất thường. Những nghiên cứu trước đây trong lãnh vực này chủ yếu dựa vào siêu âm tim qua thành ngực. Gần đây những tiến bộ về hình ảnh học ví dụ như siêu âm tim qua thực quản, chụp cắt lớp vi tính và MRI đã được sử dụng rộng rãi hơn và gia tăng đáng kể độ chính xác trong việc đánh giá cấu trúc nhĩ. Những phương pháp này cho phép chúng ta phát hiện những dấu ấn về cấu trúc mới ví dụ như xơ hóa nhĩ trái và hình dạng của tiểu nhĩ, những yếu tố này cũng góp phần phân tầng nguy cơ đột quỵ. Nghiên cứu SPAF đã khảo sát 14 thông số trên siêu âm tim để đánh giá khả năng dự đoán đột quỵ thiếu máu hoặc huyết khối hệ thống ở bệnh nhân rung nhĩ[34]. Tác giả đã cho rằng sự hiện diện của suy giảm chức năng thất trái và buồng nhĩ trái lớn là các yếu tố nguy cơ quan trọng. Hơn nữa, những chỉ số này có thể dự báo bệnh nhân nào có nguy cơ đột quỵ cao và độc lập với các yếu tố nguy cơ về lâm sàng. Một nghiên cứu tiến cứu được thực hiện trên 2,713 bệnh nhân rung nhĩ đã cho thấy lớn nhĩ trái (>45mm) làm tăng 1,7 lần nguy cơ đột quỵ thiếu máu và huyết khối hệ thống[15]. Tác giả Dakay và cộng sự cũng đã chỉ ra rằng nhĩ trái có kích thước quá lớn có mối liên hệ với tăng nguy cơ đột quỵ mặc dù có dùng kháng đông[6]. Thú vị hơn, có vẻ có mối liên hệ giữa kích thước nhĩ trái và nguy cơ đột quỵ thậm chí ở bệnh nhân không có rung nhĩ. Trong nghiên cứu Framingham, bệnh nhân không rung nhĩ có kích thước nhĩ trái lớn có nguy cơ đột quỵ và tử vong cao hơn dân số chung trong suốt 8 năm theo dõi[5]. Vì vậy lớn nhĩ trái là yếu tố giúp xác định nhóm bệnh nhân rung nhĩ vẫn có nguy cơ cao đột quỵ mặc dù đang sử dụng kháng đông. Hơn nữa, yếu tố này có thể chỉ cần đánh giá bằng siêu âm tim qua thành ngực mà không cần các phương pháp chẩn đoán hình ảnh học hiện đại và phức tạp hơn.
Đa số các đột quỵ do huyết khối từ tim bắt nguồn từ nhĩ trái. Trong nhĩ trái, vị trí thường xuất hiện huyết khối nhất là trong tiểu nhĩ trái. Đây là một túi nhỏ, cấu trúc phức tạp, dính vào mặt trước của nhĩ trái. Vì cấu trúc giải phẫu phức tạp, có nhiều kênh hẹp dẫn tới dòng máu di chuyển chậm và dễ bị ứ đọng trong túi này, từ đó dễ dàng tạo ra huyết khối. Những huyết khối này sau đó có thể đi ra khỏi nhĩ trái và gây đột quỵ. Do đó, không có gì ngạc nhiên khi chúng ta thấy rằng một số cấu trúc đặc biệt của tiểu nhĩ làm tăng nguy cơ đột quỵ. Nghiên cứu của Di Biase và cộng sự nghiên cứu trên các bệnh nhân cắt đốt rung nhĩ đã chia ra được 4 dạng cấu trúc tiểu nhĩ khác nhau (Hình 2 – trang bìa 3): dạng cánh gà (48%), dạng xương rồng (30%), dạng vớ (19%) và dạng bông cải (3%)[5]. Sau phân tích đa biến, cấu trúc tiểu nhĩ dạng cánh gà có tỉ lệ đột quỵ là thấp nhất. Hình dạng xương rồng làm tăng nguy cơ đột quỵ lên 4 lần so với dạng cánh gà, dạng bông cải làm tăng nguy cơ đột quỵ lên 8 lần so với dạng cánh gà. Những nghiên cứu khác cũng cho kết quả tương tự. Tuy nhiên kết quả của các nghiên cứu vẫn chưa có sự thống nhất với nhau chủ yếu là do có sự khác biệt về đánh giá cấu trúc nhĩ trái giữa những bác sĩ thực hiện thủ thuật. Ngoài ra các nghiên cứu còn có hạn chế là đều là những nghiên cứu hồi cứu, chỉ bao gồm một phần nhỏ bệnh nhân rung nhĩ (chỉ những bệnh nhân rung nhĩ có chỉ định cắt đốt). Do đó, cần thêm các nghiên cứu tiến cứu trong tương lai để xác định lại liệu cấu trúc tiểu nhĩ trái có thể được sử dụng để phân tầng nguy cơ đột quỵ trên dân số bệnh nhân rung nhĩ chung.

Hình 2: Các cấu trúc tiểu nhĩ trái [21]
Xơ hóa trĩ trái được đánh giá bằng tăng quang muộn trên MRI tim cũng có thể là một yếu tố dự đoán đột quỵ. Nghiên cứu chỉ ra rằng đường thể hiện sự liên quan giữa mức độ xơ hóa và nguy cơ đột quỵ là hình chữ J, điều này cho thấy bản thân bất thường cấu trúc nhĩ trái (không liên quan đến nhịp) cũng làm tăng nguy cơ đột quỵ, điều thú vị là ở bệnh nhân có điểm CHA2DS2-VASc càng cao thì tình trạng xơ hóa càng nặng.
- Những dấu ấn về di truyền.
Sự tiến bộ của những kỹ thuật phân tích gen ngày nay đã nâng cao vị thế của di truyền học trong một số bệnh lý. Những thông tin về gen cung cấp thêm một công cụ để phân tầng nguy cơ đột quỵ ở bệnh nhân rung nhĩ. Tuy nhiên, hiện nay các nghiên cứu về gen trong lĩnh vực này còn khá hiếm, các nghiên cứu hiện có tập trung chủ yếu vào nhiễm sắc thể 4q25. Tại thời điểm hiện tại, sử dụng di truyền học để phân tầng nguy cơ bệnh nhân rung nhĩ vẫn là một điều chưa thực tế.
*Tổng hợp các yếu tố nguy cơ và độ mạnh của nó nêu ở Hình 3 (trang bìa 3)
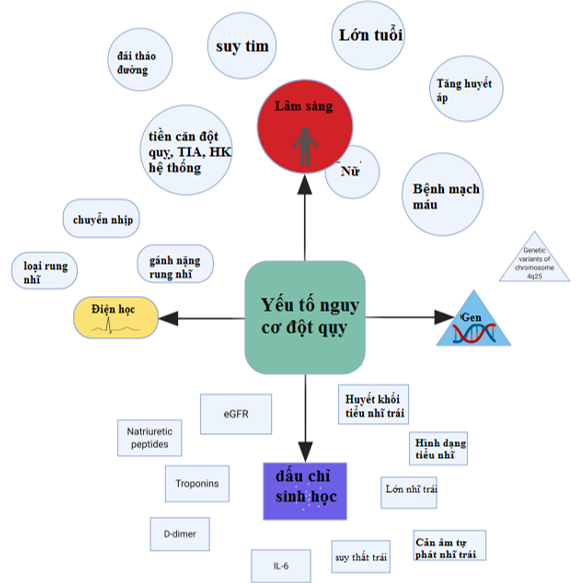
Hình 3: Bảng tổng hợp các yếu tố nguy cơ của rung nhĩ, những yếu tố nguy cơ có mối liên quan càng mạnh sẽ được thể hiện bằng những ô lớn hơn [7]
ĐÁNH GIÁ NGUY CƠ XUẤT HUYẾT
Một yếu tố quan trọng trong điều trị rung nhĩ là phòng ngừa đột quỵ và kết quả là có nhiều bệnh nhân rung nhĩ phải sử dụng kháng đông. Tuy nhiên, việc dùng kháng đông không phải là không có nguy cơ. Một phân tích gộp gồm 8 nghiên cứu RCT cho thấy tỉ lệ xuất huyết nặng mỗi năm dao động từ 1,4% đến 3,4% ở các bệnh nhân rung nhĩ đang điều trị với Warfarin[5]. Nguy cơ xuất huyết não (thể nặng nhất của biến chứng xuất huyết), ước tính khoảng 0,61% mỗi năm[8]. Mặc dù tỉ lệ xuất huyết não khá thấp, tuy nhiên lại có kết cục nặng nề nhất với 76% bệnh nhân tàn tật hoặc tử vong, làm tăng 20 lần tỉ lệ tử vong trong vòng 30 ngày so với các thể xuất huyết khác. Chính vì những kết cục nặng nề của xuất huyết liên quan đến kháng đông, đặc biệt là xuất huyết não, nên mọi nỗ lực hiện nay tập trung vào việc giảm nguy cơ xuất huyết đến mức thấp nhất trong khi đó vẫn duy trì được khả năng dự phòng đột quỵ tối ưu. Sử dụng NOACs đã cho thấy có lợi hơn warfarin. Hai phân tích gộp lớn đã cho thấy các thuốc trong nhóm NOACs có bằng chứng an toàn vượt trội với ít biến cố xuất huyết nặng và xuất huyết não hơn so với warfarin[13].
Thời gian từ lúc dùng kháng đông cho tới khi có biến cố xảy ra cũng là một yếu tố quan trọng. Về mặt này, tỉ lệ xuất huyết sẽ tăng nhẹ trong một vài tháng đầu dùng kháng vitamin K. Điều này có thể do INR chưa được kiểm soát tốt trong khoảng mục tiêu điều trị, tình trạng này thường được cải thiện khi thời gian sử dụng dài hơn. Tuy nhiên, đối với dabigatran cũng ghi nhận hiện tượng tương tự trong khi thuốc này rất hiếm khi được chỉnh liều, chính vì vậy người ta cho rằng có yếu tố khác nữa để giải thích cho hiện tượng này. Một giả thiết đơn giản là kháng đông sẽ làm lộ ra những bệnh nhân có nguy cơ xuất huyết cao mà chúng ta không thể phát hiện bằng các thăm dò thông thường. Do đó, một thang điểm đánh giá nguy cơ xuất huyết tốt hơn là rất cần thiết. Nhiều yếu tố nguy cơ về lâm sàng, xét nghiệm và di truyền học đã cho thấy có khả năng dự đoán được biến cố xuất huyết liên quan đến kháng đông ở bệnh nhân có rung nhĩ. Một vài yếu tố này còn ảnh hưởng đến cả nguy cơ đột quỵ.
Có một vài thang điểm xuất huyết đã được xây dựng riêng cho những nghiên cứu về rung nhĩ. Các thang điểm này thường là sự kết hợp giữa các yếu tố lâm sàng, xét nghiệm và di truyền học. Nói chung, mỗi yếu tố nguy cơ được cho một số điểm nhất định và tổng những điểm này lại người ta có thể xác định nguy cơ xuất huyết hằng năm ở bệnh nhân đang dùng kháng đông là bao nhiêu. Nên lưu ý rằng việc định nghĩa yếu tố nguy cơ có sự khác biệt giữa những nghiên cứu khác nhau. (ví dụ như tuổi, chức năng thận và tăng huyết áp). Hơn nữa, có nhiều yếu tố nguy cơ xuất huyết cũng là yếu tố nguy cơ đột quỵ. Điều này cho chúng ta thấy mối quan hệ phức tạp giữa quá trình đông máu và chảy máu, đồng thời cũng cho thấy bác sĩ lâm sàng phải đối diện với nhiều khó khăn khi đặt nguy cơ xuất huyết và đột quỵ lên bàn cân để quyết định điều trị kháng đông.
- Những dấu chỉ lâm sàng
Tác giả Hughes và cộng sự đã thực hiện một bài tổng quan hệ thống báo cáo chín nghiên cứu về biến chứng xuất huyết ở bệnh nhân dùng kháng đông. Phân tích cho thấy tuổi cao, huyết áp không kiểm soát tốt, tiền căn nhồi máu cơ tim hay bệnh tim thiếu máu cục bộ, tiền căn đột quỵ, thiếu máu, tiền căn xuất huyết, dùng chung với các thuốc gây chảy máu khác (như aspirin) là yếu tố nguy cơ độc lập với biến cố xuất huyết[24]. Các nghiên cứu gần đây đã cho thấy giới tính và tiểu đường không phải là các yếu tố dự đoán quan trọng. Ngược lại, tuổi và việc dùng kháng kết tập tiểu cầu có mối liên quan đáng kể với nguy cơ xuất huyết liên quan đến kháng đông[19]. Lý do có thể là ở bệnh nhân càng lớn tuổi thì sẽ có những thay đổi bất lợi, làm tăng tỉ lệ xuất huyết ví dụ như thay đổi về chuyển hóa, có nhiều bệnh đồng mắc hơn, những thay đổi mạch máu do thoái hóa, sử dụng nhiều thuốc hơn, suy giảm nhận thức. Trong khi đó, việc sử dụng kèm với kháng kết tập tiểu cầu làm ảnh hưởng nặng nề hơn đến quá trình đông máu, dễ dẫn đến xuất huyết hơn. Ngoài ra còn có những yếu tố khác làm tăng nguy cơ xuất huyết liên quan đến kháng đông là uống rượu và bệnh tuyến giáp.
1.1 Té ngã
Tiền căn té ngã là một yếu tố nguy cơ xuất huyết có liên quan đến kháng đông, đặc biệt là ở người cao tuổi. Gage và cộng sự đã cho thấy ở bệnh nhân rung nhĩ có nguy cơ té ngã cao và đang dùng warfarin thì họ cũng sẽ có nguy cơ cao bị xuất huyết nội sọ[10]. Ngoài ra, trong một nghiên cứu thực hiện trên 7,156 bệnh nhân rung nhĩ, tiền căn té ngã làm tăng nguy cơ xuất huyết nặng lên 3,3 lần[4]. Dựa trên kết quả này, những bệnh nhân có nguy cơ té ngã cao bị mất đi cơ hội dự phòng đột quỵ bằng kháng đông với suy nghĩ là dùng sẽ gây hại. Tuy nhiên cần lưu ý rằng, cũng trong nghiên của Gage, người ta nhận thấy ở các bệnh nhân nguy cơ té ngã cao, việc dùng kháng đông vẫn làm cải thiện kết cục lâm sàng cuối cùng mặc dù có làm tăng nguy cơ xuất huyết não. Nói chung, các bằng chứng hiện tại chỉ ra rằng tiền căn té ngã là một yếu tố nguy cơ quan trọng của xuất huyết nặng nhưng không nên chỉ xét mỗi một yếu tố này để quyết định có dùng kháng đông ở bệnh nhân hay không. Và để ủng hộ quan điểm này, nghiên cứu của Man-Son-Hing và cộng sự đã cho thấy người ta ước tính một bệnh nhân phải té ngã ít nhất 295 lần trong một năm thì nguy cơ xuất huyết nặng mới vượt quá lợi ích dùng warfarin[29]. Điều cần nhớ là ở bệnh nhân nguy cơ té ngã cao, nếu có các biện pháp dự phòng té ngã tốt, chúng ta vẫn có thể dùng kháng đông để dự phòng.
1.2 Ung thư
Ung thư có mối liên quan đến việc tăng tỉ lệ xuất huyết liên quan đến kháng đông. Một nghiên cứu của Gitter và cộng sự cho thấy bệnh nhân khởi động warfarin có kèm bệnh lý ác tính sẽ tăng 4 lần nguy cơ xuất huyết nặng trong vòng 28 tuần theo dõi[14]. Mặc dù về mặt tổng thể thì tỉ lệ xuất huyết tăng ở nhóm bệnh nhân mắc bệnh ác tính có dùng kháng đông, tuy nhiên người ta nhận thấy có sự khác nhau về hiệu quả và tính an toàn giữa các loại kháng đông khác nhau trong trường hợp này. Nói chung, heparin trọng lượng phân tử thấp có mức độ an toàn tương đương với kháng vitamin K và tốt hơn trong việc phòng ngừa thuyên tắc huyết khối tái phát[25]. Thuốc kháng đông đường đường uống thế hệ mới thuận tiện hơn trong việc sử dụng so với heparin trọng lượng phân tử thấp, tuy nhiên lại có nguy cơ gây xuất huyết cao hơn trong khi đó về mức độ hiệu quả thì lại như nhau[26]. Do đó, bệnh nhân có bệnh ác tính có thể sử dụng từ ban đầu bằng heparin trọng lượng phân tử thấp hoặc NOACs (ngoại trừ nhưng trường hợp chống chỉ định của NOAC).
1.3 Chủng tộc
Những nghiên cứu gần đây cho thấy tỉ lệ xuất huyết não ở các chủng tộc không phải da trắng cao hơn so với dân da trắng, cụ thể là chủng tộc châu Á có tỉ lệ xuất huyết não cao hơn dân da trắng tới 4 lần[22]. Hơn nữa, khi so sánh kết cuộc lâm sàng ở những bệnh nhân xuất huyết não với nhau, kết quả cũng cho thấy nhóm châu Á có kết cục xấu hơn[3]. Với những bằng chứng hiện tại, chúng ta nên lưu ý hơn tới các yếu tố nguy cơ điều chỉnh được ở bệnh nhân châu Á bắt đầu sử dụng kháng đông. Nên cân nhắc sử dụng NOAC ngay từ ban đầu bởi vì có bằng chứng cho thấy đây là phương pháp điều trị thay thế vitamin K an toàn hơn ở nhóm dân châu Á.
1.4 Cân nặng
Cân nặng cơ thể ảnh hưởng đến sự phân bố và thải trừ của thuốc kháng đông. Do đó có những quan ngại về tính an toàn và hiệu quả của thuốc ở những bệnh nhân quá nhẹ cân hoặc quá nặng cân. Tuy nhiên, những nghiên cứu về vấn đề này đã đưa ra kết quả khá vững chắc. Nguy cơ xuất huyết liên quan đến kháng đông là tương đương ở nhóm bệnh nhân béo phì, nhẹ cân so với những bệnh nhân có cân nặng bình thường[46]. Một vài nghiên cứu còn cho thấy béo phì làm giảm nguy cơ xuất huyết[39]. Hơn nữa, những bệnh nhân béo phì có kèm rung nhĩ được điều trị với NOAC còn có nguy cơ thuyên tắc huyết khối thấp hơn, dẫn đến có thuật ngữ “béo phì nghịch thường”[39].
- Dấu chỉ sinh học.
Có nhiều dấu chỉ sinh học giúp phân tầng nguy cơ xuất huyết liên quan đến kháng đông. Một vài dấu chỉ có liên quan đến nguy cơ đột quỵ đã được đề cập ở trên (ví dụ như suy thận, IL-6, vWF). Dấu chỉ quan trọng nhất liên quan đến sử dụng VKA là mức độ kháng đông được đo bằng INR. INR càng cao thì nguy cơ xuất huyết liên quan đến kháng đông càng cao với RR là 7,9 (95% CI, 5.4–11.5) đối với INR 4,5 so với INR 4,5[35]. Từ INR 2,5 trở đi, cứ mỗi đơn vị INR tăng lên sẽ làm tăng nguy cơ tử vong lên 2 lần[32]. Do vậy, mọi nỗ lực nên tập trung vào việc duy trì INR trong khoảng mục tiêu đã định trước, thường là từ 2 – 3. Những nghiên cứu gần đây cho thấy mức độ dao động INR là một yếu tố nguy cơ xuất huyết đáng tin cậy hơn. Thời gian INR trong khoảng điều trị (TTR) có mối liên hệ mạnh với biến cố xuất huyết trong tương lai. Tuy nhiên có một số giới hạn của TTR chúng ta nên nhớ. Đầu tiên, mối liên quan giữa biến cố xuất huyết và chỉ số INR không phải là mối quan hệ tuyến tính. Thứ hai, sự dao động của INR không làm thay đổi nguy cơ trong ngắn hạn. Cuối cùng, yếu tố dự báo này không thể áp dụng ở các bệnh nhân không theo dõi INR thường xuyên, mà đây có thể là nhóm nguy cơ cao do không tuân thủ điều trị.
Gan và thận đóng vai trò quan trọng trong dược động của thuốc và quá trình đông máu, vì vậy sự thay đổi chức năng của các cơ quan này có thể ảnh hưởng bất lợi đến nguy cơ xuất huyết liên quan đến kháng đông. Một nghiên cứu quan sát có theo dõi trên 8,466 bệnh nhân rung nhĩ được điều trị với VKA hoặc NOAC đã cho thấy bất thường chức năng gan thận đều làm tăng nguy cơ xuất huyết nghiêm trọng[41]. Các tác giả đã định nghĩa bất thường chức năng thận là creatinin > 2,3 mg/dl, tiền căn ghép thận hoặc đang sử dụng các phương pháp thay thế thận, bất thường chức năng gan là các trường hợp xơ gan, tăng men gan, phosphatase kiềm > 3 lần so với giới hạn trên, hoặc bilirubin > 2 lần so với giới hạn trên.
Thiếu máu cũng có mối liên hệ với tăng tỉ lệ xuất huyết. Lý do chính hiện vẫn chưa rõ nhưng có một vài bằng chứng gợi ý rằng khả năng kết dính của tiểu cầu bị giảm trong trường hợp số lượng hồng cầu thấp. Hơn nữa, có trường hợp thiếu máu do mất máu rỉ rả không phát hiện được, khi sử dụng kháng đông thì tình trạng xuất huyết trở nên rõ ràng hơn.
Người ta vẫn còn tranh cãi liệu có nên sử dụng IL-6 là một yếu tố dự đoán xuất huyết liên quan đến kháng đông. Một nghiên cứu đoàn hệ lớn ở bệnh nhân rung nhĩ tìm thấy rằng IL-6 có mối liên quan độc lập với tình trạng xuất huyết sau khi đã được điều chỉnh với các yếu tố nguy cơ lâm sàng và các xét nghiệm (troponin, NT-proBNP và cystatin C)[2]. Trong khi đó, một nghiên cứu đoàn hệ khác mặc dù cho thấy có mối liên quan giữa IL-6 và xuất huyết, tuy nhiên khi hiệu chỉnh với các xét nghiệm khác thì không còn ý nghĩa thống kê nữa[18]. Cả 2 nghiên cứu trên đều không tìm thấy mối liên quan giữa CRP và nguy cơ xuất huyết.
Ngoài các dấu chỉ sinh học trên, còn có nhiều dấu chỉ khác có mối liên hệ với xuất huyết khi dùng kháng đông, bao gồm vWF, Troponin siêu nhạy, GDF-15 (dấu chỉ stress oxy hóa). Roldan và cộng sự đã cho thấy nồng độ vWF tăng sẽ làm tăng nguy cơ xuất huyết nặng lên 4,5 lần[42]. Qua nghiên cứu ARISTOTLE, Hijazi và cộng sự đã thấy rằng troponin siêu nhạy và GDF-15 là những yếu tố nguy cơ dự đoán khả năng xuất huyết mạnh nhất so với các yếu tố nguy cơ truyền thống như tuổi, hemoglobin, tiền căn xuất huyết trước đây, suy tim sung huyết, đột quỵ cũ, TIA, tăng huyết áp và đái tháo đường[19]. Những nghiên cứu về NT-proBNP cho thấy nó không thể dự đoán biến cố xuất huyết liên quan kháng đông. Nói chung, các nghiên cứu ủng hộ việc sử dụng các dấu chỉ sinh học này để phân tầng nguy cơ xuất huyết còn rất hạn chế, bởi vì các dấu chỉ này không ổn định và thay đổi theo các yếu tố nguy cơ đã được nhắc đến, có thể còn do các yếu tố này không đặc hiệu.
- Di truyền học.
Tính đa hình của cytochrome P450 2C9 được cho là có mối liên quan với việc làm tăng nguy cơ xuất huyết nặng do ảnh hưởng đến sự chuyển hóa và hoạt động của warfarin. Ngoài ra nó còn ảnh hưởng đến liều warfarin cần thiết. Tuy nhiên như đã đề cập phía trên, hiện các bằng chứng về vai trò của di truyền học ở bệnh rung nhĩ còn hạn chế.
III. GIỚI HẠN CỦA CÁC THANG ĐIỂM
Các thang điểm đánh giá rất hữu ích cho các bác sĩ lâm sàng vì cung cấp một công cụ đánh giá nhanh chóng để đưa ra quyết định điều trị kháng đông ở bệnh nhân rung nhĩ cũng như phát hiện ra nhóm bệnh nhân có nguy cơ xuất huyết cao liên quan đến kháng đông . Tuy nhiên, chúng ta nên lưu ý các thang điểm đã được đơn giản hóa để các bác sĩ dễ sử và kết quả là đa số các thang điểm đều có một vài giới hạn và chỉ có khả năng tiên đoán nguy cơ đột quỵ ở mức độ trung bình.
Thứ nhất, không phải tất cả các yếu tố nguy cơ đều được đưa vào một thang điểm nào đó. Thứ hai, các thang điểm này thường sử dụng phương pháp tiếp cận chung cho mọi bệnh nhân rung nhĩ mà không tính tới sự không đồng nhất giữa các bệnh nhân này. Thứ ba, các thang điểm này chưa đánh giá mức độ ảnh hưởng của từng yếu tố nguy cơ vì mức độ liên quan của mỗi yếu tố nguy cơ với kết cục là khác nhau. Thứ tư, trong từng yếu tố nguy cơ, các thang điểm chưa đề cập đến mức độ nặng của yếu tố nguy cơ lên khả năng tiên đoán. Thứ năm, nhiều thang điểm đánh giá dựa trên các định nghĩa cũ, chưa được cập nhật. Cuối cùng, những nghiên cứu chỉ đánh giá mối liên quan giữa biến cố đột quỵ qua một thời gian dài theo dõi, trong khi các yếu tố nguy cơ lại chỉ được đánh giá ở thời điểm bắt đầu nghiên cứu. Gần đây người ta đã lưu ý hơn đến việc các yếu tố nguy cơ ở bệnh nhân rung nhĩ có thể thay đổi theo thời gian. Chao và cộng sự đã tìm thấy đa số bệnh nhân rung nhĩ trước khi bị đột quỵ họ thường xuất hiện thêm 1 yếu tố nguy cơ mới. Thật vậy, sự thay đổi của thang điểm CHA2DS2-VASc là một yếu tố dự đoán mạnh biến cố đột quỵ thiếu máu. Nghiên cứu này nhấn mạnh tầm quan trọng của việc đánh giá nguy cơ đột quỵ và xuất huyết thường xuyên là rất quan trọng. Do vậy, nguy cơ đột quỵ và xuất huyết cần phải được đánh giá xuyên suốt quá trình điều trị, đặc biệt tập trung vào việc phòng ngừa sự xuất hiện của các yếu tố nguy cơ mới. Hơn nữa, phương pháp điều trị cho bệnh nhân rung nhĩ ngày càng đa dạng. Ngày nay xuất hiện nhiều lựa chọn điều trị an toàn và hiệu quả hơn các thuốc trong quá khứ, chính vì vậy chúng ta nên đánh giá lại chỉ định bắt đầu khởi động kháng đông ở bệnh nhân rung nhĩ.
KẾT LUẬN
Tóm lại, có nhiều công cụ để phân tầng, đánh giá nguy cơ đột quỵ và xuất huyết ở bệnh nhân rung nhĩ, các công cụ này rất đa dạng từ lâm sàng, điện sinh lý, xét nghiệm đến di truyền học. Hơn nữa, việc đánh giá nguy cơ bằng bảng thang điểm cung cấp cho các bác sĩ lâm sàng một phương pháp được chuẩn hóa, bài bản và có thể áp dụng nhanh gọn trong thực hành lâm sàng.
- TÀI LIỆU THAM KHẢO
- Ancedy Y., Berthelot E., Lang S., Ederhy S., Boyer-Chatenet L., et al., “Is von Willebrand factor associated with stroke and death at mid-term in patients with non-valvular atrial fibrillation?”. Arch Cardiovasc Dis,(2018) 111 (5), pp. 357-369.
- Aulin J., Siegbahn A., Hijazi Z., Ezekowitz M. D., Andersson U., et al., “Interleukin-6 and C-reactive protein and risk for death and cardiovascular events in patients with atrial fibrillation”. Am Heart J,(2015) 170 (6), pp. 1151-60.
- Ayala C., Greenlund K. J., Croft J. B., Keenan N. L., Donehoo R. S., et al., “Racial/ethnic disparities in mortality by stroke subtype in the United States, 1995-1998”. Am J Epidemiol,(2001) 154 (11), pp. 1057-63.
- Banerjee A., Clementy N., Haguenoer K., Fauchier L., Lip G. Y., “Prior history of falls and risk of outcomes in atrial fibrillation: the Loire Valley Atrial Fibrillation Project”. Am J Med,(2014) 127 (10), pp. 972-8.
- Benjamin E. J., D’Agostino R. B., Belanger A. J., Wolf P. A., Levy D., “Left atrial size and the risk of stroke and death. The Framingham Heart Study”. Circulation,(1995) 92 (4), pp. 835-41.
- Dakay K., Chang A. D., Hemendinger M., Cutting S., McTaggart R. A., et al., “Left Atrial Enlargement and Anticoagulation Status in Patients with Acute Ischemic Stroke and Atrial Fibrillation”. J Stroke Cerebrovasc Dis,(2018) 27 (1), pp. 192-197.
- Ding Wern Yew, Harrison Stephanie, Gupta Dhiraj, Lip Gregory Y. H., Lane Deirdre A., “Stroke and Bleeding Risk Assessments in Patients With Atrial Fibrillation: Concepts and Controversies”. Frontiers in Medicine,(2020) 7 (54).
- Fang M., Go A., Chang Y., Hylek E., Henault L., et al., “Death and disability from warfarin-associated intracranial and extracranial hemorrhages”. The American journal of medicine,(2007) 120 8, pp. 700-5.
- Friberg L., Rosenqvist M., Lip G. Y., “Evaluation of risk stratification schemes for ischaemic stroke and bleeding in 182 678 patients with atrial fibrillation: the Swedish Atrial Fibrillation cohort study”. Eur Heart J,(2012) 33 (12), pp. 1500-10.
- Gage B. F., Birman-Deych E., Kerzner R., Radford M. J., Nilasena D. S., et al., “Incidence of intracranial hemorrhage in patients with atrial fibrillation who are prone to fall”. Am J Med,(2005) 118 (6), pp. 612-7.
- Ganesan A. N., Chew D. P., Hartshorne T., Selvanayagam J. B., Aylward P. E., et al., “The impact of atrial fibrillation type on the risk of thromboembolism, mortality, and bleeding: a systematic review and meta-analysis”. Eur Heart J,(2016) 37 (20), pp. 1591-602.
- Go A. S., Fang M. C., Udaltsova N., Chang Y., Pomernacki N. K., et al., “Impact of proteinuria and glomerular filtration rate on risk of thromboembolism in atrial fibrillation: the anticoagulation and risk factors in atrial fibrillation (ATRIA) study”. Circulation,(2009) 119 (10), pp. 1363-9.
- Gomez Outes Antonio, Terleira-Fernández Ana, Calvo Gonzalo, Suárez-Gea M., Vargas Emilio, “Dabigatran, Rivaroxaban, or Apixaban versus Warfarin in Patients with Nonvalvular Atrial Fibrillation: A Systematic Review and Meta-Analysis of Subgroups”. Thrombosis,(2013) 2013, pp. 640723.
- Gitter M. J., Jaeger T. M., Petterson T. M., Gersh B. J., Silverstein M. D., “Bleeding and thromboembolism during anticoagulant therapy: a population-based study in Rochester, Minnesota”. Mayo Clin Proc,(1995) 70 (8), pp. 725-33.
- Hamatani Y., Ogawa H., Takabayashi K., Yamashita Y., Takagi D., et al., “Left atrial enlargement is an independent predictor of stroke and systemic embolism in patients with non-valvular atrial fibrillation”. Sci Rep,(2016) 6, pp. 31042.
- He H., Guo J., Zhang A., “The value of urine albumin in predicting thromboembolic events for patients with non-valvular atrial fibrillation”. Int J Cardiol,(2016) 221, pp. 827-30.
- Hijazi Z., Oldgren J., Andersson U., Connolly S. J., Ezekowitz M. D., et al., “Cardiac biomarkers are associated with an increased risk of stroke and death in patients with atrial fibrillation: a Randomized Evaluation of Long-term Anticoagulation Therapy (RE-LY) substudy”. Circulation,(2012) 125 (13), pp. 1605-16.
- Hijazi Z., Aulin J., Andersson U., Alexander J. H., Gersh B., et al., “Biomarkers of inflammation and risk of cardiovascular events in anticoagulated patients with atrial fibrillation”. Heart,(2016) 102 (7), pp. 508-17.
- Hijazi Z., Oldgren J., Lindbäck J., Alexander J. H., Connolly S. J., et al., “The novel biomarker-based ABC (age, biomarkers, clinical history)-bleeding risk score for patients with atrial fibrillation: a derivation and validation study”. Lancet,(2016) 387 (10035), pp. 2302-2311.
- Hindricks G., Potpara T., Dagres N., Arbelo E., Bax J. J., et al., “2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS)”. Eur Heart J,(2021) 42 (5), pp. 373-498.
- Killu A. M., Granger C. B., Gersh B. J., “Risk stratification for stroke in atrial fibrillation: a critique”. Eur Heart J,(2019) 40 (16), pp. 1294-1302.
- Klatsky A. L., Friedman G. D., Sidney S., Kipp H., Kubo A., et al., “Risk of hemorrhagic stroke in Asian American ethnic groups”. Neuroepidemiology,(2005) 25 (1), pp. 26-31.
- Krishnamoorthy S., Khoo C. W., Lim H. S., Lane D. A., Pignatelli P., et al., “Prognostic role of plasma von Willebrand factor and soluble E-selectin levels for future cardiovascular events in a ‘real-world’ community cohort of patients with atrial fibrillation”. Eur J Clin Invest,(2013) 43 (10), pp. 1032-8.
- Landefeld C. Seth, Goldman Ohio Lee, “Major bleeding in outpatients treated with warfarin: incidence and prediction by factors known at the start of outpatient therapy”. The American Journal of Medicine,(1989) 87 (2), pp. 144-152.
- Lee A. Y., Levine M. N., Baker R. I., Bowden C., Kakkar A. K., et al., “Low-molecular-weight heparin versus a coumarin for the prevention of recurrent venous thromboembolism in patients with cancer”. N Engl J Med,(2003) 349 (2), pp. 146-53.
- Li A., Garcia D. A., Lyman G. H., Carrier M., “Direct oral anticoagulant (DOAC) versus low-molecular-weight heparin (LMWH) for treatment of cancer associated thrombosis (CAT): A systematic review and meta-analysis”. Thromb Res,(2019) 173, pp. 158-163.
- Link M. S., Giugliano R. P., Ruff C. T., Scirica B. M., Huikuri H., et al., “Stroke and Mortality Risk in Patients With Various Patterns of Atrial Fibrillation: Results From the ENGAGE AF-TIMI 48 Trial (Effective Anticoagulation With Factor Xa Next Generation in Atrial Fibrillation-Thrombolysis in Myocardial Infarction 48)”. Circ Arrhythm Electrophysiol,(2017) 10 (1).
- Lip G. Y., Skjøth F., Rasmussen L. H., Larsen T. B., “Oral anticoagulation, aspirin, or no therapy in patients with nonvalvular AF with 0 or 1 stroke risk factor based on the CHA2DS2-VASc score”. J Am Coll Cardiol,(2015) 65 (14), pp. 1385-94.
- Man-Son-Hing M., Nichol G., Lau A., Laupacis A., “Choosing antithrombotic therapy for elderly patients with atrial fibrillation who are at risk for falls”. Arch Intern Med,(1999) 159 (7), pp. 677-85.
- Nielsen Peter, Skjøth Flemming, Overvad Thure, Larsen Torben, Lip Gregory, “Female Sex Is a Risk Modifier Rather Than a Risk Factor for Stroke in Atrial Fibrillation: Should We Use a CHA2DS2-VA Score Rather Than CHA2DS2-VASc?”. Circulation,(2018) 137, pp. 832-840.
- Nozawa T., Inoue H., Hirai T., Iwasa A., Okumura K., et al., “D-dimer level influences thromboembolic events in patients with atrial fibrillation”. Int J Cardiol,(2006) 109 (1), pp. 59-65.
- Odén A., Fahlén M., “Oral anticoagulation and risk of death: a medical record linkage study”. Bmj,(2002) 325 (7372), pp. 1073-5.
- Olesen J. B., Fauchier L., Lane D. A., Taillandier S., Lip G. Y. H., “Risk factors for stroke and thromboembolism in relation to age among patients with atrial fibrillation: the Loire Valley Atrial Fibrillation Project”. Chest,(2012) 141 (1), pp. 147-153.
- P, “Predictors of thromboembolism in atrial fibrillation: II. Echocardiographic features of patients at risk. The Stroke Prevention in Atrial Fibrillation Investigators”. Ann Intern Med,(1992) 116 (1), pp. 6-12.
- Palareti G., Leali N., Coccheri S., Poggi M., Manotti C., et al., “Bleeding complications of oral anticoagulant treatment: an inception-cohort, prospective collaborative study (ISCOAT). Italian Study on Complications of Oral Anticoagulant Therapy”. Lancet,(1996) 348 (9025), pp. 423-8.
- Palomäki A., Mustonen P., Hartikainen J. E., Nuotio I., Kiviniemi T., et al., “Strokes after cardioversion of atrial fibrillation–The FibStroke study”. Int J Cardiol,(2016) 203, pp. 269-73.
- Piccini J. P., Stevens S. R., Chang Y., Singer D. E., Lokhnygina Y., et al., “Renal dysfunction as a predictor of stroke and systemic embolism in patients with nonvalvular atrial fibrillation: validation of the R(2)CHADS(2) index in the ROCKET AF (Rivaroxaban Once-daily, oral, direct factor Xa inhibition Compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation) and ATRIA (AnTicoagulation and Risk factors In Atrial fibrillation) study cohorts”. Circulation,(2013) 127 (2), pp. 224-32.
- Pinto A., Tuttolomondo A., Casuccio A., Di Raimondo D., Di Sciacca R., et al., “Immuno-inflammatory predictors of stroke at follow-up in patients with chronic non-valvular atrial fibrillation (NVAF)”. Clin Sci (Lond),(2009) 116 (10), pp. 781-9.
- Proietti M., Guiducci E., Cheli P., Lip G. Y., “Is There an Obesity Paradox for Outcomes in Atrial Fibrillation? A Systematic Review and Meta-Analysis of Non-Vitamin K Antagonist Oral Anticoagulant Trials”. Stroke,(2017) 48 (4), pp. 857-866.
- R, “Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation. Analysis of pooled data from five randomized controlled trials”. Arch Intern Med,(1994) 154 (13), pp. 1449-57.
- Rohla M., Weiss T. W., Pecen L., Patti G., Siller-Matula J. M., et al., “Risk factors for thromboembolic and bleeding events in anticoagulated patients with atrial fibrillation: the prospective, multicentre observational PREvention oF thromboembolic events – European Registry in Atrial Fibrillation (PREFER in AF)”.(2019) 9 (3), pp. e022478.
- Roldán V., Marín F., Muiña B., Torregrosa J. M., Hernández-Romero D., et al., “Plasma von Willebrand factor levels are an independent risk factor for adverse events including mortality and major bleeding in anticoagulated atrial fibrillation patients”. J Am Coll Cardiol,(2011) 57 (25), pp. 2496-504.
- Vazquez E., Sanchez-Perales C., Garcia-Garcia F., Castellano P., Garcia-Cortes M. J., et al., “Atrial fibrillation in incident dialysis patients”. Kidney Int,(2009) 76 (3), pp. 324-30.
- Yilmaz M. B., Guray Y., Guray U., Cay S., Caldir V., et al., “Fine vs. coarse atrial fibrillation: which one is more risky?”. Cardiology,(2007) 107 (3), pp. 193-6.
- You L. R., Tang M., “The association of high D-dimer level with high risk of ischemic stroke in nonvalvular atrial fibrillation patients: A retrospective study”. Medicine (Baltimore),(2018) 97 (43), pp. e12622.
- Zhou Y., Ma J., Zhu W., “Efficacy and Safety of Direct Oral Anticoagulants Versus Warfarin in Patients with Atrial Fibrillation Across BMI Categories: A Systematic Review and Meta-Analysis”. Am J Cardiovasc Drugs,(2020) 20 (1), pp. 51-60.







