BS. NGUYỄN PHẠM CAO MINH
TS. BS. NGUYỄN THỊ MỸ HẠNH
ĐẶT VẤN ĐỀ
Bệnh cơ tim phì đại (Hypertrophic Cardiomyopathy – HCM) là bệnh cơ tim do di truyền, thuộc nhóm những bệnh cơ tim nguyên phát phổ biến nhất trên toàn cầu, với tỉ lệ hiện mắc không có triệu chứng trong khoảng 1/500 đến 1/200. Dù vậy, những dữ liệu ghi nhận được về bệnh cơ tim phì đại hiện nay chỉ được ví như “phần nổi của tảng băng chìm”, với số ca mắc thực sự ước tính lên đến 20 triệu, và số ca chẩn đoán xác định hiện nay chỉ chiếm 1/7 tổng số bệnh nhân HCM thực tế [1,2]. Bệnh cơ tim phì đại còn là nguyên nhân thường gặp nhất gây đột tử trong hơn 1/3 các trường hợp ở người trẻ [3]. Các biến chứng nặng nề khác bao gồm suy tim (38%), rung nhĩ (25%) hay đột quỵ (10%) [4,5]. Vì vậy, chẩn đoán sớm, phân tầng nguy cơ và can thiệp điều trị thích hợp rất quan trọng để ngăn chặn các biến cố và giảm gánh nặng bệnh tật.
Những bằng chứng khoa học và khuyến cáo mới nhất hiện nay về bệnh cơ tim phì đại đều nhấn mạnh vai trò của cộng hưởng từ tim (Cardiac Magnetic Resonance – CMR) trong chẩn đoán cũng như hỗ trợ quyết định điều trị HCM. Với khả năng cung cấp hình ảnh ba chiều, độ phân giải không gian và thời gian tốt và không phơi nhiễm bức xạ ion hóa, CMR là kỹ thuật hình ảnh phù hợp để mô tả các dạng kiểu hình phì đại cơ tim trong HCM. Ngoài ra nhờ vào thế mạnh đánh giá đặc tính mô học của cơ tim cũng như các cơ quan khác, CMR còn ưu thế trong việc làm rõ hơn nguyên nhân nền gây phì đại cơ tim, phân biệt HCM với các tình trạng phì đại do thích nghi hoặc bệnh lý khác như bệnh thâm nhiễm, bệnh dự trữ…[6] Bài viết này sẽ thảo luận vai trò của CMR trong tiếp cận, chẩn đoán, theo dõi bệnh HCM, và cập nhật những tiến bộ kỹ thuật mới của CMR, hứa hẹn gia tăng hiệu quả quản lý bệnh lý này.
1. TỔNG QUAN BỆNH CƠ TIM PHÌ ĐẠI
1.1 Định nghĩa và sinh lý bệnh
HCM là tình trạng rối loạn nguyên phát của cơ tim, xảy ra do đột biến di truyền, được định nghĩa bởi sự hiện diện của phì đại cơ tim thất trái không giải thích được bằng những nguyên nhân xác định khác như tăng tải áp lực thất trái hay bệnh cơ tim thâm nhiễm và dự trữ [7].
Những nghiên cứu bệnh học cho thấy phì đại bất xứng là kiểu hình hay gặp ở HCM. Tắc nghẽn buồng tống thất trái do phì đại và biến đổi của van hai lá, bộ máy dưới van cũng thường xuất hiện ở bệnh nhân HCM. Các phân tích giải phẫu bệnh ghi nhận nguyên nhân phì đại bởi tình trạng mất trật tự sắp xếp tế bào cơ tim, tăng liên kết các cầu nối myosin tại đơn vị cơ (sarcomere), kèm xơ hóa mô kẽ làm tăng thể tích khoang ngoại bào. Do tình trạng phì đại, tắc nghẽn và xơ hóa cơ tim, HCM thường gây ra hậu quả rối loạn chức năng tâm thu, thiếu máu cơ tim, rối loạn nhịp và cuối cùng là suy giảm chức năng tâm thu thất trái ở giai đoạn muộn [8].
1.2 Chẩn đoán bệnh cơ tim phì đại
Chẩn đoán lâm sàng của HCM trên người lớn được thiết lập trên các phương tiện hình ảnh học (siêu âm tim 2D hoặc cộng hưởng từ tim) khi:
- Xác định ít nhất 1 vùng cơ tim ở bất cứ phân vùng nào của thất trái có bề dày thành tối đa cuối thì tâm trương ≥15 mm.
- Không ghi nhận nguyên nhân khác lý giải hiện tượng phì đại này.
Mức độ phì đại cơ tim thấp hơn với bề dày thành tim 13–14 mm cũng có thể thiết lập chẩn đoán HCM ở bệnh nhân có thân nhân quan hệ huyết thống bậc một mắc HCM hoặc đã xác định mang gen gây bệnh cơ tim phì đại [9].
Ở trẻ em, ngưỡng bề dày thành tim để thiết lập chẩn đoán HCM cần được hiệu chỉnh theo diện tích da cơ thể (BSA). Chẩn đoán HCM ở trẻ em khi bề dày thành tim hiệu chỉnh theo diện tích da lớn hơn 2 độ lệch chuẩn (z-score > +2 SD) so với giá trị trung bình ở cùng độ tuổi [10].
Trên lâm sàng, chẩn đoán HCM tuân theo lưu đồ tiếp cận, đề xuất từ khuyến cáo của Hiệp hội Tim mạch Châu Âu về quản lý điều trị bệnh cơ tim năm 2023. Tiếp cận HCM bắt đầu từ triệu chứng lâm sàng gợi ý bệnh như khó thở, nặng ngực, hồi hộp hoặc ngất; tiền sử gia đình, nhất là thân nhân bậc một có bệnh cơ tim phì đại; cũng như các dấu hiệu khác trên điện tâm đồ, xét nghiệm sinh hóa. Tiếp cận đa phương thức hình ảnh học đóng vai trò trung tâm là phương tiện tiếp theo để xác định kiểu hình phì đại, phân biệt các nhóm bệnh có kiểu hình cơ tim trùng lắp về mặt giải phẫu cũng như đánh giá chức năng tim ở những bệnh nhân này (Hình 1).
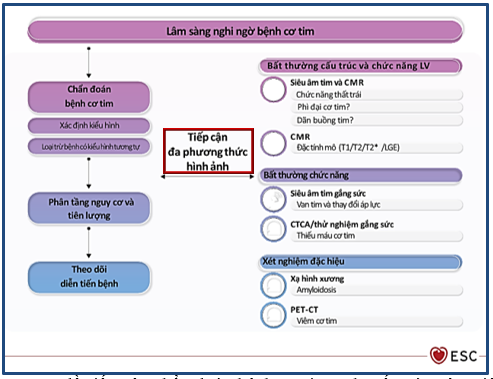
Hình 1: Lưu đồ tiếp cận chẩn đoán bệnh cơ tim. Khuyến cáo của Hiệp hội Tim mạch Châu Âu về quản lý điều trị bệnh cơ tim năm 2023. Nguồn: Arbelo E, European heart journal, 2023 [10].
1.3 Cộng hưởng từ tim đối với bệnh cơ tim phì đại theo các hướng dẫn hiện hành
Trước đây, siêu âm tim (SAT) là công cụ chủ yếu sử dụng trong HCM, với ưu điểm không xâm lấn, dễ thực hiện và có khả năng xác định kiểu hình phì đại, đánh giá huyết động tim, mức độ tắc nghẽn buồng tống[8]… Tuy nhiên, với sự phát triển của các kỹ thuật mới, đặc biệt khi khuyến cáo Quản lý điều trị bệnh cơ tim năm 2023 của Hiệp hội Tim mạch châu Âu đưa ra hướng dẫn đánh giá từ bản chất xơ hóa hoặc chuyển sản mỡ cơ tim, thay vì chỉ chú trọng kiểu hình và chức năng cơ tim [10], cộng hưởng từ tim được khuyến cáo dùng để đánh giá bước đầu ở mọi bệnh nhân nghi ngờ bệnh cơ tim để chẩn đoán bệnh (Khuyến cáo loại I – mức chứng cứ B).
Cộng hưởng từ tim kết hợp được hai ưu thế về khả năng chẩn đoán không xâm lấn và không hạn chế về cửa sổ khảo sát, đặc biệt ở những vùng cơ tim dễ bị bỏ qua với các mặt cắt trên siêu âm tim. Ngoài ra khả năng đánh giá đặc tính mô với nhiều chuỗi xung mới đã và đang được phát triển như mapping và khảo sát tăng tín hiệu muộn (LGE), cộng hưởng từ tim còn giúp xác định bản chất và mức độ tiến triển, phân tầng nguy cơ và theo dõi bệnh[10] (Khuyến cáo loại IIa – mức chứng cứ C).
Đối với tầm soát bệnh, trên cơ sở sự phát triển của các xét nghiệm di truyền, việc xác định biểu hiện bệnh cơ tim phì đại (phenotype +) ở những đối tượng nguy cơ cao như thân nhân bậc một của bệnh nhân HCM, người đã được xác nhận mang gen bệnh HCM (genotype +)… hoặc theo dõi phát hiện sớm ở những bệnh nhân chưa biểu hiện kiểu hình (phetotype -) cần vai trò của các công cụ không xâm lấn (Ví dụ: Hình 2). CMR cũng được khuyến cáo ở các nhóm đối tượng này với Khuyến cáo loại IIa – mức chứng cứ B[10].
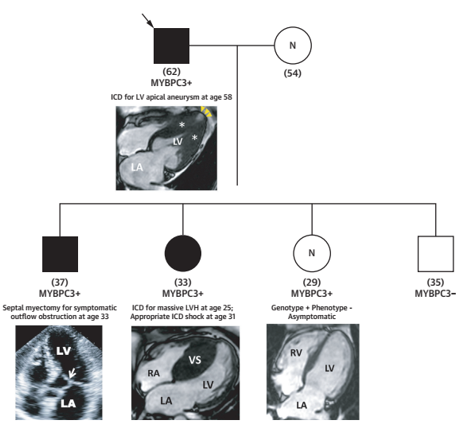
Hình 2: Ví dụ tầm soát kiểu hình bệnh cơ tim phì đại ở thân nhân bậc một với bệnh nhân HCM có gen MYBPC3 +. Nguồn: Arbelo E, European heart journal, 2023 [10]
.
2. VAI TRÒ CỘNG HƯỞNG TỪ TIM ĐỐI VỚI BỆNH CƠ TIM PHÌ ĐẠI
2.1 Đối với chẩn đoán bệnh cơ tim phì đại
2.1.1 Chẩn đoán bệnh cơ tim phì đại
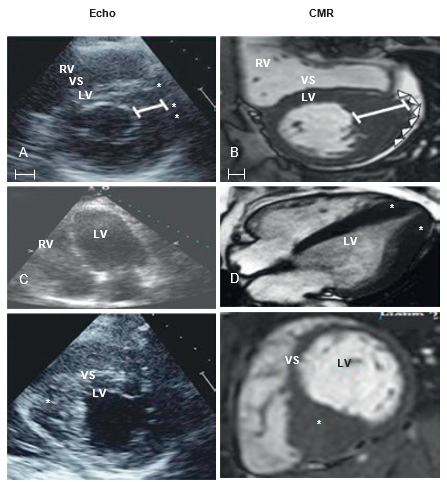
CMR có thể tăng độ chính xác cũng như độ lặp lại khi phân tích bề dày thành cơ tim, khối lượng cơ tim, đánh giá giải phẫu và chức năng buồng tâm thất trái và phải. Chuỗi xung balanced steady-state free precession (bSSFP) có độ tương phản cao giữa hồ máu (trắng) và cơ tim (tối) với phân lớp rõ ràng giới hạn nội tâm mạc và thượng tâm mạc, giúp tránh nhầm lẫn giữa cơ tim thật sự và lớp cơ bè trong buồng tim, cung cấp thông tin chính xác hơn về độ dày thành tim, khối lượng cơ tim, thể tích buồng tim và định lượng phân suất tống máu (Hình 3). Ngoài ra do không hạn chế về mặt cắt, một số vùng cơ thường bị bỏ sót trên siêu âm tim như vùng thành bên-dưới, thành dưới-vách và vùng mỏm tim có thể được ghi nhận trên CMR (Hình 4). Nghiên cứu của Debbie Zhao và cộng sự[11] năm 2021 so sánh CMR và siêu âm tim 3D cho thấy trong một số điều kiện hạn chế về cửa sổ khảo sát, siêu âm đánh giá không tối ưu thể tích và chức năng co bóp tim so với CMR. Trong một số nghiên cứu khác, CMR phát hiện phì đại cơ tim nhiều hơn 6% so với
siêu âm tim, với bề dày thành tim thì tâm trương thấp hơn khoảng 20% so với siêu âm tim [12].
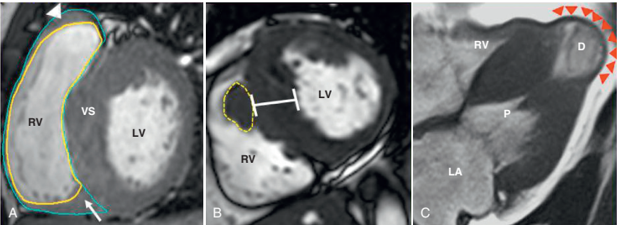
Hình 3: Ưu thế về độ tương phản trên CMR. (A) Kiểu hình phì đại cả thất trái và thất phải được ghi nhận trên CMR (B) Dải cơ lòng thất phải thường bị nhầm lẫn vào bề dày cơ tim vách liên thất, được phân biệt khá rõ trên CMR (C) Vùng mỏm tim thường có xảo ảnh bởi khí và mô lồng ngực trên siêu âm, các trường hợp phình mỏm được phát hiện khá tốt trên CMR. Nguồn: Ethan J. Rowin, Cardiovascular magnetic resonance: A companion to Braunwald’s heart disease, 2018 [13].
Hình 4: Các vùng hạn chế trên siêu âm tim so với CMR. (A) SAT: độ dày thành trước bên là 18mm; bờ tim và cấu trúc phụ không rõ (dấu sao). (B) CMR ở cùng bệnh nhân cho thấy rõ bờ tim (mũi tên), dày rõ thành trước bên (35 mm), là yếu tố nguy cơ đột tử; (C) SAT:thất trái bình thường. (D) CMR: phì đại không liên tục mỏm thất trái (dấu sao); (E) SAT: thành dưới vách dày 21 mm (dấu sao). (F) CMR: thành dưới vách dày 41 mm. Nguồn: Ethan J. Rowin, Cardiovascular magnetic resonance: A companion to Braunwald’s heart disease, 2018 [13].
Các kiểu hình phì đại thường gặp trên lâm sàng ở bệnh nhân HCM có 4 loại chính: (1) Vách liên thất Sigmoid , (2)Vách liên thất dạng cong ngược (reverse curve), (3) Thể mỏm và (4) Vách liên thất trung tính (Hình 5). Kiểu hình vách liên thất Sigmoid thường liên quan với tắc nghẽn buồng tống thất trái, trong khi kiểu hình phì đại thể mỏm có thể kèm theo phình mỏm tim (Hình 4), là yếu tố tiên lượng độc lập nguy cơ đột tử tim ở bệnh nhân HCM[14].
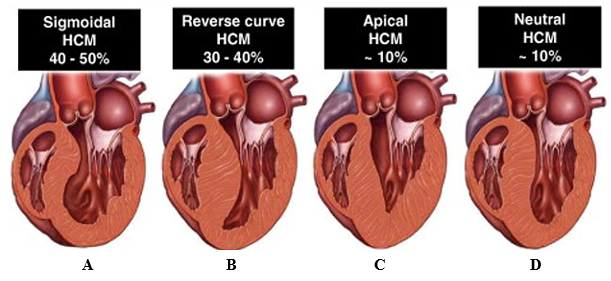
Hình 5: Các kiểu hình bệnh cơ tim phì đại và tần suất trên lâm sàng. (A) Vách liên thất Sigmoid, (B) Vách liên thất dạng cong ngược, (C) Thể mỏm, (D) Vách liên thất trung tính. Nguồn: Bos J. Martijn, Journal of the American College of Cardiology, 2009 [15].
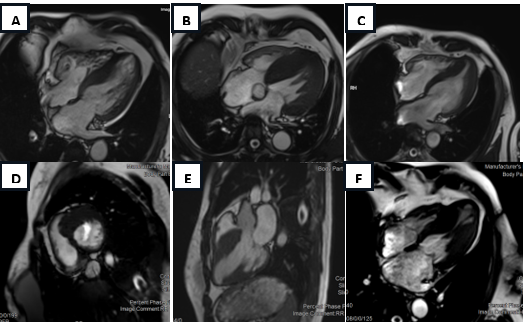
Hình 6: Hình ảnh thực tế trên bệnh nhân HCM thực hiện tại bệnh viện Tâm Anh Hồ Chí Minh. (A) Vách liên thất Sigmoid, (B) Vách liên thất dạng cong ngược, (C) Thể mỏm, (D), (E) Vách liên thất Sigmoid, (F) Thể mỏm kèm phình mỏm thất trái.
Vì các ưu điểm nêu trên, CMR đã được khuyến cáo là kỹ thuật tiếp cận ban đầu để chẩn đoán bệnh cơ tim phì đại.
2.1.2 Chẩn đoán phân biệt bệnh cơ tim phì đại
Tiêu chuẩn chẩn đoán bệnh cơ tim phì đại nêu rõ cần loại trừ các nguyên nhân nền gây tăng tải áp lực hoặc bệnh có cơ chế thâm nhiễm, tăng dự trữ gây phì đại cơ thất tương tự kiểu hình HCM. Với các kỹ thuật mới phát triển, CMR có vai trò ngày càng đáng kể, góp phần vào phân nhóm, định hướng chẩn đoán xác định (Hình 6) [16]. Những kỹ thuật này bao gồm hình ảnh tăng tín hiệu muộn cơ tim với gadolinium trên chuỗi xung LGE (Late Gadolinium Enhancement), bản đồ thời gian thư giãn cơ tim T1 (T1 mapping), T2 (T2 mapping) và đánh giá thể tích khoang ngoại bào ECV (Extracellular volume).
Đối với HCM, các tình trạng cần phân biệt bao gồm phì đại cơ tim do đáp ứng sinh lý thích nghi với cường độ hoạt động mạnh (tim vận động viên) hoặc do tải áp lực (thường gặp do tăng hậu tải ở bệnh nhân tăng huyết áp); và các tình trạng bệnh lý không do thích nghi, với hai bệnh lý thường gặp nhất là bệnh cơ tim thâm nhiễm amyloid và bệnh dự trữ sphingolipid ở cơ tim – Anderson Fabry. Ngoài ra còn một số tình trạng khác như bệnh Danon, bệnh ty thể…[16]
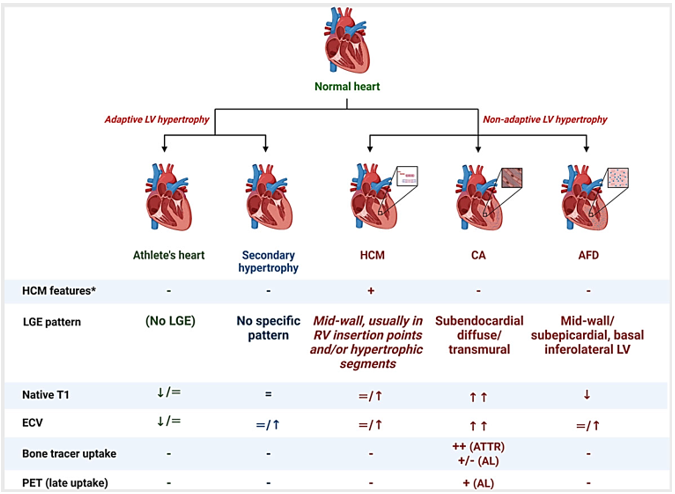
Hình 6: Tóm tắt đặc điểm phân biệt HCM với các tình trạng phì đại cơ tim khác. LV: thất trái; LGE: tăng tín hiệu muộn; CA: bệnh cơ tim amyloid; AFD: bệnh Anderson Fabry; AL: Bệnh amyloidosis chuỗi nhẹ; ATTR: Bệnh amyloidosis do rối loạn transthyretin. Nguồn: Brenda Moura, European Journal of Heart Failure, 2023 [16].
Ở chuỗi xung T1 mapping, thời gian T1 được đo trước khi tiêm thuốc cản từ gadolinium cho phép ghi nhận giá trị T1 thuần của cơ tim. Giá trị này sẽ được định lượng, biểu hiện dưới dạng thời gian thư giãn dọc (T1), đơn vị mili giây. Thời gian này có độ nhạy cao với các thay đổi ở mô cơ tim. So với cơ tim bình thường, thời gian thư giãn T1 giảm khi cơ tim lắng đọng sắt hay mỡ, tăng khi cơ tim tăng sợi xơ hóa, lắng đọng protein hay giữ nước trong phù cơ tim. T1 mapping cơ tim thay đổi khi có bất thường bất kể ở nội bào, khoang ngoại bào hoặc cả hai.
Ngược lại, thể tích khoang ngoại bào (ECV) chỉ phản ánh tổn thương làm tăng thể tích khoang giữa các tế bào cơ tim. Bằng thuốc tương phản từ gadolinium (chất làm rút ngắn thời gian thư giãn T1 của mô ngấm thuốc), mức khác biệt thời gian thư giãn T1 của cơ tim trước và sau tiêm thuốc, hiệu chỉnh với Hct của bệnh nhân, phản ánh phần trăm cơ tim chiếm bởi khoang ngoại bào. Dung tích khoang này tăng khi có bệnh lý tích tụ các sợi xơ hóa ở mô kẽ.
Chuỗi xung ghi nhận tăng tín hiệu muộn cơ tim (LGE) cũng xác định tình trạng xơ hóa cơ tim. Tuy nhiên, tín hiệu cơ tim chỉ tăng thì muộn khi có tình trạng đào thải (wash-out) chậm thuốc tương phản khỏi cơ tim, bởi tổn thương tế bào cơ tim và / hoặc thay thế tế bào cơ tim bằng mô xơ, tạo điều kiện lưu lại thuốc tương phản thì muộn tại những tổn thương này. Ở mô cơ tim còn toàn vẹn tế bào, tín hiệu cơ tim giai đoạn muộn thường không tăng do thuốc đã wash-out hết. Bởi tính đặc trưng tổn thương cơ tim của từng bệnh lý riêng biệt, chuỗi xung LGE có giá trị phân biệt với độ đặc hiệu cao[16].
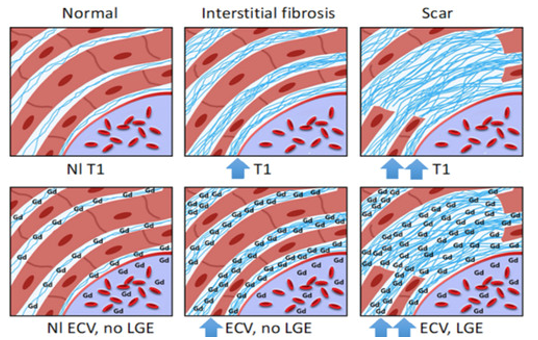
Hình 7: Thay đổi T1, ECV và LGE ở cơ tim bình thường (trái) – xơ hóa mô kẽ, tế bào toàn vẹn (giữa) – sẹo thay thế tế bào bằng mô xơ và xơ hóa mô kẽ (phải). Nguồn: Sruti Rao, Circulation: Cardiovascular Imaging, 2022 [17].
Bệnh nhân HCM: kiểu hình đặc trưng bao gồm phì đại bất xứng, tắc nghẽn buồng tống thất trái, có thể kèm theo bất thường / phì đại cơ trụ, tồn tại một số rãnh trong cơ tim. Thời gian thư giãn T1 và ECV thường tăng nhẹ ở bệnh nhân HCM. Kiểu hình phân bố LGE thường không đặc hiệu, tuy nhiên thường hiện diện ở vùng cơ tim có phì đại, vị trí ở lớp giữa cơ tim (mid-wall) dạng đốm (patchy), và thường không ảnh hưởng vùng dưới nội mạc cơ tim.
Tim vận động viên: Tim vận động viên có kiểu hình phì đại lệch tâm kèm theo dãn tương đối buồng thất trái so với phì đại bất xứng và thu nhỏ buồng tim ở bệnh HCM[18]. Bề dày thành thất trái tim vận động viên thường < 15mm. Biến dạng cơ tim bảo tồn có thể hữu ích trong phân biệt phì đại cơ tim sinh lý và bệnh lý [13]. Hơn nữa, ở tim vận động viên sẽ không ghi nhận rối loạn động năng thất trái cũng như không có xơ hóa cơ tim trên chuỗi xung LGE.
Bệnh cơ tim do tăng huyết áp: Trước đây, phân biệt HCM và bệnh cơ tim do tăng huyết áp thường khó khăn. CMR có thể giúp phân biệt nhóm bệnh này dựa vào kiểu hình cơ tim phì đại. Ở bệnh nhân tăng huyết áp hệ thống lâu năm, phì đại cơ tim đồng tâm (phì đại gần tương đương ở vách và thành bên) là chủ yếu, trong khi phần lớn bệnh nhân HCM có kiểu phì đại lệch tâm. CMR cũng giúp ích khi kiểm tra định kỳ độ dày thành thất trái sau khi đã kiểm soát huyết áp. Độ dày thất trái giảm sau điều trị gợi ý chẩn đoán bệnh cơ tim do tăng huyết áp. Một nghiên cứu năm 2022 của Shengliang Liu và cộng sự [19] cho thấy mô hình kết hợp giữa thông số biến dạng cơ tim (hướng tâm và chu vi) với hình ảnh xơ hóa trên chuỗi xung LGE (khác biệt rõ nhất ở vùng giữa vách liên thất – Hình 8) cho thấy giá trị chẩn đoán phân biệt cao với diện tích dưới đường cong AUC 0.835, độ nhạy 89% và độ đặc hiệu 70%.
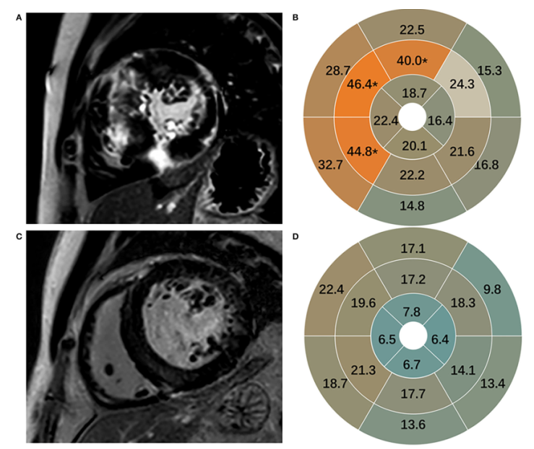
Hình 8. Hình ảnh xơ hóa: A,B: HCM – C,D: Bệnh cơ tim tăng huyết áp. Nguồn: Shengliang Liu, Frontiers in Cardiovascular Medicine, 2022 [19].
Tăng sinh cơ bè quá mức: Trên hình ảnh siêu âm, cơ bè dày có thể bị nhầm lẫn là cơ tim phì đại, dẫn đến sai lệch chẩn đoán. Nhờ vào độ tương phản mô khi khảo sát mỏm thất trái, CMR có thể xác định hình ảnh tăng cơ bè nổi bật thay vì chẩn đoán HCM thể mỏm. Việc phân biệt có ý nghĩa quan trọng trong điều trị do tình trạng tăng sinh cơ bè có hướng tiếp cận khác biệt.
Bệnh cơ tim thâm nhiễm: Bệnh cơ tim thâm nhiễm, bao gồm amyloidosis hoặc bệnh dự trữ glycogen/ lysosomal (bệnh Anderson-Fabry hoặc bệnh Danon) có thể biểu hiện tương tự hình ảnh HCM bởi biểu hiện kiểu hình các bệnh này cũng có phì đại cơ tim. Trong bệnh amyloidosis, CMR ghi nhận phì đại cơ tim đồng tâm kết hợp hình ảnh LGE lan tỏa toàn thể lớp dưới nội mạc hoặc xuyên thành, T1 và ECV đều tăng cao do amyloid lắng đọng ở mô kẽ làm tăng thể tích khoang ngoại bào nhiều. Đối với bệnh Anderson- Fabry (AFD), biểu hiện chính là phì đại thất trái đồng tâm kèm với hình ảnh LGE đặc trưng ở vùng đáy thành dưới-bên. Do tính chất lắng đọng sphingolipid trong nội bào cơ tim kết hợp không bào khổng lồ, thời gian thư giãn T1 cơ tim AFD giảm so với cơ tim bình thường, trong khi khoang ngoại bào không bị ảnh hưởng nên ECV có giá trị bình thường (Hình 9).
Mặc dù hình ảnh CMR có thể gợi ý bệnh cơ tim thâm nhiễm, việc chẩn đoán xác định cần kết hợp xét nghiệm di truyền, xạ hình và xét nghiệm giải phẫu bệnh.
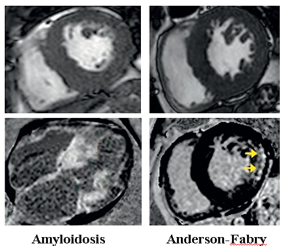
Hình 9. Kiểu hình một số bệnh gây phì đại cơ tim trên chuỗi xung giải phẫu CINE và xơ hóa/ LGE (mũi tên). Nguồn: Evan Appelbaum, Cardiovascular magnetic resonance: A companion to Braunwald’s heart disease, 2018 [13].
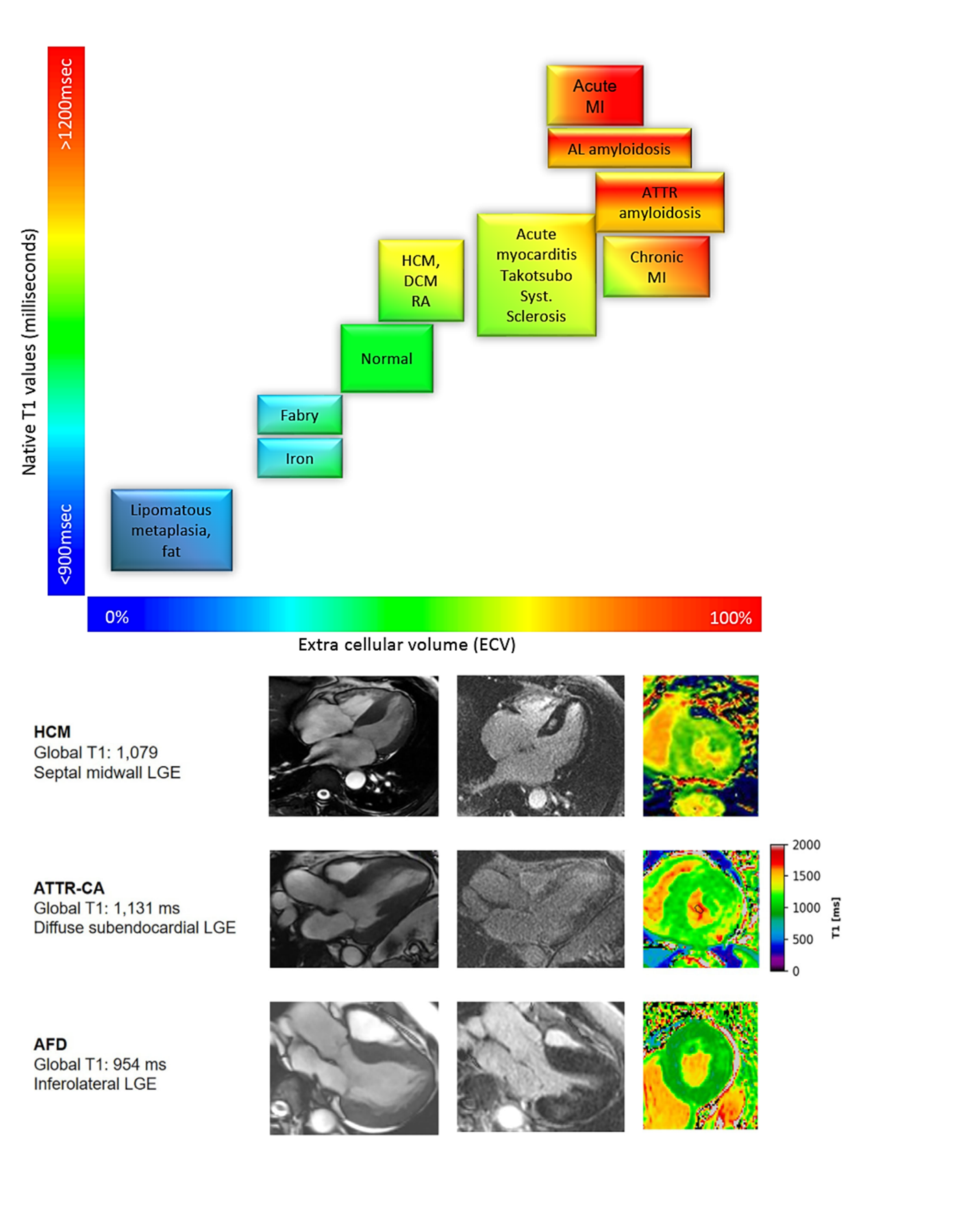
Hình 10. Hình trên: Thay đổi T1 và ECV trong một số bệnh lý. Hình dưới: Hình ảnh thực tế 3 trường hợp HCM (T1 tăng nhẹ), bệnh cơ tim amyloid ATTR (T1 tăng) và AFD (T1 giảm). Nguồn: Brenda Moura, European Journal of Heart Failure, 2023 [16].
2.2 Đối với điều trị và tiên lượng bệnh cơ tim phì đại
Những phương pháp điều trị mới hiện nay, với khả năng cá thể hóa theo vấn đề ở từng bệnh nhân, đã giúp giảm thiểu tỉ lệ tử vong rõ rệt ở bệnh nhân HCM. Tỉ lệ tử vong đã giảm hơn 10 lần từ 6% một năm xuống chỉ còn 0.5% theo các nghiên cứu mới. Tiếp cận điều trị bệnh nhân HCM trong các khuyến cáo hiện nay có 4 nhóm mục tiêu chính: (1) Điều trị phòng ngừa đột tử; (2) Điều trị tắc nghẽn buồng tống; (3) Điều trị suy tim do xơ hóa cơ tim; (4) Điều trị theo dõi rung nhĩ [14].
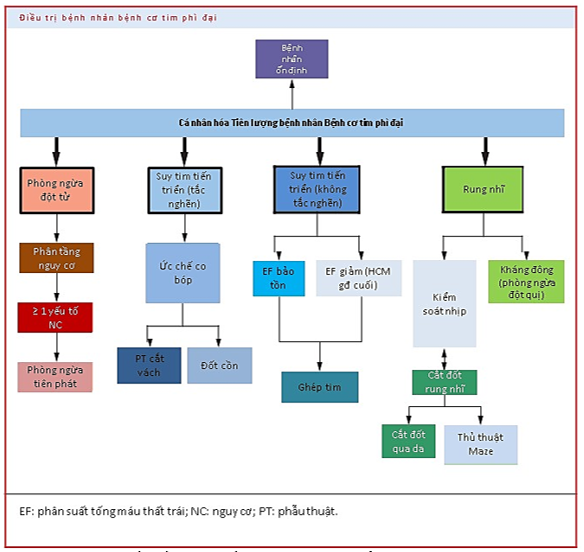
Hình 11. Lưu đồ tiếp cận điều trị HCM. Nguồn: Maron BJ, Journal of the American College of Cardiology, 2022 [14].
2.2.1 Cộng hưởng từ tim đối với điều trị phòng ngừa đột tử tim ở bệnh nhân HCM
Đột tử tim là biến chứng quan trọng nhất cần kiểm soát sau khi thiết lập chẩn đoán bệnh cơ tim phì đại. Đột tử tim chắc chắn do HCM chiếm đến 36% và đột tử khả năng do HCM chiếm 8% tổng trường hợp đột tử ở vận động viên trẻ tuổi , trên nghiên cứu thực hiện tại Hoa Kỳ [9].
Xơ hóa cơ tim tăng trong bệnh HCM là cơ chế chính gây ra rối loạn nhịp và đột tử tim (SCD). Ngoài ra, các đột biến gen HCM gây giảm độ nhạy cảm với ion Ca++ ở sợi dày (myosin), nhưng lại tăng độ nhạy với ion này ở sợi mỏng (actin) của phức hợp cơ tim sarcomere, làm tích tụ Ca++ thì tâm trương, dẫn đến thay đổi thời gian điện thế hoạt động, hình thành vòng vào lại, khởi phát các hậu khử cực sớm (EAD) hoặc hậu khử cực muộn (DAD), tiếp đó gây ra loạn nhịp trong HCM [20].Trên cơ sở sinh lý bệnh, việc đánh giá mức độ xơ hóa cơ tim đã được nghiên cứu để dự đoán nguy cơ loạn nhịp và đột tử ở bệnh nhân HCM.
Trong điều trị phòng ngừa đột tử tim, nhiều mô hình lâm sàng và / hoặc cận lâm sàng đã và đang được phát triển để dự đoán, phân tầng nguy cơ xuất hiện đột tử để bác sĩ lâm sàng lựa chọn kế hoạch điều trị phù hợp phòng ngừa tình trạng này. Các mô hình lâm sàng được sử dụng hiện nay gồm:
- Thang điểm nguy cơ đột tử (HCM Risk – SCD)/ khuyến cáo chẩn đoán và điều trị bệnh HCM của Hiệp hội tim mạch châu Âu năm 2014: phân nhóm nguy cơ đột tử < 4%; 4-6%; và > 6%, được tính từ phương trình hồi quy bởi các yếu tố: Bề dày thành tối đa, Đường kính nhĩ trái, Chênh áp tối đa qua buồng tống thất trái, Tiền sử đột tử tim gia đình, Nhịp nhanh thất không dai dẳng, Ngất và Tuổi bệnh nhân [21].
- Mô hình dự đoán nguy cơ đột tử theo khuyến cáo chẩn đoán và điều trị bệnh HCM của Hiệp hội tim mạch / Trường môn Tim mạch Hoa kỳ năm 2020: nguy cơ đột tử cao khi có một trong số các yếu tố nguy cơ đột tử lớn, bao gồm: tiền căn thân nhân đột tử, bề dày thành tim tối đa ≥30 mm, ngất chưa rõ nguyên nhân, nhịp nhanh thất không dai dẳng, phình mỏm thất trái, LGE ≥15% khối cơ và LVEF <50% [22].
- Mô hình dự đoán nguy cơ đột tử theo khuyến cáo quản lý điều trị bệnh nhân loạn nhịp thất và phòng ngừa đột tử tim của Hiệp hội tim mạch châu Âu năm 2022: kết hợp thang điểm HCM Risk – SCD và các yếu tố nguy cơ đột tử lớn [23].
Bảng 1. Khuyến cáo chỉ định đặt máy phá rung phòng ngừa đột tử tim ở bệnh nhân HCM. ICD-COR IIa: khyến cáo loại IIa cho chỉ định ICD; ICD-COR IIb: khyến cáo loại IIb cho chỉ định ICD; ICD-COR III: khyến cáo loại III cho chỉ định ICD; LVEF: phân suất tống máu thất trái; LGE: tăng tín hiệu muộn; Nguồn: Wang J, European heart journal, 2023 [24].
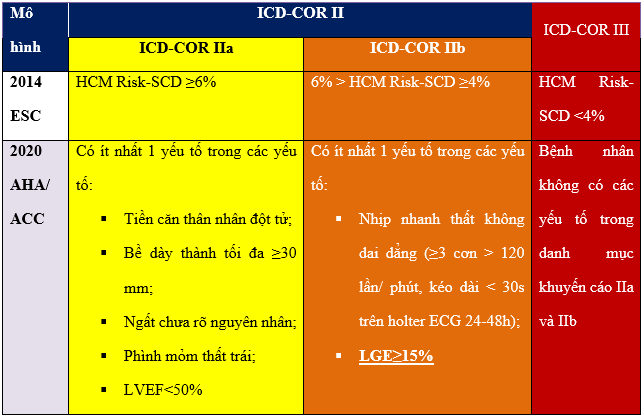

Từ năm 2020, tỉ lệ xơ hóa cơ tim trên tổng khối cơ thể hiện qua phần trăm cơ tim tăng tín hiệu muộn đã được đưa vào là một trong các yếu tố nguy cơ lớn gây ra đột tử ở bệnh nhân HCM. Nghiên cứu của tác giả Jiaxin Wang và cộng sự [24] khi so sánh giá trị tiên đoán đột tử tim ở bệnh nhân HCM đã cho thấy các mô hình có kết hợp yếu tố nguy cơ lớn (mô hình 2020 AHA/ACC và mô hình 2022 ESC) có độ nhạy và độ đặc hiệu cao hơn, với diện tích dưới đường cong tiên đoán AUC đạt 0.76 so với các mô hình khác chỉ có AUC <0.7.
Một phân tích gộp về mối liên quan giữa LGE và đột tử cho thấy nguy cơ đột tử được ghi nhận có thể tăng đến 1.7 lần khi có hiện diện LGE, mối tương quan giữa mức độ LGE định lượng và nguy cơ đột tử là tương quan chặt [13].
Nghiên cứu đa trung tâm thực hiện bởi Chan và cộng sự [25] trên gần 1300 bệnh nhân HCM với thời gian theo dõi trung bình 3 năm sau chụp CMR, cho thấy độ lan tỏa của LGE càng nhiều thì các biến cố đột tử cũng như tỉ lệ tử vong chung đều tăng theo (Hình 12), trong đó LGE ≥15% khối lượng cơ thất trái làm tăng gấp đôi nguy cơ đột tử. Trong khi đó, các bệnh nhân không có LGE biểu hiện lành tính và ít có nguy cơ xảy ra biến cố.
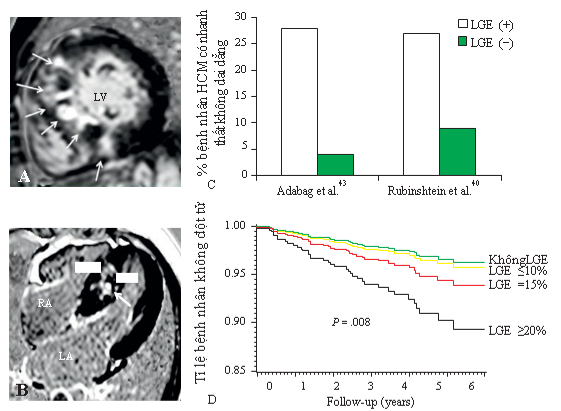
Hình 12. Mối tương quan giữa LGE và đột tử ở bệnh nhân HCM. (A,B) Hình ảnh LGE ở hai bệnh nhân khác nhau, cả hai đều có LGE lan tỏa toàn bộ vách liên thất. (C) tỉ lệ nhanh thất không dai dẳng trên holter ECG 24h cao gấp 7 lần ở nhóm bệnh nhân có LGE. (D) Mối tương quan giữa LGE và biến cố đột tử ở 1293 bệnh nhân HCM. Nguồn: Kramer CM, American heart journal, 2015 [25].
Nghiên cứu của Simon Greulich và cộng sự [26] công bố năm 2021 thực hiện trên hơn 200 bệnh nhân HCM với thời gian theo dõi hơn 10 năm cũng cho thấy mối tương quan giữa LGE và biến cố đột tử, tăng dần theo mức độ gia tăng của LGE. Trong nghiên cứu theo dõi dài hạn này, tác giả ghi nhận chỉ cần mức LGE > 5% khối cơ thất trái đã cho thấy sự khác biệt có ý nghĩa thống kê so với nhóm LGE thấp hơn 5%, AUC 0.75 với độ nhạy 85% và độ đặc hiệu 67%, gợi ý khả năng phát hiện sớm hơn nguy cơ đột tử với mức độ xơ hóa thấp hơn.
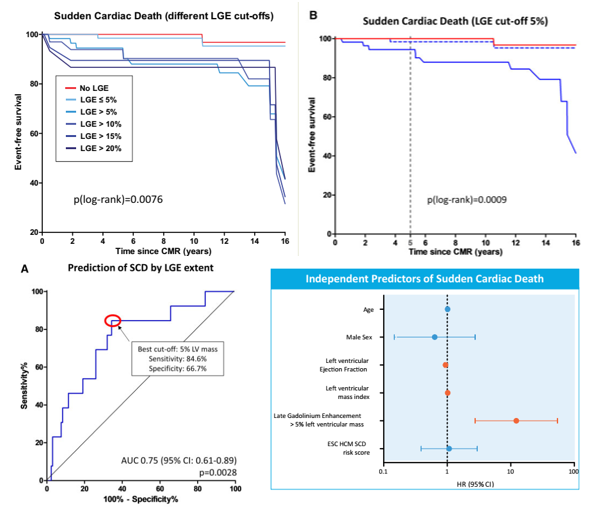
Hình 13. LGE là yếu tố tiên lượng độc lập đột tử tim, với tiên lượng sống còn càng thấp với mức LGE càng cao. Mức LGE ở ngưỡng 5% đã có giá trị phân biệt nguy cơ đột tử. Nguồn: Greulich S, European Heart Journal-Cardiovascular Imaging, 2021 [26].
Trong cộng hưởng từ tim, tăng tín hiệu muộn được thực hiện bởi chuỗi xung LGE, thực hiện xóa tín hiệu cơ tim bình thường ở thì muộn (10 phút) sau tiêm thuốc cản quang. Những vùng cơ tim có tổn thương tế bào sẽ đào thải thuốc tương phản chậm hơn, có thời gian thư giãn ngắn hơn và biểu hiện bằng vùng tăng tín hiệu trên hình ảnh CMR (Hình 14). Nhiều kỹ thuật đã được đề xuất để đánh giá định lượng mức độ lan tỏa LGE trong bệnh HCM. Các phương pháp được sử dụng rộng rãi nhất bao gồm: (1) phương pháp bán tự động xác định các điểm tín hiệu cao của LGE, sau khi đã mã hóa tín hiệu cơ tim thành các điểm màu xám đậm đến nhạt với độ lệch chuẩn từ +1SD đến +6SD so với giá trị cơ tim bình thường; và (2) phương pháp Full width at half maximum (FWHM) xác định các điểm màu có tín hiệu cường độ trên 50% so với điểm màu có cường độ của LGE lớn nhất (sáng nhất). Khuyến cáo Chẩn đoán và Điều trị bệnh cơ tim phì đại năm 2020 của Hiệp hội Tim mạch châu Âu đề nghị sử dụng ngưỡng +5-6 SD để xác định vùng tăng tín hiệu này là xơ hóa cơ tim trên cộng hưởng từ, khi làm nghiên cứu so sánh với các
vùng tổn thương trên giải phẫu bệnh[22].
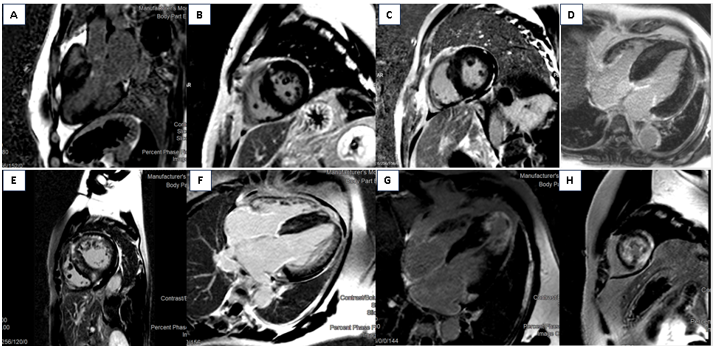
Hình 14. LGE ở bệnh nhân HCM thực hiện tại bệnh viện đa khoa Tâm Anh Hồ Chí Minh. A,B: LGE dạng đốm (patchy) ở vùng dày, đáy thành trước vách và điểm tiếp nối cơ tim thất trái và thất phải (RV insertion); C, D: LGE patchy lan tỏa; E,F: LGE lan tỏa xuyên thành ở vách, thành trước; G,H: LGE xuyên thành ở mỏm kèm phình mỏm.
2.2.2 Cộng hưởng từ tim đối với đánh giá tắc nghẽn buồng tống thất trái ở bệnh nhân HCM
Tắc nghẽn động học buồng tống thất trái (chênh áp ≥ 30 mm Hg), xảy ra khi nghỉ và / hoặc khi gắng sức ở 70% bệnh nhân HCM khi đánh giá trên siêu âm tim. Tắc nghẽn buồng tống dưới van động mạch chủ (gây tăng áp lực trong buồng tim) là yếu tố ảnh hưởng mạnh đến suy tim và là cơ chế chính trong 90% bệnh nhân HCM có suy tim nặng (phân độ NYHA III / IV).
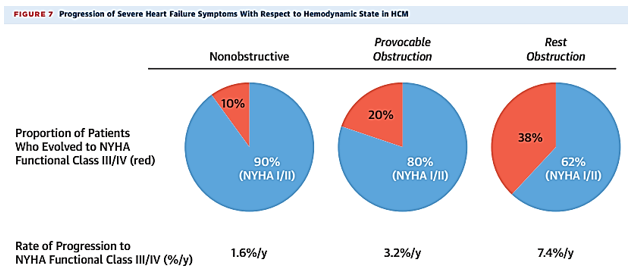
Hình 15. Tỉ lệ và tốc độ diễn tiến đến suy tim nặng (phân loại NYHA III / IV) ở bệnh nhân không có tắc nghẽn buồng tống, tắc nghẽn khi thử nghiệm gắng sức và tắc nghẽn khi nghỉ. Nguồn: Maron BJ, Journal of the American College of Cardiology, 2022 [14].
Cơ chế phổ biến gây suy tim trong HCM là kháng trở cơ học trên đường ra thất trái do cử động về trước của van hai lá thì tâm thu (SAM). Ngoài ra, CMR còn đánh giá giải phẫu hình thái buồng tống thất trái và các bất thường khác làm nặng thêm tình trạng tắc nghẽn như van hai lá dãn dài, cơ trụ trước bên bám sai vị trí lên chính mặt van hai lá, và các bó cơ bất thường xuất phát từ mỏm bám vào đáy thành trước vách (Hình 16).
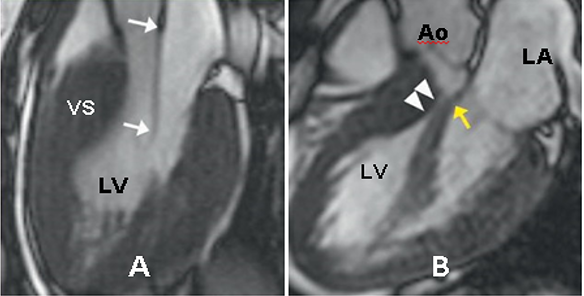
Hình 16. Hình ảnh CMR bất thường buồng tống: (A) Dãn dài lá trước van hai lá (mũi tên), (B) Dải cơ nhú bất thường bám trực tiếp lên lá trước van hai lá (mũi tên vàng), chập với vách liên thất ở thì tâm thu, gây hẹp giữa khoang buồng tống thất trái. Nguồn: Evan Appelbaum, Cardiovascular magnetic resonance: A companion to Braunwald’s heart disease, 2018 [13].
Điều trị can thiệp giảm tắc nghẽn buồng tống thất trái được chỉ định khi bệnh nhân có chênh áp qua buồng tống ≥50 mmHg, triệu chứng nặng (suy tim NYHA III / IV), và / hoặc ngất rõ không nguyên nhân dù đã điều trị nội khoa tối ưu. Vì kiểu hình rối loạn van hai lá và bộ máy dưới van, dải cơ trong buồng thất ở bệnh nhân HCM thường đa dạng, việc đánh giá các cấu trúc này trước phẫu, với chỉ định phẫu thuật cắt vách ưu thế hơn đốt vách với cồn ở những bệnh nhân có bất thường van và bộ máy dưới van hai lá, CMR thường được chỉ định để khảo sát các bất thường, với độ tương phản tốt giữa các cấu trúc và hình ảnh có độ phân giải theo thời gian. Ngoài ra, các chuỗi xung flow của CMR giúp đánh giá độ nặng, cơ chế hẹp buồng tống thất trái[10].
NHỮNG KỸ THUẬT KHÁC TRÊN CỘNG HƯỞNG TỪ ĐỐI VỚI BỆNH CƠ TIM PHÌ ĐẠI
Phân tích định lượng thời gian thư giãn ngang T2 của cơ tim được sử dụng để phát hiện phù cơ tim, có thể phản ánh những cơn thiếu máu cơ tim, tổn thương do phản ứng viêm, bất trật tự sợi cơ tim, tính bất đồng nhất của sẹo,… Vì vậy chuỗi xung này hứa hẹn có thể trở thành công cụ theo dõi diễn tiến và bất thường phát sinh khi theo dõi điều trị.
Hình ảnh khuếch tán Tensor là kỹ thuật mới giúp đánh giá cấu trúc vi thể của sợi cơ tim và khảo sát được tính bất trật tự của sợi cơ. Công cụ này hứa hẹn sẽ cung cấp những khái niệm mới về đánh giá cơ chế vi thể và có tiềm năng định nghĩa lại các mô hình dự đoán nguy cơ, nhưng hiện này còn trong quá trình nghiên cứu, cần được phát triển và đánh giá thêm [16].
KẾT LUẬN
Bệnh cơ tim phì đại là bệnh tim nguyên phát thường gặp nhất, với biến chứng đột tử ở người trẻ chiếm tỉ lệ hàng đầu. Việc chẩn đoán, điều trị và dự phòng hợp lý giúp cải thiện tiên lượng rõ rệt. Bởi tính chất khảo sát tốt đặc tính mô cơ tim cũng như không giới hạn về mặt phẳng khảo sát, cộng hưởng từ tim là công cụ hàng đầu giúp đánh giá ban đầu, thiết lập chẩn đoán, phân tầng và theo dõi điều trị bệnh cơ tim phì đại.
TÀI LIỆU THAM KHẢO
- Maron MS, Hellawell JL, Lucove JC, Farzaneh-Far R, Olivotto I. Occurrence of clinically diagnosed hypertrophic cardiomyopathy in the United States. The American journal of cardiology. 2016;117(10):1651-1654.
- Maron BJ, Rowin EJ, Maron MS. Global burden of hypertrophic cardiomyopathy. JACC: Heart Failure. 2018;6(5):376-378.
- Cavus E, Muellerleile K, Schellert S, et al. CMR feature tracking strain patterns and their association with circulating cardiac biomarkers in patients with hypertrophic cardiomyopathy. Clinical Research in Cardiology. 2021:1-13.
- Yang L, Zhang L, Cao S, et al. Advanced myocardial characterization in hypertrophic cardiomyopathy: feasibility of CMR-based feature tracking strain analysis in a case-control study. European radiology. 2020;30:6118-6128.
- Moon I, Lee SY, Kim HK, et al. Trends of the prevalence and incidence of hypertrophic cardiomyopathy in Korea: A nationwide population-based cohort study. PloS one. 2020;15(1):e0227012. doi:10.1371/journal.pone.0227012
- Sivalokanathan S. The role of cardiovascular magnetic resonance imaging in the evaluation of hypertrophic cardiomyopathy. Diagnostics. 2022;12(2):314.
- Peter Libby ROB, and Douglas L Mann, et al. Hypertrophic Cardiomyopathy. Braunwald’s heart disease: A textbook of cardiovascular medicine, 12th ed. ELSEVIER; 2022:1062-1076:chap 54.
- Chan C, Maron MS. Hypertrophic cardiomyopathy. The EACVI Textbook of Cardiovascular Magnetic Resonance. Oxford University Press; 2018:243-252:chap Section 5 – Myocardial disease, Chapter 1.
- Maron BJ, Desai MY, Nishimura RA, et al. Diagnosis and evaluation of hypertrophic cardiomyopathy: JACC state-of-the-art review. Journal of the American College of Cardiology. 2022;79(4):372-389.
- Arbelo E, Protonotarios A, Gimeno JR, et al. 2023 ESC Guidelines for the management of cardiomyopathies: Developed by the task force on the management of cardiomyopathies of the European Society of Cardiology (ESC). European heart journal. 2023;44(37):3503-3626. doi:10.1093/eurheartj/ehad194
- Berger SG, Sjaastad I, Stokke MK. Right ventricular involvement in hypertrophic cardiomyopathy: evidence and implications from current literature. Scandinavian Cardiovascular Journal. 2021;55(4):195-204.
- Auger DA, Ghadimi S, Cai X, et al. Reproducibility of global and segmental myocardial strain using cine DENSE at 3 T: a multicenter cardiovascular magnetic resonance study in healthy subjects and patients with heart disease. Journal of Cardiovascular Magnetic Resonance. 2022;24(1):1-12.
- Ethan J. Rowin EA, and Martin S. Maron. Hypertrophic Cardiomyopathy. Cardiovascular magnetic resonance: A companion to Braunwald’s heart disease. 3rd ed. Elsevier; 2018:424-433:chap 36.
- Maron BJ, Desai MY, Nishimura RA, et al. Management of hypertrophic cardiomyopathy: JACC state-of-the-art review. Journal of the American College of Cardiology. 2022;79(4):390-414.
- Bos JM, Towbin JA, Ackerman MJ. Diagnostic, Prognostic, and Therapeutic Implications of Genetic Testing for Hypertrophic Cardiomyopathy. Journal of the American College of Cardiology. 2009/07/14/ 2009;54(3):201-211. doi:https://doi.org/10.1016/j.jacc.2009.02.075
- Moura B, Aimo A, Al-Mohammad A, et al. Diagnosis and management of patients with left ventricular hypertrophy: Role of multimodality cardiac imaging. A scientific statement of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. Sep 2023;25(9):1493-1506.
- Rao S, Tseng SY, Pednekar A, et al. Myocardial Parametric Mapping by Cardiac Magnetic Resonance Imaging in Pediatric Cardiology and Congenital Heart Disease. Circulation: Cardiovascular Imaging. 2022;15(1):e012242. doi:doi:10.1161/CIRCIMAGING.120.012242
- Kübler J, Burgstahler C, Brendel J, et al. Cardiac MRI findings to differentiate athlete’s heart from hypertrophic (HCM), arrhythmogenic right ventricular (ARVC) and dilated (DCM) cardiomyopathy. The International Journal of Cardiovascular Imaging. 2021;37(8):2501-2515.
- Liu S, Li Y, Zhao Y, et al. The combination of feature tracking and late gadolinium enhancement for identification between hypertrophic cardiomyopathy and hypertensive heart disease. Frontiers in Cardiovascular Medicine. 2022:1142.
- Shen H, Dong S-Y, Ren M-S, Wang R. Ventricular arrhythmia and sudden cardiac death in hypertrophic cardiomyopathy: From bench to bedside. Frontiers in Cardiovascular Medicine. 2022;9
- Elliott PM, Anastasakis A, Borger MA, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy. Kardiologia Polska (Polish Heart Journal). 2014;72(11):1054-1126.
- Ommen SR, Mital S, Burke MA, et al. 2020 AHA/ACC guideline for the diagnosis and treatment of patients with hypertrophic cardiomyopathy: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Journal of the American College of Cardiology. 2020;76(25):e159-e240.
- Zeppenfeld K, Tfelt-Hansen J, de Riva M, et al. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: Developed by the task force for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death of the European Society of Cardiology (ESC) Endorsed by the Association for European Paediatric and Congenital Cardiology (AEPC). European heart journal. 2022;43(40):3997-4126. doi:10.1093/eurheartj/ehac262
- Wang J, Yang S, Ma X, et al. Assessment of late gadolinium enhancement in hypertrophic cardiomyopathy improves risk stratification based on current guidelines. European heart journal. 2023;doi:10.1093/eurheartj/ehad581
- Kramer CM, Appelbaum E, Desai MY, et al. Hypertrophic Cardiomyopathy Registry: The rationale and design of an international, observational study of hypertrophic cardiomyopathy. American heart journal. Aug 2015;170(2):223-30. doi:10.1016/j.ahj.2015.05.013
- Greulich S, Seitz A, Herter D, et al. Long-term risk of sudden cardiac death in hypertrophic cardiomyopathy: a cardiac magnetic resonance outcome study. European Heart Journal-Cardiovascular Imaging. 2021;22(7):732-741.







