PGS.TS.BS. Võ Thành Nhân†
* Khoa Tim Mạch Can thiệp BVND 115,
† Khoa Tim Mạch Can thiệp BV Chợ Rẫy
TÓM TẮT
Mục tiêu nghiên cứu: Khảo sát mối liên quan giữa độ xuyên thành của tăng tín hiệu muộn trên cộng hưởng từ tim (CMR) với sự cải thiện chức năng thất trái sau can thiệp động mạch vành qua da (CTĐMVQD) và khả năng tiên đoán cải thiện chức năng toàn bộ thất trái của CMR tăng tương phản được thực hiện trước khi CTĐMVQD.
Cơ sở nghiên cứu: Mối liên quan giữa mức độ xuyên thành của hình ảnh cộng hưởng từ tăng tính hiệu muộn với sự cải thiện chức năng thất trái và khả năng tiên đoán cải thiện chức năng toàn bộ thất trái của CMR chưa được nghiên cứu đầy đủ, đặc biệt ở Việt Nam.
Phương pháp nghiên cứu: Cộng hưởng từ tim đa kỹ thuật được thực hiện trên 20 bệnh nhân bị hội chứng mạch vành cấp trước và sau CTĐMVQD 3-6 tháng. Điểm tăng tín hiệu muộn (DES) từng phân đoạn được tính theo mức độ xuyên thành của hình ảnh tăng tín hiệu muộn (0: bình thường, không có vùng tăng tín hiệu; 1: Vùng tăng tín hiệu £ 25%; 2: 26 – 50%; 3: 51 – 75%; 4: > 75% bề dày thành tim). Các phân đoạn cơ tim có bề dày thành từng phân đoạn SWT £ 45% được xem là rối loạn chức năng. EF sau CTĐMVQD tăng trên 4%, SWT tăng trên 10% được xem là có cải thiện chức năng toàn phần/ từng vùng thất trái sau can thiệp. Các phân đoạn cơ tim có rối loạn chức năng (SWT £ 45%) kèm điểm tăng tín hiệu muộn DES £ 2 (sẹo không xuyên thành) sẽ được xem như là còn sống và Chỉ số sống còn cơ tim (MVI = Myocardial Viability Index) sẽ được tính bằng cách chia tổng số các phân đoạn còn sống cho 17.
Kết quả: Khoảng cách thời gian trung bình giữa 2 lần làm CMR là 3,66 ± 0,62 tháng. Sự thay đổi chức năng toàn bộ (tăng EF) và từng phần (tăng SWT) thất trái sau CTĐMVQD có mối quan hệ tuyến tính thuận với số phân đoạn cơ tim bị rối loạn chức năng còn sống trước can thiệp với r lần lượt là 0,55 (p = 0.01) và 0,65 (p = 0.002). Điểm cắt của chỉ số sống còn cơ tim để tiên đoán cải thiện EF > 4% là 29%. Từ đó chúng tôi có độ nhạy, độ đặc hiệu, giá trị tiên đoán dương, giá trị tiên đoán âm của chỉ số sống còn cơ tim £ 29% lần lượt là 67%, 63%, 73% & 56%.
Kết luận: Có thể nhận diện được những vùng cơ tim tuy có rối loạn chức năng nhưng vẫn còn sống & có thể cải thiện chức năng sau CTĐMVQD, cũng như có thể tiên đoán khả năng cải thiện EF sau can thiệp dựa vào cộng hưởng từ tim trước can thiệp.
ABSTRACT
Objectives: The aim of this study was to investigate the relationship between transmural extent of infarction quantified on delayed enhancement cardiac MRI (DE-CMR) and the change in EF (Ejection Fraction) & SWT (Segmental Wall Thickning) and to assess the diagnostic accuracy of cardiac magnetic resonance imaging (CMR) for improvement in EF.
Background: The relationship between transmural extent of infarction quantified on delayed enhancement cardiac MRI and the change in EF & SWT and the predictive value of cardiac MRI on global function are incompletely investigated, especially in Vietnam.
Methods: Multicomponent CMR was performed in 20 patients with acute coronary syndrome before and 3-6 months after PCI. Segmental DE score was scored on theImprovement of global & regional LV function was evaluated by comparision the LVEF, Segmental Wall Thickning (SWT), Wall Motion Score (WMS) and Wall Motion Score Index (WMSI) on pre- & post-procedure cine-MRI. Myocardial segments were considered dysfunctional if segmental wall thickeness was £ 45%. The magnitude of change of EF ³ 4% and SWT ³ 10% were considered improvement in global/ regional left ventricular function. The percentage of dysfunctional but viable segments/patient (MVI = Myocardial Viability Index) was defined as the sum of all dysfunctional (SWT £ 45%) but viable (DES £ 2) segments divided by the total number of segments (n=17).
Results: The mean time interval between baseline and follow-up cardiac MRI was 3,66 ± 0,62 months. The change in EF and in SWT was linearly related to the extent of the LV that was dysfunctional but viable before PCI (r = 0,55 – p = 0.01 and r = 0,65 – p = 0.002 respectively). The cutoff value of MVI £ 29% was used to predict improvement in EF ³ 4% after PCI. Sensitivity, specificity, positive and negative predictive value for the prediction of improvement in EF of ³ 4% after PCI were 67%, 63%, 73% & 56% respectively for DE-CMR.
Conclusion: Reversible myocardial dysfunction can be identified by contrast-enhanced MRI before coronary revas-cularization. Improvement in EF can be predicted by performing cardiac MRI before PCI.
1. ĐẶT VẤN ĐỀ:
Việc điều trị can thiệp động mạch vành qua da (CTĐMVQD) ở bệnh nhân bệnh động mạch vành (BMV) do thiếu máu cục bộ (TMCB) đã phổ biến rộng rãi trên thế giới trong hơn 3 thập niên qua. Trước khi xem xét CTĐMVQD, đặc biệt là ở bệnh nhân ổn định đã từng có NMCT, các phương thức chẩn đoán hình ảnh tim đóng một vai trò quan trọng giúp chẩn đoán, đánh giá sống còn cơ tim, cung cấp thông tin về tiên lượng cũng như giúp quyết định chiến lược can thiệp tái thông mạch vành phù hợp nhất cho bệnh nhân. Với khả năng khảo sát đa dạng, bao gồm cả phần cấu trúc hình thái (morphology) lẫn chức năng (function), cũng như ưu thế về khả năng xác định đặc tính mô (tissue characterization), đồng thời tính an toàn rất tốt và cho hình ảnh có chất lượng cao, cộng hưởng từ tim (Cardiac Magnetic Resonance – CMR) đã được chứng minh là phương pháp đánh giá phân suất tống máu thất trái (LVEF) chính xác nhất và rất thích hợp để khảo sát chức năng co bóp từng vùng của thất trái [1]. Ngoài ra CMR với thuốc tương phản từ và hình ảnh tăng tương phản muộn còn giúp khảo sát tưới máu cơ tim, chẩn đoán được tình trạng thiếu máu cơ tim dưới nội mạc, hoại tử và sống còn của cơ tim [1]. Do đó, ngoài việc sử dụng CMR để đánh giá hiệu quả của CTĐMVQD, hiện nay trên thế giới ngày càng có nhiều nghiên cứu tìm hiểu mối tương quan giữa độ xuyên thành của hình ảnh tăng tín hiệu muộn trên CMR với sự cải thiện chức năng thất trái sau tái thông mạch vành cũng như khảo sát khả năng tiên đoán cải thiện chức năng thất trái của CMR trước khi xem xét chiến lược điều trị tái thông mạch vành. Tại Việt Nam, CMR vẫn còn là lĩnh vực khá mới mẻ và non trẻ, cho đến nay vẫn chưa có nghiên cứu nào đánh giá khả năng chẩn đoán của CMR tăng tương phản muộn trong tiên đoán cải thiện chức năng thất trái sau CTĐMVQD. Do vậy, chúng tôi đã tiến hành đề tài nghiên cứu này với 2 mục tiêu:
1. Khảo sát mối tương quan giữa độ xuyên thành của tăng tín hiệu muộn trên CMR với sự cải thiện chức năng thất trái sau CTĐMVQD.
2. Khảo sát khả năng tiên đoán cải thiện chức năng toàn bộ thất trái của CMR tăng tương phản được thực hiện trước khi CTĐMVQD.
2. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU:
2.1. Đối tượng nghiên cứu: Tất cả các bệnh nhân được can thiệp động mạch vành qua da tại phòng thông tim Bệnh Viện Nhân Dân 115 từ tháng 01/01/ 2009 đến 31/06/2010 thỏa tiêu chuẩn chọn bệnh và không có tiêu chuẩn loại trừ sẽ được đưa vào lô nghiên cứu.
Tiêu chuẩn chọn bệnh: Có chẩn đoán bệnh tim do TMCB dù là biểu hiện lâm sàng nào (có hay không có triệu chứng, CĐTN ổn định hay không ổn định, NMCT có hay không có ST chênh lên…) được CTĐMVQD thành công (về giải phẫu chụp mạch và thủ thuật) tại phòng thông tim can thiệp BV Nhân Dân 115 trong thời gian tiến hành nghiên cứu và có điều kiện làm CMR 2 lần: lần thứ nhất trước hay sau CTĐMVQD £ 5 ngày; lần thứ hai sau CTĐMVQD £ 6 tháng.
Tiêu chuẩn loại trừ : Tất cả các bệnh nhân có chống chỉ định làm CMR: Có đặt máy tạo nhịp – Cấy máy phá rung tự động – Có dị vật kim loại ở những cơ quan quan trọng như kẹp phình mạch não, vật cấy ghép trong hốc mắt… – Có chứng sợ bị giam giữ trong buồng kín (claustrophobia) – Rối loạn nhịp nhanh nhĩ hay thất.
Lưu ý: Các thế hệ van tim nhân tạo hiện tại đều an toàn khi khảo sát MRI. Tương tự, chỉ thép cột xương ức và các kẹp cầu nối mạch vành đều không bị ảnh hưởng gì khi khảo sát. Hầu hết các loại stent động mạch vành có mặt trên thị trường hiện nay đều cấu tạo bằng các hợp kim không nhiễm từ nên có thể khảo sát MRI an toàn rất sớm sau khi đặt.
2.2. Phương pháp nghiên cứu:
Loại hình nghiên cứu: Nghiên cứu follow-up, tiền cứu, có so sánh bắt cặp trước và sau can thiệp.
Cách chọn mẫu: Chọn mẫu thuận tiện những bệnh nhân thỏa tiêu chuẩn chọn bệnh trong thời gian nghiên cứu.
Trang thiết bị sử dụng trong nghiên cứu: CTĐMVQD với máy chụp mạch xoá nền AXIOM Artis FC/BC của hãng Siemens (Đức). CMR với máy chụp cộng hưởng từ tim mạch AVENTO® 1,5 Tesla của hãng Siemens (Đức). Thuốc cản từ: Gadolinium diethylenetriamine penta-acetic acid (DTPA) (DOTAREM®)
Các buớc tiến hành nghiên cứu:
- Bệnh nhân được giải thích lợi ích và các tiến trình của thủ thuật, đồng ý ký giấy cam kết trước thủ thuật, đồng thuận tham gia nghiên cứu với đầy đủ các bước theo thiết kế nghiên cứu.
- Trước can thiệp, các bệnh nhân đều được thăm khám lâm sàng và làm các xét nghiệm cận lâm sàng cơ bản: điện tâm đồ, siêu âm tim, men tim, sinh hóa thường qui, bilan lipid máu và các trắc nghiệm gắng sức khi cần thiết.
- Chụp động mạch vành và CTĐMVQD được tiến hành tại phòng thông tim can thiệp của bệnh viện Nhân Dân 115.
- CMR lần thứ nhất sẽ được thực hiện trước hay sau CTĐMVQD £ 5 ngày, lần thứ hai sau CTĐMVQD £ 6 tháng tại phòng MRI của bệnh viện Nhân Dân 115.
- Theo dõi lâm sàng sau can thiệp qua tái khám định kỳ.
- Thu thập, xử lý các số liệu theo mục tiêu nghiên cứu.
Tiến trình thực hiện CMR:
CMR được thực hiện 2 lần như đã trình bày ở trên. CMR lần 1 được gọi là CMR căn bản (baseline CMR) hay CMR 1. CMR lần 2 được gọi là CMR theo dõi (follow-up CMR) hay CMR 2.
Tất cả bệnh nhân đều được làm đủ các kỹ thuật MRI sau: MRI hình ảnh động (cine-MRI) – MRI tưới máu có tiêm adenosine (first-pass perfusion CMR, with adenosine) – MRI tưới máu lúc nghỉ (rest – perfusion MRI) và hình ảnh tăng tương phản muộn (delayed hyperenhancement imaging)
Cine-MRI sẽ khảo sát 9-12 lát cắt liên tiếp nhau theo trục ngắn dọc theo trục dọc nằm ngang (mặt phẳng 4 buồng) của thất trái để có thể khảo sát hết toàn bộ thất trái. Adenosine được bơm vào với liều 140mg/kg/phút trong ít nhất là 2 phút dưới theo dõi liên tục huyết áp & điện tâm đồ. Hình ảnh tưới máu first-pass sẽ được thu nhận trong 30 đến 40 chu chuyển tim liên tiếp nhau ngay sau khi tiêm tĩnh mạch trực tiếp gadolinium DTPA (0,1 mmol/kg thể trọng; 5ml/giây vào tĩnh mạch trụ trước, có tống thêm 15ml nước muối sinh lý tốc độ 5ml/giây sau đó) ở đủ các phần đáy, giữa và mỏm của thất trái như trong cine-MRI với bề dày lát cắt 8mm. Tổng thời gian thu nhận hình ảnh là 40-50 giây, tổng thời gian truyền adenosine là 3-3,5 phút. Để khảo sát tưới máu lúc nghỉ, tiêm thêm gadolinium liều 0.075 – 0.10 mmol/kg, và các thông số hình ảnh được thu nhận giống như khi khảo sát tưới máu lúc gắng sức. Hình ảnh tăng tín hiệu muộn đuợc ghi nhận với chuỗi xung gradient-echo T1W 2 chiều vào thời điểm 5-10 phút sau khi thu nhận hình ảnh tưới máu.
Các biến số nghiên cứu – định nghĩa & cách thu thập:
- Các biến số lâm sàng: Tuổi – Phái – Cân nặng – Chiều cao – Chỉ số khối lượng cơ thể (BMI) – Diện tích cơ thể (BSA) – Các yếu tố nguy cơ bệnh mạch vành: hút thuốc lá, đái tháo đường, tăng huyết áp, rối loạn lipide máu, tiền căn gia đình bệnh động mạch vành sớm, nữ mãn kinh – Tiền căn – Lý do nhập viện – Sinh hiệu & chẩn đoán lâm sàng lúc nhập viện – Điều trị thuốc trước, trong & sau CTĐMVQD.
- Các biến số cận lâm sàng thường qui: Các xét nghiệm sinh hóa cơ bản – Bilan mỡ máu – Đặc điểm ECG – Siêu âm tim qua thành ngực & trắc nghiệm gắng sức (nếu có).
- Các biến số liên quan chụp ĐMV & CTĐMVQD: độ nặng BMV (bệnh 1, 2 hay 3 nhánh ĐMV) – độ nặng của sang thương (theo phân độ AHA/ACC) – Phân độ dòng chảy TIMI – số khung hình TIMI có hiệu chỉnh (CTFC) – độ tưới máu cơ tim TIMI (TMPG) (có đánh giá so sánh trước & sau can thiệp theo 3 mức: cải thiện, không đổi hay xấu hơn) – ĐM được can thiệp – Số ĐM được can thiệp – Số sang thương được can thiệp – Số stent & loại stent (thường hay phủ thuốc).
- Các biến số liên quan CMR: các bề dày thành thất (EDWT, ESWT), các đường kính & thể tích thất trái (cuối tâm trương & cuối tâm thu) (LVEDD, LVESD, LVEDV, LVESV), khối lượng cơ và chỉ số khối lượng cơ thất trái (MM & MMI), độ dày thành từng phân đoạn [segmental wall thickening = SWT = (ESWT – EDWT)/EDWT x 100)], phân suất tống máu thất trái (EF), điểm vận động thành (WMS = Wall Motion Score = tổng điểm vận động vùng của 17 phân đoạn cơ tim), chỉ số vận động thành (WMSI = Wall Motion Score Index = WMS/17), điểm tăng tín hiệu muộn (DES = Delayed Enhancement Score = tổng điểm tăng tín hiệu muộn của 17 phân đoạn cơ tim; giúp đánh giá bán định lượng sẹo NMCT), chỉ số điểm tăng tín hiệu muộn (DESI= DES/17), điểm khiếm khuyết tưới máu (PDS = Perfusion Defect Score =tổng điểm KKTM của 17 phân đoạn cơ tim), chỉ số điểm khiếm khuyết tưới máu (PDSI = PDS/17), tắc nghẽn vi mạch (MVO = MicroVascular Obstruction) (xem hình 1, 2 & 3).
Để đo các thông số trên, các đường viền thượng tâm mạc và nội tâm mạc sẽ được phát hiện một cách tự động và được điều chỉnh lại bằng tay trên mặt cắt trục ngắn chia làm 17 phân đoạn cơ tim (myocardial segments) [2] với phương pháp đường trung tâm (phần mềm SYNGO®). Các cơ nhú & cơ bè được xem như là một phần của thể tích hồ máu.
EF được tính theo phương pháp 2 mặt phẳng của Simpson sử dụng các mặt cắt theo trục dọc 2 buồng và 4 buồng. EF sau CTĐMVQD tăng trên 4% được xem là có cải thiện chức năng toàn phần thất trái sau can thiệp [3]. Các phân đoạn cơ tim có SWT £ 45% được xem là rối loạn chức năng [3-4]. SWT sau CTĐMVQD tăng trên 10% được xem là có cải thiện chức năng từng vùng thất trái sau can thiệp.
Điểm vận động vùng từng phân đoạn được tính theo thang điểm sau: 0 điểm: bình thường hay tăng động; 1 điểm: giảm động nhẹ; 2 điểm: giảm động nặng; 3 điểm: vô động; 4 điểm: loạn động (vận động nghịch thường).
Điểm tăng tín hiệu muộn từng phân đoạn được tính theo thang điểm sau: 0: bình thường, không có vùng tăng tín hiệu; 1: Vùng tăng tín hiệu £ 25%; 2: 26 – 50%; 3: 51 – 75%; 4: > 75% bề dày thành tim.
Điểm KKTM từng phân đoạn được tính theo thang điểm sau: 0: bình thường, không sẹo NMCT, không khiếm khuyết tưới máu; 1: Không sẹo NMCT, có khiếm khuyết tưới máu; 2: Sẹo NMCT, không khiếm khuyết tưới máu; 3: Sẹo NMCT, có khiếm khuyết tưới máu; 4: Sẹo NMCT xuyên thành.
Các phân đoạn cơ tim có rối loạn chức năng (SWT £ 45%) kèm DES £ 2 (sẹo không xuyên thành) sẽ được xem như là còn sống và Chỉ số sống còn cơ tim (MVI = Myocardial Viability Index) sẽ được tính bằng cách chia tổng số các phân đoạn còn sống cho 17.
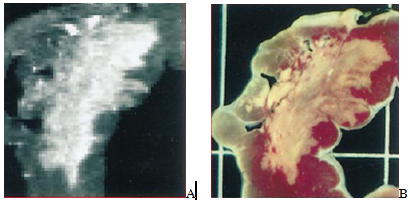
Hình 1: Hình ảnh cộng hưởng từ tăng tương phản muộn (DE-CMR) (A) đối chứng với hình ảnh mô học (B) vùng cơ tim bị hoại tử nhồi máu. Trên DE-CMR, vùng cơ tim nhồi máu đã hoại tử & không còn sống sẽ tăng tín hiệu và có màu sáng trắng. (Nguồn: Circulation 1999;100:1992-2002)
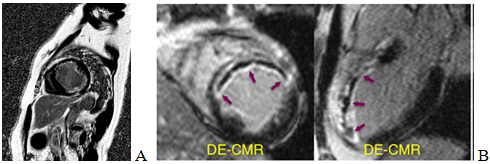
Hình 2: A – Hình ảnh tăng tín hiệu muộn của NMCT dưới nội mạc ở phần giữa của hầu hết các thành tim trên bệnh nhân ĐTĐ, THA, đã được CMV với kết quả bệnh 3 nhánh. B – Hình ảnh tổn thương vi mạch (mũi tên tím), là những vùng đen không tăng tín hiệu nằm trong vùng bị tăng tín hiệu [5].
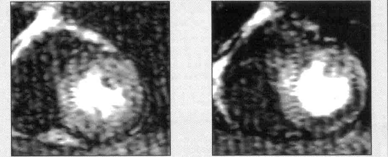
Hình 3: Hình ảnh khiếm khuyết tưới máu ở thành dưới và sau bên sau khi tiêm thuốc giãn mạch (hình phải)[6]
2.3. Phân tích thống kê:
Các thông số thu thập được sẽ được xử lý phân tích theo phương pháp thống kê y học bằng chương trình STATA 10.0. Kết quả các biến số được trình bày theo tỉ lệ phần trăm (biến định tính), trị trung bình ± độ lệch chuẩn (biến định lượng).
So sánh giữa các nhóm theo phép kiểm McNemar chi bình phương (biến định tính bắt cặp), phép kiểm matched t-test (2- tailed) (biến định lượng có phân phối bình thường), phép kiểm Wilcoxon signed-rank test (biến định lượng không có phân phối bình thường). Khảo sát tương quan mối tương quan giữa chỉ số sống còn cơ tim (MVI) với sự thay đổi EF bằng phân tích hồi qui tuyến tính. Sử dụng diện tích dưới đường cong (AUC – area under the receiver-operator characteristic curves), chúng tôi xác định điểm cắt (cut-off) của MVI để xác định độ nhạy và độ đặc hiệu, khả năng tiên đoán dương, khả năng tiên đoán âm của điểm cắt này trong tiên đoán sự cải thiện của chức năng toàn bộ và từng vùng thất trái sau can thiệp (EF tăng >4%, SWT tăng >10%).
3. KẾT QUẢ:
3.1. Đặc điểm đối tượng nghiên cứu:
Trong khoảng thời gian nghiên cứu, có 20 bệnh nhân thỏa tiêu chuẩn chọn bệnh được đưa vào phân tích trong nghiên cứu này với các đặc điểm được tóm tắt trong bảng 1 & 2.
Bảng 1: Các đặc điểm của bệnh nhân
|
Tuổi |
53.4 ± 14.1 |
|
Nam |
15 (75) |
|
Chỉ số khối cơ thể (BMI) |
22.5 ± 2.8 |
|
Các yếu tố nguy cơ BMV: – Hút thuốc lá – Tăng huyết áp – Đái tháo đường – Rối loạn mỡ máu |
6 (30) 10 (50) 2 (10) 12 (60) |
|
Tiền căn NMCT trước đó |
2 (10) |
|
Lý do nhập viện – Đau ngực – Khó thở |
19 (95) 10 (50) |
|
Chẩn đoán lúc nhập viện – CĐTNKOĐ – NSTEMI – STEMI |
1 (5) 4 (20) 15 (75) |
|
Thời gian từ lúc khởi phát triệu chứng đến lúc nhập viện (bn NMCT) – ≤12 giờ – 12-24 giờ – 24-72 giờ – ≥ 72 giờ |
10 (52.6) 1 (5.3) 0 8 (42.1) |
|
Vị trí NMCT – Trước vách – Trước rộng – Dưới – Sau – Thất P – Bên cao |
5 (33.3) 5 (33.3) 5 (33.5) 0 1 (6.7) 2 (13.3) |
|
Bilan mỡ lúc nhập viện – Cholesterol toàn phần – LDL-C – HDL-C – Triglyceride Rối loạn mỡ máu (+) |
204 ± 37.5 133.4 ± 31.5 38.7 ± 8.6 207.1 ± 120.4 16 (88.9) |
|
Sóng Q/ ECG lúc nhập viện |
15 (75) |
|
Thuốc sử dụng – Aspirin – Clopidogrel – Statin – Ức chế men chuyển – Ức chế thụ thể Angiotensine – Ức chế beta – Ức chế can-xi |
20 (100) 20 (100) 20 (100) 15 (75) 5 (25) 16 (80) 1 (5) |
(Các giá trị được trình bày dưới dạng trị số n (%) hay trung bình ± độ lệch chuẩn)
Bảng 2: Đặc điểm chụp ĐMV & CTĐMVQD
|
Độ nặng BMV – 1 nhánh – 2 nhánh – 3 nhánh |
8 (40) 6 (30) 6 (30) |
|
Phân loại sang thương theo ACC/AHA – Type A – Type B1 – Type B2 – Type C |
1 (5) 0 7 (35) 12 (60) |
|
Sang thương mới trên mạch máu tự nhiên |
20 (100) |
|
Sang thương tắc nghẽn hoàn toàn – < 3 tháng – ≥ 3 tháng |
4 (20) 2 (20) 2 (20) |
|
ĐM được can thiệp – ĐM xuống trước trái (LAD) – ĐM mũ trái (LCx) – ĐM vành phải (RCA) |
16 (48.5) 7 (21.2) 10 (30.3) |
|
Tổng số ĐM được can thiệp Số ĐM được can thiệp/ 1 bệnh nhân |
33 1,65 |
|
Tổng số sang thương được can thiệp Số sang thương được can thiệp/ 1bệnh nhân |
36 1.8 |
|
Tổng số stent sử dụng Số stent/1 bệnh nhân |
37 1.85 |
|
Loại Stent – Stent phủ thuốc – Stent thường |
14 (37.8) 23 (62.2) |
|
Cải thiện phân độ dòng chảy TIMI sau CTĐMVQD |
12 (60) |
|
Cải thiện CTFC sau CTĐMVQD |
14 (70) |
Các giá trị được trình bày dưới dạng trị số n (%)
3.2. So sánh các đặc điểm CMR trước & sau CTĐMVQD:
Khoảng cách thời gian giữa CMR 1 và ngày can thiệp là:
Khoảng cách thời gian giữa CMR 1 và CMR 2 là: 3.66 ± 0.62 (tháng)
Khoảng cách thời gian giữa CMR 2 và ngày can thiệp là:3.7 ± 0.63 (tháng)
Các đặc điểm về cấu trúc & chức năng của thất trái trên CMR trước và sau CTĐMVQD được liệt kê và so sánh trong bảng 3 & 4.
EF sau CTĐMVQD tăng trung bình 5.39 ± 11.38 (khác biệt có ý nghĩa thống kê với p = 0.04) và có 12 bệnh nhân (60%) có mức tăng EF > 4%.
Bảng 3: So sánh các đặc điểm CMR về cấu trúc hình thái thất trái
|
Đặc điểm |
CMR 1 trước CTĐMVQD |
CMR 2 sau CTĐMVQD |
Giá trị p |
|
EDWT (mm) |
8.23 ± 1.99 |
7.41 ± 1.16 |
0.0167* |
|
ESWT (mm) |
13.28 ± 2.68 |
13.03 ±2.11 |
0.5281 |
|
LVEDD (mm) |
50.3 ± 11.0 |
48.6 ± 7.3 |
0.7575 |
|
LVESD (mm) |
31.4 ± 7.7 |
31.0 ± 9.8 |
0.2648 |
|
LVEDV (ml) |
110.2 ± 35.2 |
107.6 ± 40.5 |
0.6950 |
|
LVESV (ml) |
54.5 ± 30.3 |
47.9 ± 33.7 |
0.0964 |
|
MM (g) |
97.1 ± 44.7 |
83.6 ± 26.0 |
0.0290* |
|
MMI (g/m2) |
58.9 ± 27.9 |
50.7 ± 16.1 |
0.0276* |
|
DE (+) DES DESI |
9 (45) 7.7 ± 8.8 0.45 ± 0.52 |
6 (30) 7.6 ±7.7 0.44 ± 0.45 |
0.6900 0.8791 0.8791 |
|
PD (+) PDS PDSI |
6 (30) 8.6 ± 8.7 0.5 ± 0.51 |
1 (5) 8.4 ± 8.6 0.49 ± 0.51 |
0.1250 0.3100 0.2900 |
|
MVO (+) |
3 (15) |
1 (5) |
0.6200 |
* Khác biệt có ý nghĩa thống kê
(Các giá trị được trình bày dưới dạng trị số n (%) hay trung bình ± độ lệch chuẩn)
Bảng 4: So sánh các đặc điểm CMR về chức năng toàn bộ & từng vùng thất trái
|
Đặc điểm |
CMR 1 trước CTĐMVQD |
CMR 2 sau CTĐMVQD |
Giá trị p |
|
EF (%) EF < 50% (số bn) |
53.2 ± 13.1 8 (40) |
58.6 ± 13.0 4 (20) |
0.0437* 0.037* |
|
SWT (%) SWT ≤ 45% (số bn) SWT ≤ 45% (số phân đoạn) |
70.7 ± 23.6 3 (15) 133 (39.1) |
85.6 ± 27,6 2 (10) 87 (25.6) |
0.0160* 0.0475* 0.0002* |
|
Số phân đoạn bị RLCN/ 1 bn |
6.65 ± 3.67 |
4.35 ± 2.92 |
0.0128* |
|
WMS |
8.2 ± 7.6 |
5.7 ± 6.9 |
0.0109* |
|
WMSI |
0.48 ± 0.45 |
0.33 ± 0.41 |
0.0175* |
* Khác biệt có ý nghĩa thống kê
(Các giá trị được trình bày dưới dạng trị số n (%) hay trung bình ± độ lệch chuẩn)
3.3. Khảo sát mối tương quan giữa độ xuyên thành của tăng tín hiệu muộn trên CMR với sự cải thiện chức năng thất trái sau CTĐMVQD:
Từ hình ảnh tăng tín hiệu muộn trên CMR thực hiện trước can thiệp, chúng tôi có điểm tăng tín hiệu muộn của từng phân đoạn tùy theo mức độ xuyên thành của hình ảnh tăng tín hiệu muộn như đã đề cập đến trong mục 2.2, phần định nghĩa các biến số nghiên cứu. Các phân đoạn cơ tim có rối loạn chức năng (SWT £ 45%) kèm DES £ 2 (sẹo không xuyên thành) sẽ được xem như là còn sống và Chỉ số sống còn cơ tim (MVI = Myocardial Viability Index) sẽ được tính bằng cách chia tổng số các phân đoạn còn sống cho 17.
Khảo sát mối tương quan giữa sự thay đổi EF sau CTĐMVQD và chỉ số sống còn cơ tim, chúng tôi ghi nhận sự thay đổi EF có mối quan hệ tuyến tính với số phân đoạn cơ tim bị rối loạn chức năng còn sống trước CTĐMVQD với r = 0,55 và p = 0.01 (hình 4A).
Khảo sát mối tương quan giữa sự thay đổi SWT sau CTĐMVQD và chỉ số sống còn cơ tim, chúng tôi ghi nhận sự thay đổi SWT có mối quan hệ tuyến tính với số phân đoạn cơ tim bị rối loạn chức năng còn sống trước CTĐMVQD với r = 0,65 và p = 0.002 (hình 4B).
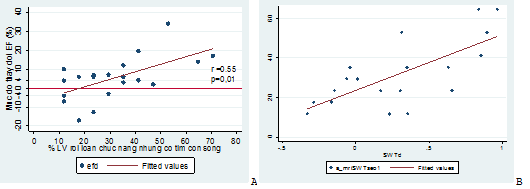
Hình 4: Mối tương quan giữa sự thay đổi EF (A) và SWT (B) sau CTĐMVQD với chỉ số sống còn cơ tim.
3.4. Khảo sát khả năng tiên đoán cải thiện chức năng toàn bộ thất trái của DE-CMR được thực hiện trước khi CTĐMVQD:
Diện tích dưới đường cong (AUC – area under the receiver- operator characteristic curves) đối với CMR tăng tương phản muộn để cải thiện EF là 0.73 (khoảng tin cậy 95%: 0.50 đến 0.96; p < 0.01). Từ đó chúng tôi xác định được điểm cắt của chỉ số sống còn cơ tim để tiên đoán cải thiện EF > 4% là 29%. Từ đó chúng tôi tính được độ nhạy, độ đặc hiệu, giá trị tiên đoán dương, giá trị tiên đoán âm của chỉ số sống còn cơ tim £ 29% như trình bày trong bảng 5.
Bảng 5: Độ chính xác chẩn đoán để tiên đoán cải thiện chức năng toàn bộ thất trái
|
|
% |
Khoảng tin cậy 95% |
|
Độ nhạy |
67 |
35-90 |
|
Độ đặc hiệu |
63 |
25-91 |
|
Giá trị tiên đoán dương |
73 |
39-94 |
|
Giá trị tiên đoán âm |
56 |
21-86 |
4. BÀN LUẬN:
Các bàn luận về đặc điểm đối tượng nghiên cứu và so sánh đặc điểm cộng hưởng từ tim trước và sau CTĐMVQD đã được đề cập đến trong bài nghiên cứu: “Bước đầu so sánh sự thay đổi các thông số phản ánh cấu trúc & chức năng thất trái trên cộng hưởng từ tim được thực hiện trước và sau can thiệp động mạch vành qua da” (được đăng trong cùng số báo này).
Trong bài viết này, chúng tôi tập trung bàn luận về vai trò của cộng hưởng từ tăng tương phản muộn (DE-MRI = Delayed Enhancement – Magnetic Resonance Imaging). Trong y văn, hình ảnh tăng tương phản muộn (DE imaging) còn được gọi là tăng tương phản muộn cơ tim (myocardial delayed enhancement), tăng tương phản gadolinium muộn (late gadolinium enhancement – LGE), hay chỉ đơn giản là CMR tăng tương phản (contrast-enhanced CMR). DE-MRI là kỹ thuật dễ làm nhưng giúp chẩn đoán NMCT chính xác & có giá trị nhất. Nó liên quan tới việc hồi phục – chuyển đổi hình ảnh sau khi tiêm thuốc cản từ gadolinium và chờ 5-10′. Cơ tim bình thường sẽ có màu đen hay không tín hiệu, trong khi vùng cơ tim nhồi máu đã hoại tử & không còn sống sẽ có màu sáng trắng hay còn gọi là tăng tín hiệu.
Cơ chế của sự tăng tín hiệu chưa được làm sáng tỏ đầy đủ, nhưng người ta đã đưa ra một cơ chế dựa trên 2 cơ sở lập luận đơn giản sau:
– Ở cơ tim bình thường, các tế bào cơ tim được nén ép dày đặt, thể tích mô nội bào chiếm ưu thế (75-80%)
– Gadolinium là chất ở ngoại bào không thể xuyên qua màng sarcolemma còn nguyên vẹn, do vậy ở cơ tim bình thường thể tích phân bố của gadolinium sẽ rất nhỏ và nồng độ trong mô sẽ rất thấp. Với hoại tử cấp (như trong NMCT cấp, viêm cơ tim cấp,…), màng tế bào sẽ bị phá vỡ và cho phép gadolinium lan tỏa vào trong tế bào cơ tim, dẫn đến tăng nồng độ gadolinium, thu ngắn thư giãn T1, và do đó làm tăng tín hiệu. Trong trường hợp đã mãn tính, mô sợi sẽ thay thế mô hoại tử và làm mở rộng khoảng gian bào, và cũng dẫn đến tăng nồng độ gadolinium và tăng tín hiệu. Trong cả 2 trường hợp cấp và mãn (và tất cả những giai đoạn ở giữa cấp và mãn), ta có thể xem cơ tim còn sống khi không bắt gadolinium. Do đó cơ chế của sự tăng tín hiệu dường như là do không có cơ tim còn sống hơn là do bất kỳ đặc tính vốn có nào đặc hiệu cho hoại tử cấp, sẹo collagen, hay các dạng cơ tim không còn sống khác [5].
Trong thực nghiệm trên thú vật, người ta thấy có sự tương đồng gần như hoàn toàn giữa kích thước và hình dạng của vùng cơ tim bị nhồi máu thấy trên DE-MRI với hình ảnh thấy trên giải phẫu bệnh mô học (hình 1). Các nghiên cứu trước đây đã cho thấy mức độ xuyên thành của DE-MRI tương ứng với mức độ xuyên thành của NMCT [7-8]. Hơn nữa, qua nghiên cứu trên thú vật, người ta thấy rằng giảm mức độ xuyên thành của nhồi máu xác định trên DE-MRI đi liền với khôi phục sớm dòng chảy và cải thiện chức năng co bóp về sau này. Trên cơ sở này, người ta đưa ra giả thuyết mức độ xuyên thành của NMCT trong vòng tuần lễ đầu sau biến cố NMCT trên người có thể tiên đoán được sự cải thiện chức năng co bóp thất trái 2-4 tháng sau. Từ đó đến nay, đã có nhiều nghiên cứu trên thế giới được thực hiện để tìm câu trả lời cho giả thuyết này. Nghiên cứu của Kelly M. Choi – Raymond J. Kim và cộng sự năm 2001 là nghiên cứu đầu tiên khảo sát mối liên quan giữa sự cải thiện chức năng co bóp về sau với mức độ xuyên thành của nhồi máu ở bệnh nhân NMCT cấp [9]. Các tác giả này đã tìm thấy trong số những vùng bị rối loạn chức năng (RLCN), giảm mức độ xuyên thành của NMCT sẽ gắn liền với việc cải thiện nhiều hơn chức năng co bóp về sau. Đây cũng là điều chúng tôi tìm thấy trong nghiên cứu của chúng tôi khi khảo sát mối tương quan giữa sự thay đổi EF và SWT sau CTĐMVQD với chỉ số sống còn cơ tim được tính theo mức độ xuyên thành của tăng tín hiệu muộn. Khác với nghiên cứu của Choi [9] và nghiên cứu của Beek năm 2003 [10] định nghĩa phân đoạn rối loạn chức năng trên CMR là có điểm vận động vùng > 0 và định nghĩa vùng cơ tim có RLCN nhưng còn sống là vùng có điểm vận động vùng > 0 đồng thời có điểm tăng tín hiệu muộn từng phân đoạn là 0 hay 1( hình ảnh tăng tín hiệu <25% bề dày thành thất), nghiên cứu của chúng tôi xem những phân đoạn có SWT £ 45% là rối loạn chức năng, và vùng cơ tim có RLCN nhưng còn sống là vùng có SWT £ 45% đồng thời có điểm tăng tín hiệu muộn từng phân đoạn là £ 2 (hình ảnh tăng tín hiệu <50% bề dày thành thất). Định nghĩa phân đoạn rối loạn chức năng trên CMR của chúng tôi tương tự như 2 nghiên cứu của Timo Baks năm 2006 [4][11] và nghiên cứu của Kirschbaum năm 2010 [3]. Tuy nhiên các tác giả này lại định nghĩa vùng cơ tim có RLCN nhưng còn sống là vùng có SWT £ 45% đồng thời có điểm tăng tín hiệu muộn từng phân đoạn là £ 1 (hình ảnh tăng tín hiệu <25% bề dày thành thất). Sau khi tắc nghẽn ĐMV, sự lan rộng trong không gian của vùng “bị nguy cơ” được thiết lập theo vùng tưới máu của ĐM bị tắc nghẽn. Bên trong vùng bị nguy cơ, hoại tử bắt đầu trước tiên ở vùng dưới nội tâm mạc, và sau đó lan rộng ra dạng sóng lan (wavefront) về phía thượng tâm mạc. Hiện tượng hoại tử dạng sóng lan này có thể giải thích cho việc mức độ xuyên thành của nhồi máu tiên đoán được sự cải thiện chức năng co bóp về sau. Trong vòng vài ngày đầu sau tái tưới máu (CMR cơ bản lần 1), hầu hết (nếu không phải tất cả) vùng bị nguy cơ sẽ bị rối loạn chức năng, hoặc là do hoại tử hoặc là do choáng váng. Trong số vùng bị rối loạn chức năng này, những bệnh nhân có thời gian tắc nghẽn ngắn hơn và/hoặc có tuần hoàn bàng hệ nhiều hơn sẽ có vùng nhồi máu nhỏ hơn, và, do hiện tượng sóng lan, sẽ kết hợp với mức độ xuyên thành của nhồi máu thấp hơn. Các phân đoạn bị rối loạn chức năng có mức độ xuyên thành nhẹ hơn thì nhiều khả năng có một tỉ lệ đáng kể cơ tim bị choáng váng và có thể phục hồi chức năng theo thời gian trên CMR lần 2 qua theo dõi. Ngược lại, những phân đoạn rối loạn chức năng có mức độ xuyên thành nhiều hơn sẽ chủ yếu bị hoại tử và nhiều khả năng sẽ không cải thiện chức năng. So sánh với các nghiên cứu cùng đề tài trên thế giới, chúng tôi thấy hệ số tương quan của mối tương quan giữa sự thay đổi EF sau CTĐMVQD với số phân đoạn cơ tim bị rối loạn chức năng còn sống trước CTĐMVQD của nghiên cứu chúng tôi thấp hơn (xem bảng 6). Sự khác biệt này có khả năng là do có sự khác nhau trong định nghĩa vùng cơ tim có RLCN nhưng còn sống mà chúng tôi đã đề cập ở trên. Ngoài ra cỡ mẫu của chúng tôi cũng nhỏ hơn so với các nghiên cứu khác.
Bảng 6: So sánh khảo sát mối tương quan giữa độ xuyên thành của tăng tín hiệu muộn trên CMR với sự cải thiện chức năng thất trái sau CTĐMVQD giữa các nghiên cứu
|
Nghiên cứu |
n |
r – p (thay đổi EF) |
r – p (thay đổi WMS/SWT) |
|
Kim Raymond J (2000) [12] |
41 |
0.7 – <0.001 |
0.75 – <0.001 |
|
Choi Kelly M (2001) [9] |
24 |
0.65 – 0.02 |
0.87 – <0.001 |
|
Bask Timo (2006) [12] |
27 |
0.49 – 0.01 |
NA |
|
Kirschbaum SW (2008) [13] |
24 |
0.44 – <0.05 |
? |
|
Kirschbaum SW (2010) [9] |
71 |
0.64 – <0.0001 |
NA |
|
Chúng tôi |
20 |
0.55 – 0.01 |
0.65 – 0.002 |
Về khảo sát khả năng tiên đoán cải thiện chức năng toàn bộ thất trái của DE-CMR được thực hiện trước khi CTĐMVQD, kết quả của chúng tôi cho thấy độ nhạy, độ đặc hiệu, giá trị tiên đoán dương, giá trị tiên đoán âm của chỉ số sống còn cơ tim £ 29% lần lượt là 67%, 63%, 73% & 56%. Nếu so sánh với các nghiên cứu của Kirschbaum năm 2010 (bảng 7), thì các giá trị trong nghiên cứu của chúng tôi đều thấp hơn. Điều này có thể là do chúng tôi sử dụng điểm cắt của chỉ số sống còn cơ tim (được tính dựa trên mức độ xuyên thành của hình ảnh tăng tín hiệu muộn phản ánh sẹo NMCT) cao hơn (29%) so với nghiên cứu củaKirschbaum (25%).
Bảng 7: So sánh độ chính xác chẩn đoán trong tiên đoán cải thiện chức năng toàn bộ thất trái
|
Nghiên cứu |
Độ nhạy (khoảng tin cậy 95%) |
Độ đặc hiệu |
Giá trị tiên đoán dương |
Giá trị tiên đoán âm |
|
Kirschbaum SW (2010) [9] |
70 (50-86) |
77 (58-89) |
70 (47-86) |
77 (58-90) |
|
Chúng tôi |
67 (35-90) |
63 (25-91) |
73 (39-94) |
56 (21-86) |
Về hạn chế của đề tài nghiên cứu, hạn chế trước tiên, thấy rõ rệt nhất, quan trọng nhất và ảnh hưởng nhiều đến kết quả nghiên cứu đó là cỡ mẫu quá nhỏ. Cỡ mẫu nhỏ đã làm giảm lực (power) của nghiên cứu nên các hệ số tương quan, độ chính xác chẩn đoán trong tiên đoán cải thiện chức năng toàn bộ thất trái của nghiên cứu đều thấp hơn so với các nghiên cứu cùng đề tài, và chúng tôi cũng không thể test phát hiện các mối tương quan giữa các thông số CMR khác với sự thay đổi chức năng toàn phần cũng như chức năng từng vùng của thất trái. Tuy nhiên, do đây chỉ là kết quả phân tích trên 20 bệnh nhân đầu của một nghiên cứu sâu hơn về vai trò của cộng hưởng từ trong đánh giá hiệu quả của CTĐMVQD mà chúng tôi sẽ công bố sau này, chúng tôi hy vọng sẽ khắc phục được hạn chế này trong nghiên cứu sau. Một hạn chế khác của nghiên cứu là mặt bệnh trong lô nghiên cứu không thống nhất & đồng bộ. Tuy cả 20 bệnh nhân đều là hội chứng mạch vành cấp, lô nghiên cứu bao gồm cả CĐTNKOĐ, NSTEMI lẫn STEMI, bao gồm cả can thiệp tiên phát STEMI lẫn can thiệp cấp cứu, bán khẩn hay chương trình. Hạn chế này có thể gây khó khăn trong phân tích & diễn giải kết quả nghiên cứu. Cũng cần nhắc đến các hạn chế do các yếu tố gây nhiễu: nhiễu về độ chính xác của tiền sử BMV, tiền sử điều trị; nhiễu trong yếu tố người đọc kết quả MRI…
5. KẾT LUẬN:
Qua khảo sát cộng hưởng từ tim đa kỹ thuật trước và sau (3-6 tháng) CTĐMVQD thành công (về mặt giải phẫu chụp mạch) của 20 bệnh nhân bị hội chứng mạch vành cấp, chúng tôi nhận thấy cộng hưởng từ tăng tương phản muộn, mà cụ thể là chỉ số sống còn cơ tim có mối tương quan tuyến tính thuận với sự thay đổi chức năng toàn phần (EF) và từng vùng (SWT) thất trái sau can thiệp. Chỉ số sống còn cơ tim được tính từ cộng hưởng từ tăng tương phản muộn trước CTĐMVQD cũng có thể tiên đoán khả năng cải thiện chức năng toàn phần thất trái sau can thiệp. Như vậy kết quả nghiên cứu đã cho thấy hưởng từ tăng tương phản muộn trước CTĐMVQD đã giúp nhận diện được những vùng cơ tim tuy có rối loạn chức năng nhưng vẫn còn sống & có thể cải thiện chức năng sau CTĐMVQD, từ đó đã bước đầu chứng minh giá trị của cộng hưởng từ tim, đặc biệt là cộng hưởng từ tăng tương phản trong chẩn đoán, tiên lượng và định hướng điều trị tái thông bệnh mạch vành. Chúng tôi sẽ tiếp tục khảo sát sâu hơn vai trò của cộng hưởng từ tim trong đánh giá hiệu quả của CTĐMVQD trong những nghiên cứu sắp tới.
TÀI LIỆU THAM KHẢO
1. Rossum Av. Magnetic resonance imaging. Imaging Ischaemia. 1st ed2000. p. 45-55.
2. Hendel RC et al. ACC/AHA/ACR/ASE/ASNC/HRS/NASCI/RSNA/SAIP/SCAI/SCCT/SCMR/SIR 2008 Key Data Elements and Definitions for Cardiac Imaging. Circulation, 2009(119): p. 154-186.
3. Kirschbaum Sharon W. et al. Complete Percutaneous Revascularization for Multivessel Disease in patients with impaired left vantricular function. J Am Coll Cardiol Intv 2010;3:392- 400
4. Baks T, et al. Prediction of left ventricular function after drug-eluting stent implantation for chronic total coronary occlusions. J Am Coll Cardiol. 2006;47:721-5.
5. Han W. Kim, M. and e. al., CMR in patients with MI. JACC, 2010. 55(No. 1): p. 1-16.
6. Rossum Av. Magnetic resonance imaging. Imaging Ischaemia. 1st ed2000. p. 45-55.
7. Kim RJ, Fieno DS, Parrish TB, et al. Relationship of MRI delayed contrast enhancement to irreversible injury, infarct age, and contractile function. Circulation. 1999;100:1992-2002.
8. Fieno DS, Kim RJ, Chen EL, et al. Contrast-enhanced magnetic resonance imaging of myocardium at risk: distinction between reversible and irreversible injury throughout infarct healing. J Am Coll Cardiol. 2000;36:1985-1991.
9. Kelly M. Choi, MD; Raymond J. Kim, MD; George Gubernikoff, MD; John D. Vargas, BS; Michelle Parker, MS, RN; Robert M. Judd, PhD. Transmural Extent of Acute Myocardial Infarction Predicts Long-Term Improvement in Contractile Function. Circulation. 2001;104:1101-1107
10. Beek MA et al. Delayed Contrast-Enhanced Magnetic Resonance Imaging for the Prediction of Regional Functional Improvement After Acute Myocardial Infarction. J Am Coll Cardiol 2003;42:895-901.
11. Baks T, et al. Effects of primary angioplasty for AMI on early & late infarct size & LV wall characteristics. J Am Coll Cardiol. 2006;47(1):40-4.
12. Kim RJ, Wu E, Rafael A, et al. The use of contrast-enhanced magnetic resonance imaging to identify reversible myocardial dysfunction. N Engl J Med 2000;343:1445-53.
13. Kirschbaum Sharon W et al. Prediction of Improvement iun Left Ventricular Function in Patients with Multivessel Disease Treated with Percutaneous Coronary Intervention .Circulation. 2008;118:S_632.







