I. Mở đầu: viêm cơ tim là một trong các nguyên nhân của suy tim xảy ra ở các bệnh nhân với tim bình thường về mặt cấu trúc và chức năng trước đó. Viêm cơ tim còn là nguyên nhân của các rối loạn nhịp, đặc biệt là các rối loạn nhịp nhanh thất ở các bệnh nhân trẻ.
BS Huỳnh Phúc Nguyên*
BS Nguyễn Trường Duy**
TS.BS Lê Thanh Liêm*
PGS.TS.BS Châu Ngọc Hoa**
*Khoa Nội Tim mạch BV Chợ Rẫy
**Bộ môn Nội ĐHYD
Tuy nhiên, viêm cơ tim thường ít được nghĩ đến do các biểu hiện lâm sàng không đặc hiệu và chẩn đoán thường là loại trừ. Hơn nữa, một số các rối loạn nhịp được cho là vô căn hoặc liên quan đến các rối loạn di truyền, thực chất là do viêm cơ tim hoặc viêm cơ tim là yếu tố khởi phát.
II. Tình huống lâm sàng
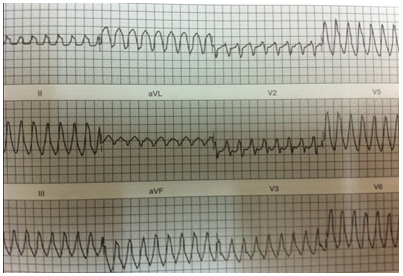
1. Tình huống I: bệnh nhân nữ, Nguyễn thị N, 1979, nhập viện ngày 27-07-2012, số nhập viện 115618, vì đau ngực. Bệnh nhân bị sốt, mệt mỏi khoảng 4 ngày, sau đó, bị khó thở. Siêu âm tim cho thấy các buồng tim không dãn, vô động vách liên thất với EF#25% và PAPs#75mmHg. Điện tâm đồ lúc vào viện là nhịp xoang # 120l/p với nghẽn nhĩ thất độ III, nhịp tự thất. Sau đó, phát triển nhịp nhanh thất đa dạng.
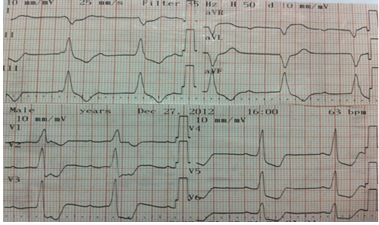
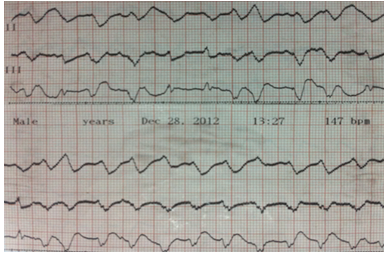
MRI tim cho thấy hình ảnh viêm cơ tim vùng giữa vách liên thất. Bệnh nhân được đặt máy tạo nhịp tạm thời và kết thúc nhịp nhanh thất bằng Lidocain, cùng với chế độ điệu trị suy tim chuẩn. Bệnh nhân đáp ứng tốt vởi điều trị và được xuất viện ngày 28-01-20013 với chức năng tim hồi phục hoàn toàn với nhịp xoang. Bệnh nhân tái khám thường xuyên mỗi tháng với tình trạng lâm sàng ổn và sinh hoạt bình thường.
2. Tình huống II: bệnh nhân nam, Nguyễn thanh H, 1984, nhập viện ngày 24-03-2013, số nhập viện 23666, vì hôn mê. Bệnh nhân bị mệt và nặng ngực, sau đó được người nhà phát hiện trong tình trạng bất tỉnh. Điện tâm đồ lúc nhập viện cho thất nhịp nhanh thất. Bệnh nhân được hồi sức bằng sốc điện chuyển nhịp và duy trì nhịp xoang bằng lidocain và điều chỉnh điện giải. Điện tâm đồ lúc nhịp xoang có các ngoại tâm thu thất dạng từ buồng tống ( outflow tract PVC), đoạn ST và sóng T bình thường. Tiền căn bệnh nhân bị ngất nhiều lần và uống thất không rõ loại. Siêu âm tim không phát hiện bất thường về cấu trúc các buồng tim, chức năng tim bình thường. CMR tim cho thất túi phình vùng vách liên thất ở buồng tống kèm hình ảnh viêm cơ tim. Bệnh nhân từ chối khảo sát điện sinh lý và cắt đốt điện. Bệnh nhân được điều trị bằng Flecainid và xuất viện ngày 09-04-2013 và tái khám hằng tháng với tình trạng tim mạch ổn.
III. Bàn luận:
- Viêm cơ tim là nguyên nhân gây ra các rối loạn nhịp và đột tử do tim:
Viêm cơ tim là tình trạng bệnh lý đặc trưng bởi quá trình viêm xảy ra tại cơ tim kết hợp với tình trạng hoại tử tế bào cơ tim. Nó là hậu quả phơi nhiễm hoặc với các kháng nguyên bên ngoài như siêu vi trùng, vi trùng, ký sinh trùng, thuốc… hoặc các yếu tố khởi kích bên trong ( internal triggers) như sự hoạt hóa tự miễn chống lại các tự kháng nguyên. Nhiễm siêu vi trùng là nguyên nhân thường gặp nhất trong đa phần viêm cơ tim ở các nước bắc Mỹ và châu Âu. Nhiều trường hợp viêm cơ tim không có biểu hiện lâm sàng hoặc triệu chứng không rõ ràng nên không được chẩn đoán, do vậy tần suất viêm cơ tim không được biết chính xác, chỉ được ước tính từ 1 đến 10 trường hợp trên 100.000 người mỗi năm. Các triệu chứng của viêm cơ tim thường thể hiện chậm từ vài ngày đến vài tuần sau khi bắt đầu quá trình bệnh lý và không có tính chất đặc hiệu bao gồm mệt mỏi, khó thở, hồi hộp, đau ngực không điển hình hoặc các triệu chứng suy tim. Nhiều trường hợp viêm cơ tim được biểu hiện bằng đột tử hoặc các rối loạn nhịp thất, đặc biệt là ở các bệnh nhân trẻ. Các nghiên cứu tử thiết ( post mortem studies ) cho thấy viêm cơ tim là nguyên nhân chính của đột tử không giải thích được ở các bệnh nhân dưới 40 tuổi(1,2). Thật vậy, viêm cơ tim thường gây ra các rối loạn nhịp thất kết hợp với rối loạn chức năng tâm thu hoặc thất trái hoặc thất phải hoặc cả hai. Các rối loạn nhịp này xảy ra trong viêm cơ tim cấp tính và mạn tính có ảnh hưởng xấu lên tiến trình tự nhiên của bệnh, do nó góp phần làm suy thoái chức năng tim và có thể dẫn đến tử vong(3,4,5). Các cơ chế sinh rối loạn nhịp trong bệnh cảnh viêm cơ tim bao gồm hoại tử tế bào cơ tim và xơ hóa mô cơ tim tạo nên cơ chế vòng vào lại, hoạt tính khởi kích ( trigger activity) do hiệu quả sinh loạn nhịp của cytokines và các chất trung gian gây viêm qua cơ chế điều tiết chức năng các kênh điện giải, chủ yếu là các kênh potassium và calcium, làm kéo dài giai đoạn trơ hiệu quả, tăng thời gian điện thế hoạt động một pha và tăng giai đoạn nguy hiểm ( vulnerability) của cơ thất . Ở các bệnh nhân bị viêm cơ tim mạn thể hoạt động, quá trình viêm dai dẳng thường có liên quan đến sự tồn tại của siêu vi trùng tại cơ tim hoặc các cơ chế tự miễn tự duy trì; tiến trình xơ hóa cơ tim đồng thời với môi trường viêm dai dẳng xung quanh các tế bào tạo ra hiện tượng tái cấu trúc điện học làm nền tảng sinh ra các rối loạn nhịp. Người ta đã chứng minh được rằng sự tồn tại của enteroviruses làm tổn thương cơ tim ngay khi không có viêm cơ tim rõ ràng, do phóng thích các proteases có khả năng tách các dystrophin, tạo ra các bất thường tại bộ xương tế bào làm ảnh hưởng đến các đặc tính cơ học và điện học của cơ tim và cuối cùng dẫn đến chết tế bào cơ tim, có thể là một yếu tố góp phần sinh rối loạn nhịp(6). Một điều may mắn là các thay đổi điện này có thể hồi phục một phần hoặc hoàn toàn sau khi quá trình viêm kết thúc và siêu vi trùng được thải trừ hoàn toàn.
Viêm cơ tim có thể chỉ gây ra các rối loạn nhịp thất ở các bệnh nhân hoặc không có triệu chứng rõ ràng hoặc chức năng tim bình thường hoặc chỉ với các bất thường tối thiểu trên điện tâm đồ và cấu trúc tim mà các bất thường này thường chỉ được phát hiện bằng các kỹ thuật chẩn đoán hình ảnh như cộng hưởng từ ( cardiac magnetic resonance CMR ) và chụp buồng thất ( ventricular angiography )(7,8). Một nghiên cứu được công bố năm 2001 cho thấy có các túi phình thất nhỏ ở các bệnh nhân bị rối loạn nhịp thất vô căn(9). Khảo sát mô học các mẫu sinh thiết cơ tim xung quanh túi phình đã phát hiện sự hiện diện của viêm cơ tim lympho bào thể hoạt động ( active lymphocytic myocarditis) với tình trạng ly giải tế bào cơ tim nặng ( intense myocytolisis).
Viêm cơ tim thất phải tạo ra các bất thường cấu trúc bao gồm các vi túi phình ( microaneurysms ) và các biểu hiện rối loạn nhịp điển hình của bệnh cơ tim thất phải sinh rối loạn nhịp ( arrhythmogenic right ventricular cardiomyopathy ARVC). Thật vậy, các thâm nhiễm do quá trình viêm kết hợp với hoại tử và xơ hóa cơ tim dẫn đến các thay đổi về mặt chức năng và cấu trúc cơ thất phải tương tự như các thay đổi do sự thay thế mô cơ tim bằng mô sợi-mỡ ( fibrofatty replacement) trong bệnh cảnh ARVC, tạo ra nền tảng bản đồ điện thế bất thường và các rối loạn nhịp thất(10,11). Viêm cơ tim được chẩn đoán bằng sinh thiết cơ tim hiện diện đến 50% ở các bệnh nhân đáp ứng đầy đủ các tiêu chuẩn chẩn đoán ARVC và nó kết hợp với sự hiện diện của các vùng điện thế thất, được phát hiện bằng kỹ thuật vẽ bản đồ điện-giải phẫu 3 chiều ( 3D electro-anatomic mapping)(11). Gần đây có những báo cáo là bệnh sarcoidosis thất phải cũng có các đặc tính bản đồ điện-giải phẫu và các biểu hiện rối loạn nhịp giống với ARVC(12,13,14).
Trong các thập niên gần đây, viêm cơ tim được xem là nguyên nhân quan trọng của đột tử do rối loạn nhịp ở các bệnh nhân với tim bình thường về mặt cấu trúc và chức năng. Năm 1986, Phillips và cộng sự đã nghiên cứu các nạn nhân bị đột tử do tim trong Không lực, viêm cơ tim được nhận biết là nguyên nhân của tử vong trong 40% các trong hợp(15). Trong các nghiên cứu gần đây hơn, phần trăm viêm cơ tim được phát hiện bằng tử thiết ở các bệnh nhân với tim bình thường, bị đột tử do rối loạn nhịp thay đổi từ 5% đến 12%(2,7). Năm 1994, một nghiên cứu trên 17 bệnh nhân trẻ ( 10 nam, 7 nữ, tuổi từ 14 đến 38) bị ngưng tim đột ngột, không có bệnh tim thực thể trước đó và được thực hiện các trắc nghiệm điện tâm đồ, siêu âm tim, chụp động mạch vành, CMR, EPS ( electrophysiology study) và sinh thiết cơ tim. Các bệnh nhân được chia là 2 nhóm: nhóm 1 bao gồm 9 bệnh nhân có các thông số tim hoàn toàn bình thường, nhóm 2 bao gồm 8 bệnh nhân có các bất thường không đặc hiệu về cấu trúc ( 4 bệnh nhân có dãn và giảm động thất trái, 3 bệnh nhân có dày đồng tâm thất trái, 1 bệnh nhân có rối loạn chức năng thất phải). Tất cả bệnh nhân có bất thường về mô học với 65% có các sang thương đặc hiệu, đặc biệt là viêm cơ tim thể hoạt động được tìm thấy trong 6 bệnh nhân nhóm 1. Các bệnh nhân này được nhận chế độ điều trị ức chế miễn dịch và thuốc chống loạn nhịp đã không xuất hiện rối loạn nhịp và biến mất viêm cơ tim trên các mẫu sinh thiết(16). Một nghiên cứu trên 273 nạn nhân đột tử do tim, trong số 76 nạn nhân với tim bình thường về quan sát đại thể có 79% có các bất thường về mô học với 36% là viêm cơ tim thể hoạt động(17). Các dữ liệu trên gợi ý viêm cơ tim là nguyên nhân quan trọng của các đột tử do rối loạn nhịp, nhưng thường không được nhận biết và không được quan tâm. Theo UCARE (Unexplained Cardiac Arrest Registry of Europe) và IVS-US ( Idiopathic Ventricular Fibrillation Registry of United States), viêm cơ tim là một trong các rối loạn dưới lâm sàng gây ra đột tử(18). Cũng cần nhấn mạnh là viêm cơ tim là nguyên nhân của đột tử do rối loạn nhịp ở các vận động viên điền kinh thường bị nhiễm siêu vi đường hô hấp trên, do vậy, gắng sức trong bệnh cảnh đang bị viêm cơ tim hoạt động được xem là yếu tố khởi kích gây ra rối loạn nhịp.
2. Viêm cơ tim và các hội chứng rối loạn nhịp do đột biến gen và bệnh cơ tim:
Trong các thập niên gần đây, vài nghiên cứu cho thấy sự hiện diện của viêm cơ tim trong bệnh sinh của các hội chứng rối loạn nhịp do đột biến gen và các bệnh cơ tim. Viêm cơ tim tác động như là một cơ chế gây tổn thương cơ tim, làm nặng thêm các rối loạn chức năng có liên quan đến các bất thường do đột biến gen hoặc như là yếu tố khởi kích các biểu hiện lâm sàng đặc hiệu như rối loạn nhịp, xuất hiện muộn trong bệnh sử tự nhiên của bệnh. Viêm cơ tim được tìm thấy trên các mẫu sinh thiết và tử thiết ở các bệnh nhân ARVC, hội chứng Brugada, bệnh cơ tim phì đại. Trong ARVC, viêm cơ tim hiện diện trong 75% các mẫu tử thiết và có thể là yếu tố khởi kích các rối loạn nhịp nhanh thất(19). Viêm cơ tim có thể là hiện tượng phản ứng với tình trạng chết tế bào hoặc là hậu quả của nhiễm trùng hoặc cơ chế miễn dịch. Bowles và cộng sự đã phát hiện sự hiện diện của siêu vi trùng trong cơ tim ở các bệnh nhân ARVC và cho là ARVC là do bệnh nguyên nhiễm trùng ( infective etiology)(20). Nhưng Calabrese và cộng sự lại cho là sự hiện diện của siêu vi trùng chỉ là bystanders vô tội hoặc tiến trình thoái tế bào tự phát tạo môi trường thuận lợi cho sự định cư của chúng(21). Dù là bất kỳ cơ chế nào, một điều đáng chú ý là viêm cơ tim có thể có các biểu hiện lâm sàng, các rối loạn nhịp và các bất thường của thất phải về mặt cấu trúc tương tự như là ARVC(11,22).
Pieroni và cộng sự đã nghiên cứu 18 bệnh nhân với hội chứng Brugada với các biểu hiệu lâm sàng rung thất ở 7 bệnh nhân, nhanh thất đa dạng kéo dài ở 7 bệnh nhân và ngất ở 4 bệnh nhân. Tất cả bệnh nhân được chụp mạch vành và buồng thất, sinh thiết cơ tim cả 2 buồng thất và khảo sát DNA để sàng lọc gen SCN5A. Về mô học, 14 bệnh nhân có viêm cơ tim thất phải lan tỏa hoặc khu trú, 1 bệnh nhân với ARVC và 3 bệnh nhân có các thay đổi bệnh cơ tim; 4 bệnh nhân này có đột biến gen SCN5A gây ra các bất thường chức năng của các proteins đột biến. Các bệnh nhân này có tình trạng thoái hóa tương bào cơ tim và sự gia tăng chết tế bào cơ tim theo chương trình ở 2 buồng thất so với nhóm chứng(23). Nghiên cứu này đã là sáng tỏ tính phức tạp giữa các biểu hiện lâm sàng của hội chứng Brugada, sự hiện diện của đột biến gen SCN5A và sự hiện diện của bệnh tim cấu trúc và đã mang lại bằng chứng mới là viêm cơ tim có liên quan đến sự phát triển thoáng qua các bất thường trên điện tâm đồ giống hội chứng Brugada và các rối loạn nhịp.Tuy nhiên, vẫn còn chưa rõ ràng là viêm cơ tim là một phần của các thay đổi theo sau các rối loạn chức năng của các kênh điện giải hay viêm cơ tim tạo ra các bất thường trên điện tâm đồ và các rối loạn nhịp giống hội chứng Brugada.
Viêm cơ tim cũng được tìm thấy ở các bệnh nhân với bệnh cơ tim phì đại và các biểu hiện rối loạn nhịp, gợi ý là quá trình viêm tác động như là yếu tố khởi kích các rối loạn nhịp nghiêm trọng(24). Tuy nhiên, cũng chưa rõ là viêm cơ tim là hậu quả của tiến trình phản ứng với tình trạng hoại tử tế bào cơ tim hay là tiến trình làm tổn thương do siêu vi trùng hay tự miễn chồng lên.
1. Chẩn đoán viêm cơ tim:
Chẩn đoán viêm cơ tim phải được thực hiện trên cơ sở mô học theo tiêu chuẩn Dallas, do vậy, sinh thiết cơ tim là tiêu chuẩn vàng cho chẩn đoán viêm cơ tim và là nền tảng để có chế độ điều trị thích hợp. Tuy nhiên, tính nhạy cảm của kỹ thuật sinh thiết thấp do bản chất của sang thương viêm là từng mảng và các nguy cơ nghiêm trọng của kỹ thuật sinh thiết nên chỉ định sinh thiết cơ tim bị hạn chế và chẩn đoán viêm cơ tim dựa vào kỹ thuật chẩn đoán hình ảnh CMR và chụp động mạch vành.
1 Cộng hưởng từ tim CMR có khả năng thể hiện các đặc tính mô học của cơ tim ( dựa vào số lượng nước và động học của chất đối quang): thâm nhiễm, hoại tử, xơ hóa và phù nề. Tuy nhiên, CMR có vài hạn chế do tính khó khăn về kỹ thuật để có được hình ảnh tốt ở các bệnh nhân bị rối loạn nhịp và tính an toàn có liên quan đến các thiết bị tạo nhịp. Chẩn đoán viêm cơ tim dựa trên CMR khi có ít nhất 2 trong các hình ảnh: một vùng gia tăng gadolinium muộn ( phù hợp với tổn thương cơ tim và sẹo) mà không do thiếu máu cơ tim cục bộ ( loại trừ lớp dưới nội tâm mạc và/hoặc các vùng cơ tim phân bố không phù hợp với vùng tưới máu của mạch vành), tăng tín hiệu toàn bộ hoặc khu trú trong hình ảnh tăng T2 ( chỉ định tình trạng phù nề mô), gia tăng toàn bộ gadolinium sớm ( phù hợp với tăng lượng máu ( hyperemia)(25). CMR cho phép phát hiện các bệnh cơ tim cấu trúc, bao gồm viêm cơ tim, đến 30% các bệnh nhân bị rối loạn nhịp thất(26). Các nghiên cứu lâm sàng sử dụng CMR trong chẩn đoán viêm cơ tim ở các bệnh nhân bị rối loạn nhịp hoặc suy tim cho thấy độ nhạy cảm và độ đặc hiệu của CMR hơn 90%(27). CMR có khả năng phân biệt quá trình viêm đang hoạt động với quá trình viêm đang hồi phục ở các bệnh nhân bị viêm cơ tim mạn. De Cobelli và cộng sự đã sử dụng CMR và sinh thiết cơ tim để nghiên cứu các bệnh nhân bị viêm cơ tim mạn(28). Các vùng tăng T2 được tim thấy ở 36% bệnh nhân bị viêm cơ tim mạn hoạt động, nhưng không có ở bệnh nhân bị viêm cơ tim tới hạn ( borderline myocarditis). Các vùng tăng gadolinium muộn được tìm thấy ở 84% bệnh nhân bị viêm cơ tim hoạt động và 44% bệnh nhân bị viêm cơ tim tới hạn. Dạng giữa thành của vùng tăng muộn thường được tìm thấy ở các bệnh nhân bị viêm cơ tim hoạt động và tới hạn, ngược lại, dạng dưới thượng mô cơ tim chỉ gặp ở các bệnh nhân bị viêm cơ tim hoạt động. Như vậy, CMR là phương tiện dùng để nghiên cứu chẩn đoán viêm cơ tim, đặc biệt ở các bệnh nhân bị rối loạn nhịp thất và là phương tiện theo dõi không xâm lấn quan trọng. Hơn nữa, CMR còn dùng để hướng dẫn vị trí thực hiện sinh thiết cơ tim.
2. Sinh thiết cơ tim ( endomyocardial biopsy EMB): là tiêu chuẩn vàng để chẩn đoán viêm cơ tim vì nó cho phép nhận biết các đặc điểm của quá trình viêm, đánh giá tình trạng hoại tử và xơ hóa cơ tim cũng như phát hiện các genomes của các siêu vi trùng. Do các sang thương viêm là từng mảng, nên dễ sai lầm khi lấy mẫu, dẫn đến độ nhạy cảm của EMB thấp từ 38% đến 65%. Hơn nữa, EMB có các nguy cơ nghiêm trọng như tử vong (0.05%), thủng tim và chèn ép tim cấp ( 0.3% – 0.5%), thuyên tắc huyết khối, rối loạn nhịp, tổn thương van 3 lá…nên chỉ định EMB bị hạn chế. Theo AHA/ACC/ESC 2007, có 14 bệnh cảnh lâm sàng mà EMB được chỉ định với giá trị chẩn đoán, tiên lượng và điều trị, bao gồm tình huống rối loạn nhịp nhanh thất kéo dài và/hoặc đe dọa tính mạng và các rối loạn dẫn truyền nhĩ thất độ II và độ III(29).
- Điều trị:
Mặc dù có sự cải tiến các kỹ thuật chẩn đoán giúp xác định các đặc tính và bệnh nguyên của tiến trình viêm và các hiểu biết đặc hiệu hơn các cơ chế làm tổn thương cơ tim, một chế độ điều trị chuẩn, đặc hiệu cho viêm cơ tim vẫn chưa được áp dụng. Xác định bệnh nguyên của viêm cơ tim dựa trên đánh giá hóa-mô và bằng chứng nhiễm siêu vi trùng dựa trên PCR ở các mẫu mô sinh thiết là thiết yếu để thiết lập các chiến thuật điều trị thích hợp. Điều trị ức chế miễn dịch cho các bệnh nhân bị viêm cơ tim chỉ có hiệu quả khi không có sự hiện diện dai dẳng của siêu vi trùng trong cơ tim. Kuhl và cộng sự đã phân tích 172 bệnh nhân với bệnh cơ tim dãn nở và có bằng chứng nhiễm siêu vi trùng trên mẫu mô sinh thiết, cho thấy tần suất cao nhiễm entoroviruses ( 32.6%)và parvoviruse B19 ( 36%), và sự hiện diện dai dẳng của siêu vi trùng kết hợp với sự suy giảm tiến triển phân suất tống máu của thất trái, ngược lại, có sự cải thiện chức năng thất trái khi siêu vi trùng được thải trừ tự phát(30). Như vậy, sự hiện diện dai dẳng của siêu vi trùng trong cơ tim có vai trò tiên lượng âm tính.
Tính tự miễn cũng có vai trò nổi bật trong tiến trình tổn thương cơ tim và tính dai dẳng của các triệu chứng, bao gồm các rối loạn nhịp. Điều đáng chú ý là tình trạng nhiễm siêu vi trùng cấp và sự hiện diện thường xuyên của siêu vi trùng trong cơ tim có thể gây ra tính tự miễn qua các cơ chế chưa được làm sáng tỏ một cách đầy đủ. Sự bắt chước về mặt phân tử được xem là một cơ chế giải thích viêm cơ tim mạn và một vài kháng nguyên tế bào được nhận biết có phản ứng chéo với các kháng nguyên siêu vi trùng, tạo ra các bia trong viêm cơ tim do siêu vi trùng(31,32). Các tự kháng thể được tạo ra có thể do tổn thương tế bào cơ tim ban đầu do nhiễm siêu vi trùng, làm phóng thích một số lượng lớn các tự kháng nguyên vào tuần hoàn. Các tự kháng thể chống lại các thụ thể adrenergic và acetylcholine, các cấu trúc co bóp, các proteins của chất nền ngoài tế bào, các proteins liên quan đến quá trình chuyển hóa năng lượng, các thụ thể can-xi, các proteins cân bằng nội môi và chống stress được phát hiện ở các bệnh nhân bị viêm cơ tim(33,34). Tính tự miễn được xem là cơ chế bệnh sinh chính trong viêm cơ tim do tăng bạch cầu ái toan ( eosinophilic myocarditis), viêm cơ tim tế bào lớn ( giant cell myocarditis), viêm cơ tim tế bào hạt ( granulomatous myocarditis), viêm cơ tim kết hợp với bệnh mô liên kết, bệnh cơ tim chu sinh hoặc ghép tim mà điều trị ức chế miễn dịch cho thấy có hiệu quả(35,36). Như vậy, điều trị ức chế miễn dịch được chỉ định cho các trường hợp viêm cơ tim với siêu vi trùng âm tính. Sự thiếu đáp ứng với điều trị ức chế miễn dịch có thể do sự hiện diện của siêu vi trùng không được khảo sát hoặc do các cơ chế gây tổn thương cơ tim không nhạy cảm với ức chế miễn dịch. Điều trị kháng siêu vi trùng được chỉ định khi có bằng chứng về sự hiện diện dai dẳng của siêu vi trùng trong mô cơ tim với mục đích ngăn chặn tổn thương cơ tim do siêu vi trùng gây ra và ức chế sự tăng sinh của siêu vi trùng bằng cách ngăn chặn sự tương tác của siêu vi trùng với các thụ thể trên tế bào và các hệ thống tín hiệu khuếch đại như tyrosine kinase p561lck, phosphatase CD45, downstream ERK1/2(37).
Hiện tại, chưa có các thử nghiệm đặc hiệu hay chỉ có các nghiên cứu đơn trung tâm về điều trị các rối loạn nhịp do viêm cơ tim. Điều trị các rối loạn nhip do viêm cơ tim cấp chủ yếu là điều trị nâng đở ( supportive therapy) vì các rối loạn nhịp này thường kết thúc sau giai đoạn cấp, có thể kéo dài trong vài tuần, cùng với sự tiêu biến quá trình viêm. Trong viêm cơ tim mạn, điều trị các rối loạn nhịp cũng chỉ giới hạn ở các thuốc chống loạn nhịp; cấy ICD ( implantable cardioverter-defibrillator) khi bệnh nhân có nguy cao với các rối loạn nhịp gây rối loạn huyết động và các bệnh sống sót sau đột tử ( aborted sudden death)(38). Kỹ thuật cắt đốt bằng sóng cao tần ( radiofrequency catheter ablation) có hiệu quả là giảm xuất hiện các rối loạn nhịp nhanh thất ở bệnh nhân bị viêm cơ tim Chagas và sarcoidosis cũng như viêm cơ tim do lympho bào ( lymphocytic myocarditis)(4,39,40,41).
IV. Kết luận:
Viêm cơ tim là một nguyên nhân thường gặp nhưng cũng thường ít được quan tâm của các rối loạn nhịp thất nghiêm trọng và các đột tử do rối loạn nhịp, do vậy, cần phải nghĩ đến viêm cơ tim ở các bệnh nhân với bệnh cơ tim tiến triển nhanh, đau ngực với các bất thường trên điện tâm đồ giống như hội chứng mạch vành cấp nhưng động mạch vành bình thường hoặc các rối loạn nhịp thất vô căn và các nạn nhân trẻ bị đột tử khi gắng sức nhiều mà không ghi nhận bệnh lý tim mạch trước đó. Sự nhận biết viêm cơ tim như là nguyên nhân của các rối loạn nhịp thất có ý nghĩa quan trọng trong điều trị và tiên lượng. Kỹ thuật chẩn đoán hình ảnh CMR đã cải thiện khả năng nhận biết các tổn thương cơ tim do viêm và sử dụng như là phương tiện chẩn đoán viêm cơ tim. Sinh thiết cơ tim EMB là tiêu chuẩn vàng để chẩn đoán viêm cơ tim vì nó cung cấp thông tin về các đặc điểm miễn dịch-mô học và siêu vi trùng của tiến trình viêm cơ tim, có ảnh hưởng đến điều trị. EMB còn là công cụ nghiên cứu quan trọng về bệnh lý của các kênh điện giải ( channellopathies) và các hội chứng rối loạn nhịp do đột biến gen.
Tài liệu tham khảo:
1. Fabre A, Sheppard MN. Sudden adult death syndrome and other non-ischemic causes of sudden cardiac death. Heart. 2006 Mar; 92(3):316-20
2. Doolan A, Langlois N, Semsarian C. Causes of sudden cardiac death in young Australians. Med J Aust 2004;180:110-112
3. Magnani JW, Danik HJ, Dec GW, Jr., DiSalvo TG. Survival in biopsy-proven myocarditis: a long-term retrospetive analysis of the histopathologic, clinical, and hemodynamic predictors. Am Heart J 2006;151:463-70
4. Zeppenfeld K, Blom NA, Bootsma M, Schalij MJ. Incessant ventricular tachycardia in fulminant lymphocytic myocarditis: Evidence for origin in the Purkinje system and successful treatment with ablation. Heart Rhythm 2007;4:88-91
5. Graner M, Lommi J, Kupari M, Raisanen-Sokolowski A, Toivonen L. Multiple forms of sustained monomorphic ventricular tachycardia as common presentation in giant cell myocarditis. Heart 2007;93:119-21
6. Andreoletti L, Venteo L, Douche-Aourik F, et al. Active Coxsakiviral B infection is associated with disruption of dystropin in endomyocardial tissue of patients who died suddenly of acute myocardial infarction. J Am Coll Cardiol 2007;50:2207-14
7. Theleman KP, Kuiper JJ, Roberts WC. Acute myocarditis ( prodominately lymphocytic) causing sudden death without heart failure. Am J Cardiol 2001;88:1078-83
8. Friedman RA, Kearney DL, Moak JP, Fenrich AL, Perry JC. Persistence of ventricular arrhythmia after resolution of occult myocarditis in children and young adults. J Am Coll Cardiol 1994;24:780-3
9. Chimenti C, Calabrese F, Thiene G, Pieroni M, Maseri A, Frustaci A. Inflammatory left ventricular microaneurysms as a cause of apparently idiopathic ventricular tachyarrhythmias. Circulation 2001;104:168-73
10. Hofmann R, Trappe HJ, Klein H, Kemnitz J. Chronic ( or healed) myocarditis mimicking arrhythmogenic right ventricular dysplasia. Eur Heart J 1993;14:717-20
11. Pieroni M, Dello Russo A, et al. High prevalence of myocarditis mimicking arrhythmogenic right ventricular cardiomyopathy differential diagnosis by electroanatomic mapping-guided endomyocardial biopsy. L Am Coll Cardiol 2009;53:681-9
12. Ott P, Marcus FI, Sobonya RE, Morady F, Knight BP, Fuenzalida CE. Cardiac sarcoidosis masquerading as right ventricular dysplasia. Pacing Clin Electrophysiol. 2003;26:1498-503
13. Koplan BA, Soejima K, Baughman K, et al. Refractory ventricular tachycardia secondary to cardiac sarcoid: electrophysiologic characteristics, mapping, and ablation. Heart Rhythm 2006;3:924-9
14. Vasaiwala SC, Finn C, Delpriore J, et al. Prospective Study of cardiac sarcoid mimicking arrhythmogenic right ventricular dysplasia. J Cardiovasc Electrophysiol 2008;19:2000-7
15. Phillips MP, Robinowitz M, Higgins JR, et al. Sudden cardiac death in Air Force recruits. JAMA 1986;256:2696-2699
16. Frustaci A, Bellocci F, Olsen EG. Results of biventricular endomyocardial biopsy in survivors of cardiac arrest with apparently normal hearts. Am J Cardiol 1994;74:890-5
17. Corrado D, Basso C, Thiene G. Suden cardiac death in young people with apparently normal heart. Cardiovasc Res 2001;50:399-408
18. UCARE, IVF-US. Survivors of out-of-hospital cardiac arrest with apparently normal heart. Need for definition and standardized clinical evaluation. Consensus Statement of the Joint Steering Committees of the Unexplained Cardiac Arrest Registry of Europe and of the Idiopathic Ventricular Fibrillation Registry of the United States. Circulation 1997;95:265-72
19. Thiene G, Basso C. Arrhythmogenic right ventricular cardiomyopathy: An update. Cardiovasc Pathol 2001;10:109-117
20. Bowles NE, Ni J, Marcus F, Towbin JA. The detection of cardiotropic viruses in the myocardium of patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy. J Am Coll Cardiol 2002;39:892-895
21. Calabrese F, Basso C, Carturan E, Valente M, Thiene G. Arrhythmogenic right ventricular cardiomyopathy/dysplasia: is there a role for viruses? Cardiovasc Pathol 2006;15:11-17
22. Chimenti C, Pieroni M, Maseri A, Frustaci A. Histologic findings in patients with clinical and instriumental diagnosis of sporadic arrhythmogenic right ventricular dysplasia. J Am Coll Cardiol 2004;43:2305-2313
23. Frustaci A, Priori SG, Pieroni M, et al. Cardiac histological substrate in patients with clinical phenotype of Brugada syndrome. Circulation 2005;112:3680-7
24. Frustaci A, Verardo MA, Caldarulo M, Acconcia MC, Russo MA, Chimenti C. Myocarditis in hypertrophic cardiomyopathy patients presenting acute clinical deterioration. Eur Heart J 2007;28:733-40
25. Friedrich MG, Sechtem U, Schulz-Menger J, Holmvang G, Alakija P, Cooper LT, White JA, Abdel-Aty H, Gutbertlet M, Prasad S, Aletras A, Laissy JP, Paterson I, Filipchuk NG, Kumar A, Pauschinger M, Lui P; International Consensus Group on Cardiovascular Magnetic Resonance in Myocarditis. Cardiovascular magnetic resonance in myocarditis: A JACC White Paper. J Am Coll Cardiol 2009;53:1475-87
26. Ordovas KG, Reddy GP, Higgins CB. MRI in nonischemic acquired heart disease. J Magn Reson Imaging 2008;27:1195-213
27. Mahrholdt H, Goedecke H, Wagner A, et al. Cardiovascular magnetic resonance assessment of human myocarditis: comparison to histology and molecular pathology. Circulation 2004;109:1250-8
28. De Cobelli F, Pieroni M, Esposito A, et al. Delayed gadolinium-enhanced cardiac magnetic resonance in patients with chronic myocarditis presenting with heart failure or recurrent arrhythmias. J Am Coll Cardiol 2006;47:1649-54
29. Cooper LT, Baughman KL, Felman MA, et al. American Heart Association; American College of Cardiology; European Society of Cardiology. The role of endomyocardial biopsy in the management of cardiovascular disease: a scientific statement from the American Heart Association, the American College of Cardiology, and the European Society of Cardiology. Circulation 2007;116:2216-33
30. Kuhl U, Pauschinger M, Seeberg B, et al. Viral persistence in the myocardium is associated with progressive cardiac dysfunction. Circulation 2005;112:1965-1970
31. Caforio AL, Mahon NJ, Tona F, McKenna WJ. Circulating cardiac autoantibodies in dilated cardiomyopathy and myocarditis: pathogenegic and clinical significance. Eur J Heart Fail 2002;4:411-417
32. Rose NR. The significance of autoimmunity in myocarditis. Ernst Schering Res Found Workshop 2006:141-154
33. Neumann DA, Rose NR, Ansari AA, Herskowitz A. Induction of multiple heart autoantibodies in mice with coxsackievirus B3- and cardiac myosin-induced autoimmune myocarditis. J Immunol 1994;152:343-350
34. Pankuweit S, Portig I, Lottspeich F, Maisch B. Autoantibodies in sera of patients with myocarditis: characterization of the corresponding proteins by isoelectric fosusing and N-ternimal sequence analysis. J Mol Cell Cardiol 1997;29:77-84
35. Cihakova D, Rose NR. Pathogenesis of myocarditis and dilated cardiomyopathy. Adv Immunol 2008;99:95-114
36. Ansari AA, Fett JD, Carraway RE, et al. Autoimmune mechanisms as the basis for human peripartum cardiomyopathy. Clin Rev Allergy Immunol 2002;23:301-324
37. Lui P, Aitken K, Kong YY, et al. The tyrosine kinase p561ck is essential in coxsackievirus B3-mediated heart disease. Nat Med 200;6:429-434
38. Zipes DP, Camm AJ, Borggrefe M, et al. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death-executive summary: A report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines ( Writing Committee to Develop Guidelines for Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death) Developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Eur Heart J 2006;27:2099-140
39. Chauhan VS, Hameedullah I, Nanthakumar K, Downar E. Epicardial catheter ablation of incessant ventricular tachycardia in giant cell myocarditis. J Cardiovasc Electrophysiol 2008;19:1219
40. Hama Y, Funabashi N, Ueda M, et al. Right-sided heart wall thickening and delayed enhancement caused by chronic active myocarditis complicated by sustained monomorphic ventricular tachycardia. Circulation 2009;119:e 200-3
41. Kettering K, Kampmann C, Mollnau H, Kreitner KF, Munzel T, Weiss C. Catheter ablation of an incessant ventricular tachycardia originating from the left aortic sinus cusp in an adolescent with subacute myocarditis. Clin Res Cardiol 2009;98:66-70.







