Trang XA LỘ THÔNG TIN kỳnày hân hạnh gửi đến quý độc giả 2 thông tin mới: Đầu tiên là một nghiên cứu thế giới thực mới, đánh giá về hiệu quả và độ an toàn của các NOACs so với warfarin trên bệnh nhân rung nhĩ không do van tim kèm thể trạng suy nhược, được xuất bản tháng 4 năm 2018 trên tạp chí JAHA (Journal of American Heart Association). Tiếp theo, là thông tin về một chất đối kháng thuốc ức chế Xa mới, vừa được phê duyệt vào tháng 5 năm 2018 bởi FDA.
Hiệu quả và an toàn của Apixaban, Dabigatran và Rivaroxaban so với Warfarin trên các bệnh nhân rung nhĩ không do bệnh van tim, có thể trạng suy nhược
Bệnh nhân rung nhĩ không do bệnh van tim có thể trạng suy nhược thường có tiên lượng xấu hơn và nhất là có tình trạng giảm sử dụng kháng đông. Nghiên cứu này nhằm mục đích so sánh hiệu quả và an toàn của apixaban, dabigatran và rivaroxaban so với warfarin trên các bệnh nhân rung nhĩ không do van tim có thể trạng suy nhược.
Phương pháp nghiên cứu:
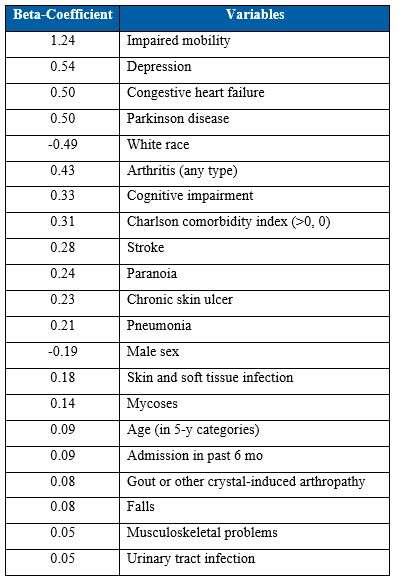
Dân số nghiên cứu được lấy từ dữ liệu bảo hiểm US MarketScan của Mỹ từ tháng 11/2011 đến tháng 12/2016. Tình trạng suy nhược được xác định bằng cách sử dụng thang điểm Johns Hopkins Claims-based Frailty Indicator score (≥0.20 indicating frailty) (bảng 1).
Lần lượt apixaban, dabigatran và rivaroxaban được bắt cặp với warfarin, sử dụng phương pháp propensity score matching, sau khi bắt cặp khác biệt tuyệt đối <0.1 thu được ở tất cả các nhóm.
Các bệnh nhân được theo dõi đến 2 năm hoặc cho đến khi có biến cố hoặc hủy đăng ký bảo hiểm hoặc kết thúc theo dõi. Tỷ lệ đột quỵ hoặc thuyên tắc hệ thống và chảy máu nặng được so sánh bằng cách sử dụng hồi quy Cox và được báo cáo với tỷ lệ nguy cơ (HRs) và khoảng tin cậy 95% (CIs). Tổng cộng lần lượt 2700, 2784, 5270 bệnh nhân dùng apixaban, dabigatran và rivaroxaban được bắt cặp 1:1 với warfarin.
Bảng 1: Johns Hopkins Claims-based Frailty Indicator Score
Kết quả nghiên cứu:
Tại thời điểm 2 năm theo dõi, so với warfarin, cả apixaban và dabigatran đều khác biệt không có ý nghĩa thống kê về các biến cố đột quỵ, thuyên tắc hệ thống (HR=0.78; 95% CI=0.46–1.35 and HR=0.94; 0.60–1.45) hay chảy máu nặng (HR=0.72; 95% CI=0.49–1.06 and HR=0.87; 95% CI=0.63–1.19). Trong khi đó, rivaroxaban giảm có ý nghĩa thống kê các biến cố đột quỵ, thuyên tắc hệ thống tại thời điểm 2 năm (HR=0.68; 95% CI=0.49–0.95) mà không có khác biệt về nguy cơ xuất huyết nặng (HR=1.07; 95% CI=0.81–1.32).
Kết luận:
Nghiên cứu cho thấy rằng, rivaroxaban chứ không phải apixaban hay dabigatran làm giảm các biến cố đột quỵ, thuyên tắc hệ thống so với warfarin trên các bệnh nhân rung nhĩ không do van tim kèm thể tạng suy nhược. Không kháng đông đường uống thế hệ mới nào giảm có ý nghĩa các biến cố chảy máu nặng so với warfarin.
Nguồn dịch: J Am Heart Assoc. 2018;7:e008643. DOI:10.1161/JAHA.118.008643
FDA lần đầu tiên phê duyệt Andexxa, một chất đối kháng thuốc ức chế Xa
Công ty Dược phẩm Portola Pharmaceuticals công bố đã được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt Andexxa (đối kháng thuốc bất hoạt yếu tố đông máu Xa) để đảo ngược tác dụng chống đông của thuốc ức chế Xa cho những người trong tình trạng chảy máu đe dọa tính mạng hoặc không kiểm soát được.
Ước tính có khoảng 4 triệu người đang dùng các thuốc ức chế Xa, như rivaroxaban (Xarelto, Bayer / Janssen Pharmaceuticals) và apixaban (Eliquis, Bristol-Myers Squibb), nhưng cho đến nay, vẫn chưa có tác nhân đảo ngược nào được chấp thuận.
Vài tháng trước thì FDA đã phê duyệt đầy đủ cho idarucizumab (Praxbind, Boehringer Ingelheim) chỉ định đảo ngược tác dụng chống đông của dabigatran (Pradaxa, Boehringer Ingelheim) – chất ức chế thrombin trực tiếp, trong trường hợp phẫu thuật khẩn cấp hoặc chảy máu đe dọa tính mạng hoặc không kiểm soát được.
Theo báo cáo của công ty Portola Pharmaceuticals, chỉ tính riêng tại Hoa Kỳ, đã có khoảng 117.000 ca nhập viện do chảy máu liên quan đến chất ức chế Xa và gần 2000 ca tử vong do chảy máu mỗi tháng (theo thông cáo báo chí từ công ty, đăng ngày 3 tháng 5).
Randy Fenninger, giám đốc điều hành của Liên Minh Đông Máu Quốc Gia (National Blood Clot Alliance)cho biết: “Việc mở rộng các thuốc đảo ngược tình trạng kháng đông có sẵn cho các bác sĩ kê toa thuốc chống đông đường uống mới là rất quan trọng”. “Sự sẵn có hiện nay cho tác nhân đảo ngược chuyên biệt với rivaroxaban và apixaban làm mở rộng sự chọn lựa và cho phép bệnh nhân và thầy thuốc tự tin hơn khi xem xét lựa chọn điều trị các thuốc này.” Andexxa đã được phê duyệt theo con đường phê duyệt tăng tốc của FDA (FDA’s accelerated approval pathway)dựa trên hiệu quả ở những người tình nguyện khỏe mạnh, và sự chấp thuận tiếp theo sẽ phụ thuộc vào các nghiên cứu hậu tiếp thị để chứng minh có cải thiện trong cầm máu bệnh nhân. Một thử nghiệm lâm sàng so sánh thuốc đảo ngược này với chăm sóc thông thường dự kiến sẽ bắt đầu vào năm 2019 và được báo cáo vào năm 2023.
Andexxa đã được chấp thuận với một cảnh báo cho các nguy cơ về sinh huyết khối thuyên tắc, nguy cơ thiếu máu cục bộ, ngừng tim và đột tử. Điều trị với tác nhân đảo ngược này có liên quan đến các tác dụng phụ nghiêm trọng và đe dọa tính mạng, bao gồm các biến cố huyết khối động mạch và tĩnh mạch, ngừng tim, đột tử và các biến cố thiếu máu cục bộ như nhồi máu cơ tim và đột quỵ thiếu máu. Tác dụng phụ thường gặp nhất ở ít nhất 5% bệnh nhân dùng Andexxa là nhiễm trùng đường tiết niệu và viêm phổi.
Sự chấp thuận của thuốc này được hỗ trợ bởi dữ liệu từ 2 nghiên cứu pha 3 ANNEXA-R và ANNEXA-A, cho thấy độ giảm trung vị hoạt tính chống yếu tố Xa so với ban đầu đạt được 97% đối với rivaroxaban và 92% đối với apixaban (theo thông tin từ phía công ty đăng ngày 3 tháng 5).
Trong quá trình xem xét, FDA cũng đánh giá dữ liệu giữa kỳ từ nghiên cứu ANNEXA-4 đang diễn ra. Trong số 185 bệnh nhân có nguy cơ cao được đánh giá trong nghiên cứu mở nhãn này, thuốc nghiên cứu cho thấy giúp cầm máu lâm sàng hiệu quả ở 83% bệnh nhân trong 12 giờ, như báo cáo gần đây bởi theheart.org|Medscape Cardiology. Giảm hoạt tính chống yếu tố Xa trung vị so với ban đầu là 90% đối với rivaroxaban và 93% đối với apixaban.
Stuart J Connolly, MD, Đại học McMaster, Hamilton, Ontario, Canada, chủ tọa ANNEXA-4 cho biết “Sự chấp thuận hôm nay thể hiện một bước tiến quan trọng trong việc chăm sóc bệnh nhân mà cộng đồng y tế đã háo hức chờ đợi,”. “Sự đảo ngược nhanh chóng của Andexxa đối với tác dụng chống đông của rivaroxaban và apixaban sẽ giúp các bác sĩ lâm sàng điều trị chảy máu nặng đe dọa tính mạng, mà tình trạng lâm sàng này đếm từng phút.”
Andexxa dự kiến sẽ được tung ra thị trường vào đầu tháng 6 dưới mộtchương trình hỗ trợ trong giai đoạn đầu cho sản phẩm thế hệ 1 cùng với sự triển khai thương mại rộng lớn hơn dự kiến vào đầu năm 2019 khi FDA phê duyệt cho quy trình sản xuất thế hệ thứ 2. Andexanet alfa cũng đang được xem xét bởi Cơ quan Thuốc Châu Âu, với quyết định dự kiến công bố vào đầu năm 2019.
T.H.
Nguồn dịch: https://www.medscape.com/viewarticle/896182







