TS. BS. NGUYỄN TUẤN VŨ1
BSCK.II NGUYỄN THỊ KIM SÁNG2
THS. BS. NGUYỄN MINH QUI2
THS. BS. LÊ MINH TRUNG3
BS. CKII NGUYỄN TRUNG QUỐC3
1-ĐHYK Phạm Ngọc Thạch
2-TTYK Medic TP HCM
3-Viện Tim TP HCM
Dẫn nhập
Chúng tôi giới thiệu hai trường hợp dò động mạch vành (DĐMV) được chẩn đoán xác định bằng chụp cắt lớp điện toán vi tính (MSCT) mạch vành và điều trị bằng phẫu thuật. Trường hợp đầu tiên là bệnh nhân nữ 23 tuổi nhập viện với chẩn đoán ngất do cơn nhịp nhanh thất. Trường hợp thứ hai là bệnh nhân nữ 28 tuổi đến khám vì hồi hộp, khó thở khi gắng sức. Trường hợp bệnh nhân nữ 28 tuổi trong khi chờ phẫu thuật thì xuất hiện biến chứng viêm nội tâm mạc nhiễm khuẩn (VNTMNK).
Từ khóa: Dò động mạch vành, MSCT mạch vành, viêm nội tâm mạc nhiễm khuẩn.
Giới thiệu
Dò động mạch vành lần đầu tiên được mô tả vào năm 1865 bởi Krause được định nghĩa là bệnh tim bẩm sinh hoặc mắc phải hiếm gặp do sự thông nối bất thường giữa động mạch vành (ĐMV) và buồng tim hoặc mạch máu lớn ở lồng ngực và không có mạng lưới mao mạch đi kèm [1]. Trong một nghiên cứu hồi cứu gần đây sử dụng chụp MSCT mạch vành cho thấy DĐMV bắt nguồn từ ĐMV trái chiếm 42%, ĐMV phải 12%, cả hai 46% [2]. Chỗ đổ vào của đường dò thường là vào hệ tĩnh mạch, thường gặp nhất là vào động mạch phổi và thất phải [2,3]. Chúng tôi báo cáo hai trường hợp DĐMV được chẩn đoán thông qua siêu âm tim qua thành ngực (TTE), siêu âm tim qua thực quả (TEE), chụp mạch số hóa xóa nền (DSA), và quan trọng là MSCT mạch vành.
Trường hợp lâm sàng 1:
Bệnh nhân nữ, 28 tuổi đến khám tại phòng khám MEDIC vì hồi hộp và khó thở khi gắng sức khởi phát 2 năm nay, chưa ghi nhận tiền căn bệnh lý tim mạch và cô hiện không đang sử dụng bất kì thuốc nào. Thăm khám lâm sàng phát hiện âm thổi liên tục, cường độ 4/6 ở khoang liên sườn III bờ trái xương ức. Không ghi nhận tiếng tim T3, tĩnh mạch cổ nổi, gan to, phù chân. Ngoài ra các cơ quan khác trong giới hạn bình thường.
X-quang ngực thẳng ghi nhận bóng tim to với tình trạng tăng tuần hoàn phổi, điện tim ghi nhận nhịp nhanh xoang và không thay đổi ST-T. Siêu âm tim qua thành ngực ghi nhận phân suất tống máu bảo tổn (EF=73%), tăng áp động mạch phổi (PAPs=51 mmHg), dãn ĐMV phải (RCA=21 mm) và thấy dòng xoáy liên tục trong thất phải. Sau đó bệnh nhân được siêu âm tim qua thực quản ghi nhận dãn toàn bộ ĐMV phải, nơi lớn nhất có đường kính 21 mm, nối với túi phình mạch máu có đường kính 35 mm, sau đó dò vào thất phải. MSCT mạch vành ghi nhận dãn toàn bộ ĐMV phải với đường kính 23 mm, túi phình mạch vành đường kính 57×38 mm, dò ĐMV phải vào thất phải, đường kính dò 9 mm.
Trong quá trình đợi phẫu thuật, bệnh nhân xuất hiện sốt, đau khớp và phải nhập viện. Siêu âm tim qua thực quản lần hai ghi nhận cấu trúc sùi VNTMNK gây hở van động mạch chủ nặng. Bệnh nhân được điều trị với kháng sinh ceftriaxone 2 g/ngày trong 4 tuần trước khi được chuyển phẫu thuật. Chẩn đoán sau mổ: ĐMV phải dò vào thất phải, phình đoạn III của ĐMV phải, sùi tại chỗ dò và trên van động mạch chủ. Bệnh nhân được đóng lỗ dò, cắt bỏ túi phình, khâu gấp nếp ĐMV phải, lấy sùi VNTMNK, thay van động mạch chủ nhân tạo.
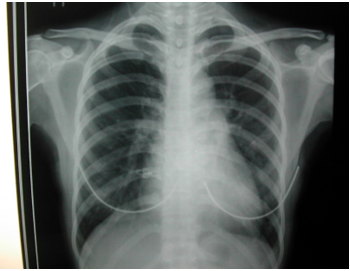
Hình 1. X-quang ngực thẳng của bệnh nhân số 1 ghi nhận bóng tim lớn và tăng tuần hoàn phổi.
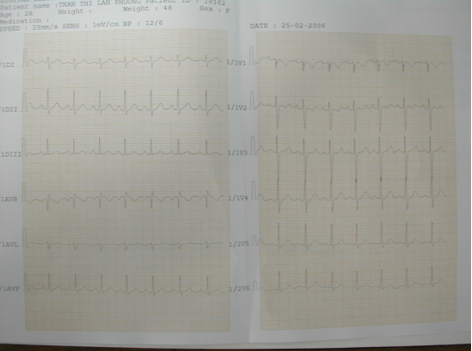
Hình 2. Điện tim của bệnh nhân số 1 ghi nhận nhịp nhanh xoang
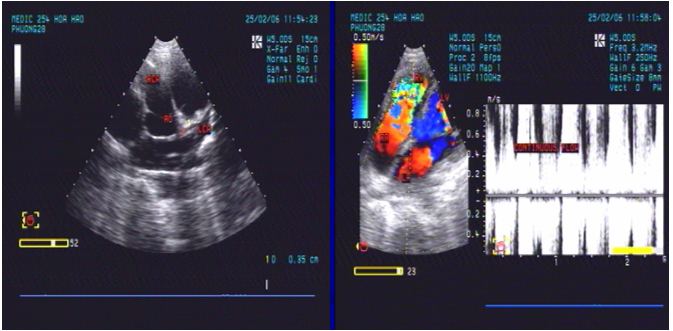
Hình 3. Siêu âm tim qua thành ngực bệnh nhân số 1 ghi nhận dãn động mạch vành phải với đường kính 21 mm (hình bên trái), và dòng xoáy trong thất phải, áp lực động mạch phổi tâm thu 51 mmHg (hình bên phải)
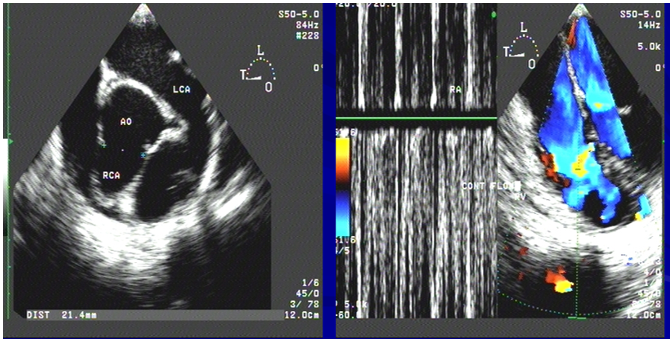
Hình 4. Siêu âm tim qua thực quản cũng ghi nhận dãn động mạch vành phải và dòng liên tục
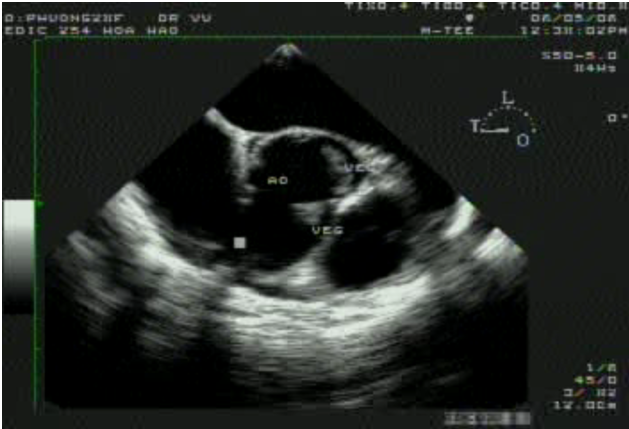
Hình 5. Khối sùi viêm nội tâm mạc trên van động mạch chủ
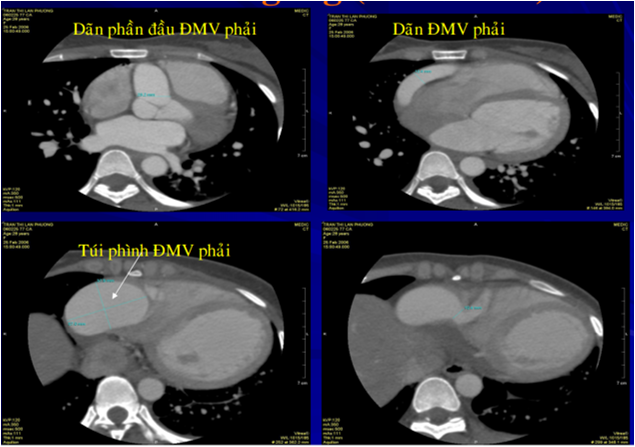
Hình 6. MSCT mạch vành của bệnh nhân số 1

Hình 7. Tái tạo hình ảnh ba chiều mạch vành
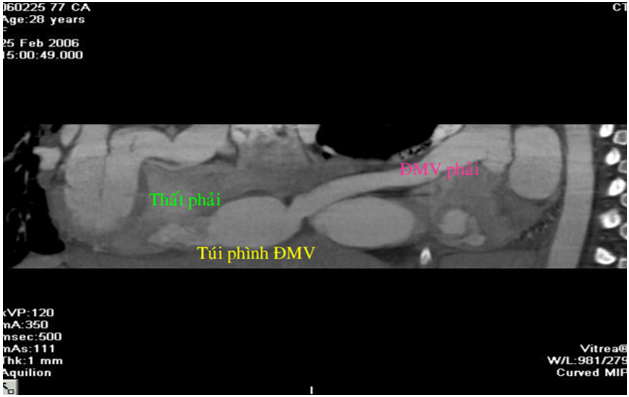
Hình 8. Tái tạo hình ảnh hai chiều theo đường cong
Trường hợp lâm sàng 2:
Bệnh nhân nữ, 23 tuổi nhập viện vì ngất. Bệnh nhân có nhiều cơn hồi hộp và ngất nhiều lần trong vòng 2 tuần và đã được chẩn đoán nhịp nhanh thất tái phát nhiều lần, khó kiểm soát bằng thuốc. Tiền căn chưa ghi nhận bệnh lý tim mạch nào khác. Khám lâm sàng không ghi nhận âm thổi ở tim hay các dấu hiệu suy tim. X-quang ngực ghi nhận bóng tim to. Điện tim ghi nhận nhịp nhanh thất lặp lại nhiều lần, phải khống chế bằng amiodarone truyền tĩnh mạch. Siêu âm tim qua thành ngực ghi nhận phân suất tống máu bảo tồn (EF=78%), không tăng áp động mạch phổi (PAPs=29 mmHg), dãn ĐMV trái (LCA=8 mm), túi phình ở mỏm tim 44 mm, có huyết khối và máu xoáy ở trong. Bệnh nhân được chụp cộng hưởng từ tim (CMR) ghi nhận dãn ĐMV trái (LCA=9 mm), có túi phình sát mỏm tim, có huyết khối và máu xoáy, kích thước 45×37 mm. Chụp MSCT mạch vành ghi nhận dãn ĐMV trái, LCA=10 mm, LAD=8 mm, túi phình mạch vành ở mỏm kích thước 45 mm và không thấy dò. Chẩn đoán sau mổ: ĐMV xuống trước trái LAD dò vào thất trái ngay tại mỏm tim, dò nhiều lỗ, phình đoạn xa LAD. Bệnh nhân được đóng nhiều lỗ dò <0,5 mm bằng patch, khâu gấp nếp túi phình, khâu sửa chữa LAD.
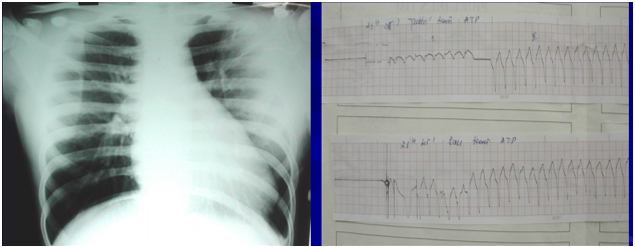
Hình 9. X-quang ngực ghi nhận bóng tim to và điện tim ghi nhận nhanh thất
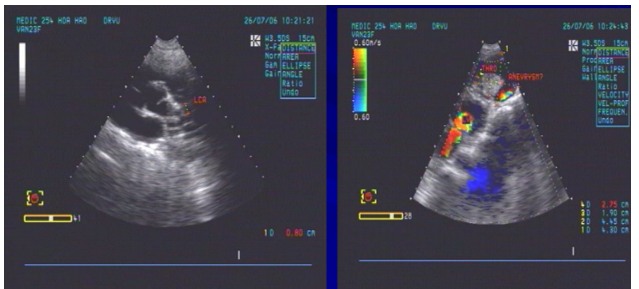
Hình 10. Siêu âm tim qua thành ngực ghi nhận ĐMV trái dãn 9 mm (hình bên trái) và cấu trúc mạch máu sát mỏm tim có huyết khối và máu xoáy bên trong (hình bên phải)
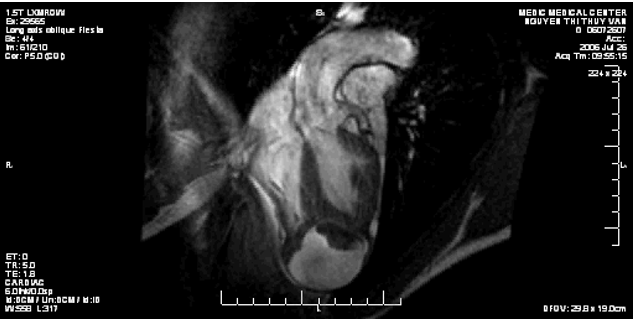
Hình 11. Hình ảnh cộng hưởng từ tim của bệnh nhân số 2
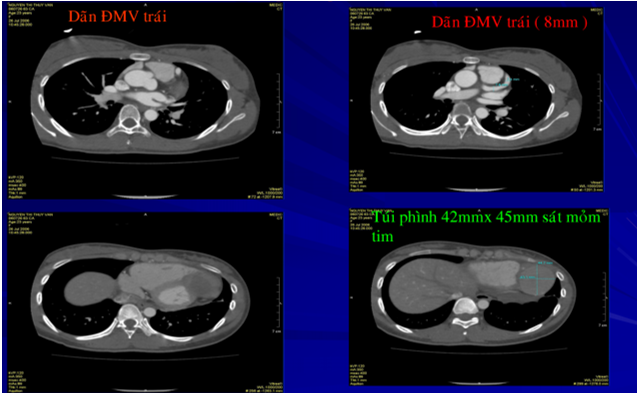
Hình 12. HÌnh ảnh MSCT mạch vành của bệnh nhân số 2
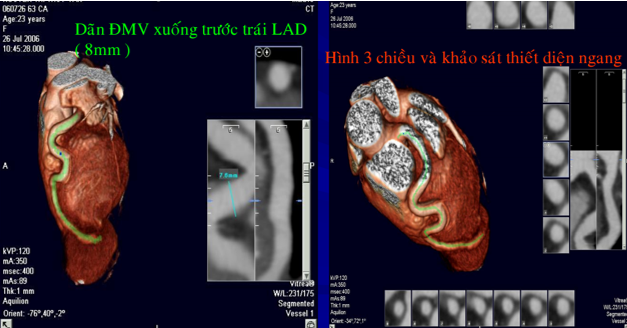
Hình 13. Tái tạo hình ảnh ba chiều mạch vành của bệnh nhân số 2
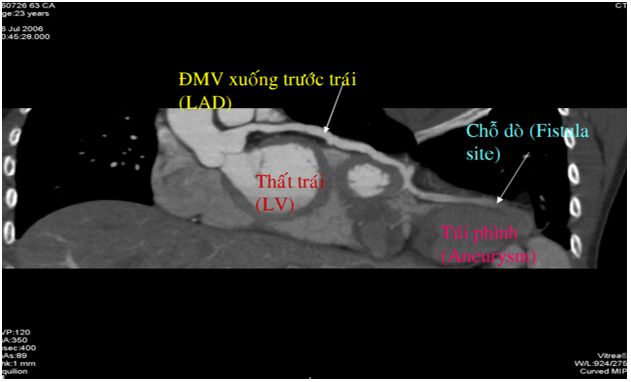
Hình 14. Tái tạo hình ảnh hai chiều theo đường cong
Bàn luận
Dò động mạch vành là một bất thường mạch vành hiếm gặp, chỉ gặp trên khoảng 0,1-0,2% dân số, tuy nhiên tỉ lệ phát hiện trong những nghiên cứu gần đây bằng chụp MSCT mạch có thể lên tới 0,19-0,91% [4,5]. Đường dò ĐMV hoạt động như một shunt làm lượng máu được oxi hóa không đi qua hệ thống tiểu động mạch, mao mạch trong cơ tim. Sự thay đổi sinh lý bệnh phụ thuộc vào sức cản qua lỗ dò, được xác định bởi kích thước lỗ dò, sự quanh co, chiều dài và vị trí đường dò dẫn lưu vào [6]. Hậu quả quan trọng của DĐMV là sự phát triển của thiếu máu cục bộ cơ tim ở xa vị trí đổ vào của đường dò, thứ phát sau giảm tưới máu do máu đi qua lỗ dò thay vì hệ thống mao mạch, còn gọi là hiện tượng cướp máu vành từ đó dẫn tới các triệu chứng của thiếu máu cục bộ cơ tim như đau ngực, khó thở khi gắng sức [7]. Để đáp ứng với thiếu máu cục bộ, mạch vành bị ảnh hưởng giãn ra, dẫn đến sự giãn ra của lỗ dò. Tăng lưu lượng máu trong thời gian dài dẫn đến tái cấu trúc động mạch vành (ĐMV), hình thành phình mạch [8,9]. DĐMV cũng liên quan đến bất thường van tim, và nguy cơ viêm nội tâm mạc. Tỉ lệ mắc viêm nội tâm mạc nhiễm trùng được báo cáo có thể lên tới 12% [9]. Mặc dù DĐMV phần lớn không có triệu chứng, bệnh nhân có thể được phát hiện DĐMV tình cờ khi thăm khám thấy âm thổi liên tục. DĐMV cũng liên quan đến sự hình thành một số rối loạn dẫn truyền và rối loạn nhịp, bao gồm cả rung nhĩ và rối loạn nhịp thất [10]. Trong trường hợp đầu tiên, bệnh nhân đến khám vì khó thở khi gắng sức và hồi hộp, đây là những triệu chứng không đặc hiệu như các tài liệu đã mô tả. Trong quá trình đợi phẫu thuật bệnh nhân xuất hiện các triệu chứng của VNTMNK và được chẩn đoán xác định thông qua siêu âm tim qua thực quản phát hiện thấy mảnh sùi gây hở van động mạch chủ nặng. Ở trường hợp thứ hai, bệnh nhân đến khám vì ngất và xuất hiện rối loạn nhịp thất nghiêm trọng, phải khống chế bằng amiodarone truyền tĩnh mạch, một triệu chứng hiếm gặp của DĐMV nhưng cũng đã được báo cáo qua các y văn [11,12]. Siêu âm tim (SÂT) có thể phát hiện DĐMV một cách tình cờ trong quá trình thực hiện do các chỉ định khác. DĐMV có thể được nhìn thấy trên SÂT đen trắng khi giãn lớn, trong khi Doppler màu hữu dụng trong việc đánh giá dòng chảy trong đường dò [13]. Cả hai trường hợp đều có chức năng tâm thu thất trái bảo tồn với EF>70% vì trong giai đoạn đầu, sự gia tăng thể tích sẽ là thất trái giãn to và tăng co bóp, chỉ khi shunt quá lớn và thời gian dài mới làm giảm chức năng thất trái [6]. Khảo sát áp lực động mạch phổi tâm thu ở bệnh nhân đầu tiên cho thấy phổ của dòng hở 3 lá và tăng áp động mạch phổi (PAPs=51 mmHg) do shunt lớn và đổ vào thất phải, còn ở bệnh nhân thứ hai chưa ghi nhận tăng áp động mạch phổi do chỉ tạo shunt đổ vào thất trái và kích thước lỗ dò nhỏ, tuy nhiên ở bệnh nhân này ghi nhận có một túi phình khá lớn với huyết khối và dòng máu xoáy bên trong. Chụp MSCT mạch vành đã trở thành một công cụ đánh giá đường dò rất tốt với những tiến bộ trong kĩ thuật chụp và dựng hình của chụp MSCT mạch vành trong thời gian gần đây. Một điểm mạnh khác của CLVT mạch vành là có thể tái tạo hình ảnh theo các phương thức khác nhau bao gồm tái tạo nhiều mặt phẳng (multiplanar reformation) hoặc tái tạo hình ảnh 3 chiều (3D volume rendered images). Bên cạnh đó tái tạo nhiều mặt phẳng theo đường cong (curved multiplanar reformation) tái tạo hình ảnh mạch vành theo chiều dọc cho phép cái nhìn tổng quát về nguồn gốc của đường dò, sự liên quan với các cấu trúc lân cận [14]. Cả hai trường hợp đều được chụp MSCT mạch vành và ghi nhận sự dãn mạch vành cũng như phát hiện các túi phình mạch vành khá lớn, ở trường hợp 1 MSCT còn xác định được vị trí lỗ dò đổ vào và đường kính. Ở trường hợp 2, MSCT không thể phát hiện được lỗ dò có thể do kích thước lỗ dò quá nhỏ <0,5 mm và được xác định khi phẫu thuật tim. Bên cạnh MSCT mạch vành, CMR cũng là một phương tiện giúp đánh giá DĐMV mặc dù giá trị của CMR vẫn còn chưa rõ ràng qua các nghiên cứu [14]. Chỉ có trường hợp 2 được thực hiện CMR tuy nhiên không cung cấp được thêm nhiều thông tin hơn MSCT. Mặc dù hiện tại chưa có khuyến cáo chính thức về chỉ định đóng lỗ dò cũng như phương thức đóng lỗ dò, một đồng thuận đề nghị các chỉ định đóng lỗ dò như sau: (1) bằng chứng của thiếu máu cục bộ tại đoạn xa của ĐMV bị ảnh hưởng, (2) rối loạn nhịp nghĩ do DĐMV, (3) viêm nội tâm mạc, (4) vỡ mạch, (5) giãn buồng tim, (6) rối loạn chức năng thất trái [15]. Cả hai bệnh nhân của chúng tôi đều có những chỉ định phẫu thuật kể trên. Ở bệnh nhân số 1, bệnh nhân có mạch vành bị ảnh hưởng giãn lớn và biến chứng VNTMNK sau đó. Ở bệnh nhân số 2, rối loạn nhịp thất nặng phải kiểm soát bằng amiodarone được nghĩ do DĐMV.
Kết luận
Dò động mạch vành là một bất thường mạch máu hiếm gặp. Chẩn đoán lâm sàng thường rất khó khăn do những triệu chứng không đặc hiệu. Trước đây, để chẩn đoán cần thông tim chụp động mạch vành xâm lấn hoặc siêu âm cản âm để xác định. Với sự phát triển của MSCT mạch vành là một công cụ không xâm lấn đã giúp chẩn đoán dò động mạch vành tốt hơn, mô tả được đầy đủ các cấu trúc lân cận cũng như đặc điểm đường dò, cũng như định hướng cho phẫu thuật, từ đó làm giảm số ca phải chụp mạch vành xâm lấn không cần thiết. Điều trị dò động mạch vành cần có sự tham gia của một đội ngũ chuyên gia và cân nhắc kĩ lưỡng trước khi điều trị.
Tài liệu tham khảo
1.Krause WJZRM, 24. Ber den ursprung einer akzessorischen a. coronaria aus der a. pulmonalis. 1865;225
2.Zhou K, Kong L, Wang Y, et al. Coronary artery fistula in adults: evaluation with dual-source CT coronary angiography. 2015;88(1049):20140754.
3.Dodge-Khatami A, Mavroudis C, Backer CLJTAots. Congenital Heart Surgery Nomenclature and Database Project: anomalies of the coronary arteries. 2000;69(3):270-297.
4. Ouchi K, Sakuma T, Ojiri HJJoC. Coronary artery fistula in adults: incidence and appearance on cardiac computed tomography and comparison of detectability and hemodynamic effects with those on transthoracic echocardiography. 2020;76(6):593-600.
5.Li N, Zhao P, Wu D, Liang CJTBJoR. Coronary artery fistulas detected with coronary CT angiography: a pictorial review of 73 cases. 2020;93(1108):20190523.
6. Sommer RJ, Hijazi ZM, Rhodes Jr JFJC. Pathophysiology of congenital heart disease in the adult: part I: shunt lesions. 2008;117(8):1090-1099.
7. Latson LAJC, Interventions C. Coronary artery fistulas: how to manage them. 2007;70(1):111-118.
8. Yang Z, Zhang L, Gao J, et al. Giant coronary artery fistula complicated with coronary artery aneurysm and acute myocardial infarction: a case report. 2020;20:1-6.
9. Kawano M, Wada T, Anai H, Shuto T, Miyamoto SJSCR. A case of ruptured aneurysm of coronary-pulmonary artery fistula diagnosed after emergency thoracotomy. 2018;4:1-4.
10.Yun G, Nam TH, Chun EJJR. Coronary artery fistulas: pathophysiology, imaging findings, and management. 2018;38(3):688-703.
11.Kugelmass AD, Manning WJ, Piana RN, et al. Coronary arteriovenous fistula presenting as congestive heart failure. 1992;26(1):19-25.
12. Liberthson RR, Sagar K, Berkoben JP, Weintraub RM, Levine FHJC. Congenital coronary arteriovenous fistula. Report of 13 patients, review of the literature and delineation of management. 1979;59(5):849-854.
13.Lin F-C, Chang H-J, Chern M-S, Wen M-S, Yeh S-J, Wu DJAhj. Multiplane transesophageal echocardiography in the diagnosis of congenital coronary artery fistula. 1995;130(6):1236-1244.
14.Kalisz K, Sanders AE, Avery R, Allen BD. Coronary Artery Fistulas: A Review of the Current and Future Roles of Imaging. Journal of thoracic imaging. Nov 1 2021;36(6):333-344. doi:10.1097/rti.0000000000000557
15.Al-Hijji M, Sabbagh AE, Hajj SE, et al. Coronary Artery Fistulas. 2021;14(13):1393-1406. doi:doi:10.1016/j.jcin.2021.02.044







