ĐẶT VẤN ĐỀ
Dabigatran và rivaroxaban là các thuốc kháng đông đường uống không phải đối kháng vitamin K, đã được đồng thuận trong phòng ngừa đột quỵ trên những bệnh nhân rung nhĩ không do bệnh van tim.
David J. Graham, MD, MPH; Marsha E. Reichman, PhD; MichaelWernecke, BA; Ya-Hui Hsueh, PhD; Rima Izem, PhD;
Mary Ross Southworth, PharmD; YuqinWei, MS; Jiemin Liao, MA; Margie R. Goulding, PhD; Katrina Mott, MHS;
Yoganand Chillarige,MPA; Thomas E. MaCurdy, PhD; ChrisWorrall, BS; Jeffrey A. Kelman, MD, MMSc
Biên dịch: BS. Lý Văn Chiêu
Phó Khoa Nội Tim Mạch – Bệnh viện Chợ Rẫy
Không có các nghiên cứu so sánh đối đầu ngẫu nhiên giữa 2 thuốc về các biến cố đột quỵ, xuất huyết và tử vong.
MỤC TIÊU
So sánh nguy cơ đột quỵ thuyên tắc huyết khối, xuất huyết nội so, xuất huyết ngoài sọ nặng bao gồm xuất huyết tiêu hóa nặng; và tử vong trên những bệnh nhân rung nhĩ không do bệnh van tim được điều trị dự phòng đột quỵ với dabigatran hoặc rivaroxaban.
THIẾT KẾ VÀ ĐỐI TƯỢNG NGHIÊN CỨU
Nghiên cứu đoàn hệ hồi cứu người dùng mới (new-user cohort study) trên 118891 bệnh nhân từ 65 tuổi trở lên có rung nhĩ không do bệnh van tim, tham gia dịch vụ Medicare tự chi trả, được khởi đầu điều trị với dabigatran hoặc rivaroxaban từ 04/11/2011 đến 30/06/2014. Sự khác biệt về các đặc điểm cơ bản được điều chỉnh bằng thuật toán xác suất nghịch đảo cố định (stabilized inverse probability of treatment weights) dựa vào chỉ số khuynh hướng (propensity scores). Phân tích dữ liệu thực hiện từ 07/05/2015 đến 30/06/2016.
PHÁC ĐỒ ĐIỀU TRỊ
Dabigatran 150mg, 2 lần mỗi ngày; hoặc Rivaroxaban 20mg 1 lần mỗi ngày
BIẾN CỐ VÀ TIÊU CHUẨN ĐÁNH GIÁ CHÍNH
Tỉ số nguy cơ được hiệu chỉnh (Adjusted hazard ratios – HR) cho các biến cố chính: đột quỵ thuyên tắc huyết khối, xuất huyết não, xuất huyết ngoài sọ nặng bao gồm xuất huyết tiêu hóa nặng; và tử vong, dùng dabigatran làm chuẩn. Sự khác biệt về tỉ lệ mắc phải được hiệu chỉnh (Adjusted incidence rate differences – AIRDs) cũng được ước tính.
KẾT QUẢ
Nghiên cứu của chúng tôi bao gồm 52240 bệnh nhân sử dụng dabigatran và 66651 bệnh nhân sử dụng rivaroxaban (47% nữ), tương ứng với số theo dõi điều trị là 15524 người-năm và 20199 người-năm; xảy ra 2537 biến cố chính. Rivaroxaban giảm không có ý nghĩa thống kê nguy cơ đột quỵ (HR 0,81; KTC 95% 0,65 – 1,01; p=0,07; AIRD giảm 1,8 trường hợp (fewer case)/1000 người-năm); gia tăng có ý nghĩa thống kê nguy cơ xuất huyết não (HR 1,65; KTC 95%1,20 – 2,26; p=0,002; AIRD tăng 2.3 trường hợp (excess cases)/1000 người-năm), và nguy cơ xuất huyết ngoài sọ nặng (HR 1.48; KTC 95% 1.32-1.67; p < 0.001; AIRD tăng 13.0 trường hợp/1000 người-năm), trong đó có xuất huyết tiêu hóa nặng (HR, 1.40; KTC 5% 1.23-1.59; p < .001; AIRD tăng 9.4 trường hợp/1000 người-năm); tăng tử vong không có ý nghĩa thống kê (HR 1.15; KTC 95% 1.00-1.32; p = 0.051; AIRD tăng 3.1 trường hợp/1000 người-năm). Trên bệnh nhân từ 75 tuổi hoặc điểm CHADS2 >= 2, so với dabigatran, rivaroxaban gây tăng tử vong có ý nghĩa. Sử dụng rivaroxaban tăng tỉ lệ xuất huyết não cao hơn việc giảm tỉ lệ đột quỵ thuyên tắc huyết khối.
KẾT LUẬN
So với sử dụng dabigatran 150mg 2 lần mỗi ngày, việc sử dụng rivaroxaban 20 mg 1 lần mỗi ngày gây tăng có ý nghĩa tỉ lệ xuất huyết não và xuất huyết ngoài sọ nặng, bao gồm xuất huyết tiêu hóa nặng. Chất đối kháng vitamin K, muối warfarin, là thuốc nền tảng giảm nguy cơ đột quỵ thuyên tắc huyết khối trên bệnh nhân rung nhĩ, nhưng cũng gia tăng nguy cơ xuất huyết não và xuất huyết ngoài sọ; khó khăn trong việc duy trì ngưỡng điều trị. Chất ức chế thrombin trực tiếp (dabigatran) và chất ức chế yếu tố Xa (rivaroxaban) là 2 loại kháng đông đường uống không phải đối kháng vitamin K (NOAC), với liều sử dụng đơn giản hơn warfarin và không cần theo dõi điều trị. Trong nghiên cứu RE-LY (Randomized Evaluation of Longterm Anticoagulation Therapy), dabigatran ưu thế hơn warfarin trong giảm đột quỵ và xuất huyết não trên bệnh nhân rung nhĩ không do bệnh van tim, nhưng nguy cơ xuất huyết tiêu hóa nặng thấp hơn. Trong nghiên cứu ROCKET-AF (Rivaroxaban Once Daily Oral Direct Factor Xa Inhibition Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation), điều trị rivaroxaban không giảm thấp hơn warfarin trong dự phòng đột quỵ và thuyên tắc hệ thống. Trên nhóm rivaroxaban, biến cố xuất huyết nội sọ và xuất huyết gây tử vong giảm nhưng biến cố xuất huyết tiêu hóa nặng gia tăng.
So sánh gián tiếp qua dữ liệu từ nghiên cứu RE-LY và ROCKET-AF cho thấy nguy cơ đột quỵ, thuyên tắc hệ thống và đột quỵ xuất huyết trên nhóm điều trị với dabigatran giảm có ý nghĩa so với rivaroxaban. Tuy nhiên, kết quả phân tích trên không kiểm soát được khác biệt về các yếu tố nguy cơ nền tảng gây đột quỵ hoặc đánh giá hiệu quả của kháng đông warfarin giữa 2 nghiên cứu trên. Phân tích so sánh gián tiếp khác trên phân nhóm bệnh nhân có nguy cơ đột quỵ cao từ 2 nghiên cứu cho thấy nhóm điều trị dabigatran giảm nguy cơ đột quỵ và thuyên tắc hệ thống không có ý nghĩa thống kê. Câu hỏi vẫn chưa có lời đáp: liệu hiệu quả điều trị của các loại NOACs này tương tự hay có khác biệt lâm sàng ý nghĩa để các bác sĩ và bệnh nhân ưu tiên lựa chọn?
Như chúng ta biết, 80% bệnh nhân rung nhĩ trên 65 tuổi. Vì vậy, chúng tôi nghiên cứu trên những bệnh nhân lớn tuổi hưởng dịch vụ Medicare có rung nhĩ không do bệnh van tim, được điều trị khởi đầu với dabigatran hoặc rivaroxaban; và so sánh trực tiếp các nguy cơ đột quỵ, xuất huyết và tử vong ở 2 nhóm thuốc. Cả 2 loại NOAC được sử dụng tại Hoa Kì trên bệnh nhân rung nhĩ không do bệnh van tim với 2 liều: liều thấp cho bệnh nhân có suy chức năng thận; và liều chuẩn cho các bệnh nhân còn lại. Chúng tôi so sánh những bệnh nhân được điều trị khởi đầu với liều chuẩn dabigatran (150mg 2 lần mỗi ngày) và rivaroxaban (20mg 1 lần mỗi ngày).
PHƯƠNG PHÁP NGHIÊN CỨU
ĐỐI TƯỢNG NGHIÊN CỨU
Medicare cung cấp dịch vụ bảo hiểm y tế cho người từ 65 tuổi trở lên và người dưới 65 tuổi có bệnh thận mạn giai đoạn cuối hoặc bị tàn tật. Nghiên cứu này giới hạn trên đối tượng người lớn tuổi tham gia vào dịch vụ Medicare tự chi trả nhóm A (nhập viện), nhóm B (chăm sóc sức khỏe ngoại trú), nhóm D (uống thuốc theo toa) vì yêu cầu từ những nhóm này cần thiết cho mục tiêu nghiên cứu. Những bệnh nhân trong nhóm C (Medicare Advantage) được chăm sóc sức khỏe bởi các công ty bảo hiểm tư nhân, không tham gia vào nghiên cứu vì các yêu cầu về thăm khám và nhập viện không được Medicare ghi nhận chắc chắn trong thời gian nghiên cứu.
Thiết kế đoàn hệ người dùng mới (new-user cohort study) trên những bệnh nhân khởi đầu điều trị rung nhĩ không do bệnh van tim với liều chuẩn dabigatran hoặc rivaroxaban.
Tiêu chuẩn nhận bệnh:tất cả các bệnh nhân nội ngoại trú có rung nhĩ hoặc cuồng nhĩ dựa trên mã bệnh theo Hệ thống phân loại bệnh tật, phiên bản thứ 9 (International Classification of Diseases, Ninth Revision – ICD-9), được sử dụng đầu tiên một trong hai loại thuốc trên từ 03/11/2011 (thời điểm rivaroxaban được chấp thuận sử dụng trên bệnh nhân rung nhĩ tại HOA Kì) đến 30/06/2014.
Tiêu chuẩn loại trừ:tham gia vào dịch vụ Medicare nhóm A, B, C dưới 6 tháng; tuổi dưới 65; từng được điều trị trước đó với warfarin hoặc bất kì loại NOAC nào; sinh sống trong viện điều dưỡng hoặc được tạo điều kiện chăm sóc với điều dưỡng có chuyên môn cao; đang được chăm sóc cận tử (hospice care) vào ngày được kê toa thuốc phù hợp tiêu chuẩn nhận bệnh (ngày vào nghiên cứu – index day). Chúng tôi loại trừ những bệnh nhân có thời gian nhập viện vượt qua ngày vào nghiên cứu như người nhận thận ghép; người được lọc máu. Ngoài ra, những bệnh nhân có chẩn đoán liên quan đến khả năng chỉ định sử dụng kháng đông trong 6 tháng trước khi tham gia nghiên cứu cũng được loại trừ: bệnh van 2 lá, sửa hoặc thay van, huyết khối tĩnh mạch sâu, thuyên tắc phổi, thay khớp. Vì mục đích của nghiên cứu là so sánh đối đầu dabigatran và rivaroxaban nên chúng tôi không thu nhận nhóm bệnh nhân điều trị warfarin vào nghiên cứu.
Nghiên cứu được chấp thuận bởi phòng nghiên cứu trong Ủy ban nhân quyền của trung tâm kiểm nghiệm và nghiên cứu thuốc. Đây là nghiên cứu hồi cứu nên bệnh nhân không cần kí vào bản chấp thuận trên cơ sở được thông tin (Informed consent).
BIẾN SỐ CƠ BẢN
Trong 6 tháng trước khi tham gia vào nghiên cứu, Medicare yêu cầu cung cấp các dữ kiện bao gồm: bệnh mạn tính, bệnh tim mạch, các yếu tố nguy cơ xảy ra các biến cố tim mạch, đột quỵ, và xuất huyết. Mỗi bệnh nhân sẽ được ghi nhận tình trạng chăm sóc sức khỏe trước đó, các loại thuốc điều trị các bệnh lý kể trên, cũng như các loại thuốc tương tác có khả năng ảnh hưởng đến dược động học của dabigatran hoặc rivaroxaban. Chúng tôi đánh giá thang điểm dự đoán nguy cơ đột quỵ trên bệnh nhân rung nhĩ – CHADS2, sử dụng trong nghiên cứu RE-LY và ROCKET-AF; và thang điểm dự đoán nguy cơ xuất huyết HASBLED trên bệnh nhân rung nhĩ sử dụng warfarin.
KIỂM SOÁT YẾU TỐ NHIỄU TRONG NGHIÊN CỨU
Vì các biến số cơ bản trong nghiên cứu có thể không cân xứng, chúng tôi điều chỉnh khả năng tương đồng trong khi vẫn duy trì cỡ mẫu bằng cách sử dụng phương pháp Xác suất nghịch đảo của hiệu chỉnh điều trị (Inverse Probability of Treatment Weighting – IPTW) dựa vào chỉ số khuynh hướng (propensity score). Bằng phương pháp này, chỉ số khuynh hướng (propensity score – xác suất dự đoán khi khởi đầu điều trị dabigatran dựa trên các đặc điểm cơ bản) được sử dụng để thiết lập mức hiệu chỉnh ổn định chuyên biệt bệnh nhân (patient-specific stabilized weights) có thể kiểm soát tính mất cân xứng của các biến số. Tính cân bằng biến số giữa các đoàn hệ được xác định dựa vào độ lệch chuẩn trung vị. Độ lệch chuẩn ≤ 0.1 cho thấy khác biệt giữa 2 nhóm không đáng kể. Sự phân bố chỉ số khuynh hướng và sự hiệu chỉnh ổn định được kiểm duyệt cho các biến số bất thường.
THEO DÕI NGHIÊN CỨU
Tiến trình theo dõi bắt đầu từ ngày tham gia nghiên cứu đến khi không tham gia dịch vụ Medicare; ngưng kháng đông quá 3 ngày; sử dụng loại kháng đông khác; ghép thận hoặc bắt đầu lọc máu; vào viện điều dưỡng; được chăm sóc cận tử; kết thúc nghiên cứu hoặc xuất hiện biến cố. Chúng tôi chọn khoảng thời gian 3 ngày cho phép ngưng thuốc kháng đông vì thời gian bán hủy ngắn của dabigatran (12 – 17 giờ) và rivaroxaban (11 – 13 giờ) và mong muốn của chúng tôi có thể gia tăng tính phù hợp (likelihood) của những bệnh nhân tham gia vào nghiên cứu được đảm bảo hiệu quả điều trị kháng đông. Chúng tôi kiểm duyệt tình trạng gia nhập viện điều dưỡng vì liên quan đến việc ghi nhận không chính xác các biến cố; và kiểm duyệt việc chuyển qua chăm sóc cận tử, vì hầu hết tử vong đã được biết trước và dĩ nhiên không phải do biến cố cấp tính có liên quan đến kháng đông.
BIẾN CỐ NGHIÊN CỨU
Biến cố chính: đột quỵ thuyên tắc huyết khối, xuất huyết não, xuất huyết ngoài sọ nặng bao gồm xuất huyết tiêu hóa nặng; và tử vong.
Biến cố phụ là tất cả các biến cố xuất huyết ngoài sọ phải nhập viện; và nhồi máu cơ tim cấp.
Các biến cố được định nghĩa dựa trên lưu đồ được chấp thuận trước đây căn cứ vào mã chẩn đoán ICD-9. Các lưu đồ này có giá trị tiên đoán dương từ 86% đến 97% (bảng 1 trong phụ lục). Hồ sợ bệnh án không được thu thập để đánh giá các biến cố một cách độc lập. Xuất huyết ngoài sọ nặng bao gồm xuất huyết gây tử vong, xuất huyết nhập viện đề truyền máu, hoặc nhập viện do xuất huyết ở những vị trí quan trọng ngoài sọ (ví dụ: nội tủy, nội khớp, nội nhãn, màng ngoài tim, sau phúc mạc, trong cơ gây hội chứng chèn ép khoang). Các định nghĩa trên không giống với định nghĩa trong nghiên cứu RE-LY và ROCKET-AF vì chúng tôi thiếu các dữ liệu dẫn chứng cho nồng độ hemoglobin giảm ít nhất 2 g/dL hoặc số lượng đơn vị máu truyền. Tử vong được xác định chắc chắn bằng cách kết hợp với dữ liệu của tổ chức Phúc lợi Xã hội (Social Security), tuy nhiên chúng tôi chỉ được cung cấp ngày tử vong, không được cung cấp nguyên nhân tử vong và đã ghi nhận tại Hoa Kì, trên 95% tử vong tập trung ở đối tượng trên 65 tuổi. Biến cố tử vong bao gồm tử vong như biến cố nghiên cứu xuất hiện đầu tiên hoặc tử vong xảy ra trong vòng 30 ngày sau khi nhập viện vì các biến cố chính khác.
PHÂN TÍCH DỮ LIỆU
Tất cả các số liệu được phân tích dựa trên đoàn hệ điều chỉnh bằng phương pháp IPTW và được tính toán khử nhiễu do các yếu tố nền tảng. Biểu đồ tỉ lệ mới mắc tích lũy Kaplan-Meier hiệu chỉnh (weighted) được thiết kế để mô tả nguy cơ theo thời gian. Mô hình hồi quy tỉ lệ nguy cơ Cox hiệu chỉnh (Weighted Cox proportional hazards regression) với ước lượng rõ ràng được sử dụng để ước tính biến cố theo thời gian trên nhóm dùng rivaroxaban so với nhóm dùng dabigatran (nhóm chứng). Sự khác biệt tỉ lệ mới mắc hiệu chỉnh cũng được ước tính qua số lượng biến cố và thời gian theo dõi trong nghiên cứu. Đánh giá ý nghĩa của thống kê dùng khoảng tin cậy 95% và chỉ số p 2 đuôi (2-tailed p – p ≤ 0.5). Ngoại trừ biến cố tử vong, tỉ lệ ca tử vong – 30 ngày, các biến cố còn lại được tính dựa vào số tử vong trong vòng 30 ngày xảy ra biến cố chia cho tổng số bệnh nhân xuất hiện biến cố trên.
Phân tích dưới nhóm được xác định trước trên tất cả các biến cố được phân thành nhiều mục như tuổi, giới, nhập viện trong 30 ngày trước, sử dụng kháng đông cùng với kháng kết tập tiểu cầu, bệnh thận mạn, điểm CHADS2 và HASBLED. Trong phân tích phụ này, mô hình hồi quy Cox được dùng để khảo sát các nguy cơ trong suốt khoảng thời gian điều trị định sẵn vì nguy cơ xuất huyết có thể cao nhất trong 3 tháng đầu khi bắt đầu dùng kháng đông. Chúng tôi cũng thực hiện một số phân tích độ nhạy (sensitivity analyses). Để đánh giá liệu các phân tích chính có bị ảnh hưởng bởi sự phân loại sai thời gian dùng thuốc, chúng tôi giới hạn phân tích trên những bệnh nhân có từ 2 toa thuốc có chứa 1 trong 2 loại thuốc nghiên cứu, khoảng cách giữa các toa thuốc có dùng kháng đông được gia tăng từ 3 – 14 ngày. Chúng tôi lập lại phân tích chính sử dụng mô hình hồi quy Cox đa biến, bao gồm tất cả các biến số sử dụng để phân tích đa biến. Trong phân tích độ nhạy post-hoc, thang điểm CHA2DS2-VASc thay thế thang điểm CHA2DS2; và chúng tôi không còn đánh giá khi nào bệnh nhân chạy thận, ghép thận, hoặc nhập vào viện điều dưỡng; hay được chăm sóc cận tử; và chúng tôi sử dụng phương pháp phân phối nguy cơ dưới nhóm để hiệu chỉnh nguy cơ tử vong.
Chúng tôi phân tích bằng phần mềm R phiên bản 3.2.0 (Cơ sở R cho tính toán thống kê, Vienna, cộng hòa Áo) and SAS phiên bản 9.4 (SAS Institute Inc).
KẾT QUẢ
Chúng tôi thu nhận 52240 bệnh nhân khởi đầu dabigatran và 66651 bệnh nhân khởi đầu rivaroxaban, tương ứng 15524 và 20199 người-năm theo dõi điều trị ở mỗi nhóm (thời gian [khoảng] trung bình ở mỗi nhóm lần lượt là 108 [0-969] và 111 [0-923] ngày). Trước khi điều chỉnh, có nhiều khác biệt nhỏ về thu nhập, đặc điểm địa lí, nhập cấp cứu trong 30 ngày qua, đã sử dụng kháng đông chích, kháng tiểu cầu, và digoxin. Cách cho thuốc của các bác sĩ có nhiều khác biệt lớn: rivaroxaban được cho nhiều bởi các chuyên gia tim mạch, nhưng ít hơn bởi các bác sĩ gia đình (bảng 1 và bảng 2 trong phụ lục). Sau khi hiệu chỉnh IPTW, các biến số đoàn hệ nghiên cứu cân xứng hợp lý.
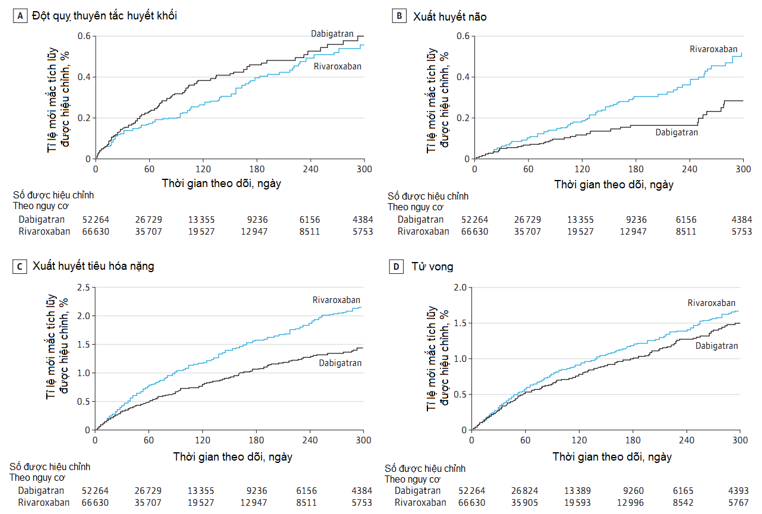
Trong thời gian theo dõi, có 2537 biến cố chính gồm 306 biến cố đột quỵ thuyên tắc huyết khối, 176 biến cố xuất huyết nội sọ, 1209 biến cố xuất huyết ngoài sọ nặng gồm cả 1018 trường hợp xuất huyết tiêu hóa (84.2%); và 846 trường hợp tử vong (724 trường hợp tử vong là biến cố đầu tiên, 122 trường hợp tử vong trong 30 ngày vì các biến cố chính khác). Biểu đồ tỉ lệ mới mắc tích lũy cho thấy đường biểu diễn ở 2 nhóm tách ra sớm và xa dần theo thời gian theo dõi các biến cố xuất huyết não, xuất huyết tiêu hóa nặng, tử vong; nhưng hội tụ lại vào ngày 240 khi theo dõi biến cố đột quỵ thuyên tắc huyết khối (Hình 1). Sử dụng rivaroxaban giảm nguy cơ thuyên tắc huyết khối không có ý nghĩa (HR 0.81; KTC 95% 0.65 – 1.01; p=0.07); gia tăng có ý nghĩa tỉ lệ xuất huyết não (HR 1.65; KTC 95% 1.20 – 2.26; P = 0.002), và xuất huyết ngoài sọ nặng (HR 1.48; KTC 95% 1.32 – 1.67; P < 0.001) bao gồm xuất huyết tiêu hóa nặng (HR, 1.40; KTC 95%, 1.23 – 1.59; P < 0.001); gia tăng tử vong không ý nghĩa (HR 1.15; KTC 95% 1.00 – 1.32; P = 0.051) (bảng 2). Kết quả của các biến cố chính tương tự nhau khi so sánh liều thấp rivaroxaban (15 mg mỗi ngày 1 lần) với liều thấp dabigatran (75 mg mỗi ngày 2 lần) (Bảng 3 trong phụ lục). Trên các biến cố phụ, tỉ lệ xuất huyết não nhập viện tăng có ý nghĩa trên nhóm dùng rivaroxaban và nguy cơ nhồi máu cơ tim không khác biệt giữa hai nhóm. Trên 1000 người-năm được theo dõi điều trị với rivaroxaban, sai biệt tỉ suất mới mắc đã hiệu chỉnh giảm 1.8 ca đột quỵ thuyên tắc huyết khối; tăng 2.3 ca xuất huyết não; tăng 13 ca xuất huyết ngoài sọ nặng, trong đó tăng 9.4 ca xuất huyết tiêu hóa nặng; tăng 3.1 ca tử vong.
Nguy cơ đột quỵ thuyên tắc huyết khối và tử vong ở 2 nhóm không khác biệt có ý nghĩa. Điều quan trọng là khi dùng rivaroxaban, tỉ lệ xuất huyết não gia tăng vượt quá tỉ lệ giảm đột quỵ thuyên tắc huyết khối. Tỉ lệ ca tử vong – 30 ngày là 9.2% (đột quỵ thuyên tắc huyết khối), 31.8% (xuất huyết não), 3.1% (xuất huyết ngoài sọ nặng), 9.7% (nhồi máu cơ tim cấp) với khác biệt giữa 2 nhóm không đáng kể.
Nhìn chung, tỉ số nguy cơ giữa các phân nhóm là ngang nhau với một số ít ngoại lệ (Hình 2). Trên nhóm sử dụng rivaroxaban, nguy cơ gia tăng xuất huyết tiêu hóa nặng giảm khi tuổi càng cao và nguy cơ tử vong giảm có ý nghĩa trên những bệnh nhân từ 75 tuổi và có điểm CHADS2 ≥2 (bảng 4 trong phụ lục). Phân tích thêm cho thấy theo thời gian không có sự khác biệt trên tất cả các biến cố nghiên cứu ngoại trừ đột quỵ thuyên tắc huyết khối: nguy cơ khi dùng rivaroxaban có thể giảm trong 90 ngày đầu tiên sử dụng nhưng sau đó thì không (HR 0.71; KTC 95% 0.55 – 0.93 và HR 1.14; KTC 95% 0.74 – 1.75; P = 0.07) (Bảng 5 trong phụ lục). Phân tích độ nhạy mang lại kết quả tương tự như phân tích chính (bảng 6 trong phụ lục).
BÀN LUẬN
Khi so sánh trực tiếp những bệnh nhân rung nhĩ không do bệnh van tim được điều trị với liều chuẩn rivaroxaban và dabigatran, nguy cơ xuất huyết não và xuất huyết ngoài sọ nặng, bao gồm xuất huyết tiêu hóa nặng, gia tăng có ý nghĩa trên nhóm sử dụng rivaroxaban. Mặc dù nguy cơ tử vong khi dùng rivaroxaban gia tăng không ý nghĩa ở các nhóm tuổi trong phân tích chính, nhưng lại gia tăng có ý nghĩa trên nhóm bệnh nhân từ 75 tuổi trở lên và điểm CHADS2 ≥ 2, so sánh với dabigatran. Các kết quả sau cùng này phải được hiểu một cách thận trọng cho thấy chúng tôi đã kiểm tra trên nhiều phân nhóm. Trên nhóm dùng rivaroxaban, sự gia tăng thực (net increase) nguy cơ xuất huyết não, biến cố có tỉ lệ tử vong-ca bệnh cao nhất, vượt qua sự giảm thực (net reduction) nguy cơ đột quỵ thuyên tắc huyết khối. Đáng lưu ý là vào năm 2014, trên những bệnh nhân rung nhĩ tại Hoa Kì, rivaroxaban được sử dụng gấp 2 đến 3 lần so với dabigatran, một phần có lẽ do nhận thức không đúng của các bác sĩ về nguy cơ chảy máu khi dùng dabigatran, ghi nhận của Cục quản lý thuốc và thực phẩm Hoa Kì thông qua các báo cáo sau khi được chấp thuận. Trớ trêu thay, về căn bản, nguy cơ xuất huyết cao hơn khi dùng rivaroxaban so với dabigatran. Kết quả của chúng tôi phù hợp với một nghiên cứu nhỏ được công bố gần đây tại Đan Mạch cho thấy không khác biệt về nguy cơ đột quỵ nhưng gia tăng nguy cơ tử vong và xuất huyết khi dùng rivaroxaban 20mg mỗi ngày 1 lần so với dabigatran 150 mg mỗi ngày 2 lần trên bệnh nhân rung nhĩ.
Kết quả của chúng tôi khác với các nghiên cứu khác dựa trên so sánh gián tiếp giữa các thử nghiệm lâm sàng, nguy cơ đột quỵ có thể cao hơn khi dùng rivaroxaban nhưng không khác biệt về nguy cơ xuất huyết và tử vong ở 2 loại NOAC. Điều này làm nói lên tầm quan trọng của các nghiên cứu đối đầu khi đánh giá hiệu quả có thể so sánh được của các liệu pháp điều trị khác nhau. So sánh gián tiếp có thể không chính xác. Ví dụ, những bệnh nhân dùng rivaroxaban trong nghiên cứu ROCKET-AF lớn tuổi và điểm CHADS2 nền cao hơn những bệnh nhân dùng dabigatran trong nghiên cứu RE-LY, trong khi đó, thời gian điều trị trên những bệnh nhân được dùng warfarin ở trong nghiên cứu RE-LY cao hơn trong nghiên cứu ROCKET-AF. Những khác biệt này, và có thể do những khác biệt khác không được đánh giá, có thể gây nhiễu khi so sánh gián tiếp. Nhưng trái lại, một nghiên cứu trực tiếp ngẫu nhiên giữa dabigatran và rivaroxaban sẽ thành tối ưu, những nghiên cứu như vậy không chắc sẽ được thực hiện bởi nhà sản xuất thuốc kể trên.
Nghiên cứu của chúng tôi cho thấy liều chuẩn rivaroxaban đạt được hiệu quả kháng đông tốt hơn so với liều chuẩn dabigatran. Trong khi thời gian bán hủy của rivaroxaban và dabigatran tương đương, khoảng 12h, nhưng dabigatran sử dụng mỗi ngày 2 lần, còn rivaroxaban sử dụng mỗi ngày 1 lần. Liều rivaroxaban dùng 1 lần mỗi ngày được cho rằng có nồng độ huyết thanh đỉnh cao hơn và đáy thấp hơn so với liều rivaroxaban sử dụng 2 lần một ngày với cùng tổng liều. Việc rút gọn thành liều 1 lần mỗi ngày hoặc chấp nhận liều 2 lần mỗi ngày có thể giảm xuất huyết quá mức và nguy cơ tử vong trên các phân nhóm chúng tôi theo dõi. Tuy nhiên, hiệu quả lên biến cố huyết khối và xuất huyết của việc điều chỉnh liều dùng như trên cần được đánh giá qua các nghiên cứu lâm sàng. Các bệnh nhân sử dụng dabigatran với liều 1 lần mỗi ngày nhiều hơn dùng 2 lần mỗi ngày, dẫn đến hiệu quả kháng đông không đủ trên nhóm dùng dabigatran. Chúng tôi nghĩ điều này không chắc chắn vì 2 lí do. Trong nghiên cứu trước đây trên bệnh nhân rung nhĩ khởi đầu sử dụng warfarin hoặc liều chuẩn dabigatran, sử dụng cùng cơ sở dữ liệu của dịch vụ Medicare và các khái niệm biến cố, kết quả tương tự với những bệnh nhân rung nhĩ trong nghiên cứu RE-LY, điều này cho thấy các bệnh nhân hưởng dịch vụ Medicare tuân thủ liều dabigatran 2 lần mỗi ngày có thể so sánh với các bệnh nhân trong nghiên cứ RE-LY. Phân tích độ nhạy của chúng tôi loại ra những bệnh nhân có toa thuốc dùng 2 hay nhiều loại NOAC để đảm bảo các kết quả tương tự như phân tích chính. Phân tích này chỉ bao gồm những bệnh nhân dùng dabigatran 2 lần 1 ngày đến khám để nhận thuốc vào một thời điểm nhất định. Vào thời điểm này, những bệnh nhân dùng dabigatran 1 lần mỗi ngày sẽ không đến khám bởi vì vẫn còn lượng thuốc chưa sử dụng hết. Cuối cùng, liều thấp hơn của dabigatran được khuyến cáo trên những bệnh nhân có độ thanh thải creatinine 15 – 30 ml/phút/1,73 m2 da, trong khi đó, đối với rivaroxaban, độ thanh thải creatinine có khoảng rộng hơn: 15 – 50 mL/phút/1.73 m2 da (chuyển đổi thành mL/giây/1.73 m2 da: nhân với 0.0167). Trong phân tích sử dụng liều chuẩn, những bệnh nhân sử dụng liều thấp được loại ra. Chúng tôi không thể loại trừ trường hợp phần lớn những bệnh nhân có suy thận được dùng rivaroxaban với liều chuẩn (sử dụng thuốc ngoài hướng dẫn – off-label) bởi vì hướng dẫn sử dụng rivaroxaban cho phép phạm vi độ thanh thải Creatinin rộng hơn. Nếu có sử dụng thuốc ngoài hướng dẫn, hiệu quả kháng đông khi dùng rivaroxaban mạnh hơn và có thể được theo dõi qua dữ liệu nghiên cứu của chúng tôi. Dịch vụ Medicare yêu cầu không ghi nhận độ thanh thải creatinine hoặc các kết quả xét nghiệm máu, vì vậy chúng tôi không thể đánh giá hiệu quả kháng đông một cách rõ ràng. Với phạm vị độ thanh thải creatinine rộng hơn, chúng tôi mong muốn phần lớn người dùng rivaroxaban nhiều hơn dabigatran được điều trị với liều thấp, đã được ghi nhận trong dữ liệu của chúng tôi, với 19.6% bệnh nhân dùng dabigatran và 26.8% bệnh nhân dùng rivaroxaban với liều thận (bảng 7 trong phụ lục).
Nghiên cứu này có một vài giới hạn. Thời gian trung bình theo dõi điều trị là dưới 4 tháng, do đó làm giảm cỡ mẫu so với thời gian sử dụng lâu hơn. Những nghiên cứu khác về tính an toàn của NOACs sử dụng cơ sở dữ liệu khác của Hoa Kì có thời gian theo dõi trung bình dưới 6 tháng, điều này cho thấy hạn chế trong khảo sát các yếu tố nguy cơ lâu dài. Mặc dù vậy, chúng tôi có một số lượng lớn những bệnh nhân vẫn được điều trị kháng đông ở tháng thứ 6 hoặc tháng thứ 8, nhiều hơn so với lượng bệnh nhân bắt đầu điều trị NOAC trong nghiên cứu của chúng tôi cũng như các nghiên cứu khác. Đây là nghiên cứu quan sát, có thể lệ thuộc vào các giá trị có thể bị nhiễu bởi một số yếu tố không thể đo đạc được. Điều này dẫn đến ước lượng các nguy cơ bị sai lệch (biased estimate of risks). Ngoài ra, nghiên cứu của chúng tôi tiến hành trên đối tượng bệnh nhân từ 65 tuổi trở lên, nhóm tuổi chiếm 80% bệnh nhân rung nhĩ. Hiệu quả so sánh giữa dabigatran và rivaroxaban có thể khác biệt trên nhóm dân số nhỏ tuổi hơn. Cuối cùng, nghiên cứu của chúng tôi khảo sát trên những bệnh nhân sử dụng dabigatran hoặc rivaroxaban lần đầu tiên, chưa dùng warfarin, để dự phòng đột quỵ trên bệnh nhân rung nhĩ. Kết quả có thể khác biệt trên đối tượng chuyển đổi từ warfarin sang NOAC.
KẾT LUẬN
Trong nghiên cứu so sánh trực tiếp việc dùng rivaroxaban và dabigatran trên những bệnh nhân rung nhĩ, rivaroxaban gia tăng có ý nghĩa nguy cơ xuất huyết não và xuất huyết ngoài sọ nặng, bao gồm xuất huyết tiêu hóa nặng; và có khả năng gia tăng tử vong trên những bệnh nhân lớn tuổi hoặc có nguy cơ đột quỵ cao. Hiệu quả kháng đông trên nhóm dùng rivaroxaban cao hơn có thể do liều dùng cao hơn với 1 lần một ngày. Hiệu quả kháng đông cao có thể do không được loại trừ được việc sử dụng không đúng hướng dẫn với liều chuẩn rivaroxaban trên bệnh nhân suy chức năng thận.
Bảng 1.Các yếu tố dân số xã hội, bệnh lý, thuốc dùng ở hai nhóm cơ bản và nhóm được hiệu chỉnh của các bệnh nhân hưởng dịch vụ Medicare khởi đầu điều trị rivaroxaban hoặc dabigatran từ 2011 đến 2014a
|
|
Nhóm cơ bản |
Nhóm hiệu chỉnh |
||||
|
|
% |
% |
||||
|
Đặc điểm |
Dabigatran (n=52240) |
Rivaroxaban (n=66651) |
SMD |
Dabigatran (n=52264) |
Rivaroxaban (n=66630) b |
SMD |
|
Dân số học |
|
|
|
|
|
|
|
Tuổi |
|
|
|
|
|
|
|
65 – 74 |
50 |
51 |
0.02 |
50 |
50 |
0.00 |
|
75 – 84 |
40 |
40 |
0.00 |
40 |
40 |
0.00 |
|
≥ 85 |
10 |
9 |
0.03 |
9 |
9 |
0.00 |
|
Giới nữ |
47 |
47 |
0.00 |
47 |
47 |
0.00 |
|
Chủng tộc |
|
|
|
|
|
|
|
Da trắng |
91 |
92 |
0.03 |
92 |
92 |
0.00 |
|
Da đen |
4 |
3 |
0.02 |
4 |
4 |
0.00 |
|
Khác |
5 |
4 |
0.02 |
5 |
5 |
0.00 |
|
Tiền căn bệnh lý |
|
|
|
|
|
|
|
Tổng quát |
|
|
|
|
|
|
|
Đái tháo đường |
34 |
32 |
0.03 |
33 |
33 |
0.00 |
|
Tăng cholesterol máu |
39 |
40 |
0.03 |
39 |
39 |
0.00 |
|
Tăng huyết áp |
86 |
86 |
0.00 |
86 |
86 |
0.00 |
|
Suy thận |
|
|
|
|
|
|
|
Cấp |
3 |
3 |
0.01 |
3 |
3 |
0.00 |
|
Mạn |
10 |
8 |
0.04 |
9 |
9 |
0.00 |
|
Béo phì |
14 |
15 |
0.04 |
15 |
15 |
0.00 |
|
Loét dạ dày |
<1 |
<1 |
0.01 |
<1 |
<1 |
0.00 |
|
Xuất huyết nhập viện trước đây |
<1 |
<1 |
0.00 |
<1 |
<1 |
0.00 |
|
Hút thuốc lá |
18 |
20 |
0.05 |
19 |
19 |
0.00 |
|
Bệnh tim mạch |
|
|
|
|
|
|
|
Nhồi máu cơ tim |
|
|
|
|
|
|
|
Ngày 1 – 30 |
1 |
1 |
0.03 |
1 |
1 |
0.00 |
|
Ngày 31 – 183 |
1 |
1 |
0.01 |
1 |
1 |
0.00 |
|
Tái thông mạch vành |
14 |
15 |
0.02 |
15 |
15 |
0.00 |
|
Suy tim |
|
|
|
|
|
|
|
Nhập viện |
3 |
3 |
0.01 |
3 |
3 |
0.00 |
|
Ngoại trú |
13 |
11 |
0.04 |
12 |
12 |
0.00 |
|
Bệnh tim thiếu máu khác |
44 |
45 |
0.02 |
45 |
45 |
0.00 |
|
Đột quỵ |
|
|
|
|
|
|
|
Ngày 1 – 30 |
2 |
2 |
0.00 |
2 |
2 |
0.00 |
|
Ngày 31 – 183 |
1 |
1 |
0.01 |
1 |
1 |
0.00 |
|
Bệnh mạch máu não khác |
11 |
11 |
0.01 |
11 |
11 |
0.00 |
|
Cơn thoáng thiếu máu não |
6 |
6 |
0.01 |
6 |
6 |
0.00 |
|
Cắt đốt điện sinh lý |
2 |
2 |
0.00 |
2 |
2 |
0.00 |
|
Chuyển nhịp |
9 |
9 |
0.01 |
9 |
9 |
0.00 |
|
Bệnh lý khác |
|
|
|
|
|
|
|
Ngã |
5 |
5 |
0.00 |
5 |
5 |
0.00 |
|
Gãy xương |
1 |
1 |
0.00 |
1 |
1 |
0.00 |
|
Ngất |
8 |
9 |
0.02 |
9 |
9 |
0.00 |
|
Dùng xe đẩy (walker use) |
2 |
2 |
0.01 |
2 |
2 |
0.00 |
|
Điểm CHADS2c |
|
|
|
|
|
|
|
0 – 1 |
33 |
34 |
0.03 |
34 |
34 |
0.00 |
|
2 |
40 |
40 |
0.02 |
40 |
40 |
0.00 |
|
3 |
19 |
18 |
0.01 |
19 |
19 |
0.00 |
|
≥4 |
8 |
8 |
0.00 |
8 |
8 |
0.00 |
|
Điểm HASBLEDd |
|
|
|
|
|
|
|
1 |
10 |
10 |
0.01 |
10 |
10 |
0.00 |
|
2 |
54 |
54 |
0.01 |
54 |
54 |
0.00 |
|
3 |
29 |
29 |
0.01 |
29 |
29 |
0.00 |
|
≥4 |
7 |
7 |
0.01 |
7 |
7 |
0.00 |
|
Dùng thuốc |
|
|
|
|
|
|
|
Chung |
|
|
|
|
|
|
|
Liệu pháp estrogen |
2 |
2 |
0.01 |
2 |
2 |
0.00 |
|
Đối kháng histamine H2 |
5 |
5 |
0.00 |
5 |
5 |
0.00 |
|
Kháng viêm không steroids |
14 |
14 |
0.01 |
14 |
14 |
0.00 |
|
ức chế bơm proton |
26 |
27 |
0.02 |
27 |
27 |
0.00 |
|
Chống trầm cảm SSRIs |
13 |
12 |
0.01 |
13 |
13 |
0.00 |
|
Tim mạch |
|
|
|
|
|
|
|
Ức chế mẹn chuyển/chẹn thụ thể angiotensin II |
59 |
58 |
0.01 |
59 |
58 |
0.00 |
|
Chống loạn nhịp |
25 |
25 |
0.01 |
25 |
25 |
0.01 |
|
Kháng tiểu cầu |
13 |
15 |
0.06 |
14 |
14 |
0.00 |
|
Chẹn beta |
70 |
71 |
0.01 |
71 |
71 |
0.00 |
|
Chẹn kênh canxi |
42 |
42 |
0.00 |
42 |
42 |
0.00 |
|
Digoxin |
14 |
12 |
0.07 |
13 |
13 |
0.00 |
|
Lợi tiểu |
|
|
|
|
|
|
|
Quai |
25 |
22 |
0.05 |
23 |
23 |
0.00 |
|
Giữ kali |
8 |
8 |
0.02 |
8 |
8 |
0.00 |
|
Thiazide |
30 |
30 |
0.00 |
30 |
30 |
0.00 |
|
Nitrates |
9 |
9 |
0.01 |
9 |
9 |
0.00 |
|
Statin |
58 |
57 |
0.00 |
57 |
57 |
0.00 |
|
Fibrate |
5 |
4 |
0.02 |
4 |
4 |
0.00 |
|
Đái tháo đường |
|
|
|
|
|
|
|
Insulin |
6 |
6 |
0.02 |
6 |
6 |
0.00 |
|
Metformin |
15 |
15 |
0.01 |
15 |
15 |
0.00 |
|
Sulfonylureas |
9 |
8 |
0.03 |
9 |
9 |
0.00 |
|
Khác |
6 |
6 |
0.03 |
6 |
6 |
0.00 |
|
Ức chế chuyển hóae |
|
|
|
|
|
|
|
Amiodarone |
9 |
10 |
0.01 |
9 |
9 |
0.00 |
|
Dronedarone |
4 |
4 |
0.01 |
4 |
4 |
0.00 |
|
Kháng nấm azole |
<1 |
<1 |
0.01 |
<1 |
<1 |
0.00 |
|
Chuyên khoa bác sĩ kê thuốc |
|
|
|
|
|
|
|
Tim mạch |
54 |
60 |
0.10 |
57 |
57 |
0.00 |
|
Y học gia đình |
21 |
19 |
0.04 |
20 |
20 |
0.00 |
|
Nội khoa |
21 |
19 |
0.04 |
20 |
20 |
0.00 |
|
Khác |
13 |
13 |
0.01 |
13 |
13 |
0.00 |
SMD: standardized mean difference, độ lệch chuẩn trung bình
a: các yếu tố thêm vào phương pháp xác xuất nghịch đảo của hiệu chỉnh điều trị, sử dụng để hiệu chỉnh các biến số (bảng 2 trong phụ lục)
b: cỡ mẫu nhóm hiệu chỉnh được tính toán bằng tổng các xác suất nghịch đảo cố định của hiệu chỉnh điều trị từ mỗi bệnh nhân trong nhóm. Cỡ mẫu dân số hiệu chỉnh có thể khác biệt không đáng kể so với cỡ mẫu của dân số thật chưa được hiệu chỉnh.
c: điểm CHADS2 bao gồm suy tim sung huyết, tăng huyết áp, tuổi ≥ 75, đái tháo đường, đột quỵ, hoặc cơn thoáng thiếu máu não
d: điểm HASBLED bao gồm tăng huyết áp, bất thường chức năng gan hoặc thận, đột quỵ, tiền sử xuất huyết, INR không ổn định, tuổi ≥65, sử dụng kháng tiểu cầu hoặc nghiện rượu. bệnh nhân không điều trị vời warfarin nên không thực hiện xét nghiệm INR, vì vậy INR không đưa vào tính điểm
e: ngày dùng thuốc trùng với ngày bắt đầu dùng dabigatran hoặc rivaroxaban.
Bảng 2.Số lượng các biến số, sai biệt tỉ suất mới mắc được hiệu chỉnh, tỉ số nguy cơ được hiệu chỉnh và không hiệu chỉnh so sánh trên nhóm bệnh nhân rung nhĩ không do bệnh van tim sử dụng đầu tiên dabigatran và rivaroxaban, dùng phương pháp xác suất nghịch đảo của hiệu chỉnh điều trị a
|
|
Tỉ lệ mới mắc chưa hiệu chỉnh/1000 người-năm (số biến cố) |
Sai biệt tỉ lệ mới mắc hiệu chỉnh /1000 người năm (KTC 95%)b |
Tỉ số nguy cơ (KTC 95%) |
|||
|
Biến cố |
Dabigatran (n=52240) |
Rivaroxaban (n=66651) |
|
Chưa hiệu chỉnh |
Hiệu chỉnh |
P |
|
Chính |
||||||
|
Đột quỵ thuyên tắc huyết khối |
9.7 (150) |
7.7 (156) |
−1.8 (−3.8 đến 0.1) |
0.80 (0.64 – 1.00) |
0.81 (0.65 – 1.01) |
0.07 |
|
Xuất huyết não |
3.7 (58) |
5.8 (118) |
2.3 (0.9 đến 3.7) |
1.58 (1.15 – 2.16) |
1.65 (1.2 – 2.26) |
0.002 |
|
Xuất huyết ngoài sọ nặng |
26.6 (413) |
39.4 (796) |
13.0 (9.2 đến 16.7) |
1.47 (1.31 – 1.66) |
1.48 (1.32 – 1.67) |
< 0.001 |
|
Xuất huyết tiêu hóa |
23.3 (362) |
32.5 (656) |
9.4 (6.0 đến 12.8) |
1.39 (1.22 – 1.58) |
1.40 (1.23 – 1.59) |
< 0.001 |
|
Tử vong |
22.2 (346) |
24.7 (500) |
3.1 (-0.1 đến 6.3) |
1.12 (0.98 – 1.29) |
1.15 (1.00 đến 1.32) |
0.051 |
|
Phụ |
||||||
|
Xuất huyết ngoại sọ nhập viện |
39.2 (608) |
54 (1091) |
15.1 (10.7 đến 19.6) |
1.38 (1.25 – 1.52) |
1.39 (1.25 – 1.53) |
< 0.001 |
|
Nhồi máu cơ tim cấp |
12.9 (200) |
11.0 (223) |
-1.7 (-4.0 đến 0.6) |
0.86 (0.71 – 1.05) |
0.88 (0.72 – 1.06) |
0.18 |
a: dabigatran được xem là nhóm chuẩn
b : Sai biệt tỉ lệ mới mắc hiệu chỉnh = tỉ lệ rivaroxaban – tỉ lệ dabigatran.
Hình 1.Biểu đồ tỉ lệ mới mắc tích lũy Kaplan-meier được hiệu chỉnh của đột quỵ thuyên tắc huyết khối, xuất huyết não, xuất huyết tiêu hóa nặng và tử vong trên những bệnh nhân rung nhĩ không do bệnh van tim được dự phòng đột quỵ với dabigatran hoặc rivaroxaban.
Tài liệu tham khảo:
1.Atrial Fibrillation Investigators. Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation: analysis of pooled data from five randomized controlled trials. Arch Intern Med. 1994;154(13):1449-1457.
2. Aguilar MI, Hart R. Oral anticoagulants for preventing stroke in patients with non-valvular atrial fibrillation and no previous history of stroke or transient ischemic attacks. Cochrane Database Syst Rev. 2005;(3):CD001927.
3. Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med. 2007;146(12):857-867.
4. ReynoldsMW, Fahrbach K, Hauch O, et al. Warfarin anticoagulation and outcomes in patients with atrial fibrillation: a systematic review and metaanalysis. Chest. 2004;126(6):1938-1945.
5. Pradaxa [package insert]. Ridgefield, CT: Boehringer Ingelheim; 2012. http://www.accessdata.fda.gov/drugsatfda_docs/label/2012/022512s011lbl.pdf. Accessed October 2, 2015.
6. Xarelto [package insert]. Leverkusen, Germany: Janssen; 2011. http://www.xareltohcp.com/shared/product/xarelto/prescribing-information.pdf.
Accessed August 26, 2016.
7. Connolly SJ, Ezekowitz MD, Yusuf S, et al; RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361(12):1139-1151.
8. Patel MR, Mahaffey KW, Garg J, et al; ROCKET AF Investigators. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011;
365(10):883-891.
9. Lip GYH, Larsen TB, Skjøth F, Rasmussen LH. Indirect comparisons of new oral anticoagulant drugs for efficacy and safety when used for stroke
prevention in atrial fibrillation. J AmColl Cardiol. 2012;60(8):738-746.
10. Schneeweiss S, Gagne JJ, Patrick AR, Choudhry NK, Avorn J. Comparative efficacy and safety of new oral anticoagulants in patients with atrial
fibrillation. Circ Cardiovasc Qual Outcomes. 2012;5(4):480-486.
11. Go AS, Hylek EM, Phillips KA, et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke
prevention: the Anticoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA. 2001;285(18):2370-2375.
12. Benjamin EJ, Levy D, Vaziri SM, DAgostino RB, Belanger AJ,Wolf PA. Independent risk factors for atrial fibrillation in a population-based cohort: the Framingham Heart Study. JAMA. 1994;271(11):840-844.
13. Centers for Medicare & Medicaid Services. Medicare program—general information. https://www.cms.hhs.gov/MedicareGenInfo/. Accessed June 26, 2012.
14. Centers for Medicare & Medicaid Services. Prescription drug coverage—general information.https://www.cms.hhs.gov/PrescriptionDrugCovGenIn/. Accessed June 26, 2012.
15. RayWA. Evaluating medication effects outside of clinical trials: new-user designs. Am J Epidemiol. 2003;158(9):915-920.
16. Gage BF,Waterman AD, ShannonW, Boechler M, RichMW, Radford MJ. Validation of clinical classification schemes for predicting stroke: results
from the National Registry of Atrial Fibrillation. JAMA. 2001;285(22):2864-2870.
17. Pisters R, Lane DA, Nieuwlaat R, de Vos CB, Crijns HJ, Lip GY. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding
in patients with atrial fibrillation: the Euro Heart Survey. Chest. 2010;138(5):1093-1100.
18. Rosenbaum PR. Model-based direct adjustment. J AmStat Assoc. 1987;82:387-394.
19. Harder VS, Stuart EA, Anthony JC. Propensity score techniques and the assessment of measured covariate balance to test causal associations in
psychological research. Psychol Methods. 2010;15(3):234-249.
20. Xu S, Ross C, Raebel MA, Shetterly S, Blanchette C, Smith D. Use of stabilized inverse propensity scores as weights to directly estimate relative risk and its confidence intervals. Value Health. 2010;13(2):273-277.
21. Robins JM, Hernán MA, Brumback B. Marginal structural models and causal inference in epidemiology. Epidemiology. 2000;11(5):550-560.
22. Austin PC. An introduction to propensity score methods for reducing the effects of confounding in observational studies. Multivariate Behav Res. 2011;46(3):399-424.
23. Mamdani M, Sykora K, Li P, et al. Readers guide to critical appraisal of cohort studies: 2. Assessing potential for confounding. BMJ. 05;330(7497):
960-962.
24. Morgan SL, Todd JJ. A diagnostic routine for the detection of consequential heterogeneity of causal effects. Sociol Methodol. 2008;38:231-281.
25. Tirschwell DL, LongstrethWT Jr. Validating administrative data in stroke research. Stroke. 2002;33(10):2465-2470.
26. Roumie CL, Mitchel E, Gideon PS, Varas-Lorenzo C, Castellsague J, Griffin MR. Validation of ICD-9 codes with a high positive predictive value for incident strokes resulting in hospitalization using Medicaid health data. Pharmacoepidemiol Drug Saf. 2008;17(1):20-26.
27. Kokotailo RA, Hill MD. Coding of stroke and stroke risk factors using International Classification of Diseases, Revisions 9 and 10. Stroke. 2005;36
(8):1776-1781.
28. Cunningham A, Stein CM, Chung CP, Daugherty JR, SmalleyWE, RayWA. An automated database case definition for serious bleeding related to oral anticoagulant use. Pharmacoepidemiol Drug Saf. 2011;20(6):560-566.
29. Hylek EM, Evans-Molina C, Shea C, Henault LE, Regan S. Major hemorrhage and tolerability of warfarin in the first year of therapy among elderly
patients with atrial fibrillation. Circulation. 2007;115(21):2689-2696.
30. Wahl PM, Rodgers K, Schneeweiss S, et al. Validation of claims-based diagnostic and procedure codes for cardiovascular and gastrointestinal serious adverse events in a commercially-insured population. Pharmacoepidemiol Drug Saf. 2010;19(6):596-603.
31. Petersen LA,Wright S, Normand SL, Daley J. Positive predictive value of the diagnosis of acute myocardial infarction in an administrative database.
J Gen Intern Med. 1999;14(9):555-558.
32. Levy AR, Tamblyn RM, Fitchett D, McLeod PJ, Hanley JA. Coding accuracy of hospital discharge data for elderly survivors ofmyocardial infarction.
Can J Cardiol. 1999;15(11):1277-1282.
33. Austin PC, Daly PA, Tu JV. A multicenter study of the coding accuracy of hospital discharge administrative data for patients admitted to cardiac
care units in Ontario. Am Heart J. 2002;144(2):290-296.
34. Kiyota Y, Schneeweiss S, Glynn RJ, Cannuscio CC, Avorn J, Solomon DH. Accuracy of Medicare claims-based diagnosis of acutemyocardial infarction: estimating positive predictive value on the basis of review of hospital records. Am Heart J.2004;148(1):99-104.
35. Choma NN, Griffin MR, Huang RL, et al. An algorithm to identify incidentmyocardial infarction using Medicaid data. Pharmacoepidemiol Drug Saf.
2009;18(11):1064-1071.
36. Schulman S, Kearon C; Subcommittee on Control of Anticoagulation of the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non-surgical patients. J Thromb Haemost. 2005;3(4):692-694.
37. Hill ME, Rosenwaike I. The Social Security Administrations Death Master File: the completeness of death reporting at older ages. Soc Secur Bull. 2001-2002;64(1):45-51.
38. Graham DJ, Reichman ME,WerneckeM, et al. Cardiovascular, bleeding, and mortality risks in elderly Medicare patients treated with dabigatran or warfarin for nonvalvular atrial fibrillation. Circulation. 2015;131(2):157-164.
39. Lip GYH, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ; The Euro Heart Survey on Atrial Fibrillation. Refining clinical risk stratification for predicting
stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the Euro Heart Survey on Atrial Fibrillation. Chest. 2010;
137(2):263-272.
40. Fine JP, Gray RJ. A proportional hazards model for the subdistribution of a competing risk. J Am Stat Assoc. 1999;94:496-509.
41. Barnes GD, Lucas E, Alexander GC, Goldberger ZD. National trends in ambulatory oral anticoagulant use.AmJ Med. 2015;128(12):1300-5.e2.
42. SouthworthMR, Reichman ME, Unger EF. Dabigatran and postmarketing reports of bleeding. N Engl J Med. 2013;368(14):1272-1274.
43. Gorst-Rasmussen A, Lip GYH, Bjerregaard Larsen T. Rivaroxaban versus warfarin and dabigatran in atrial fibrillation: comparative effectiveness and safety in Danish routine care. Pharmacoepidemiol Drug Saf. 2016.
44. Cannon CP, Kohli P. Danger ahead: watch out for indirect comparisons! J AmColl Cardiol. 2012;60(8):747-748.
45. Buxton IO, Benet LZ. Pharmacokinetics: the dynamics of drug absorption, distribution, metabolism, and elimination. In: Brunton LL, Chabner BA, Knollmann BC, eds. Goodman & Gilman’s the Pharmacological Basis of Therapeutics. 12th ed. New York, NY:McGraw-Hill; 2011. http://accessmedicine.mhmedical.com/content.aspx?bookid=374&Sectionid=41266207. Accessed November 2, 2015.
46. Chang HY, Zhou M, TangW, Alexander GC, Singh S. Risk of gastrointestinal bleeding associated with oral anticoagulants: population based
retrospective cohort study. BMJ. 2015;350:h1585.
47. Hernandez I, Baik SH, Piñera A, Zhang Y. Risk of bleeding with dabigatran in atrial fibrillation. JAMA Intern Med. 2015;175(1):18-24.
48. Wang SV, Franklin JM, Glynn RJ, Schneeweiss S, EddingsW, Gagne JJ. Prediction of rates of thromboembolic and major bleeding outcomes
with dabigatran or warfarin among patients with atrial fibrillation: new initiator cohort study. BMJ.2016;353:i2607.
49. Abraham NS, Singh S, Alexander GC, et al. Comparative risk of gastrointestinal bleeding with dabigatran, rivaroxaban, and warfarin: population
based cohort study. BMJ. 2015;350:h1857. Research Original Investigation Dabigatran vs Rivaroxaban for Nonvalvular Atrial Fibrillation E10







