Mở đầu
TS. Phạm Hữu Văn
BV Nhân Dân 115
Mở đầu
Một số test thâm nhập và không thâm nhập cho phân tầng nguy cơ đột tử tim (SCD) đã được nghiên cứu. Phần lớn trong phạm vi bệnh tim thực thể như bệnh mạch vành, bệnh cơ tim và suy tim. Ngoại trừ phân xuất tống máu (LVEF), một số chỉ dấu SCD có thể có lợi ích trong thực hành lâm sàng. Các test như sự thay đổi luân phiên vi điên thế sóng T (MTWA) và và tín hiệu điện thế trung bình (SAECG) có giá trị dự báo âm tính cao ở các bệnh nhân có nhồi máu cơ tim (MI) hoặc bệnh cơ tim. Hạn chế lớn của các test này là thiếu giá trị dự báo dương mong muốn cho SCD.
Loạn nhịp thất ác tính như nhịp nhanh thất (VT) dai dẳng và rung thất (VF) phù hợp cho 2/3 SCD. Khởi đầu và duy trì loạn nhịp thất vào lại phụ thuộc vào khởi kích và nền cơ tim dễ bị tổn thương. Loạn nhịp thất được khởi đầu do ổ cũng được duy trì bằng vào lại giải phẫu hay chức năng trong quá trình VF. Để vào lại đễ xuất hiện, đòi hỏi tái cực bất thường ở các tổ chức và hoặc rối loạn dẫn truyền xung động. Điều này có thể được phát hiện khi bất thường tái cực và khử cực của tim bằng các test thâm nhập và không thâm nhập khác nhau. Bất thường tái cực như MTWA, QT dài và phân tán QT là những yếu tố dự báo của SCD. Bất thường khử cực lớn dự báo SCD là điện thể trễ (LP) trên SAECG.
Gần đây, người ta mô tả sự có mặt của fQRS trên 12 chuyển đạo ECG thông dụng như là một chỉ dấu khác của bất thường khử cực. Các tư liệu của các tác giả gợi ý fQRS thể hiện chậm trễ dẫn truyền gây ra do sẹo cơ tim ở các bệnh nhân có bệnh mạch vành (CAD). Tuy nhiên, fQRS không đặc hiệu cho CAD và cũng được ghi nhận ở các bệnh cơ tim khác như bệnh cơ tim và bệnh tim bẩm sinh. Gần đây, fQRS đã được định nghĩa như chỉ dấu của bệnh cơ tim hoặc dị sản thất phải gây loạn nhịp (ARVD/C) và hội chứng Brugada (BS). Mục đích của bài này là đề cập về vai trò tiềm tàng của fQRS trong cơ chế và phân tầng nguy cơ tử vong và SCD.
Chúng ta biết gì về fQRS?
Người ta xác định fQRS trên 12 chuyển đạo ECG thông dụng (phạm vi lọc 0.15 đến 100 Hz: AC filter 60 Hz, 25 mm/s, 10 mm/s) và gồm hình thái thay đổi của phức bộ QRS với có hoặc không có sóng Q. fQRS gồm sự hiện diện của sóng R thêm vào (R’) hoặc chẽ đôi ở chỗ đi xuống của sóng R hoặc sóng S, hoặc có mặt của > R’ (phân đoạn) ở 2 chuyền đạo liên tiếp, tương ứng khu vực động mạch vành lớn (hình 1).
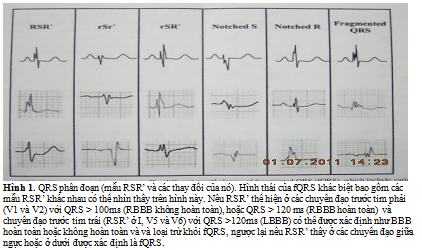
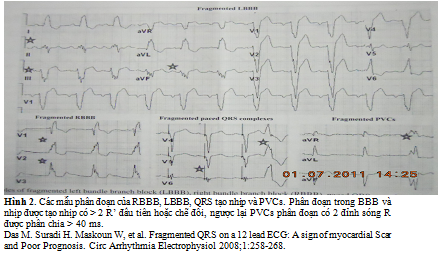
Người ta loại các dạng bloc nhánh điển hình (BBB) (QRS ≥ 120 ms) và BBB không điển hình ra ngoài khái niệm này. Sau này khái niệm fQRS đã được mở rộng khi có mặt của phức hợp QRS rộng (> 120 ms), như BBB, PVCs và QRS tạo nhịp (pQRS). Để xác định fQRS trong các phúc hợp QRS rộng, người ta thêm vào tiêu chuẩn > 2 sự chẽ đôi ở sóng R hoặc sóng S, do BBBs đã có hai chẽ đôi hoặc các đỉnh (peaks) biểu hiện ở hai chuyển đạo liên tục (hình 2). Tương tự, bề rộng các phức hợp QRS do tạo nhịp (pQRS) phân đoạn và PVCs phân đoạn được xác định bằng sự hiện diện > 2 đỉnh hoặc chẽ đôi có ở 2 chuyển đạo liên tục. Thêm vào, PVC phân đoạn cũng bao gồm PVCs với chỉ 2 chẽ đôi ở sóng R nhưng > 40 ms một bên và có ở 2 chuyển đạo liên tục.
fQRS: chỉ dấu của sẹo cơ tim trong CAD
Các nghiên cứu đã chỉ ra fQRS trên 12 chuyển đạo ECG đã dự báo sẹo cơ tim ở các bệnh nhân có bệnh động mạch vành (CAD) hoặc nghi ngờ CAD. Sự hiện diện của fQRS ở ≥ chuyển đạo trước liên tục (V1 đến V5) đã dự báo sẹo cơ tim ở các đoạn cơ tim trước hoặc ở các khu vực trước trái xuống. Sự hiên diện của fQRS ở ≥ 2 chuyển đạo bên liên tục (I, aVL, V6) dự báo sẹo cơ tim ở đoạn cơ tim bên hoặc sẹo cơ tim khu vực mũ (circumflex). Tương tự, sự có mặt của fQRS ≥ 2 chuyển đạo dưới kế tiếp (II, III và aVF) dự báo sẹo cơ tim ở đoạn cơ tim dưới hoặc ở khu vực động mạch vành phải. Trong nhóm 479 bệnh nhân (tuổi 58,2 ± 13,2 tuổi; 283 nữ) được sử dụng các test stress hạt nhân, các sóng Q đã có ở 15% bệnh nhân, fQRS đã có ở 35% bệnh nhân và fQRS và hoặc sóng Q có ở 42% bệnh nhân. Độ nhạy cảm, độ đặc hiệu và giá trị dự báo âm cho sẹo cơ tim là 86%, 89% và 93%, theo thứ tự, cho fQRS , và 91%, 89% và 94%, theo thứ tự, cho sóng Q và hoặc fQRS.
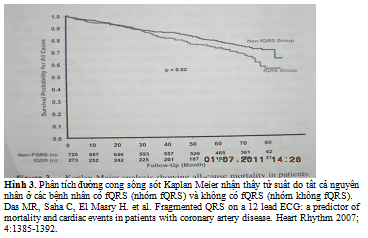
Tiếp theo, trong nghiên cứu 998 bệnh nhân để lượng giá cho CAD, đã nhận thấy tử suất do tất cả nguyên nhân (34% đối lại 26%) và biến cố tim (MI, tử vong do tim, cần cho tái tuần hoàn) tần số (50% đối lại 28%) cao hơn một cách có ý nghĩa ở các bệnh nhân có fQRS so với các bệnh nhân không có fQRS, trong quá trình theo dõi trung bình 57 tháng. Phân tích sống sót Kaplan – Meier chỉ ra sự sống sót thoát khỏi các biến cố thấp hơn một cách có ý nghĩa trong các biến cố tim (P < 0.001) và tử suất do tất cả nguyên nhân (P = 0.02) (hinh 3). fQRS không dự báo tử suất một cách độc lập. Tuy nhiên, nghiên cứu mở đầu chỉ ra fQRS cũng dự báo các biến cố loạn nhịp ở các bệnh nhân CAD nhận được ICD trong phòng ngừa tiên phát SCD. Hơn nữa, Pietrasik và cộng sự nhận thấy trong số các bệnh nhân bệnh sử MI có sóng Q, fQRS đã dự báo nguy cơ cao hơn 2 lần (HR có điều chỉnh: 2.68, P = 0.004) của các biến cố tim tái phát (tử vong do tim, MI không nguy hiểm so với người không có fQRS và các sóng Q cố định)
Trong nghiên cứu khác ở 879 bệnh nhân có phức hợp QRS rộng, QRS rộng được phân đoạn (f-wQRS) đã thể hiện sẹo cơ tim. Độ nhạy cảm, đặc hiệu, giá trị dự báo dương và giá trị dự báo âm của f-wQRS đối với sẹo cơ tim là 87%, 93%, 92% và 88% theo thứ tự. Độ nhạy cảm và đặc hiệu cho sẹo cơ tim được chẩn đoán là 89% và 94%, 81% và 88%, và 90% và 96% cho f-BBB, f-PVC, và f-pQRS, theo thứ tự, f-wQRS được kết hợp với tử suất sau điều chỉnh theo tuổi, LVEF và tiều đường (P = 0,017).
fQRS: Chỉ dấu các biến cố loạn nhịp trong bệnh cơ tim không do thiều máu cục bộ
Tỷ lệ phân đoạn QRS còn chưa được nghiên cứu đầy đủ ở các bệnh nhân bệnh cơ tim không do thiếu máu. Tuy nhiên, đây là một nhận định chung ở 12 chuyển đạo ECG ở các bệnh nhân nhận được ICD cho phòng ngừa tiên phát và thứ phát. Ở các bệnh nhân có bệnh cơ tim không do thiếu máu, sự phân đoạn QRS đã được nghi nhận trong quá trình phân tích các sóng gợn lăn tăn ECG (wavelet ECG) từ 6 chuyển đạo trước tim trái đơn cực, sử dụng bộ khuếch đại có độ chính xác cao (highprecision). Khi so sánh với các người đối chứng không có bệnh tim, các sóng gợn lăn tăn như vậy đã dự báo tần số PVCs và SCD. Người ta đã nghiên cứu các biến cố loạn nhịp và tử suất do tất cả nguyên nhân ở 105 bệnh nhân (tuổi 58,7 ± 15,5); nam, 70) có bệnh cơ tim không do thiếu máu nhận được ICD để dự phòng tiên phát và thứ phát. Nhóm fQRS nhận ICD trị liệu (trị liệu chống nhịp nhanh và hoặc shock ICD) khi so sánh với chỉ 5 (10%) bệnh nhân ở nhóm không có fQRS (P < 0.001). Tiêu chí hỗn hợp của trị liệu ICD và tử suất cũng cao hơn một cách có ý nghĩa ở nhóm có fQRS so với nhóm không có fQRS (70% đối lại 17,6%, P < 0.001). Tử suất là 24% ở nhóm fQRS và 14% ở nhóm không fQRS (P = 0.18). Sống sót do thoát khỏi biến cố giảm đi một cách có ý nghĩa ở nhóm fQRS đối lại với nhóm không fQRS. Các biến cố do loạn nhịp điều trị bằng shock ICD được hiểu thông thường khi biến cố SCD được cứu thoát. Tuy nhiên, các ICD cần được phóng ra các shock phù hợp suất hiện nhiều hơn so với SCD ở các bệnh nhân có bệnh cơ tim không do thiếu máu. Điều này gợi ý các cơn VT tạm thời thường bị ngừng tự phát ở các bệnh nhân như vậy.
fQRS: Chỉ dấu cho cho dị sản thất phải gây loạn nhịp (ARVD/C)
Mới đây, fQRS đã được Peter và cộng sự nhận biết như chỉ dấu của ARVD/C. Người ta đã nghiên cứu giá trị của phân đoạn QRS ở 12 chuyển đạo điện tâm đồ chuẩn ở 360 bệnh nhân có ARVD/C (176 nam, tuổi trung bình 47,3 ± 13,7) và so sánh với sự hiện diện của nó với sự phát hiện các sóng epsilon ở các chuyển đạo trước tim phải được khếch đại cao ngoại biên cải biến ở nhóm nhỏ 207 bệnh nhân. Trong nghiên cứu này, 52 người không bị ảnh hưởng do phenotype và genotype từ việc tầm soát gia đình một cách hệ thống ở 10 gia đình có đột biến plakophilin-2 và desmoplakin đóng vai trò như nhóm chứng. fQRS được xác định ở 85% các bệnh nhân và 4% đối chứng, ngược lại các sóng epsilon ở các chuyển đạo trước tim phải được khếch đại cao và ngoại biên được cải biên có thể được xác định ở 77% các bệnh nhân. Các dấu hiệu khác ECG của ARVD/C bao gồm QRS kéo dài, sườn lên của sóng S kéo dài, chậm trễ hoạt động của đoạn cuối và điện thể epsilon. Đại đa số các dấu hiệu này được kết hợp trong fQRS điển hình. fQRS sẽ hầu như chắc chắn làm đơn giản chẩn đoán ECG của ARVD/C ở các bệnh nhân có khả năng bị bệnh cao.
fQRS và các bất thường khử cực khác trong hội chứng Brugada
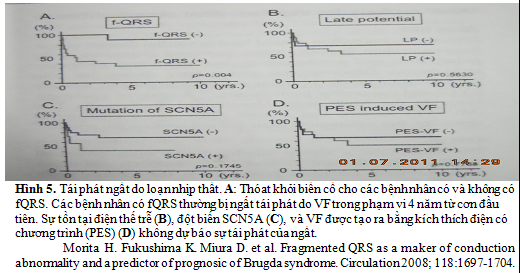
Mới đây, Morita và cộng sự đã nhận thấy 43% có fQRS ở 115 bệnh nhân bị BS (13 được cứu sống từ VF, 28 bị ngất và 74 không có triệu chứng) (hình 4).
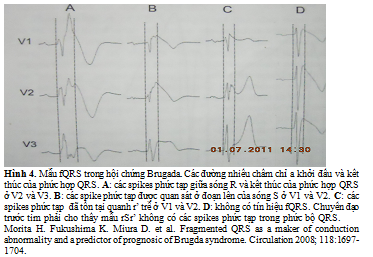
Tỷ lệ của fQRS là cao hơn một cách có ý nghĩa trong nhóm VF khi so sánh với ngất hoặc không có triệu chứng (tỷ lệ fQRS: VF 85%, ngất 50%, và không triệu chứng 34%, P < 0.01). Thú vị hơn, khi đột biến gene SCN5A suất hiện thường nhiều hơn ở các bệnh nhân fQRS (35%) so với trong nhóm không có fQRS (5%). Ở các bệnh nhân có ngất hoặc VF, chỉ 6% bệnh nhân không có fQRS trải qua VF trong 43 tháng theo dõi, ngược lại 58% các bệnh nhân có fQRS có ngất tái phát gây ra do VF (P < 0.004). Phân tích sống sót Kaplan – Meier đã nhận thấy sống do thoát khỏi biến cố (VF) giảm đi một cánh có ý nghĩa trong nhóm fQRS khi so sánh với nhóm không có fQRS (hình 5). Tuy nhiên, sự tồn tại của LP, đột biến SCN5A và VF tạo ra do kích thích điện có chương trình, không dự báo được ngất tái phát.
Các bất thường khử cực khác (bất thường SAECG cũng như RBBB hoàn toàn hoặc không hoàn toàn) trong BS đã được biết rõ. Sự tồn tại LP trong SAECG gợi ý sự có mặt của khu vực nền khử cực trễ hơn so với phần lớn thất và do đó là một chỉ dấu bất thường dẫn truyền cơ tim. Điện thế trễ (LPs) được thông báo đã xuất hiện thường xuyên ở các bệnh nhân có ECG type Brugada, nhưng VF cũng có thể xuất hiện ở các bệnh nhân không có LPs. Bản đồ điện đồ (mapping) nội tâm mạc của thất phải các bệnh nhân có BS phát hiện tỷ lệ cao hơn sự phân đoạn nôi buồng tim giống như ghi nhận ở các bệnh nhân bị CAD trong quá trình mapping nội mạc thất trái. Mapping nội mạc cũng cho biết các bệnh nhân có BS type I có thời gian hoạt động thất phải dài hơn và khoảng QRS (cả hai chỉ số này đều là bất thường khử cực) so sánh với các bệnh nhân type 2 hội chứng BS và các người nhóm chứng trong nghiên cứu. Bất thường tái cực nội mạc ở các bệnh nhân này được phát hiện bằng mapping điện giải phẫu (electroanatomical mapping) dựa trên cách nhận ra khoảng thời gian phục hồi hoạt động trung bình có điều chỉnh theo tần số tim khi đo khoảng thời gian điện thể hoạt động thấp hơn một cách có ý nghĩa so với các người nhóm chứng. Trong mẫu BS type I, phức hợp phân đoạn tăng lên, hoạt động bị làm chậm và sư phục hồi ngắn lại chỉ ra dẫn truyền xung động chậm. lại nhưng phục hồi nhanh. Điều này có thể là bổ xung quan trọng vào mẫu ECG đặc biệt và nguồn gốc loạn nhịp trong BS.
Các chỉ dấu khác cho các bất thường khử cực
Dẫn truyền kéo dài gây ra do bệnh cơ tim hoặc bệnh hệ thống dẫn truyền tạo ra sự phân tán tăng lên của khử cực và tái cực, do đó thúc đẩy loạn nhịp thất. Các nghiên cứu quan sát đã nhận thấy khoảng thời gian QRS rộng dự báo tử suất tim ở các bệnh nhân có LVEF thấp và suy tim. Nghiên cứu nhóm nhỏ quần thể trong nghiên cứu MUSTT nhận thấy QRS rộng là yếu tố dự báo tử suất, nhưng các nghiên cứu tiếp theo đã không khẳng định kết quả này.
Điện tâm đồ tín hiệu trung bình (SAECG)
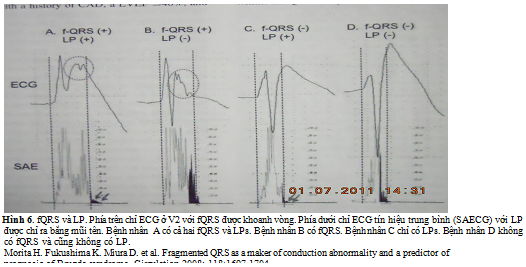
SAECG được khếch đại cao và ECG được tiến triển các tín hiệu (signal-processed ECG). Không giống ECG 12 chuyển đạo, SAECGs có thể phát hiện các điện thể điện học mức độ microvolt ở kết thúc của phức bộ QRS, được biết như là LPs. Điều này tăng lên từ khu vực sẹo cơ tim, có thể là môi trường cho loạn nhịp thất ác tính vào lại. khoảng thời gian bất thường của phức bộ QRS trên SAECG hoặc sự hiện diện của LP đã được sử dụng cho phân tần nguy cơ cho SCD hoặc biến cố loạn nhịp. Độ nhạy cảm của SAECG bất thường đã được thông báo thay đổi từ 30 đến 76% và độ đặc hiệu từ 63% đến 96%. Tần số tương đối thấp của các biến cố, do đó, dẫn đến giá trị dự báo dương thấp cho SCD, phạm vi từ 7% đén 40%. Giá trị dự báo âm là cao (> 95%); tuy nhiên, điều này cũng được liên quan đến tần số biến cố thấp trong quần thể nghiên cứu thấp. Trong MUSTT là một trong những nghiên cứu lớn nhất lợi ích SAECG như một phân tầng nguy cơ cho tử vong loạn nhịp, tử vong tim và tử suất do tất cả các nguyên nhân, các bệnh nhân được đăng ký với bệnh sử CAD, LVEF ≤ 40%, VT tạm thời không triệu chứng. Trong nghiên cứu này các bệnh nhân có SAECG bất thường (khoảng thời gian QRS được lọc > 114 ms) có tần số 5 năm tử vong do loạn nhịp cao hơn có ý nghĩa (28% đối lại 17%, P = 0.01) và tử suất do tất cả các nguyên nhân khác nhau (43% đối lại 35%, P = 0.01) so với các bệnh nhân có SAECG bình thường. Bệnh cơ tim là chưa chắc chắn. SAECG bất thường thể hiện khử cực thất kế tiếp không thể được phát hiện trên ECG thông dụng 12 chuyển đạo. Tuy nhiên, nó không chắc chắn chỉ ra sự chậm trễ dẫn truyền nội thất hoặc các mẫu khử cực đã được sửa đổi, nó xuất hiện trong quá trình sớm và giữa QRS có thể không kéo dài vượt ra ngoài giới hạn điểm J, nó ghi nhận kết thúc của khử cực trên 12 chuyển đạo ECG. Người ta tin rằng khử cực thất bị phá vỡ tổ chức phụ thuộc vào mẫu không gian và thời gian của dẫn truyền xung động trong nền bệnh lý của thất, do đó sự phân đoạn các sóng QRS có thể xuất hiện sớm, giữa và các pha trễ của sóng QRS. Morita và cộng sự đã chỉ rõ fQRS có thể hoặc không cùng tồn tại với LP ở các bệnh nhân có BS (hình 6).
Phân đoạn trong QRS tăng lên trên ghi điện từ tim (magnetocardiography:MCG)
MCG đã được sử dụng cho phân tầng nguy cơ ở các bệnh nhân có CAD. Korhonen và cộng sự nhận thấy điểm phân đoạn nối QRS tăng lên (FRA) trong MCG được kết hợp với loạn nhịp thất dai dẳng ở các bệnh nhân sau nhồi máu cơ tim, gợi ý mối liên hệ của nó với nền loạn nhịp. FRA của các phức bộ QRS điền từ tim được vi tính bằng tính toán số cực tối đa và cường độ của chúng trong phạm vi phức bộ QRS của 7 kênh đồng trục được sử dụng để ghi. FRA của mỗi bệnh nhân được bắt nguồn bằng trung bình số tất cả các kênh được ghi. MCG được được đăng ký và FRA được vi tính hóa ở 158 bệnh nhân có bệnh sử MI cấp và giảm LVEF vừa phải. Trong quá trình theo dõi 50 ± 15 tháng, 32% (20%) bệnh nhân tử vong và 18 (11%) có biến cố loạn nhịp. Cả hai tần số biến cố loạn nhịp và tử suất do tất cả nguyên nhân cao hơn một cách có ý nghĩa ở các bệnh nhân có FRA tăng lên (P < 0,001 cho cả hai). Trong nghiên cứu tương tự, khoảng thời gian QRS được tăng lên ở ECG đã dự báo tử suất do tất cả nguyên nhân (P <0.05) nhưng không phải biến cố loạn nhịp. Trong phân tích đa biến, FRA là yếu tố dự báo độc lập của cả hai biến cố loạn nhịp và tử suất toàn bộ do các nguyên nhân. Sự hiện diện của FRA tăng lên với LVEF < 30% được kết hợp với độ chính xác dự báo dương và âm của 50% và 91% cho các biến cố loạn nhịp. Các nhà nghiên cứu đã gợi ý phân tích phân đoạn nội QRS bằng MCG có thể tham gia vào hướng dẫn điều trị bệnh nhân sau nhồi máu. Điều này có khả năng phân đoạn nội QRS có thể biểu hiện bất thường khử cực tương tự như fQRS trên 12 chuyển đạo ECG thông dụng.
Cơ chế của fQRS: Nó có thể là chỉ dấu chính của sẹo cơ tim hay cũng là hiện tượng sinh lý ?
Cơ chế của phân đoạn của phức hợp QRS trên 12 chuyển đạo ECG thông dụng được giải thích bằng hoạt động không đồng nhất của các thất do sẹo cơ tim và hoặc thiếu máu cục bộ. Các công bố sớm hơn đã xác định chẽ đôi của sóng QRS sau MI như là bloc dẫn truyền quanh nhồi máu (peri-infarction), điều này cũng có thể được xác định như fQRS. Flowers và cộng sự đã nhận thấy phạm vi của LPs trên SAECG ở các bệnh nhân có bloc dẫn truyền quanh nhồi máu đã vượt quá điều được xác định ở các bệnh khân không có bloc quanh nhồi máu (P< 0.0001). Có tỷ lệ cao hơn có ý nghĩa của các loạn nhịp thất dai dẳng và SCD ở các bệnh nhân có bloc quanh nhồi máu trên ECG bề mặt.
Phân đoạn phức hợp QRS cũng chỉ ra sự kết hợp với seo cơ tim có từ lâu trong các nghiên cứu nhỏ và trên mô hình vi tính (27). Khái niệm này cũng được ủng hộ bằng các nghiên cứu phân tích quang phổ của điện tâm đồ tần số cao đã phát hiện các nốt chẽ đôi tăng lên và hoặc líu nhíu (slurring) trên điềm đồ sau tổn thương cơ tim. Thêm vào đó, ghi băng rộng (wide-band) ở các bệnh nhân CAD phát hiện nhiều nôt chẽ đôi trên các sóng R và líu nhíu ở sóng S ở các bệnh nhân này với các sẹo cơ tim. Cơ chế có thể của phân đoạn được ủng hộ bằng tử thiết (autopsy) các bệnh nhân có MI và phình thất trái được khẳng định sự có mặt của hoại tử cơ tim có ý nghĩa, với “các đảo” (islands) của tổ chức cơ tim còn sống có rải rác nhiều tổ chức sợi. Các đảo cơ tim thiếu máu cục bộ mạn tính được biểu hiện hoạt động chậm như hậu quả của tốc độ đột biến điện thế hoạt động bị suy giảm và khử cực một phần và phù hợp có khả năng cho hoạt động thất trái không đồng nhất. Số lượng, phân bố và mô hình của sẹo phụ thuộc vào trạng thái bệnh. Ví dụ, sẹo trong CAD thường dưới nội mạc hoặc xuyên thành ở trong sự phân bố của động mạch vành bị tắc, ngược lại sẹo ở các bệnh nhân bệnh cơ tim không do thiếu máu là lốm đốm (patchy) và dưới thượng tâm mạc hoặc giữa cơ tim. Do đó, hình thái khác biệt của fQRS được tạo ra do sự thay đổi của vector QRS trong quá trình khử cực trong cả quanh các khu vực được tạo sẹo hoặc cơ tim thiều máu cục bộ, phụ thuộc vào phạm vi của chúng và khu vực ở thất. Mẫu dẫn truyền được thay đổi đưa đến dẫn truyền chậm ở các khu vực quanh sẹo cơ tim, nó có thể thúc đẩy loạn nhịp thất ác tính vào lại. Các biến cố loạn nhịp tăng lên và tử suất kết hợp với fQRS phản ảnh bệnh cơ tim cơ bản có ý nghĩa với nền cho loạn nhịp.
Morita và cộng sự đã chỉ ra fQRS là chỉ dấu của bất thường dẫn truyền trong cả không có bệnh tim thực thể sử dụng mô hình tổ chức thất phải loài chó đồng nhất BS. Trong mô hình này, chậm trễ trong hoạt động ở thượng tâm mạc đã tái tạo ra (reproduced) fQRS tương tự như trong điện tâm đồ xuyên thành. Bằng sự mapping tối ưu của điện thế hoạt động đa vị trí, đoạn ST chênh lên do pha 1 lớn chẽ đôi của điện thế hoạt động ở thượng tâm mạc và chậm trễ hoạt động thượng tâm mạc được tái tạo ra fQRS trong ECG xuyên thành. Dòng Na+ bị giảm đi trong BS không chỉ đào sâu xuông (deepen) pha 1 chẽ đôi của điện thế hoạt động (AP), mà còn làm chậm đi tốc độ dẫn truyền và giảm đi yếu tố an toàn của dẫn truyền, dẫn đến các bất thường dẫn truyền (với chậm dẫn truyền trong khu vực hoặc bloc dẫn truyền). Mặc dù, chậm dẫn truyền khu vực có thể được gây ra do sơ hóa cơ tim trong BS, các thay đổi chức năng (dynamic) và tự phát (spontaneous) trong các sóng fQRS gợi biến đổi chức năng dẫn truyền hơn so với cơ tim bị sẹo hóa cố định, chẳng hạn gây ra bằng hoạt động thần kinh tự động, tuổi tác, nhiệt độ hoặc tần số tim, có thể cũng gây các phân đoạn như vậy. Điều đó cũng có khả năng khử cực thay đổi có thể ảnh hưởng dến tái cực của cơ tim. Các nhà nghiên cứu đã kết luận fQRS biểu hiện nền cho VF tự phát trong BS và đã dự báo bệnh nhân có nguy cơ cao cho ngất. Trong nghiên cứu này, sự hiện diện của LPs không dự báo sự tái phát của ngất. Ngược lại, sự phân đoạn của QRS trên 12 chuyển đạo thông dụng đã dự báo sự tái phát và gợi ý sự có mặt của nền gây loạn nhịp có nhiều khu vực chậm dẫn truyền trong tổ chức tương đối lớn cơ tim. Do đó, fQRS có thể biểu hiện khu vực bất thường sinh lý hay bệnh lý tương đối lớn hơn của cơ tim có nền cho VF tự phát và nguy cơ cao cho tử vong và SCD ở các bệnh nhân có bệnh tim thực thể và BS.
Các hạn chế của fQRS (limitations of fQRS)
fQRS trên 12 chuyển đạo ECG thông dụng đổi hỏi trạng thái qua bộ lọc thấp tối ưu (optimal low-pass filter) (100 hoặc 150 Hz). Sự phân đoạn có thể bị nhầm với trạng thái lọc ở 40 hoặc 60 Hz. Ngoài sự chẽ đôi, líu díu của fQRS có thể biểu hiện seo cơ tim; tuy nhiên xác định biểu hiện của fQRS đang là định tính, nó không thể được kết hợp chặt chẽ. Xác định định lượng của fQRS với sự phát triển của phần mền chuyên biệt đang được thực hiện: nó được nhấn mạnh các nhận định fQRS không đặc hiệu và chỉ nên được làm sáng tỏ trong sự hiện diện của bằng chứng lâm sàng phù hợp của sẹo cơ tim như trong CAD hoặc các bất thường điện học tiên phát của khử cực.
Các hướng tương lai
Hiểu biết cơ chế của SCD cần phối hợp các nỗi lực trong di truyền, khoa học phân tử, nghiên cứu tịch tiến và các nghiên cứu lâm sàng. Nó sẽ đòi hỏi nghiên cứu kết hợp chặt chẽ lâm sàng và tịnh tiến tập trụng vào cơ chế của fQRS ( bất thường bệnh học đối lại với sinh ly của dẫn truyền hay cả hai). Ngoài LVEF thấp, các test không thâm nhập khác cho phân tầng nguy cơ đột tử có giá trị dự báo dương thấp. fQRS là tín hiệu ECG đơn giản, rẻ tiền và có khả năng sẵn, các nhà lâm sàng có thể làm sáng tỏ sớm. Các nhà nghiên cứu có thể nhận thấy vai trò tiềm năng của fQRS trong cơ chế rối loạn nhịp. fQRS có thể có giá trị trong xác định nguy cơ SCD và hướng dẫn lựa chọn cho việc điều trị bằng dụng cụ ở các bệnh nhân có bệnh tim thực thể và BS. Do đó, lợi ích của nó trong phân tầng SCD cần được khám phá tiếp theo. Nó có khả năng có giá trị dự báo của fQRS (chỉ dấu của bất thường khử cực) cho SCD có thể tăng lên xa hơn nữa bằng sự kết hợp chỉ dấu các bất thường tái cực như MTWA.
Tài liệu tham khảo
1. Zapes DP. Wellens HJ. Sudden cardiac death. Circulation 1998; 98: 2334-2351.
2. Hikuri HV, Castellanos A, Myerburg RJ. Sudden death due to cardiac arrhythmias. N Engl J Med 2001; 345: 1473-1482.
3. Das MK, Khan B, Jacob S, et al. Significance of a fragmented QRS complex versus a Q wave in patients with cronary artery disease. Circulation 2pp6: 113: 2495-2501.
4. Peters S, Trummel M, Kochler B. QRS fragmention in standard ECG as a diagnostic marker of arrhythmogenic right ventricular dysplasia-cardiomyopathy. Heart Rhythm 2008: 5: 1417-1421.
5. Morita H, Fukushima K, Miura D, et al. Fragmented QRS as a marler of conduction abnormality and a predictor of prognosis of Brugada syndrome. Circulation 2008; 118:1697-1704.
6. Das M, Suradi H, Maskoun W, et al. Fragmended QRS on a 12 lead ECG: a Sign of Myocardial Scar and Poor prognosis. Circ Arrhythmia Electrophysiol 2008: I: 258-268.
7. Das MK, Saha C, EL Masry H, etal. Fragmented QRS on a 12 lead ECG: a predictor of mortality and cardiac events in patients with coronary artery disease. Heart Rhythm 2007; 4: 1385-1392.
8. Maskoun W, Suradi H, Maheenhiran J, et al, Fragmented QRS complezes on a 12 lead predict arrhythmic events in patients with ischemic cardiomyopathy who receive an ICD for primary prophylaxis. Heart Rhythm 2007; 4: S211-212.
9. Pietrasik G, Goldenberg I, Zdzienicka J, et al. Prognostic significance of fragmented QRS complex for predicting the risk of recurrent cardiac events in patients with Q wave







