6. Thuốc ức chế men alpha-glucosidase
Thuốc ức chế men α-glucosidase không được khuyến cáo trong điều trị đái tháo đường típ 2 trong tuyên bố gần đây của ADA-EASD [16], có lẽ phần lớn do hiệu quả giảm đường huyết kém hơn và tính dung nạp ở đường tiêu hóa kém trong đối tượng người da trắng.
Andre´ J Scheen
University of Lie`ge, Division of Diabetes, Nutrition and Metabolic Disorders, Division of ClinicalPharmacology, Department of Medicine, Lie`ge, Belgium
Biên dịch: BS Tạ Bình Minh
Khoa Nội Tiết – BV Chợ rẫy TP.HCM
6. Thuốc ức chế men alpha-glucosidase
Thuốc ức chế men α-glucosidase không được khuyến cáo trong điều trị đái tháo đường típ 2 trong tuyên bố gần đây của ADA-EASD [16], có lẽ phần lớn do hiệu quả giảm đường huyết kém hơn và tính dung nạp ở đường tiêu hóa kém trong đối tượng người da trắng. Tuy nhiên, thuốc rất thông dụng ở các nước Châu Á. Có nhiều hợp chất thuộc nhóm dược tính này nhưng dữ liệu hiện có về thuốc trên bệnh nhân BTM khá ít [13]. Do các đặc tính dược động học, không cần chỉnh liều thuốc ở bệnh nhân suy thận mặc dù không có khuyến cáo sử dụng ở bệnh nhân BTM mức độ trung bình đến nặng vì không có số liệu [41].
6.1 Acarbose
Acarbose tác dụng khu trú trong đường tiêu hóa và đặc trưng bằng tính khả dụng sinh học toàn thân thấp [92]. Mặc dù < 2% liều acarbose đường uống có hoạt ính, bệnh nhân suy thận nặng (CLCR < 25 ml/phút) có nồng đồ đỉnh acarbose huyết tương tăng khoảng năm lần và giá trị AUC tăng gấp 6 lần so với người có chức năng thận bình thường [13]. Do không có các thử nghiệm lâm sàng lâu dài ở bệnh nhân đái tháo đường với rối loạn chức năng thận đáng kể, điều trị đái tháo đường típ 2 bằng acarbose trên nhóm bệnh nhân này không được khuyến cáo [2].
6.2 Miglitol
Miglitol được hấp thu toàn thân nhưng không bị chuyển hóa và nhanh chóng đào thải qua thận ở dạng không thay đổi [93]. Bệnh nhân có CLCR < 25 ml/phút uống miglitol 25 mg ba lần mỗi ngày có tăng gấp đôi nồng độ miglitol huyết tương so với nhóm có CLCR > 60 ml/phút [13]. Không dễ điều chỉnh liều để khắc phục tình trạng tăng nồng độ trong huyết tương do miglitol hoạt động chủ yếu ở ruột. Điều trị miglitol ở bệnh nhân CLCR < 25 ml/phút không được khuyến cáo do độ an toàn của thuốc trên đối tượng này chưa được khảo sát [13].
6.3 Voglibose
Voglibose là một thuốc ức chế α-glucosidase chỉ được lưu hành ở Nhật Bản. Thuốc không bài tiết ở thận [13]. Hai nghiên cứu cho thấy thuốc có thể sử dụng an toàn ở bệnh nhân đái tháo đường có chạy thận khi phối hợp với pioglitazone hoặc mitiglinide [94, 95].
7. Thiazolidinediones
Các nghiên cứu thực nghiệm đánh giả hiệu quả tiềm năng của thuốc đồng vận thụ thể PPARγ (TZD: pioglitazone, rosiglitazone) trên chức năng thận đã được xem xét. Trong bài báo này, hiệu quả, tính dung nạp, và độ an toàn của sử dụng TZD trên bệnh nhân có mức độ suy thận khác nhau, trên bệnh nhân chạy thận và bệnh nhân đái tháo đường đã ghép thận được xem xét lại [96]. Các dữ liệu từ nhiều nghiên cứu trên người và động vật củng cố việc TZD làm giảm tiết albumin niệu và có thể phòng ngừa phát triển tổn thương thận [97]. Trên phương diện dược động học, TZD được chuyển hóa ở gan và không bài tiết qua thận. Do đó không cần chỉnh liều ở bệnh nhân BTM. Tuy nhiên, độ an toàn của TZD được đặt ra và một số quan tâm này có cơ sở trong nhóm dân số đái tháo đường BTM [98]. Nguy cơ ứ dịch và suy tim sung huyết – một biến cố bất lợi được biết nhiều liên quan đến điều trị TZD – có thể là một vấn đề, đặc biệt ở nhóm dân số dễ bị tổn thương có BTM. Dữ kiện tiền lâm sàng và nghiên cứu thí điểm (pilot) cho thấy ít nhất một phần tác dụng ứ dịch là do tác động trực tiếp của TZD trên sự tái hấp thu muối ở ống góp tủy thận. Cơ chế này nhạy với thuốc lợi tiểu do cùng vị trí tác dụng (spironolactone, amiloride và hydrochlorothiazide) nhưng hiệu quả của các thuốc lợi tiểu còn hạn chế và/hoặc tính an toàn chưa rõ ràng ở bệnh nhân BTM [99]. Hơn nữa, TZD có thể tăng suất độ của gãy xương [100], một biến chứng vốn đã thường thấy trên bệnh nhân BTM độc lập với điều trị bằng TZD do thiếu hụt hoạt hóa Vitamin D và loạn dưỡng xương do thận. Cuối cùng, độ an toàn trên tim mạch của TZD đặc biệt là rosiglitazone đang được đặt ra [98] trong khi bệnh nhân đái tháo đường típ 2 có BTM được biết là có nguy cơ biến cố tim mạch cao hơn. Các kết quả trái ngược nhau đã được báo cáo về tử suất của bệnh nhân đái tháo đường có BTGĐC điều trị bằng lọc thận và sử dụng TZD, bao gồm tăng tử suất [101] lẫn tăng tỷ lệ sống còn [102]. Do đó, mặc dù có đặc tính dược động học ưu thế, TZD dường như không phải là thuốc được lựa chọn ở bệnh nhân đái tháo đường típ 2 có BTM. Tuy nhiên, một nghiên cứu nhỏ cho thấy TZD an toàn và hiệu quả đối với bệnh nhân ngoại trú đang lọc thận, thậm chí ở một số ít trường hợp suy tim [103].
7.1 Pioglitazone
Do pioglitazone và chất chuyển hóa có hoạt tính của nó được bài tiết chủ yếu qua gan nên các đặc tính dược động học này thích hợp cho bệnh nhân có BTM [104]. Những người khỏe mạnh có chức năng thận bình thường (CLCR > 80 ml/phút), bệnh nhân có suy thận mức độ trung bình (CLCR 30- 60 ml/phút) và mức độ nặng (CLCR < 30 ml/phút) được cho dùng pioglitazone 45 mg liều duy nhất hoặc nhiều liều. Các thông số dược động học huyết thanh của thuốc và chất chuyển hóa của nó M-III và M-IV được đánh giá vào liều đầu và liều cuối (là ngày 1 và ngày 12). Kết quả tương tự nhau ở nhóm bình thường và suy thận trung bình, không có tích tụ đáng kể thuốc hoặc chất chuyển hóa trên bệnh nhân. AUC trung bình giảm ở bệnh nhân suy thận nặng so với người bình thường đối với thuốc và chất chuyển hóa M-III, M-IV (Bảng 1). Điều này có thể do giảm protein gắn kết vốn hay gặp trên bệnh nhân suy thận làm tăng nồng độ pioglitazone tự do và tăng độ thanh thải toàn phần của thuốc (giả định chức năng gan không thay đổi). Trong nghiên cứu này, pioglitazone dung nạp tốt ở bệnh nhân có mức độ suy thận khác nhau do đó có lẽ không cần chỉnh liều khởi đầu và liều duy trì trên đối tượng này [105]. Thông số dược động học của pioglitazone tương tự nhau ở bệnh nhân BTGĐC đang lọc thận với bệnh nhân có chức năng thận bình thường [106]. Ở bệnh nhân đái tháo đường típ 2 có lọc thận, điều trị pioglitazone giúp kiểm soát đường huyết tốt hơn, cải thiện thông số lipid, và tăng nhạy cảm insulin, nồng độ adiponectin, giảm dấn ấn viêm, giảm liều erythropoietin do đó cải thiện yếu tố nguy cơ tim mạch [107]. Điều thú vị là phân tích post hoc từ nghiên cứu PROactive có khảo sát hiệu quả của 45 mg pioglitazone trên bệnh tim mạch trong dân số đái tháo đường có biến chức mạch máu lớn theo kết quả GFR. Bệnh nhân có BTM (eGFR < 60 ml/phút/1.73 m2) và được điều trị bằng pioglitazone lại ít bị các biến cố gộp về tử vong chung, nhồi máu cơ tim và đột quị (HR 0.66, 95% khoảng tin cậy 0.45 – 0.98), độc lập với độ nặng suy thận [108,109].
7.2 Rosiglitazone
Rosiglitazone chuyển hóa chủ yếu qua CYP2C8 thành chất chuyển hóa không hoạt tính, và <1% thuốc gốc xuất hiện trong nước tiểu [110]. Để khảo sát tác động của các mức độ BTM trên dược động học của rosiglitazone sau khi dùng liều duy nhất 8 mg, người tham gia được phân tần bằng CLCR ước đoán: bình thường (> 80 ml/phút), suy thận nhẹ (60 – 80 ml/phút), trung bình (30 – 59 ml/phút) và BTGĐC chưa lọc thận (< 30 ml/phút) [111]. Có tăng nhẹ (khoảng 10-20%) giá trị trung bình AUC∞ không gắn kết ở mỗi nhóm suy thận so với dân số bình thường nhưng không có ý nghĩa lâm sàng. Bệnh nhân suy thận nặng có tăng 38% về phân suất không gắn kết trung bình, dẫn đến làm tăng độ thanh lọc toàn phần, làm giảm 19 – 24% giá trị trung bình của AUC∞ toàn phần và Cmax so với nhóm bình thường. Tỷ lệ biến cố bất lợi tương đương nhau ở các nhóm. Do suy thận không làm thay đổi rõ dược động học của rosiglitazole toàn phần và không gắn kết khi uống liều duy nhất, liều khởi đầu không cần điều chỉnh ở bệnh nhân BTM. Điều chỉnh liều sau đó nên dựa trên đáp ứng từng bệnh nhân [111].
Dược động học và tính dung nạp của rosiglitazone 8 mg uống liều duy nhất được so sánh trên bệnh nhân BTGĐC đang lọc thận và 10 người tình nguyện khỏe mạnh. Lọc thận không làm ảnh hưởng đến dược động học của rosiglitazole, và độ thanh lọc thấp (0.10l/giờ). AUC∞, Cmax , t1/2 trung bình của rosiglitazone tương tự nhau trong bệnh nhân lọc thận và người khỏe mạnh. Do đó, không cần chỉnh liều rosiglitazone ở bệnh nhân đái tháo đường típ 2 bị BTMGĐC phải lọc thận [112]. Dược động học của 8 mg rosiglitazone đường uống một lần duy nhất được nghiên cứu trên bệnh nhân BTGĐC cần thẩm phân phúc mạc lâu dài. AUC∞ và Cmax trung bình của rosiglitazone ở bệnh nhân thẩm phân phúc mạc dường như không khác biệt so với nhóm khỏe mạnh [113].
Trong phân tích post hoc dữ liệu gộp từ 3 nghiên cứu mù đôi, ngẫu nhiên có đối chứng giả dược, hiệu quả của 4 mg rosiglitazone trong phác đồ có sulfonylurea được đánh giá ở bệnh nhân đái tháo đường típ 2 suy thận nhẹ đến trung bình (CLCR trước nghiên cứu 30 -80 ml/phút). Rosiglitazone có hiệu quả và dung nạp tốt trong nhóm dân số này, không có sự khác biệt rõ về kết quả trên bệnh nhân chức năng thận bình thường [114]. Trong hai nghiên cứu khác, rosiglitazone dung nạp tốt và có lợi ở bệnh nhân đái tháo đường típ 2 thẩm phân phúc mạc [115] hoặc đang lọc thận [116].
8. Thuốc ức chế men DPP-4
Thuốc ức chế men DPP-4 (gliptin) là nhóm thuốc viên hạ đường huyết mới thuộc loại thuốc dựa trên incretin. Thuốc cải thiện kiểm soát đường huyết mà không làm hạ đường huyết (ngược với sulfonylurea) và tác động trung tính trên cân nặng [117]. Hiện đã có một số phân tử với các đặc tính dược động học khác nhau [118, 119]. Thuốc ức chế DPP-4 đang được nghiên cứu đặc biệt nhiều trên bệnh nhân BTM [120]. Sitagliptin [121], vildagliptin [122,123], saxagliptin [124] và alogliptin [125] được bài tiết phần lớn ở thận. Kết quả nghiên cứu dược động học phức tạp trên các đối tượng có suy thận mức độ khác nhau cho thấy liều hàng ngày của 4 thuốc ức chế men DPP-4 nên được chỉnh theo eGFR để đạt nồng độ huyết tương tương đương nhau [120]. Một số nghiên cứu chứng minh rằng hiệu quả thuốc hạ đường huyết được duy trì trong khi thông số an toàn tốt khi giảm liều gliptin trên bệnh nhân suy thận [126 – 129]. Ngược lại, linagliptin bài tiết chủ yếu ở mật hơn là thận (< 5%) [130]. Do đó, thuốc ức chế men DPP-4 này không cần điều chỉnh liều khi có suy thận và có thể sử dụng trên bệnh nhân BTM các mức độ khác nhau (Bảng 5) [131, 132]. Trong tất cả nghiên cứu liên quan đến ức chế men DPP-4, nhóm dân số sau đây được thử nghiệm: chức năng thận bình thường, CLCR > 80 ml/phút; suy thận nhẹ, 50 – 80 ml/phút; trung bình 30 – 50 ml/phút; nặng < 30 ml/phút; BTGĐC < 30 ml/phút đang lọc thận.
Thuốc ức chế men DPP-4 có vai trò đang lên trong điều trị đái tháo đường típ 2, đặc biệt trong phối hợp với metformin. Một số liều kết hợp cố định hiện đã có và sớm xuất hiện trên thị trường [117]. Những thuốc kết hợp này chỉ có chỉ định khi cả hai thành phần thuốc không có chống chỉ định do sự hiện diện suy thận và có thể cần phải điều chỉnh liều [133 -135].
8.1 Sitagliptin
Dược động học của 50 mg sitagliptin liều đơn độc được đánh giá trên bệnh nhân có mức độ suy thận khác nhau: nhẹ, trung bình, nặng, BTGĐC đang lọc thận và chức năng thận bình thường [121]. So với nồng độ ở người bình thường, AUC∞ của sitagliptin tăng lần lượt gấp ~1.6, ~2.3, ~3.8 và 4.5 lần trên bệnh nhân có suy thận mức độ nhẹ, trung bình, nặng và BTGĐC (Bảng 1). Dựa trên kết quả này, liều sitagliptin được khuyến cáo điều chỉnh cho bệnh nhân suy thận mức độ trung bình (50 mg/ngày) hoặc nặng và BTGĐC (25 mg/ngày) để tạo nồng độ sitagliptin huyết tương tương đương ở bệnh nhân có chức năng thận bình thường (100 mg/ngày) (Bảng 5).
Sitagliptin nhìn chung dung nạp tốt và giúp kiểm soát hiệu quả đường huyết ở bệnh nhân đái tháo đường típ 2 có suy thận mức độ trung bình đến nặng, bao gồm cả bệnh nhân BTGĐC đang lọc thận [127]. Ở bệnh nhân đái tháo đường típ 2 có BTM mức độ trung bình đến nặng, sitagliptin (liều lần lượt 50 -25 mg/ngày) và glipizide có hiệu quả giảm HbA1c tương đương. So với glipizide, sitagliptin nhìn chung dung nạp tốt, nguy cơ hạ đường huyết thấp và cân nặng trung tính [74]. Ở bệnh nhân đái tháo đường típ 2 có BTGĐC đang lọc thận, sitagliptin 25mg/ngày gần như hiệu quả tương đương trong giảm HbA1c như glipizide (khác biệt 0.15% không có ý nghĩa sau 54 tuần), với suất độ hạ đường huyết có triệu chứng (6.3 so với 10.8%) cũng như hạ đường huyết nặng (0 so với 7.7%) thấp hơn [75].
8.2 Vildagliptin
Vildagliptin chuyển hóa chủ yếu qua cơ chế thủy phân và chất chuyển hóa được bài tiết chính ở thận. Vildagliptin cũng được bài tiết qua thận dưới dạng không thay đổi ở mức độ thấp hơn (23% sau liều uống). Do đó, suy thận có một số tác động trên dược động học của vildagliptin [122]. Giá trị AUC trung bình tăng 32 – 134% và giá trị Cmax tăng 8 – 66% ở bệnh nhân suy thận nhẹ, vừa, nặng và BTGĐC đang lọc thận so với người bình thường. CLR của vildagliptin ở người tình nguyện khỏe mạnh trung bình là 12.4 l/giờ, và giảm ở người có các mức độ suy thận khác nhau với mối tương quan có ý nghĩa đến sự giảm GFR (r2 = 0.75). Tuy nhiên, AUC của vildagliptin không cho thấy mối tương quan rõ với độ nặng của suy thận (đánh giá bằng GFR). Vildagliptin được loại bỏ khi lọc thận ở mức giới hạn (3%). So với giá trị trên người bình thường, AUC của chất chuyển hóa thủy phân chính ở dạng bất hoạt (LAY151) trên người suy thận nhẹ, trung bình, nặng và những người BTGĐC lần lượt tăng 1.6, 2.4, 5.4 và 6.7 lần, tương quan rõ giữa các thay đổi về AUC của LAY151 với giảm GFR (Bảng 1) [123]. Việc thiếu mối tương quan rõ giữa tăng AUC của vildagliptin với độ nặng suy thận có thể cho thấy thận không chỉ góp phần vào bài tiết mà còn đóng góp chính vào chuyển hóa thủy thân của vildagliptin. Trên phương diện dược động học, việc tăng xấp xỉ hai lần nồng độ thuốc gợi ý liều của vildagliptin ở bệnh nhân suy thận nặng đến trung bình nên được giảm một nửa so với liều người có chức năng thận bình thường (50 mg/ngày thay vì 50 mg hai lần/ngày) (Bảng 5) [122].
Trong một nghiên cứu 24 tuần trên 515 bệnh nhân đái tháo đường típ 2 bị suy thận mức độ trung bình – nặng, việc thêm vildagliptin (50 mg/ngày) vào điều trị hiện có cho thông số an toàn tương đương với giả dược với giảm HbA1c có ý nghĩa thống kê lẫn lâm sàng [128]. Kết quả này được khẳng định sau 1 năm theo dõi [129]. Trong một nghiên cứu khác, thông số an toàn về vildagliptin 50 mg phối hợp với metformin tương đương nhau ở bệnh nhân suy thận nhẹ và nhóm chức năng thận bình thường [136]. Trong phân tích gộp 38 nghiên cứu có vildagliptin dùng trong 12-104 tuần trên bệnh nhân đái tháo đường típ 2, sự hiện diện của suy thận nhẹ không ảnh hưởng bất lợi trên độ an toàn của vildagliptin so với bệnh nhân có chức năng thận bình thường [137]. Cuối cùng, vildagliptin cũng hiệu quả và an toàn trên bệnh nhân đái tháo đường đang lọc thận [138] hoặc trên bệnh nhân suy thận nặng (eGFR < 30 ml/phút/1.73 m2), đái tháo đường kéo dài không kiểm soát đầy đủ bằng insulin [139].
8.3 Saxagliptin
Dược động học của saxagliptin và chất chuyển hóa có hoạt tính dược lý của thuốc – 5-hydroxy saxagliptin – trên bệnh nhân không đái tháo đường có suy thận nhẹ, trung bình, nặng hay BTGĐC được so sánh với thông số trên người trưởng thành khỏe mạnh [124]. Tất cả đối tượng được cho một liều duy nhất 10 mg saxagliptin uống. Sử dụng hướng tiếp cận dựa trên mô hình và so với người khỏe mạnh, giá trị trung bình hình học của AUC∞ đối với saxagliptin cao hơn lần lượt 16, 41 và 108% ở nhóm suy thận nhẹ, trung bình hoặc nặng (Bảng 1). Thời gian đào thảo t1/2 của saxagliptin và 5-hydroxy saxagliptin tăng từ từ trong khi CLR giảm từ từ theo sự giảm CLCR. Do đó, nửa liều thông thường của sitagliptin 5 mg (nghĩa là 2.5 mg/ngày) được khuyến cáo trên bệnh nhân suy thận nặng, trung bình hoặc BTGĐC đang lọc thận, trong khi không cần chỉnh liều ở suy thận nhẹ.
Một nghiên cứu 12 tuần đánh giá hiệu quả và tính an toàn của saxagliptin 2.5 mg so với giả dược ở bệnh nhân đái tháo đường típ 2 suy thận (CLCR < 50 ml/phút) [140]. Các thuốc hạ đường huyết uống và insulin dùng trước giai đoạn tuyển dụng được tiếp tục sử dụng trong suốt nghiên cứu. HbA1c trung bình sau khi hiệu chỉnh giảm nhiều hơn trong nhóm saxagliptin so với giả dược sau 12 tuần trong phân nhóm bệnh nhân suy thận trung bình (30 ≤ CLCR ≤ 50 ml/phút) và nặng (CLCR < 30 ml/phút) ngoại trừ trong nhóm BTGĐC có lọc thận. Sau khi mở rộng theo dõi 52 tuần, mức giảm trung bình đã hiệu chỉnh của HbA1c ở nhóm saxagliptin lớn hơn so với giả dược (khác biệt -0.73%, p< 0.001). Giảm HbA1c nhiều hơn ở nhóm saxagliptin 2.5 mg so với giả dược ở bệnh nhân suy thận trung bình hoặc nặng ngoại trừ nhóm BTGĐC có lọc thận. Saxagliptin nhìn chung dung nạp tốt với tỷ lệ báo cáo hạ được huyết tương đương với nhóm giả dược. Do đó, 2.5 mg saxagliptin mỗi ngày cho hiệu quả kéo dài, độ dung nạp tốt trên bệnh nhân đái tháo đường típ 2 suy thận trung bình hoặc nặng, nhưng không có khuyến cáo trên bệnh nhân BTGĐC (Bảng 5) [126].
8.4 Alogliptin
Kết quả nghiên cứu dược động học liều duy nhất (50 mg) trên bệnh nhân suy thận cho thấy tăng nồng độ alogliptin so với nhóm tình nguyện viên khỏe mạnh; lần lượt tăng xấp xỉ 1.7, 2.1, 3.2 và 3.8 lần ở bệnh nhân suy thận nhẹ, trung bình, nặng và BTGĐC (Bảng 1) [125]. Dựa trên những nghiên cứu này, để đạt được nồng độ alogliptin huyết tương tương đương bệnh nhân có chức năng thận bình thường, đã có khuyến cáo cần chỉnh liều thuốc cho bệnh nhân đáo tháo đường típ 2 suy thận trung bình đến nặng, bao gồm BTGĐC cần lọc thận (Bảng 5).
8.5 Linagliptin
Ảnh hưởng của suy thận trên nồng độ linagliptin được đánh giá ở trên đối tượng có và không có đái tháo đường típ 2 [141]. Dược động học của linagliptin (5 mg/ngày) được nghiên cứu khi dùng liều duy nhất và trong trạng thái ổn định (dùng trong 7 – 10 ngày) ở bệnh nhân BTM nhẹ, trung bình, nặng và BTGĐC đang lọc thận so với ở người có chức năng thận bình thường. Sự bài tiết linagliptin dạng không thay đổi ở thận là <7% trong tất cả các nhóm. Mặc dù có khuynh hướng nồng độ thuốc cao hơn (20 – 60%) ở bệnh nhân BTM so với chức năng thận bình thường, giá trị AUC∞ và Cmax giai đoạn ổn định cho thấy có sự trùng lắp lớn và không bị ảnh hưởng bởi mức độ suy thận (Bảng 1). Do đó, BTM có tác động nhỏ lên dược động học của linagliptin – một phát hiện được khẳng định trong phân tích post hoc về nồng độ đáy linagliptin huyết tương trong nghiên cứu pha III đánh giá 5 mg linagliptin dùng một lần mỗi ngày trong 24 – 52 tuần ở bệnh nhân suy thận có mức độ suy thận khác nhau [142].
Một phân tích gộp ba thử nghiệm lâm sàng đánh giá tác động của chức năng thận trên hiệu quả và tính an toàn của linagliptin. Dữ liệu về 2141 bệnh nhân đái tháo đường típ 2 được phân nhóm theo chức năng thận bình thường (n = 1684), BTM nhẹ (n = 418) hoặc trung bình (n = 39). Linagliptin cho thấy sự hằng định trong thay đổi trung bình HbA1c hiệu chỉnh theo giả dược sau 24 tuần ở cả 3 nhóm: chức năng thận bình thường (-0.63%), BTM nhẹ (-0.69%) và trung bình (-0.69%) với sự khác biệt không có ý nghĩa giữa các nhóm. Linagliptin nhìn chung dung nạp tốt, với suất độ các biến cố bất lợi tương tự như giả dược [131].
Cuối cùng, có một nghiên cứu pha III gần đây đánh giá hiệu quả và độ an toàn của linagliptin trên bệnh nhân đái tháo đường típ 2 có BTM nặng (GFR < 30 ml/phút/1.73 m2) [132]. Bệnh nhân được điều trị bằng linagliptin 5mg/ngày hoặc giả dược. Linagliptin làm giảm HbA1c có ý nghĩa ở tuần 12 khi phân tích toàn bộ (-0.8 so với -0.2% của giả dược) và cả trong phân tích theo nhóm bệnh nhân kiểm soát kém (HbA1c đầu nghiên cứu ≥ 9%) (-1.5 so với -0.3%). Hạ đường huyết xảy ra nhiều hơn ở nhóm linagliptin so với giả dược, một kết quả có thể là do không thay đổi liều điều trị nền gồm insulin và/hoặc sulfonylurea. Những biến cố bất lợi khác tương tự nhau ở hai nhóm.
9. Thuốc ức chế SGLT2
Thận đóng vai trò chính trong điều hòa glucose nội môi do vai trò của nó trong tân sinh đường, độ lọc cầu thận và sự tái hấp thu đường ở ống lượn gần. Sự vận chuyển glucose từ lòng ống vào trong tế bào biểu mô ống thận thông qua chất đồng vận chuyển natri-glucose (SGLTs – sodium-glucose cotransporters), đặc biệt là SGLT2, một chất vận chuyển mạnh có ái lực thấp hiện diện chủ yếu ở thận. SGLT2 đảm nhận xấp xỉ 90% quá trình tái hấp thu glucose. Thuốc ức chế SGLT2 là một loại thuốc hạ đường huyết mới, chuyên biệt tại thận ức chế sự tái thấp thu của glucose đã được lọc, do đó dẫn đến tình trạng “đái tháo đường” (glucosuria). Cơ chế tác dụng này có tiềm năng hứa hẹn trên bệnh nhân đái tháo đường típ 2 không chỉ ở khía cạnh cải thiện kiểm soát đường huyết mà còn có thể có ích làm giảm cân và giảm huyết áp động mạch [143]. Dapagliflozin là thuốc ức chế SGLT2 hiện có nhiều dữ liệu lâm sàng nhất [144]. Những thuốc ức chế SGLT2 khác (canagliflozin, empagliflozin) gần đây đang ở pha cuối trong giai đoạn phát triển, nhưng chưa một nghiên cứu chuyên biệt về dược động học nào được thực hiện trên bệnh nhân suy thận [143]. Trong một nghiên cứu khảo sát tương tác thuốc giữa empagliflozin và metformin ở người nam giới khỏe mạnh, độ thanh lọc của empagliflozin và metformin không bị ảnh hưởng khi dùng đồng thời [145].
Có một nghiên cứu đánh giá tác động của các mức độ chức năng thận trên dược động học/dược lực học của dapagliflozin. Dapagliflozin 50 mg liều duy nhất được sử dụng trên 5 nhóm đối tượng phân chia theo tình trạng đái tháo đường và chức năng thận: người khỏe mạnh không có đái tháo đường; bệnh nhân đái tháo đường típ 2 có chức năng thận bình thường, suy thận nhẹ, vừa hoặc trung bình dựa trên eGFR. Sau đó, bệnh nhân đái tháo đường típ 2 được đánh giá khi cho dùng nhiều liều (20 mg mỗi ngày). Nồng độ dapagliflozin và D3OG – một chất chuyển hóa không hoạt động – trong huyết tương tăng dần khi chức năng thận giảm. Cmax của dapagliflozin giai đoạn ổn định cao hơn lần lượt là 4, 6 và 9% trong khi với D3OG là 20, 37, và 52% ở bệnh nhân suy thận nhẹ, trung bình và nặng so với nhóm bình thường. AUC0-tau cao hơn tương tự (Bảng 1). So với bệnh nhân có chức năng thận bình thường, hiểu quả giảm đường kém hơn khi có suy thận. Độ thanh thải đường tại thận giai đoạn ổn định bị giảm lần lượt 42, 83 và 84% ở bệnh nhân suy thận nhẹ, trung bình và nặng. Những kết quả này cho thấy ngoài gan, thận đóng góp đáng kể vào cơ chế chuyển hóa dapagliflozin, dẫn đến nồng độ thuốc trong cơ thể cao hơn khi chức năng thận suy giảm. Dapagliflozin giảm dược lực học ở bệnh nhân đái tháo đường suy thận trung bình, nặng và tác động này phù hợp với việc giảm hiệu quả trong việc giảm HbA1c ở nhóm dân số bệnh nhân này [146].
10. Thuốc đồng vận thụ thể GLP-1
Khi các thuốc uống không đủ kiểm soát đường huyết, các thuốc tiêm có thể được sử dụng. Bên cạnh insulin, thuốc đồng vận thụ thể GLP-1 (exenatide, liraglutide và sắp tới là lixisenatide) đem lại những hy vọng mới trong điều trị đái tháo đường típ 2 [16]. Tuy nhiên, do đặc tính dược động học của những hợp chất này, một số hạn chế đã bị bộc lộ khi có suy thận (Bảng 5).
Những trường hợp đã được báo cáo về mối liên hệ giữa sử dụng exenatide [147, 248] hoặc liraglutide [149] với suy thận cấp ở bệnh nhân đái tháo đường típ 2. Nguyên nhân có thể do tác dụng phụ trên đường tiêu hóa trong đó nôn ói nhiều lần khiến cho mất nước và suy thận cấp thứ phát. Các bác sĩ nên nhận thức về biến cố bất lợi này và bệnh nhân cũng cần được giáo dục khi nào cần thông báo những triệu chứng đường tiêu hóa kéo dài và bất thường. Tuy nhiên, một nghiên cứu đoàn hệ hồi cứu một cơ sỡ dữ liệu lớn về y học và dược đã cho thấy gia tăng suất độ suy thận cấp ở bệnh nhân đái tháo đường so với nhóm không bị đái tháo đường nhưng không có mối liên hệ giữa sử dụng exenatide với suy thận cấp [150].
10.1 Exenatide
Dược động học, độ an toàn và tính dung nạp của liều exenatide duy nhất được đánh giá trên bệnh nhân suy thận. Exenatide (5 hoặc 10 μg) được tiêm dưới da cho 31 đối tượng (chỉ một trong số đó bị đái tháo đường típ 2) được phân tầng theo chức năng thận: bình thường (ClCR > 80 ml/phút), nhẹ (51 – 80 ml/phút), trung bình (31 – 50 ml/phút) hoặc BTGĐC cần lọc thận [151]. Dữ liệu về dược động học được phối hợp với bốn nghiên cứu dùng liều duy nhất trước đó trên bệnh nhân đái tháo đường típ 2 để cho thấy mối liên hệ giữa độ thanh lọc exenatide (CL/F) và CLCR. Thời gian t1/2 trung bình ở nhóm khỏe mạnh, suy thận nhẹ, trung bình, nặng và BTGĐC lần lượt là 1.5, 2.1, 3.2, và 6 giờ. Sau khi kết hợp số liệu từ nhiều nghiên cứu, bình phương tối thiểu của trung bình hình học của CL/F ở người có chức năng thận bình thường, nhẹ, trung bình, nặng và BTGĐC lần lượt là 8.14, 5.19, 7.11 và 1.3 L/giờ. Do đó, AUC của exenatide tăng rõ rệt ở bệnh nhân BTGĐC (Bảng 1). Exenatide nhìn chung dung nạp tốt ở nhóm suy thận nhẹ đến trung bình ngoại trừ nhóm BTGĐC do buồn nôn, nôn ói. Do thay đổi về tính dung nạp và dược động học có thể chấp nhận được trên lâm sàng ở bệnh nhân suy thận nhẹ đến trung bình, có thể dùng exenatide trên đối tượng này mà không cần chỉnh liều. Tuy nhiên, tính dung nạp kém và thay đổi đáng kể về dược độnghọc đã khiến các liều thuốc điều trị hiện có trên thị trường (5 và 10 μg) không phù hợp cho bệnh nhân suy thận nặng hoặc BTGĐC [151].
10.2 Liraglutide
Để khảo sát có cần chỉnh liều thuốc đồng phân GLP-1 người là liraglutide dùng một lần/ngày cho bệnh nhân có các mức độ suy thận khác nhau, 30 bệnh nhân được cho liều tiêm dưới da duy nhất 0.75 mg liraglutide. Không có khuynh hướng rõ ràng về thay đổi dược động học ở các nhóm theo sự suy giảm chức năng thận. Phân tích hồi qui về log(AUC) ở những đối tượng có chức năng thận bình thường và suy thận từ nhẹ đến trung bình không cho thấy tác động có ý nghĩa của giảm CLCR trên dược động học của liraglutide. Mức độ suy thận dường như không liên quan đến tăng nguy cơ biến cố bất lợi. Do rối loạn chức năng thận không thấy làm tăng nồng độ thuốc, bệnh nhân đái tháo đường típ 2 bị suy thận nên dùng các phác đồ điều trị chuẩn của liraglutide. Tuy nhiên, vẫn có những hạn chế về kinh nghiệm với liraglutide trên bệnh nhân có BTM ở mức độ nặng hơn [152].
Để xác định tác động của suy thận nhẹ trên hiệu quả và an toàn của liraglutide trên bệnh nhân đái tháo đường típ 2, sáu thử nghiệm lâm sàng LEAD (Liraglutide Effect and Action in Diabetes) được tiến hành phân tích gộp tập trung vào dữ liệu từ bệnh nhân chức năng thận bình thường (CLCR > 89 ml/phút), suy thận nhẹ (60 – 89 ml/phút) và trung bình hoặc nặng (< 60 ml/phút). Dân số nghiên cứu bao gồm bệnh nhân có dùng liraglutide ngày một lần (1.2 hoặc 1.8 mg) hoặc giả dược trong đơn trị hoặc phối hợp với thuốc viên hạ đường huyết khác trong 26 tuần. Suy thận nhẹ không ảnh hưởng đến các khác biệt điều trị đã ước tính với HbA1c, cân nặng và huyết áp tâm thu. Điều trị bằng liraglutide an toàn và dung nạp tốt ở bệnh nhân suy thận nhẹ do không có khác biệt có ý nghĩa về thay đổi tỷ lệ tổn thương thận, hạ đường huyết nhẹ hay buồn nôn so với giả dược. Mặc dù vậy, một khuynh hướng tăng buồn nôn đã được quan sát thấy trên nhóm suy thận trung bình hoặc nặng dùng liraglutide mặc dù số lượng bệnh nhân quá nhỏ để tính khác biệt có ý nghĩa thống kê. Kết luận: suy thận nhẹ không làm ảnh hưởng đến hiệu quả và độ an toàn của liraglutide [153].
11. Insulin và các đồng phân insulin (insulin analog)
11.1 Insulin người
Thận đóng vai trò then chốt trong thanh lọc và phân hủy insulin trong tuần hoàn [154]. Gần 50% insulin trong máu (insulin ngoại sinh có tỉ lệ cao hơn) bị thanh lọc ở thận qua con đường khác nhau: i) lọc qua cầu thận và sau đó tái hấp thu ở tế bào ống thận gần qua cơ chế nội bào và ii) khuyếch tán insulin từ các mao mạch quanh thận và sau đó gắn kết chúng vào màng đáy bên (contraluminal membrane) của tế bào ống thận. Khi suy thận tiến triển, quá trình hấp thu insulin quanh ống thận gia tăng, bù trừ cho việc giảm thoái hóa insulin được lọc cho đến khi GFR giảm xấp xỉ dưới 20 ml/phút. Với mức GFR thấp hơn, sự thanh lọc insulin giảm hơn nữa và nhìn chung phải giảm liều insulin. Nếu không, nguy cơ hạ đường huyết gia tăng.
Tác động của bệnh thận do đái tháo đường (hội chứng Kimmelstiel-Wilson) trên nhu cầu insulin được biết đến từ lâu [155]. Suy giảm CLR của insulin làm kéo dài t1/2 của thuốc trong máu và thường dẫn đến giảm nhu cầu insulin trên bệnh nhân đái tháo đường [156]. Khuyến cáo chung khi GFR giảm trong khoảng 10 – 50 ml/phút, liều insulin nên giảm 25% và khi GFR dưới 10 ml/phút, liều insulin nên giảm 50% [8, 9]. Giảm nhu cầu insulin trong suy thận tương tự nhau ở bệnh nhân đái tháo đường típ 1 và típ 2 điều trị bằng insulin. Ở những người đái tháo đường típ 2, sự tiết insulin còn lại không ảnh hưởng đến việc giảm nhu cầu insulin phụ thuộc vào GFR. Ví dụ liều insulin trên bệnh nhân đái tháo đường típ 2 bị giảm 51% trên bệnh nhân có CLCR 10 ml/phút so với bệnh nhân có CLCR 80 ml/phút [157].
11.2 Các insulin analog
Việc thay đổi phân tử insulin tạo ra hai loại insulin analog tác dụng dài (glargin và detemir) và ba loại insulin tác dụng nhanh (aspart, lispro và glulisine) với thông số dược động học/dược lực học được cải tiến. Như insulin người, thông số dược động học/dược lực học của insulin analog có thể bị ảnh hưởng bởi nhiều biến số bao gồm chức năng thận mặc dù số liệu hiện nay còn rất ít [158]. Insulin lispro duy trì các đặc tính dược động học/dược lực học ở những bệnh nhân có bệnh thận do đái tháo đường giai đoạn toàn phát [159]. Trên bệnh nhân đái tháo đường lọc thận, insulin lispro bị hấp thu nhanh hơn insulin người, tương tự như người có chức năng thận bình thường [160]. Tương tự, suy thận không ảnh hưởng đến dược động học của insulin aspart một cách có ý nghĩa trên lâm sàng [161]. Theo kiến thức của tác giả, chưa có nghiên cứu được công bố nào kiểm định chuyên biệt về dược động học của hai loại insulin analog tác dụng kéo dài là glargine và detemir trên bệnh nhân BTM [158]. Giảm liều khởi đầu theo cân nặng của glargine/glulisine trên bệnh nhân đái tháo đường típ 2 có suy thận trong bệnh viện làm giảm tần suất hạ đường huyết 50% mà không ảnh hưởng đến kiểm soát đường huyết [162]. Insulin analog tác dụng ngắn cũng có thể được dùng trên bệnh nhân đái tháo đường típ 2 đang lọc thận [163].
12 Kết luận
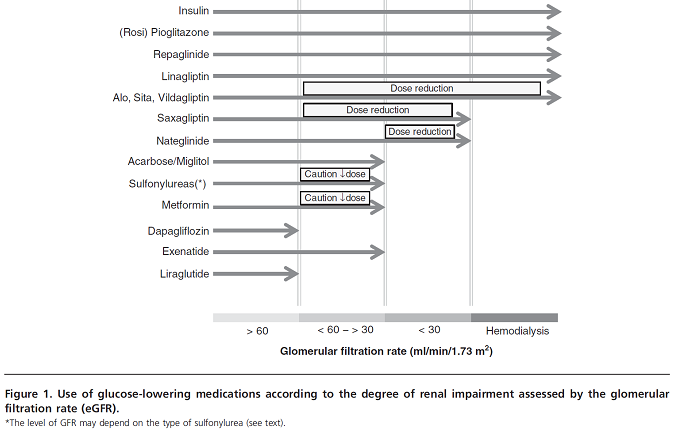
Một tỷ lệ lớn và tăng dần (gần đây khoảng 20 – 25%) bệnh nhân đái tháo đường típ 2 có BTM trung bình đến nặng (giai đoạn 3 – 5), đặc biệt trong dân số già vốn đòi hỏi sự thay đổi trong điều trị hạ đường huyết. Thật vậy, suy thận cho thấy những ảnh hưởng lớn lên dược động học của đa số thuốc hạ đường huyết uống hoặc tiêm. Do đó, nên giảm liều trong đa số trường hợp hoặc nếu BTM đủ nặng, có thể ngưng thuốc hoặc trì hoãn vì lý do an toàn (Hình 1). Tuy nhiên, kinh nghiệm lâm sàng ở nhiều nước cho thấy nhiều bệnh nhân đái tháo đường típ 2 không được điều trị phù hợp khi được cho liều quá cao theo sự suy giảm chức năng thận hoặc thậm chí rơi vào chống chỉ định do mức độ trầm trọng của BTM. Mặc dù cho thuốc không phù hợp, suất độ các biến cố bất lợi tương đối thấp, thậm chí hơi bị đánh giá thấp trong thực hành lâm sàng. Tác dụng phụ được nhận biết nhiều nhất khi cho thuốc hạ đường huyết ở bệnh nhân đái tháo đường típ 2 có suy thận là nhiễm acid lactic với metformin, hạ đường huyết với sulfonylurea (hiếm gặp hơn ở glinide) cũng như insulin (hay insulin analog), và phù với nguy cơ suy tim sung huyết của TZD. Dược động học của thuốc ức chế men DPP-4 (ngoại trừ linagliptin) và thuốc đồng vận thụ thể GLP-1 cũng bị thay đổi khi suy thận nên có thể cần giảm liều phù hợp. Tuy nhiên, nguy cơ tiềm ẩn liên quan đến những nhóm thuốc này, thậm chí khi sử dụng trên bệnh nhân BTM, vẫn chưa được thiết lập đầy đủ. Dù sao đi nữa, có thể làm giảm nguy cơ hạ đường huyết vốn tiềm ẩn nguy hiểm thậm chí tử vong khi dùng sulfonylurea trên bệnh nhân BTM bằng chuyển qua nhóm thuốc ức chế DPP-4. Trường hợp của metformin cần được lưu ý nhiều hơn. Thật vậy, metformin là thuốc viên hạ đường huyết đầu tay trong tất cả hướng dẫn điều trị đái tháo đường típ 2, nhưng thuốc cũng bị chống chỉ định trên bệnh nhân có GFR dưới 60 ml/phút. Nếu chống chỉ định này được tuân thủ chặt chẽ (mà thực tế thì ngược lại), nhiều bệnh nhân sẽ không được dùng thuốc hạ đường huyết tốt nhất này. Điều đó dẫn đến việc cần có bổ túc về qui định sử dụng thuốc metformin trên bệnh nhân suy thận nhẹ đến trung bình. Cuối cùng, kinh nghiệm về thuốc ức chế SGLT 2, loại thuốc hạ đường huyết duy nhất nhắm đặc hiệu đến thận, vẫn còn hạn chế, mặc dù nhóm thuốc này đã cho thấy giảm dược động học trên bệnh nhân BTM nên không phải là lựa chọn tốt nhất trong dân số này.
Sự gia tăng độ lưu hành của bệnh nhân đái tháo đường típ 2 và BTM, đặc biệt nhóm người già, đòi hỏi phải theo dõi định kỳ chức năng thận và lựa chọn hợp lý cũng như liều của các thuốc hạ đường huyết theo GFR. Việc cân bằng giữa nguy cơ/lợi ích nên được cân nhắc trong nhóm bệnh nhân đái tháo đường nhạy cảm này. Có thể trong tương lai sẽ có những thuốc hạ đường huyết mới có thể sử dụng hiệu quả và an toàn trên một số lượng lớn dân số đái tháo đường típ 2 có BTM.
13. Quan điểm chyên gia
Theo tuyên bố mới nhất của ADA – EASD, điều trị tăng đường huyết trong đái tháo đường típ 2 nên lấy bệnh nhân làm trung tâm. Nói chung, mục tiêu và phương thức điều trị nên phù hợp với các đặc tính của bệnh nhân đái tháo đường típ 2. BTM là một biến chứng thường gặp, đặc biệt ở nhóm dân số già với tỷ lệ đang gia tăng nhanh chóng, chủ yếu do khả năng bảo vệ tim mạch tốt hơn trên bệnh nhân đái tháo đường típ 2. Bước đầu tiên là sử dụng các phương pháp phù hợp để định lượng và theo dõi chức năng thận. Việc sử dụng không thống nhất các công thức khác nhau gần đây dẫn đến nhiều lúng túng hơn là giúp chỉnh liều nên cần có một sự chuẩn hóa hơn trong ước lượng eGRF.
Thứ hai, theo hướng tiếp cận cá nhân hóa, sự xuất hiện BTM rõ ràng là một yếu tố quan trọng phải tính đến, đặc biệt trong việc chọn lựa, tính liều và theo dõi điều trị. Ở bệnh nhân đái tháo đường típ 2 có BTM, lưu đồ điều trị có thể dùng sau đây, mặc dù không có một hướng dẫn chính thống nào trong nhóm dân số chuyên biệt này.
Thuốc đựa lựa chọn đầu tiên vẫn là metformin nếu suy thận ổn định, CLCR trên 30 ml/phút và chức năng thận cần theo dõi thường xuyên. Khi CLCR dưới 45 ml/phút, liều hàng ngày của metformin nên giảm một nữa và phải ngưng khi CLCR xuống dưới 30 ml/phút. Lưu ý, bệnh nhân và gia đình cần được thông báo kịp thời rằng phải ngưng metformin trong các tình huống cấp tính, đặc biệt những trường hợp có thể dẫn đến mất nước (nôn ói, buồn nôn, v.v) để làm giảm nguy cơ nhiễm toan acid lactic (hiếm gặp nhưng là biến chứng chết người).
Trong trường hợp có chống chỉ định metformin (CLCR từ 30 – 45 ml/phút nhưng có nguy cơ bất ổn hoặc CLCR < 30 ml/phút), bác sĩ có thể chọn thuốc ức chế DPP-4 hơn là sulfonylurea để làm giảm nguy cơ hạ đường huyết do thuốc ở bệnh nhân dễ gặp biến chứng nặng này. Linagliptin, vốn không được bài tiết ở thận, có thể dùng ở liều thông thường trong khi những thuốc khác trong nhóm phải giảm liều (nhìn chung giảm một nửa) để đạt nồng độ tương đương trong huyết tương. Theo đó, hiệu quả hạ đường huyết tương đương được đảm bảo với độ an toàn tốt trên bệnh nhân đái tháo đường típ 2 có BTM trung bình đến nặng như trong nhóm có chức năng thận bình thường. Để giảm chi phí điều trị, một cách khác là xem xét glinide hoặc sulfonylourea có sự bài tiết qua thận thấp (và không có chất chuyển hóa có hoạt tính). Thiazolidinedion (gần đây chỉ còn pioglitazone do rosiglitazone bị rút ra khỏi hầu hết quốc gia vì lý do an toàn trên tim mạch) có thể dùng mà không chỉnh liều, mặc dù nguy cơ ứ dịch và suy tim sung huyết có thể tăng trên nhóm bệnh nhân nhạy cảm hơn bị BTM. Trong nhóm dân số châu Á, thuốc ức chế men α-glucosidase có thể là một lựa chọn mặc dù gần như không có dữ liệu trên bệnh nhân BTM nên cần những nghiên cứu chuyên biệt hơn trong tương lai trên nhóm đối tượng này.
Khi không thể dùng metformin đơn trị liệu để kiểm soát đường huyết theo cá nhân, việc phối hợp thêm thuốc ức chế DPP-4 dường như đem lại vài lợi điểm so với sulfonylurea (ít hạ đường huyết hơn, không tăng cân, không cần dò liều). Một số thuốc kết hợp giữa gliptin và metformin hiện đã có mặt để thúc đẩy việc sử dụng các phối hợp này và cải thiện tính tuân trị. Những thuốc thay thế trình bày ở trên (repaglinide, pioglitazone, acarbose) cũng có thể tính đến, mặc dù hiện có ít thử nghiệm lâm sàng có đối chứng trong nhóm dân số BTM và do đó bằng chứng lâm sàng còn chưa nhiều.
Khi thất bại với phối hợp gliptin-metformin, việc chuyển sang insulin có lẽ là chọn lựa tốt nhất do những hạn chế về kinh nghiệm trong điều trị ba thuốc hoặc với thuốc đồng vận thụ thể GLP-1 đường tiêm trên bệnh nhân có BTM. Cần lưu ý rằng liều insulin hàng ngày nhìn chung thấp hơn ở bệnh nhân có BTM do thận thanh lọc khoảng 50% lượng insulin trong máu và bệnh nhân đái tháo đường có suy thận dễ bị hạ đường huyết. Dược động học của các chế phẩm insulin (bao gồm cả insulin analog) chưa được nghiên cứu đầy đủ ở bệnh nhân có các mức độ suy thận khác nhau, và do đó không có một hướng dẫn tuyệt đối vào xác định điều chỉnh liều phù hợp của insulin theo mức độ GFR.
Cuối cùng, thuốc ức chế SGLT2 là thuốc viên hạ đường huyết duy nhất nhắm chuyên biệt vào thận để cải thiện kiểm soát đường huyết. Tuy nhiên, hiệu quả lâm sàng của thuốc mất khi chức năng thận giảm nên nhóm thuốc mới này không nên sử dụng ở bệnh nhân có BTM. Thông số an toàn của thuốc cũng ít được biết trên nhóm dân số này.
Do sự gia tăng độ lưu hành BTM (đặc biệt ở giai đoạn nhẹ đến trung bình) trên bệnh nhân đái thái đường típ 2, rất cần việc làm rõ vấn đề sử dụng thuốc hạ đường huyết trong nhóm dân số này cũng như sự phát triển nhóm thuốc mới có hiệu quả và an toàn trong kiểm soát đường huyết cho dù suy giảm chức năng thận.
|
Các điểm chính trong bài báo |
|
· Giảm chức năng thận thường gặp ở bệnh nhân đái tháo đường típ 2, đặc biệt trên 65 tuổi nhưng thường không được bác sĩ quan tâm và bệnh nhân không biết · Chức năng thận nên được theo dõi ở tất cả bệnh nhân đái tháo đường trước khi kê toa bất kỳ loại thuốc hạ đường huyết nào, và theo dõi thường xuyên nhằm phát hiện diễn tiến xấu, đặc biệt khi có các biến cố tiềm ẩn nguy cơ suy giảm chức năng thận. · Dược động học của đa số thuốc hạ đường huyết có thể thay đổi khi suy thận, do đó cần có điều chỉnh liều phù hợp theo sự giảm độ lọc cầu thận (GFR) (độ thanh lọc creatinine (CLCR)) · Metformin, thuốc viên hạ đường huyết đầu tay, bị chống chỉ định khi CLCR < 60 ml/phút/1.73 m2, mặc dù trên thực tế cho thấy thuốc được kê toa rộng rãi ở bệnh nhân có CLCR thấp hơn với nhiều lợi ích tiềm năng mà không gây bất kỳ biến cố nào. Trong những hướng dẫn gần đây có đề nghị giảm liều khi < 45-60 ml/phút/1.73 m2 và thuốc phải được ngưng sử dụng ở mức 30 ml/phút/1.73 m2. · Đa số thuốc sulfonylurea được bài tiết ở thận (dưới dạng không đổi hoặc chất chuyển hóa có hoạt tính), lý giải nguyên nhân thuốc khiến nguy cơ hạ đường huyết (nặng) cao hơn ở bệnh nhân đái tháo đường típ 2 có BTM. Thuốc ức chế men DPP-4 với liều cũng bị giảm khi có suy thận (trừ linagliptin) cho thấy lợi điểm rõ ràng trong tình huống này. · Hiệu quả và độ an toàn của thuốc đồng vận thụ thể glucagon-like peptide-1 (GLP-1) và nhóm mới ức chế chất đồng vận chuyển natri-glucose (SGLT2) vẫn còn chưa được hiểu rõ ở bệnh nhân BTM và cần có những nghiên cứu thêm trước khi sử dụng cho nhóm dân số này. |
|
Bảng này tóm tắt những điểm chính trong bài báo. |
|
Bảng 2: Các khuyến cáo lâm sàng về sử dụng thuốc hạ đường huyết trong bệnh nhân đái tháo đường típ 2 với các mức độ suy thận khác nhau theo GFR |
||||
|
|
AUC trong bệnh nhân suy thận |
Nguy cơ tác dụng phụ ở bệnh nhân suy thận |
Sử dụng theo GFR (ml/phút) |
Sử dụng trong bệnh nhân BTGĐC và lọc thận |
|
Biguanides Metformin |
Tăng |
Nhiễm acid lactic |
≥ 60: cho phép 30 – 45: thận trọng (nửa liều) < 30: ngưng thuốc |
Không (chạy thận khi bị ngộ độc) |
|
Sulfonylureas |
||||
|
Glibenclamide |
Tăng (chất chuyển hóa có hoạt tính) |
Hạ đường huyết (nguy cơ khác nhau theo thuốc) |
≥ 60: cho phép < 60: không dùng |
Không |
|
Glimepiride |
Tăng (chất chuyển hóa có hoạt tính) |
≥ 60: cho phép < 60: thận trọng |
Không |
|
|
Glipizide |
Không thay đổi (chất chuyển hóa không hoạt tính) |
Cho phép |
Cho phép |
|
|
Gliclazide |
Không thay đổi (chất chuyển hóa không hoạt tính) |
Cho phép (thận trọng) |
Không dữ liệu |
|
|
Gliquidone |
Không thay đổi (chất chuyển hóa không hoạt tính) |
Cho phép (ít dữ liệu) |
Không dữ liệu |
|
|
Glinides |
||||
|
Repaglinide |
Không thay đổi |
Hạ đường huyết (ít hơn sulfonylurea) |
Cho phép |
Cho phép |
|
Nateglinide |
Thay đổi không nhiều |
< 60: thận trọng |
Không |
|
|
Thuốc ức chế α-glucosidase |
||||
|
Acarbose/Miglitol |
Tăng (chất chuyển hóa) |
Không biết |
≥ 60: cho phép < 60: thận trọng |
Không |
|
Thiazolidinediones Pioglitazone/Rosiglitazone |
Không thay đổi |
Ứ dịch Suy tim sung huyết |
≥ 60: cho phép < 60: thận trọng |
Kinh nghiệm hạn chế Rất thận trọng |
|
Thuốc ức chế men DPP-4 |
||||
|
Sitagliptin |
Tăng |
Không biết |
≥50: cho phép 30 – 50: nửa liều < 30: ¼ liều |
Thận trọng |
|
Vildagliptin |
Tăng |
≥50: cho phép < 50: nửa liều |
Thận trọng |
|
|
Saxagliptin |
Tăng (+ chất chuyển hóa có hoạt tính) |
≥50: cho phép < 50: nửa liều < 30: thận trọng |
Không dùng |
|
|
Alogliptin |
Tăng |
≥50: cho phép < 50: giảm liều |
Thận trọng |
|
|
Linagliptin |
Không thay đổi |
Cho phép (không cần giảm liều) |
Có thể được (không dữ liệu) |
|
|
Thuốc ức chế SGLT2 Dapagliflozin |
Tăng |
Không biết |
≥ 60: cho phép < 60: không dùng |
Không |
|
Thuốc đồng vận thụ thể GLP-1 |
||||
|
Exenatide |
Không thay đổi |
Không biết |
≥60: cho phép 30 – 60: thận trọng < 30: không dùng |
Không |
|
Liraglutide |
Không thay đổi |
≥ 50: cho phép < 50: không dùng |
Không |
|
|
Insulin Insulin và các analog |
Tăng |
Hạ đường huyết |
Cho phép (giảm liều trong ngày) |
Cho phép |
|
AUC: diện tích dưới đường cong nồng độ-thời gian; DDP-4: dipeptidyl peptidase-4; BTGĐC: bệnh thận giai đoạn cuối; GFR: độ lọc cầu thận; GLP-1: Glucagon-like peptide-1; SGLT2: Sodium-glucose contransporters 2; |
||||
|
Bảng 3: Các giai đoạn BTM khác nhau theo ước tính GFR bằng công thức MDRD (eGFR) hoặc theo CLCR bằng công thức Cockroft-Gault |
|||
|
Giai đoạn |
Mô tả |
eGFR bằng MDRD |
CLCR bằng Cockroft-Gault |
|
Công thức |
|
GFR (ml/phút/1.73 m2) = 186.3 x (creatinine huyết tương (µmol/l)/88.4)-1.154 x tuổi-0.203 |
GFR (ml/phút) = (140 – tuổi) x cân nặng (kg)/creatinine huyết tương (µmol/l) |
|
Yếu tố hiệu chỉnh |
|
Phụ nữ: x 0.742 Mỹ gốc Phi: x 1.21 |
Phụ nữ: x 1.03 Nam: x 1.23 |
|
1 |
Chức năng thận bình thường |
≥ 90 |
> 80 |
|
2 |
BTM nhẹ |
60 – 89 |
50 – 80 |
|
3* |
BTM trung bình |
30 – 59 |
30 – 50 |
|
4 |
BTM nặng |
15 – 29 |
< 30 |
|
5 |
BTGĐC |
< 15 (hoặc lọc thận) |
Lọc thận |
|
*Giai đoạn 3 có thể chia là hai loại: 3a là từ 45 – 59 ml/phút/1.73 m2 và 3b từ 30 -44 ml/phút/1.73 m2 BTM: bệnh tha65nma5n; CLCR độ thanh thải creatinine; eGFR: độ lọc cầu thận ước tính; BTGĐC: bệnh thận giai đoạn cuối; GFR: độ lọc cầu thận |
|||
|
Bảng 4: Các khuyến cáo được đề nghị về việc sử dụng metformin theo eGFR |
|
|
eGFR (ml/phút/1.73 m2) |
Điều trị |
|
≥ 60 |
Không có chống chỉ định với metformin. Theo dõi chức năng thận hàng năm |
|
< 60 & ≥ 45 |
Tiếp tục metformin nếu dung nạp tốt Tăng cường theo dõi chức năng thận (mỗi 3 – 6 tháng) Tránh các thuốc độc thận khác Ngưng metformin trong trường hợp có tình trạng cấp tính nghiêm trọng và mất nước |
|
< 45 & ≥ 30 |
Cho metformin với sự thận trọng Sử dụng liều thấp hơn (ví dụ như giảm 50% hoặc một nửa liều tối đa) Theo dõi sát chức năng thận (mỗi 3 tháng) Tránh các thuốc độc thận Ngưng metformin trong trường hợp có tình trạng cấp tính nghiêm trọng và mất nước Không bắt đầu metformin trên bệnh nhân mới |
|
< 30 |
Ngưng metformin Điều chỉnh liệu pháp hạ đường huyết khi cần thiết Theo dõi sát chức năng thận (mỗi 6 tuần) |
|
Cần cẩn trọng thêm ở bệnh nhân nguy cơ tổn thương thận cấp hoặc đang có những thay đổi đáng kể về chức năng thận, dựa trên tiền sử, bệnh lý đi kèm, hoặc những thuốc có khả năng tương tác nhau. Theo mục tham khảo [37]. eGFR: độ lọc cầu thận ước tính |
|
|
Bảng 5. Khuyến cáo điều chỉnh liều khi sử dụng liệu pháp incretin ở bệnh nhân có mức độ suy thận khác nhau dưạ trên các nghiên cứu dược động học trước đó. |
||||
|
Suy thận |
Nhẹ |
Trung bình |
Nặng |
BTGĐC |
|
Giai đoạn |
1 – 2 |
3 |
4 |
5 |
|
CLCR (ml/phút) |
≥ 50 |
≥ 30 và < 50 |
< 30 |
Chạy thận |
|
Sitagliptin |
100 mg/ngày |
50 mg/ngày |
25 mg/ngày |
25 mg/ngày |
|
Vildagliptin |
2 x 50 mg/ngày |
1 x 50 mg/ngày |
1 x 50 mg/ngày |
1 x 50 mg/ngày |
|
Saxagliptin |
5 mg/ngày |
2.5 mg/ngày |
2.5 mg/ngày |
Không khuyến cáo |
|
Alogliptin |
25 mg/ngày |
12.5 mg/ngày |
6.25 mg/ngày |
6.25 mg/ngày |
|
Linagliptin |
5 mg/ngày |
5 mg/ngày |
5 mg/ngày |
5 mg/ngày |
|
Exenatide |
2 x 10 µg/ngày |
2 x 10 µg/ngày |
Không khuyến cáo |
Không khuyến cáo |
|
Liraglutide |
1.2 – 1.8 mg/ngày |
Không khuyến cáo |
Không khuyến cáo |
Không khuyến cáo |
|
CLCR độ thanh thải creatinine |
||||
Bài liên quan:
{article 970}{link}- {title}{/link}{/article}
Tài liệu tham khảo:
1.National Kidney Foundation. K/DOQI Clinical practice guidelines for chronic kidney disease: evaluation, classification, and. stratification. Am J Kidney Dis 2002;39:S1-266
2.National Kidney Foundation. KDOQI Clinical practice guidelines and clinical practice recommendations for diabetes and chronic kidney disease. Am J Kidney Dis 2007;49:S12-154
3. National Kidney Foundation. KDOQI Clinical Practice Guideline for Diabetes and CKD: 2012 Update. Am J Kidney Dis 2012;60:850-86. The 2012 update of the KDOQI Clinical Practice Guideline for Diabetes and CKD is intended to assist the practitioner caring for patients with diabetes and CKD.
4. Detournay B, Simon D, Guillausseau PJ, et al. Chronic kidney disease in type 2 diabetes patients in France: prevalence, influence of glycaemic control and implications for the pharmacological management of diabetes. Diabetes Metab 2012;38:102-12
5. de Boer IH, Rue TC, Hall YN, et al. Temporal trends in the prevalence of diabetic kidney disease in the United States. JAMA 2011;305:2532-9
6. Koro CE, Lee BH, Bowlin SJ. Antidiabetic medication use and prevalence of chronic kidney disease among patients with type 2 diabetes mellitus in the United States. Clin Ther 2009;31:2608-17
7. Whaley-Connell A, Sowers JR, McCullough PA, et al. Diabetes mellitus and CKD awareness: the Kidney Early Evaluation Program (KEEP) and
National Health and Nutrition Examination Survey (NHANES). Am J Kidney Dis 2009;53:S11-21
8. Charpentier G, Riveline JP, Varroud-Vial M. Management of drugs affecting blood glucose in diabetic patients with renal failure. Diabetes Metab 2000;26(Suppl 4):73-85
9. Reilly JB, Berns JS. Selection and dosing of medications for management of diabetes in patients with advanced kidney disease. Semin Dial 2010;23:163-8
10. Lubowsky ND, Siegel R, Pittas AG. Management of glycemia in patients with diabetes mellitus and CKD. Am J Kidney Dis 2007;50:865-79
11. Meyers JL, Candrilli SD, Kovacs B. Type 2 diabetes mellitus and renal impairment in a large outpatient electronic medical records database: rates of diagnosis and antihyperglycemic medication dose adjustment. Postgrad Med 2011;123:133-43
12. Ritz E. Limitations and future treatment options in type 2 diabetes with renal impairment. Diabetes Care 2011;34(Suppl 2):S330-4
13. Abe M, Okada K, Soma M. Antidiabetic agents in patients with chronic kidney disease and end-stage renal disease on dialysis: metabolism and clinical practice. Curr Drug Metab 2011;12:57-69. This review describes the PK, metabolism, clinical efficacy and safety of OADs used as alternative treatments to sulfonylureas and metformin in patients with CKD, including those receiving dialysis.
14. Ahmed Z, Simon B, Choudhury D. Management of diabetes in patients with chronic kidney disease. Postgrad Med 2009;121:52-60
15. Slinin Y, Ishani A, Rector T, et al. Management of hyperglycemia, dyslipidemia, and albuminuria in patients with diabetes and CKD: a systematic review for a KDOQI clinical practice guideline. Am J Kidney Dis 2012;60:747-69
16. Inzucchi SE, Bergenstal RM, Buse JB, et al. Management of hyperglycaemia in type 2 diabetes: a patient-centered approach. Position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2012;55:1577-96. These joint recommendations should be considered within the context of the needs, preferences and tolerances of each patient with T2DM, a key of success in patients with CKD.
17. Scheen AJ. Medications in the kidney. Acta Clin Belg 2008;63:76-80
18. Haneda M, Morikawa A. Which hypoglycaemic agents to use in type 2 diabetic subjects with CKD and how? Nephrol Dial Transplant 2009;24:338-41
19. Scheen AJ, Lefebvre PJ. Oral antidiabetic agents. A guide to selection. Drugs 1998;55:225-36
20. Neumiller JJ, Setter SM. Pharmacologic management of the older patient with type 2 diabetes mellitus. Am J Geriatr Pharmacother 2009;7:324-42
21. Rigalleau V, Beauvieux MC, Gonzalez C, et al. Estimation of renal function in patients with diabetes. Diabetes Metab 2011;37:359-66
22. McFarland MS, Markley BM, Zhang P, et al. Evaluation of modification of diet in renal disease study and Cockcroft-Gault equations for sitagliptin
dosing. J Nephrol 2012;25:515-22
23. Luft D, Schmulling RM, Eggstein M. Lactic acidosis in biguanide-treated diabetics: a review of 330 cases. Diabetologia 1978;14:75-87
24. Lalau JD. Lactic acidosis induced by metformin: incidence, management and prevention. Drug Saf 2010;33:727-40
25. Holstein A, Stumvoll M. Contraindications can damage your health–is metformin a case in point? Diabetologia 2005;48:2454-9
26. Scheen AJ, Paquot N. Metformin revisited: a critical review of the benefit/ risk balance in “at risk” patients with type 2 diabetes. Diabetes Metab
2013; Submitted
27. Scheen AJ. Clinical pharmacokinetics of metformin. Clin Pharmacokinet 1996;30:359-71
28. Graham GG, Punt J, Arora M, et al. Clinical pharmacokinetics of metformin. Clin Pharmacokinet 2011;50:81-98
29. Tzvetkov MV, Vormfelde SV, Balen D, et al. The effects of genetic polymorphisms in the organic cation transporters OCT1, OCT2, and OCT3 on the renal clearance of metformin. Clin Pharmacol Ther 2009;86:299-306
30. Stocker SL, Morrissey KM, Yee SW, et al. The effect of novel promoter variants in MATE1 and MATE2 on the pharmacokinetics and pharmacodynamics
of metformin. Clin Pharmacol Ther 2013;93:186-94
31. Sirtori CR, Franceschini G, Galli-Kienle M, et al. Disposition of metformin (N,N-dimethylbiguanide) in man. Clin Pharmacol Ther 1978;24:683-93
32. Tucker GT, Casey C, Phillips PJ, et al. Metformin kinetics in healthy subjects and in patients with diabetes mellitus. Br J Clin Pharmacol 1981;12:235-46
33. Sambol NC, Chiang J, Lin ET, et al. Kidney function and age are both predictors of pharmacokinetics of metformin. J Clin Pharmacol 1995;35:1094-102
34. Lalau JD, Vermersch A, Hary L, et al. Type 2 diabetes in the elderly: an assessment of metformin (metformin in the elderly). Int J Clin Pharmacol Ther Toxicol 1990;28:329-32
35. Frid A, Sterner GN, Londahl M, et al. Novel assay of metformin levels in patients with type 2 diabetes and varying levels of renal function: clinical recommendations. Diabetes Care 2010;33:1291-3
36. Duong JK, Roberts DM, Furlong TJ, et al. Metformin therapy in patients with chronic kidney disease. Diabetes Obes Metab 2012;14:963-5
37. Lipska KJ, Bailey CJ, Inzucchi SE. Use of metformin in the setting of mild-to-moderate renal insufficiency. Diabetes Care 2011;34:1431-7. This review paper strongly supports an evidence-based approach to prescribing metformin in diabetic patients with mild to moderate RI and suggests that the current guidelines for metformin use should be updated.
38. Lalau JD, Andrejak M, Moriniere P, et al. Hemodialysis in the treatment of lactic acidosis in diabetics treated by metformin: a study of metformin elimination. Int J Clin Pharmacol Ther Toxicol 1989;27:285-8
39. Dichtwald S, Weinbroum AA, Sorkine P, et al. Metformin-associated lactic acidosis following acute kidney injury. Efficacious treatment with continuous renal
replacement therapy. Diabet Med 2012;29:245-50
40. Howlett HC, Bailey CJ. A risk-benefit assessment of metformin in type 2 diabetes mellitus. Drug Saf 1999;20:489-503
41. Harrower AD. Pharmacokinetics of oral antihyperglycaemic agents in patients with renal insufficiency. Clin Pharmacokinet 1996;31:111-19 . This paper carefully reviews the effects of renal insufficiency on the PK of old oral antidiabetic drugs, various sulfonylureas, metformin and acarbose.
42. Scheen AJ. Metformin and lactic acidosis. Acta Clin Belg 2011;66:329-31
43. Philbrick AM, Ernst ME, McDanel DL, et al. Metformin use in renal dysfunction: is a serum creatinine threshold appropriate? Am J Health Syst Pharm 2009;66:2017-23
44. Emslie-Smith AM, Boyle DI, Evans JM, et al. Contraindications to metformin therapy in patients with Type 2 diabetes–a population-based study of adherence to prescribing guidelines. Diabet Med 2001;18:483-8
45. Vasisht KP, Chen SC, Peng Y, et al. Limitations of metformin use in patients with kidney disease: are they warranted? Diabetes Obes Metab 2010;12:1079-83
46. Pongwecharak J, Tengmeesri N, Malanusorn N, et al. Prescribing metformin in type 2 diabetes with a contraindication: prevalence and outcome. Pharm World Sci 2009;31:481-6
47. Kennedy L, Herman WH. Renal status among patients using metformin in a primary care setting. Diabetes Care
2005;28:922-4
48. Roussel R, Travert F, Pasquet B, et al. Metformin use and mortality among patients with diabetes and atherothrombosis. Arch Intern Med 2010;170:1892-9
49. Nye HJ, Herrington WG. Metformin: the safest hypoglycaemic agent in chronic kidney disease? Nephron Clin Pract 2011;118:c380-3
50. Pilmore HL. Review: metformin: potential benefits and use in chronic kidney disease. Nephrology (Carlton) 2010;15:412-18
51. del Pozo-Fernandez C, Pardo-Ruiz C, Sanchez-Botella C, et al. Discrepancies among consensus documents, guidelines, clinical practice and the legal framework for the treatment of type 2 diabetes mellitus patients. Nefrologia 2012;32:367-73
52. Rocha A, Almeida M, Santos J, et al. Metformin in patients with chronic kidney disease: strengths and weaknesses. J Nephrol 2013;26:55-60
53. Inkster B, Zammitt NN, Frier BM. Drug-induced hypoglycaemia in type 2 diabetes. Expert Opin Drug Saf 2012;11:597-614
54. Schejter YD, Turvall E, Ackerman Z. Characteristics of patients with sulphonylurea-induced hypoglycemia. J Am Med Dir Assoc 2012;13:234-8
55. Holstein A, Hammer C, Hahn M, et al. Severe sulfonylurea-induced hypoglycemia: a problem of uncritical prescription and deficiencies of diabetes
care in geriatric patients. Expert Opin Drug Saf 2010;9:675-81
56. Moen MF, Zhan M, Hsu VD, et al. Frequency of hypoglycemia and its significance in chronic kidney disease. Clin J Am Soc Nephrol 2009;4:1121-7
57. Hung AM, Roumie CL, Greevy RA, et al. Comparative effectiveness of incident oral antidiabetic drugs on kidney function. Kidney Int 2012;81:698-706
58. Rosenkranz B. Pharmacokinetic basis for the safety of glimepiride in risk groups of NIDDM patients. Horm Metab Res 1996;28:434-9
59. Balant L. Clinical pharmacokinetics of sulphonylurea hypoglycaemic drugs. Clin Pharmacokinet 1981;6:215-41







