BS. Nguyễn Thị Lệ Trang
BS. Nguyễn Thanh Hiền
- đặt vấn đề:
tỷ lệ rung nhĩ (RN) trong dân số chung là 1% và tăng dần theo tuổi, trong khi tỷ lệ RN ở bệnh nhân (BN)mắc bệnh thận mạn tính (CKD) giai đoạn cuối đang điều trị thay thế thận cao hơn nhiều dao động từ 7%-27%25,26.
BN mắc CKDcó hai nguy cơ cùng lúc đó là rất dễ bịthành lập huyết khối và kèm theo nguy cơ xuất huyết cao. Do đó khi điều trị thuốc chống huyết khối, không giống như dân số nói chung có chức năng thận bình thường, ở những BN này có thể có cả tác dụng có lợi và cả tác dụng bất lợi. Những BNCKD có nguy cơ bị biến cố huyết khối đã làm tăng tỷ lệ mắc bệnh tim mạch và bệnh huyết khối tĩnh mạch. Các biến cố huyết khối động mạch bao gồm bệnh mạch máu não, nhồi máu cơ tim và bệnh động mạch ngoại biên (PAD), trong khi huyết khối tĩnh mạch có thể liên quan đến huyết khối tĩnh mạch sâu và thuyên tắc phổi, huyết khốitừ các catheter ngoại biên và trung tâm3,4.Ngoài ra, đã có báo cáo về huyết khối tĩnh mạch không chỉ giới hạn ở CKD nặng mà còn cả giai đoạn 1-3 của CKD với sự hiện diện của albumin niệu. Huyết khối tĩnh mạch có nguy cơ liên quan đến albumin niệu hơn là suy giảm tốc độ lọc cầu thận (GFR), cho thấy sự phổ biến của biến chứng này ở BN CKD16.
Nhiều nghiên cứu đã cho thấy mức eGFR thấp và tăng albumin niệu dẫn đến tăng nguy cơ biến cố bệnh tim mạch (CVD). Đột tử do tim trên BN CKD giai đoạn 3 cao hơn 2 lần, giai đoạn 4 là 3 lần so với BN có chức năng thận bình thường. Nguy cơ suy tim sung huyết tiến triển (CHF), RN, đột quỵ, bệnh mạch vành (CAD), PADtăng 2 lần đối với BN có eGFR< 60ml/ph. Nghiên cứu sổ bộ gần đây cho thấy suy giảm chức năng thận có thể xem làm một yếu tố nguy cơ độc lập cho việc tiến triển CVD4,5.
Đã có rất nhiều nghiên cứu và các hướng dẫn điều trị kháng đông để phòng ngừa biến cố thuyên tắc đột quỵ ở BN RN có chức năng thận bình thường,trái lại vấn đề điều trị kháng đông ở BNRN với chức năng thận giảm thì hiện có rất ít bằng chứng và các hướng dẫn cụ thể. Chỉ khoảng 1/3 BN thận nhân tạo (TNT) kèm RN được điều trị với warfarin để dự phòng đột quỵ.Sự xuất hiện của các thuốc kháng đông đường uống mới là một thuận lợi trong điều trị vì có thể tăng cường lợi ích và giảm thiểu đáng kể các tác dụng phụ về chảy máu. Do đó chúng tôi viết bài này để giúp các bác sỹ lâm sàng có thể hiểu rõ cơ chế tác động cũng như biết cách cân bằng giữa lợi ích và nguy cơ trong sử dụng thuốc kháng đông ở BN CKD.
- II. cơ chế thành lập huyết khối ở BN CKD và các yếu tố nguy cơ gây chảy máu:
II.1. cơ chế thành lập huyết khối ở bn CKD7,8:
Nguyên nhân đầu tiên nghĩ đến là sự thay đổi lưu lượng máu, làm xấu đi GFR trong RN do áp lực co bóp nhĩ trái giảm và hình thành cản âm tự phát trong nhĩ, dẫn tới tình trạng ứ máu đáng kể và tăng nguy cơ huyết khối. Thứ hai, tổn thương rối loạn chức năng nội mô liên quan đến CKD ở thành mạch có thể biểu hiện trực tiếp như chức năng nội mô bất thường (được đánh giá bằng sự giãn nở qua trung gian dòng chảy) hoặc tăng tốc độ sóng xung, hoặc gián tiếp, khi tăng nồng độ yếu tố endothelin và Von Willebrand.Thứ ba, tăng sinh huyết khối trong CKD cũng liên quan đến sự gia tăng các bất thường về chức năng tiểu cầu và đông máu (các thành phần máu bất thường) thông qua một số con đường, ví dụ, tăng phức hợp procoagulant và viêm, tăng đông qua con đường yếu tố mô, và tương tác của nó với tiểu cầu, giảm antithrombin III và chất ức chế hoạt hóa plasminogen (PAI) -1, làm giảm sự suy giảm yếu tố Von Willebrand và tăng khả năng kết dính tiểu cầu. Ngoài ra còn có các yếu tố khác góp phần tăng sinh huyết khối như: kích hoạt hệ thống renin-angiotensin-aldosterone,viêm mạn tính, vôi hóa động mạch chủ hoặc mạch máu và rối loạn chức năng canxi-phosphate chuyển hóa khoáng chất, có liên quan đến rối loạn chức năng thận (hình 1)
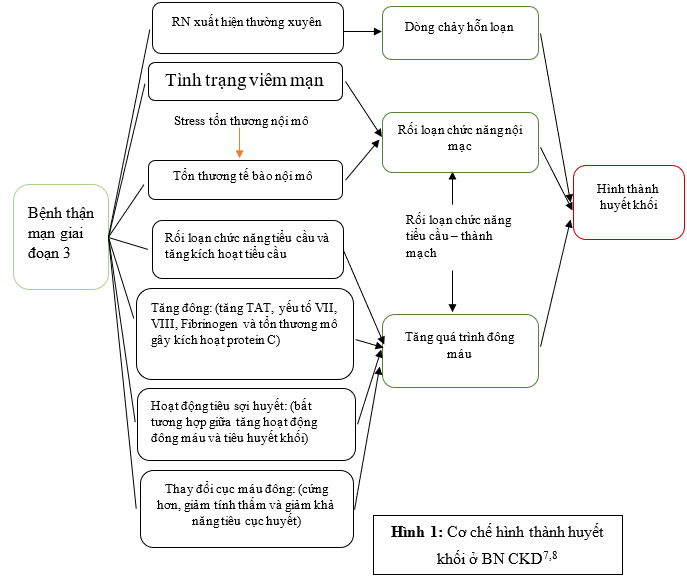
II.2. các yếu tố nguy cơ gây chảy máu7.,8:
Mặc dù các nguyên nhân RN kể trên làm tăng đáng kể nguy cơ huyết khối và đột quị do thiếu máu cục bộ ở BN RN, nhưng CKD cũng dẫn đến nghịch lý là tăng nguy cơ biến cố xuất huyết.Bằng chứng từ cả nghiên cứu Rotterdam và thử nghiệm CIRCS (Circulatory Risk in Communities Study) của Nhật Bản cho thấy rằng ởBN có chức năng thận giảm (GFR <60 ml / phút /1,73 m2) dẫn đến nguy cơ đột quỵ xuất huyết tăng gấp 4 lần ở nam giới và nguy cơ tăng gấp 7 lần ở phụ nữ. BN CKD được lọc máu mạn tính có nguy cơ xuất huyết nội sọ tương đối cao hơn 10 lần. Việc suy giảm chức năng thận và rối loạn chức năng mạch máu có thể dẫn đến tăng xu hướng hình thành các vi mạch nhỏ xuất huyết được chẩn đoán qua hình ảnh cộng hưởng từ, có khả năng góp phần gây xuất huyết nội sọ sau đó. Nguy cơ xuất huyết tiêu hóa cũng gia tăng ở BN CKD và lọc thận.
Các nguyên nhân sinh lý bệnh của việc tăng nguy cơ biến cố xuất huyết là do nhiều yếu tố. Chúng có thể là hậu quả trực tiếp của rối loạn chức năng tiểu cầu liên quan đến urê huyết hoặc suy giảm kết dính và kết tập tiểu cầu; suy yếu kích hoạt thụ thể glycoprotein IIb hoặc IIIa tiểu cầu và liên kết với glycoprotein sau đó; thay đổi yếu tố Von Willebrand; và chuyển hóa oxit nitric. Ngoài ra xu hướng chảy máu có thể là kết quả của việc sử dụng đồng thời các thuốc chống tiểu cầu hoặc thuốc chống viêm không steroid. Hơn nữa, BN bệnh thận giai đoạn cuối(ESRD) sẽ phải chịu các chiến lược chẩn đoán và biện pháp điều trị xâm lấn thường xuyên, chẳng hạn như tiếp cận tĩnh mạch trung tâm và chạy thận nhân tạo (cộng với phải dùng heparin thường xuyên sau đó), cũng có thể làm tăng nguy cơ chảy máu. (hình 2)
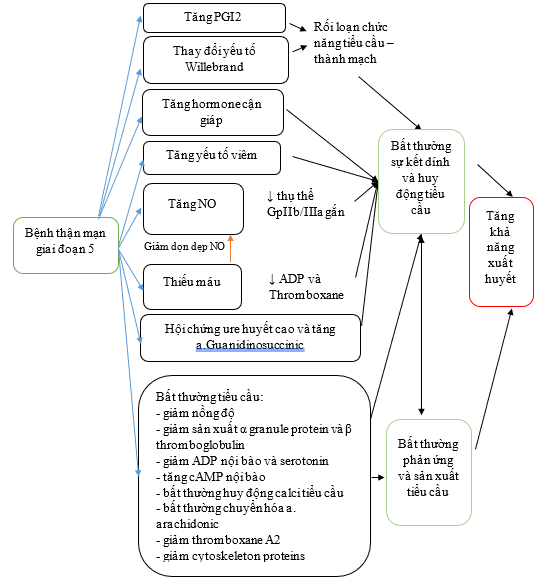
Hình 2: Cơ chế gây xuất huyết ở BN CKD7,8
III. Dược động học và dược lý học của các thuốc kháng đông TRÊN BN CKD: (Bảng 113)
III.1. KHÁNG ĐÔNG ĐƯỜNG UỐNG (OACs):
OACs sử dụng trên CKD thường là kháng đông kháng vitamin K (VKAs) và kháng đông đường uống trực tiếp (DOACs). Tuy nhiên cần chỉnh liều và theo dõi sát trong quá trình điều trị.13
III.1.1. Thuốc kháng vitamin K (VKAs):
Warfarin thường được sử dụng rộng rãi trên lâm sàngvì đã có nhiều bằng chứng điều trị. Các guideline RN khuyến cáo khác nhau khi dùng warfarin trên BN suy thận. AHA/ ACC/ khuyến cáo warfarin trên tất cả giai đoạn CKD (Gđ 1 ClassI, A; Gđ 4 Class IIb, C; Gđ 5 Class IIa, B). Guideline Canada khuyến cáo warfarin đến Gđ 4, và ESC không đưa ra bằng chứng đặc hiệu cho việc sử dụng kháng đông đường uống OAC riêng biệt nào cho mỗi Gđ CKD. Mặc dù guideline cho RN hay huyết khối tĩnh mạch sâu chi dưới không đưa ra khuyến cáo chỉnh liều trên CKD, nghiên cứu lâm sàng cho thấy tăng nguy cơ chảy máu, đặc biệt cao trong 30 – 90 ngày sau khi bắt đầu điều trị. Hầu hết biến cố xuất huyết lớn là xuất huyết tiêu hóa, thường là từ các sang thương từ đường tiêu hóa liên quan đến ure huyết. Cửa sổ điều trị hẹp và khó kiểm soát INR nên thường gây tăng cao INR >4 ở BN CKD. Mặt khác đáp ứng với warfarin còn liên quan đến chế độ ăn, thể tích nội mạch, thay đổi chuyển hóa thuốc, tương tác thuốc, tình trạng thiếu vitamin K, sự tuân thủ điều trị của BN. Do đó, cần giảm liều warfarin 10% khi GFR 30-59, giảm 19% khi GFR <30, để duy trì INR ≤ 4. Một khía cạnh khác cũng cần quan tâm đó là nguy cơ suy thận cấp khi INR > 3, do warfarin gây tổn thương thận. Cần nghĩ tới suy thận cấp khi creatinine tăng ≥ 0.3 mg/dl trong 7 ngày ở BN đang dùng warfarin có INR > 3.0. Một nguyên nhân khác được cho là gây xuất huyết cầu thận do thiếu các yếu tố đông máu và tắc nghẽn các khối kết cấu mảnh vỡ hồng cầu tại ống thận,thường gặp trên BN CKD, với tỉ lệ tử vong 31% trong vòng 1 năm. Xét nghiệm tính đa hình của gen CYP2C9 và VKORC1 giúp xác định nhóm nguy cơ cao nhạy cảm với warfarin nhằm làm giảm bớt nguy cơ quá liều, tuy nhiên, phương pháp này vẫn chưa ứng dụng trênlâm sàng gần đây. Điều chỉnh liều là rất cần thiết vì thuốc chuyển hóa qua gan, đào thải qua thận và tương tác với các thuốc khác thường rất thay đổi. Sử dụng warfarin trên BN lọc máu thậm chí còn rất khó khăn, liên quan đến các biến cố xuất huyết và đông máu cao. Hơn nữa, một vấn đề quan trọng là mối liên quan giữa warfarin, độ xơ vữa mạch máu, và suy giảm chức năng thận. Cơ chế của kháng vitamin K là ức chế gián tiếp chất nền protein G1a, qua đó làm tăng tình trạng vôi hóa nội mạch và hiện tượng phản vệ calci (calciphylaxis: tình trạng tăng cảm ứng mô khiến cho tăng tích tụ calci trong mô khi gặp một kích thích thích hợp). Sự vôi hóa mạch máu thận làm nặng thêm tình trạng suy thận tiến triển, qua đó tăng nguy cơ biến cố huyết khối và xuất huyết.19
III.1.2.Thuốc kháng đông đường uống trực tiếp (DOACs):
Là một lựa chọn có nhiều lợi ích, tuy nhiên, khi suy thận cần chỉnh liều, với từng mức GFR. Liều thuốc đươc đề nghị từ các nghiên cứu phân tích gộp trên những BN RN và suy thận (dabigatran – RE-LY, rivaroxaban – ROCKET- AF, apixaban – ARISTOTOLE, edoxaban – ENGAGE-AF TIMI 48). Các guideline khuyến cáo DOACs dành cho CKD từ nhẹ đến trung bình. Không có bằng chứng suy thận nặng và CKD giai đoạn cuối, nên việc chỉnh liều thường theo ước đoán, dựa trên một số nghiên cứu nhỏ về dược động học hoặc nghiên cứu quan sát. Vì thế, qua sự hiểu biết về dược động học, FDA chấp thuận liều 75 mg x 2 lần/ngày (BID) dabigatran cho BN có GFR 15 – 29 ml/ph. Cũng có một số nghiên cứu nhỏ khuyến cáo liều rivaroxaban 10 mg x 1 lần / ngày (QD) và edoxaban 25 mg QD trênBNRN và CKD nặng.Rivaroxaban không được khuyến cáo dùng cho BN VTE có GFR < 30 ml/ph, và đối với GFR 30 – 49 ml/ph liều khuyến cáo là 15 mg BID trong 21 ngày đầu, sau đó duy trì 20 mg QD.
Trên BN đã chạy thận nhân tạo (TNT), ngoại trừ CKD giai đoạn 5 nhưng chưa chạy TNT, FDA cho phép dùng apixaban 5 mg BID, mặc dù theo dược động học và hướng dẫn trên nhãn thuốc khuyến cáo dùng liều 2.5 mg BID để duy trì nồng độ phù hợp. Nhãn thuốc ủng hộ có thể dùng rivaroxaban liều 15 mg QD. Vẫn chưa có bằng chứng nào cho edoxaban.1,13,19
Một tác dụng phụ đặc biệt là bệnh thận liên quan – DOACs, cơ chế là có sự tắc nghẽn trong ống thận do các mảnh vỡ máu, cũng như là sự hoạt hóa receptor protease 1. Hậu quả cuối cùng là sự suy giảm chức năng thận khi dùng kháng đông, khi có giảm GFR ≥ 20%. Vì thế khi sử dụng DOACs, nên kiểm tra và theo dõi thường quy chức năng thận.
III.2. THUỐC HEPARIN:
Không phân biệt loại heparin, các loại heparin đều được chỉ định dựa trên tình trạng bệnh nền (HCVC/ VTE). Điều chỉnh liều là cần thiết trên CKD tiến triển và thường dựa trên hướng dẫn thực hành.
- Heparin không phân đoạn (UFH) được sử dụng vì có thời gian bán huỷ ngắn và tác dụng kháng đông chỉ kéo dài 1-4 giờ sau ngưng thuốc, ngay cả trên những BN có nguy cơ chảy máu cao như rối loạn chức năng thận nặng. Ngoài ra, thuốc có antidote (protamine) dùng để đảo ngược tác dụng của UFH. Mặc dù khuyến cáo sử dụng UFH trên CKD nặng mà không cần chỉnh liều nhưng sự tích tụ thuốc là khác nhau trên mỗi BN. Vì thế, bác sĩ thận học khuyến cáo giảm liều đầu chuẩn khoảng 1/3, và điều chỉnh liều tiếp theo dựa trên aPTT10. Trong hướng dẫn điều trị nhồi máu cơ tim không ST chênh lên, chỉ định dựa theo liều hiệu chỉnh. Vấn đề thường gặp phải là nguy cơ xuất huyết trên BN CKD18.
- Heparin trọng lượng phân tử thấp (LMWHs) được sử dụng vì dược động học có thể dự đoán được, dễ dàng trong thực hành do không cần phải theo dõi sát. Do đào thải qua thận một phần, nên cần chỉnh liều trên CKD giai đoạn 4, 5. Khi chỉnh liều cần theo dõi nồng độ ức chế Xa để tránh dùng liều dưới ngưỡng và để đạt được liều điều trị tối ưu10. Enoxaparin là thường dùng nhất liều 1mg/kg QD dùng cho CKD nặng. Không có bằng chứng cho dalteparin và tinzaparin trên CKD nặng. Mặc dù fondaparinux được ưu tiên trên những ca giảm tiểu cầu nghi do heparin, nó cũng không được khuyến cáo dùng trên CKD nặng.
| Bảng 1: dược động học kháng đông đường uống (Jain và cs và Lutz và cs13) | |||||
| Thuốc | Cơ chế tác dụng | Tiền chất | Dược động học | ||
| Chuyển hóa | Lọc máu | Chỉnh liều khi suy thận | |||
| Warfarin | Kháng vitamin K | No | Chủ yếu qua P450 type 2C9 (CYP2C9) | No | No |
| Dabigatran | ức chế trực tiếp thrombin tự do và các thrombin gắn fibrin | Yes | Thải qua thận 80% | Yes | Yes |
| Rivaroxaban | ức chế Xa tự do cũng như trong cục máu đông, ức chế hoạt động của prothrombinase | No | Thải qua thận 66%, 36% dưới dạng không biến đổi | No | Yes |
| Apixaban | ức chế Xa tự do cũng như trong cục máu đông | No | Chuyển hóa tại gan qua CYP3A4, thải qua thận 27% và qua phân | Từng phần | No |
| Edoxaban | ức chế Xa tự do và yếu tố mô | No | 10% hydro hóa qua men carboxylesterase 1, 50% thải qua thận dạng không biến đổi | No | Yes |
- Khuyến cáo sử dụng kháng đông tối ưu trên lâm sàng ở bn ckd:
Đã có nhiều hướng dẫn khuyến cáo dùng thuốc kháng đông ở BN có CKD. Bảng 2 và 3 dưới đây tóm tắt hướng dẫn và bằng chứng sử dụng kháng đông ở BN RN kèm CKD2.
| Bảng 2: Guideline dùng kháng đông trên BN RN trong các giai đoạn CKD2 | |||
| Giai đoạn CKD | AHA/ACC/HRS | ESC | CCS |
| Nhẹ đến trung bình: Gđ 2 – 3 (eGFR 30 – 90 ml/ph/1.73m2) | Warfarin (Class 1, LOE A)
DOACs (Class 1, LOE B) với chỉnh liều khi CKD trung bình (Class IIb, LOE C) |
DOACs (CKD nhẹ đến trung bình không được đề cập) | DOACs (CKD nhẹ đến trung bình không được đề cập) |
| Gia đoạn nặng: Gđ 4 (eGFR 15 – 29 ml/ph/1.73m2) | Khuyến cáo warfarin, DOACs có thể dùng (class IIb, LOE C) | Kháng đông có thể dùng an toàn (không đề cập cụ thể) | Khuyến cáo warfarin |
| Giai đoạn cuối: Gđ 5 (eGFR <15 hoặc đang thận nhân tạo) | Khuyến cáo dùng Warfarin (Class Iia, LOE B), không dùng DOACs | Không khuyến cáo | Không khuyến cáo dùng thường quy |
| Bảng 3: Tóm tắt bằng chứng dùng warfarin và DOACs trên RN và CKD2 | ||
| Giai đoạn CKD | Warfarin | DOACs |
| Nhẹ đến trung bình:
Gđ 2- 3 (eGFR 30 – 90 ml/ph/1.73m2) |
Bằng chứng từ việc quan sát ủng hộ việc sử dụng | Có bằng chứng vững chắc dùng DOACs tốt hơn Warfarin |
| Gia đoạn nặng: Gđ 4 (eGFR 15 – 29 ml/ph/1.73m2) | Bằng chứng hạn chế cho việc dùng | Những nghiên cứu dược động học ủng hộ việc giảm liều, dữ liệu trên BN còn hạn chế |
| Giai đoạn cuối: Gđ 5 (eGFR <15 hoặc đang thận nhân tạo) | Hầu hết nghiên cứu thiếu bằng chứng về mức độ lợi ích và nguy cơ | Dabigatran bị lọc bởi TNT
Rivaroxaban duy trì được nồng độ an toàn, nhưng thiếu bằng chứng trên BN. Apixaban thì an toàn và hiệu quả trong nghiên cứu hồi cứu nhưng cần thêm bằng chứng ở các nghiên cứu đoàn hệ. |
IV.1. Chỉ định điều trị và theo dõi khi sử dụng OACs:
Cân bằng giữa nguy cơ và lợi ích đòi hỏi phải kiểm soát tối ưu nguy cơ huyết khối và nguy cơ xuất huyết. Chúng ta nên sử dụng thang điểm CHA2DS2-VASc và HAS-BLED để quyết định dùng kháng đông và đánh giá nguy cơ chảy máu để có biện pháp phòng ngừa. Lựa chọn dùng warfarin hay DOACs tùy thuộc vào nhiều yếu tố. Trong thực hành, chúng ta có thể sử dụng bảng điểm mới SAMe-TT2R2 để quyết định lựa chọn kháng vitamin K hay DOACs. Khuyến cáo dùng warfarin với điểm từ 0- 2 (nếu TTR > 65 – 70%) và dùng DOACs khi ≥ 2. (Bảng 4, hình 3). Ở BN CKD, có khoảng 53% BN CKD có nguy cơ chảy máu cao.2
| Bảng 4: Thang điểm SAMe-TT2R2, sử dụng để hỗ trợ việc lựa chọn khởi trị giữa VKA (với việc kiểm soát kháng đông tốt) và DOACs (a) (16) | |
| Xác định | Điểm |
| Giới tính (nữ) | 1 |
| Tuổi (<60 t) | 1 |
| Tiền căn bệnh nội khoa (b) | 1 |
| Điều trị (những thuốc có tính tương tác, ví dụ đang dùng amiodarone để kiểm soát nhịp) | 1 |
| Hút thuốc lá (trong 2 năm gần nhất) | 2 |
| Chủng tộc (không phải da trắng) | 2 |
| Tổng tối đa | 8 |
| (a) Thang điểm SAMe-TT2R2 được dùng như là phương tiện để giúp đưa ra quyết định, cho những BN mới được chẩn đoán RN, có thể dùng VKA (khi SAMe-TT2R2 0 – 2đ) và đạt được ngưỡng INR điều trị trong khoảng 65 – 70%. Ngược lại, nếu ≥ 2 đ BN khó có thể đạt được INR trong ngưỡng điều trị khi dùng VKA, và DOACs nên được dùng, mà không cần dùng thử VKA trước.
(b) 2 trong các bệnh sau: THA, ĐTĐ, BMV hoặc NMCT, bệnh mạch máu ngoại biên, suy tim sung huyết, tiền căn đột quỵ, bệnh phổi, bệnh gan, thận. |
|
Theo dõi kháng đông để đạt được liều tối ưu và phù hợp. Sử dụng INR cho VKAs, nhưng giá trị thường không ổn định, khiến cho việc theo dõi rất khó khăn. Nguyên tắc khởi đầu thấp tăng liều chậm cho VKAs và nên giảm liều 10% – 20% dựa theo mức lọc GFR. Theo dõi mỗi tuần trong những tháng đầu tiên là cần thiết nhưng rất khó trên thực hành lâm sàng. Tuy nhiên, theo dõi thường xuyên cho phép duy trì thời gian INR nằm trong khoảng điều trị. Mặc dù TTR ≥ 70% là một yếu tố dự đoán riêng biệt cho việc nguy cơ huyết khối thấp, nhưng nguy cơ xuất huyết và tử vong trên CKD vẫn chưa được tối ưu.
Đối với DOACs vấn đề chính vẫn là xác định chức năng thận để chỉnh liều thích hợp. Một nghiên cứu thế giới thực ở Mỹ cho thấy 43% BN dùng quá liều thuốc, làm tăng 2.19 lần nguy cơ xuất huyết; trong khi 13.3 % dùng liều không đủ (apixaban), làm tăng 4.87 lần nguy cơ đột quỵ. Cách tiếp cận hiện nay là đánh giá chức năng thận trước khi dùng DOACs, sau 1-3 tháng, và mỗi năm, trừ khi đối với BN nguy cơ cao ( >75 tuổi, nữ, BMI thấp, suy kiệt, đang dùng dabigatran) thì cần theo dõi mỗi 6 tháng. Hội nhịp học Châu Âu gần đây đã khuyến cáo ở những BNcó GFR ≤ 60 ml/ph, nên tái đánh giá lại hằng tháng9. Ngoài ra, ở mọi BN dùng DOACs, đều cần đánh giá lại khi có bất cứ tình trạng làm nặng chức năng thận (nhiễm trùng, suy tim, tổn thương thận do thuốc…). Để đạt được phương pháp theo dõi tối ưu, có nhiều test chính xác và có tính chất định lượng nhưng chưa phổ biến trên lâm sàng như đối với dabigatran có test thời gian pha loãng thrombin (dilute thrombin time), đối với rivaroxaban có test định lượng yếu tố Xa. Bảng 5 và hình 4 giới thiệu liều DOACs ở BN suy thận và cách tiếp cận điều trị kháng đông ở BN suy thận.
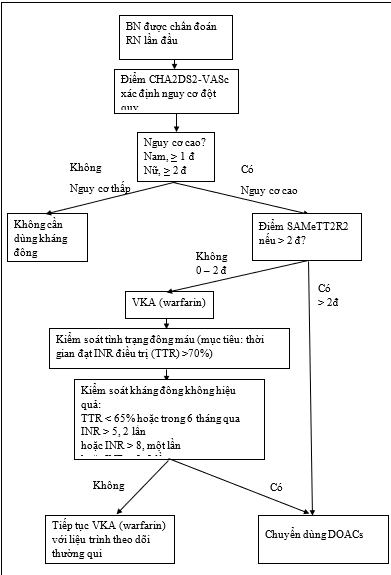
Hình 3: Chiến lược lựa chọn loại kháng đông uống trong điều trị16
| Bảng 5: Điều chỉnh liều DOACs dựa trên mức độ CKD ở BN RN/VTE2,18,23 | |||||
| Khuyến cáo kháng đông đường uống | GFR theo Cockroft – Gault | ||||
| ≥ 50 | 30 – 49 | 15 – 29 | < 15 | ESRD đã TNT | |
| DOACs | DOACs | Wafarin/DOACs | Warfarin/DOACs(thận trọng) | ||
| Warfarin | Điều chỉnh liều dựa theo INR, TTR tối ưu ≥ 70% | ||||
| Dabigatran | -150mg BID
-110 mg BID ≥80 t, hoặc dùng chung thuốc ức chế P-glycoprotein, hoặc nguy cơ xuất huyết cao |
Giống trước | Mỹ: chấp thuận 75mg BID
Châu Âu: không |
Không | |
| Rivaroxaban | 20mg QD | 15 mg QD (dùng theo nghiên cứu lớn và nghiên cứu về dược động học nhỏ) | Không | ||
| Apixaban | 5 mg BID
2.5 mg BID nếu ≥ 2 điều sau: ≥ 80t, ≤ 60kg, creatinine ≥ 1.5 mg/dl |
Giống trước | 2.5 mg BID | Mỹ chấp thuận 2.5 mg BID
Châu Âu: không |
Mỹ chấp thuận 5 mg BID
Châu Âu: không |
| Edoxaban | 60 mg QD
30 mg QD nếu ≥2 điều sau: ≤ 60 kg, GFR 30 – 50, đang dùng verapamil, Dronedarone hoặc quinidine FDA không khuyến cáo khi GFR > 95 ml/ph |
30 mg QD | Không | ||
| DOAC kháng đông đường uống trực tiếp, TNT thận nhân tạo, TTR: thời gian trong ngưỡng điều trị | |||||
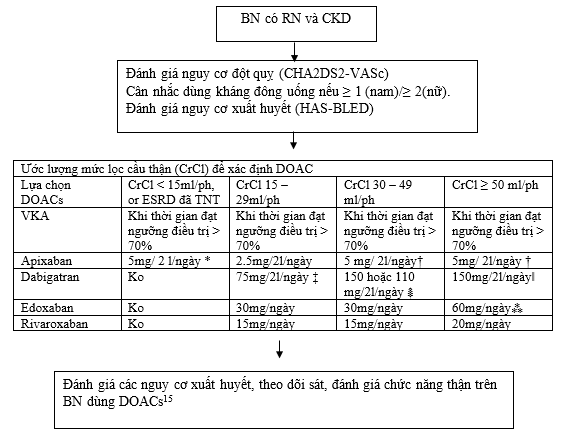
 Hình 4: Chiến lược tiếp cận kháng đông ở BN CKD15
Hình 4: Chiến lược tiếp cận kháng đông ở BN CKD15
IV.2. Theo dõi điều trị với heparins2,10 (Bảng 6):
Điều chỉnh liều theo aPTT được khuyến cáo với UFH để đạt được liều tối ưu (aPTT 1.5 – 2.0). Đối với LMWH đánh giá yếu tố kháng Xa hiệu chỉnh cho mỗi loại thuốc là bắt buộc trên CKD giai đoạn 4, 5. Xét nghiệm đầu tiên thực hiện lúc 2 – 4 giờ trước và sau liều đầu. Thông thường theo dõi 2 lần một tuần. Liều thấp khi đỉnh yếu tố đối kháng Xa < 0.5 UI/ml. Liều tối ưu đối với dự phòng là 0.1 – 0.3 UI/ml, đối với liều điều trị là 0.4 – 1 UI/ml. Khi không có guideline và hướng dẫn từ các nghiên cứu lâm sàng, sủ dụng phác đồ địa phương là phù hợp. Giảm tiểu cầu do heparin thì rất khó để kiểm soát trên ESRD, và fondaparinux thường chống chỉ định trong trường hợp này. Liều LMWH có thể chia đôi trong ngày nếu nguy cơ chảy máu cao.
| Bảng 6: chỉnh liều heparins dựa theo giai đoạn CKD (thực hiện bởi Hughes và cs, guideline ESC)2,10 | |||
| Kháng đông | Liều điều chỉnh theo GFR | ||
| 59 – 30 | 29 – 15 | < 15 | |
| Heparin không phân đoạn | Không chỉnh | Không chỉnh | Giảm < 33 %, liều tải 60 IU/kg, duy trì 12 IU/kg, điều chỉnh liều theo aPTT sau đó |
| Enoxaparin | Không chỉnh (1mg/kg/12 giờ)
VTE 1.5mg/kg QD (Mỹ) |
1mg/kg QD,
chỉnh liều theo nồng độ yếu tố kháng Xa (anti Xa: Iia: 3.9) |
|
| Dalteparin | HCVC (120 IU/kg/12 giờ)
VTE (100 IU/kg/12 giờ hoặc 200 IU/kg QD trong 1 tháng, sau đó 150 IU/kg QD trong 5 tháng, sau chuyển kháng đông uống/ LMWH) |
||
| Tinzaparin | VTE (175 Iu/kg QD) | Điều chỉnh theo anti-Xa khi GFR <20 (anti-Xa:Iia: 2.8 | |
| Fondaparinux | VTE: 50% liều so với khuyến cáo trên cân nặng
HCVC 2.5 mg QD |
VTE: không dùng GFR <30
HCVC: không dùng GFR <20 |
|
| Argatroban | Không chỉnh liều (0.5 – 2ug/kg/ph) – thải qua thận 15 % | ||
| HCVC: hội chứng vành cấp, VTE huyết khối tĩnh mạch, QD: 1 lần/ngày, BID: 2 lần /ngày | |||
- 3. Các bước theo dõi và những điều cần lưu ý ớ BN CKD có chỉ định dùng kháng đông21:
- Theo dõi INR và chức năng thận cần thực hiện mỗi 3-4 tuần trong 3 tháng đầu dùng kháng đông, INR thường tăng trong 6 – 8 tuần đầu khi bắt đầu dùng thuốc. Wafarin cần dùng từ liều thấp và điều chỉnh dần để tránh làm tăng quá nhanh INR.
- BN có CKD trung bình đến nặng (CrCl < 60ml/ph) cần đánh giá chức năng thận mỗi 3-6 tháng trong khi dùng kháng đông.
- Bất kì BN có INR trên ngưỡng điều trị cần đánh giá lại chức năng thận sớm nhất có thể. Chức năng thận cần được theo dõi sát cho đến khi INR về ngưỡng điều trị.
- Bất kì BN nào dùng kháng đông có chức năng thận giảm đáng kể cần đánh giá lại tình trạng thận, bao gồm tổng phân tích nước tiểu, điện giải đồ niệu, siêu âm thận. Nếu tất cả âm tính hoặc chỉ có tiểu máu đơn độc, cần chẩn đoán phân biệt với tổn thương thận cấp.
- Dữ liệu về độ an toàn của DOACs với độc thận và tăng nguy cơ tổn thương thận cấp còn hạn chế. Tuy nhiên, sau khi có kết luận từ những lần thử nghiệm warfarin gây nên bệnh lý thận, việc kiểm tra lại chức năng thận thường xuyên trong 3 tháng đầu khi dùng DOACs là rất cần thiết. (bảng 7)
| Bảng 7: Khuyến cáo tần suất theo dõi chức năng thận khi sử dụng kháng đông21 | ||||
| Trong 3 tháng đầu | Duy trì | |||
| GFR >60 ml/ph | 30-60 ml/ph | <30 ml/ph | ||
| Warfarin | 3-4 tuần | 6 tháng | 2-3 tháng | 2-3 tháng |
| DOAC | 3-4 tuần | 12 tháng | 6 tháng | 3 tháng |
- SỬ DỤNG THUỐC KHÁNG ĐÔNG ĐƯỜNG UỐNG TRÊN BN BỆNH THẬN NẶNG VÀ GIAI ĐOẠN CUỐI HOẶC ĐANG THẬN NHÂN TẠO (TNT):
V.1. Bệnh nhân CKD nặng(GFR 15-29 mL/min/1.73 m2 )13:
Các hướng dẫn điều trị trên thế giới đều khuyến cáo dùng warfarin hơn DOACs trên BN eGFR 15-30 ml/ph. Hiệp hội tim mạch Châu Âu khuyến cáo dùng kháng đông có thể an toàn khi dùng trên BN CKD trung bình đến nặng, nhưng không nhắc đến DOAC nào. Dữ liệu của BN CKD nặng dùng warfarin còn giới hạn, nhưng đã có những bằng chứng ủng hộ việc này. Warfarin thấp hơn về nguy cơ tử vong chung, đột quỵ, cơn thiếu máu não thoáng qua, mà không tăng nguy cơ xuất huyết khi so với 532 BN không dùng có eGFR < 30 ml/ph/1.73m2. Trong nghiên cứu Carrero,tỉ lệ nhập viện vì nhồi máu cơ tim hay đột quỵ thiếu máu não cũng giảm mà không làm tăng nguy cơ xuất huyết, cụ thể tỉ lệ tái nhập viện này là 8.1% (n=1966) trên BN CrCl 15 – 30 ml/ph, và những BN này có thời gian đạt trị liệu TTR rất cao.
Bằng chứng cho việc dùng DOACs còn giới hạn, liều dùng được dựa trên các nghiên cứu về dược động học của thuốc, thiếu bằng chứng trên thực tế. Nghiên cứu RE-LY loại trừ những BN có CrCl < 30 ml/ph; tuy nhiên, khuyến cáo dùng liều dabigatran 75 mg/2l/ngày cho BN CrCl 15 – 30 ml/ph. Trong nghiên cứu ROCKER-AF, BN có CrCl 15 – 30 ml/ph không được nghiên cứu, nhưng FDA cho phép rivaroxaban 15 mg/ngày có hiệu quả tương đương liều 20 mg/ngày trên BN có chức năng thận bình thường dựa trên nghiên cứu về dược động học. Nhìn chung, dữ liệu cho warfarin và DOACs trên BN CKD nặng còn giới hạn. Tuy nhiên, nhiều nghiên cứu ủng hộ warfarin, trong khi DOACs còn bị giới hạn nhiều vì đặc tính dược động học và thiếu dữ liệu trên lâm sàng.
V.2. Bệnh nhân CKD giai đoạn cuối hoặc lọc thận nhân tạo (GFR < 15 mL/min/1.73 m2 or dialysis)13,14,24:
Nhiều nghiên cứu quan sát đã đưa ra nhiều tranh cãi về kết quả đối với VKA liên quan đến hiệu quả khi dùng trên BN có CKD nặng. Khi sử dụng VKA thì hiệu quả ghi nhận giảm đáng kể tần suất mắc đột quỵ và huyết khối, nhưng cũng làm tăng đáng kể nguy cơ xuất huyết. Một số bác sĩ tim mạch và thận học (50.7% và 49.5%) không chỉnh liều đối với suy thận, một số khác thì chỉnh liều đối với từng giá trị eGFR/CrCl cụ thể, và khoảng (2.2% bs tim mạch và 8.3% bác sĩ thận học) sẽ không dùng kháng vitamin K trên BNRN có suy thận nặng hoặc đang thận nhân tạo.Chú ý rằng việc dùng warfarin trên BN CKD giai đoạn cuối trong một số trường hợp có thể gây nên chứng calci hóa mạch máu và calciphylaxis, tình trạng nguy hiểm do tắc nghẽn các động mạch và tiểu động mạch dưới da.
Hiện nay, hiệu quả và an toàn của DOACs trên BN CKD giai đoạn cuối và TNT là chưa rõ ràng và cần phải nghiên cứu thêm. Tỉ lệ các BS lâm sàng cần hội chẩn chuyên khoa khác tăng lên với việc tăng mức độ nặng của CKD, và có một số bằng chứng hướng đến việc dùng VKAs và apixaban hoặc edoxaban (và, rivaroxaban) tốt hơn là dabigatran trên BN CKD nặng hoặc TNT. Một nghiên cứu sổ bộ cho thấy có sự tăng lên về tỉ lệ tái nhập viện và tử vong do xuất huyết do DOACs trên BN TNT khi thử nghiệm mù đôi dabigatran và rivaroxaban so với VKA. Trong một nhóm nhỏ BN TNT apixaban 2.5 mg 2 lần / ngày tỏ ra an toàn. Tương tự với liều edoxaban 15 mg/ngày (những BN Nhật Bản với chức năng thận rất xấu), rivaroxban 10 mg /ngày trên BN CKD giai đoạn cuối.
Không có dữ liệu cho việc dùng DOACs trên BN RN đã được ghép thận. Nếu DOACs được dùng trên nhóm BN này, liều cần được cân nhắc dựa trên ước đoán chức năng thận, và thận trọng trong các tương tác thuốc giữa NOAC và các thuốc ức chế miễn dịch chống thải ghép7.
Trên những BN ESRD, AHA/ACC/HRS guideline khuyến cáo dùng warfarin như là lựa chọn đầu tay (Class IIa, LOE B). AHA/ACC/HRS guideline không khuyến cáo dabigatran hoặc rivaroxaban vì thiếu bằng chứng (Class III, LOE C). CCS guideline không thể đưa ra khuyến cáo dùng kháng đông thường quy trên BN TNT vì thiếu bằng chứng. ESC không đưa ra khuyến cáo cụ thể, những nghiên cứu đối chứng dùng kháng đông cần được tiến hành trên BN TNT. Warfarin được xem là điều trị tiêu chuẩn cho dự phòng huyết khối liên quan đến RN trên BN TNT, nhưng hiệu quả vẫn còn nhiều bàn cãi22,23.
- PHƯƠNG PHÁP THAY THẾ KHÁNG ĐÔNG17:
Mặc dù nằm bên ngoài phần muốn đề cập, nhưng nó khá quan trọng để nhắc đến phương pháp thay thế kháng đông trên BN RN kèm CKD mà không thể dùng kháng đông. Cụ thể, đóng tiểu nhĩ trái (left atrial appendage closure-LAAO) đã đang được cải tiến như là một phương pháp thay thế kháng đông. Gần đây có một nghiên cứu quan sát cho thấy có sự giống nhau về độ an toàn và hiệu quả của phương pháp này trên 2 nhóm BN có CKD và BN không CKD. LAAO có thể là phương thức nhiều tiềm năng trong việc dự phòng đột quỵ trên nhóm BN này. Nghiên cứu đoàn hệ đầu tiên PROTECT AF sử dụng dụng cụ WATCHMAN, cho thấy có giảm nguy cơ chung về tử vong và đột quỵ trong nhóm BN có RN. Năm 2015, FDA đã công nhận dụng cụ WATCHMAN có thể dùng trên BN RN mà không thể duy trì kháng đông uống lâu dài. So sánh giữa LAAO và kháng đông uống trên BN có CKD, nghiên cứu thực hiện bởi Kefer và cộng sự đã dùng ACP Amplatzer cardiac plug nút chẹn tiểu nhĩ. Họ đã cho thấy sự an toàn tương đương giữa các thiết bị LAAO trên BN có CKD và BN có chức năng thận bình thường và có sự giảm đáng kể nguy cơ đột quỵ và nguy cơ xuất huyết lớn.
Genovesi và cộng sự cũng cho thấy sự an toàn của thiết bị LAAO trên BN ESRD. Nhìn chung, thiết bị LAAO được cho thấy làm giảm đáng kể đột quỵ. Việc sử dụng trên BN có chức năng thận giảm thì an toàn và hiệu quả, cho thấy đây là một hướng đi mới cho việc nghiên cứu các thiết bị LAAO trên BN ESRD kèm RN.
Cuối cùng, một nghiên cứu sổ bộ đã cho thấy bằng chứng cho việc dùng warfarin trên BN ERSD kèm rung nhĩ thì không thay đổi tần suất mắc đột quỵ thiếu máu não. Kháng đông khác ngoài warfarin bao gồm DOACs, kháng kết tập tiểu cầu dùng kèm hoặc không warfarin, và dụng cụ LAAO có thể được nghiên cứu thêm để sử dụng trên BN ESRD kèm RN.
VII. kết luận:
Sự suy giảm chức năng thận GFR ảnh hưởng đáng kể lên tử vong chung và các biến cố tim mạch, đặc biệt với BN có CKD trước đó, điều đó đặc biệt quan trọng khi có những nhiên cứu được thiết kế tốt để tìm ra được cách sử dụng kháng đông một các an toàn nhất trên phương diện thận học. Phối hợp giữa các chuyên khoa tim mạch, thận học, và huyết học để làm sáng tỏ các khía cạnh lâm sàng và sinh lý của kháng đông khởi kích bệnh lý thận, và cải thiện việc dùng kháng đông trên từng cá thể trong tương lai20.
Trên BN RN kèm CKD gây nên tình trạng vừa tăng nguy cơ xuất huyết lẫn hình thành huyết khối. Với việc dùng DOACs, nhiều phác đồ lựa chọn, và có thể lựa chọn dựa trên mức độ CKD. Đối với CKD nhẹ đến trung bình, warfarin và DOACs cả 2 đều được, nhưng DOACs thì an toàn và hiệu quả hơn11. Trên CKD nặng, tuy chứng cứ giới hạn nhưng cho thấy warfarin có hiệu quả hơn. FDA đã công nhận việc giảm liều DOACs dựa trên nghiên cứu dược động học, nhưng lại thiếu bằng chứng trên tiêu chí lâm sàng. Trên BN ESRD và BN TNT, đa phần các bằng chứng không đủ cho việc ủng hộ lợi ích của warfarin mặt khác lại làm tăng nguy cơ xuất huyết. Vẫn còn nhiều hạn chế dữ liệu trong việc dùng DOACs, nhưng apixaban đã được FDA công nhận, với nghiên cứu hồi cứu gần đây ủng hộ cả sự an toàn lẫn hiệu quả của nó. Những nghiên cứu trong tương lai cần thực hiện đối với BN ESRD và TNT đang được thiết kế khá tốt, những nghiên cứu đối chứng đang đặt ra câu hỏi liên quan đến mức độ hiệu quả và sự an toàn của cả warfarin và apixaban.
Tài liệu tham khảo:
- Boriani G, Proietti M, Laroche C, Fauchier L, Marin F, Nabauer M et al.; EORP- AF Long-Term General Registry Investigators. Contemporary stroke prevention strategies in 11 096 European patients with atrial fibrillation: a report from the EURObservational Research Programme on Atrial Fibrillation (EORP-AF) Long- Term General Registry. Europace 2018;20:747–57.
- Hs ET AL: Atrial Fibrillation and Chronic Kidney Disease: A Review of Options for Therapeutic Anticoagulation to Reduce Thromboembolism Risk. Clinical Cardiology 2018. Doi: 10.1002/clc.23085
- CDC: Division for Heart Disease and Stroke Prevention-Atrial Fibrillation Fact Sheet. Available online: http://www.cdc.gov/dhdsp/data_statistics/fact_sheets/fs_atrial_fibrillation.htm (accessed on 18 December 2019).
- ChanKE,LazarusJM,ThadhaniR,HakimRM.Warfarinuseassociateswithincreasedriskforstrokein hemodialysis patients with atrial fibrillation. J Am Soc Nephrol. 2009;20(10):2223-2233. doi:10.1681/ASN. 2009030319
- ChenJJ,LinLY,YangYH,HwangJJ,ChenPC,LinJL.Anti-plateletoranti-coagulantagentforthepreventionof ischemic stroke in patients with end-stage renal disease and atrial fibrillation—a nation-wide database analyses. Int J Cardiol. 2014;177(3):1008-1011. doi:10.1016/j.ijcard.2014.09.140
- Connolly, S.J.; Ezekowitz, M.D.; Yusuf, S.; Eikelboom, J.; Oldgren, J.; Parekh, A.; Wang, S. Dabigatran versus warfarin in patients with atrial fibrillation. Engl. J. Med. 2009, 361, 1139–1151. [CrossRef]
- Estella Davis 1,*, Dallin Darais 2,Prescribing and Safety of Direct-Acting Oral Anticoagulants Compared to Warfarin in Patients with Atrial Fibrillation on Chronic Hemodialysis
- KP Ng, NC Edwards, GYH Lip,Atrial Fibrillation in CKD: Balancing the Risks and Benefits of Anticoagulation,Volume 62, Issue 3, September 2013, Pages 615-632
- FusterV,RydénLE,CannomDS,etal.2011ACCF/AHA/HRSfocusedupdatesincorporatedintothe ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines developed in partnership with the European Society of Cardiology and in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. J Am Coll Cardiol. 2011;57(11):e101-e198. doi:10.1016/j.jacc.2010.09.013
- Hughes S, Szeki I, Nash MJ, Thachil J. Anticoagulation in chronic kidney disease patients – the practical aspects. Clin Kidney J. 2014;7: 442-449. Jan Steffel et al,The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation, European Heart Journal, Volume 39, Issue 16, 21 April 2018, Pages 1330–1393,https://doi.org/10.1093/eurheartj/ehy136
- JanuaryCT,WannLS,AlpertJS,etal;AmericanCollegeofCardiology/AmericanHeartAssociationTaskForceon Practice Guidelines. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol. 2014;64(21):e1-e76. doi:10.1016/j.jacc.2014.03.022
- Jain N, Reilly RF. Clinical pharmacology of oral anticoagulants in patients with kidney disease. Clin J Am Soc Nephrol. 2019;14(2): 278-287
- Kevin E. Chan, MD MSc,Dabigatran and Rivaroxaban Use in Atrial Fibrillation Patients on Hemodialysis,downloaded from http://circ.ahajournals.org/at cons california dig lib on january 19, 2015.
- Konstantinos C. Siontis, MD.Outcomes Associated With Apixaban Use in Patients With End-Stage Kidney Disease and Atrial Fibrillation in the United States
- Lau, Y.C.; Proietti, M.; Guiducci, E.; Blann, A.D.; Lip, G.Y. Atrial fibrillation and thromboembolism in patients with chronic kidney disease. Am. Coll. Cardiol. 2016, 68, 1452–1464. [CrossRef] [PubMed]
- GY et al: Stroke Prevention in Atrial Fibrillation A Systematic Review. JAMA. 2015;313(19):1950-1962
- Mandeep S. Randhawa, Association Between Use of Warfarin for Atrial Fibrillation and Outcomes Among Patients With End-Stage Renal Disease A Systematic Review and Meta-analysis
- Roffi M, Patrono C, Collet JP, et al.: 2015 ESC guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation – Web Addenda. Task force for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2016;37(3):267–315.
- ShahM,AvgilTsadokM,JackeviciusCA,etal.Warfarinuseandtheriskforstrokeandbleedinginpatientswith atrial fibrillation undergoing dialysis. Circulation. 2014;129(11):1196-1203. doi:10.1161/CIRCULATIONAHA.113. 004777
- Sarmad Said et al, The link between chronic kidney disease and cardiovascular disease,Published online 2014 Jul 1. doi: 12860/jnp.2014.19.
- Steffel J, Verhamme P, Potpara TS, et al The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation-European Heart Journal, Volume 39, Issue 16, 21 April 2018, Pages 1330-1393 https://doi.org/10.1093/eurheartj/ehy136
- United States Renal Data System. 2018 USRDS Annual Data Report: Chapter 4: Cardiovascular Disease of Patients with CKD; National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases: Bethesda, MD, USA, 2018. Available online: https://www.usrds.org/2018/view/v1_04.aspx (accessed on 18 December 2019).
- Viviana Aursulesei, Anticoagulation in chronic kidney disease: from guidelines to clinical practice,Clinical Cardiology. 2019;42:774–782,doi: 10.1002/clc.23196
- WakasugiM,KazamaJJ,TokumotoA,etal.Associationbetweenwarfarinuseandincidenceofischemicstroke in Japanese hemodialysis patients with chronic sustained atrial fibrillation: a prospective cohort study. Clin Exp Nephrol. 2014;18(4):662-669. doi:10.1007/s10157-013-0885-6
- WinkelmayerWC,LiuJ,SetoguchiS,ChoudhryNK.Effectivenessandsafetyofwarfarininitiationinolder hemodialysis patients with incident atrial fibrillation. Clin J Am Soc Nephrol. 2011;6(11):2662-2668. doi:10.2215/ CJN.04550511
- ZimmermanD,SoodMM,RigattoC,HoldenRM,HiremathS,ClaseCM.Systematicreviewandmeta-analysisof incidence, prevalence and outcomes of atrial fibrillation in patients on dialysis. Nephrol Dial Transplant. 2012;27 (10):3816-3822. doi:10.1093/ndt/gfs416







