TS. PHẠM HỮU VĂN
- Mở đầu
Rối loạn nhịp tim đại diện cho một nguyên nhân quan trọng gây ra rối loạn chức năng tâm thu thất trái có thể điều trị hồi phục. [1- 8] Tuy nhiên, rối loạn nhịp tim có thể ít được ghi nhận đưa đến chậm trễ trong can thiệp. [9] Với sự ra đời của triệt phá qua catheter, một công cụ hiệu quả có sẵn có thể khôi phục nhịp xoang mà không có tác dụng bất lợi của độc tính thuốc. [9,10] Với mục đích của bài này, chúng tôi sẽ sử dụng thuật ngữ bệnh cơ tim do rối loạn nhịp (Arrhythmia-induced cardiomyopathies: AIC) đề cập đến tình trạng tập hợp bệnh cơ tim do nhịp nhanh và nhịp ngoại vị gây ra. Rung tâm nhĩ (AF) và suy tim (HF) là bệnh dịch hiện nay thường cùng tồn tại và làm trầm trọng lẫn nhau. [11] Các nghiên cứu CAMERA MRI [7] và CASTLE ‐ AF2 là hai nghiên cứu quan trọng làm nổi bật vai trò của rung nhĩ trong suy tim tâm thu. Chúng tôi mong muốn qua bài viết này cung cấp một cái nhìn tổng quan về sự hiểu biết về bằng chứng hiện tại trong điều trị và quản lý AIC, tập trung đặc biệt vào bệnh cơ tim qua trung gian AF và đề xuất các phương pháp để nhận biết, sàng lọc và quản lý AIC.
- Khái niệm về bệnh cơ tim do loạn nhịp (AIC)
Bệnh cơ tim do rối loạn nhịp gây ra được mô tả lần đầu tiên vào năm 1913 nhưng mãi đến năm 1962, tính chất có thể đảo ngược của tình trạng này mới được đánh giá cao. [12,13] AIC được xác định bằng rối loạn nhịp trên thất hoặc thất vừa đủ để gây ra rối loạn chức năng tâm thu thất trái (LV). [9] Rối loạn nhịp tim có thể hoặc dai dẳng, hoặc thành cơn, hoặc hoạt động ngoại vị thường xuyên một cách cao. [9,14,15] Rối loạn nhịp trong quá trình đó đi trước sự phát triển của rối loạn chức năng LV thường khó để xác định khi khởi phát triệu chứng thường giả dạng (insidious) với mệt mỏi tiến triển và khó thở không có hồi hộp. Trong các mô hình động vật, AIC có thể được tái tạo với tốc độ nhanh trong 1‐2 tháng. [16] Một khi rối loạn nhịp tim được sửa chữa phục hồi chức năng LV được nhận thấy trong vòng 6 tuần. [10] Hầu hết bệnh nhân mắc AIC có thể mong đợi để cải thiện chức năng LV của họ đến mức bình thường với tiên lượng toàn bộ tốt. Tuy nhiên, có một nguy cơ nhỏ về đột tử do tim, đặc biệt là trong tình trạng tái phát loạn nhịp tim hoặc trong đó bệnh cơ tim là nguyên nhân hỗn hợp bao gồm cả bệnh mạch vành. [10,17] AIC có thể xảy ra với một loạt các rối loạn nhịp tim (Bảng 1). Tỷ lệ mắc AIC được ước tính là 8% ‐28% với nhịp nhanh nhĩ ổ (FAT) và 10% – 34% bệnh nhân với phức hợp thất sớm (PVC) và nhịp nhanh thất tạm thời (VT). [18] Chỉ cho đến gần đây, định nghĩa về AIC mới bắt đầu gồm rối loạn nhịp tim khác với nhịp tim nhanh. [8] Rối loạn nhịp tim gây ra bệnh cơ tim có một phạm vi rộng các biểu hiện lâm sàng và có thể chịu trách nhiệm hoàn toàn cho bệnh cơ tim (Type 1) hoặc góp phần vào bệnh cơ tim cơ bản (Type 2). [19] Do đó, hai loại AIC đã được đề xuất. [9,20].
- Type 1 AIC: Rối loạn nhịp được bao gồm. Đây là khi rối loạn nhịp tim chỉ chịu trách nhiệm về AIC và chức năng LV trở lại bình thường sau khi điều trị thành công chứng loạn nhịp tim. [9]
- Type 2 AIC: Rối loạn nhịp tim qua trung gian. Rối loạn nhịp tim làm trầm trọng thêm bệnh cơ tim nền và điều trị rối loạn nhịp tim dẫn đến giải quyết một phần bệnh cơ tim. [9]
BẢNG 1. Một loạt các rối loạn nhịp nhĩ và thất đã được báo cáo liên quan đến AIC.
| Các nguyên nhân của AIC qua trung gian nhịp nhanh | |
| Trên thất | Rung nhĩ [2,7]
Nhịp nhanh nhĩ ngoại vị [25,26] Cuồng nhĩ Nhịp nhanh vào lại nút nhĩ thất Nhịp nhanh vào lại nhĩ thất Nhịp nhanh bộ nối lặp lại thường xuyên |
| Thất | Co bóp thất sớm (PVC) [14,54]
Nhịp nhanh thất (gánh nặng cao) |
- Sinh bệnh học của AIC
Rối loạn nhịp tim gây ra bệnh cơ tim dường như được qua trung gian thông qua ba cơ chế sau đây với sự chồng chéo đáng kể giữa các yếu tố này (Hình 1):
- Nhịp nhanh
- Nhịp không đều
- Mất đồng bộ
Trong các mô hình động vật, rối loạn chức năng LV có thể tái tạo một cách tương đối với tạo nhịp nhanh trong phạm vi vài tuần khởi phát nhịp nhanh. Ba giai đoạn đã được báo cáo trong kiểu hình này. [9]
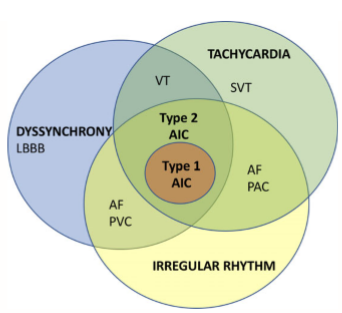
Hình 1. Cơ chế chồng chéo trong AIC.
Sơ đồ biểu hiện các cơ chế liên quan đến AIC với sự chồng chéo đáng kể giữa các yếu tố này. AIC: Bệnh cơ tim do rối loạn nhịp gây ra, SVT: Nhịp nhanh trên thất, AF: Rung tâm nhĩ, PAC: Phức hợp nhĩ sớm, PVC: Phức hợp thất sớm, VT: Nhịp nhanh thất, LBBB: block nhánh bó. Dyssynchrony: rối loạn đồng bộ. Tachycardia: nhịp nhanh. Irregular rhythm: nhịp không đều.
Phase 1: Giai đoạn còn bù (> 7 ngày). Trong giai đoạn này, có sự kích hoạt hoc-môn thần kinh tăng lên với những thay đổi sớm đối khuôn khổ tế bào dự trữ (để dành) và chức năng thất trái tâm thu được bảo tồn.
Phase 2: Giai đoạn rối loạn chức năng LV (1-3 tuần). Tiếp tục kích hoạt hoc-môn thần kinh và điều hòa lại hệ thống angiotensin renin. Có sự tái cấu trúc tế bào, rối loạn chức năng co bóp với rối loạn chức năng tâm thu và giãn LV.
Phase 3: Giai đoạn suy LV (> 3 tuần). Tái cấu trúc LV xấu hơn tiếp theo với suy bơm, giãn nghiêm trọng và điều khiển (handling) canxi nội bào bất thường.
Ở người, AIC khó dự đoán hơn với yếu tố thứ phát, có khả năng là nhạy cảm di truyền, để giải thích tại sao một gánh nặng rối loạn nhịp tim tương tự có thể có tác động thay đổi như vậy đối với chức năng tâm thu ở những người khác nhau.[10] Nhịp tim > 100 bpm [4] và > 15% mỗi ngày có khả năng dẫn đến AIC. [20] Thời điểm khởi phát rối loạn nhịp tim đến biểu hiện lâm sàng hoặc thoái biến LV có thể rất khác nhau và phụ thuộc vào thời gian rối loạn nhịp kéo dài, bệnh tim cấu trúc cùng tồn tại và tuổi của bệnh nhân. Cơ chế của bệnh cơ tim qua trung gian nhịp nhanh chưa được hiểu đầy đủ, tuy nhiên, có thể bao gồm thiếu máu cục bộ dưới lâm sàng, stress oxy hóa, xử lý canxi bất thường và gián đoạn dẫn đến dự trữ năng lượng với sự suy giảm ATP. Ở cấp độ tế bào có mất liên hệ các sợi cơ tim, kéo dài tế bào, mất sarcomere và suy giảm tế bào cơ tim [4,16,21] dẫn đến sự gia tăng đường kính cuối tâm trương LV (LVEDD). Hoạt động tế bào thần kinh hormon được đặc trưng bằng tăng mức độ Epinephrine, norepinephrine, hoạt động renin‐aldosterone, và plasma atrial natriuretic peptide.[22] (Xem hình 2).
- Nhịp nhanh và AIC
Nhịp tim nhĩ ổ (FAT) là nguyên nhân gây ra AIC được ghi nhận rõ dệt với tỷ lệ mắc AIC ở bệnh nhân FAT là 8,3% – 10%. [23,24] Medi và cộng sự đã báo cáo loạt lớn nhất cho đến nay là 30 bệnh nhân (với AT liên hồi ở 29 bệnh nhân) với nhịp nhanh nhĩ ổ và rối loạn chức năng tâm thu LV từ toàn bộ quần thể 345 bệnh nhân trải qua triệt phá qua catheter cho FAT trong giai đoạn 10 năm. [25] Chiều dài chu kỳ nhịp nhanh và tần số đáp ứng thất đã chậm hơn ở các bệnh nhân TCM hơn các bệnh nhân FAT và chức năng tâm thu LV giảm. Các tĩnh mạch phổi và tận cùng eo (Hình 3) là vị trí giải phẫu thường hơn đối với nhịp nhanh liên hồi. [26] Triệt phá qua catheter thành công ở 25 trên 30 bệnh nhân TCM với sự phục hồi hoàn toàn chức năng LV 96%
Cuồng nhĩ có thể được kết hợp với rối loạn chức năng LV lên đến 25% với phần lớn các trường hợp cải thiện chức năng LV sau khi chấm dứt rối loạn nhịp tim. [27]
Nhịp tim nhanh trên thất (SVT) như nhịp nhanh lặp lại nút nhĩ thất (Atrioventricular nodal reciprocating tachycardia: AVNRT),[28] và nhịp nhanh lặp lại nhĩ thất (Atrioventricular reciprocating tachycardia: AVRT) hiếm khi được liên kết với AIC vì các cơn xẩy ra không thường xuyên. [29] Tuy nhiên, nhịp nhanh lặp lại bộ nối (junctional reciprocating tachycardia: PJRT), hình thái của SVT dai dẳng hơn thường phổ biến hơn ở trẻ em và có sự kết hợp với AIC tăng lên. [15]
Nhịp tim nhanh thất nguyên phát (VT) xuất phát từ đường ra, nếu thường xuyên hoặc kéo dài, có thể dẫn đến AIC. Các ổ có khả năng đáp ứng thường bắt nguồn từ đường ra thất phải (right ventricular outflow tract: RVOT), nhưng không giới hạn ở đường thoát lưu thất phải (RVOT) và mang tiên lượng tốt khi rối loạn nhịp tim được phục hồi và chức năng LV được phục hồi. [30] Trong một loạt, 7% bệnh nhân mắc PVC thường xuyên đã có VT đơn hình dai dẳng và 7% trong số họ có AIC. [31]
Nhịp tim nhanh thất nguyên phát (VT) xuất phát từ đường ra, nếu thường xuyên hoặc kéo dài, có thể dẫn đến AIC. Các ổ có khả năng đáp ứng thường bắt nguồn từ đường ra thất phải (right ventricular outflow tract: RVOT), nhưng không giới hạn ở đường thoát lưu thất phải (RVOT) và mang tiên lượng tốt khi rối loạn nhịp tim được phục hồi và chức năng LV được phục hồi. [30] Trong một loạt, 7% bệnh nhân mắc PVC thường xuyên đã có VT đơn hình dai dẳng và 7% trong số họ có AIC. [31]
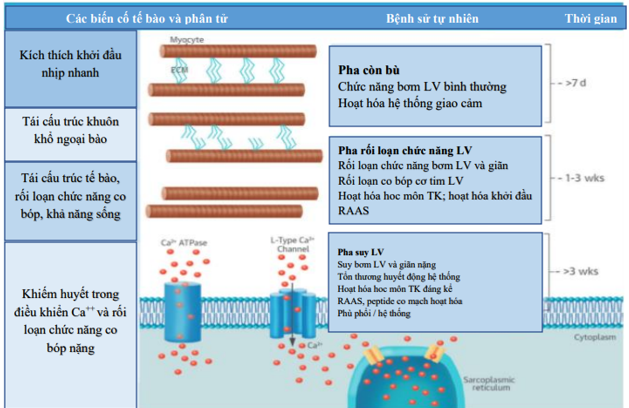
Hình 2. Thay đổi tế bào và phân tử trong cơ tim với nhịp tim nhanh.
Đáp ứng tế bào và phân tử phụ thuộc thời gian có thể dự bào đối với tại nhịp thất nhanh ở động vật liên quan đến cả hai khuôn khổ ngoài tế bảo (extracellular matrix: ECM) và tái cấu trúc tế bào. Có sự mất đi khuôn khổ ngoại bào và kiến trúc xảy ra qua ba giai đoạn: Còn bù (> 7 ngày), giai đoạn rối loạn chức năng LV (1‐3 tuần), suy LV (> 3 tuần). LV: Tâm thất trái. ATPase: adenosine triphosphatase; RAAS: hệ thống renin ‐ angiotensin ‐ aldosterone. Sarcoplasmic reticulium: Lưới cơ tương. Cytoplasm: bào tương.
- Bệnh cơ tim qua trung gian rung nhĩ (AF)
Rung tâm nhĩ là nguyên nhân phổ biến nhất của AIC ở người trưởng thành [9,10,32] và kết hợp giữa AF và AIC đã được mô tả rõ. AF và HF là những dịch bệnh hiện thời thường cùng tồn tại và thúc đẩy lẫn nhau. [11] Trong nghiên cứu Framingham, những người bị AF có nguy cơ phát triển HF cao hơn (HR 2,22 [CI 1,47‐3,34] P < 0,0001). [11] Các cơ chế sinh lý bệnh cơ bản phát triển hoặc tiến triển của bệnh cơ tim ở bệnh nhân AF gồm: nhịp tim nhanh, nhịp tim không đều, mất chức năng tâm thu nhĩ và các yếu tố di truyền.
Co bóp không đều dẫn đến hậu quả huyết động bất lợi không phụ thuộc vào nhịp tim. [33,34] Sự đóng góp của không đều được chứng minh ở các bệnh nhân với AF được kiểm soát tần số và rối loạn chức năng LV, người đã cải thiện chức năng LV sau triệt phá nút nhĩ thất sau đó được làm đều nhịp thất bằng tạo nhịp. [33,35] Hơn nữa, rối loạn chức năng nhĩ thất có thể làm giảm khả năng đổ đầy tâm trương, từ đó làm xấu đi chức năng tâm trương, do đó dẫn đến tăng áp lực bên trái và tái cấu trúc nhĩ xấu đi, từ đó duy trì AF. [36,37] Co bóp tâm nhĩ phối hợp đóng góp tới 20% cung lượng tim và mất co bóp tâm nhĩ ảnh hưởng xấu đến cung lượng tim trong AF. [8,33,38]
Có khả năng AF không che dấu xu hướng cơ bản và khả năng mẫn cảm để phát triển bệnh cơ tim ở các bệnh nhân có AIC. [37] Một loạt các đột biến gen như mã hóa các phân tử liên quan đến chức năng hợp đồng, tính toàn vẹn của tế bào và / hoặc cấu trúc tế bào học đã được liên quan đến bệnh cơ tim không do thiếu máu. [39] Hơn 50 gen gây bệnh đã được liên quan đến bệnh cơ tim giãn (DCM) và có thể được xác định ở 30% bệnh nhân. Bốn gen chính bao gồm Titin (TTN), lamin A / C (LMNA), chuỗi nặng β‐myosin (MYH7) và gen troponin T tim (TNNT2). [40]
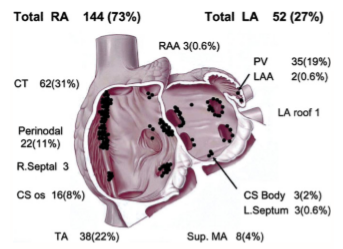
Hình 3. Nơi phát ra nhịp nhanh nhĩ ngoại vi. Diễn tả sơ đồ phân bố giải phẫu các nhịp nhanh nhĩ ổ. Total RA: toàn bộ nhĩ phải. Total LA: toàn bộ nhĩ trái. CS: xoang vành; CT: Mào tận cùng (crista terminalis); LA: tâm nhĩ trái; LAA: tiểu nhĩ nhĩ trái; MA: vòng hai lá; PV: tĩnh mạch phổi; RA: tâm nhĩ phải; RAA: phần phụ nhĩ phải; TA: vòng ba lá.
Cho đến gần đây, việc kiểm soát tần số được cho là phù hợp trong việc quản lý AIC do AF gây ra. [9,41] Thử nghiệm AF ‐ CHF không cho thấy lợi thế sống sót ở bệnh nhân có triệu chứng suy tim NYHA class 2/3 và LVEF <35% ngẫu nhiên để kiểm soát tần số bằng thuốc và kiểm soát nhịp. Tuy nhiên, nhiều nghiên cứu ngẫu nhiên (Xem Bảng 2) với triệt phá qua catheter như chiến lược kiểm soát nhịp đã chứng minh ưu thế của phục hồi nhịp xoang với triệt phá khi so sánh với điều trị thuốc. [42 .46] Một đánh giá có hệ thống về 19 nghiên cứu (914 bệnh nhân) cho thấy 13.3% cải thiện (95% CI 115 đến 16%) trong LV EF ở những bệnh nhân được triệt phá qua catheter để phục hồi nhịp xoang. [47] Mặc dù các hướng dẫn về suy tim hiện tại vẫn chưa bao gồm triệt phá AF ở những người HF, nhưng điều này có khả năng thay đổi đặc biệt là trong các thử nghiệm CAMERA – MRI và CASTLE ‐ AF gần đây. [1,6,7]
Trong thử nghiệm CAMERA ‐ MRI, 7 68 bệnh nhân AF và bệnh cơ tim nguyên phát (EF <45%) được chọn ngẫu nhiên (1: 1) để kiểm soát tần số tối ưu hoặc triệt phá qua catheter để phục hồi nhịp xoang và theo dõi trong 6 tháng. Bệnh nhân bị bệnh động mạch vành đáng kể và các nguyên nhân thực thể khác cho bệnh cơ tim đã được loại trừ. Độ tuổi trung bình là 60 tuổi với chỉ số EF là 33 ± 8,6% và điểm CHA2DS2Vasc là 2,4 ± 0,9. Tất cả các bệnh nhân đều được tính toán các thuốc chống suy tim với 97% là beta blockers và 94% là ức chế hệ thống renin angiotensin aldosterone. Thời gian cho thuốc 4 tuần trong khoảng được đảm bảo tối ưu hóa kiểm soát tần số ở cả hai nhóm với nhịp tim lúc nghỉ là 78 ± 18 bpm. Bệnh nhân được chọn ngẫu nhiên để triệt phá được thực hiện cô lập tĩnh mạch phổi và thành sau [48] với gánh nặng rối loạn nhịp được chứng minh bằng máy ghi vòng lập cấy vào cơ thể. Tiêu chí đầu tiên cao có ý nghĩa với EF cải thiện tuyệt đối là 18,3% ở phía triệt phá qua catheter so với 4,4% ở phía kiểm soát tần số bằng thuốc (P <0,0001). Sự vắng mặt của việc tăng cường gadolinium muộn (LGE) trên MRI cho thấy kết quả tốt hơn với sự cải thiện tuyệt đối của LVEF là 22% ở LGE âm tính so với 11% ở nhóm dương tính LGE (P = 0,0069). Năm mươi ‐ tám phần trăm bệnh nhân ở phía triệt phá qua catheter đã bình thường hóa EF so với chỉ 9% ở nhánh kiểm soát tần số. Triệt phá qua catheter có liên quan đến sự cải thiện trong class NYHA và giảm BNP
Nghiên cứu CASTLE ‐ AF2 mang tính bước ngoặt là một nghiên cứu quốc tế đa trung tâm, ngẫu nhiên với 363 bệnh nhân được triệt phá qua catheter so với điều trị nội khoa (kiểm soát tần số hoặc nhịp). Có sự khác biệt quan trọng trong dân số nghiên cứu so với thử nghiệm CAMERA – MRI. Các tiêu chí bao gồm cả AF kịch phát và dai dẳng, LVEF ≤ 35% với thiếu máu cục bộ (40% ‐50%) và / hoặc nguồn gốc không do thiếu máu. Tất cả các bệnh nhân đều cấy máy khử rung tim hai buồng (ICD) hoặc máy khử rung tim đồng bộ hóa tim (CRT D)
Tiêu chí đầu tiên của hỗn hợp tử vòng do bất kỳ nguyên nhân hoặc nhập viện vì suy tim là thấp hơn đáng kể ở phía triệt phá (51 bệnh nhân [28,5%] so với 82 bệnh nhân [44,6%]; HR 0,62; 95% CI 0,43‐0,87; P = 0,007) trong thời gian theo dõi trung bình 37 tháng. Tiêu chí tử vong lớn thứ hai do bắt kỳ nguyên nhân ít hơn có ý nghĩa ở phía triệt phá (24 [13,4%] đối lại 46 [25%]; HR, 0,53; P = 0,01) với ít nhập viện hơn do suy tim xấu đi (37 [20,7] đối lại 66 [35,9]; HR 0,56; P = 0,004) hoặc tử vong do tim mạch (HR 0,49; P = 0,009). Phân suất tống máu được cải thiện tuyệt đối là 8% sau 60 tháng ở nhóm cắt bỏ so với 0% ở nhóm điều trị thuốc. Phân tích phân nhóm đã chứng minh lợi ích lớn hơn trong LVEF là 25% 35% so với <25%. Cả tỷ lệ tử vong thấp và nhập viện suy tim đều đóng góp vào tiêu chí đầu tiên, nhưng tác dụng suy tim rõ ràng sớm hơn 6 tháng so với lợi ích tử vong trở nên đáng kể sau 3 năm. Nền tảng của chiến lược triệt phá là cô lập tĩnh mạch phổi (PVI) với cô lập tĩnh mạch phổi bổ xung theo sự cắt bỏ bổ sung theo toàn quyền quyết định của người thực hiện. Gánh nặng AF trong nhóm triệt phá là 20% 27% đối lại 48% ‐64% trong nhóm điều trị thuốc
Hai thử nghiệm quan trọng này cho thấy tầm quan trọng của việc phục hồi nhịp xoang bằng triệt phá qua catheter ở bệnh nhân AF và suy tim tâm thu với những cải thiện về LVEF, chất lượng cuộc sống, nhập viện do suy tim và tổng tử suất.
- Bệnh cơ tim do ngoại tâm thu thất
Tỷ lệ mắc AIC ở bệnh nhân PVC được ước tính từ 9% đến 34% .[18,31] Cơ chế gây ra đối với bệnh cơ tim do PVC gây ra có thể được giải thích bằng [8] rối loạn chức năng tâm thất và co bóp tâm thất bất thường [49] Cơ chế này gần giống với tạo nhịp RV. Bệnh cơ tim gây ra với sự tái phân bố sức căng cơ tim (strain) và hoạt động, [50] phân bố thần kinh adrenergic bị suy giảm [34] và các khiếm khuyết tưới máu cơ tim. [51] Năm đến 7% bệnh nhân bị PVC đường thoát và nhịp nhanh có thể phát triển AIC [14,31,52] và ngưỡng của PVC 17 000 đến 30 000 PVC / ngày (16% ‐24% tổng gánh nặng) .[14,31,53,54] Quan trọng, AIC không được nhìn thấy với gánh nặng PVC dưới 10% và chủ yếu bị giới hạn ở những người có gánh nặng PVC là > 20% .[54] Penela và cộng sự đề xuất gánh nặng PVC ≥13% là điểm cắt lý tưởng để dự đoán khả năng phục hồi LV với độ nhạy 100% và độ đặc hiệu 85% độc lập với bệnh tim cấu trúc cùng tồn tại. [55] Trong một nghiên cứu hồi cứu, triệt phá qua catheter có ưu thế hơn điều trị chống loạn nhịp với beta blockers, blockers kênh canxi, hoặc amiodarone với mức giảm 93% PVCs. [56] Lợi ích của việc triệt phá PVC được quan sát ngay cả ở những người mắc bệnh tim cấu trúc nền với cải thiện EF 10% ‐15% .[57] Các yếu tố có thể làm tăng nguy cơ mắc AIC bao gồm: QRS rộng hơn (> 150 ms), [14,58] sự hiện diện của VT tạm thời, PVC đa ổ và PVC thất phải. [59] Do đó, bất kỳ bệnh nhân nào bị rối loạn chức năng LV và gánh nặng PVC> 20% nên xem xét triệt phá hoặc chiến lược thuốc để giảm gánh nặng rối loạn nhịp tim. [60]
Bảng 2 Tóm tắt các thử nghiệm ngẫu nhiên về triệt phá AF ở BN rối loạn chức năng tâm thu
| Tên
nghiên cứu
|
Thiết kế
|
Số
bệnh nhân |
Type AIC (IschMC và không IschCM) | Type AF
|
EF cơ bản (trong nhóm CM) | LVEF sau triệt phá
|
Chiến lược | Chiến lược trong điều trị |
| Khanetal.2008NEJM (PABA‐CHF) | Tiền cứu ngẫu nhiên đa trung tâm (PVI đối lại triệt phá nút AV và tạo nhịp. | 81 bệnh nhân (41 triệt phá) | Không do IschCM 29.5% | PsAF 48.5% | Gồm: EF≤40%, Trung bình: EF28% | +8.0±8% đối lại với triệt phá nút AV −1±4.0%(P<0.001) | Triệt phá nút AV với tạo nhịp hai buồng thất đối lại với PVI | NA |
| McDonaldetal.2011 Heart | Tiền cứu ngẫu nhiên đa trung tâm | 41bệnh nhân CM (22 đã RFA,19 điều trị thuốc) | DCM22%, IschCM 49% | PsAF100 | Gồm: EF<35 | +8.2±12% đối lại với thuốc +1.4±5.9%P=0.032 | Điều trị thuốc đối lại với triệt phá | Chỉ kiểm soát tần số |
| Jonesetal.2013JACC | Tiền cứu ngẫu nhiên đa trung tâm | 52 bệnh nhân (26 kiểm soát tần số &26 triệt phá | Không phải IschCM 67% | PsAF100% | Gồm: EF< 35%, Trung bình: 24% | +10.9±11.5% P<0.001 đối lại với thuốc +5.4±8.5%P<0.003 | Điều trị thuốc đối lại với triệt phá | Chỉ kiểm soát tần số |
| Hunteretal.2014Circ AE(CAMTAF) | Tiền cứu ngẫu nhiên đa trung tâm | 50patientswithCM (24ratecontrol,26 ablation) | DCM 31%, IschCM 23 | PsAF100% | Gồm: EF<50%, Trung bình: EF33% | +8.1±5.1% đối lại với thuốc 3%±13%P<0.001 | Điều trị thuốc đối lại với triệt phá | Chỉ kiểm soát tần số |
| Prabhuetal.2017 JACC(CAMERA‐MRI) | Tiền cứu ngẫu nhiên đa trung tâm | 68 bệnh nhân CM | 100% DCM | PsAF100% | Gồm: EF≤45%. Trung bình: EF 33±8.6% | +18%±13% đối lại với thuốc: 4.4%±13%P<0.0001 | Điều trị thuốc đối lại với triệt phá | Chỉ kiểm soát tần số |
| Marroucheetal.2018 NEJM(CASTLE‐AF) | Tiền cứu ngẫu nhiên đa trung tâm | 363 bệnh nhân (184 thuốc đối lại với 179 triệt phá) | DCM (NICM) 52%, IschCM 46% | PsAF 67.5% | Gồm: EF≤35% Trung bình: EF32% | +8% đối lại với thuốc:0.2% P=0.005 | Điều trị thuốc đối lại với triệt phá | Chỉ kiểm soát tần số |
CM: Bệnh cơ tim, DCM: Bệnh lý cơ tim giãn, IschCM: Bệnh cơ tim thiếu máu cục bộ, PsAF: AF dai dẳng, EF: Phân suất tống máu, AIC: Bệnh cơ tim do rối loạn nhịp gây ra.
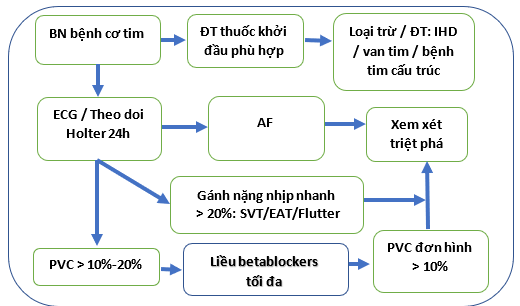
Hình 4. Thuật toán điều chỉnh AIC được nghi ngờ. Một sơ đồ quy trình quản lý rối loạn nhịp tim do nghi ngờ bệnh cơ tim do rối loạn nhịp gây ra được trình bày ở đây. ECG: Điện tâm đồ, PVC:co bóp thắt sớm, AF: Rung tâm nhĩ, SVT: Nhịp tim nhanh trên thất, IHD: Bệnh tim thiếu máu cục bộ, EAT: Nhịp tim nhĩ ngoại vị.
- Điều trị AIC
Thuật toán quản lý nghi ngờ AIC được trình bày trong Hình 4. Mặc dù không có khuyến cáo cụ thể nào trong hướng dẫn xác định vai trò của triệt phá qua catheter ở bệnh nhân AF và HF, bằng chứng ủng hộ triệt phá đang được gắn kết. [2,7,47] Triệt phá qua catheter là một công cụ hiệu quả trong AIC và tránh độc tính của các thuốc kiểm soát nhịp; tuy nhiên, nó có thể không hiệu quả hoặc phù hợp ở tất cả các bệnh nhân. Cân nhắc nên gồm tác động có thể có của việc điều chỉnh nhịp lên chức năng LV. Cụ thể những bệnh nhân bệnh cơ tim lâu năm bị rối loạn nhịp tim trong bối cảnh tiến triển của bệnh tiềm ẩn ít có lợi hơn so với những người có chẩn đoán rối loạn chức năng tâm thu LV và rối loạn nhịp tim. MRI tim có thể cung cấp thông tin bổ sung như đã thấy trong nghiên cứu CAMERA MRI. [7,61] mà không có sẹo LGE liên quan đến việc phục hồi LVEF nhiều hơn. Bệnh kèm theo, sự ưa thích của bệnh nhân và khả năng triệt phá thành công và an toàn cũng là những cân nhắc quan trọng.
- KẾT LUẬN
Rối loạn nhịp tim là một nguyên nhân được ghi nhận gây ra rối loạn chức năng tâm thu thất trái. Rung nhĩ là hình thức rối loạn nhịp phổ biến nhất gây ra bệnh cơ tim với kiểm soát tần số đơn thuần kém hơn đối với phục hồi nhịp xoang bằng triệt phá qua catheter. Triệt phá qua catheter ở bệnh nhân AF và rối loạn chức năng tâm thu tạo ra cải thiện trong triệu chứng, LVEF với việc giảm nhập viện và tử suất toàn bộ, và nên được xem xét là điều trị hàng đầu ở quần thể bệnh nhân này.
TÀI LIỆU THAM KHẢO
- Calvo N, Bisbal F, Guiu E, et al. Impact of atrial fibrillation‐induced tachycardiomyopathy in patients undergoing pulmonary vein isolation. Int J Cardiol. 2013;168(4):4093–7.
- Marrouche NF, Brachmann J, Andresen D, et al. Catheter ablation for atrial fibrillation with heart failure. N Engl J Med. 2018;378 (5):417–27.
- McLaran CJ, Gersh BJ, Sugrue DD, Hammill SC, Seward JB, Holmes DR Jr. Tachycardia induced myocardial dysfunction. A reversible phenomenon? Br Heart J. 1985;53(3):323–7.
- Shinbane JS, Wood MA, Jensen DN, Ellenbogen KA, Fitzpatrick AP, Scheinman MM. Tachycardia‐induced cardiomyopathy: a review of animal models and clinical studies. J Am Coll Cardiol. 1997;29 (4):709–15.
- Umana E, Solares CA, Alpert MA. Tachycardia‐induced cardiomyopathy. Am J Med. 2003;114(1):51–5.
- Ling LH, Taylor AJ, Ellims AH, et al. Sinus rhythm restores ventricular function in patients with cardiomyopathy and no late gadolinium enhancement on cardiac magnetic resonance imaging who undergo catheter ablation for atrial fibrillation. Heart Rhythm. 2013;10 (9):1334–9.
- Prabhu S, Taylor AJ, Costello BT, et al. Catheter ablation versus medical rate control in atrial fibrillation and systolic dysfunction (CAMERA‐MRI). J Am Coll Cardiol. 2017;70:1949–61.
- Simantirakis EN, Koutalas EP, Vardas PE. Arrhythmia‐induced cardiomyopathies: the riddle of the chicken and the egg still unanswered? Europace. 2012;14(4):466–73.
- Gopinathannair R, Etheridge SP, Marchlinski FE, Spinale FG, Lakkireddy D, Olshansky B. Arrhythmia‐induced cardiomyopathies: mechanisms, recognition, and management. J Am Coll Cardiol. 2015;66 (15):1714–28.
- Nerheim P, Birger-Botkin S, Piracha L, Olshansky B. Heart failure and sudden death in patients with tachycardia‐induced cardiomyopathy and recurrent tachycardia. Circulation. 2004;110(3):247–52.
- Santhanakrishnan R, Wang N, Larson MG, et al. Atrial fibrillation begets heart failure and vice versa: temporal associations and differences in preserved vs. reduced ejection fraction. Circulation. 2016;133(5):484–92.
- Whipple GH. Reversible congestive heart failure due to chronic rapid stimulation of the normal heart. Proc N Engl Cardiovasc Soc. 1962;20:39–40.
- Gossage AM, Hicks JAB. On auricular fibrillation. QJM. 1913;os6 (4):435–40.
- Baman TS, Lange DC, Ilg KJ, et al. Relationship between burden of premature ventricular complexes and left ventricular function. Heart Rhythm. 2010;7(7):865–9.
- Moore JP, Patel PA, Shannon KM, et al. Predictors of myocardial recovery in pediatric tachycardia‐induced cardiomyopathy. Heart Rhythm. 2014;11(7):1163–9.
- Wilson JR, Douglas P, Hickey WF, et al. Experimental congestive heart failure produced by rapid ventricular pacing in the dog: cardiac effects. Circulation. 1987;75(4):857–67.
- Rabbani LE, Wang PJ, Couper GL, Friedman PL. Time course of improvement in ventricular function after ablation of incessant automatic atrial tachycardia. Am Heart J. 1991;121(3 Pt 1): 816–9.
- Yokokawa M, Good E, Crawford T, et al. Recovery from left ventricular dysfunction after ablation of frequent premature ventricular complexes. Heart Rhythm. 2013;10(2):172–5.
- Gopinathannair R, Sullivan R, Olshansky B. Tachycardia‐mediated cardiomyopathy: recognition and management. Curr Heart Fail Rep. 2009;6(4):257–64.
- Fenelon G, Wijns W, Andries E, Brugada P. Tachycardiomyopathy: mechanisms and clinical implications. Pacing Clin Electrophysiol. 1996;19(1):95–106.
- Martin CA, Lambiase PD. Pathophysiology, diagnosis and treatment of tachycardiomyopathy. Heart. 2017;103(19):1543–52.
- Moe GW, Stopps TP, Angus C, Forster C, De Bold AJ, Armstrong PW. Alterations in serum sodium in relation to atrial natriuretic factor and other neuroendocrine variables in experimental pacinginduced heart failure. J Am Coll Cardiol. 1989;13(1):173–9.
- Scheinman MM, Basu D, Hollenberg M. Electrophysiologic studies in patients with persistent atrial tachycardia. Circulation. 1974;50 (2):266–73.
- Chiladakis JA, Vassilikos VP, Maounis TN, Cokkinos DV, Manolis AS. Successful radiofrequency catheter ablation of automatic atrial tachycardia with regression of the cardiomyopathy picture. Pacing Clin Electrophysiol. 1997;20(4 Pt 1):953–9.
- Medi C, Kalman JM, Haqqani H, et al. Tachycardia‐mediated cardiomyopathy secondary to focal atrial tachycardia: long‐term outcome after catheter ablation. J Am Coll Cardiol. 2009;53(19):1791–7.
- Kistler PM, Roberts-Thomson KC, Haqqani HM, et al. P‐wave morphology in focal atrial tachycardia: development of an algorithm to predict the anatomic site of origin. J Am Coll Cardiol. 2006;48 (5):1010–7.
- Pizzale S, Lemery R, Green MS, Gollob MH, Tang AS, Birnie DH. Frequency and predictors of tachycardia‐induced cardiomyopathy in patients with persistent atrial flutter. Can J Cardiol. 2009;25(8): 469–72.
- Sugumar H, Tung M, Leather R, Lane C, Sterns LD, Novak PG. Atrioventricular nodal non re‐entrant tachycardia (AVNNT). Heart Lung Circ. 2017;26(5):524–5.
- Wang NC. Dual atrioventricular nodal nonreentrant tachycardia: a systematic review. Pacing Clin Electrophysiol. 2011;34(12):1671–81.
- Grimm W, Menz V, Hoffmann J, Maisch B. Reversal of tachycardia induced cardiomyopathy following ablation of repetitive monomorphic right ventricular outflow tract tachycardia. Pacing Clin Electrophysiol. 2001;24(2):166–71.
- Hasdemir C, Ulucan C, Yavuzgil O, et al. Tachycardia‐induced cardiomyopathy in patients with idiopathic ventricular arrhythmias: the incidence, clinical and electrophysiologic characteristics, and the predictors. J Cardiovasc Electrophysiol. 2011;22(6):663–8.
- Calo L, De Ruvo E, Sette A, et al. Tachycardia‐induced cardiomyopathy: mechanisms of heart failure and clinical implications. J Cardiovasc Med (Hagerstown). 2007;8(3):138–43.
- Clark DM, Plumb VJ, Epstein AE, Kay GN. Hemodynamic effects of an irregular sequence of ventricular cycle lengths during atrial fibrillation. J Am Coll Cardiol. 1997;30(4):1039–45.
- Simantirakis EN, Prassopoulos VK, Chrysostomakis SI, et al. Effects of asynchronous ventricular activation on myocardial adrenergic innervation in patients with permanent dual‐chamber pacemakers; an I(123)‐metaiodobenzylguanidine cardiac scintigraphic study. Eur Heart J. 2001;22(4):323–32.
- Natale A, Zimerman L, Tomassoni G, et al. Impact on ventricular function and quality of life of transcatheter ablation of the atrioventricular junction in chronic atrial fibrillation with a normal ventricular response. Am J Cardiol. 1996;78(12):1431–3.
- Cha YM, Redfield MM, Shen WK, Gersh BJ. Atrial fibrillation and ventricular dysfunction: a vicious electromechanical cycle. Circulation. 2004;109(23):2839–43.
- Prabhu S, Voskoboinik A, Kaye DM, Kistler PM. Atrial fibrillation and heart failure ‐ cause or effect? Heart Lung Circ. 2017;26 (9):967–74.
- Mukharji J, Rehr RB, Hastillo A, et al. Comparison of atrial contribution to cardiac hemodynamics in patients with normal and severely compromised cardiac function. Clin Cardiol. 1990;13(9):639–43.
- Burke MA, Cook SA, Seidman JG, Seidman CE. Clinical and mechanistic insights into the genetics of cardiomyopathy. J Am Coll Cardiol. 2016;68(25):2871–86.
- Cahill TJ, Ashrafian H, Watkins H. Genetic cardiomyopathies causing heart failure. Circ Res. 2013;113(6):660–75.
- Investigators TAFF-uIoRM. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med. 2002;347 (23):1825–33.
- 42Hunter RJ, Berriman TJ, Diab I, et al. A randomized controlled trial of catheter ablation versus medical treatment of atrial fibrillation in heart failure (the CAMTAF trial). Circ Arrhythm Electrophysiol. 2014;7(1):31–8.
- Khan MN, Jais P, Cummings J, et al. Pulmonary‐vein isolation for atrial fibrillation in patients with heart failure. N Engl J Med. 2008;359(17):1778–85.
- Di Biase L, Mohanty P, Mohanty S, et al. Ablation versus amiodarone for treatment of persistent atrial fibrillation in patients with congestive heart failure and an implanted device: results from the AATAC multicenter randomized trial. Circulation. 2016;133 (17):1637–44.
- Hsu LF, Jais P, Keane D, et al. Atrial fibrillation originating from persistent left superior vena cava. Circulation. 2004;109(7):828–32.
- MacDonald MR, Connelly DT, Hawkins NM, et al. Radiofrequency ablation for persistent atrial fibrillation in patients with advanced heart failure and severe left ventricular systolic dysfunction: a randomised controlled trial. Heart. 2011;97(9):740–7.
- Ganesan AN, Nandal S, Luker J, et al. Catheter ablation of atrial fibrillation in patients with concomitant left ventricular impairment: a systematic review of efficacy and effect on ejection fraction. Heart Lung Circ. 2015;24(3):270–80.
- Sugumar H, Thomas SP, Prabhu S, Voskoboinik A, Kistler PM. How to perform posterior wall isolation in catheter ablation for atrial fibrillation. J Cardiovasc Electrophysiol. 2018;29(2):345–52.
- Olgun H, Yokokawa M, Baman T, et al. The role of interpolation in PVC‐induced cardiomyopathy. Heart Rhythm. 2011;8(7):1046–9.
- Prinzen FW, Hunter WC, Wyman BT, McVeigh ER. Mapping of regional myocardial strain and work during ventricular pacing: experimental study using magnetic resonance imaging tagging. J Am Coll Cardiol. 1999;33(6):1735–42.
- Skalidis EI, Kochiadakis GE, Koukouraki SI, et al. Myocardial perfusion in patients with permanent ventricular pacing and normal coronary arteries. J Am Coll Cardiol. 2001;37(1):124–9.
- Duffee DF, Shen WK, Smith HC. Suppression of frequent premature ventricular contractions and improvement of left ventricular function in patients with presumed idiopathic dilated cardiomyopathy. Mayo Clin Proc. 1998;73(5):430–3.
- Yarlagadda RK, Iwai S, Stein KM, et al. Reversal of cardiomyopathy in patients with repetitive monomorphic ventricular ectopy originating from the right ventricular outflow tract. Circulation. 2005;112 (8):1092–7.
- Bogun F, Crawford T, Reich S, et al. Radiofrequency ablation of frequent, idiopathic premature ventricular complexes: comparison with a control group without intervention. Heart Rhythm. 2007;4(7):863–7.
- Penela D, Van Huls Van Taxis C, Aguinaga L, et al. Neurohormonal, structural, and functional recovery pattern after premature ventricular complex ablation is independent of structural heart disease status in patients with depressed left ventricular ejection fraction: a prospective multicenter study. J Am Coll Cardiol. 2013;62(13):1195–202.
- Zhong L, Lee YH, Huang XM, et al. Relative efficacy of catheter ablation vs antiarrhythmic drugs in treating premature ventricular contractions: a single‐center retrospective study. Heart Rhythm. 2014;11(2):187–93.
- Mountantonakis SE, Frankel DS, Gerstenfeld EP, et al. Reversal of outflow tract ventricular premature depolarization‐induced cardiomyopathy with ablation: effect of residual arrhythmia burden and preexisting cardiomyopathy on outcome. Heart Rhythm. 2011;8 (10):1608–14.
- Yokokawa M, Kim HM, Good E, et al. Impact of QRS duration of frequent premature ventricular complexes on the development of cardiomyopathy. Heart Rhythm. 2012;9(9):1460–4.
- Del Carpio Munoz F, Syed FF, Noheria A, et al. Characteristics of premature ventricular complexes as correlates of reduced left ventricular systolic function: study of the burden, duration, coupling interval, morphology and site of origin of PVCs. J Cardiovasc Electrophysiol. 2011;22(7):791–8.
- Tseng ZH, Gerstenfeld EP. 81 – outflow tract ventricular tachyarrhythmias: mechanisms, clinical features, and management A2 – zipes, Douglas P. In: Jalife J, Stevenson WG, editors. Cardiac electrophysiology: from cell to bedside. 7th ed. Amsterdam: Elsevier, 2018; pp. 782–92.
- Hasdemir C, Yuksel A, Camli D, et al. Late gadolinium enhancement CMR in patients with tachycardia‐induced cardiomyopathy caused by idiopathic ventricular arrhythmias. Pacing Clin Electrophysiol. 2012;35(4):465–70.







