Để đánh giá và so sánh về độ sinh khả dụng, tính an toàn và ứng dụng lâm sàng của ticagrelor dạng nghiền (uống hoặc bơm qua ống thông dạ dày) với uống nguyên viên ticagrelor, chúng tôi xin trình bày 2 nghiên cứu sau.
ThS. BS. Trương Phi Hùng
Giảng viên Bộ môn Nội trường ĐHYD TP.HCM
I. Nghiên cứu tính khả dụng sinh học, ngẫu nhiên, nhãn mở về phương pháp cung cấp thuốc ticagrelor dạng nghiền ở người bình thường khỏe mạnh (An open-label, randomized bioavailability study with alternative methods of administration of crushed ticagrelor tablets in healthy volunteers). Nguồn: (International Journal of Clinical Pharmacology and Therapeutics, Vol. 53 – No. 2/2015 (182-189))
Tóm tắt
Mục tiêu:So sánh tính khả dụng sinh học và độ an toàn của viên ticagrelor dạng nghiền cho uống hoặc bơm qua ống thông mũi dạ dày (nasogastric tube) với uống nguyên viên ticagrelor (không nghiền).
Phương pháp:Nghiên cứu bắt chéo 3 phương pháp điều trị, ngẫu nhiên, nhãn mở, tại một trung tâm, với 36 người khỏe mạnh tình nguyện, được phân ngẫu nhiên sử dụng 90 mg ticagrelor bằng cách uống nguyên viên hoặc cung cấp dưới dạng nghiền ngâm trong nước (uống hoặc bơm qua ống thông dạ dày), với thời gian không dùng thuốc (wash-out) tối thiểu 7 ngày giữa các nhóm điều trị. Nồng độ ticagrelor trong huyết tương và AR-C124910XX (chất chuyển hóa có hoạt tính của ticagrelor) được đánh giá ở các thời điểm 0, 0.5, 1, 2, 3, 4, 6, 8, 10, 12, 16, 24, 36, và 48 giờ sau uống ticagrelor để phân tích về dược động học. Tính an toàn và khả năng dung nạp được đánh giá trong suốt quá trình nghiên cứu. Kết quả: ở thời điểm 0.5 giờ sau uống ticagrelor, nồng độ ticagrelor trong huyết tương và AR-C124910XX ở nhóm bệnh nhân sử dụng ticagrelor dạng nghiền uống (148.6 ng/ mL và 13.0 ng/mL) hoặc bơm qua ống thông dạ dày (264.6 ng/mL và 28.6 ng/mL) cao hơn nhóm bệnh nhân uống ticagrelor nguyên viên (33.3 ng/mL và 5.2 ng/mL). Ở thời điểm 1 giờ sau uống cũng cho kết quả tương tự. Thời gian đạt nồng độ ticagrelor tối đa (tmax) thì ngắn hơn sau khi uống dạng nghiền so với uống nguyên viên (1giờ vs. 2 giờ). Tỉ lệ trung bình (Geometric mean ratios – GMR) của AUC và Cmax giữa các nhóm điều trị cho nằm trong giới hạn tương đương sinh học từ 80 – 125% đối với ticagrelor và AR-C124910XX. Nhìn chung, các phương pháp điều trị đều dung nạp tốt.
Kết luận: Ticagrelor được sử dụng dưới dạng nghiền có hiệu quả tương đương sinh học so với uống nguyên viên, không phụ thuộc vào kiểu cung cấp thuốc (uống hoặc qua ống thông dạ dày), và có nồng độ ticagrelor trong huyết tương và AR-C124910XX tăng cao hơn ở thời gian sớm hơn so với khi uống ticagrelor nguyên viên.
1. Mở đầu
Ticagrelor là thuốc ức chế trực tiếp thụ thể P2Y12 của tiểu cầu, được sử dụng trên lâm sàng để phòng ngừa các biến cố huyết khối động mạch ở bệnh nhân hội chứng mạch vành cấp [1, 2].
Ticagrelor có tác dụng chống kết tập tiểu cầu mạnh thông qua cơ chế ức chế có hồi phục thụ thể P2Y12 [3]. Ngoài cơ chế tác dụng chính của thuốc, ticagrelor cũng có tác dụng ức chế thu nhận adenosine của tế bào qua cơ chế ức chế 1 đồng vận chuyển nucleoside [4, 5]. Sau khi uống thuốc, ticagrelor được hấp thu nhanh và có thể tiên đoán được dược động học của thuốc [6, 7].
Mặc dù ticagrelor là thuốc kháng kết tập tiểu cầu có cơ chế tác dụng trực tiếp và có thời gian khởi phát tác dụng nhanh [2, 8], thuốc cũng được chuyển hóa bởi cytochrome P450 (CYP) 3A4 và men 3A5 thành dạng chuyển hóa có tác dụng (AR-C124910XX) [9], dạng chuyển hóa này có hiệu quả ức chế thụ thể P2Y12 tương đương ticagrelor. Hiệu quả của ticagrelor được đánh giá trong nghiên cứu PLATO, gồm 18,624 bệnh nhân hội chứng mạch vành cấp [10]. Ở thời điểm 12 tháng theo dõi của nghiên cứu, các tiêu chí gộp chính (gồm có nhồi máu cơ tim, đột quỵ, hoặc tử vong do tim mạch) giảm đáng kể ở nhóm bệnh nhân sử dụng ticagrelor so với nhóm bệnh nhân sử dụng clopidogrel (9.8% vs. 11.7%, hazard ratio (HR), 0.84; 95% confidence interval (CI), 0.77 – 0.92; p < 0.001), không tăng tỉ lệ xuất huyết nặng toàn bộ. Hơn nữa, nhóm bệnh nhân (BN) sử dụng ticagrelor có tỉ lệ tử vong do mọi nguyên nhân thấp hơn nhóm bệnh nhân sử dụng clopidogrel. Khuyến cáo của FDA trong sử dụng ticagrelor, bao gồm dùng liều tải: uống 180 mg; sau đó duy trì liều 90 mg- ngày 2 lần (180 mg/ngày) (thông tin kê toa Brilinta của FDA [11]). Việc xác định và tìm ra phương pháp mới để cung cấp thuốc ticagrelor (ngoài cách thông thường là cho bệnh nhân uống) có thể có lợi ở một số nhóm bệnh nhân chuyên biệt. Ví dụ, khó nuốt là một vấn đề thường gặp ở BN lớn tuổi và có bệnh tim mạch, đặc biệt khi BN nằm viện [12, 13]. Nhóm BN này sẽ khó khăn khi uống nguyên viên thuốc ticagrelor, và có khả năng gặp các sai sót trong việc cung cấp thuốc [14]. Khó nuốt cũng được ghi nhận ở các BN ổn định, có liên quan đến tính hiệu quả và an toàn của thuốc, cũng như liên quan đến không tuân trị [15]. Vì vậy, ở nhóm BN không thể uống nguyên viên và BN khó nuốt, xem xét cung cấp thuốc ticagrelor dưới dạng nghiền và cho uống hoặc bơm qua ống thông dạ dày. Tính chất về dược động học và dược lực học của thuốc ticagrelor dạng cho uống nguyên viên đã được chứng minh đầy đủ [7, 16, 17], cách cung cấp thuốc bằng nghiền (ngoài kiểu uống nguyên viên) có thể làm thay đổi tính chất dược động học của ticagrelor. Để đánh giá hiệu quả của phương pháp cung cấp thuốc dưới dạng nghiền về tính khả dụng sinh học của ticagrelor, một nghiên cứu về dược học lâm sàng đã được tiến hành để khảo sát xem việc cho thuốc ticagrelor dạng nghiền (uống hoặc bơm qua ống thông dạ dày) có hiệu quả tương đương sinh học với uống nguyên viên ticagrelor hay không.
2. Phương pháp
a) Dân số nghiên cứu
Người tình nguyện khỏe mạnh, tuổi từ 18-50, chỉ số khối cơ thể (BMI) 18-30 kg/m2 và cân nặng từ 50-100 kg. Phụ nữ tình nguyện trong độ tuổi có thể mang thai, được yêu cầu dùng các biện pháp ngừa thai; hoặc triệt sản hoặc phụ nữ mãn kinh. Các tiêu chuẩn loại trừ chính bao gồm: sử dụng các thuốc tạo men trong vòng 3 tuần kể từ ngày bắt đầu nghiên cứu, có tiền căn bệnh: hemophilia; bệnh Willebrand; lupus đỏ hoặc các bệnh lý có xu hướng gây xuất huyết; bệnh gan, thận hoặc bệnh tiêu hóa (viêm loét dạ dày tá tràng); hoặc các bệnh lí gây ảnh hưởng đến hấp thu, chuyển hóa hoặc bài tiết thuốc. dựa vào kết quả từ một nghiên cứu trước đây, gồm 18 người tình nguyện uống 1 liều duy nhất 90 mg ticagrelor, độ thay đổi trong nhóm của ticagrelor và AR-C124910XX về dược động học (AUC and Cmax) được ước tính ≤ 24% [18]. Ước tính cỡ mẫu của nghiên cứu này là 30 người. Tất cả các người tham gia nghiên cứu phải đồng ý và kí cam kết trước khi tuyển chọn vào nghiên cứu. Đề cương nghiên cứu được xem xét và chấp thuận bởi hội đồng Y đức độc lập.
b) Thiết kế nghiên cứu và điều trị
Đây là nghiên cứu được thực hiện tại một trung tâm, với thiết kế nghiên cứu bắt chéo ba phương thức điều trị, ba giai đoạn, ngẫu nhiên và nhãn mở (mã nghiên cứu: thử nghiêm lâm sàng NCT01887626; xác nhận của AstraZeneca: D5130C00076).
Nghiên cứu bao gồm 3 phương cách điều trị với thời gian 4 ngày. Người tình nguyện tham gia nghiên cứu sẽ được điều trị một trong ba phương cách sau: uống nguyên viên ticagrelor 90-mg với 200 ml nước, hoặc uống ticagrelor 90-mg dạng nghiền được pha với 200 ml nước, hoặc bơm qua ống thông dạ dày với ticagrelor 90-mg dạng nghiền pha với 200 ml nước. Như mô tả trước đây [19], viên ticagrelor được nghiền ra bằng cách sử dụng cối giã và chày, sau đó cho vào ly định liều, thêm vào 100 ml nước và khuấy đều lên để thành một dung dịch (ticagrelor có độ hòa tan trong nước 10 μg/mL [11]). Thêm 100 ml nước vào cối giã thuốc và đổ vào ly định liều thuốc. Lúc này đã có 200 ml dung dịch thuốc và sẵn sàng cung cấp cho bệnh nhân [19]. Sau giai đoạn không dùng thuốc (wash-out) ít nhất 7 ngày, người tình nguyện tham gia nghiên cứu được bắt chéo nhận phương pháp điều trị thay thế khác. Người tham gia nghiên cứu cần nhịn ăn ít nhất 10 giờ trước khi uống thuốc ticagrelor. Bệnh nhân được ăn lại sau 4 giờ uống thuốc. Trong giai đoạn nghiên cứu phải hạn chế các điều sau: tránh các phẫu thuật, tránh gắng sức, hạn chế sử dụng các thức uống có chứa cồn, taurine, glucuronolactone, caffeine, hoặc bưởi, và tránh hút thuốc lá hoặc các sản phẩm có chứa nicotine, và các thuốc như aspirin, hoặc thuốc kháng viêm không steroid.
c) Các phương pháp phân tích và lấy mẫu về dược động học.
Để xác định nồng độ của ticagrelor và chất chuyển hóa của ticagrelor (AR- C124910XX) trong huyết tương, lấy máu ở các thời điểm: 0 giờ (trước uống thuốc), 0.5 , 1 , 2 , 3, 4, 6, 8, 10, 12, 16, 24, 36, và 48 giờ sau uống thuốc, ứng với mỗi liệu pháp điều trị. Đối với ticagrelor và ARC124910XX, giới hạn dưới của định lượng là 5.0 ng/mL và 2.5 ng/mL.
d) Đánh giá độ an toàn và tính dung nạp của thuốc
Độ an toàn và khả năng dung nạp của ticagrelor dạng nghiền được cung cấp bằng cách uống hoặc bơm qua ống thông dạ dày, được đánh giá qua tỉ lệ các tác dụng phụ, các chỉ số về hóa sinh lâm sàng, huyết học, và phân tích nước tiểu, khám lâm sàng, đo điện tâm đồ 12 chuyển đạo, và dấu hiệu sinh tồn.
e) Phân tích dữ liệu
Các thông số về dược động học được tính bằng các phương pháp chuẩn (WinNonlin Professional, Pharsight Corporation, Mountain View, CA, USA). Dữ liệu về thời gian-nồng độ ticagrelor trong huyết tương được sử dụng để đánh giá nồng độ tối đa (Cmax), thời gian để đạt Cmax (tmax), thời gian bán hủy (t1/2), diện tích dưới đường cong thời gian-nồng độ huyết tương từ thời điểm 0 đến vô cực (AUC), và tỉ lệ thuốc chuyển hóa/thuốc ban đầu (Cmax và AUC) của ticagrelor và AR-C124910XX. Phân tích thống kê sử dụng phần mềm SAS phiên bản 9.2 (SAS Institute, Cary, NC, USA). Người tham gia nghiên cứu nhận ít nhất 1 liều thuốc nghiên cứu và có ít nhất một mẫu đo nồng độ huyết tương sau uống thuốc để phân tích. Các chỉ số dược động học của ticagrelor và ARC124910XX về diện tích dưới đường cong (AUC) và nồng độ đỉnh (Cmax) được chuyển dạng sang lô-ga-rít tự nhiên và phân tích.
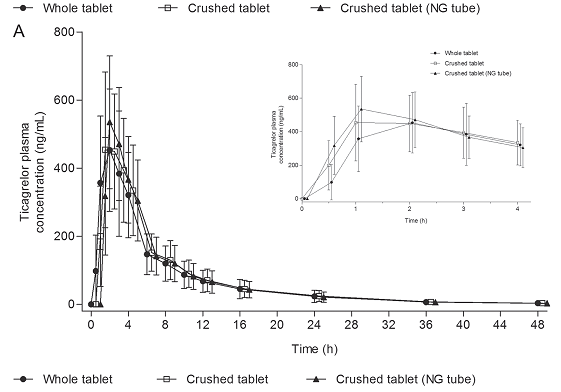
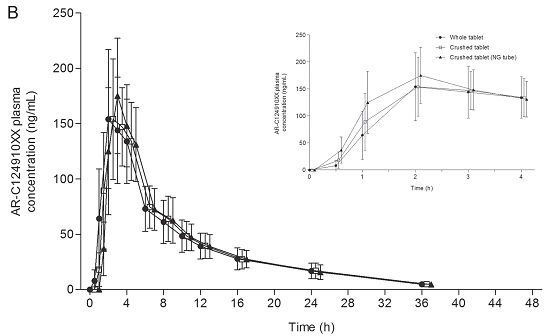
Hình 1. (A) Nồng độ trung bình ± độ lệch chuẩn của thuốc ticagrelor và (B) Nồng độ trung bình ± độ lệch chuẩn của AR-C124910XX sau uống 90 mg ticagrelor nguyên viên hoặc dạng nghiền (uống hoặc bơm qua ống thông dạ dày).
Bảng 1. Các chỉ số về dược động học của ticagrelor và AR-C124910XX sau uống 90 mg ticagrelor nguyên viên hoặc dạng nghiền (uống hoặc bơm qua ống thông dạ dày)
|
|
Ticagrelor (90 mg) |
Tỉ lệ trung bình (GMR)
|
|||
|
‑ Các chỉ số |
Uống nguyên viên (n = 36) |
Dạng nghiền uống (n = 36) |
Dạng nghiền bơm qua ống thông (n = 36) |
Dạng nghiền (uống) so với nguyên viên |
Dạng nghiền (bơm) so với nguyên viên |
|
Ticagrelor |
|
|
|||
|
Cmax (ng/mL) |
506 (35.8) |
529 (37.0) |
547 (37.5) |
104.4 (97.5 – 111.9) |
108.00 (100.8 – 115.7) |
|
AUC (n g×h/mL) |
2,890 (43.8) |
3,090 (43.7) |
3,050 (40.5) |
107.2 (102.5 – 112.0) |
105.8 (101.2 – 110.6) |
|
AUC0–t (ng×h/mL) |
2,840 (43.8) |
3,050 (43.4) |
3,020 (40.1) |
– |
– |
|
t1/2 (giờ) |
7.56 (1.2) |
7.79 (1.2) |
7.40 (1.2) |
– |
– |
|
tmax (giờ) |
2.0 (1.0 ‒ 4.0) |
1.0 (1.0 ‒ 4.0) |
1.0 (1.0 ‒ 3.0) |
– |
– |
|
AR-C124910XX |
|
|
|||
|
Cmax (ng/mL) |
165 (30.1) |
166 (25.3) |
174 (28.2) |
100.8 (93.9 – 108.2) |
105.9 (98.7 – 113.7) |
|
AUC (ng×h/mL) |
1,380 (30.7) |
1,430 (27.7) |
1,460 (25.4) |
103.3 (99.5 – 107.3) |
105.2 (101.3 – 109.3) |
|
AUC0–t (ng×h/mL) |
1,320 (32.6) |
1,370 (29.2) |
1,410 (26.6) |
– |
– |
|
t1/2 (giờ) |
8.30 (1.2) |
8.32 (1.2) |
7.95 (1.2) |
– |
– |
|
tmax (giờ) |
2.0 (2.0 ‒ 4.0) |
2.0 (2.0 ‒ 8.0) |
2.0(1.0 ‒ 4.0) |
– |
– |
|
Tỉ lệ thuốc chuyển hóa/dạng thuốc ban đầu (Metabolit:parent ratios) |
|
|
|||
|
Tỉ lệ Cmax |
0.325 (31.3) |
0.314 (24.0) |
0.319 (27.7) |
– |
– |
|
Tỉ lệ AUC |
0.480 (34.0) |
0.463 (28.3) |
0.477 (30.3) |
– |
– |
(GMR): Tỉ lệ trung bình; Cmax: nồng độ tối đa; thời gian để đạt Cmax (tmax), thời gian bán hủy (t1/2), AUC: diện tích dưới đường cong thời gian-nồng độ huyết tương từ thời điểm 0 đến vô cực. tmax: thời gian để đạt Cmax.
Bảng 2. Nồng độ trong huyết tương của ticagrelor và AR-C124910XX ở thời điểm 0.5 giờ, 1 giờ và 2 giờ sau uống 90 mg ticagrelor nguyên viên hoặc dạng nghiền (uống hoặc bơm qua ống thông dạ dày)
|
Thời gian |
Nồng độ trung bình trong huyết tương (95% CI) |
||
|
|
Uống nguyên viên n = 36 |
Uống dạng nghiền n = 36 |
Dạng nghiền bơm qua ống thông n = 36 |
|
Ticagrelor (ng/mL) |
|||
|
0.5 giờ |
33.3 (21.7 – 51.2) |
148.6 (96.8 – 228.3) |
264.6 (172.3 – 406.3) |
|
1.0 giờ |
270.9 (216.6 – 338.8) |
392.5 (313.9 – 490.9) |
497.8 (398.1 – 622.5) |
|
2.0 giờ |
414.7 (360.1 – 477.6) |
418.4 (363.3 – 481.8) |
442.1 (383.9 – 509.1) |
|
AR-C124910XX (ng/mL) |
|||
|
0.5 giờ |
5.2 (4.0 – 6.9) |
13.0 (9.9 – 17.0) |
28.6 (21.8 – 37.6) |
|
1.0 giờ |
41.4 (31.3 – 54.6) |
73.2 (55.5 – 96.7) |
111.8 (84.8 – 147.6) |
|
2.0 giờ |
141.8 (125.8 – 159.7) |
143.8 (127.7 – 162.1) |
167.9 (149.0 – 189.2) |
3. Kết quả
a) Đặc điểm cơ bản về nhân khẩu học của dân số nghiên cứu
36 người tham gia nghiên cứu được phân ngẫu nhiên để nhận 1 trong 3 cách điều trị với thuốc ticagrelor. Tất cả người tham gia phải hoàn tất nghiên cứu và nhận đủ 3 cách điều trị. Do đó có đủ dữ liệu để phân tích về dược động học và độ an toàn. Dân số nghiên cứu gồm có 28 nam chiếm 77.8%, da trắng chiếm tỉ lệ 58.3%, 22.2% là dân châu Á, 8.3% là dân da đen hoặc người Mỹ gốc Phi, 8.3% người Mexico và 2.8% gốc Châu Phi. Tuổi trung bình của nhóm tham gia nghiên cứu: 31 (8, 20 – 49) tuổi, cân nặng trung bình 74.5 (11.4, 55.2 – 94.0) kg và BMI: 24.4 (2.9, 19.4 – 29.6) kg/m2.
b) Dược động học
Dữ liệu về thời gian-nồng độ trong huyết tương của ticagrelor và ARC124910XX được trình bày trong hình 1. Nồng độ ticagrelor trong huyết tương đạt đỉnh ở thời điểm 1 giờ sau uống 90 mg ticagrelor dạng nghiền (tmax trung bình là 1giờ (1 – 4) và 1giờ (1 – 3) khi cung cấp thuốc bằng uống hoặc bơm qua ống thông dạ dày).
Khi uống nguyên viên 90 mg ticagrelor, nồng độ trong huyết tương đạt đỉnh ở thời điểm 2 giờ (tmax trung bình 2 (1 – 4) hours). Nồng độ huyết tương của ARC124910XX đạt đỉnh ở thời điểm 2 giờ sau uống, giống nhau trong 3 cách cho thuốc (tmax trung bình 2 giờ) (bảng 1).
Thời điểm 0.5 giờ sau cung cấp thuốc, nồng độ ticagrelor trong huyết tương ở nhóm uống thuốc dạng nghiền (148.6 ng/mL) hoặc bơm qua ống thông dạ dày (264.6 ng/mL) cao hơn nhóm bệnh nhân uống nguyên viên (33.3 ng/mL) (bảng 2). Tỉ lệ trung bình (Geometric mean ratios: GMR) của nồng độ ticagrelor trong huyết tương cao hơn đáng kể ở nhóm bệnh nhân uống thuốc dạng nghiền (445.9%, 95% CI, 243.0 – 818.0) hoặc bơm qua ống thông dạ dày (793.7%, 95% CI, 432.7 – 1,456.1), so với uống nguyên viên.
Tương tự, nồng độ AR-C124910XX trong huyết tương cao hơn đáng kể ở nhóm bệnh nhân uống thuốc dạng nghiền (13.0 ng/mL; GMR, 247.6%, 95% CI, 169.9 – 360.7) hoặc bơm qua ống thông dạ dày (28.6 ng/mL; GMR, 546.6%, 95% CI, 375.1 – 796.5), so với uống nguyên viên (5.2 ng/mL) (bảng 2). Ở thời điểm 1 giờ sau uống thuốc, khuynh hướng về nồng độ tương tự ở thời điểm 0.5 giờ cho thuốc ticagrelor và AR-C124910XX (bảng 2). Giữa thời điểm 2 giờ và 48 giờ sau uống, và thời điểm 3 giờ và 48 giờ sau uống, tính chất về thời gian-nồng độ huyết tương của thuốc ticagrelor và AR-C124910XX có thể so sánh được giữa các điều trị (hình 1). Không có sự khác biệt đáng kể về AUC và Cmax khi so sánh giữa các cách điều trị. Tỉ lệ trung bình (GMR) (với khoảng tin cậy 90%) của AUC và Cmax giữa các liệu pháp điều trị chứa trong khoảng giới hạn 80 – 125% được xác định trước về tương đương sinh học của ticagrelor và ARC124910XX (bảng 1).
c) Tính an toàn và khả năng dung nạp
Nhìn chung thuốc ticagrelor được dung nạp tốt. Không có trường hợp nào tử vong hoặc có biến cố nặng trong nghiên cứu này, cũng không có trường hợp nào phải ngừng nghiên cứu do tác dụng phụ. 44.4% người tham gia nghiên cứu có ít nhất 1 tác dụng phụ. Tác dụng phụ thường gặp nhất là rối loạn hệ thần kinh trung ương (chóng mặt, nhức đầu, đau đầu migraine, ngất) và nhiễm trùng (herpes miệng, nhiễm trùng răng, và nhiễm trùng đường hô hấp trên), với tỉ lệ lần lượt là 13.9% và 11.1%. Tất cả tác dụng phụ thường nhẹ, ngoại trừ 2 trường hợp sau. Một trường hợp ghi nhận bị nhiễm trùng răng sau uống thuốc ticagrelor dạng nghiền, mức độ trung bình. Một trường hợp khác bị đau đầu migraine mức độ trung bình sau uống ticagrelor dạng nghiền. Cả 2 trường hợp này hồi phục trước khi kết thúc nghiên cứu và được xem như không kiên quan đến điều trị. Không có thay đổi về các chỉ số xét nghiệm, cũng như trên khám lâm sàng, dấu hiệu sinh tồn và các biến đổi trên điện tâm đồ.
4. Bàn luận
Tính chất về dược động học và dược lực học của uống nguyên viên ticagrelor đã được chứng minh đầy đủ [7, 16, 17]. Tuy nhiên, hiệu quả của cung cấp thuốc ticagrelor dạng nghiền chưa có nghiên cứu nào đánh giá trước đây. Vì vậy, nghiên cứu này đánh giá việc cung cấp thuốc ticagrelor dạng nghiền qua đường uống hoặc bơm qua ống thông dạ dày có hiệu quả tương đương sinh học so với uống nguyên viên ticagrelor hay không. Trong nghiên cứu này, các tính chất về dược động học của uống nguyên viên ticagrelor 90 mg bao gồm: thời gian đạt nồng độ đỉnh (tmax) trong vòng 2 giờ và thời gian bán hủy trong vòng 8 giờ, được so sánh với các nghiên cứu trước đây ở nhóm người khỏe mạnh, tình nguyện tham gia[7]. So với uống nguyên viên ticagrelor, việc cung cấp ticagrelor dạng nghiền (uống hoặc bơm qua ống thông dạ dày) sẽ đạt nồng độ ticagrelor và AR-C124910XX cao hơn ở thời điểm sớm hơn (0.5 giờ và 1 giờ). Hơn nữa, ticagrelor dạng nghiền đạt được nồng độ tối đa trong huyết tương sớm hơn dạng uống nguyên viên (1 giờ so với 2 giờ). Phương pháp cung cấp thuốc không có tác động đáng kể trên tiếp xúc toàn bộ với ticagrelor hoặc AR-C124910XX, được đánh giá bằng Cmax và AUC.
Tỉ lệ trung bình (GMR) của AUC và Cmax giữa các liệu pháp điều trị nằm trong khoảng giới hạn được xác định trước về tương đương sinh học của ticagrelor và ARC124910XX, điều này khẳng định thuốc ticagrelor có thể cho dưới dạng nguyên viên uống, hoặc dạng nghiền (uống hoặc bơm qua ống thông dạ dày) và không cần điều chỉnh liều. Dựa vào kết quả nghiên cứu này, thuốc ticagrelor dạng nghiền có thể là một phương pháp thay thế cho uống nguyên viên ticagrelor. Trong khi chờ đợi nhiều nghiên cứu hơn nữa để đánh giá các hiệu quả về dược lực học của ticagrelor dạng nghiền (ví dụ: hiệu quả trên kết tập tiểu cầu, thời gian máu chảy…), thì với kết quả của nghiên cứu này gợi ý cho chúng ta việc cung cấp ticagrelor dạng nghiền cho thấy có nhiều lợi điểm trong thực hành lâm sàng. Ví dụ, khó nuốt là một trong những vấn đề thường gặp ở bệnh nhân nằm viện [12, 13], đặc biệt nhóm bệnh nhân lớn tuổi, và thuốc dạng nghiền được ưu tiên chọn lựa cho nhóm bệnh nhân này. Hơn nữa, trong những tình huống cấp cứu, bệnh nhân có thể bị hôn mê hoặc không tỉnh táo, việc cung cấp thuốc dạng nghiền bơm qua ống thông dạ dày là phương pháp tốt và hiệu quả. Thuốc dạng nghiền đã được đánh giá là phương pháp giúp thời gian khởi phát tác dụng ức chế tiểu cầu nhanh hơn. Áp dụng này (cho thuốc dạng nghiền) có thể cung cấp các lợi ích lâm sàngở một số nhóm bệnh nhân; ví dụ: ở bệnh nhân nhồi máu cơ tim cấp ST chênh lên, thời gian khởi phát tác dụng của thuốc kháng kết tập tiểu cầu (ticagrelor) có thể bị chậm, có thể do cung cấp morphin cùng lúc [21, 22, 23]. Hiện nay, nghiên cứu MOJITO đánh giá phản ứng tiểu cầu sau cho thuốc ticagrelor dạng nghiền liều tải so với uống nguyên viên (liều tải) ở bệnh nhân NMCT cấp ST chênh lên (clinicaltrials.gov NCT01992523). Xem xét về tính an toàn và khả năng dung nạp, nhìn chung tất cả dạng thuốc ticagrelor đều dung nạp tốt bất kể phương cách cung cấp thuốc. Không có tác dụng phụ nặng trong nghiên cứu này, và không có bệnh nhân nào phải ngừng nghiên cứu vì tác dụng phụ. Hầu hết các tác dụng phụ thường nhẹ và giống như các nghiên cứu trước đây [7].
5. Kết luận của nghiên cứu
Việc cung cấp ticagrelor dạng nghiền (bằng đường uống hoặc bơm qua ống thông dạ dày) có liên quan đến tăng nồng độ của ticagrelor và ARC124910XX trong huyết tương ở thời điểm sớm hơn so với uống nguyên viên ticagrelor. Bất kể phương cách cung cấp thuốc (uống hoặc bơm qua ống thông), ticagrelor dạng nghiền có mức độ tương đương sinh học bằng với uống nguyên viên ticagrelor.
II. Nghiên cứu: “Sử dụng ticagrelor dạng nghiền ở bệnh nhân nhồi máu cơ tim cấp ST chênh lên (Ticagrelor Crushed Tablets Administration in STEMI Patients).
Nguồn: J Am Coll Cardiol. 2015;65(5):511-512. doi:10.1016/j.jacc.2014.08.056)
Nghiên cứu MOJITO (Mashed Or Just Integral pill of TicagrelOr) là một nghiên cứu tiến cứu, ngẫu nhiên có đối chứng thực hiện tại 4 trung tâm, với mục đích để đánh giá tính vượt trội của ticagrelor dạng nghiền so với dạng nguyên viên ticagrelor ở liều tương đương ở bệnh nhân NMCT cấp ST chênh lên có can thiệp mạch vành tiên phát (thì đầu). Nghiên cứu này được chấp thuận bởi hội đồng Y đức và được đăng ký với mã nghiên cứu ClinicalTrials.gov(NCT01992523). Tất cả bệnh nhân ký vào tờ cam kết đồng ý tham gia nghiên cứu. Sau khi loại trừ, 82 bệnh nhân được phân ngẫu nhiên: sử dụng liều tải 180 mg ticagrelor dạng nghiền hoặc uống nguyên viên với liều tương đương (180 mg ticagrelor) trước khi can thiệp mạch vành qua da. Thực hiện xét nghiệm chức năng tiểu cầu với VerifyNow (Accumetrics, San Diego, California) ở thời điểm lấy mẫu, 1 giờ, 2 giờ, 4 giờ, và 8 giờ sau uống thuốc, và kết quả được hiển thị thông qua chỉ số PRU (P2Y12 reaction units: đơn vị phản ứng với thụ thể P2Y12). Phản ứng tiểu cầu cao (High-platelet reactivity: HPR) được định nghĩa khi PRU >208. Tiêu chí chính là chỉ số PRU 1 giờ sau uống thuốc liều tải.
Các đặc điểm cơ bản không có sự khác biệt đáng kể giữa hai nhóm. Chỉ số PRU 1 giờ sau uống ticagrelor liều tải ở nhóm sử dụng dạng nghiền là 168 (interquartile range [IQR]: 61 to 251) và nhóm uống nguyên viên là 252 (IQR: 167 to 301), (p = 0.006), không có khác biệt ở thời điểm 2 giờ, 4 giờ và 8 giờ. Nhóm dùng thuốc dạng nghiền có 35% bệnh nhân có phản ứng tiểu cầu cao (HPR) và nhóm uống nguyên viên có 63% bệnh nhân có phản ứng tiểu cầu cao (HPR) ở thời điểm 1 giờ sau uống thuốc (p = 0.011). Không có sự khác biệt về HPR ở thời điểm 2 giờ sau uống thuốc giữa hai nhóm (20% và 28%, p = 0.431). Các yếu tố tiên đoán độc lập của phản ứng tiểu cầu cao (HPR) 1 giờ sau uống liều tải gồm sử dụng morphin (làm tăng HPR) và uống ticagrelor dạng nghiền (làm giảm HPR).
Kết quả nghiên cứu này, lần đầu tiên trong Y văn, cho thấy việc cung cấp ticagrelor dạng nghiền ở BN NMCT cấp ST chênh lên là có tính khả thi và tạo ra hiệu quả ức chế tiểu cầu sớm hơn so với uống nguyên viên. Chính vì vậy tỉ lệ huyết khối cấp trong stent giảm, và tái tưới máu cơ tim tốt hơn. Cần có nghiên cứu với cỡ mẫu lớn hơn để xác định tính ưu việt của cung cấp viên dạng nghiền. Hiện nay tất cả các thuốc ức chế thụ thể P2Y12 sử dụng ở BN NMCT ST chênh lên chỉ có ở dạng viên uống. Do đó ticagrelor dạng nghiền sẽ có lợi ở nhóm BN già, nuốt khó, bệnh nhân có di chứng tai biến mạch máu não, BN được đặt nội khí quản, BN mê. Nghiên cứu này ủng hộ sử dụng ticagrelor dạng nghiền ở BN không nuốt được.
Tóm lại thông qua 2 nghiên cứu trên chúng ta nhận thấy ticagrelor được sử dụng dưới dạng nghiền có hiệu quả tương đương sinh học so với uống nguyên viên, không phụ thuộc vào kiểu cung cấp thuốc (uống hoặc qua ống thông dạ dày), và có nồng độ ticagrelor và AR-C124910XX trong huyết tương tăng cao hơn, ở thời gian sớm hơn so với khi uống ticagrelor nguyên viên. Và trong trường hợp NMCT cấp có ST chênh lên, ticagrelor dạng nghiền còn tạo ra hiệu quả ức chế tiểu cầu sớm hơn, dẫn đến giảm tỉ lệ huyết khối cấp trong stent và tái tưới máu cơ tim tốt hơn. Chúng ta có thể sử dụng ticagrelor dạng nghiền trong các tình huống lâm sàng sau: BN già, nuốt khó, bệnh nhân có di chứng tai biến mạch máu não, BN được đặt nội khí quản, BN mê.
Tài liệu tham khảo
[1] Husted S, Emanuelsson H, Heptinstall S, Sandset PM, Wickens M, Peters G. Pharmacodynamics,pharmacokinetics, and safety of the oral reversible P2Y12 antagonist AZD6140 with aspirin in patients with atherosclerosis: a double-blind comparison to clopidogrel with aspirin. Eur Heart J.2006; 27: 1038-1047.
[2] VAN Giezen JJ, Nilsson L, Berntsson P, WissingBM, Giordanetto F, Tomlinson W, Greasley PJ.Ticagrelor binds to human P2Y(12) independently from ADP but antagonizes ADP-induced receptor signaling and platelet aggregation. J Thromb Haemost. 2009; 7: 1556-1565.
[3] Cannon CP, Husted S, Harrington RA, Scirica BM, Emanuelsson H, Peters G, Storey RF; DISPERSE-2 Investigators. Safety, tolerability, and initial efficacy of AZD6140, the first reversible oral adenosine diphosphate receptor antagonist, compared with clopidogrel, in patients with non-ST-segment elevation acute coronary syndrome:primary results of the DISPERSE-2 trial. J Am Coll Cardiol. 2007; 50: 1844-1851.
[4] Armstrong D, Summers C, Ewart L, Nylander S,Sidaway JE, van Giezen JJ. Characterization of the adenosine pharmacology of ticagrelor reveals therapeutically relevant inhibition of equilibrative nucleoside transporter 1. J Cardiovasc Pharmacol Ther. 2014; 19: 209-219.
[5] Wittfeldt A, Emanuelsson H, Brandrup-Wognsen G, van Giezen JJ, Jonasson J, Nylander S, Gan LM. Ticagrelor enhances adenosine-induced coronary vasodilatory responses in humans. J Am Coll Cardiol. 2013; 61: 723-727.
[6] Teng R, Butler K. AZD6140, the first reversible oral platelet P2Y12 receptor antagonist, has linear pharmacokinetics and provides near complete inhibition of platelet aggregation, with reversibility of effect in healthy subjects. Can J Clin Pharmacol. 2010; 15: e426.
[7] Teng R, Butler K. Pharmacokinetics, pharmacodynamics, tolerability and safety of single ascending doses of ticagrelor, a reversibly binding oral P2Y(12) receptor antagonist, in healthy subjects. Eur J Clin Pharmacol. 2010; 66: 487-496.
[8] Gurbel PA, Bliden KP, Butler K, et al. Randomizeddouble-blind assessment of the ONSET and OFFSETof the antiplatelet effects of ticagrelor versusclopidogrel in patients with stable coronary arterydisease: the ONSET/OFFSET study. Circulation.2009; 120: 2577-2585.
[9] Zhou D, Andersson TB, Grimm SW. In vitro evaluation of potential drug-drug interactions with ticagrelor: cytochrome P450 reaction phenotyping,inhibition, induction, and differential kinetics. Drug Metab Dispos. 2011; 39: 703-710.
[10] Wallentin L, Becker RC, Budaj A, Cannon CP, Emanuelsson H, Held C, Horrow J, Husted S, James S, Katus H, Mahaffey KW, Scirica BM, Skene A, Steg PG, Storey RF, Harrington RA, Freij A, Thorsén M; PLATO Investigators. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2009; 361: 1045-1057.
[11] Food and Drug Administration. Drug Labels: Brilinta prescribing information. http://www.fda. gov/downloads/Drugs/DrugSafety/UCM264220. pdf; accessed February 17 2014.
[12] Batty S. Communication, swallowing and feeding in the intensive care unit patient. Nurs Crit Care. 2009; 14: 175-179.
[13] Bassi D, Furkim AM, Silva CA, Coelho MS, Rolim MR, de Alencar ML, Machado MJ. Identification of risk groups for oropharyngeal dysphagia in hospitalized patients in a university hospital. Codas. 2014; 26: 17-27.
[14] Wright DJ, Kelly J. Medication administration in patients with dysphagia. Nurs Stand. 2012; 27: 35-40.
[15] Schiele JT, Quinzler R, Klimm HD, Pruszydlo MG, Haefeli WE. Difficulties swallowing solid oral dosage forms in a general practice population: prevalence, causes, and relationship to dosage forms. Eur J Clin Pharmacol. 2013; 69: 937-948.
[16] Butler K, Teng R. Pharmacokinetics, pharmacodynamics, safety and tolerability of multiple ascending doses of ticagrelor in healthy volunteers. Br J Clin Pharmacol. 2010; 70: 65-77.
[17] Teng R, Butler K. Safety, tolerability, pharmacokinetics and pharmacodynamics of high single-ascending doses of ticagrelor in healthy volunteers. Int J Clin Pharmacol Ther. 2013; 51: 795-806.
[18] Teng R, Butler K. Effect of the CYP3A inhibitors, diltiazem and ketoconazole, on ticagrelor pharmacokinetics in healthy volunteers. J Drug Assess. 2013; 2: 30-39.
[19] Crean B, Finnie C, Crosby A. Evaluation of crushed ticagrelor tablet doses: recovery following crushing and naso-gastric tube passage exvivo. Drugs R D. 2013; 13: 153-157.
[20] Sillén H, Cook M, Davis P. Determination of ticagrelor and two metabolites in plasma samples by liquid chromatography and mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Biomed Life Sci. 2010; 878: 2299-2306.
[21] Alexopoulos D, Xanthopoulou I, Gkizas V,vet al. Randomized assessment of ticagrelor versus prasugrel antiplatelet effects in patients with ST-segment-elevation myocardial infarction. Circ Cardiovasc Interv. 2012; 5: 797-804.
[22] Parodi G, Valenti R, Bellandi B,et al. Comparison of prasugrel and ticagrelor loading doses in STsegment elevation myocardial infarction patients: RAPID (Rapid Activity of Platelet Inhibitor Drugs) primary PCI study. J Am Coll Cardiol. 2013; 61: 1601-1606.
[23] Camurça FD, De Queiroz DA, Leal PR, Rodrigues CL, Gondim FA, Da Graça JR, Rola FH, Nobre e Souza MA, dos Santos AA. Gastric emptying and gastrointestinal transit of liquid in awake rats is delayed after acute myocardial infarction.
Dig Dis Sci. 2004; 49: 757-762.







