Tỷ lệ bệnh đái tháo đường hay tiểu đường (DM) đang gia tăng nhanh chóng. DM là nguyên nhân hàng đầu cho các bệnh tim mạch, có thể dẫn đến biến chứng tim mạch khác nhau do xơ vữa động mạch nặng hơn ở các động mạch lớn và xơ vữa động mạch vành.
TS.Phạm Hữu Văn
Do đó làm tăng nguy cơ mắc các bệnh mạch máu lớn và nhỏ, đột quỵ, đoạn chi và bệnh võng mạc. Hơn nữa bệnh đái tháo đường là một trong những yếu tố nguy cơ độc lập và mạnh nhất đối vớibệnh tim mạch và tử vong, liên quan đến các rối loạn nhịp tim thường xuyên như rung tâm nhĩ (AF) và loạn nhịp thất (VA). Chúng tôi muốn trình bày một cách tổng quan về sự phối hợp giữa DM và rối loạn nhịp tim như rung nhĩ (AF) và rối loạn nhịp thất (VA) với các cơ chế sinh lý bệnh lý cơ bản.
Mở đầu
Đái tháo đường (DM) được ghi nhận là yếu tố nguy cơ tim mạch chính (CV) và mối quan hệ chặt chẽ của nó với bệnh suất và tử suất tim mạch được tính toán rõ [1]. Mặc dù bệnh động mạch vành và các biến cố tim là đại đa số các ảnh hưởng tim mạch do đái tháo đường được chứng minh bằng tư liệu, hệ thống điện học của tim cũng là một mục tiêu quan trọng đối với tổn thương do đái tháo đường. Trong nghiên cứu tim Framingham, DM được xác định là một yếu tố nguy cơ độc lập gây rung nhĩ (AF) sau 38 năm theo dõi [2]. Một phân tích gộp gần đây được được Huxley và cộng sự công bố đã cho thấy những bệnh nhân bị DM có nguy cơ phát triển AF cao hơn 40% so với bệnh nhân không có đái tháo đường. Mặt khác, đã có bằng chứng ngày càng tăng về mối quan hệ giữa các đợt hạ đường huyết và rối loạn nhịp thất trong những năm gần đây [4,5]. Mối quan hệ giữa DM và rối loạn loạn nhịp vẫn chưa được hiểu đầy đủ và quần thể đái tháo đường tăng lên mỗi ngày. Mối quan hệ này dự kiến sẽ trở thành một vấn đề trong tương lai gần. Ở đây chúng tôi muốn trình bày một cái nhìn tổng quan ngắn gọn về mối quan hệ này đặc biệt là cho AF và loạn nhịp thất.
Tiểu đường và AF
AF là rối loạn nhịp phổ biến nhất trong thực hành lâm sàng dẫn đến bệnh suất và tử suất tim mạch lớn [6]. Trước đó Nghiên cứu Framingham và gần đây một nghiên cứu do Movahed và cộng sự đã xác định rõ ràng DM là một yếu tố nguy cơ độc lập và mạnh mẽ cho sự phát triển của AF. Mối quan hệ chặt chẽ giữa AF và DM nêu lên câu hỏi về cơ sở sinh bệnh học cho thực thể này. Mặc dù không có câu trả lời duy nhất và dễ dàng cho câu hỏi này, cả tu sửa điện và giải phẫu dường như là chìa khóa quan trọng của những thay đổi sinh lý bệnh phức tạp này.
Sự xơ hóa lan rộng trong tổ chức nhĩ là dấu hiệu giải phẫu AF với vai trò trong cả khởi đầu và kéo dài của rối loạn nhịp tim và khi xơ hóa làm giãn nhĩ gây nhiều khả năng AF chuyển sang dạng vĩnh viễn hoặc kháng lại các thuốc chống loạn nhịp [8,9]. Kato và cộng sự đã chỉ ra xơ nhĩ liên quan đến DM có vai trò tiềm tàng trong việc khởi đầu AF trong các mô hình chuột đái tháo đường. Áp lực oxy hóa hệ thống và mức độ tổ chức bị quá mức dường như là yếu tố quan trọng trong xơ hóa tâm nhĩ liên quan đến DM. Dudley và cộng sự đã đánh giá mức độ superoxide bất cứ đối tượng nào trong mô hình nhĩ lợn. Nghiên cứu so sánh nồng độ superoxide trong tiểu nhĩ trái giữa nhóm nhịp xoang và nhóm tạo nhịp nhĩ nhanh (atrial rapid pacing: ARP). Kết quả cho thấy trong nhóm ARP còn lại nồng độ anion superoxide nhĩ trái cao gấp gần 3 lần so với nhóm chứng. Một nghiên cứu khác do Anderson và cộng sự đã cho thấy stress oxy hóa ty lạp thể được tăng lên trong tổ chức nhĩ ở người bị đái tháo đường. Những nghiên cứu này có thể chỉ ra mặc dù mức độ áp lực ô xy hóa hệ thống được tăng lên trong DM, có thể có một sản xuất các loại oxy phản ứng thông qua con đường tylạpthể đặc biệt ở mức độ tổ chức nhĩ.
Glycosyl hóa không enzyme của protein và các sản phẩm cuối cùng của con đường này (Advanced Glycation End products; AGEs) tương tác với các thụ thể của chúng (RAGE) và điều chỉnh yếu tố tăng trưởng mô liên kết (CGTF) [13]. Hệ thống này (AGERAGE) có thể khởi đầu hoặc góp phần vào xơ hóa nhĩ ở bệnh nhân đái tháo đường thông qua kích thích yếu tố tăng trưởng tổ chức liên kết trong cơ nhĩ [14].
Rối loạn chức năng trong phân bố thần kinh tự trị và kiểm soát hệ tim mạch được xác định ở bệnh nhân tiểu đường [15]. Dường như sự mất cân bằng tự trị có lợi cho hệ thống giao cảm, có thể có vai trò trong sự khởi đầu của AF. Otake và cộng sự [16] trước đây đã ghi nhận sự kích thích giao cảm quá mức ở chuột bị đái tháo đườngdo streptozocin làm tăng tỷ lệ AF so với nhóm chứng. Các nghiên cứu điện sinh lý khác ở vùng tâm nhĩ chuột đái tháo đườngcho thấy thời gian trơ hiệu quả của nhĩ (atrial effective refractory period: AERP) rút ngắn và tăng sự phân tán của AERP. Một nghiên cứu lâm sàng khác cho thấy việc phục hồi tần số tim bị giảm ở bệnh nhân DM type 2 với phân suất tống máu bảo tồn có liên quan với sự gia tăng tỷ lệ AF [17]. Những nghiên cứu lâm sàng và xét nghiệm này ngụ ý rối loạn chức năng tự trị có vai trò trong sinh bệnh học của AF ở bệnh nhân DM.
Cấu trúc điện học nhĩ cũng bị ảnh hưởng ở bệnh nhân đái tháo đường. AERP rút ngắn làm tăng sự phân tán của AERD và thời gian dẫn truyền trong nhĩ, đó là những yếu tố chính của tu sửa điện học tâm nhĩ [16,18]. Chao và cộng sự đã phân tích bản đồ giải phẫu điện học ba chiều chi tiết của 228 bệnh nhân bị DM hoặc chuyển hóa glucose bất thường (abnormal glucose metabolism: AGM) và đã trải qua triệt phá AF trong thời gian trước tiên. Kết quả cho thấy các phép đo điện thế hai nhĩ trong nhóm DM và nhóm AGM thấp hơn đáng kể so với nhóm chứng. Hơn nữa những bệnh nhân này cũng đã tăng tỷ lệ tái phát AF trong giai đoạn theo dõi. Acar và cộng sự [20] đã chỉ ra trong nghiên cứu được công bố của họ, những bệnh nhân bị DM đã làm tăng đáng kể sự chậm trễ điện cơ học trong và ngoài nhĩ với chức năng tâm trương suy yếu so với nhóm chứng. Mặt khác, nó đã được chứng minh rằng có một sự thay đổi cụ thể trong tế bào để tích hợp tế bào ở bệnh nhân DM. Trong một nghiên cứu mô hình chuột mắc bệnh tiểu đường do streptozocin gây ra, biểu hiện của connexin 43 cao hơn đáng kể so với connexin 40 ở chuột đái tháo đường, có thể ký hiệu rằng biểu hiện của connexin 43 được điều chỉnh ở con vật đái tháo đườngnhư protein khoảng trống chức năng [21].
Ngược lại, có một số dữ liệu khác cho thấy sự biến động nồng độ đường trong máu hơn là môi trường tăng đường huyết dài hạn có liên quan đến việc tăng tỷ lệ AF ở bệnh nhân đái tháo đường [22]. Saito và cộng sự đã chỉ ra sự biến động glucose làm tăng tỷ lệ AF trong các mô hình chuột tiểu đường do streptozocin gây ra. Huxley và cộng sự [24] đã không thể hiện được mối tương quan giữa glucose lúc đói, mức insulin, nồng độ HbA1c và sự khởi phát AF ở những bệnh nhân không mắc bệnh tiểu đường. Một nghiên cứu lâm sàng khác do Fatemi và cộng sự đã đánh giátiền cứu ảnh hưởng của kiểm soát glucose tích cực trên tỷ lệ AF ở các bệnh nhân đái tháo đường. Điều thú vị là, họ không thể hiện bất kỳ mối liên quan nào giữa AF liên quan và điều trị tích cực so với nhóm điều trị tiêu chuẩn. Tuy nhiên, sự lựa chọn của họ về kiểm tra điện tâm đồ định kỳ thay vì máy ghi sự kiện có thể làm thay đổi kết quả dưới dạng thiếu các cơn AF kịch phát xuất hiện bất ký thời gian vềviệc thiếu các tập AF kịch phát xảy ra bất cứ lúc nào ngoàikiểm tra tại phòng khám.
Không có dữ liệu ngẫu nhiên để nhấn mạnh một cách chuyên biết về ảnh hưởng của DM trong loạn nhịp trên thất khác, nhưng có những báo cáo trường hợp thảo luận liệu những thay đổi cấp tính về mặt chuyển hóa trong quá trình các cơn nhiễm a xít ceto có thể khởi kích rối loạn nhịp như các cơn nhịp nhanh trên thấthay không[26].
Nhìn chung, DM dường như đóng vai trò then chốt trong việc tạo và duy trì AF ở BN đái tháo đường. Sự thay đổi cấu trúc, điệnhọcvà điện cơhọccụ thể trong tim BN đái tháo đườngcó thể tạo ra một chất nền giải phẫu cho sự phát triển của AF. Mặt khác, sự thay đổi cấp tính hoặc tăng đường huyết cấp tính trong nồng độ điện giải hoặc tình trạng axit-base và biến dạng hệ thống tự trị có thể là một cơ chế kích hoạt cho chứng loạn nhịp tim (Hình 1). Rõ ràng là vẫn còn những điểm chưa rõ về mối quan hệ giữa AF và DM cần phải nghiên cứu sâu hơn.
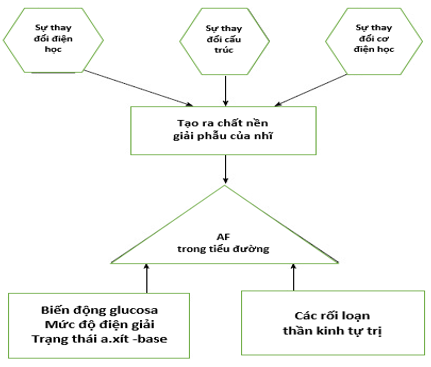
Hình 1: Các cơ chế sinh bệnh học tiềm tàng của rung nhĩ ở các bệnh nhân có DM
Đái tháo đường và rối loạn nhịp thất
Bệnh tim mạch (CVD) là nguyên nhân hàng đầu gây tử vong ở BN đái tháo đườngvà DM gần như là đồng nghĩa cho xơ vữa động mạch và bệnh động mạch vành. Tỷ lệ mắc và mức độ cao của bệnh tim xơ vữa động mạch ở BN đái tháo đườngdẫn đến tỷ lệ cao của loạn nhịp thất (VA) và đột tử do tim (SCD) là không tránh khỏi [27-29]. Mặc dù mối quan hệ gần gũi giữa VA, SCD và DM chủ yếu trên cơ sở mức độ bệnh động mạch vành ở BN đái tháo đường, các quá trình không do xơ vữa động mạch chẳng hạn như bệnh thần kinh tự động, bệnh mạch máu nhỏ, các thay đổi cấu trúc và điện học của thất có thể đóng vai trò một phần trong hiện tượng này [30].
Tái cực thất một cách bất thường, được phản ánh bằng khoảng thời gian QTc kéo dàicó liên quan đến nguy cơ cao cho rối loạn nhịp thất (VA). Có một số nghiên cứu đã cho thấy, có sự kéo dài QTc ở BN đái tháo đường[31]. Một yếu tố dự báo mạnh mẽ cho VAkhác, microvolt T (TWA) đã được nghiên cứu ở BN đái tháo đườngtype 2 không có CVDđã được biết, xem xét tình trạng đường huyết ở mỗi bệnh nhân (được phản ánh bằng nồng độ HbA1c) [32]. Trong nghiên cứu nhỏ này, tần số các bệnh nhâncó số đoTWA không điển hình cao hơn đáng kể so với nhóm chứng. Ở nhóm bệnh nhân đái tháo đường, bệnh nhân có số đo TWA không điển hình có nồng độ HbA1c tăng lên một cách đáng kể, kết luận là mức tăng HbA1c tăng 1% liên quan với nguy cơ cao gấp 13 lần TWA không điển hình và kiểm soát đường huyết dưới mức tối ưu có nguy cơcho VA tự phátcao hơn độc lập với khoảng thời gian QTc. Những kết quả từ các nghiên cứu này nghi nhận sự không ổn định điện học của cơ tim BN đái tháo đường, đã tạo ra nền tiềm ẩn cho rối loạn nhịp thất độc lập với các khu vực sẹo cơ tim do tổn thương tim thiếu máu cục bộ từ trước. Mặt khác, bệnh thần kinh tự trị ở BN đái tháo đườngdẫn đến sự kích thích giao cảm trên cơ tim bị mấtcân bằng, điều này có thể đóng góp thêm vào sự bất ổn định điệnhọcvà có khuynh hướng gây rối loạn nhịp nguy hiểm [33]. Trong bối cảnh này, bệnh lý thần kinh nhận cảm của tim ở BN đái tháo đườnglà một vấn đề quan trọng khác gây ra VA và đột tử tim một cách gián tiếp do thiếu máu cục bộ im lặng [34].
Khi DM tạo ra cho cơ tim dễ bị tổn thương đối với rối loạn nhịp, dường như điều nàycũng liên quan đến cơ chế khởi kích các rối loạn nhịp tim này. Một nghiên cứu từ Chen-Scarabelli và cộng sự đã nghiên cứu nếu có mối liên hệ giữa nồng độ HbA1c và nguy cơ VA ở những bệnh nhân đã được cấy máy khử rung tim được hồi cứu. Nghiên cứu bao gồm 141 bệnh nhân bị DM và 195 bệnh nhân không có DM. Một mối liên hệ đáng kể giữa nồng độ HbA1c 8% -10% và tỷ lệ VA tự phát ở bệnh nhân đái tháo đường được quan sát, chứ không phải điều kiện đái tháo đường và độc lập với QT kéo dài, một trạng thái kiểm soát đường huyếtdưới mứctối ưu và tăng đường huyết dai dẳng có liên quan với nguy cơ cao hơn của VA tự phát. Mặt khác, trong một nghiên cứutiền cứu ngẫu nhiênkhác, mối liên hệ giữa các cơn hạ đường huyết và VA ở những bệnh nhân có DM 2 và CVD được nghiên cứu [4]. Trong nghiên cứu này, đã có 30 bệnh nhân được điều trị bằng insulin và/hoặc sulfonylureas (SU) và có nhóm đối chứngcótuổiphù hợpgồm 12 bệnh nhân được điều trị bằng thuốc chống tăng đường huyết với nguy cơ hạ đường huyếtthấp. Đã có tỷ lệ cao của hạ đường huyết và VA im lặng trongnhóminsulin và / hoặc nhóm SU so sánh với nhóm đối chứng. Một nghiên cứu do Pistrosch và cộng sự đã phân tích sâu hơn tác dụng hạ đường huyết như là một kích hoạt cho VA trong nhóm bệnh nhân lớn hơn với DMtype 2cho thấy hạ đường huyết có thể kích hoạt VA và mức hormone kích thích tuyến giáp ở mức thấp bình thường, cho thấy cường giáp dưới lâm sàng, được kết hợpmột cách độc lậpvới sự xuất hiện của VA. Mặc dù hai nghiên cứu này không có mối quan hệ bình thường giữa hạ đường huyết và VA ở BN đái tháo đường, nhưng có thể cho rằng hạ đường huyết có thể gây khởi kích VA hoặckích thích giao cảm quá mức hoặc kéo dài QT[36].
Điều thú vị, một nghiên cứu khác nghiên cứu mối liên quan giữa bệnh đái tháo đườngvà VA ở bệnh nhân suy tim nặng đã cho thấy mối quan hệ âm tính độc lập với bệnh đái tháo đườngvà VA trong nhóm bệnh nhân này. Hơn nữa, các tác giả kết luận DM có thể có tác dụng bảo vệ cho sự xuất hiện của VA trong bối cảnh suy tim mất bù [37].
Tóm lại, DM có thể đóng một vai trò quan trọng trong việc tạo ra một nền dễ bị tổn thương và/hoặc như là một khởi kích cho VA ngoài nguy cơđượcdự kiến dựa trên mức độ cao và tỷ lệ mắc bệnh động mạch vành. Ngược lại, có dữ liệu lâm sàng cho thấy DM có tác dụng bảo vệ đối với VA ít nhất là ở một số nhóm bệnh nhân nhất định. Thật không may, không có đủ dữ liệu quy mô lớn ngẫu nhiên trong tài liệu để đề xuất một mối quan hệ nhất định và cơ chế sinh lý bệnh lý rõ ràng cho thực thể này.
Kết luận
AF và VA là dạng loạn nhịp phổ biến nhất, dẫn đến biến chứng tim mạch và tử vong ở bệnh nhân DM. Mặc dù, có một yếu tố nguy cơ dựa trên bằng chứng cho thấy nền loạn nhịp có thể liên quan cụ thể đến bệnh đái tháo đường, chẳng hạn như không đồng nhất trong tái cực nhĩ và thất, lan rộng tổn thương cơ tim, hình thành sẹo, rối loạn hệ thống tự trị, biến động glucose cũng như thay đổi cấu trúc và điện học, cơ chế sinh lý bệnh và sinh lý điện học cần được lưu ý trong các nghiên cứu tiếp theo.
Tài liệu tham khảo
1. Garcia MJ, McNamara PM, Gordon T, Kannel WB. Morbidity and mortality in diabetics in the Framingham population. Sixteen year follow-up study. Diabetes. 1974;23:105-111.
2. Benjamin EJ, Levy D, Vaziri SM, D’Agostino RB, Belanger AJ, Wolf PA. Independent risk factors for atrial fibrillation in a population-based cohort. The Framingham Heart Study. JAMA. 1994;271:840-844.
3. Huxley RR, Filion KB, Konety S, Alonso A. Meta-analysis of cohort and case-control studies of type 2 diabetes mellitus and risk of atrial fibrillation. Am J Cardiol. 2011;108:56-62.
4. Stahn A, Pistrosch F, Ganz X, Teige M, Koehler C, Bornstein S, Hanefeld M. Relationship between hypoglycemic episodes and ventricular arrhythmias in patients with type 2 diabetes and cardiovascular diseases: silent hypoglycemias and silent arrhythmias. Diabetes Care. 2014;37:516-520.
5. Pistrosch F, Ganz X, Bornstein SR, Birkenfeld AL, Henkel E, Hanefeld M. Risk of and risk factors for hypoglycemia and associated arrhythmias in patients with type 2 diabetes and cardiovascular disease: a cohort study under real-world conditions. Acta Diabetol. 2015;52:889-895.
6. Ball J, Carrington MJ, McMurray JJ, Stewart S. Atrial fibrillation: profile and burden of an evolving epidemic in the 21st century. Int J Cardiol. 2013;167:1807-1824.
7. Movahed MR, Hashemzadeh M, Jamal MM. Diabetes mellitus is a strong, independent risk for atrial fibrillation and flutter in addition to other cardiovascular disease. Int J Cardiol. 2005;105:315-318
8. Burstein B, Nattel S. Atrial fibrosis: mechanisms and clinical relevance in atrial fibrillation. J Am Coll Cardiol. 2008;51:802-809.
9. Corradi D. Atrial fibrillation from the pathologist’s perspective. Cardiovasc Pathol. 2006;23:71-84.
10. Kato T, Yamashita T, Sekiguchi A, Sagara K, Takamura M, Takata S, Kaneko S, Aizawa T, Fu LT. What are arrhythmogenic substrates in diabetic rat atria? J Cardiovasc Electrophysiol. 2006;17:890-894.
11. Dudley SC, Hoch NE, McCann LA, Honeycutt C, Diamandopoulos L, Fukai T, Harrison DG, Dikalov SI, Langberg J. Atrial fibrillation increases production of superoxide by the left atrium and left atrial appendage: role of the NADPH and xanthine oxidases. Circulation. 2005;112:1266-1273.
12. Anderson EJ, Kypson AP, Rodriguez E, Anderson CA, Lehr EJ, Neufer PD. Substrate-specific derangements in mitochondrial metabolism and redox balance in the atrium of the type 2 diabetic human heart. J Am Coll Cardiol. 2009;54:1891-1898.
13. Twigg SM, Cao Z, MCLennan SV, Burns WC, Brammar G, Forbes JM, Cooper ME. Renal connective tissue growth factor induction in experimental diabetes is prevented by aminoguanidine. Endocrinology. 2002;143:4907-4915.
14. Kato T, Yamashita T, Sekiguchi A, Tsuneda T, Sagara K, Takamura M, Kaneko S, Aizawa T, Fu LT. AGEs-RAGE system mediates atrial structural remodeling in the diabetic rat. J Cardiovasc Electrophysiol. 2008;19:415-420.
15. Pop-Busui R. Cardiac autonomic neuropathy in diabetes: a clinical perspective. Diabetes Care. 2010;33:434-441
16. Otake H, Suzuki H, Honda T, Maruyama Y. Influences of autonomic nervous system on atrial arrhythmogenic substrates and the incidence of atrial fibrillation in diabetic heart. Int Heart J. 2009;50:627-641.
17. Negishi K, Seicean S, Negishi T, Yingchoncharoen T, Aljaroudi W, Marwick TH. Relation of heart-rate recovery to new onset heart failure and atrial fibrillation in patients with diabetes mellitus and preserved ejection fraction. Am J Cardiol. 2013;111:748-753.
18. Heijman J, Voigt N, Nattel S, Dobrev D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circ Res. 2014;114:1483-1499.
19. Chao TF, Suenari K, Chang SL, Lin YJ, Lo LW, Hu YF, Tuan TC, Tai CT, Tsao HM, Li CH. Atrial substrate properties and outcome of catheter ablation in patients with paroxysmal atrial fibrillation associated with diabetes mellitus or impaired fasting glucose. Am J Cardiol. 2010;106:1615-1620.
20. Acar G, Akcay A, Sokmen A, Ozkaya M, Guler E, Sokmen G, Kaya H, Nacar AB, Tuncer C. Assessment of atrial electromechanical delay, diastolic functions, and left atrial mechanical functions in patients with type 1 diabetes mellitus. J Am Soc Echocardiogr. 2009;22:732-738.
21. Watanabe M, Yokoshiki H, Mitsuyama H, Mizukami K, Ono T, Tsutsui H. Conduction and refractory disorders in the diabetic atrium. Am J Physiol Heart Circ Physiol. 2012;303:H86-H95.
22. Lip GY, Varughese GI. Diabetes mellitus and atrial fibrillation: perspectives on epidemiological and pathophysiological links. Int J Cardiol. 2005;105:319-321.
23. Saito S, Teshima Y, Fukui A, Kondo H, Nishio S, Nakagawa M, Saikawa T, Takahashi N. Glucose fluctuations increase the incidence of atrial fibrillation in diabetic rats. Cardiovasc Res. 2014;104:5-14.
24. Huxley RR, Alonso A, Lopez FL, Filion KB, Agarwal SK, Loehr LR, Soliman EZ, Pankow JS, Selvin E. Type 2 diabetes, glucose homeostasis and incident atrial fibrillation: the Atherosclerosis Risk in Communities study. Heart. 2012;98:133-138.
25. Fatemi O, Yuriditsky E, Tsioufis C, Tsachris D, Morgan T, Basile J, Bigger T, Cushman W, Goff D, Soliman EZ. Impact of intensive glycemic control on the incidence of atrial fibrillation and associated cardiovascular outcomes in patients with type 2 diabetes mellitus (from the Action to Control Cardiovascular Risk in Diabetes Study). Am J Cardiol. 2014;114:1217-1222.
26. Thomas N, Scanlon J, Ahmed M. Supraventricular tachycardia in association with diabetic ketoacidosis. B J Diabetes Vasc Dis. 2007;7:244-245.
27. Fox CS, Coady S, Sorlie PD, Levy D, Meigs JB, D’Agostino RB, Wilson PW, Savage PJ. Trends in cardiovascular complications of diabetes. JAMA. 2004;292:2495-2499.
28. Cho E, Rimm EB, Stampfer MJ, Willett WC, Hu FB. The impact of diabetes mellitus and prior myocardial infarction on mortality from all causes and from coronary heart disease in men. J Am Coll Cardiol. 2002;40:954-960.
29. Balkau B, Jouven X, Ducimetière P, Eschwège E. Diabetes as a risk factor for sudden death. Lancet. 1999;354:1968-1969.
30. Wheeler SG, Ahroni JH, Boyko EJ. Prospective study of autonomic neuropathy as a predictor of mortality in patients with diabetes. Diabetes Res Clin Pract. 2002;58:131-138
31. Cardoso CR, Salles GF, Deccache W. Prognostic value of QT interval parameters in type 2 diabetes mellitus: results of a long-term follow-up prospective study. J Diabetes Complications. 2003;17:169-178.
32. Molon G, Costa A, Bertolini L, Zenari L, Arcaro G, Barbieri E, Targher G. Relationship between abnormal microvolt T-wave alternans and poor glycemic control in type 2 diabetic patients. Pacing Clin Electrophysiol. 2007;30:1267-1272.
33. Vinik AI, Ziegler D. Diabetic cardiovascular autonomic neuropathy. Circulation. 2007;115:387-397.
34. Faerman I, Faccio E, Milei J, Nuñez R, Jadzinsky M, Fox D, Rapaport M. Autonomic neuropathy and painless myocardial infarction in diabetic patients. Histologic evidence of their relationship. Diabetes. 1977;26:1147-1158.
35. Chen-Scarabelli C, Scarabelli TM. Suboptimal glycemic control, independently of QT interval duration, is associated with increased risk of ventricular arrhythmias in a high-risk population. Pacing Clin Electrophysiol. 2006;29:9-14.
36. Laitinen T, Lyyra-Laitinen T, Huopio H, Vauhkonen I, Halonen T, Hartikainen J, Niskanen L, Laakso M. Electrocardiographic alterations during hyperinsulinemic hypoglycemia in healthy subjects. Ann Noninvasive Electrocardiol. 2008;13:97-105.
37. Aronson D, Burger AJ. Diabetes and the occurrence of ventricular arrhythmic events in patients with severe left ventricular dysfunction. Diabetologia. 2002;45:1440-1445.







