TÓM TẮT
Mục tiêu
Đánh giá tỷ lệ mắc Bệnh thận mãn (CKD) giai đoạn 3-5 (giảm chức năng thận kéo dài dưới 60 ml/phút/1,73 m2) trong các bệnh nhân đái thào đường type 2 (ĐTĐ 2) trên năm năm, xác định các yếu tố nguy cơ liên quan đến suy thận, và đưa ra một bảng yếu tố nguy cơ để dự đoán mức độ suy thận trong vòng 5 năm để áp dụng vào lâm sàng.
Miguel A. Salinero-Fort, Francisco J. San Andrés-Rebollo, Carmen de Burgos-Lunar
Paloma Gómez-Campelo, Rosa M. Chico-Moraleja , Ana López de Andrés , Rodrigo Jiménez-García , MADIABETES Group
Người tổng hợp: ThS.BS Trịnh Thị Bích Hà
Bộ môn lão Khoa – ĐHYD TP HCM
Thiết kế nghiên cứu
Nghiên cứu MADIABETES là một nghiên cứu đoàn hệ tiến cứu trên 3.443 bệnh nhân ĐTĐ type 2 điều trị ngoại trú, lấy mẫu từ 56 trung tâm chăm sóc sức khỏe ban đầu (131 nghiên cứu viên) ở Madrid (Tây Ban Nha).
Kết quả
Tỷ lệ mắc bệnh thận mạn giai đoạn 3-5 sau năm năm là 10,23% (95% CI = 9,12-11,44) và tỉ suất mắc là 2,07 ca (95% CI = 1,83-2,33) trên 1000 bệnh nhân-tháng hoặc 2,48 ca (95 % CI = 2,19-2,79) trên 100 bệnh nhân-năm. Yếu tố nguy cơ cao nhất (HR) của suy thận giai đoạn 3-5 là albumin niệu 300 mg/g (HR = 4,57; 95% CI = 2,46-8,48). Ngoài ra, còn các yếu tố khác: tuổi trên 74 (HR = 3,20; 95% CI = 2,13-4,81), có tiền căn tăng huyết áp (HR = 2,02; 95% CI = 1,42-2,89), nhồi máu cơ tim (HR = 1,72; 95% IC = 1,25-2,37), rối loạn lipid máu (HR = 1,68; 95% CI 1,30-2,17), mắc bệnh đái tháo đường ≥ 10 năm (HR = 1,46; 95% CI = 1,14-1,88) và huyết áp tâm thu > 149 mmHg (HR = 1,52; 95% CI = 1,02-2,24).
Bàn luận
Sau năm năm theo dõi, tỷ lệ mắc của CKD phù hợp với tỷ lệ được mô tả ở Tây Ban Nha và các nước khác. Albumin niệu ≥ 300 mg/g và độ tuổi trên 74 là các yếu tố nguy cơ liên quan chặt chẽ với quá trình suy thận (giai đoạn 3-5). Kiểm soát huyết áp, lipid và albumin niệu có thể làm giảm tỷ lệ mắc CKD ở bệnh nhân ĐTĐ2.
Giới thiệu
Bệnh thận do đái tháo đường chiếm khoảng 40% BN ĐTĐ và được đặc trưng bởi albumin niệu, huyết áp cao và giảm dần chức năng thận dẫn đến bệnh thận giai đoạn cuối. Ngoài ra, những bệnh nhân này còn có nguy cơ cao mắc bệnh tim mạch, làm suy giảm chức năng thận nhiều hơn [1]. Bệnh thận mãn tính (CKD) được định nghĩa dựa vào sự hiện diện của tổn thương thận (protein niệu, tiểu ra máu, hoặc bất thường về giải phẫu) hoặc suy giảm chức năng thận từ ba tháng trở lên, không phụ thuộc chẩn đoán lâm sàng. Bệnh thận mạn giai đoạn 3-5 được phân loại dựa vào độ lọc cầu thận (GFR)< 60ml/ph/1,73m2 dựa trên bảng phân loại KDOQI [2].
GFR ước tính (eGFR) đã được chứng minh là một yếu tố nguy cơ độc lập có ý nghĩa đối với bệnh tim mạch và tử vong ở những bệnh nhân ĐTĐ2 [3, 4].
Tuy nhiên, không có đủ các nghiên cứu phân tích tỷ lệ giảm eGFR với yếu tố nguy cơ ở Nam Âu [5,6].
Chúng tôi đã tiến hành một nghiên cứu dựa trên nghiên cứu đoàn hệ của người Tây Ban Nha bị ĐTĐ 2 để đánh giá tỷ lệ bệnh thận mạn giai đoạn 3-5 (chức năng thận giảm dưới 60 ml/phút/1,73 m2) trong vòng năm năm, để xác định các yếu tố nguy cơ liên quan với sự phát triển của bệnh này, và để xây dựng một bảng nguy cơ để dự đoán mức độ suy thận trong vòng 5 năm khi áp dụng vào lâm sàng
Thiết kế nghiên cứu
Dân số và thiết kế nghiên cứu
Nghiên cứu MADIABETES là một nghiên cứu đoàn hệ tiến cứu trên 3.443 bệnh nhân ĐTĐ2 ngoại trú [7]. Các BN này được lấy mẫu từ 56 trung tâm chăm sóc sức khỏe ban đầu tại Thủ đô Madrid (Tây Ban Nha). Mẫu nghiên cứu được lựa chọn bằng cách lấy mẫu ngẫu nhiên đơn giản bằng cách sử dụng danh sách các bệnh nhân được chẩn đoán ĐTĐ trong hồ sơ bệnh án trên máy vi tính. Đây là phương pháp chọn mẫu, dựa trên các hồ sơ lâm sàng đã được xác nhận trước đó trên máy vi tính [8]. Trong nghiên cứu này, định nghĩa ĐTĐ2 được dựa trên các tiêu chuẩn chẩn đoán của Hiệp hội Đái tháo đường Mỹ [9], và vẫn có hiệu lực vào năm 2007.
Dữ liệu được thu thập bởi các nghiên cứu viên ở lần khám đầu (năm 2007) và hàng năm trong giai đoạn tiếp theo (2008-2012). Những dữ liệu này được ghi nhận mẫu báo cáo trường hợp điện tử. Lần khám cuối cùng được ghi nhận trong trường hợp BN bị mất theo dõi
Tiêu chí nhận bệnh: tuổi >30 và đã được chẩn đoán ĐTĐ2 trước đó.
Tiêu chuẩn loại trừ: ĐTĐ type 1, giảm chức năng thận trong lần thăm khám đầu tiên (eGFR <60ml/ph/1.73m2) (n = 787) và không có đầy đủ XN creatinine (n = 36). Trong số 2.620 BN được theo dõi cho đến năm 2012, 249 BN đã chết trong giai đoạn 2007-2012.
Sơ đồ quá trình nghiên cứu được thể hiện trong hình 1.
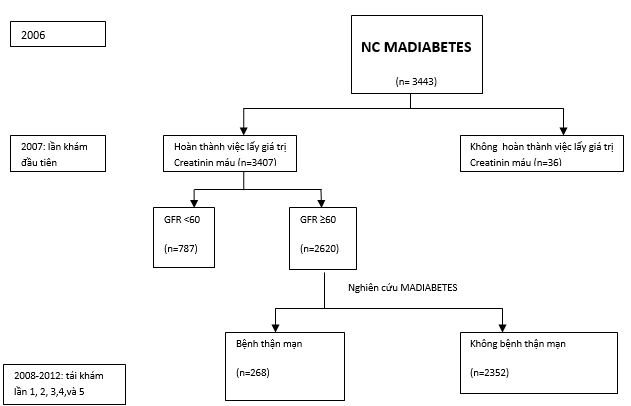
Hình 1: Mô hình nghiên cứu MADIABETES
Sau khi thu thập xong, tất cả các dữ liệu đã được kiểm toán nội bộ để đảm bảo chất lượng. Điều này liên quan đến việc lựa chọn ngẫu nhiên của 50 nghiên cứu viên tham gia nói chung và xem xét các bệnh án lâm sàng họ thu thập. Các dữ liệu thu thập có sự thống nhất chặt chẽ (cao hơn 88% cho tất cả các biến).
Biến kết quả của chúng tôi là tỷ lệ giảm chức năng thận (CKD giai đoạn 3-5 K/DOQI) được định nghĩa là eGFR <60 ml/phút /1,73m2 tại bất kỳ lần khám nào. eGFR đã được chứng minh là một chỉ số chính xác cho tình trạng suy thận [10].
Thời gian tham gia nghiên cứu của mỗi bệnh nhân được xác định là số tháng tính từ ngày của lần khám đầu tiên của họ trong năm 2008 cho đến khi một trong các trường hợp sau đây xảy ra: 1)ngày được chẩn đoán xác định BTM giai đoạn 3-5, 2) ngày của lần đăng ký trước, 3) ngày tử vong hay, 4) ngày 31 tháng 12 năm 2012 (lần cuối cùng).
Dữ liệu tử vong được lấy từ bệnh án, dựa vào giấy chứng tử để xác định những người bị mất theo dõi do chết trước khi các điểm kết thúc nghiên cứu (31 tháng 12 năm 2012).
Thời gian theo dõi trung bình cho mỗi bệnh nhân là 60 tháng (khoảng tứ phân vị [IQR] = 24)
Khám và Kết quả cận lâm sàng (CLS)
Tất cả các bệnh nhân đã được hỏi tiền sử bệnh, khám lâm sàng và xét nghiệm CLS. Các biến sau đây đã thu thập được ở lần khám đầu tiên: tuổi, giới tính và thời gian bị ĐTĐ 2 (năm). Các dữ liệu được thu thập thêm tại nơi khám bệnh trong mỗi lần tái khám (ít nhất một lần mỗi năm): đường huyết lúc đói (FPG), glycated hemoglobin (HbA1c), huyết áp tâm thu và huyết áp tâm trương, cholesterol, triglycerid (TG), HDL-C, LDL-C, albumin niệu, tình trạng hút thuốc (đang hút thuốc, đã bỏ thuốc lá, không hút thuốc), sử dụng thuốc hạ đường huyết và thuốc tim mạch (thuốc hạ áp, statin, aspirin), chỉ số khối cơ thể (BMI), tiền sử bệnh tim mạch (nhồi máu cơ tim hay đột quỵ) và cao huyết áp.
BMI được tính bằng trọng lượng/chiều cao2 (Kg/m2), bệnh nhân có BMI > 30 được xem là béo phì. Huyết áp (HA) được đo hai lần bằng cách sử dụng máy đo huyết áp đã được kiểm tra, hiệu chuẩn. Sau khi nghỉ ngơi 5 phút, đo lần 1 và sau 5 phút tiếp tục đo lần 2. Tăng huyết áp được định nghĩa là huyết áp tâm thu> 140 mmHg và/hoặc huyết áp tâm trương> 90 mmHg hoặc sử dụng các thuốc hạ huyết áp. Rối loạn lipid máu đã được xác định khi bất kỳ thay đổi lipid như sau: cholesterol toàn phần> 250 mg/dl hoặc triglycerides> 200 mg/dl; LDL-c> 130 mg/dl hay HDL-c <30 mg/g trong ít nhất hai trong số ba mẫu liên tiếp. Nguy cơ tim mạch đã được tính toán theo công thức REGICOR (một hiệu chuẩn của tiêu chuẩn Framingham thích hợp cho Tây Ban Nha) cho mỗi bệnh nhân [13]. Bệnh nhân có nguy cơ tim mạch 10% trong vòng mười năm được xem là có nguy cơ cao hoặc trung bình [14].
Cỡ mẫu
Cỡ mẫu được ước tính bằng cách sử dụng phân phối Poisson và có tính đến các giả định sau: 5% nguy cơ alpha, beta 20% nguy cơ và tỷ lệ tổn thất 10%. Do đó, 30 bệnh nhân với albumin niệu> 300 mg/g và 1.800 bệnh nhân có albumin niệu <300 là cần thiết để phát hiện một nguy cơ tương đối là 3,5 và 10% tỷ lệ suy thận ở nhóm bệnh nhân mất dấu.
Phân tích thống kê
Dữ liệu mô tả được thể hiện dưới dạng trung bình, độ lệch chuẩn, trung vị và IQR. So sánh các biến liên tục giữa hai nhóm được thực hiện bằng cách sử dụng test t- Student cho phân phối bình thường, kiểm định Mann-Whitney U cho các phân phối không bình thường, và phép kiểm Chi-square cho các biến định tính.
Số liệu được xử lý bằng phần mềm SPPSS 21.0 cho Window và STATA. Sự khác biệt có ý nghĩa thống kê khi p<0,05.
Vấn đề y đức
Nghiên cứu này đã được chấp thuận bởi Institutional Review Board của Bệnh viện Ramón y Cajal (Madrid). Tất cả các bệnh nhân đã ký văn bản đồng ý tham gia vào nghiên cứu.
Kết quả
Bảng 1 cho thấy các đặc điểm lâm sàng về nhân khẩu học, xã hội và trước nghiên cứu MADIABETES. Nữ chiếm 45,2% dân số nghiên cứu. Tuổi trung bình trong nhóm bệnh nhân này là 67,3 năm (SD = 10,8) và thời gian trung bình mắc ĐTĐ 2 là 8,5 T2DM năm (SD = 7,4). Đại đa số (91,6%) có nguy cơ thấp (ít hơn hoặc bằng 10 phần trăm) của biến cố mạch vành trong vòng mười năm tới.
Bảng 1: Đặc điểm lâm sàng của BN ĐTĐ2 trong nghiên cứu
|
N=2620 |
95%CI |
|
|
Giới nữ (%) |
45.2 |
43.3 – 47.1 |
|
Tuổi (năm), trung bình (SD) |
67.3 (10.8) |
66.8 – 67.7 |
|
Thời gian mắc bệnh ĐTĐ |
6 (7) |
6.0 – 7.0 |
|
Đang hút thuốc lá (%) |
18.1 |
16.6 – 19.6 |
|
Đã bỏ thuốc lá (%) |
27.4 |
25.8 – 29.8 |
|
Không hút thuốc lá |
54.5 |
52.6 – 56.6 |
|
Thuốc sử dụng |
||
|
Thuốc hạ ĐH uống |
75.2 |
73.5 – 76.8 |
|
Insulin |
17.4 |
16 – 19 |
|
Thuốc hạ áp |
81.7 |
80.2 – 83.2 |
|
Aspin |
48.8 |
46.8 – 50.7 |
|
Statin |
70.8 |
69 – 72.6 |
|
Tiền căn |
||
|
Nhồi máu cơ tim |
11.2 |
10 – 11.4 |
|
Đột quỵ |
71.1 |
6.2 – 8.2 |
|
Tăng HA |
69.7 |
68 – 71.5 |
|
Suy tim |
5.6 |
4.8 – 8.8 |
|
Bệnh thần kinh do ĐTĐ |
6.4 |
5.5 – 7.4 |
|
Bệnh lý võng mạc |
7.7 |
6.8 – 8.8 |
|
Bệnh mạch máu ngoại biên |
6.2 |
5.4 – 7.2 |
|
Sinh hiệu |
||
|
BMI (kg/m2), trung bình (SD) |
30 (5) |
29.8 – 30.2 |
|
HATT (mmHg), trung bình (SD) |
133.5 (13.7) |
132.9 – 134 |
|
HATTr (mmHg), trung bình (SD) |
77.2 (8.1) |
76.9 – 77.6 |
|
XN CLS |
||
|
Đường huyết đói (mg/dl), |
144.8 (41.8) |
143.1 – 146.4 |
|
BN có HbA1C<7% |
53.2 |
51.3 – 55.1 |
|
HbA1C (%), trung bình (SD) |
7.1 (1.2) |
7 – 7.1 |
|
Rối loạn lipid máu (%) |
57.2 |
55.3 – 59.1 |
|
Cholesterol toàn phần (mg/dl), trung bình (SD) |
192.8 (35.7) |
191.5 – 194.2 |
|
LDL-C (mg/dl), trung bình (SD) |
116 (29.7) |
114.9 – 117.2 |
|
HDL-C, (mg/dl), trung bình (SD) |
49 (12.6) |
48.6 – 49.5 |
|
TG, (mg/dl), trung bình (SD) |
144.3 (94) |
140.6 – 147.8 |
|
Albumin niệu (%) (1) |
20.1 |
17.4 – 23.1 |
SD: độ lệch chuẩn
Bảng 2 cũng cho thấy các đặc điểm của bệnh nhân đã bị suy thận so với những người không bị suy thận. Có sự khác biệt đáng kể về mặt thống kê giữa các bệnh nhân suy thận và không suy thận về tuổi, thời gian ĐTĐ2, tình trạng hút thuốc, và sử dụng thuốc (aspirin với thuốc hạ áp, và insulin). Bệnh nhân suy thận có nguy cơ tim mạch cao hơn (nhồi máu, đột quỵ, bệnh mạch máu ngoại vi, và suy tim sung huyết), các yếu tố nguy cơ tim mạch (tăng huyết áp), và các biến chứng ĐTĐ 2 mạn tính (bệnh lý võng mạc và bệnh thận). Tuy nhiên, không có sự khác biệt giữa các nhóm trong việc sử dụng đường uống thuốc hạ đường huyết, statin, nguy cơ bệnh mạch vành (Điểm REGICOR chức năng) và HA, HbA1c, LDL-cholesterol, BMI. Các bệnh nhân suy thận có tỷ lệ tử vong cao hơn nhóm chứng (18,3% so với 8,5%; p <0,001).
Bảng 2: So sánh các yếu tố giữa suy thận và không suy thận.
|
Bệnh thận mạn (n=268) |
Không mắc bệnh thận mạn (n=2352) |
p |
|
|
Giới nữ (%) |
48.5 |
44.8 |
0.247 |
|
Tuổi (năm), trung bình (SD) |
71.8 (9.8) |
66.7 (10.8) |
<0.001 |
|
Thời gian mắc bệnh ĐTĐ |
10.4 (8.2) |
8.3 (7.2) |
<0.001 |
|
Đang hút thuốc lá (%) |
11.7 |
18.8 |
0.004 |
|
Đã bỏ thuốc lá (%) |
29.7 |
27.2 |
0.384 |
|
Không hút thuốc lá |
58.6 |
54 |
0.152 |
|
Thuốc sử dụng (%) |
|||
|
Thuốc hạ ĐH uống |
79.8 |
74.7 |
0.068 |
|
Insulin |
25.2 |
16.6 |
0.001 |
|
Thuốc hạ áp |
95.7 |
80.1 |
<0.001 |
|
Aspin |
55.8 |
48 |
0.017 |
|
Statin |
74.4 |
70.4 |
0.183 |
|
Tiền căn |
|||
|
Nhồi máu cơ tim |
18.7 |
10.3 |
<0.001 |
|
Đột quỵ |
11.6 |
6.6 |
0.003 |
|
Tăng HA |
85.4 |
68 |
<0.001 |
|
Suy tim |
9.7 |
5.2 |
0.02 |
|
Bệnh thần kinh do ĐTĐ |
7.5 |
6.2 |
0.44 |
|
Bệnh lý võng mạc |
12.7 |
7.2 |
0.001 |
|
Bệnh mạch máu ngoại biên |
11.2 |
5.7 |
<0.001 |
|
Sinh hiệu |
|||
|
BMI (kg/m2), trung bình (SD) |
30.3 (5.3) |
30 (4.9) |
0.381 |
|
HATT (mmHg), trung bình (SD) |
136.7 (13) |
133.1 (13.7) |
0.288 |
|
HATTr (mmHg), trung bình (SD) |
76.7 (7.4) |
77.3 (8.1) |
0.983 |
|
XN CLS |
|||
|
Đường huyết đói (mg/dl), |
142.5 (42.9) |
145 (41.3) |
0.381 |
|
BN có HbA1C<7% |
52.3 |
53.3 |
0.751 |
|
HbA1C (%), trung bình (SD) |
7.1 (1.2) |
7.1 (1.8) |
0.954 |
|
Rối loạn lipid máu (%) |
54.5 |
57.5 |
0.336 |
|
Cholesterol toàn phần (mg/dl), trung bình (SD) |
191.8 (36.9) |
193 (35.5) |
0.616 |
|
LDL-C (mg/dl), trung bình (SD) |
113.3 (28.8) |
116.4 (29.7) |
0.12 |
|
HDL-C, (mg/dl), trung bình (SD) |
49.4 (13) |
49 (12.5) |
0.619 |
|
TG, (mg/dl), trung bình (SD) |
151.8 (100.5) |
143.4 (93.2) |
0.178 |
|
Albumin niệu (%) (1) |
126 (79) |
120 (77) |
0.07 |
|
Vi đạm niệu |
30.3 |
17 |
0.002 |
|
Tiểu đạm đại thể |
5.7 |
1 |
0.001 |
|
Tử vong do mọi nguyên nhân trong 5 năm (%) |
18.3 |
8.5 |
<0.001 |
Tỷ lệ mắc của CKD sau năm năm là 10,23% (95% CI = 9,12-11,43) và tỷ lệ tuyệt đối là 2,07 (95% CI = 1,83-2,33) ca trên 1000 bệnh nhân-tháng hoặc 2,48 (95% CI = 2.19 -2,79) ca trên 100 bệnh nhân-năm trong số bệnh nhân ĐTĐ2 ≥ 10 năm. Đối với BN ĐTĐ 2 <10 năm, tỷ lệ này là 2,03 ca trên 100 bệnh nhân-năm (95% CI = 1,73-2,38) và 3,54 (95% CI = 2,92-4,25) đối với bệnh nhân ĐTĐ 2 lâu hơn. Mức tỷ lệ được phân tầng theo thời gian bị ĐTĐ 2 có thể được coi là khác biệt đáng kể bởi vì 95% CI không trùng nhau.
Các yếu tố nguy cơ liên quan với tỷ lệ mắc CKD được thể hiện trong Bảng 3. Yếu tố liên quan cao nhất là albumin niệu ≥ 300 mg/g (HR = 4,57; CI 95% = 2,46-8,48). Ngoài ra còn các biến khác là độ tuổi trên 74 (HR = 3,20; 95% CI = 2,13-4,81), tiền căn cao huyết áp (HR = 2,02; 95% CI = 1,42-2,89), nhồi máu cơ tim (HR = 1,72 ; 95% CI = 1,25-2,37), rối loạn lipid máu (HR = 1,68; CI 95% = 1,30-2,17), huyết áp tâm thu> 149 mmHg (HR = 1,52; CI 95% = 1,02-2,24) và thời gian ĐTĐ 2 ≥10 năm (HR = 1,46; 95% CI = 1,14-1,88). Hơn nữa, một phân tích thăm dò của các dữ liệu cho thấy hội chứng chuyển hóa không liên quan đáng kể với tỷ lệ mắc CKD (HR = 1,08, KTC 95% = 0,8-1,5; p = 0,617)
Bảng 3: Yếu tố nguy cơ phát triển thành bệnh thận mạn sau 5 năm (n=2620)
|
Biến số |
aHR |
HR 95% CI |
Giá trị p |
|
Tuổi |
|||
|
<60 |
1 |
1.25 – 2.77 |
0.02 |
|
60-74 |
1.86 |
2.13 – 4.81 |
<0.001 |
|
>74 |
3.2 |
||
|
Albumin niệu |
|||
|
<30 mg/g |
1 |
||
|
30-299 mg/g |
1.67 |
1.11 – 2.5 |
0.013 |
|
>=300 mg/g |
4.57 |
2.46 – 8.48 |
<0.001 |
|
Giới |
|||
|
Nam |
1 |
||
|
Nữ |
1.15 |
0.89 – 1.49 |
0.283 |
|
Tiền căn THA trước đó |
|||
|
Có |
1 |
||
|
Không |
2.02 |
1.42 – 2.89 |
<0.001 |
|
Thời gian mắc bệnh ĐTĐ |
|||
|
<10 năm |
1 |
||
|
>=10 năm |
1.46 |
1.14 – 1.88 |
0.003 |
|
Nhồi máu cơ tim |
|||
|
Không |
1 |
||
|
Có |
1.72 |
1.25 – 2.37 |
0.001 |
|
Rối loạn lipid máu |
|||
|
Không |
1 |
||
|
Có |
1.68 |
1.3 – 2.17 |
<0.001 |
|
Huyết áp tâm thu |
|||
|
<130 mmHg |
1 |
||
|
130-149 mmHg |
1.22 |
0.91 – 1.64 |
0.184 |
|
>149 mmHg |
1.52 |
1.02 – 2.24 |
0.037 |
aHR: Adjusted Hazard Ratio (Tỷ số nguy cơ hiệu chỉnh)
Bảng 4 cho thấy xác suất nguy cơ bị suy thận. Nguy cơ lớn nhất được quan sát thấy ở những bệnh nhân trên 75 tuổi, với thời gian ĐTĐ 2 ≥10 năm, tăng huyết áp, albumin niệu ≥300 mg/g, huyết áp tâm thu ≥150 mmHg, rối loạn lipid máu và NMCT cấp. Giá trị C-index của Harrell cho mô hình CKD là 70,3 (95% CI = 66,5-73,9), điều này cho thấy khả năng dự đoán tốt để phân biệt giữa các bệnh nhân có và không có suy thận.
Bàn luận
Tỷ lệ bệnh thận mạn
Trong nghiên cứu của chúng tôi, Tỷ lệ bệnh thận mạn trong 5 năm là 10,23% (2,04% / năm). Tỷ lệ này phù hợp với những giá trị nghiên cứu trước đây ở những bệnh nhân ĐTĐ2. Tuy nhiên, tỷ lệ CKD (giai đoạn 3-5) của chúng tôi là cao hơn các NC khác là 2,48 trường hợp trên 100 bệnh nhân-năm so với 0,133-0,200 trường hợp trên 100 bệnh nhân-năm [19,20]. Những khác biệt này có thể được giải thích, một phần, như các nghiên cứu sử dụng dữ liệu từ những năm 1990 khi tỷ lệ suy chức năng thận ở bệnh nhân đái tháo đường thấp hơn ngày hôm nay [21]. Tỷ lệ hiện tại cao hơn của GFR giảm là bởi vì tuổi khởi phát của bệnh tiểu đường type 2 đang giảm, cho phép bệnh nhân đủ thời gian mắc bệnh để phát triển các biến chứng vi mạch máu. Hơn nữa, sự sống còn của bệnh nhân đái tháo đường có bệnh thận mạn đã được cải thiện do đó tăng tỷ lệ [22].
Bệnh nhân bị ĐTĐ lâu ngàycó tỷ lệ suy thận cao hơn người mới được chẩn đoán gần đây. Những phát hiện này trong thỏa thuận với các nghiên cứu được công bố [5], cho thấy rằng những bệnh nhân được chẩn đoán ĐTĐ 2 > 15 năm cho thấy hàng năm eGFR giảm 1.0 mL / phút / 1,73 m2 mỗi năm và so với giảm 0.7 mL / phút / 1,73 m2 mỗi năm ở những bệnh nhân vừa mới được chẩn đoán. Tuy nhiên, các nghiên cứu khác đã không tìm thấy mối liên quan giữa thời gian ĐTĐ2 và mức độ giảm eGFR [27].
Yếu tố nguy cơ
Trong nghiên cứu đoàn hệ này, những biến số chính liên quan đến tỷ lệ suy thận giai đoạn 3-5 là albumin niệu ≥ 300 mg / g và tuổi> 74. Một số mô hình dự báo của suy thận bao gồm tuổi tác và sự hiện diện albumin niệu, cả trong dân số chung và ở những bệnh nhân ĐTĐ 2 [24,26-28]. Tuy nhiên, Tangri và cộng sự [16] đã xác định tuổi như là một yếu tố bảo vệ cho diễn tiến suy thận(chạy thận hoặc thay thận). Trong nghiên cứu này, HR là 0.61 (p <0,05) cho mỗi lần tăng 5 mL / phút / 1.73m2. Phát hiện này là không phù hợp với đại đa số các nghiên cứu, và có lẽ là do thực tế chạy thận và ghép thận chủ yếu cung cấp cho các bệnh nhân trẻ.
Albumin niệu (bao gồm microalbumin niệu và albumin niệu) là một yếu tố nguy cơ của suy thận. Nghiên cứu quan sát đã chỉ ra mối quan hệ giữa tăng albumin niệu và giảm GFR. Ở những bệnh nhân ĐTĐ2, một nguy cơ tương đối là 3,6 (95% CI = 1,6-8,4) [28]. Ngoài ra, GFR giảm nhiều hơn ở những bệnh nhân có microalbumin niệu (1,7 ml mỗi phút mỗi năm) so với những người không có albumin niệu [28].
Tương tự như vậy với các nghiên cứu trước đó, số liệu của chúng tôi cho thấy albumin niệu≥300 mg / g liên quan chặt chẽ đến suy thận (HR = 4,57; CI 95% = 2,46-8,48). Mặt khác, sự liên quan giữa tỷ lệ bài tiết albumin và GFR đã được báo cáo ở những bệnh nhân ĐTĐ 2 [29,30].
Như được ghi chép trong y văn [31], albumin niệu> 300 mg / g là một yếu tố nguy cơ cũng được thành lập với tỷ lệ suy thận và điều này được phản ánh trong số liệu của chúng tôi. Vì vậy, chúng tôi khuyến cáo các nhà cung cấp chăm sóc y tế tăng cường nỗ lực để ngăn chặn và / hoặc đảo ngược albumin niệu ở những bệnh nhân của họ. Một phân tích gộp các nghiên cứu can thiệp đã chứng minh rằng việc giảm tỷ lệ ban đầu về tốc độ bài tiết albumin là 20,8% trong bệnh thận mạn giai đoạn cuối do ĐTĐ2 tương ứng với giảm GFR là 9,2% [32].
Ngoài ra, hai nghiên cứu đã chứng minh rằng một số bệnh nhân ĐTĐ có tỷ lệ thanh thải creatinin thấp vẫn không có microalbumin niệu [33,34]. Tương tự như vậy, trong nghiên cứu UKPDS-74 đa số (51%) bệnh nhân bị suy thận giai đoạn 3-5 không có microalbumin niệu [26].
Tăng huyết áp vừa là nguyên nhân vừa ảnh hưởng của suy thận. Một phân tích của một số nghiên cứu can thiệp lớn đã chỉ ra rằng giảm HA trung bình trong khi điều trị sẽ làm giảm độ suy giảm GFR [35]. HATT/24h tăng 1 độ lệch chuẩn làm tăng nguy cơ mắc bệnh thận giai đoạn cuối bằng 3,04 (95% CI = 2,13-4,35) và bằng 2,20 (95% CI = 1,43-2,39) khi nó được điều chỉnh xuống HA tiêu chuẩn [36 ]. Ngoài ra, kiểm soát HA đã được chứng minh là làm giảm tỷ lệ albumin niệu, HATT giảm 10 mmHg thì tỷ lệ CKD giảm khoảng 10% [37]. Nhiều nghiên cứu đã báo cáo tăng nguy cơ suy thận ở bệnh nhân tăng huyết áp [24,38-40] với HR : 1,4-3,0. Nghiên cứu của chúng tôi cho thấy có huyết áp tâm thu trong phạm vi trên (> 149 mmHg) dẫn đến một tỷ lệ CKD cao hơn khoảng 50% (HR = 1,52; 95% CI = 1,02-2,24; p = 0,037). HergetRosenthal và cộng sự [41] tìm ra tăng huyết áp được chứng minh là một yếu tố nguy cơ (HR 4,83; CI 95% = 1,18-19,35) gây giảm eGFR > 7,5 ml / phút / 1,73 m2 ở những bệnh nhân có nguy cơ cao ban đầu sau ba năm theo dõi. Tuy nhiên, các nghiên cứu khác đã không tìm thấy một mối quan hệ giữa huyết áp tâm thu và tỷ lệ mắc CKD 3-5 sau khi hiệu chỉnh tuổi [42].
Rối loạn lipid máu không liên quan đến giai đoạn suy thận trong dân số nói chung và bệnh nhân ĐTĐ2 trong NC. Trong khi có khá nhiều bằng chứng cho thấy rối loạn lipid máu có vai trò quan trọng trong sự tiến triển của bệnh thận ở bệnh nhân đái tháo đường [43], các nghiên cứu khác đã chỉ ra rằng TG cao [44] và HDL cholesterol thấp, nhưng không LDL cholesterol, dự đoán một tăng nguy cơ rối loạn chức năng thận [45] và giảm GFR [46]. Trong thực tế, các nghiên cứu lớn nhất nghiên cứu câu hỏi này trên 2.193 bệnh nhân ĐTĐ2 và chức năng thận bình thường lúc ban đầu. Trong nghiên cứu này, HDL tăng 0,26 mmol / L làm giảm 24% tốc độ phát triển CKD [47]. Trong nghiên cứu của chúng tôi, rối loạn lipid máu làm tăng nguy cơ suy thận 68% (HR = 1,68; CI 95% = 1,30-2,17; p <0,001). Tuy nhiên, các nghiên cứu UKPDS 74 không tìm thấy sự liên quan này [26].
Nữ giới thường liên quan đáng kể với sự suy giảm của GFR [24,26,40]. Tuy nhiên, các nghiên cứu khác đã tìm thấy một liên quan cao hơn với nam giới [42]. Chúng tôi tìm thấy một liên quan không đáng kể giữa giới nữ và các giai đoạn CKD (HR = 1,15; CI 95% = 0,89-1,49; p = 0,283).
Bệnh mạch vành đã được chứng minh là một yếu tố nguy cơ để phát triển suy thận [48]. Tuy nhiên, một số nghiên cứu đã không tìm thấy sự liên kết này [16,24,40-42,50,51]. Trong nghiên cứu này, nhồi máu cơ tim cho thấy một HR là 1,72 (95% CI = 1,25-2,37; p <0,001).
Mối liên hệ giữa suy thận cấp tính và tỷ lệ nhồi máu cơ tim rất biến đổi từ 1,4 (GFR 45-59 mL / phút / 1,73 m2) đến 3.4 (GFR <15mL/phút/1,73m2) [52].
Ảnh hưởng của suy thận (giai đoạn 3-5) trên tỷ lệ tử vong sau 5 năm (18,3% so với 8,5%; p <0,001) là phù hợp với báo cáo trước [53-56] cho thấy tỷ lệ tử vong tăng hơn 2 lần ở bệnh nhân giảm GFR so với những bệnh nhân có GFR bình thường.
Mặc dù gần đây một phân tích gộp [57] cho thấy Hội chứng chuyển hóa đã liên quan đến giảm eGFR <60 mL/phút/1,73m2, với OR = 1,55 (95% CI = 1,34-1,80), nghiên cứu của chúng tôi đã không tìm thấy mối liên quan như vậy. Vì vậy, hội chứng trao chuyển hóa không được đưa vào mô hình của chúng tôi và chúng tôi thay bằng tăng huyết áp và rối loạn lipid máu.
Cuối cùng, các yếu tố khác như chế độ ăn Địa Trung Hải có thể được xem là một yếu tố trong sự phát triển của tỷ lệ suy thận ở bệnh nhân ĐTĐ2. Ví dụ, Dunkler và cộng sự [58] nghiên cứu việc thay đổi chế độ ăn (mAHEI) cho thấy những người có chế độ ăn lành mạnh có nguy cơ CKD thấp hơn (OR = 0,74; 95% CI = 0,64 -0.84) và giảm nguy cơ tử vong (OR = 0,61; 95% CI = 0,48-0,78). Ngoài ra, người tham gia tiêu thụ nhiều hơn 3 phần trái cây mỗi tuần có nguy cơ CKD thấp hơn so với người tham gia tiêu thụ các mặt hàng thực phẩm ít thường xuyên hơn. Trong ý nghĩa này có thể là chế độ ăn Địa Trung Hải đã có một hiệu ứng tương tự. Tuy nhiên, các nghiên cứu khác nhau trong quần thể Địa Trung Hải đã không cho thấy tỷ lệ tỷ lệ thấp hơn của CKD so với dân số không Địa Trung Hải [59]. Trong nghiên cứu của chúng tôi, chúng tôi đã không thu thập dữ liệu về tiêu thụ thực phẩm, vì vậy chúng tôi không thể phân tích ảnh hưởng của chế độ ăn uống.
Bảng 4: Nguy cơ giảm độ lọc cầu thận GFR (giai đoạn 3-5 theo K/DOGI), trong 5 năm:
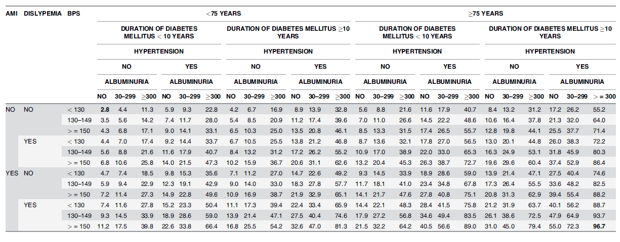
AMI: Nhồi máu cơ tim cấp
BPS: Huyết áp tâm thu
Đây có lẽ là nghiên cứu đầu tiên đã xây dựng một bảng yếu tố nguy cơ đơn giản để dự đoán nguy cơ suy thận trong 5 năm ở bệnh nhân ĐTĐ 2. Ví dụ: tuổi trên 75 tuổi, tăng huyết áp, nhồi máu cơ tim, albumin niệu ≥300 mg/g, rối loạn lipid máu, thời gian ĐTĐ2 ≥ 10 năm, và huyết áp tâm thu≥ 150 mmHg; nguy cơ phát triển CKD trong năm năm theo dõi là 96,7%. Tuy nhiên, trong cùng một bệnh nhân, mà không có albumin niệu nguy cơ được giảm đến 55%, và không có albumin niệu và huyết áp tâm thu <130 mmHg nguy cơ được tiếp tục giảm đến 40,1%. Như vậy, sau khi thay đổi huyết áp tâm thu và albumin niệu nguy cơ giảm từ 96,7% đến 40,1% (56,6 điểm phần trăm ít hơn).
Bảng yếu tố nguy cơ này cho phép tính toán ước lượng nguy cơ cá nhân và có thể giúp ích trong việc phát triển các chiến lược giảm thiểu nguy cơ bằng cách nêu bật một số thông số như huyết áp tâm thu, hoặc albumin niệu, cần kiểm soát. Vì vậy, nó là đặc biệt hữu ích cho các Bác sĩ lâm sàng trong việc chăm sóc bệnh nhân ĐTĐ2, vì nó cho phép giám sát yếu tố nguy cơ theo thời gian và có thể được sử dụng bởi các bác sĩ đa khoa tại các trung tâm chăm sóc sức khỏe ban đầu để xác định bệnh nhân có nguy cơ cao và cải thiện công tác phòng chống suy thận.
Ý nghĩa và hạn chế của nghiên cứu
Có nhiều ý nghĩa tiềm năng của bài báo này. Sai số lựa chọn là một hạn chế quan trọng của nghiên cứu này và có thể ảnh hưởng đến giá trị bên ngoài của các kết quả của chúng tôi. Mẫu nghiên cứu không đại diện dân số chung vì nó đã được lấy từ bệnh nhân ngoại trú đến khám tại Trung tâm Chăm sóc sức khỏe ban đầu. Những bệnh nhân đến các phòng khám tư nhân, những người có thể có một tình trạng kinh tế xã hội cao hơn, có thể thiếu đại diện trong mẫu của chúng tôi. Hơn nữa, nghiên cứu đã được tiến hành ở Madrid, một thành phố lớn ở Tây Ban Nha, trong đó có thể không đại diện cho toàn bộ dân số Tây Ban Nha về thu nhập, trình độ học vấn, lối sống, và hồ sơ y tế. Nghiên cứu đoàn hệ tiến cứu MADIABETES được mô tả tốt, gồm những người sống chung với ĐTĐ2 và phân tích kết quả cận lâm sàng. Theo dự kiến, một số bệnh nhân có giá trị creatinine huyết thanh không đầy đủ tại cơ sở y tế (n = 36; 1%) hoặc mất theo dõi (n = 49; 1,4%). Nhờ tính năng này của nghiên cứu này, bệnh nhân được theo dõi cho đến khi tiếp xúc cuối cùng với một bác sĩ đa khoa hoặc cho đến khi chết; tổng cộng 249 đối tượng đã chết trong thời gian theo dõi. Điều này phải được xem xét khi khái quát hóa các kết quả nghiên cứu.
Cuối cùng, điều quan trọng là phải xem xét rằng một số biến số gây nhiễu, chẳng hạn như tuân thủ các phương pháp điều trị y tế, có thể không có được thu thập trong nghiên cứu này và chúng ta có thể không hoàn toàn loại trừ khả năng gây nhiễu dư. Ngoài ra, nó là cần thiết để xác nhận các mô hình đa biến trong một phương trình theo thời gian dài hơn để cải thiện độ chính xác và độ tin cậy.
Quan trọng hơn, các bác sĩ đa khoa có thể cải thiện chất lượng chăm sóc cho bệnh nhân ĐTĐ2 của họ bằng việc có thể tính được tỉ lệ nguy cơ. Điều này sẽ giúp cung cấp các tư vấn lâm sàng tốt hơn và cải thiện việc ra quyết định. Điểm mạnh của nghiên cứu này bao gồm các thiết kế tương lai, trong đó đảm bảo rằng đo lường các yếu tố nguy trong quá trình làm giảm eGFR.
Kết luận
Sau khi theo dõi năm năm, tỷ lệ của CKD phù hợp với giá công bố trước đây trong các tài liệu. Tuổi trên 74 và albumin niệu ≥ 300 mg/g là những yếu tố nguy cơ liên quan mạnh mẽ hơn với tỷ lệ suy thận giai đoạn 3-5. Kết quả của chúng tôi cho thấy rằng kiểm soát tốt huyết áp, lipid và albumin niệu có thể làm giảm tỷ lệ suy thận ở bệnh nhân ĐTĐ2. Cần có thêm các nghiên cứu để khẳng định vai trò của các biến này là yếu tố nguy cơ và làm sáng tỏ mối quan hệ nhân quả của chúng với CKD.
TLTK
1. Parving HH, Mauer M, Ritz E. Diabetic nephropaty. In: Brenner BM, editor. Brenner and Rector`s The Kidney. 7th ed. Philadelphia: WB Saunders; 2004. p. 1777–818.
2. Zoppini G, Tahger G, Chonchol M, Ortalda V, Negri C, Stoico V, et al. Predictors of estimated GFR decline in patients with type 2 diabetes and preserved kidney function. Clin J Am Soc Nephrol 2012; 7(3):401–8. doi: 10.2215/CJN.07650711 PMID: 22282481
3. ESRD Incidence Study Group, Stewart JH, McCredie MR, Williams SM. Divergent trends in the incidence of end-stage renal disease due to Type 1 and Type 2 diabetes in Europe, Canada and
4. Selvin E, Coresh J, Zhu H, Folsom A, Steffes MW. Measurement of HbA1c from stored whole blood samples in the Atherosclerosis Risk in Communities study. J Diabetes 2010; 2(2):118–24. doi: 10. 1111/j.1753-0407.2010.00070.x PMID: 20923494
5. Marrugat J, Solanas P, DAgostino R, Sullivan L, Ordovas J, Cordón F, et al. Coronary risk estimation in Spain using a calibrated Framingham function. Rev Esp Cardiol 2003; 56(3):253–61. PMID: 12622955
6. Harrel FE, Lee KL, Mark DB. Multivariable prognostic models: issues in developing models, evaluating assumptions and adequacy, and measuring and reducing errors. Stat Med 1996; 15(4):361–87. PMID: 8668867
7. Domenech JM, Navarro JB. Análisis de la supervivencia y modelo de riesgos proporcionales de Cox. Barcelona:Signo;2008.
8. De Boer IH, Rue TC, Hall YN, Heagerty PJ, Weiss NS, Himmelfarb J. Temporal trends in the prevalence of diabetic kidney disease in the United States. JAMA 2011; 305(24):2532–39. doi: 10.1001/ jama.2011.861 PMID: 21693741
9. Rossing P. Diabetic nephropathy: worldwide epidemic and effects of current treatment and natural history. Curr Diab Rep 2006; 6(6):479–83. PMID: 17118233
10. Zoppini G, Targher G, Choncol M, Ortalda V, Abaterusso C, Pichiri I, et al. Serum uric acid levels and incident chronic kidney disease in patients with type 2 diabetes and preserved kidney function. Diabetes Care 2012; 35(1):99–104. doi: 10.2337/dc11-1346 PMID: 22028277
11. Maclsaac RJ, Tsalamandris C, Panagiotopoulos S, Smith TJ, McNeil KJ, et al. Nonalbuminuric renal insufficiency in type 2 diabetes. Diabetes Care 2004; 27(1):195–200. PMID: 14693989
12. Gansevoort RT, Matsushita K, van der Velde M, Astor BC, Woodward M, Levey AS, et al. Lower estimated GFR and higher albuminuria are associated with adverse kidney outcomes. A collaborative meta-analysis of general and high-risk population cohorts. Kidney Int 2011; 80(1):93–104. doi: 10. 1038/ki.2010.531 PMID: 21289597
13. Herget-Rosenthal S, Dehnen D, Kribben A, Quellmann T. Progressive chronic kidney disease in primary care: modifiable risk factors and predictive model. Prev Med 2013; 57(4):357–62. doi: 10.1016/j. ypmed.2013.06.010 PMID: 23783072
14. Muntner P, Coresh J, Smith JC, Eckfeldt J, Klag MJ. Plasma lipids and risk of developing renal dysfunction: the atherosclerosis risk in communities study. Kidney Int 2000; 58(1):293–301. PMID: 10886574
15. Thakar CV, Christianson A, Himmelfarb J, Leonard AC. Acute kidney injury episodes and chronic kidney disease risk in diabetes mellitus. Clin J Am Soc Nephrol 2011, 6(11):2567–72. doi: 10.2215/CJN. 01120211 PMID: 21903988
16. Chronic Kidney Disease Pognosis Consortium, Matsushita K, van der Velde M, Astor BC, Woodward M, Levey AS, et al. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet 2010; 375(9731):2073–81. doi: 10.1016/S0140-6736(10)60674-5 PMID: 20483451
17. Dunkler D, Deghan M, Teo KK, Heinze G, Gao P, Kohl M, et al. Diet and kidney disease in high-risk individuals with type 2 diabetes mellitus. JAMA Intern Med 2013; 173(18):1682–92. PMID: 23939297
18. Díaz-López A, Bulló M, Martínez-González MÁ, Guasch-Ferré M, Ros E, Basora J, et al. Effects of Mediterranean diets on kidney function: a report from the PREDIMED trial. Am J Kidney Dis 2012; 60(3):380–9. doi: 10.1053/j.ajkd.2012.02.334 PMID: 22541738
19. Humphrey LL, Ballard DJ, Frohnert PP, Chu CP, OFallon WM, Palumbo PJ. Chronic renal failure in
non-insulin-dependent diabetes mellitus. A population-based study in Rochester, Minnesota. Ann Intern
Med 1989; 111(10):788–96. PMID: 2817626
20. Brancati FL, Whelton PK, Randall BL, Neaton JD, Stamier J, Klag MJ. Risk of end-stage renal disease
in diabetes mellitus: a prospective cohort study of men screened for MRFIT. Multiple Risk Factor Intervention
Trial. JAMA 1997; 278(23):2069–74. PMID: 9403420
21. De Boer IH, Rue TC, Hall YN, Heagerty PJ, Weiss NS, Himmelfarb J. Temporal trends in the prevalence
of diabetic kidney disease in the United States. JAMA 2011; 305(24):2532–39. doi: 10.1001/
jama.2011.861 PMID: 21693741
22. Rossing P. Diabetic nephropathy: worldwide epidemic and effects of current treatment and natural history.
Curr Diab Rep 2006; 6(6):479–83. PMID: 17118233
23. DCCT/EDIC Research Group, de Boer IH, Sun W, Cleary PA, Lachin JM, Molitch M, et al. Intensive diabetes
therapy and glomerular filtration rate in type 1 diabetes. N Engl J Med 2011; 365(25):2366–76.
doi: 10.1056/NEJMoa1111732 PMID: 22077236
24. Afghari H, Cederholm J, Eliasson B, Zethelius B, Gudbjömsdottir S, Hadimeri H, et al. Risk factors for
the development of albuminria and renal impairment in type 2 diabetes-the Swedish National Diabetes
Risk Factors of Chronic Kidney Disease in SpainRegister (NDR). Nephrol Dial Transplant 2011; 26(4):1236–43. doi: 10.1093/ndt/gfq535 PMID:
20817668
25. Zoppini G, Targher G, Choncol M, Ortalda V, Abaterusso C, Pichiri I, et al. Serum uric acid levels and incident
chronic kidney disease in patients with type 2 diabetes and preserved kidney function. Diabetes
Care 2012; 35(1):99–104. doi: 10.2337/dc11-1346 PMID: 22028277
26. Retnakaran R, Cull CA, Thorne KI, Adler AI, Holman RR, UKPDS Study Group. Risk factors for renal
dysfunction in type 2 diabetes: U.K. Prospective Diabetes Study 74. Diabetes 2006; 55(6):1832–39.
PMID: 16731850
27. Gunzler D, Bleyer AJ, Thomas RL, OBrien A, Russel GB, Sattar A, et al. Diabetic nephropathy in a sibling
and albuminuria predict early GFR decline: a prospective cohort study. BMC Nephrol 2013; 14:124.
doi: 10.1186/1471-2369-14-124 PMID: 23773264
28. Newman DJ, Mattock MB, Dawnay AB, Kerry S, McGuire A, Yaqoob M, et al. Systematic review on
urine albumin testing for early detection of diabetic complications. Health Technol Asses 2005; 9(30):
iii–vi,xiii–163. PMID: 16095545
29. Kramer HJ, Nguyen QD, Curhan G, Hsu CY. Renal insufficiency in the absence of albuminuria and retinopathy
among adults with type 2 diabetes mellitus. JAMA 2003; 289(24):3273–7. PMID: 12824208
30. Maclsaac RJ, Tsalamandris C, Panagiotopoulos S, Smith TJ, McNeil KJ, et al. Nonalbuminuric renal insufficiency
in type 2 diabetes. Diabetes Care 2004; 27(1):195–200. PMID: 14693989
31. Gansevoort RT, Matsushita K, van der Velde M, Astor BC, Woodward M, Levey AS, et al. Lower estimated
GFR and higher albuminuria are associated with adverse kidney outcomes. A collaborative
meta-analysis of general and high-risk population cohorts. Kidney Int 2011; 80(1):93–104. doi: 10.
1038/ki.2010.531 PMID: 21289597
32. Jerums G, Panagiotopoulos S, Premaratne E, Power DA, Maclsaac RJ. Lowering of proteinria in response
to antihypertensive therapy predicts improved renal function in late but not in early diabetic
nephropaty: a pooled analysis. Am J Nephrol 2008; 28(4):614–27. doi: 10.1159/000117461 PMID:
18285683
33. Lane PH, Steffes MW, Mauer SM. Glomerular structure in IDDM women with low glomerular filtration
rate and normal urinary albumin excretion. Diabetes 1992; 41(5):581–6. PMID: 1568527
34. Tsalamandris C, Allen TJ, Gilbert RE, Sinha A, Panagiotopoulos S, Cooper ME, et al. Progressive decline
in renal function in diabetic patients with and without albuminuria. Diabetes 1994; 43(5):649–55.
PMID: 8168641
35. Bakris GL, Williams M, Dworkin L, Elliot WJ, Epstein M, et al. Preserving renal function in adults with hypertension
and diabetes: a consensus approach. National Kidney Foundation Hypertension and Diabetes
Executive Committees Working Group. Am J Kidney Dis 2000; 36(3):646–61. PMID: 10977801
36. Agarwal R, Andersen MJ. Prognostic importance of ambulatory blood pressure recordings in patients
with chronic kidney disease. Kidney Int 2006; 69(7):1175–80. PMID: 16467785
37. UK Prospective Diabetes Study Group. Tight blood pressure control and risk of macrovascular and microvascular
complications in type 2 diabetes: UKPDS 38. BMJ 1998; 317(7160):703–13. PMID:
9732337
38. OSeaghdha CM, Lyass A, Massaro JM, Meigs JB, Coresh J, DAgostino RB, et al. A risk score for
chronic kidney disease in the general population. Am J Med 2012; 125(3):270–7. doi: 10.1016/j.
amjmed.2011.09.009 PMID: 22340925
39. Hippisley-Cox J, Coupland C. Predicting the risk of chronic Kidney Disease in men and women in England
and Wales: prospective derivation and external validation of the QKidney Scores. BMC Fam
Pract 2010; 11:49. doi: 10.1186/1471-2296-11-49 PMID: 20565929
40. Yamagata K, Ishida K, Sairenchi T, Takahashi H, Ohba S, Shiigai T, et al. Risk factors for chronic
kidney disease in a community-based population: a 10-year follow-up study. Kidney Int 2007;
71(2):159–66. PMID: 17136030
41. Herget-Rosenthal S, Dehnen D, Kribben A, Quellmann T. Progressive chronic kidney disease in primary
care: modifiable risk factors and predictive model. Prev Med 2013; 57(4):357–62. doi: 10.1016/j.
ypmed.2013.06.010 PMID: 23783072
42. Gall MA, Hougard P, Borch-Johnsen K, Parving HH. Risk factors for development of incipient and overt
diabetic nephropathy in patients with non-insulin dependent diabetes mellitus: prospective, observational
study. BMJ 1997; 314(7083):738–8.
43. Rutledge JC, Ng KF, Aung HH, Wilson DW. Role of triglyceride-rich lipoproteins in diabetic nephropathy.
Nat Rev Nephrol 2010; 6(6):361–70. doi: 10.1038/nrneph.2010.59 PMID: 20440276
44. Jenkins AJ, Lyons TJ, Zheng D, Otvos JD, Lackland DT, McGee D, et al. Lipoproteins in the DCCT/
EDIC cohort: associations with diabetic nephropathy. Kidney Int 2003; 64(3):817–28. PMID: 1291153Muntner P, Coresh J, Smith JC, Eckfeldt J, Klag MJ. Plasma lipids and risk of developing renal dysfunction:
the atherosclerosis risk in communities study. Kidney Int 2000; 58(1):293–301. PMID: 10886574
46. Tozawa M, Iseki K, Iseki C, Oshiro S, Ikemiya Y, Takishita S. Triglyceride, but not total cholesterol
or low-density lipoprotein cholesterol levels, predict development of proteinuria. Kidney Int 2002;
62(5):1743–9. PMID: 12371975
47. Zoppini G, Targher G, Chonchol M, Perrone F, Lippi G, Muggeo M. Higher HDL cholesterol levels are
associated with a lower incidence of chronic kidney disease in patients with type 2 diabetes. Nutr
Metab ardiovasc Dis 2009; 19(8):580–6. doi: 10.1016/j.numecd.2008.11.003 PMID: 19196499
48. Rodriguez-Poncelas A, Garre-Olmo J, Franch-Nadal J, Diez-Espino J,Mundet-Tuduri X, Barrot-De la
Puente J, et al. Prevalence of chronic kidney disease in patients with type 2 diabetes in Spain:
PERCEDIME2 study. BMC Nephrol 2013; 14:46. doi: 10.1186/1471-2369-14-46 PMID: 23433046
49. Hillege HL, van Gilst WH, van Veldhuisen DJ, Navis G, Grobbee DE, de Graeff PA, et al. Accelerated
decline and prognostic impact of renal function after myocardial infarction and the benefits of ACE inhibition:
the CATS randomizef trial. Eur Heart J 2003; 24(5):412–20. PMID: 12633543
50. Lee ET, Lee VS, Lu M, Lee JS, Russell D, Yeh J. Incidence of renl failure in NIDDM. The Oklahoma Indian
Diabetes Study. Diabetes 1994; 43(4):572–9. PMID: 8138063
51. Thakar CV, Christianson A, Himmelfarb J, Leonard AC. Acute kidney injury episodes and chronic kidney
disease risk in diabetes mellitus. Clin J Am Soc Nephrol 2011, 6(11):2567–72. doi: 10.2215/CJN.
01120211 PMID: 21903988
52. Go AS, Chertow GM, Fan D, McCulloch CE, Hsu C. Chronic kidney disease and the risks of death, cardiovascular
events, and hospitalization. N Engl J Med 2004; 351(13):1296–305. PMID: 15385656
53. Nitsch D, Grams M, Sang Y, Black C, Cirillo M, Djurdjev O, et al. Associations of estimated glomerular
filtration rate and albuminuria with mortality and renal failure by sex: a meta-analysis. BMJ 2013; 346:
f324. doi: 10.1136/bmj.f324 PMID: 23360717
54. Fox CS, Matsushita K, Woodward M, Bilo HJ, Chalmers J, Heerspink HJ, et al. Associations of kidney
disease measures with mortality and end-stage renal disease in individuals with and without diabetes:
a meta-analysis. Lancet 2012; 380(9854):1662–73. doi: 10.1016/S0140-6736(12)61350-6 PMID:
23013602
55. Chronic Kidney Disease Pognosis Consortium, Matsushita K, van der Velde M, Astor BC, Woodward
M, Levey AS, et al. Association of estimated glomerular filtration rate and albuminuria with all-cause
and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet 2010;
375(9731):2073–81. doi: 10.1016/S0140-6736(10)60674-5 PMID: 20483451
56. Hallan SI, Matsushita K, Sang Y, Mahmoodi BK, Black C, Ishani A, et al. Age and association of kidney
measures with mortality and end-stage renal disease. JAMA 2012; 308(22):2349–60. PMID: 23111824
57. Thomas G, Sehgal AR, Kashyap SR, Srinivas TR, Kirwan JP, Navaneethan SD, et al. Metabolic
Syndrome and kidney disease: a systematic review and meta-analysis. Clin J Am Soc Nephrol 2011;
6(10):2364–73. doi: 10.2215/CJN.02180311 PMID: 21852664
58. Dunkler D, Deghan M, Teo KK, Heinze G, Gao P, Kohl M, et al. Diet and kidney disease in high-risk individuals
with type 2 diabetes mellitus. JAMA Intern Med 2013; 173(18):1682–92. PMID: 23939297
59. Díaz-López A, Bulló M, Martínez-González MÁ, Guasch-Ferré M, Ros E, Basora J, et al. Effects of
Mediterranean diets on kidney function: a report from the PREDIMED trial. Am J Kidney Dis 2012;
60(3):380–9. doi: 10.1053/j.ajkd.2012.02.334 PMID: 22541738







