TS. PHẠM HỮU VĂN
(…)
10.1.4.3 Các thuốc chống huyết khối khác
Trong thử nghiệm ACTIVE W (Atrial Fibrillation Clopidogrel Trial with Irbesartan for Prevention of Vascular Events: Thử nghiệm Clopidogrel rung nhĩ với Irbesartan để ngăn ngừa các biến cố mạch máu), liệu pháp kháng tiểu cầu kép (DAPT) với aspirin và clopidogrel ít hiệu quả hơn warfarin để phòng ngừa đột quỵ, thuyên tắc hệ thống, nhồi máu cơ tim và tử vong do mạch máu ( nguy cơ biến cố hàng năm là 5,6% so với 3,9%, P = 0,0003), với tỷ lệ xuất huyết nặng tương tự. [438] Trong thử nghiệm ACTIVE-A, những bệnh nhân không thích hợp với kháng đông có tỷ lệ biến chứng huyết khối thấp hơn khi clopidogrel được thêm vào aspirin so với aspirin đơn thuần, nhưng có sự gia tăng đáng kể về xuất huyết lớn. [439]
Đơn trị liệu Aspirin không hiệu quả trong việc phòng ngừa đột quỵ so với không điều trị chống huyết khối và có liên quan đến nguy cơ đột quỵ do thiếu máu cục bộ cao hơn ở bệnh nhân cao tuổi. [440] Nhìn chung, đơn trị liệu chống kết tập tiểu cầu không hiệu quả trong phòng ngừa đột quỵ và có khả năng gây hại, (đặc biệt là ở những bệnh nhân AF cao tuổi) trong khi DAPT có liên quan đến nguy cơ chảy máu tương tự như liệu pháp OAC. Do đó, liệu pháp chống kết tập tiểu cầu không nên được sử dụng để phòng ngừa đột quỵ ở bệnh nhân AF.
10.1.4.4 Điều trị phối hợp kháng đông uống và thuốc chống ngưng hợp tiểu cầu
Việc sử dụng liệu pháp chống kết tập tiểu cầu vẫn còn phổ biến trong thực hành lâm sàng, thường ở những bệnh nhân không có chỉ định (ví dụ PAD, CAD, hoặc bệnh mạch máu não) ngoài AF. [443] Có ít bằng chứng ủng hộ liệu pháp kết hợp chỉ để phòng ngừa đột quỵ trong AF, không có tác dụng giảm đột quỵ, nhồi máu cơ tim hoặc tử vong, nhưng làm tăng đáng kể nguy cơ chảy máu lớn và ICH. [441.442]
10.1.4.5 Làm tắc và loại trừ tiểu nhĩ trái
10.1.4.5.1 Các dụng cụ làm tắc tiểu nhĩ trái.
Chỉ thiết bị Watchman mới được so sánh với liệu pháp VKA trong RCTs [PROTECT AF (WATCHMAN Left Atrial Appendage System for Embolic Protection in Patients With Atrial Fibrillation: Hệ thống Tiểu nhĩ Trái Watchman cho phòng ngừa thuyên tắc ở các bệnh nhân rung nhĩ) và PREVAIL (Watchman LAA Closure Device in Patients With Atrial Fibrillation Versus Long Term Warfarin Therapy: Thiết bị Watchman đóng LAA ở bệnh nhân rung nhĩ so với liệu pháp Warfarin dài hạn)], [444,446] trong đó tắc LAA không thua kém điều trị dự phòng đột quỵ VKA ở bệnh nhân AF có nguy cơ đột quỵ trung bình, với khả năng tỷ lệ chảy máu thấp hơn khi theo dõi lâu hơn. [447] Tắc LAA cũng có thể làm giảm nguy cơ đột quỵ ở những bệnh nhân có chống chỉ định với OAC. [448.449]
Một đăng ký lớn ở Châu Âu đã báo cáo tỷ lệ cấy thành công cao (98%), với tỷ lệ biến chứng liên quan đến thủ thuật có thể chấp nhận được là 4% sau 30 ngày.[450] Tuy nhiên, thủ thuật cấy có thể gây ra các biến chứng nghiêm trọng (tỷ lệ biến cố cao hơn đã được báo cáo phân tích thế giới thực so với các nghiên cứu được ngành tài trợ, có thể xác định một số sai lệch trong báo cáo) và huyết khối liên quan đến thiết bị có thể không phải là một phát hiện lành tính. [451454] Quản lý chống huyết khối sau làm tắc LAA còn không bao giờ được đánh giá bằng các phương pháp ngẫu nhiên và được dựa trên các nghiên cứu bệnh sử, ít nhất gồm aspirin (Bảng 12). Đối với những bệnh nhân không dung nạp với bất kỳ liệu pháp chống kết tập tiểu cầu nào, phương pháp tiếp cận bằng catheter tâm mạc (ví dụ như hệ thống dây thòng lọng (lariat)) hoặc kẹp LAA qua nội soi lồng ngực có thể là một lựa chọn.
Đáng chú ý, sự không thua kém của tắc LAA đối với điều trị VKA chủ yếu được thúc đẩy do việc ngăn ngừa đột quỵ xuất huyết, với xu hướng tăng đột quỵ do thiếu máu cục bộ. Những hạn chế của tắc LAA như một chiến lược để giảm nguy cơ đột quỵ liên quan đến AF cũng bao gồm việc xem xét AF hoạt động như một dấu hiệu nguy cơ đột quỵ. Việc giữ lại OAC sau khi tắc LAA có khả năng làm giảm nguy cơ đột quỵ tổng thể liên quan đến bệnh cơ tim tâm nhĩ.
10.1.4.5.2 Làm tăc và loại bỏ tiểu nhĩ trái bằng phẫu thuật.
Nhiều nghiên cứu quan sát chỉ ra tính khả thi và an toàn của phẫu thuật làm tắc / loại trừ LAA, nhưng chỉ có sẵn dữ liệu thử nghiệm có đối chứng còn hạn chế. [457459] Dòng tồn dư LAA hoặc tắc không hoàn toàn LAA có thể kết hợp với nguy cơ đột quỵ tăng lên.[460] Trong hầu hết các nghiên cứu, tắc / loại trừ LAA được thực hiện trong phẫu thuật tim hở khác và trong những năm gần đây kết hợp với phẫu thuật triệt phá AF [ 459,461] hoặc như một thủ thuật nội soi lồng ngực cô lập. RCT lớn ở những bệnh nhân có thủ thuật phẫu thuật tim liên quan đang diễn ra. [462]
Lý do phổ biến nhất cho việc tắc / loại trừ LAA trong thực hành lâm sàng là nguy cơ chảy máu cao hoặc ít thường xuyên hơn là chống chỉ định đối với OAC. [450] Tuy nhiên, những vật tắc LAA không được thử nghiệm ngẫu nhiên trong những quần thể như vậy. Hầu hết những bệnh nhân cách đây vài năm được coi là không phù hợp với liệu pháp OAC với VKA thì nay dường như tương đối tốt với NOAC, [433.463.464] và làm tắc LAA không được so sánh với liệu pháp NOAC ở những bệnh nhân có nguy cơ chảy máu, hoặc phẫu thuật làm tắc hoặc loại trừ LAA. Aspirin dài hạn là một chiến lược phổ biến ở những bệnh nhân này, [465] và người ta có thể đặt câu hỏi liệu NOAC sẽ không phải là một chiến lược tốt hơn nếu aspirin được dung nạp. Cần có các thử nghiệm đầy đủ để xác định các chỉ định tốt nhất của làm tắc / loại trừ LAA so với liệu pháp NOAC ở bệnh nhân có chống chỉ định tương đối hoặc tuyệt đối đối với chống đông máu, ở những người bị đột quỵ do thiếu máu cục bộ đang điều trị chống đông máu, và để đánh giá loại thuốc chống huyết khối thích hợp. liệu pháp sau khi tắc LAA.
10.1.4.6 Thuốc kháng đông đường uống dài hạn cho mỗi gánh nặng rung nhĩ
Mặc dù nguy cơ đột quỵ do thiếu máu cục bộ / thuyên tắc hệ thống cao hơn với AF không kịch phát so với kịch phát, và sự tiến triển của AF có liên quan đến quá nhiều kết quả bất lợi, [169,466] mô hình AF thời gian được xác định trên lâm sàng sẽ không ảnh hưởng đến quyết định liên quan đến- thuật ngữ OAC, được thúc đẩy bằng sự hiện diện của các yếu tố nguy cơ đột quỵ. [156] Quản lý bệnh nhân có AHRE / AF dưới lâm sàng được xem xét trong phần 16. Nguy cơ đột quỵ ở bệnh nhân AHRE có thể thấp hơn so với bệnh nhân có AF được chẩn đoán, [467] và đột quỵ thường xảy ra khi không có mối quan hệ thời gian rõ ràng với AHRE / AF dưới lâm sàng, [179,226] nhấn mạnh vai trò của nó như một dấu hiệu nguy cơ hơn là một yếu tố nguy cơ đột quỵ.4, [172] Liệu AHRE và AF dưới lâm sàng có cùng yêu cầu điều trị như AF [7] lâm sàng hay không hiện chưa rõ ràng và lợi ích lâm sàng thực của OAC đối với AHRE / AF dưới lâm sàng > 24 h hiện đang được nghiên cứu trong một số RCT. [4]
Đáng chú ý, bệnh nhân AF / AHRE dưới lâm sàng có thể phát triển loạn nhịp nhanh nhĩ kéo dài hơn 24 giờ [468] hoặc AF lâm sàng; do đó nên theo dõi cẩn thận những bệnh nhân này, thậm chí cân nhắc theo dõi từ xa, đặc biệt là với AHRE dài hơn và có hồ sơ nguy cơ cao hơn. [469] Do bản chất động của AF cũng như nguy cơ đột quỵ, thời gian ghi lại trong một giai đoạn theo dõi sẽ không nhất thiết phải giống nhau trong những lần tiếp theo.
10.1.4.7 Kháng đông uống dài hạn cho chiến lược kiểm soát triệu chứng
Kiểm soát triệu chứng tập trung vào các phương pháp tiếp cận lấy bệnh nhân làm trung tâm và hướng vào triệu chứng để kiểm soát tần số hoặc nhịp. Một lần nữa, chiến lược kiểm soát triệu chứng không được ảnh hưởng đến quyết định liên quan đến OAC dài hạn, điều này được thúc đẩy bằng sự hiện diện của các yếu tố nguy cơ đột quỵ, chứ không phải là sự thành công ước tính trong việc duy trì nhịp xoang.
10.1.5 Quản lý nguy cơ xuất huyết liên quan đến kháng đông
10.1.5.1 Các chiến lược làm tối thiểu hóa nguy cơ xuất huyết
Đảm bảo chất lượng điều trị VKA tốt (TTR> 70%) và lựa chọn liều NOAC thích hợp (theo tiêu chuẩn giảm liều được chỉ định trên nhãn thuốc tương ứng) là những cân nhắc quan trọng để giảm thiểu nguy cơ chảy máu. Như đã thảo luận trong phần 10.1.2, cần chú ý đến các yếu tố nguy cơ chảy máu có thể thay đổi được ở mỗi lần tiếp xúc với bệnh nhân và đánh giá nguy cơ chảy máu chính thức là cần thiết để giúp xác định những bệnh nhân có nguy cơ cao cần được theo dõi hoặc xem xét sớm hơn (ví dụ: 4 tuần thay vì 4 – 6 tháng). [407] Nên tránh dùng thường xuyên đồng thời thuốc chống kết tập tiểu cầu hoặc thuốc chống viêm không steroid (NSAID) ở bệnh nhân kháng đông. Nguy cơ xuất huyết là thay đổi, và chú ý đến sự thay đổi trong hồ sơ nguy cơ chảy máu là một yếu tố dự báo mạnh hơn về các biến cố xuất huyết lớn, đặc biệt là trong 3 tháng đầu. [389]
10.1.5.2 Các nhóm nguy cơ cao
Một số quần thể AF có nguy cơ cao ít được đại diện trong RCTs, gồm người quá già (> _90 tuổi), những người bị suy giảm nhận thức / sa sút trí tuệ, xuất huyết gần đây hoặc ICH trước đó, suy thận giai đoạn cuối, suy gan, ung thư, v.v. trên. Dữ liệu quan sát cho thấy những bệnh nhân như vậy có nguy cơ cao bị đột quỵ do thiếu máu cục bộ và tử vong, và nhiều người sẽ được hưởng lợi từ OAC.
Những bệnh nhân có bất thường về chức năng gan có thể có nguy cơ xuất huyết do VKA cao hơn, có thể ít hơn đối với NOAC. Dữ liệu quan sát ở bệnh nhân xơ gan cho thấy giảm đột quỵ do thiếu máu cục bộ có thể nhiều hơn nguy cơ xuất huyết. [470, 472]
Ở những bệnh nhân có biến cố xuất huyết gần đây, cần chú ý đến việc giải quyết bệnh lý có nguy cơ mắc phải (ví dụ như loét hoặc polyp chảy máu ở bệnh nhân xuất huyết tiêu hóa), và việc sử dụng lại OAC càng sớm càng tốt, như một phần của quyết định của nhóm đa ngành. Cần cân nhắc đối với các loại thuốc như apixaban hoặc dabigatran 110 mg hai lần ngày., không liên quan đến xuất huyết tiêu hóa quá mức so với warfarin. Khi OAC không được sử dụng lại, có nguy cơ đột quỵ và tử vong cao hơn so với khi khởi động lại OAC, mặc dù nguy cơ xuất huyết tái phát có thể cao hơn. [473] Tương tự, dự phòng huyết khối trong ung thư có thể yêu cầu một nhóm đa ngành quyết định cân bằng việc giảm đột quỵ chống lại chảy máu nghiêm trọng, điều này có thể phụ thuộc vào loại ung thư, (các) vị trí, giai đoạn, liệu pháp chống ung thư, v.v.
Dự phòng huyết khối ở các nhóm nguy cơ cao cụ thể được thảo luận chi tiết trong suốt phần 11.
10.1.6 Ra quyết định để tránh đột quỵ
Trong các nhóm thuần tập dân số quan sát, cả đột quỵ và tử vong đều là các tiêu chí liên quan, vì một số trường hợp tử vong có thể là do đột quỵ gây tử vong (do các tiêu chí không được điều chỉnh trong các nhóm dân số và hình ảnh về não hoặc hậu phẫu không bắt buộc). Vì OAC làm giảm đáng kể đột quỵ (64%) và tử vong do mọi nguyên nhân (26%) so với nhóm chứng hoặc giả dược, [412] các tiêu chí của đột quỵ và / hoặc tử vong có liên quan đến việc ra quyết định điều trị dự phòng huyết khối.
Ngưỡng bắt đầu OAC để phòng ngừa đột quỵ, cân bằng giảm đột quỵ do thiếu máu cục bộ với nguy cơ ICH và QoL liên quan, được ước tính là 1,7% / năm đối với warfarin và 0,9% / năm đối với NOAC (dữ liệu dabigatran được sử dụng để phân tích mô hình ) .[474] Ngưỡng đối với warfarin có thể còn thấp hơn, nếu đạt được kiểm soát chống đông chất lượng tốt, với TTR trung bình> 70%. [475]
Với những hạn chế của điểm số nguy cơ lâm sàng, bản chất động của nguy cơ đột quỵ, nguy cơ đột quỵ và tử vong cao hơn ở bệnh nhân AF có ≥ 1 yếu tố nguy cơ đột quỵ không phải giới tính và lợi ích lâm sàng tích cực của OAC trong số những bệnh nhân này, ngưới ta khuyến cáo cách tiếp cận dựa trên yếu tố nguy cơ để phòng ngừa đột quỵ thay vì tập trung quá mức vào những bệnh nhân ‘có nguy cơ cao’ (được xác định một cách chủ quan). Vì mặc định là cung cấp phòng ngừa đột quỵ trừ khi bệnh nhân có nguy cơ thấp, điểm CHA2DS2- VASc nên được áp dụng theo cách giảm thiểu, để quyết định có OAC hay không. [476]
Do đó, bước đầu tiên trong quá trình ra quyết định (‘A’ Chống đông máu / Tránh đột quỵ) là xác định những bệnh nhân có nguy cơ thấp không cần điều trị chống huyết khối. Bước 2 là đưa ra phương pháp phòng ngừa đột quỵ (tức là OAC) cho những người có> _1 yếu tố nguy cơ đột quỵ không phụ thuộc giới tính (độ mạnh của bằng chứng khác nhau, với nhiều thử nghiệm lâm sàng cho bệnh nhân có> _2 yếu tố nguy cơ đột quỵ, và phân nhóm từ các thử nghiệm / dữ liệu quan sát trên bệnh nhân có 1 yếu tố nguy cơ đột quỵ nonsex). Bước 3 là lựa chọn OAC – một NOAC (do tính hiệu quả, an toàn và tiện lợi tương đối của chúng, những loại thuốc này thường được lựa chọn đầu tiên như OAC để phòng ngừa đột quỵ ở AF) hoặc VKA (với TTR tốt > 70%). Lộ trình bệnh nhân ‘AF 3 bước’ này [182,477] để phân tầng nguy cơ đột quỵ và ra quyết định điều trị được thể hiện trong Hình 12. 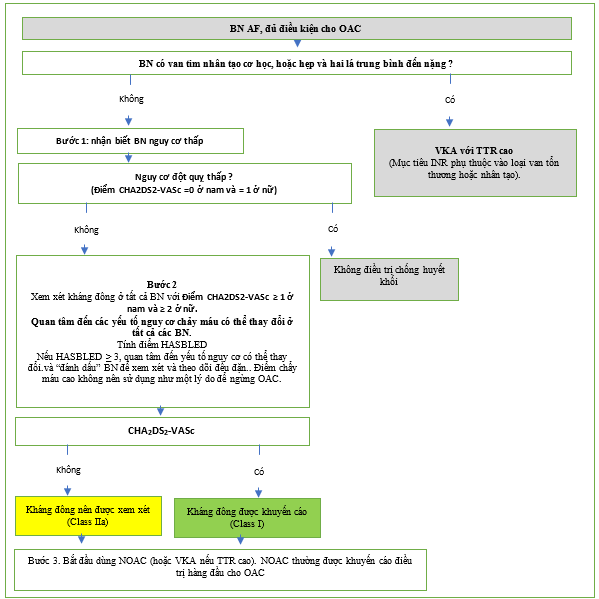
Hình 12. ‘A’ – Chống đông máu / Tránh đột quỵ: Cách tiến hành ‘AF 3 bước’.
AF = rung nhĩ; CHA2DS2-VASc = Suy tim sung huyết, Tăng huyết áp, Tuổi ≥75, Đái tháo đường, Đột quỵ, Bệnh mạch máu, Từ 65 – 74 tuổi, Giới tính (nữ); HAS-BLED = Tăng huyết áp, Chức năng thận / gan bất thường, Đột quỵ, Tiền sử hoặc khuynh hướng chảy máu, INR không ổn định, Người cao tuổi (> 65 tuổi), Các chất nghiện / rượu đồng thời; INR = tỷ lệ chuẩn hóa quốc tế; NOAC = thuốc chống đông đường uống không kháng không vitamin K; OAC = thuốc chống đông máu đường uống; SAMe-TT2R2 = Giới tính (nữ), Tuổi (2, nên sắp xếp xem xét thường xuyên / kiểm tra INR thường xuyên / tư vấn cho người dùng VKA để giúp kiểm soát tốt chống đông máu, hoặc xem xét lại việc sử dụng NOAC thay thế; TTR lý tưởng là> 70%.
Các khuyến cóa cho ngăn ngừa biến cố thuyên tắc huyết khối trong AF
| Các khuyến cáo | Classa | Levelb |
| Để phòng ngừa đột quỵ ở bệnh nhân AF hội đủ điều kiện điều trị OAC, các NOAC được khuyến cáo ưu tiên hơn VKA (loại trừ bệnh nhân có van tim cơ học hoặc hẹp van hai lá mức độ trung bình đến nặng). [423.424] |
I |
A |
| Để đánh giá nguy cơ đột quỵ, nên tiếp cận dựa trên yếu tố nguy cơ, sử dụng thang điểm nguy cơ đột quỵ lâm sàng CHA2DS2-VASc để xác định ban đầu những bệnh nhân có ‘nguy cơ đột quỵ thấp’ (điểm CHA2DS2-VASc = 0 ở nam hoặc 1 ở nữ) không nên dùng liệu pháp chống huyết khối. [334.388] |
I |
A |
| OAC được khuyến cáo để phòng ngừa đột quỵ ở bệnh nhân AF có điểm CHA2DS2-VASc ≥ 2 ở nam hoặc ≥ 3 ở nữ. [412] | I | A |
| OAC nên được xem xét để phòng ngừa đột quỵ ở bệnh nhân AF có điểm CHA2DS2-VASc là 1 ở nam hoặc 2 ở nữ.
Việc điều trị nên được cá thể hóa dựa trên lợi ích lâm sàng ròng và cân nhắc các giá trị và sở thích của bệnh nhân. [338.378.380] |
IIb |
B |
| Để đánh giá nguy cơ chảy máu, đánh giá nguy cơ xuất huyết dựa trên cơ sở nguy cơ cấu trúc chính thức được khuyến cáo để giúp nhận biết các yếu tố nguy cơ xuất huyết không thể thay đổi và giải quyết các yếu tố nguy cơ xuất huyết có thể thay đổi ở tất cả các bệnh nhân rung nhĩ, và để nhận biết các bệnh nhân có tiềm năng ở nguy cơ xuất huyết cao những người nên được lên kết hoạch xem xét lâm sàng sớm và thường xuyên hơn. [388.395.404.406] |
I |
B |
| Để đánh giá nguy cơ chảy máu dựa trên thang điểm chính thức, thang điểm HAS-BLED nên được xem xét để giúp giải quyết các yếu tố nguy cơ xuất huyết có thể sửa đổi và xác định những bệnh nhân có nguy cơ xuất huyết cao (điểm HAS-BLED ≥ 3) sớm và hơn thế nữa xem xét và theo dõi lâm sàng thường xuyên. [388.395.404.406] |
IIa |
B |
| Nên đánh giá lại nguy cơ đột quỵ và chảy máu trong các khoảng thời gian định kỳ để cung cấp thông tin cho các quyết định điều trị (ví dụ: bắt đầu OAC ở những bệnh nhân không còn ở nguy cơ đột quỵ thấp) và giải quyết các yếu tố nguy cơ xuất huyết có thể sửa đổi được. C [389.478.479] |
I |
B |
| Ở những bệnh nhân AF ban đầu có nguy cơ đột quỵ thấp, nên đánh giá lại nguy cơ đột quỵ đầu tiên sau 4 – 6 tháng sau khi đánh giá chỉ số. [385387] |
IIa |
B |
| Nếu sử dụng VKA, INR mục tiêu từ 2.0 – 3.0 được khuyến nghị, với TTR riêng rẽ ≥70%. [414] |
I |
B |
| Ở những bệnh nhân điều trị VKA có khoảng thời gian điều trị INR thấp (ví dụ: TTR <70%), các lựa chọn được khuyến nghị là:
• Chuyển sang NOAC nhưng đảm bảo tuân thủ tốt và kiên trì với liệu pháp [415,416]; hoặc |
I |
B |
| • Nỗ lực cải thiện TTR (như giáo dục / tư vấn và kiểm tra INR thường xuyên hơn). [480] | IIa | B |
| Điều trị kháng tiểu cầu đơn thuần (đơn trị liệu hoặc aspirin kết hợp với clopidogrel) không được khuyến cáo để phòng ngừa đột quỵ trong AF. [440.441.480.481] | III | A |
| Nguy cơ chảy máu ước tính, trong trường hợp không có chống chỉ định tuyệt đối với OAC, bản thân nó không nên hướng dẫn các quyết định điều trị sử dụng OAC để phòng ngừa đột quỵ. | III | A |
| Hình thái lâm sàng của AF (như AF phát hiện lần đầu, kịch phát, dai dẳng, dai dẳng kéo dài, vĩnh viễn) không nên là dấu hiệu chỉ định điều trị dự phòng huyết khối. [160] | III | B |
| Các khuyến cáo cho làm tắc bít hoặc loại bỏ LAA | ||
| Bít tắc LAA có thể được xem xét để phòng ngừa đột quỵ ở bệnh nhân AF và có chống chỉ định điều trị chống đông máu lâu dài (ví dụ chảy máu nội sọ mà không có nguyên nhân hồi phục). [448.449.481.482] | IIb | B |
| Phẫu thuật làm tắc bít hoặc loại bỏ LAA có thể được xem xét để ngăn ngừa đột quỵ ở những bệnh nhân AF trải qua phẫu thuật tim. [459.483] | IIb | C |
AF = rung nhĩ; BP = huyết áp; CHA2DS2-VASc = Suy tim sung huyết, Tăng huyết áp, Tuổi ≥75, Đái tháo đường, Đột quỵ, Bệnh mạch máu, Từ 65 – 74 tuổi, Giới tính (nữ); HAS-BLED = Tăng huyết áp, Chức năng thận / gan bất thường, Đột quỵ, Tiền sử hoặc khuynh hướng chảy máu, INR không ổn định, Người cao tuổi (> 65 tuổi), Ma túy / rượu đồng thời; INR = tỷ lệ chuẩn hóa quốc tế; LAA = tiểu nhĩ trái; NOAC = thuốc chống đông đường uống không phải kháng vitamin K; NSAID = thuốc chống viêm không steroid; OAC = thuốc chống đông máu đường uống; TTR = thời gian trong phạm vi điều trị; VKA = chất đối kháng vitamin K.
a Class khuyến cáo .
b Mức độ bằng chứng.
c Bao gồm HA không kiểm soát được; INR không ổn định (ở bệnh nhân dùng VKA); uống rượu quá mức; sử dụng đồng thời NSAID hoặc aspirin ở bệnh nhân chống đông máu; khuynh hướng hoặc khuynh hướng chảy máu (ví dụ: điều trị loét dạ dày, tối ưu hóa chức năng thận hoặc gan, v.v.).
10.2 ‘B’ Khiểm soát triệu chứng tốt hơn
10.2.1 Kiểm soát tần số
Kiểm soát tần số là một phần không thể thiếu trong quản lý AF và thường đủ để cải thiện các triệu chứng liên quan đến AF. Có rất ít bằng chứng xác thực để thông tin về loại và cường độ điều trị kiểm soát tỷ lệ tốt nhất. [484-48]
10.2.1.1 Mục tiêu /phạm vi tần số thất tối ưu
Mục tiêu tần số tim tối ưu ở bệnh nhân AF không rõ ràng. Trong RACE (Race Control Efficacy in Permanent Atrial Fibrillation: Hiệu quả kiểm soát tranh chấp (race) trong rung nhĩ vĩnh viễn) II RCT của bệnh nhân AF vĩnh viễn, không có sự khác biệt trong tổng hợp các biến cố lâm sàng, phân loại của Hiệp hội Tim mạch New York (NYHA), hoặc nhập viện giữa kiểm soát tần số nghiêm ngặt (strict) [nhịp tim mục tiêu < 80 /phút (bpm) khi nghỉ và <110 bpm khi gắng sức vừa phải] và không nghiêm ngặt (lenient) (mục tiêu nhịp tim <110 bpm), [487.488] tương tự như phân tích từ AFFIRM (Atrial Fibrillation Follow-up Investigation of Rhythm Management: Điều tra theo dõi rung nhĩ về quản lý nhịp) và nghiên cứu RACE. [489] Do đó, kiểm soát tần số không nghiêm ngặt là một cách tiếp cận ban đầu có thể chấp nhận được, bất kể tình trạng HF (ngoại trừ bệnh cơ tim do nhịp tim nhanh), trừ khi các triệu chứng yêu cầu kiểm soát tỷ lệ chặt chẽ hơn (Hình 13).
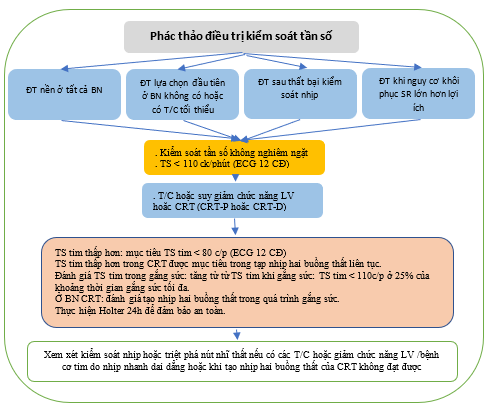
Hình 13. Phác thảo điều trị kiểm soát tần số. [490]
AF = rung nhĩ; AVN = nút nhĩ thất; bpm = c/phút; BV = hai thất; CRT = điều trị tái đồng bộ tim; CRT-D: điều trị tái đồng bộ tim – khử rung tim; CRT-P = điều trị tái đồng bộ – tạo nhịp; ECG = điện tâm đồ; LV = thất trái; SR = nhịp xoang.
Tài liệu tham khảo
- Lip GYH. The ABC pathway: an integrated approach to improve AF management. Nat Rev Cardiol 2017;14:627628.
- Proietti M, Romiti GF, Olshansky B, Lane DA, Lip GYH. Improved outcomes by integrated care of anticoagulated patients with atrial fibrillation using the simple ABC (Atrial Fibrillation Better Care) Pathway. Am J Med 2018;131:13591366.e6.
- Yoon M, Yang PS, Jang E, Yu HT, Kim TH, Uhm JS, Kim JY, Sung JH, Pak HN, Lee MH, Joung B, Lip GYH. Improved population-based clinical outcomes of patients with atrial fibrillation by compliance with the simple ABC (Atrial Fibrillation Better Care) pathway for integrated care management: a nationwide cohort study. Thromb Haemost 2019;19:16951703.
- Pastori D, Pignatelli P, Menichelli D, Violi F, Lip GYH. Integrated care management of patients with atrial fibrillation and risk of cardiovascular events: the ABC (Atrial fibrillation Better Care) pathway in the ATHERO-AF study cohort. Mayo Clin Proc 2019;94:12611267
- Pastori D, Farcomeni A, Pignatelli P, Violi F, Lip GY. ABC (Atrial fibrillation Better Care) pathway and healthcare costs in atrial fibrillation: the ATHEROAF study. Am J Med 2019;132
- Guo Y, Lane DA, Wang L, Zhang H, Wang H, Zhang W, Wen J, Xing Y, Wu F, Xia Y, Liu T, Wu F, Liang Z, Liu F, Zhao Y, Li R, Li X, Zhang L, Guo J, Burnside G, Chen Y, Lip GYH; mAF-App II Trial Investigators. Mobile health technology to improve care for patients with atrial fibrillation. J Am Coll Cardiol 2020;75:15231534.
- Pisters R, Lane DA, Marin F, Camm AJ, Lip GY. Stroke and thromboembolism in atrial fibrillation. Circ J 2012;76:22892304.
- Szymanski FM, Lip GY, Filipiak KJ, Platek AE, Hrynkiewicz-Szymanska A, Opolski G. Stroke risk factors beyond the CHA(2)DS(2)-VASc score: can we improve our identification of ‘high stroke risk’ patients with atrial fibrillation?Am J Cardiol 2015;116:17811788.
- Atrial Fibrillation Investigators. Echocardiographic predictors of stroke in patients with atrial fibrillation: a prospective study of 1066 patients from 3 clinical trials. Arch Intern Med 1998;158:13161320.
- Ntaios G, Lip GY, Lambrou D, Papavasileiou V, Manios E, Milionis H, Spengos K, Makaritsis K, Vemmos K. Leukoaraiosis and stroke recurrence risk in patients with and without atrial fibrillation. Neurology 2015;84:12131219.
- Esteve-Pastor MA, Roldan V, Rivera-Caravaca JM, Ramirez-Macias I, Lip GYH, Marin F. The use of biomarkers in clinical management guidelines: a critical appraisal. Thromb Haemost 2019;119:19011919.
- Hijazi Z, Oldgren J, Siegbahn A, Wallentin L. Application of biomarkers for risk stratification in patients with atrial fibrillation. Clin Chem 2017;63:152164.
- Yaghi S, Kamel H. Stratifying stroke risk in atrial fibrillation: beyond clinical risk scores. Stroke 2017;48:26652670.
- Ioannou A, Papageorgiou N, Falconer D, Rehal O, Sewart E, Zacharia E, Toutouzas K, Vlachopoulos C, Siasos G, Tsioufis C, Tousoulis D. Biomarkers associated with stroke risk in atrial fibrillation. Curr Med Chem 2019;26:803823.
- Sepehri Shamloo A, Bollmann A, Dagres N, Hindricks G, Arya A. Natriuretic peptides: biomarkers for atrial fibrillation management. Clin Res Cardiol 2020;109:957966.
- Decker JJ, Norby FL, Rooney MR, Soliman EZ, Lutsey PL, Pankow JS, Alonso A, Chen LY. Metabolic syndrome and risk of ischemic stroke in atrial fibrillation: ARIC Study. Stroke 2019;50:30453050.
- Lip GY, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the Euro Heart Survey on atrial fibrillation. Chest 2010;137:263272.
- Banerjee A, Taillandier S, Olesen JB, Lane DA, Lallemand B, Lip GY, Fauchier L. Ejection fraction and outcomes in patients with atrial fibrillation and heart failure: the Loire Valley Atrial Fibrillation Project. Eur J Heart Fail 2012;14:295301.
- Jung H, Sung JH, Yang PS, Jang E, Yu HT, Kim TH, Pak HN, Lee MH, Joung B, Lip GYH. Stroke risk stratification for atrial fibrillation patients with hypertrophic cardiomyopathy. J Am Coll Cardiol 2018;72:24092411.
- Jung H, Yang PS, Jang E, Yu HT, Kim TH, Uhm JS, Kim JY, Pak HN, Lee MH, Joung B, Lip GYH. Effectiveness and safety of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation with hypertrophic cardiomyopathy: a nationwide cohort study. Chest 2019;155:354363.
- Kim D, Yang PS, Kim TH, Jang E, Shin H, Kim HY, Yu HT, Uhm JS, Kim JY, Pak HN, Lee MH, Joung B, Lip GYH. Ideal blood pressure in patients with atrial fibrillation. J Am Coll Cardiol 2018;72:12331245.
- Lip GY, Clementy N, Pericart L, Banerjee A, Fauchier L. Stroke and major bleeding risk in elderly patients aged >/=75 years with atrial fibrillation: the Loire Valley Atrial Fibrillation Project. Stroke 2015;46:14350.
- Overvad TF, Skjoth F, Lip GY, Lane DA, Albertsen IE, Rasmussen LH, Larsen TB. Duration of diabetes mellitus and risk of thromboembolism and bleeding in atrial fibrillation: nationwide cohort study. Stroke 2015;46:216874.
- Lip GYH, Clementy N, Pierre B, Boyer M, Fauchier L. The impact of associated diabetic retinopathy on stroke and severe bleeding risk in diabetic patients with atrial fibrillation: the Loire Valley Atrial Fibrillation Project. Chest 2015;147:11031110.
- Fangel MV, Nielsen PB, Larsen TB, Christensen B, Overvad TF, Lip GYH, Goldhaber SZ, Jensen MB. Type 1 versus type 2 diabetes and thromboembolic risk in patients with atrial fibrillation: a Danish nationwide cohort study. Int J Cardiol 2018;268:137142.
- Chao TF, Liu CJ, Liao JN, Wang KL, Lin YJ, Chang SL, Lo LW, Hu YF, Tuan TC, Chung FP, Chen TJ, Lip GY, Chen SA. Use of oral anticoagulants for stroke prevention in patients with atrial fibrillation who have a history of intracranial hemorrhage. Circulation 2016;133:15401547.
- Bronnum Nielsen P, Larsen TB, Gorst-Rasmussen A, Skjoth F, Rasmussen LH, Lip GYH. Intracranial hemorrhage and subsequent ischemic stroke in patients with atrial fibrillation: a nationwide cohort study. Chest 2015;147:16511658.
- Nielsen PB, Larsen TB, Skjoth F, Gorst-Rasmussen A, Rasmussen LH, Lip GY. Restarting anticoagulant treatment after intracranial hemorrhage in patients with atrial fibrillation and the impact on recurrent stroke, mortality, and bleeding: a nationwide cohort study. Circulation 2015;132:517525.
- Lin LY, Lee CH, Yu CC, Tsai CT, Lai LP, Hwang JJ, Chen PC, Lin JL. Risk factors and incidence of ischemic stroke in Taiwanese with nonvalvular atrial fibrillation a nation-wide database analysis. Atherosclerosis 2011;217:292295.
- Anandasundaram B, Lane DA, Apostolakis S, Lip GY. The impact of atherosclerotic vascular disease in predicting a stroke, thromboembolism and mortality in atrial fibrillation patients: a systematic review. J Thromb Haemost 2013;11:975987.
- Friberg L, Rosenqvist M, Lip GY. Evaluation of risk stratification schemes for ischaemic stroke and bleeding in 182 678 patients with atrial fibrillation: the Swedish Atrial Fibrillation cohort study. Eur Heart J 2012;33:15001510.
- Steensig K, Olesen KKW, Thim T, Nielsen JC, Jensen SE, Jensen LO, Kristensen SD, Botker HE, Lip GYH, Maeng M. Should the presence or extent of coronary artery disease be quantified in the CHA2DS2-VASc score in atrial fibrillation? A report from the Western Denmark Heart Registry. Thromb Haemost 2018;118:21622170.
- Zabalgoitia M, Halperin JL, Pearce LA, Blackshear JL, Asinger RW, Hart RG. Transesophageal echocardiographic correlates of clinical risk of thromboembolism in nonvalvular atrial fibrillation. Stroke Prevention in Atrial Fibrillation III Investigators. J Am Coll Cardiol 1998;31:16221626.
- Kim TH, Yang PS, Yu HT, Jang E, Uhm JS, Kim JY, Pak HN, Lee MH, Joung B, Lip GYH. Age threshold for ischemic stroke risk in atrial fibrillation. Stroke 2018;49:18721879.
- Chao TF, Wang KL, Liu CJ, Lin YJ, Chang SL, Lo LW, Hu YF, Tuan TC, Chung FP, Liao JN, Chen TJ, Chiang CE, Lip GY, Chen SA. Age threshold for increased stroke risk among patients with atrial fibrillation: a nationwide cohort study from Taiwan. J Am Coll Cardiol 2015;66:13391347.
- Nielsen PB, Skjoth F, Overvad TF, Larsen TB, Lip GYH. Female sex is a risk modifier rather than a risk factor for stroke in atrial fibrillation: should we use a CHA2DS2-VA score rather than CHA2DS2-VASc?Circulation 2018;137:832840.
- Killu AM, Granger CB, Gersh BJ. Risk stratification for stroke in atrial fibrillation: a critique. Eur Heart J 2019;40:12941302.
- Rivera-Caravaca JM, Roldan V, Esteve-Pastor MA, Valdes M, Vicente V, Lip GYH, Marin F. Long-term stroke risk prediction in patients with atrial fibrillation: comparison of the ABC-Stroke and CHA2DS2-VASc scores. J Am Heart Assoc 2017;6: pii: JAHA.117.006490. doi: 10.1161/JAHA.117.006490.
- Alkhouli M, Friedman PA. Ischemic stroke risk in patients with nonvalvular atrial fibrillation: JACC review topic of the week. J Am Coll Cardiol 2019;74:30503065.
- Wu VC, Wu M, Aboyans V, Chang SH, Chen SW, Chen MC, Wang CL, Hsieh IC, Chu PH, Lin YS. Female sex as a risk factor for ischaemic stroke varies with age in patients with atrial fibrillation. Heart 2020;106:534540.
- Tomasdottir M, Friberg L, Hijazi Z, Lindback J, Oldgren J. Risk of ischemic stroke and utility of CHA2 DS2 -VASc score in women and men with atrial fibrillation. Clin Cardiol 2019;42:10031009.
- Friberg L, Benson L, Rosenqvist M, Lip GY. Assessment of female sex as a risk factor in atrial fibrillation in Sweden: nationwide retrospective cohort study. BMJ 2012;344:e3522.
- Overvad TF, Potpara TS, Nielsen PB. Stroke risk stratification: CHA2DS2-VA or CHA2DS2-VASc?Heart Lung Circ 2019;28:e14e15.
- Nielsen PB, Overvad TF. Female sex as a risk modifier for stroke risk in atrial fibrillation: using CHA2DS2-VASc versus CHA2DS2-VA for stroke risk stratification in atrial fibrillation: a note of caution. Thromb Haemost 2020. doi: 10.1055/s-0040-1710014. Epub ahead of print.
- Marzona I, Proietti M, Farcomeni A, Romiti GF, Romanazzi I, Raparelli V, Basili S, Lip GYH, Nobili A, Roncaglioni MC. Sex differences in stroke and major adverse clinical events in patients with atrial fibrillation: a systematic review and meta-analysis of 993,600 patients. Int J Cardiol 2018;269:182-191.
- Friberg L, Benson L, Lip GY. Balancing stroke and bleeding risks in patients with atrial fibrillation and renal failure: the Swedish Atrial Fibrillation Cohort study. Eur Heart J 2015;36:297306.
- Poli M, Philip P, Taillard J, Debruxelles S, Renou P, Orgogozo JM, Rouanet F, Sibon I. Atrial fibrillation is a major cause of stroke in apneic patients: a prospective study. Sleep Med 2017;30:251254.
- Bassand JP, Accetta G, Al Mahmeed W, Corbalan R, Eikelboom J, Fitzmaurice DA, Fox KAA, Gao H, Goldhaber SZ, Goto S, Haas S, Kayani G, Pieper K, Turpie AGG, van Eickels M, Verheugt FWA, Kakkar AK; GARFIELD-AF Investigators. Risk factors for death, stroke, and bleeding in 28,628 patients from the GARFIELD-AF registry: rationale for comprehensive management of atrial fibrillation. PLoS One 2018;13:e0191592.
- Overvad TF, Rasmussen LH, Skjoth F, Overvad K, Lip GY, Larsen TB. Body mass index and adverse events in patients with incident atrial fibrillation. Am J Med 2013;126:640.e9-17.
- Lip GY, Lane D, Van Walraven C, Hart RG. Additive role of plasma von Willebrand factor levels to clinical factors for risk stratification of patients with atrial fibrillation. Stroke 2006;37:22942300.
- Fox KAA, Lucas JE, Pieper KS, Bassand JP, Camm AJ, Fitzmaurice DA, Goldhaber SZ, Goto S, Haas S, Hacke W, Kayani G, Oto A, Mantovani LG, Misselwitz F, Piccini JP, Turpie AGG, Verheugt FWA, Kakkar AK; GARFIELDAF Investigators. Improved risk stratification of patients with atrial fibrillation: an integrated GARFIELD-AF tool for the prediction of mortality, stroke and bleed in patients with and without anticoagulation. BMJ Open 2017;7:e017157.
- Zhu W, Fu L, Ding Y, Huang L, Xu Z, Hu J, Hong K. Meta-analysis of ATRIA versus CHA2DS2-VASc for predicting stroke and thromboembolism in patients with atrial fibrillation. Int J Cardiol 2017;227:436442.
- Singer DE, Chang Y, Borowsky LH, Fang MC, Pomernacki NK, Udaltsova N, Reynolds K, Go AS. A new risk scheme to predict ischemic stroke and other thromboembolism in atrial fibrillation: the ATRIA study stroke risk score. J Am Heart Assoc 2013;2:e000250.
- Graves KG, May HT, Knowlton KU, Muhlestein JB, Jacobs V, Lappe DL, Anderson JL, Horne BD, Bunch TJ. Improving CHA2DS2-VASc stratification of non-fatal stroke and mortality risk using the Intermountain Mortality Risk Score among patients with atrial fibrillation. Open Heart 2018;5:e000907.
- Hijazi Z, Lindback J, Alexander JH, Hanna M, Held C, Hylek EM, Lopes RD, Oldgren J, Siegbahn A, Stewart RA, White HD, Granger CB, Wallentin L; ARISTOTLE and STABILITY Investigators. The ABC (age, biomarkers, clinical history) stroke risk score: a biomarker-based risk score for predicting stroke in atrial fibrillation. Eur Heart J 2016;37:158290.
- Hijazi Z, Lindahl B, Oldgren J, Andersson U, Lindback J, Granger CB, Alexander JH, Gersh BJ, Hanna M, Harjola VP, Hylek EM, Lopes RD, Siegbahn A, Wallentin L. Repeated measurements of cardiac biomarkers in atrial fibrillation and validation of the ABC stroke score over time. J Am Heart Assoc 2017;6.
- Oldgren J, Hijazi Z, Lindback J, Alexander JH, Connolly SJ, Eikelboom JW, Ezekowitz MD, Granger CB, Hylek EM, Lopes RD, Siegbahn A, Yusuf S, Wallentin L; RE-LY and ARISTOTLE Investigators. Performance and validation of a novel biomarker-based stroke risk score for atrial fibrillation. Circulation 2016;134:16971707.
- Berg DD, Ruff CT, Jarolim P, Giugliano RP, Nordio F, Lanz HJ, Mercuri MF, Antman EM, Braunwald E, Morrow DA. Performance of the ABC scores for assessing the risk of stroke or systemic embolism and bleeding in patients with atrial fibrillation in ENGAGE AF-TIMI 48. Circulation 2019;139:760771.
- Rivera-Caravaca JM, Marin F, Vilchez JA, Galvez J, Esteve-Pastor MA, Vicente V, Lip GYH, Roldan V. Refining stroke and bleeding prediction in atrial fibrillation by adding consecutive biomarkers to clinical risk scores. Stroke 2019;50:13721379.
- Esteve-Pastor MA, Rivera-Caravaca JM, Roldan V, Vicente V, Valdes M, Marin F, Lip GY. Long-term bleeding risk prediction in ‘real world’patients with atrial fibrillation: comparison of the HAS-BLED and ABC-Bleeding risk scores. Thromb Haemost 2017;117:18481858.
- Shin SY, Han SJ, Kim JS, Im SI, Shim J, Ahn J, Lee EM, Park YM, Kim JH, Lip GYH, Lim HE. Identification of markers associated with development of stroke in ‘clinically low-risk’ atrial fibrillation patients. J Am Heart Assoc 2019;8:e012697.
- Chao TF, Lip GYH, Lin YJ, Chang SL, Lo LW, Hu YF, Tuan TC, Liao JN, Chung FP, Chen TJ, Chen SA. Age threshold for the use of non-vitamin K antagonist oral anticoagulants for stroke prevention in patients with atrial fibrillation: insights into the optimal assessment of age and incident comorbidities. Eur Heart J 2019;40:15041514.
- Nielsen PB, Larsen TB, Skjoth F, Overvad TF, Lip GY. Stroke and thromboembolic event rates in atrial fibrillation according to different guideline treatment thresholds: a nationwide cohort study. Sci Rep 2016;6:27410.
- Fauchier L, Clementy N, Bisson A, Ivanes F, Angoulvant D, Babuty D, Lip GY. Should atrial fibrillation patients with only 1 nongender-related CHA2DS2- VASc risk factor be anticoagulated?Stroke 2016;47:18311836.
- Chao TF, Lip GYH, Liu CJ, Lin YJ, Chang SL, Lo LW, Hu YF, Tuan TC, Liao JN, Chung FP, Chen TJ, Chen SA. Relationship of aging and incident comorbidities to stroke risk in patients with atrial fibrillation. J Am Coll Cardiol 2018;71:122132.
- Yoon M, Yang PS, Jang E, Yu HT, Kim TH, Uhm JS, Kim JY, Pak HN, Lee MH, Lip GYH, Joung B. Dynamic changes of CHA2DS2-VASc score and the risk of ischaemic stroke in Asian patients with atrial fibrillation: a nationwide cohort study. Thromb Haemost 2018;118:12961304.
- Chao TF, Chiang CE, Chen TJ, Lip GYH, Chen SA. Reassessment of risk for stroke during follow-up of patients with atrial fibrillation. Ann Intern Med 2019;170:663664.
- Potpara TS, Polovina MM, Licina MM, Marinkovic JM, Prostran MS, Lip GY. Reliable identification of ‘truly low’ thromboembolic risk in patients initially diagnosed with ‘lone’ atrial fibrillation: the Belgrade Atrial Fibrillation Study. Circ Arrhythm Electrophysiol 2012;5:319326.
- Weijs B, Dudink E, de Vos CB, Limantoro I, Tieleman RG, Pisters R, Cheriex EC, Luermans J, Crijns H. Idiopathic atrial fibrillation patients rapidly outgrow their low thromboembolic risk: a 10-year follow-up study. Neth Heart J 2019;27:487497.
- Chao TF, Liao JN, Tuan TC, Lin YJ, Chang SL, Lo LW, Hu YF, Chung FP, Chen TJ, Lip GYH, Chen SA. Incident co-morbidities in patients with atrial fibrillation initially with a CHA2DS2-VASc score of 0 (males) or 1 (females): implications for reassessment of stroke risk in initially ‘low-risk’ patients. Thromb Haemost 2019;119:11621170.
- Borre ED, Goode A, Raitz G, Shah B, Lowenstern A, Chatterjee R, Sharan L, Allen LaPointe NM, Yapa R, Davis JK, Lallinger K, Schmidt R, Kosinski A, AlKhatib SM, Sanders GD. Predicting thromboembolic and bleeding event risk in patients with non-valvular atrial fibrillation: a systematic review. Thromb Haemost 2018;118:21712187.
- Chao TF, Lip GYH, Lin YJ, Chang SL, Lo LW, Hu YF, Tuan TC, Liao JN, Chung FP, Chen TJ, Chen SA. Incident risk factors and major bleeding in patients with atrial fibrillation treated with oral anticoagulants: a comparison of baseline, follow-up and Delta HAS-BLED scores with an approach focused on modifiable bleeding risk factors. Thromb Haemost 2018;118:768777.
- Man-Son-Hing M, Nichol G, Lau A, Laupacis A. Choosing antithrombotic therapy for elderly patients with atrial fibrillation who are at risk for falls. Arch Intern Med 1999;159:677685.
- Gage BF, Yan Y, Milligan PE, Waterman AD, Culverhouse R, Rich MW, Radford MJ. Clinical classification schemes for predicting hemorrhage: results from the National Registry of Atrial Fibrillation (NRAF). Am Heart J 2006;151:713719.
- Fang MC, Go AS, Chang Y, Borowsky LH, Pomernacki NK, Udaltsova N, Singer DE. A new risk scheme to predict warfarin-associated hemorrhage: the ATRIA (Anticoagulation and Risk Factors in Atrial Fibrillation) study. J Am Coll Cardiol 2011;58:395401.
- O’Brien EC, Simon DN, Thomas LE, Hylek EM, Gersh BJ, Ansell JE, Kowey PR, Mahaffey KW, Chang P, Fonarow GC, Pencina MJ, Piccini JP, Peterson ED. The ORBIT bleeding score: a simple bedside score to assess bleeding risk in atrial fibrillation. Eur Heart J 2015;36:32583264.
- Rohla M, Weiss TW, Pecen L, Patti G, Siller-Matula JM, Schnabel RB, Schilling R, Kotecha D, Lucerna M, Huber K, De Caterina R, Kirchhof P. Risk factors for thromboembolic and bleeding events in anticoagulated patients with atrial fibrillation: the prospective, multicentre observational PREvention oF thromboembolic events European Registry in Atrial Fibrillation (PREFER in AF). BMJ Open 2019;9:e022478.
- Pisters R, Lane DA, Nieuwlaat R, de Vos CB, Crijns HJ, Lip GY. A novel userfriendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest 2010;138:10931100.
- Mori N, Sotomi Y, Hirata A, Hirayama A, Sakata Y, Higuchi Y. External validation of the ORBIT bleeding score and the HAS-BLED score in nonvalvular atrial fibrillation patients using direct oral anticoagulants (Asian data from the DIRECT registry). Am J Cardiol 2019;124:10441048.
- Yao X, Gersh BJ, Sangaralingham LR, Kent DM, Shah ND, Abraham NS, Noseworthy PA. Comparison of the CHA2DS2-VASc, CHADS2, HAS-BLED, ORBIT, and ATRIA risk scores in predicting non-vitamin K antagonist oral anticoagulants-associated bleeding in patients with atrial fibrillation. Am J Cardiol 2017;120:15491556.
- Rutherford OW, Jonasson C, Ghanima W, Holst R, Halvorsen S. New score for assessing bleeding risk in patients with atrial fibrillation treated with NOACs. Open Heart 2018;5:e000931.
- Thomas MR, Lip GY. Novel risk markers and risk assessments for cardiovascular disease. Circ Res 2017;120:133149.
- Khan AA, Lip GYH. The prothrombotic state in atrial fibrillation: pathophysiological and management implications. Cardiovasc Res 2019;115:3145.
- Ban N, Siegfried CJ, Lin JB, Shui YB, Sein J, Pita-Thomas W, Sene A, Santeford A, Gordon M, Lamb R, Dong Z, Kelly SC, Cavalli V, Yoshino J, Apte RS. GDF15 is elevated in mice following retinal ganglion cell death and in glaucoma patients. JCI Insight 2017;2:pii: 91455. doi: 10.1172/jci.insight.91455.
- Hijazi Z, Oldgren J, Lindback J, Alexander JH, Connolly SJ, Eikelboom JW, Ezekowitz MD, Held C, Hylek EM, Lopes RD, Siegbahn A, Yusuf S, Granger CB, Wallentin L; ARISTOTLE and RE-LY Investigators. The novel biomarker-based ABC (age, biomarkers, clinical history)-bleeding risk score for patients with atrial fibrillation: a derivation and validation study. Lancet 2016;387:23022311.
- Esteve-Pastor MA, Rivera-Caravaca JM, Roldan V, Vicente V, Valdes M, Marin F, Lip GYH. Long-term bleeding risk prediction in ‘real world’ patients with atrial fibrillation: comparison of the HAS-BLED and ABC-Bleeding risk scores. The Murcia Atrial Fibrillation Project. Thromb Haemost 2017;117:1848-1858.
- Caldeira D, Costa J, Fernandes RM, Pinto FJ, Ferreira JJ. Performance of the HAS-BLED high bleeding-risk category, compared to ATRIA and HEMORR2HAGES in patients with atrial fibrillation: a systematic review and meta-analysis. J Interv Card Electrophysiol 2014;40:277284.
- Zhu W, He W, Guo L, Wang X, Hong K. The HAS-BLED score for predicting major bleeding risk in anticoagulated patients with atrial fibrillation: a systematic review and meta-analysis. Clin Cardiol 2015;38:555561.
- Chang G, Xie Q, Ma L, Hu K, Zhang Z, Mu G, Cui Y. Accuracy of HAS-BLED and other bleeding risk assessment tools in predicting major bleeding events in atrial fibrillation: a network meta-analysis. J Thromb Haemost 2020;18:791801.
- Lip GY, Lane DA. Bleeding risk assessment in atrial fibrillation: observations on the use and misuse of bleeding risk scores. J Thromb Haemost 2016;14:17111714.
- Chao TF, Lip GYH, Lin YJ, Chang SL, Lo LW, Hu YF, Tuan TC, Liao JN, Chung FP, Chen TJ, Chen SA. Major bleeding and intracranial hemorrhage risk prediction in patients with atrial fibrillation: attention to modifiable bleeding risk factors or use of a bleeding risk stratification score? A nationwide cohort study. Int J Cardiol 2018;254:157161.
- Guo Y, Zhu H, Chen Y, Lip GYH. Comparing bleeding risk assessment focused on modifiable risk factors only versus validated bleeding risk scores in atrial fibrillation. Am J Med 2018;131:185192.
- Esteve-Pastor MA, Rivera-Caravaca JM, Shantsila A, Roldan V, Lip GYH, Marin F. Assessing bleeding risk in atrial fibrillation patients: comparing a bleeding risk score based only on modifiable bleeding risk factors against the HAS-BLED score. The AMADEUS trial. Thromb Haemost 2017;117:22612266.
- Guo Y, Lane DA, Chen Y, Lip GYH; mAF-App II Trial investigators. Regular bleeding risk assessment associated with reduction in bleeding outcomes: the mAFA-II randomized trial. Am J Med 2020:pii: S0002-9343(20)30274-6.
- Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007;146:857867.
- De Caterina R, Husted S, Wallentin L, Andreotti F, Arnesen H, Bachmann F, Baigent C, Huber K, Jespersen J, Kristensen SD, Lip GY, Morais J, Rasmussen LH, Siegbahn A, Verheugt FW, Weitz JI. Vitamin K antagonists in heart disease: current status and perspectives (Section III). Position paper of the ESC working group on thrombosis Task Force on anticoagulants in heart disease. Thromb Haemost 2013;110:10871107.
- Wan Y, Heneghan C, Perera R, Roberts N, Hollowell J, Glasziou P, Bankhead C, Xu Y. Anticoagulation control and prediction of adverse events in patients with atrial fibrillation: a systematic review. Circ Cardiovasc Qual Outcomes 2008;1:8491. 415. Sjalander S, Sjogren V, Renlund H, Norrving B, Sjalander A. Dabigatran, rivaroxaban and apixaban vs. high TTR warfarin in atrial fibrillation. Thromb Res 2018;167:113118.
- Amin A, Deitelzweig S, Jing Y, Makenbaeva D, Wiederkehr D, Lin J, Graham J. Estimation of the impact of warfarin’s time-in-therapeutic range on stroke and major bleeding rates and its influence on the medical cost avoidance associated with novel oral anticoagulant use-learnings from ARISTOTLE, ROCKET-AF, and RE-LY trials. J Thromb Thrombolysis 2014;38:150159.
- Apostolakis S, Sullivan RM, Olshansky B, Lip GYH. Factors affecting quality of anticoagulation control among patients with atrial fibrillation on warfarin: the SAMe-TT(2)R(2) score. Chest 2013;144:15551563.
- Proietti M, Lip GY. Simple decision-making between a vitamin K antagonist and a non-vitamin K antagonist oral anticoagulant: using the SAMe-TT2R2 score. Eur Heart J Cardiovasc Pharmacother 2015;1:150152.
- Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, Pogue J, Reilly PA, Themeles E, Varrone J, Wang S, Alings M, Xavier D, Zhu J, Diaz R, Lewis BS, Darius H, Diener HC, Joyner CD, Wallentin L; RE-LY Steering Committee Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009;361:11391151.
- Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, Breithardt G, Halperin JL, Hankey GJ, Piccini JP, Becker RC, Nessel CC, Paolini JF, Berkowitz SD, Fox KA, Califf RM; ROCKET AF Investigators. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011;365:883891.
- Granger CB, Alexander JH, McMurray JJ, Lopes RD, Hylek EM, Hanna M, AlKhalidi HR, Ansell J, Atar D, Avezum A, Bahit MC, Diaz R, Easton JD, Ezekowitz JA, Flaker G, Garcia D, Geraldes M, Gersh BJ, Golitsyn S, Goto S, Hermosillo AG, Hohnloser SH, Horowitz J, Mohan P, Jansky P, Lewis BS, Lopez-Sendon JL, Pais P, Parkhomenko A, Verheugt FW, Zhu J, Wallentin L; ARISTOTLE Committees and Investigators. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011;365:981992.
- Giugliano RP, Ruff CT, Braunwald E, Murphy SA, Wiviott SD, Halperin JL, Waldo AL, Ezekowitz MD, Weitz JI, Spinar J, Ruzyllo W, Ruda M, Koretsune Y, Betcher J, Shi M, Grip LT, Patel SP, Patel I, Hanyok JJ, Mercuri M, Antman EM; ENGAGE AF-TIMI Investigators. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013;369:20932104.
- Ruff CT, Giugliano RP, Braunwald E, Hoffman EB, Deenadayalu N, Ezekowitz MD, Camm AJ, Weitz JI, Lewis BS, Parkhomenko A, Yamashita T, Antman EM. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet 2014;383:955962.
- Wang KL, Lip GY, Lin SJ, Chiang CE. Non-vitamin K antagonist oral anticoagulants for stroke prevention in Asian patients with nonvalvular atrial fibrillation: meta-analysis. Stroke 2015;46:25552561.
- Connolly SJ, Eikelboom J, Joyner C, Diener HC, Hart R, Golitsyn S, Flaker G, Avezum A, Hohnloser SH, Diaz R, Talajic M, Zhu J, Pais P, Budaj A, Parkhomenko A, Jansky P, Commerford P, Tan RS, Sim KH, Lewis BS, Van Mieghem W, Lip GY, Kim JH, Lanas-Zanetti F, Gonzalez-Hermosillo A, Dans AL, Munawar M, O’Donnell M, Lawrence J, Lewis G, Afzal R, Yusuf S; AVERROES Steering Committee Investigators. Apixaban in patients with atrial fibrillation. N Engl J Med 2011;364:806817.
- Carmo J, Moscoso Costa F, Ferreira J, Mendes M. Dabigatran in real-world atrial fibrillation. Meta-analysis of observational comparison studies with vitamin K antagonists. Thromb Haemost 2016;116:754763.
- Huisman MV, Rothman KJ, Paquette M, Teutsch C, Diener HC, Dubner SJ, Halperin JL, Ma CS, Zint K, Elsaesser A, Lu S, Bartels DB, Lip GYH; GLORIAAF Investigators. Two-year follow-up of patients treated with dabigatran for stroke prevention in atrial fibrillation: Global Registry on Long-Term Antithrombotic Treatment in Patients with Atrial Fibrillation (GLORIA-AF) registry. Am Heart J 2018;198:5563.
- Camm AJ, Amarenco P, Haas S, Hess S, Kirchhof P, Kuhls S, van Eickels M, Turpie AG; XANTUS Investigators. XANTUS: a real-world, prospective, observational study of patients treated with rivaroxaban for stroke prevention in atrial fibrillation. Eur Heart J 2016;37:11451153.
- Martinez CAA, Lanas F, Radaideh G, Kharabsheh SM, Lambelet M, Viaud MAL, Ziadeh NS, Turpie AGG; XANTUS Investigators. XANTUS-EL: a real-world, prospective, observational study of patients treated with rivaroxaban for stroke prevention in atrial fibrillation in Eastern Europe, Middle East, Africa and Latin America. Egypt Heart J 2018;70:307313.
- Li XS, Deitelzweig S, Keshishian A, Hamilton M, Horblyuk R, Gupta K, Luo X, Mardekian J, Friend K, Nadkarni A, Pan X, Lip GYH. Effectiveness and safety of apixaban versus warfarin in non-valvular atrial fibrillation patients in ‘real-world’ clinical practice. A propensity-matched analysis of 76,940 patients. Thromb Haemost 2017;117:10721082.
- Lee SR, Choi EK, Han KD, Jung JH, Oh S, Lip GYH. Edoxaban in Asian patients with atrial fibrillation: effectiveness and safety. J Am Coll Cardiol 2018;72:838853.
- Ingrasciotta Y, Crisafulli S, Pizzimenti V, Marciano I, Mancuso A, Ando G, Corrao S, Capranzano P, Trifiro G. Pharmacokinetics of new oral anticoagulants: implications for use in routine care. Expert Opin Drug Metab Toxicol 2018;14:1057-1069.
- Chao TF, Liu CJ, Lin YJ, Chang SL, Lo LW, Hu YF, Tuan TC, Liao JN, Chung FP, Chen TJ, Lip GYH, Chen SA. Oral anticoagulation in very elderly patients with atrial fibrillation: a nationwide cohort study. Circulation 2018;138:3747.
- Stanton BE, Barasch NS, Tellor KB. Comparison of the safety and effectiveness of apixaban versus warfarin in patients with severe renal impairment. Pharmacotherapy 2017;37:412419.
- Siontis KC, Zhang X, Eckard A, Bhave N, Schaubel DE, He K, Tilea A, Stack AG, Balkrishnan R, Yao X, Noseworthy PA, Shah ND, Saran R, Nallamothu BK. Outcomes associated with apixaban use in patients with end-stage kidney disease and atrial fibrillation in the United States. Circulation 2018;138:15191529.
- Steinberg BA, Shrader P, Thomas L, Ansell J, Fonarow GC, Gersh BJ, Kowey PR, Mahaffey KW, Naccarelli G, Reiffel J, Singer DE, Peterson ED, Piccini JP; ORBIT-AF Investigators and Patients. Off-label dosing of non-vitamin K antagonist oral anticoagulants and adverse outcomes: the ORBIT-AF II registry. J Am Coll Cardiol 2016;68:25972604.
- Yao X, Shah ND, Sangaralingham LR, Gersh BJ, Noseworthy PA. Non-vitamin K antagonist oral anticoagulant dosing in patients with atrial fibrillation and renal dysfunction. J Am Coll Cardiol 2017;69:27792790.
- ACTIVE Writing Group of the ACTIVE Investigators, Connolly S, Pogue J, Hart R, Pfeffer M, Hohnloser S, Chrolavicius S, Pfeffer M, Hohnloser S, Yusuf S. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events (ACTIVE W): a randomised controlled trial. Lancet 2006;367:19031912.
- ACTIVE Investigators, Connolly SJ, Pogue J, Hart RG, Hohnloser SH, Pfeffer M, Chrolavicius S, Yusuf S. Effect of clopidogrel added to aspirin in patients with atrial fibrillation. N Engl J Med 2009;360:20662078.
- Sjalander S, Sjalander A, Svensson PJ, Friberg L. Atrial fibrillation patients do not benefit from acetylsalicylic acid. Europace 2014;16:631638.
- Mant J, Hobbs FD, Fletcher K, Roalfe A, Fitzmaurice D, Lip GY, Murray E; BAFTA investigators, Midland Research Practices Network (MidReC). Warfarin versus aspirin for stroke prevention in an elderly community population with atrial fibrillation (the Birmingham Atrial Fibrillation Treatment of the Aged Study, BAFTA): a randomised controlled trial. Lancet 2007;370:493503.
- Lip GY. The role of aspirin for stroke prevention in atrial fibrillation. Nat Rev Cardiol 2011;8:602606. 443. Verheugt FWA, Gao H, Al Mahmeed W, Ambrosio G, Angchaisuksiri P, Atar D, Bassand JP, Camm AJ, Cools F, Eikelboom J, Kayani G, Lim TW, Misselwitz F, Pieper KS, van Eickels M, Kakkar AK; GARFIELD-AF Investigators. Characteristics of patients with atrial fibrillation prescribed antiplatelet monotherapy compared with those on anticoagulants: insights from the GARFIELDAF registry. Eur Heart J 2018;39:464473.
- Holmes DR, Reddy VY, Turi ZG, Doshi SK, Sievert H, Buchbinder M, Mullin CM, Sick P; PROTECT AF Investigators. Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation: a randomised non-inferiority trial. Lancet 2009;374:534542.
- Reddy VY, Doshi SK, Sievert H, Buchbinder M, Neuzil P, Huber K, Halperin JL, Holmes D; PROTECT AF Investigators. Percutaneous left atrial appendage closure for stroke prophylaxis in patients with atrial fibrillation: 2.3-year follow-up of the PROTECT AF (Watchman Left Atrial Appendage System for Embolic Protection in Patients with Atrial Fibrillation) trial. Circulation 2013;127:720729.
- Holmes DR Jr, Kar S, Price MJ, Whisenant B, Sievert H, Doshi SK, Huber K, Reddy VY. Prospective randomized evaluation of the Watchman left atrial appendage closure device in patients with atrial fibrillation versus long-term warfarin therapy: the PREVAIL trial. J Am Coll Cardiol 2014;64:112.
- Holmes DR, Jr., Doshi SK, Kar S, Price MJ, Sanchez JM, Sievert H, Valderrabano M, Reddy VY. Left atrial appendage closure as an alternative to warfarin for stroke prevention in atrial fibrillation: a patient-level meta-analysis. J Am Coll Cardiol 2015;65:26142623.
- Reddy VY, Mobius-Winkler S, Miller MA, Neuzil P, Schuler G, Wiebe J, Sick P, Sievert H. Left atrial appendage closure with the Watchman device in patients with a contraindication for oral anticoagulation: the ASAP study (ASA Plavix Feasibility Study With Watchman Left Atrial Appendage Closure Technology). J Am Coll Cardiol 2013;61:25512556.
- Boersma LV, Schmidt B, Betts TR, Sievert H, Tamburino C, Teiger E, Pokushalov E, Kische S, Schmitz T, Stein KM, Bergmann MW, on behalf of the EWOLUTION investigators. Implant success and safety of left atrial appendage closure with the WATCHMAN device: peri-procedural outcomes from the EWOLUTION registry. Eur Heart J 2016;37:24652474.
- Boersma LV, Ince H, Kische S, Pokushalov E, Schmitz T, Schmidt B, Gori T, Meincke F, Protopopov AV, Betts T, Foley D, Sievert H, Mazzone P, De Potter T, Vireca E, Stein K, Bergmann MW, for the EWOLUTION Investigators. Efficacy and safety of left atrial appendage closure with WATCHMAN in patients with or without contraindication to oral anticoagulation: 1-year followup outcome data of the EWOLUTION trial. Heart Rhythm 2017;14:13021308.
- Badheka AO, Chothani A, Mehta K, Patel NJ, Deshmukh A, Hoosien M, Shah N, Singh V, Grover P, Savani GT, Panaich SS, Rathod A, Patel N, Arora S, Bhalara V, Coffey JO, O’Neill W, Makkar R, Grines CL, Schreiber T, Di Biase L, Natale A, Viles-Gonzalez JF. Utilization and adverse outcomes of percutaneous left atrial appendage closure for stroke prevention in atrial fibrillation in the United States: influence of hospital volume. Circ Arrhythm Electrophysiol 2015;8:4248.
- Pison L, Potpara TS, Chen J, Larsen TB, Bongiorni MG, Blomstrom-Lundqvist C; Scientific Initiative Committee EHRA. Left atrial appendage closure-indications, techniques, and outcomes: results of the European Heart Rhythm Association Survey. Europace 2015;17:642646.
- Price MJ, Gibson DN, Yakubov SJ, Schultz JC, Di Biase L, Natale A, Burkhardt JD, Pershad A, Byrne TJ, Gidney B, Aragon JR, Goldstein J, Moulton K, Patel T, Knight B, Lin AC, Valderrabano M. Early safety and efficacy of percutaneous left atrial appendage suture ligation: results from the US transcatheter LAA ligation consortium. J Am Coll Cardiol 2014;64:565572.
- Fauchier L, Cinaud A, Brigadeau F, Lepillier A, Pierre B, Abbey S, Fatemi M, Franceschi F, Guedeney P, Jacon P, Paziaud O, Venier S, Deharo JC, Gras D, Klug D, Mansourati J, Montalescot G, Piot O, Defaye P. Device-related thrombosis after percutaneous left atrial appendage occlusion for atrial fibrillation. J Am Coll Cardiol 2018;71:15281536.
- Lakkireddy D, Afzal MR, Lee RJ, Nagaraj H, Tschopp D, Gidney B, Ellis C, Altman E, Lee B, Kar S, Bhadwar N, Sanchez M, Gadiyaram V, Evonich R, Rasekh A, Cheng J, Cuoco F, Chandhok S, Gunda S, Reddy M, Atkins D, Bommana S, Cuculich P, Gibson D, Nath J, Ferrell R, Matthew E, Wilber D. Short and long-term outcomes of percutaneous left atrial appendage suture ligation: results from a US multicenter evaluation. Heart Rhythm 2016;13:10301036.
- van Laar C, Verberkmoes NJ, van Es HW, Lewalter T, Dunnington G, Stark S, Longoria J, Hofman FH, Pierce CM, Kotecha D, van Putte BP. Thoracoscopic left atrial appendage clipping: a multicenter cohort analysis. JACC Clin Electrophysiol 2018;4:893901.
- Healey JS, Crystal E, Lamy A, Teoh K, Semelhago L, Hohnloser SH, Cybulsky I, Abouzahr L, Sawchuck C, Carroll S, Morillo C, Kleine P, Chu V, Lonn E, Connolly SJ. Left Atrial Appendage Occlusion Study (LAAOS): results of a randomized controlled pilot study of left atrial appendage occlusion during coronary bypass surgery in patients at risk for stroke. Am Heart J 2005;150:288293.
- Whitlock RP, Vincent J, Blackall MH, Hirsh J, Fremes S, Novick R, Devereaux PJ, Teoh K, Lamy A, Connolly SJ, Yusuf S, Carrier M, Healey JS. Left Atrial Appendage Occlusion Study II (LAAOS II). Can J Cardiol 2013;29:14431447.
- Tsai YC, Phan K, Munkholm-Larsen S, Tian DH, La Meir M, Yan TD. Surgical left atrial appendage occlusion during cardiac surgery for patients with atrial fibrillation: a meta-analysis. Eur J Cardiothorac Surg 2015;47:847854.
- Aryana A, Singh SK, Singh SM, O’Neill PG, Bowers MR, Allen SL, Lewandowski SL, Vierra EC, d’Avila A. Association between incomplete surgical ligation of left atrial appendage and stroke and systemic embolization. Heart Rhythm 2015;12:14311437.
- Gillinov AM, Gelijns AC, Parides MK, DeRose JJ Jr, Moskowitz AJ, Voisine P, Ailawadi G, Bouchard D, Smith PK, Mack MJ, Acker MA, Mullen JC, Rose EA, Chang HL, Puskas JD, Couderc JP, Gardner TJ, Varghese R, Horvath KA, Bolling SF, Michler RE, Geller NL, Ascheim DD, Miller MA, Bagiella E, Moquete EG, Williams P, Taddei-Peters WC, O’Gara PT, Blackstone EH, Argenziano M; CTSN Investigators. Surgical ablation of atrial fibrillation during mitral-valve surgery. N Engl J Med 2015;372:13991409.
- Whitlock R, Healey J, Vincent J, Brady K, Teoh K, Royse A, Shah P, Guo Y, Alings M, Folkeringa RJ, Paparella D, Colli A, Meyer SR, Legare JF, Lamontagne F, Reents W, Boning A, Connolly S. Rationale and design of the Left Atrial Appendage Occlusion Study (LAAOS) III. Ann Cardiothorac Surg 2014;3:4554.
- Nielsen PB, Skjoth F, Sogaard M, Kjaeldgaard JN, Lip GY, Larsen TB. Effectiveness and safety of reduced dose non-vitamin K antagonist oral anticoagulants and warfarin in patients with atrial fibrillation: propensity weighted nationwide cohort study. BMJ 2017;356:j510.
- Larsen TB, Skjoth F, Nielsen PB, Kjaeldgaard JN, Lip GY. Comparative effectiveness and safety of non-vitamin K antagonist oral anticoagulants and warfarin in patients with atrial fibrillation: propensity weighted nationwide cohort study. BMJ 2016;353:i3189.
- Tilz RR, Potpara T, Chen J, Dobreanu D, Larsen TB, Haugaa KH, Dagres N. Left atrial appendage occluder implantation in Europe: indications and anticoagulation post-implantation. Results of the European Heart Rhythm Association Survey. Europace 2017;19:17371742.
- Ogawa H, An Y, Ikeda S, Aono Y, Doi K, Ishii M, Iguchi M, Masunaga N, Esato M, Tsuji H, Wada H, Hasegawa K, Abe M, Lip GYH, Akao M; Fushimi AF Registry Investigators. Progression from paroxysmal to sustained atrial fibrillation is associated with increased adverse events. Stroke 2018;49:23012308.
- Mahajan R, Perera T, Elliott AD, Twomey DJ, Kumar S, Munwar DA, Khokhar KB, Thiyagarajah A, Middeldorp ME, Nalliah CJ, Hendriks JML, Kalman JM, Lau DH, Sanders P. Subclinical device-detected atrial fibrillation and stroke risk: a systematic review and meta-analysis. Eur Heart J 2018;39:14071415.
- Van Gelder IC, Healey JS, Crijns H, Wang J, Hohnloser SH, Gold MR, Capucci A, Lau CP, Morillo CA, Hobbelt AH, Rienstra M, Connolly SJ. Duration of device-detected subclinical atrial fibrillation and occurrence of stroke in ASSERT. Eur Heart J 2017;38:13391344.
- Boriani G, Glotzer TV, Ziegler PD, De Melis M, Mangoni di SSL, Sepsi M, Landolina M, Lunati M, Lewalter T, Camm AJ. Detection of new atrial fibrillation in patients with cardiac implanted electronic devices and factors associated with transition to higher device-detected atrial fibrillation burden. Heart Rhythm 2018;15:376383.
- Pastori D, Lip GYH, Farcomeni A, Del Sole F, Sciacqua A, Perticone F, Marcucci R, Grifoni E, Pignatelli P, Violi F, ATHERO-AF study group. Incidence of bleeding in patients with atrial fibrillation and advanced liver fibrosis on treatment with vitamin K or non-vitamin K antagonist oral anticoagulants. Int J Cardiol 2018;264:5863.
- Kuo L, Chao TF, Liu CJ, Lin YJ, Chang SL, Lo LW, Hu YF, Tuan TC, Liao JN, Chung FP, Chen TJ, Lip GYH, Chen SA. Liver cirrhosis in patients with atrial fibrillation: would oral anticoagulation have a net clinical benefit for stroke prevention?J Am Heart Assoc 2017;6.
- Lee SR, Lee HJ, Choi EK, Han KD, Jung JH, Cha MJ, Oh S, Lip GYH. Direct oral anticoagulants in patients with atrial fibrillation and liver disease. J Am Coll Cardiol 2019;73:32953308.
- Staerk L, Lip GY, Olesen JB, Fosbol EL, Pallisgaard JL, Bonde AN, Gundlund A, Lindhardt TB, Hansen ML, Torp-Pedersen C, Gislason GH. Stroke and recurrent haemorrhage associated with antithrombotic treatment after gastrointestinal bleeding in patients with atrial fibrillation: nationwide cohort study. BMJ 2015;351:h5876.
- Eckman MH, Singer DE, Rosand J, Greenberg SM. Moving the tipping point: the decision to anticoagulate patients with atrial fibrillation. Circ Cardiovasc Qual Outcomes 2011;4:1421.
- Proietti M, Lip GY. Major outcomes in atrial fibrillation patients with one risk factor: impact of time in therapeutic range observations from the SPORTIF trials. Am J Med 2016;129:11101116.
- Lip GY, Nielsen PB. Should patients with atrial fibrillation and 1 stroke risk factor (CHA2DS2-VASc Score 1 in Men, 2 in Women) be anticoagulated? Yes: even 1 stroke risk factor confers a real risk of stroke. Circulation 2016;133:14981503; discussion 1503.
- Lip GY, Lane DA. Stroke prevention in atrial fibrillation: a systematic review. JAMA 2015;313:19501962.
- Hijazi Z, Hohnloser SH, Andersson U, Alexander JH, Hanna M, Keltai M, Parkhomenko A, Lopez-Sendon JL, Lopes RD, Siegbahn A, Granger CB, Wallentin L. Efficacy and safety of apixaban compared with warfarin in patients with atrial fibrillation in relation to renal function over time: insights from the ARISTOTLE randomized clinical trial. JAMA Cardiol 2016;1:451460.
- Bohm M, Ezekowitz MD, Connolly SJ, Eikelboom JW, Hohnloser SH, Reilly PA, Schumacher H, Brueckmann M, Schirmer SH, Kratz MT, Yusuf S, Diener HC, Hijazi Z, Wallentin L. Changes in renal function in patients with atrial fibrillation: an analysis from the RE-LY trial. J Am Coll Cardiol 2015;65:24812493.
- Clarkesmith DE, Pattison HM, Lip GY, Lane DA. Educational intervention improves anticoagulation control in atrial fibrillation patients: the TREAT randomised trial. PLoS One 2013;8:e74037.
- Teiger E, Thambo JB, Defaye P, Hermida JS, Abbey S, Klug D, Juliard JM, Pasquie JL, Rioufol G, Lepillier A, Elbaz M, Horvilleur J, Brenot P, Pierre B, Le Corvoisier P. Percutaneous left atrial appendage closure is a reasonable option for patients with atrial fibrillation at high risk for cerebrovascular events. Circ Cardiovasc Interv 2018;11:e005841.
- Saw J, Fahmy P, Azzalini L, Marquis JF, Hibbert B, Morillo C, Carrizo A, Ibrahim R. Early Canadian multicenter experience with WATCHMAN for percutaneous left atrial appendage closure. J Cardiovasc Electrophysiol 2017;28:396401.
- Martin Gutierrez E, Castano M, Gualis J, Martinez-Comendador JM, Maiorano P, Castillo L, Laguna G. Beneficial effect of left atrial appendage closure during cardiac surgery: a meta-analysis of 280 585 patients. Eur J Cardiothorac Surg 2020;57:252262.
- Al-Khatib SM, Allen LaPointe NM, Chatterjee R, Crowley MJ, Dupre ME, Kong DF, Lopes RD, Povsic TJ, Raju SS, Shah B, Kosinski AS, McBroom AJ, Sanders GD. Rate- and rhythm-control therapies in patients with atrial fibrillation: a systematic review. Ann Intern Med 2014;160:760773.
- Tamariz LJ, Bass EB. Pharmacological rate control of atrial fibrillation. Cardiol Clin 2004;22:3545.
- Nikolaidou T, Channer KS. Chronic atrial fibrillation: a systematic review of medical heart rate control management. Postgrad Med J 2009;85:303312.
- Groenveld HF, Crijns HJ, Van den Berg MP, Van Sonderen E, Alings AM, Tijssen JG, Hillege HL, Tuininga YS, Van Veldhuisen DJ, Ranchor AV, Van Gelder IC; RACE II Investigators. The effect of rate control on quality of life in patients with permanent atrial fibrillation: data from the RACE II (Rate Control Efficacy in Permanent Atrial Fibrillation II) study. J Am Coll Cardiol 2011;58:17951803.
- Van Gelder IC, Groenveld HF, Crijns HJ, Tuininga YS, Tijssen JG, Alings AM, Hillege HL, Bergsma-Kadijk JA, Cornel JH, Kamp O, Tukkie R, Bosker HA, Van Veldhuisen DJ, Van den Berg MP; RACE II Investigators. Lenient versus strict rate control in patients with atrial fibrillation. N Engl J Med 2010;362:13631373.
- Van Gelder IC, Wyse DG, Chandler ML, Cooper HA, Olshansky B, Hagens VE, Crijns HJ; RACE and AFFIRM Investigators. Does intensity of rate-control influence outcome in atrial fibrillation? An analysis of pooled data from the RACE and AFFIRM studies. Europace 2006;8:935942.
- Van Gelder IC, Rienstra M, Crijns HJ, Olshansky B. Rate control in atrial fibrillation. Lancet 2016;388:818828.







