1. ĐẠI CƯƠNG
Đau thắt ngực ổn định mạn tính là biểu hiệnlâm sàngcó triệu chứng thường gặp nhất của bệnh tim thiếu máu cục bộ và việc điều trị bệnh lý này là một vấn đề cần được ưu tiên.
ThS.BS TRẦN CÔNG DUY
Bộ Môn Nội Tổng Quát
Đại Học Y Dược TP. Hồ Chí Minh
Các hướng dẫn thực hành lâm sàng hiện hànhkhuyến cáo điều trị giảm đau ngực để kiểm soát triệu chứng trước khi xem xét tái thông động mạch vành. Tuy nhiên, tái thông động mạch vành bằng can thiệp động mạch vành qua da hoặc phẫu thuật bắc cầu động mạch vành được chỉ định ở các bệnh nhân hẹp động mạch vành có ý nghĩa để giảm thiếu máu cục bộ cơ tim và biểu hiện lâm sàng nặng. Các thuốc chống đau thắt ngực được chấp thuận điều trị vì cải thiện tổng thời gian gắng sức cùng với giảm tần suất cơn đau ngực mỗi ngày so với giả dược và/hoặc tương đương với hoạt chất khác. Các kết cục tim mạch mặc dù được ủng hộ cao nhưng không phải là tiêu chuẩn bắt buộc để chấp thuận sử dụng một thuốc tim mạch. Các thuốc chống đau thắt ngực chưa chứng minh giảm được tử vong tim mạch hoặc tỉ lệ nhồi máu cơ tim. Khi các bệnh nhân được điều trị tối ưu, tỉ lệ tử vong do đau thắt ngực ổn định thấp, điều này có thể giải thích tại sao tất cả các thử nghiệm cải thiện tiên lượng đều cho kết quả âm tính. Các hướng dẫn khuyến cáo tiếp cận lựa chọn thuốc chống đau thắt ngực hàng thứ nhất và hàng thứ hai dựa vào truyền thống và kinh nghiệm chuyên gia hơn là dựa vào chứng cứ. Phương pháp tiếp cận này bị đặt nghi vấn trong những năm qua. Các thuốc chống đau thắt ngực mới được phân loại hàng thứ hai có nhiều dữ liệu lâm sàng mới dựa vào chứng cứ ủng hộ sử dụng nhóm thuốc này hơn các thuốc hàng thứ nhất truyền thống. Một vấn đề trong thực hành lâm sàng là sự phối hợp hai hoặc ba thuốc chống đau thắt ngực thường dựa vào ý kiến chuyên gia và không liên quan với cơ chế sinh lý bệnh. Do đó, điều trị giảm đau thắt ngực tối ưu thay đổi đáng kể giữa các quốc gia và phần lớn bác sĩ điều trị bệnh nhân theo ý kiến riêng của họ. Một nhóm chuyên gia với nhiều kinh nghiệm và quan tâm về đau thắt ngực ổn định đã họp tại Đại học Ferrara, Italy để thảo luận về tiếp cận cá thể hóa điều trị nội khoa đau thắt ngực ổn định dựa vào sinh lý bệnh và các bệnh đồng mắc [100]. Phương pháp tiếp cận ‘kim cương’ này có thể phù hợp hơn các khuyến cáo hiện tại để hướng dẫn các bác sĩ lâm sàng chọn lựa chế độ thuốc thích hợp nhất trong đơn trị liệu hoặc phối hợp thuốc đối với từng bệnh nhân (Hình 1) [100].
2. SINH LÝ BỆNH CỦA ĐAU THẮT NGỰC ỔN ĐỊNH MẠN TÍNH
Nhiều cơ chế sinh lý bệnh khác nhau có thể gây ra thiếu máu cục bộ cơ tim và triệu chứng đau thắt ngực (Hình 2). Đau thắt ngực ổn định mạn tính có thể được chia thành ba nhóm chính: đau thắt ngực ổn định, đau thắt ngực do co thắt động mạch vành và đau thắt ngực do vi mạch. Đau thắt ngực ổn định xảy ra khi thiếu máu cục bộ cơ tim bị gây ra bởi hẹp cố định một hoặc nhiều động mạch vành thượng tâm mạc do xơ vữa động mạch.
Trong một số trường hợp, đau thắt ngực có liên quan với co thắt động mạch vành và rối loạn chức năng chuyển hóa. Đau thắt ngực do co thắt động mạch vành xuất hiện khi thiếu máu cục bộ cơ tim bị gây ra bởi co thắt động mạch vành có hoặc không có rối loạn chức năng nội mô.
Đau thắt ngực do vi mạch đề cập đến trường hợp không có tắc nghẽn động mạch vành thượng tâm mạc. Thiếu máu cục bộ cơ tim trong trường hợp này xảy ra do rối loạn chức năng vi mạch và/hoặc nội mô và viêm.
3. CÁC THUỐC ĐIỀU TRỊ CHỐNG ĐAU THẮT NGỰC
Điều trị đau thắt ngực ổn định mạn tính bao gồm thay đổi lối sống, kiểm soát các yếu tố nguy cơ bệnh động mạch vành với các biện pháp điều trị xâm lấn và không xâm lấn [1-4]. Điều trị thuốc có hai mục tiêu chính: thứ nhất là giảm triệu chứng, tăng thời gian đi bộ không đau ngực và cải thiện chất lượng cuộc sống; và thứ hai là phòng ngừa các biến cố tim mạch, chủ yếu là nhồi máu cơ tim và tử vong. Thật không may, các nghiên cứu dựa vào chứng cứ chỉ ra rằng cả hai mục tiêu này không thể đạt được với cùng một nhóm thuốc – điều trị thuốc để phòng ngừa các biến cố tim mạch (aspirin, statin và ức chế men chuyển) không giảm triệu chứng và tương tự điều trị triệu chứng không cải thiện tiên lượng.
Tất cả các hướng dẫn điều trị xem xét chứng cứ từ các dữ liệu thử nghiệm được xuất bản và phân tích gộp của các nghiên cứu khác nhau. Tuy nhiên, trong trường hợp không có các dữ liệu này, các khuyến cáo được đưa ra theo các hướng dẫn trước đó, niềm tin truyền thống và ý kiến của các chuyên gia trong ủy ban soạn thảo. Do đó, một số hướng dẫn không dựa vào chứng cứ. Sự thiếu dữ liệu khách quan, đáng tin cậy dẫn đến mức độ khuyến cáo thấp. Sự thiếu dữ liệu khách quan đặc biệt có ý nghĩa đối với các hướng dẫn điều trị đau thắt ngực [5-8]. Các khuyến cáo AHA/ACC [2], ESC [1] và NICE [4] đề nghị điều trị lựa chọn hàng thứ nhất là nitroglycerine tác dụng ngắn hoặc ngậm dưới lưỡi, ức chế beta và ức chế canxi. Ivabradine, nicorandil, ranolazine, và trimetazidine được dành cho các bệnh nhân có chống chỉ định hoặc không dung nạp với thuốc hàng thứ nhất, hoặc vẫn còn triệu chứng mặc dù dữ liệu lâm sàng dựa vào chứng cứ của các thuốc hàng thứ hai cập nhật và sẵn có hơn các thuốc hàng thứ nhất. Nghiên cứu so sánh đối đầu giữa các nhóm thuốc hàng thứ nhất và hàng thứ hai không được thực hiện để chứng minh tính ưu việt của nhóm thuốc này so với nhóm kia về tác dụng giảm đau thắt ngực. Hơn nữa, điều trị hai thuốc và thỉnh thoảng ba thuốc với các nhóm thuốc khác nhau thường cần thiết và các hướng dẫn không cung cấp chỉ định phối hợp tối ưu. Tuy nhiên, y văn rõ ràng cho thấy rằng một số thuốc có những đặc điểm chuyên biệt (ngoài tác dụng chống đau thắt ngực) cho phép chọn lựa điều trị tốt nhất theo cơ chế sinh lý bệnh đặc hiệu hoặc bệnh đồng mắc và/hoặc các yếu tố nguy cơ. Tiếp cận “kim cương” là một khung tham khảo để cá thể hóa điều trị sử dụng các thuốc chống đau thắt ngực đã có, giúp các bác sĩ lâm sàng chọn lựa thuốc tốt nhất cho các bệnh nhân.
Phối hợp hai hoặc ba thuốc chống thiếu máu cục bộ với tác dụng bổ sung hoặc cộng hợp thường cần thiết để kiểm soát hiệu quả các triệu chứng. Cách phối hợp thuốc này cũng nên được điều chỉnh theo loại đau thắt ngực ổn định và từng cá thể bệnh nhân (Hình 1). Dưới đây là thông tin về trimetazidine và ivabradine, các loại thuốc chống đau thắt ngực đã được chứng minh hiệu quả và tính an toàn qua các thử nghiệm lâm sàng và nghiên cứu thế giới thực và thường được dùng trong thực hành lâm sàng.
TRIMETAZIDINE
Trimetazidine là dẫn xuất piperazine. Trimetazidine tăng dung nạp của tế bào với thiếu máu cục bộ bằng cách ức chế 3-ketoacyl-CoA thiolase ở ty thể và do đó tăng chuyển hóa glucose. Vì thế, trimetazidine tác động trực tiếp đưa pyrovate vào ty thể, dẫn đến sản xuất ít proton và acid lactic từ cơ tim thiếu máu cục bộ và nhiều ATP hơn từ bào tương trong điều kiện kỵ khí. Kết quả của tác dụng này là giảm oxy hóa acid béo và tăng sử dụng glucose bởi cơ tim thiếu máu cục bộ [66]. Những ảnh hưởng chuyển hóa này đã được khẳng định trong tình huống lâm sàng khi điều trị trimetazidine trong 3 tháng tăng 33% nồng độ phosphate năng lượng cao ở cơ tim của bệnh nhân suy tim [67]. Các tác dụng giảm đau thắt ngực trên lâm sàng của trimetazidine đã được kiểm định trong các nghiên cứu ở bệnh nhân thiếu máu cục bộ cơ tim mạn tính như đơn trị hay phối hợp với ức chế canxi hoặc ức chế beta [68-70]. Nhìn chung, tác dụng phụ liên quan điều trị nhẹ và dung nạp tốt, chủ yếu gồm rối loạn tiêu hóa như buồn nôn, nôn và đau đầu nhẹ. Tuy nhiên, trimetazidine không được khuyến cáo ở các bệnh nhân bệnh Parkinson, hội chứng Parkinson, và các rối loạn vận động liên quan khác hoặc ở các bệnh nhân suy thận nặng (độ thanh lọc creatinine < 30 ml/phút).
Những điểm chính của trimetazidine:
vTrimetazidine là thuốc điều hòa chuyển hóa không gây ra các ảnh hưởng huyết động. Do đó, không như tất cả các thuốc chống đau thắt ngực hàng thứ nhất và hàng thứ hai khác, trimetazidine không ảnh hưởng nhu cầu oxy nhưng cải thiện hiệu suất chuyển hóa của tế bào cơ tim thiếu máu cục bộ.
vTrong một phân tích gộp, trimetazidine cải thiện có ý nghĩa dung nạp gắng sức, số cơn đau thắt ngực mỗi tuần và giảm sử dụng nitrat tác dụng ngắn so với giả dược [71]. Các tác dụng giảm đau thắt ngực tương tự với các thuốc chống đau thắt ngực khác [23].
IVABRADINE
Bằng cách ức chế kênh If, ivabradine giảm độ dốc pha khử cực tâm trương chậm của điện thế động ở các tế bào nút xoang, do đó giảm chọn lọc tần số tim. Ức chế If phụ thuộc vào liều sử dụng, và giảm tần số tim với ivabradin nhiều hơn khi tần số tim ban đầu cao, và thấp hơn khi tần số tim ban đầu thấp [45]. Ivabradine không có tác dụng giảm co bóp cơ tim [45]. Giảm tần số tim do ivabradine tương tự như ức chế beta nhưng duy trì dãn động mạch vành trong lúc gắng sức [46]. Ngoài ra, ivabradin tăng dự trữ lưu lượng động mạch vành và tưới máu tuần hoàn bàng hệ, thúc đẩy sự phát triển của tuần hoàn bàng hệ và duy trì chức năng nội mô ở các bệnh nhân đau thắt ngực ổn định [47,48]. Tác dụng giảm đau thắt ngực của ivabradine đã được báo cáo ở một số thử nghiệm lâm sàng ngẫu nhiên so với giả dược/các hoạt chất khác và phối hợp với ức chế beta cũng như ở các nghiên cứu thế giới thực phản ánh thực hành lâm sàng hàng ngày [29],[49]. Tác dụng phụ của ivabradin là nhịp tim chậm và mắt nhìn đom đóm. Sự xuất hiện nhịp chậm được báo cáo ở 2,2-4,2% bệnh nhân đau thắt ngực ổn định. Tỉ lệ nhịp chậm cao hơn nhiều (18,0%) trong thử nghiệm SIGNIFY [39]. Lưu ý là chế độ điều trị trong SIGNIFY (7,5 mg tăng liều đến 10,0 mg 2 lần/ngày) khác đáng kể với thực hành lâm sàng hiện tại, và 4,6% bệnh nhân được điều trị với diltiazem or verapamil, là các chất ức chế trung bình cytochrome P450 P3A4 trong chuyển hóa ivabradine. Sự ức chế này có thể góp phần vào nhịp chậm quá mức. Trong thử nghiệm SHIFT gồm 6.558 bệnh nhân suy tim mạn, mặc dù tình trạng suy yếu của bệnh nhân và 89% bệnh nhân sử dụng ức chế beta, ngưng điều trị do nhịp chậm xảy ra chỉ ở 1% trong toàn bộ dân số. Các triệu chứng thị giác do ivabradine gây ra bởi sự hiện diện của kênh If ở võng mạc gần giống với kênh If của nút xoang. Mắt nhìn đom đóm xảy ra ở 5,4% bệnh nhân, nhẹ và thoáng qua, và hiếm khi dẫn đến ngưng điều trị (< 1%) [39]. Điều trị với ivabradine cũng dường như tăng tỉ lệ tuyệt đối rung nhĩ 0,7% [51]. Phần lớn trường hợp rung nhĩ trong thử nghiệm SIGNIFY [39] là kịch phát và được điều trị theo các hướng dẫn châu Âu hiện hành.
Những điểm chính của ivabradine:
vHiệu quả giảm đau thắt ngực của ivabradine tương tự với các nhóm thuốc chống đau thắt ngực khác [52,53].
vIvabradine mang lại những lợi ích bổ sung khi được sử dụng phối hợp với các thuốc chống đau thắt ngực khác (ngoại trừ diltiazem và verapamil) bao gồm ức chế beta [29].
vTác dụng cộng hợp giữa ức chế beta và ivabradine cho thấy ở các bệnh nhân đang điều trị với ức chế beta vẫn còn triệu chứng, bổ sung ivabradine hiệu quả hơn tăng liều ức chế beta [54].
vDữ liệu thử nghiệm SIGNIFY [39] khẳng định rằng ivabradine cải thiện các triệu chứng đau thắt ngực ổn định nhưng không ảnh hưởng các kết cục ở bệnh nhân với phân suất tống máu thất trái bảo tồn. Ở phân nhóm đau thắt ngực ổn định đã xác định trước (CCS ≥ 2; 12.000 bệnh nhân), tổ hợp kết cục chính gồm tử vong do tim mạch và nhồi máu cơ tim không tử vong có vẻ tăng. Ủy Ban Đánh Giá Nguy Cơ Cảnh Giác Dược của Cơ Quan Dược Châu Âu (European Medicines Agency) kết luận rằng sau khi đánh giá dữ liệu SIGNIFY, liều ivabradine thích hợp (đến 7,5 mg hai lần/ngày) là chọn lựa điều trị hữu ích giảm các triệu chứng và cải thiện chất lượng cuộc sống ở các bệnh nhân đau thắt ngực ổn định thích hợp với nhịp xoang ≥ 70 lần/phút không thể dung nạp hoặc triệu chứng không được kiểm soát đầy đủ với ức chế beta [55].
vThử nghiệm BEAUTIFUL [56,57] đánh giá ảnh hưởng của ivabradine trên các kết cục lâm sàng. Kết cục chính (phối hợp tử vong do tim mạch và nhập viện do nhồi máu cơ tim hoặc suy tim mới khởi phát hoặc nặng hơn) không được cải thiện bởi ivabradine. Trong một phân tích dưới nhóm đã xác định trước ở bệnh nhân đau thắt ngực ổn định mạn tính tại thời điểm ban đầu, ivabradine giảm tỉ lệ nhồi máu cơ tim [58].
vPhân tích vào năm 2016 ở các bệnh nhân bệnh tim thiếu máu cục bộ và đau thắt ngực ổn định mạn tính trong thử nghiệm SHIFT cho thấy rằng các lợi ích kết cục của ivabradine được duy trì trong thời gian theo dõi 22,9 tháng.
4. TIẾP CẬN ‘KIM CƯƠNG’ TRONG ĐIỀU TRỊ ĐAU THẮT NGỰC ỔN ĐỊNH MẠN TÍNH
Đơn trị liệu hoặc phối hợp thuốc trong điều trị đau thắt ngực ổn định được dựa trên cơ chế sinh lý bệnh đặc hiệu hoặc bệnh đồng mắc của từng cá thể bệnh nhân (Hình 3, 4).
Tần số tim cao
Các thuốc giảm tần số tim như ức chế beta, ức chế canxi nondihydropyridine (diltiazem và verapamil), và ivabradine là các thuốc được ưa thích khi tần số tim > 70 lần/phút. Ivabradine có thể được sử dụng an toàn và hiệu quả trong phối hợp với ức chế beta khi tần số tim vẫn còn ≥ 70 lần/phút [29], nhưng phối hợp ivabradine với diltiazem hoặc verapamil bị chống chỉ định [39]. Các thuốc dãn mạch như ức chế canxi dihydropyridine và nitrat ít hấp dẫn hơn vì có thể tăng tần số tim. Các thuốc chống đau thắt ngực khác có thể thêm vào nếu cần. Tuy nhiên, phối hợp ức chế beta với diltiazem hoặc verapamil không được khuyến cáo do nguy cơ của block nhĩ thất cao độ. Mục tiêu tần số tim tối ưu chưa được đồng thuận. Cơ Quan Dược Châu Âu khuyến cáo các thuốc giảm tần số tim nên được sử dụng khi tần số tim > 70 lần/phút, nhưng nên giảm liều nếu tần số tim dưới 50 – 55 lần/phút (Hình 3).
Tần số tim thấp
Khi tần số tim thấp (≤ 50-55 lần/phút), các thuốc giảm tần số tim rõ ràng bị chống chỉ định. Các lựa chọn ưa thích nên là ức chế canxi dihyropyridine và nitrat hoặc nicorandil, bởi vì các thuốc này có thể tăng tần số tim bằng thúc đẩy phản xạ giao cảm (Hình 3).
Tăng huyết áp
Ức chế beta và ức chế canxi được ưa thích ở bệnh nhân có tăng huyết áp. Huyết áp không nên giảm dưới 130 mmHg tâm thu và 80 mmHg tâm trương vì hiện tượng đường cong J đã được chứng minh ở bệnh nhân bệnh động mạch vành [72]. Một phân tích gộp cho thấy ở các bệnh nhân đái tháo đường và huyết áp tâm thu ban đầu < 140 mmHg, điều trị hạ áp thêm nữa dẫn đến tăng nguy cơ tử vong do tim mạch [73] (Hình 3).
Tụt huyết áp
Các thuốc như ức chế canxi, nitrat và ức chế beta không nên được sử dụng ở các bệnh nhân đau thắt ngực có huyết áp thấp vì có thể giảm tưới máu mạch vành. Ngưỡng cụ thể huyết áp cao so với huyết áp thấp chưa được đề ra ở các bệnh nhân bệnh động mạch vành. Xem xét các dữ liệu có sẵn, ngưỡng huyết áp tâm thu 130 mmHg và tâm trương 80 mmHg có thể hợp lý [72],[73]. Ở các bệnh nhân huyết áp thấp, sử dụng ivabradine (nếu liên quan tăng tần số tim đồng thời), ranolazine hoặc trimetazidine được ưa thích (Hình 3).
Rối loạn chức năng thất trái và suy tim
Khi đau thắt ngực ổn định mạn tính hiện diện ở các bệnh nhân rối loạn chức năng thất trái có hoặc không có biểu hiện suy tim, chỉ định dựa vào chứng cứ là sử dụng ức chế beta có thể giảm đau thắt ngực và đồng thời giảm hiệu quả tử vong và bệnh tật do tim mạch ở các bệnh nhân này [30-31]. Các tác dụng hữu ích này có vẻ liên quan trực tiếp với tác dụng giảm tần số tim của ức chế beta; do đó, nên tránh dùng ức chế beta với hoạt tính giao cảm nội tại. Nếu tần số tim > 70 lần/phút mặc dù sử dụng ức chế beta tối ưu, ivabradine nên được xem xét. Thử nghiệm SHIFT [50] cho thấy lợi ích trên tiên lượng của bổ sung ivabradine vào điều trị tối ưu ở các bệnh nhân suy tim và phân suất tống máu giảm. Các lợi ích tương tự cũng gặp ở phân nhóm đau thắt ngực ổn định [59]. Diltiazem và verapamil nên được sử dụng thận trọng ở phân nhóm bệnh nhân này vì có thể làm nặng hơn rối loạn chức năng thất trái [74]. Phân tích gộp các nghiên cứu ở các bệnh nhân rối loạn chức năng thất trái và/hoặc suy tim cho thấy trimetazidine có thể có lợi khi phối hợp với các biện pháp điều trị được khuyến cáo [75] (Hình 4).
Rung nhĩ
Rung nhĩ có thể tăng các triệu chứng đau thắt ngực do tăng tần số tim. Vì vậy, các thuốc ức chế beta và ức chế canxi nondihydropyridine được ưa thích khi rung nhĩ hiện diện. Ngược lại, do tính chọn lọc kênh If, ivabradine không hiệu quả ở bệnh nhân rung nhĩ và thậm chí có thể tăng tỉ lệ rối loạn nhịp. Một phân tích gộp cho thấy điều trị với ivabradine có liên quan với nguy cơ tương đối rung nhĩ 1,15 [76]. Thử nghiệm SIGNIFY [39] cho thấy rối loạn nhịp nhĩ thường gặp hơn ở bệnh nhân được điều trị ivabradine (5,3%) so với giả dược (3,8%). Vì những lý do đó, ivabradine chống chỉ định ở các bệnh nhân đau thắt ngực ổn định và rung nhĩ. Ức chế canxi dihydropyridine, nitrat hoặc nicorandil cũng nên tránh sử dụng vì có thể tăng tần số tim trong khi các thuốc khác có thể cần kết hợp với ức chế beta để kiểm soát các triệu chứng của đau thắt ngực ổn định. Ranolazine ức chế rối loạn nhịp trên thất và rung nhĩ có thể hữu ích [77,78] (Hình 3).
Đái tháo đường
Đái tháo đường thường liên quan với xơ vữa động mạch vành và được xem là yếu tố tương đương bệnh tim thiếu máu cục bộ. Các bệnh nhân đái tháo đường có gánh nặng thiếu máu cục bộ nặng hơn ở cả thể lâm sàng biểu hiện triệu chứng và im lặng. Điều trị đau thắt ngực ở các bệnh nhân này cần các thuốc có tác dụng chuyển hóa dương tính hoặc trung tính. Trimetazidine có tác dụng dương tính bằng cách tăng sử dụng glucose trong tình trạng thiếu máu cục bộ. Một số thử nghiệm trimetazidine đã cung cấp các dữ liệu dương tính này ở phân nhóm bệnh nhân đái tháo đường [79]. Vì thế, trimetazidine nên là tiếp cận ưa thích ở phân nhóm bệnh nhân này. Nhiều dữ liệu lâm sàng dựa vào chứng cứ cũng cho thấy ranolazine mang đến tác dụng có lợi lên HbA1C [80]. Hiệu quả của ranolazine ở bệnh nhân đái tháo đường típ 2 và đau thắt ngực ổn định được nghiên cứu trong một thử nghiệm mù đôi, có đối chứng giả dược. Ranolazine giảm có ý nghĩa nồng độ HbA1C, dẫn đến giảm nồng độ đường huyết đói và sau ăn 2 giờ và giảm sự xuất hiện đau ngực trong khi tăng dung nạp gắng sức [81].
Về mặt chứng cứ truyền thống, ức chế beta được xem làm tăng đái tháo đường mới mắc và cản trở kiểm soát đường huyết. Vì những lý do, ức chế beta nên được tránh dùng ở bệnh nhân đái tháo đường và đau thắt ngực ổn định. Tuy nhiên, các thuốc ức chế beta dãn mạch mới như carvedilol và nebivolol đã được báo cáo cải thiện tính nhạy cảm với insulin, vượt qua hạn chế chuyển hóa của các thuốc ức chế beta truyền thống [82]. Tất cả các thuốc chống đau thắt ngực khác có thể được sử dụng để giảm gánh nặng thiếu máu cục bộ (Hình 4).
Bệnh thận mạn
Bệnh thận mạn là một yếu tố nguy cơ thường liên quan với bệnh động mạch vành và có ảnh hưởng lớn đến kết cục và quyết định điều trị. Tuy nhiên, nhóm bệnh nhân này ít được đề cập trong các thử nghiệm lâm sàng vì bệnh thận mạn thường là một tiêu chuẩn loại trừ. Ranolazine và trimetazidine không nên được kê đơn khi độ lọc cầu thận < 30 mL/phút/1,73 m2 da. Ranolazine được chuyển hóa ở gan bởi cytochrome P450 và được bài tiết bởi thận. Nồng độ thuốc này trong huyết tương tăng đến 50-60% ở bệnh nhân suy gan hoặc suy thận trung bình [83]. Không ngạc nhiên rằng do cùng nhóm dược lý nên những hạn chế của ranolazine cũng tồn tại đối với trimetazidine. Do đó, các thuốc này không nên được sử dụng ở bệnh nhân đau thắt ngực ổn định và bệnh thận mạn vì cónguy cơ tác dụng phụ. Các thuốc chống đau thắt ngực khác không bị chống chỉ định (Hình 4).
Bệnh phổi tắc nghẽn mạn tính
Bệnh phổi tắc nghẽn mạn tính thường gặp, chiếm phần lớn các yếu tố nguy cơ bệnh động mạch vành và là nguyên nhân tử vong đứng hàng thứ ba [84]. Các nghiên cứu quan sát phát hiện rằng bệnh phổi tắc nghẽn mạn tính tăng ba lần nguy cơ suy tim và hai lần nguy cơ bệnh động mạch vành [84]. Về mặt lịch sử, ức chế beta không được khuyến cáo vì tiềm năng tác dụng phụ trên hô hấp; ức chế thụ thể β2 giao cảm có thể dẫn đến co thắt phế quản và làm xấu đichức năng hô hấp. Chứng cứ cho thấy ức chế beta chọn lọc β1 nhìn chung được dung nạp tốt ở các bệnh nhân bệnh phổi tắc nghẽn mạn tính và có thể cải thiện sống còn và tính đáp ứng phế quản [85]. Do tính chọn lọc β1 cao, bisoprolol là thuốc ức chế beta duy nhất không bị chống chỉ định ở bệnh phổi tắc nghẽn mạn tính. Tuy nhiên, sự đồng mắc hen phế quản là chống chỉ định rõ ràng của sự dụng ứcchế beta vì đây là bệnh lý tắc nghẽn đường hô hấp mạn tính với tính đáp ứng phế quản dương tính. Ở những bệnh nhân này, khi điều trị đau thắt ngực cần giảm tần số tim, ivabradine, diltiazem, hoặc verapamil được ưa thích. Đối với bệnh nhân đau thắt ngực ổn định và chức năng thất trái bảo tồn, lựa chọn ức chế canxi hoặc nitrat được ưa thích vì ức chế beta sẽ không mang lại bất kỳ lợi ích về tiên lượng. Trong trường hợp đồng mắc tăng áp động mạch phổi với rối loạn chức năng thất phải, ức chế canxi và ức chế beta không có tính chọn lọc không được khuyến cáo (Hình 4).
Bệnh động mạch ngoại biên
Đau cách hồi từng cơn là triệu chứng thường gặp nhất của bệnh động mạch ngoại biên do xơ vữa, và thường liên quan với đau thắt ngực ổn định nhất là ở các bệnh nhân đái tháo đường [86]. Đau cách hồi từng cơn giới hạn thời gian gắng sức nên thường che giấu sự xuất hiện của đau thắt ngực ổn định. Bệnh nhân bệnh động mạch ngoại biên và đau thắt ngực ổn định tăng tỉ lệ tử vong và do đó cần điều trị tích cực. Về mặt truyền thống, ức chế beta được xem có tác dụng bảo vệ tim chống lại thiếu máu cục bộ và do đó cũng hiệu quả ở bệnh nhân bệnh động mạch ngoại biên. Nhận định này đã bị nghi ngờ vì ảnh hưởng huyết động ngoại biên bất lợi của ức chế beta gồm giảm cung lượng tim và hoạt hóa α-adrenergic dẫn đến co mạch [86,87]. Vào năm 2013, Hội Y Khoa Anh tuyên bố rằng chống chỉ định ức chế beta ở bệnh động mạch ngoại biên mức độ nặng [88]. Vào cùng năm đó, tổng quan hệ thống Cochrane kết luậnkhông có chứng cứ mạnh ủng hộ hoặc chống lại sử dụng ức chế beta ở bệnh động mạch ngoại biên [89]. Do thiếu dữ liệu hiện đại và đáng tin cậy, ức chế beta nên được tránh hoặc sử dụng thận trọng ở bệnh nhân đau thắt ngực ổn định kèm bệnh động mạch ngoại biên. Tương tự (và đặc biệt trong trường hợp thiếu máu cục bộ nặng), các thuốc dãn mạch như ức chế canxi và nitrat cũng nên được tránh vì giảm huyết áp cấp tính có hại. Các thuốc chống đau thắt ngực còn lại (ivabradine, ranolazine, và trimetazidine) được ưa thích (Hình 4).
Rối loạn dẫn truyền nhĩ thất
Các bệnh nhân đau thắt ngực ổn định thường biểu hiện rối loạn dẫn truyền nhĩ thất với các mức độ khác nhau. Ức chế beta và ức chế canxi nondihydropyridine giảm dẫn truyền nhĩ thất và có thể gây ra block nhĩ thất hoàn toàn và mất đồng vận trong thất [90]. Do đó, chống chỉ định sử dụng các thuốc này ở bệnh nhân block nhĩ thất độ II. Các thuốc chống đau thắt ngực khác được ưa thích để kiểm soát triệu chứng đau thắt ngực (Hình 4).
Cường giáp
Cường giáp là rối loạn bệnh học trong đó tuyến giáp tổng hợp và bài tiết quá mức hormone tuyến giáp. Mối liên quan giữa cường giáp và bất thường tim mạch đã được biết rõ. Các bệnh nhân cường giáp tăng 3 lần nguy cơ rung nhĩ và suy tim [91]. Hormone tuyến giáp có thể ảnh hưởng trực tiếp các yếu tố quyết định tiêu thụ oxy của cơ tim, dẫn đến sự phát triển đau thắt ngực ổn định ở bệnh nhân bệnh động mạch vành hoặc thậm chí động mạch vành bình thường. Hormone tuyến giáp cũng có thể gây co thắt động mạch vành [92]. Điều trị ưa thích ở các bệnh nhân này là ức chế beta không chọn lọc (propanolol), diltiazem, verapamil, hoặc ivabradine nếu chống chỉ định ức chế beta. Các thuốc dãn mạch không nên được sử dụng do tăng nguy cơ nhịp tim nhanh phản xạ (Hình 4).
Đau thắt ngực do co thắt động mạch vành
Các thuốc ưa thích để phòng ngừa và/hoặc điều trị co thắt động mạch vành là ức chế canxi và nitrat tác dụng dài. Tất cả thuốc ức chế canxi có thể phòng ngừa co thắt ở 90% bệnh nhân. Nitrat tác dụng dài cũng hiệu quả, nhưng điều trị ngắt quãng cần thiết để ngăn ngừa sự dung nạp nitrat. Ức chế beta bị chống chỉ định vì có thể thúc đẩy co thắt bằng cách co mạch qua hoạt hóa thụ thể α. Ở các bệnh nhân đau thắt ngực kháng trị, liều cao ức chế canxi có thể được thử. Ở các bệnh nhân không đáp ứng với liều tối đa dung nạp được của ức chế canxi, cắt hạch giao cảm là một chọn lựa điều trị [93] (Hình 4).
Đau thắt ngực do vi mạch
Chứng cứ ủng hộ một nhóm thuốc chuyên biệt trong trường hợp đau thắt ngực do rối loạn chức năng vi mạch khôngsẵn có vìhạn chế kiến thức về các nguyên nhân của đau thắt ngực do rối loạn chức năng vi mạch và đáp ứng thay đổi đối với các thuốc khác nhau. Trong nhiều năm, các thuốc chống đau thắt ngực truyền thống như ức chế beta, ức chế canxi và nitrat được xem là lựa chọn duy nhất mặc dù 20-30% bệnh nhân vẫn còn triệu chứng. Ức chế beta có thể được ưa thích ở bệnh nhân tăng hoạt tính giao cảm [1]. Ranolazine đã được đề nghị để giảm chèn ép cơ học của tuần hoàn vi mạch vành [94,95]. Ngoài ra, ranolazine cũng có thể cải thiện sự tự điều hòa mạch vành [96]. Một thử nghiệm nhỏ với ranolazine cho thấy cải thiện triệu chứng đau thắt ngực ở phụ nữ với đau thắt ngực do vi mạch [97]. Sau đó, trong một nghiên cứu trao đổi chéo, mù đôi, có đối chứng giả dược được thực hiện ở phụ nữ đau thắt ngực nhưng không có tắc nghẽn động mạch vành, ranolazine không mang lại lợi ích đáng kể ở một số bệnh nhân suy giảm dự trữ lưu lượng động mạch vành [65]. Tương tự, ivabradine cải thiện lưu lượng tuần hoàn bàng hệ và dư trữ lưu lượng động mạch vành ở bệnh nhân đau thắt ngực do vi mạch [47,48]. Tác dụng này của ivabradine ưu thế hơn bisoprolol mặc dù mức độ giảm tần số tim tương tự [48]. Do đó, điều trị đau thắt ngực do vi mạch là mộtthử thách và cần có kinh nghiệm. Giảm tần số tim với ức chế beta, diltiazem, verapamil hoặc ivabradine có thể được xem xét vì tăng thời gian tâm trương và tưới máu mạch vành. Điều trị phối hợp với ranolazine hoặc trimetazidine cũng có thể hữu ích. Ở các bệnh nhân tăng cảm nhận đau, thuốc kháng adenosine và các thuốc hiệu quả trong hội chứng đau mạn tính imipramine (thuốc chống trầm cảm ba vòng) là các lựa chọn điều trị khác.
5. KẾT LUẬN
Điều trị thuốc cho các bệnh nhân đau thắt ngực ổn định mạn tính gặp nhiều thử thách, đặc biệt ở các bệnh nhân đau thắt ngực ổn định và động mạch vành bình thường, một tình trạng còn nhiều việc cần làm để xác định điều trị tối ưu. Vì tất cả các thuốc chống đau thắt ngực có hiệu quả và mức độ chứng cứ tương đương nhau, và không có lợi ích sống còn nên loại trừ đi quan điểm thuốc hàng thứ nhất hay hàng thứ hai. Hơn nữa, bệnh nhân bệnh tim thiếu máu cục bộ ổn định có một số bệnh đồng mắc và đau thắt ngực có thể do nhiều cơ chế sinh lý bệnh khác nhau. Ngoài tác dụng giảm đau ngực, một số thuốc có các đặc tính phụ có thể hữu ích, phụ thuộc vào bệnh đồng mắc và các cơ chế của đau thắt ngực ổn định. Theo các chuyên gia, đã đến lúc chúng ta cần đề xuất một cách tiếp cận mới khác biệt, cá thể hóa dành cho các bệnh nhândựa vàobệnh đồng mắc và cơ chế đau thắt ngực ổn định: tiếp cận “kim cương”. Cách tiếp cận này sẽ giúp các bác sĩ lâm sàng đưa ra những lựa chọn điều trị tốt nhất có thể cho bệnh nhân bất kể thuốc này đã từng được xếp hàng thứ nhất hay hàng thứ hai.
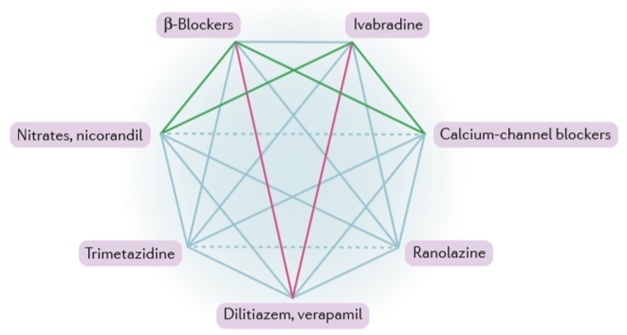
Hình 1. Phối hợp các thuốc chống đau thắt ngực (Chụp từ tài liệu gốc) [100].
Hình này cho thấy phối hợp hữu ích (đường màu xanh lá cây), phối hợp không được khuyến cáo (đường màu đỏ), phối hợp có thể hữu ích (đường liền nét màu xanh dương) và các thuốc với hoạt động tương tự (đường đứt nét màu xanh dương).
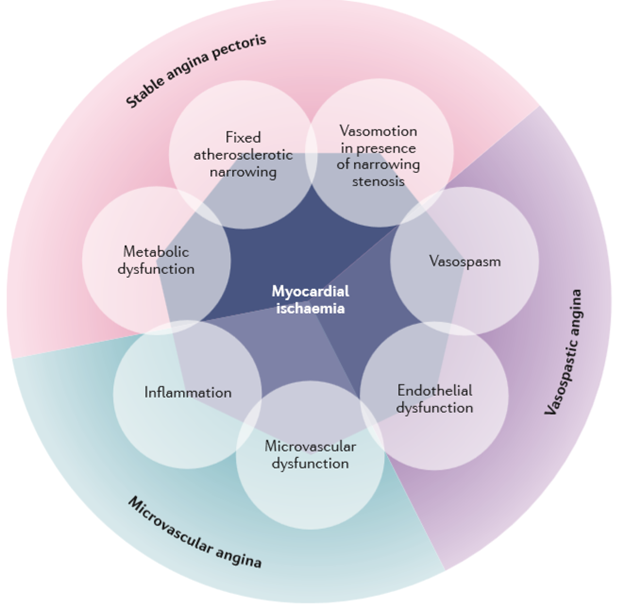
Hình 2. Cơ chế sinh lý bệnh của bệnh tim thiếu máu cục bộ ổn định mạn tính (Chụp từ tài liệu gốc) [100].
Stable angina pectoris: đau thắt ngực ổn định; Vasospatic angina : đau thắt ngực do co thắt động mạch vành; Microvascular angina: đau thắt ngực do vi mạch. Myocardial ischemia: thiếu máu cục bộ cơ tim; Fixed atherosclerotic narrowing: hẹp cố định do xơ vữa động mạch; Vasomotion in presence of narrowing stenosis: Vận mạch trong trường hợp hẹp mạch vành; Vasospam: co thắt mạch vành; Endothelial dysfunction: rối loạn chức năng nội mô; Microvascular dysfunction: rối loạn chức năng vi mạch; Inflammation: viêm; Metabolic dysfunction: rối loạn chức năng chuyển hóa.
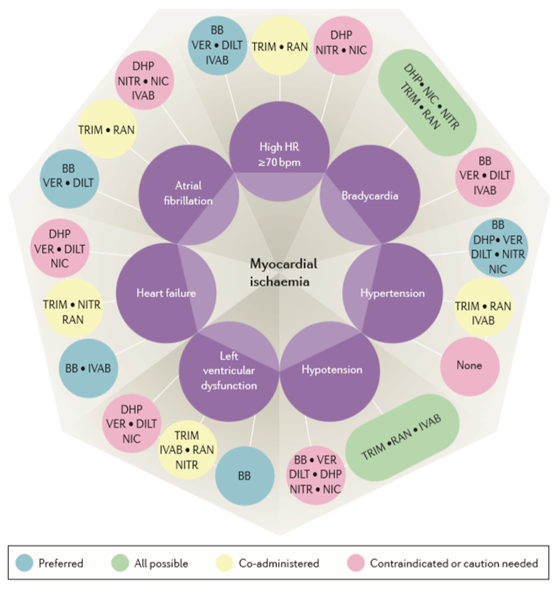
Hình 3. Phối hợp các thuốc chống đau thắt ngực dựa theo bệnh đồng mắc (Chụp từ tài liệu gốc) [100].
Preferred: ưa thích; All possible: có thể; Co-administered: điều trị phối hợp; Contraindicated or caution needed: chống chỉ định hoặc cần thận trọng. BB: ức chế beta; DHP: ức chế canxi dihydropyridine; DILT: diltiazem; IVAB: ivabradine; NIC: nicorandil; NITR: nitrat; Non Sel-BB: ức chế beta không chọn lọc; RAN: ranolazine; Sel-BB: ức chế chọn lọc β1; TRIM: trimetazidine; VER: verapamil. High HR: tần số tim cao; bradycardia: nhịp tim chậm; hypertension: tăng huyết áp; hypotension: tụt huyết áp; left ventricular dysfucntion: rối loạn chức năng thất trái; heart failure: suy tim; atrial fibrillation: rung nhĩ.
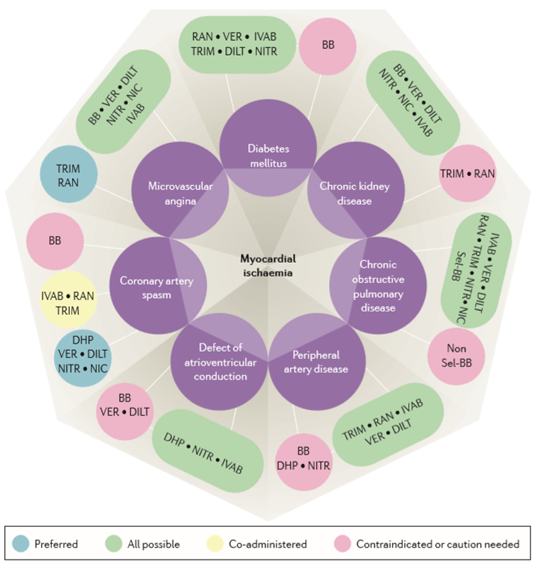
Hình 4. Phối hợp các thuốc chống đau thắt ngực dựa theo bệnh đồng mắc (Chụp từ tài liệu gốc) [100].
Preferred: ưa thích; All possible: có thể; Co-administered: điều trị phối hợp; Contraindicated or caution needed: chống chỉ định hoặc cần thận trọng. BB: ức chế beta; DHP: ức chế canxi dihydropyridine; DILT: diltiazem; IVAB: ivabradine; NIC: nicorandil; NITR: nitrat; Non Sel-BB: ức chế beta không chọn lọc; RAN: ranolazine; Sel-BB: ức chế chọn lọc β1; TRIM: trimetazidine; VER: verapamil. Diabetes mellitus: đái tháo đường; Chronic kidney disease: bệnh thận mạn; Chronic obstructive pulmonary disease: bệnh phổi tắc nghẽn mạn tính; Peripheral artery disease: bệnh động mạch ngoại biên; Defect of atrioventricular conduction: rối loạn dẫn truyền nhĩ thất; Coronary artery spasm: co thắt động mạch vành; Microvascular angina: đau thắt ngực do vi mạch.
TÀI LIỆU THAM KHẢO
1. Task Force Members etal. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur. Heart J. 34, 2949–3003 (2013).
2. Fihn,S.D. etal. 2012 ACCF/AHA/ACP/AATS/PCNA/ SCAI/STS guideline for the diagnosis and management of patients with stable ischemic heart disease: a report of the American College of Cardiology Foundation/ American Heart Association Task Force on Practice Guidelines, and the American College of Physicians, American Association for Thoracic Surgery, Preventive Cardiovascular Nurses Association, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J.Am. Coll. Cardiol. 60, e44–e164 (2012).
3. Mancini,G.B. etal. Canadian Cardiovascular Society guidelines for the diagnosis and management of stable ischemic heart disease. Can. J.Cardiol. 30, 837–849 (2014).
4. National Clinical Guidelines Centre. Stable angina: methods, evidence & guidance. NICE http:// www.nice.org.uk/guidance/cg126/evidence/ full-guideline-183176605 (2011).
5. Thadani,U. Management of stable angina — current guide lines: a critical appraisal. Cardiovasc. Drugs Ther. 30, 419–426 (2016).
6. Camm,A.J. etal. Unresolved issues in the management of chronic stable angina. Int. J.Cardiol. 201, 200–207 (2015).
7. Ambrosio,G. etal. Management of stable angina: acommentary on the European Society of Cardiology guidelines. Eur. J.Prev. Cardiol. 23, 1401–1412 (2016).
8. Manolis,A.J. etal. Medical treatment of stable angina: a tailored therapeutic approach. Int.J.Cardiol. 220, 445–453 (2016).
9. Marzilli,M. etal. Obstructive coronary atherosclerosis and ischemic heart disease: an elusive link! J.Am. Coll. Cardiol. 60, 951–956 (2012).
10. Crea,F., Camici,P.G. & Bairey Merz,C.N. Coronary microvascular dysfunction: an update. Eur. Heart J. 35, 1101–1111 (2014).
11. Stergiopoulos,K. etal. Percutaneous coronary intervention outcomes in patients with stable obstructive coronary artery disease and myocardial ischemia: a collaborative meta-analysis of contemporary randomized clinical trials. JAMA Intern. Med. 174, 232–240 (2014).
12. McGill,H.C.Jr etal. Association of coronary heart disease risk factors with microscopic qualities of coronary atherosclerosis in youth. Circulation 102, 374–379 (2000).
13. Vermeltfoort,I.A. etal. Definitions and incidence of cardiac syndromeX: review and analysis of clinical data. Clin. Res. Cardiol. 99, 475–481 (2010).
14. Paul,T.K., Sivanesan,K. & Schulman-Marcus,J. Sex differences in non obstructive coronary artery disease: recent insights and substantial knowledge gaps. Trends Cardiovasc. Med. 27, 173–179 (2016). 15. Marinescu,M.A. etal. Coronary microvascular dysfunction, microvascular angina, and treatment strategies. JACC Cardiovasc. Imaging 8, 210–220 (2015).
16. Lanza,G.A. & Crea,F. Primary coronary microvascular dysfunction: clinical presentation pathophysiology and management. Circulation 121, 2317–2325 (2010).
17. Sedlak,T., Izadnegahdar,M., Humphries,K.H. & Bairey Merz,C.N. Sex-specific factors in microvascular angina. Can. J.Cardiol. 30, 747–755 (2014).
18. Maseri,A. Coronary artery spasm and thrombosis. Cardiovascular Clinics, vol14 No.1. J.R.Soc. Med. 78, 178 (1985).
19. Chrysant,S.G. etal. Efficacy and safety of extendedrelease isosorbide mononitrate for stable effort angina pectoris. Am. J.Cardiol. 72, 1249–1256 (1993).
20. ORourke,S.T. Nitro vasodilators: pharmacology anduse in the treatment of myocardial ischemia. Am.J.Pharm. Educ. 66, 177–180 (2002).
21. Thadani,U. & Rodgers,T. Side effects of using nitrates to treat angina. Expert Opin. Drug Saf. 5, 667–674 (2006).
22. Heidenreich,P.A. etal. Meta-analysis of trials comparing beta-blockers, calcium antagonists, and nitrates for stable angina. JAMA 281, 1927–1936 (1999).
23. Belsey,J., Savelieva,I., Mugelli,A. & Camm,A.J. Relative efficacy of antianginal drugs used as add-on therapy in patients with stable angina: a systematic review and meta-analysis. Eur. J. Prev. Cardiol. 22, 837–848 (2015).
24. Salazar,C.A. etal. Ranolazine for stable angina pectoris. Cochrane Database Syst. Rev. 2, CD011747 (2017).
25. Thadani,U. & Opie,L.H. in Drugs for the Heart 4thedn (ed. Opie,L.H.) 31–48 (Saunders, 1995).
26. Daiber,A. & Münzel,T. Organic nitrate therapy, nitrate tolerance, and nitrate-induced endothelial dysfunction: emphasis on redox biology and oxidative stress. Antioxid. Redox Signal. 23, 899–942 (2015).
27. Husted,S.E. & Ohman,E.M. Pharmacological and emerging therapies in the treatment of chronic angina. Lancet 386, 691–701 (2015).
28. Thadani,U. etal. Comparison of the immediate effects of five beta adrenoreceptor-blocking drugs with different ancillary properties in angina pectoris. N.Engl. J.Med. 300, 750–755 (1979).
29. Tardif,J.C. etal. Efficacy of the If current inhibitor ivabradine in patients with chronic stable angina receiving beta-blocker therapy: a 4-month, randomized, placebo-controlled trial. Eur. Heart J. 30, 540–548 (2009).
30. Bangalore,S. etal. Clinical outcomes with betablockers for myocardial infarction: a meta-analysis of randomized trials. Am. J.Med. 127, 939–953 (2014).
31. Bangalore,S. etal. â-blocker use and clinical outcomes in stable outpatients with and without coronary artery disease. JAMA 308, 1340–1349 (2012).
32. Ferrari,R. Coronary artery disease in 2012: revising common beliefs in the management of stable CAD. Nat. Rev. Cardiol. 10, 65–66 (2013).
33. Ferrari,R. & Fox,K. Heart rate reduction in coronary artery disease and heart failure Nat. Rev. Cardiol. 13, 493–501 (2016).
34. Andersson,C. etal. â-blocker therapy and cardiac events among patients with newly diagnosed coronary heart disease. J.Am. Coll. Cardiol. 64, 247–252 (2014).
35. Booij,H.G. etal. â-blocker therapy is not associated with reductions in angina or cardiovascular events after coronary artery bypass graft surgery: insights from the IMAGINE trial. Cardiovasc. Drugs Ther. 29, 277–285 (2015).
36. Antman,E. etal. Nifedipine therapy for coronaryartery spasm: experience in 127 patients. N.Engl. J.Med. 302, 1269–1273 (1980).
37. The Multicenter Diltiazem Postinfarction Trial Research Group. The effect of diltiazem on mortality and reinfarction after myocardial infarction. N.Engl. J.Med. 319, 385–392 (1988).
38. Poole-Wilson,P.A. etal. Effect of long-acting nifedipine on mortality and cardiovascular morbidity in patients with stable angina requiring treatment (ACTION trial): randomised controlled trial. Lancet 364, 849–857 (2004).
39. Fox,K. etal. Ivabradine in stable coronary artery disease without clinical heart failure. N.Engl. J.Med. 371, 1091–1099 (2014).
40. Suryapranata,H. etal. Coronary vasodilatory action after a single dose of nicorandil. Am. J.Cardiol. 61, 292–297 (1988).
41. Gupta,A.K., Winchester,D. & Pepine,C.J. Antagonist molecules in the treatment of angina. Expert Opin. Pharmacother. 14, 2323–2342 (2013).
42. Camm,A.J. & Maltz,M.B. A controlled single-dose study of the efficacy, dose response and duration of action of nicorandil in angina pectoris. Am. J.Cardiol. 63, 61J–65J (1989). 43. Thadani,U. Can nicorandil treat angina pectoris effectively? Nat. Clin. Pract. Cardiovasc. Med. 2, 186–187 (2005).
44. The IONA Study Group. Effect of nicorandil on coronary events in patients with stable angina: the Impact Of Nicorandil in Angina (IONA) randomised trial. Lancet 359, 1269–1275 (2002). 45. Borer,J.S. & Heuzey,J.Y. Characterization of the heart rate-lowering action of ivabradine, a selective If current inhibitor. Am. J.Ther. 15, 461–473 (2008).
46. Simon,L. etal. Coronary and hemodynamic effects ofS16257, a new bradycardic agent, in resting and exercising conscious dogs. J.Pharmacol. Exp. Ther. 275, 659–666 (1995).
47. Gloekler,S. etal. The effect of heart rate reduction byivabradine on collateral function in patients with chronic stable coronary artery disease. Heart 100, 160–166 (2014).
48. Tagliamonte,E. etal. Ivabradine and bisoprolol on doppler-derived coronary flow velocity reserve in patients with stable coronary artery disease: beyond the heart rate. Adv. Ther. 32, 757–767 (2015).
49. Werdan,K. etal. Effectiveness of ivabradine treatment in different subpopulations with stable angina in clinical practice: a pooled analysis of observational studies. Cardiology 135, 141–150 (2016).
50. Swedberg,K. etal. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebocontrolled study. Lancet 376, 875–885 (2010).
51. Fox,K. etal. Bradycardia and atrial fibrillation in patients with stable coronary artery disease treated with ivabradine: an analysis from the SIGNIFY study. Eur. Heart J. 36, 3291–3296 (2015).
52. Tardif,J.C. etal. Efficacy of ivabradine, a new selective If inhibitor, compared with atenolol in patients with chronic stable angina. Eur. Heart J. 26, 2529–2536 (2005).
53. Ruzyllo,W., Tendera,M., Ford,I. & Fox,K.M. Antianginal efficacy and safety of ivabradine compared with amlodipine in patients with stable effort angina pectoris: a 3-month randomised, double-blind, multicentre, noninferiority trial. Drugs 67, 393–405 (2007).
54. Amosova,E. etal. Efficacy of ivabradine in combination with beta-blocker versus uptitration of beta-blocker in patients with stable angina. Cardiovasc. Drugs Ther. 25, 531–537 (2011).
55. European Medicines Agency: Pharmacovigilance Risk Assessment Committee (PRAC). Assessment report: ivabradine. EMA http://www.ema.europa.eu/docs/en_ GB/document_library/EPAR_-_Assessment_Report_-_ Variation/human/000597/WC500182140.pdf (2014).
56. Fox,K. etal. Ivabradine for patients with stable coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a randomised, double-blind, placebo-controlled trial. Lancet 372, 807–816 (2008).
57. Fox,K. etal. Heart rate as a prognostic risk factor inpatients with coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): asubgroup analysis of a randomised controlled trial. Lancet 372, 817–821 (2008).
58. Fox,K. etal. Relationship between ivabradine treatment and cardiovascular outcomes in patients with stable coronary artery disease and left ventricular systolic dysfunction with limiting angina: asubgroup analysis of the randomized, controlled BEAUTIFUL trial. Eur. Heart J. 30, 2337–2345 (2009).
59. Borer,J.S. etal. Efficacy profile of ivabradine in patients with heart failure plus angina pectoris. Cardiology 136, 138–144 (2016). 60. Rayner-Hartley,E. & Sedlak,T. Ranolazine: acontemporary review. J.Am. Heart Assoc. 5, e003196 (2016).
61. McCormack,J.G., Barr,R.L., Wolff,A.A. &Lopaschuk,G.D. Ranolazine stimulates glucose oxidation in normoxic, ischemic, and reperfused ischemic rat hearts. Circulation 93, 135–142 (1996).
62. Thadani,U., Ezekowitz,M., Fenney,L. & Chiang,Y.K. Double-blind efficacy and safety study of a novel antiischemic agent, ranolazine, versus placebo in patients with chronic stable angina pectoris. Circulation 90, 726–734 (1994).
63. Weisz,G. etal. Use of ranolazine in patients with incomplete revascularization after percutaneous coronary intervention: design and rationale of the Ranolazine for Incomplete Vessel Revascularization Post-Percutaneous Coronary Intervention (RIVER-PCI) trial. Am. Heart J. 166, 953.e3–959.e3 (2013).
64. Morrow,D.A. etal. Effects of ranolazine on recurrent cardiovascular events in patients with non-ST-elevation acute coronary syndromes: the MERLIN-TIMI36 randomized trial. JAMA 297, 1775–1783 (2007).
65. Bairey Merz,C.N. etal. A randomized, placebocontrolled trial of late Na current inhibition (ranolazine) in coronary microvascular dysfunction (CMD): impact on angina and myocardial perfusion reserve. Eur. Heart J. 37, 1504–1513 (2016).
66. Kantor,P.F., Lucien,A., Kozak,R. & Lopaschuk,G.D. The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial longchain 3-ketoacyl coenzymeA thiolase. Circ. Res. 86, 580–588 (2000).
67. Fragasso,G. etal. Effects of metabolic modulation bytrimetazidine on left ventricular function and phosphocreatine/adenosine triphosphate ratio in patients with heart failure. Eur. Heart J. 27, 942–948 (2006). 68. McClellan,K.J. & Plosker,G.L. Trimetazidine. A review of its use in stable angina pectoris and other coronary conditions. Drugs 58, 143–157 (1999).
69. Detry,J.M. etal. Trimetazidine: a new concept in the treatment of angina. Comparison with propranolol in patients with stable angina. Br. J.Clin. Pharmacol. 37, 279–288 (1994).
70. Peng,S. etal. The efficacy of trimetazidine on stable angina pectoris: a meta-analysis of randomized clinical trials. Int. J.Cardiol. 177, 780–785 (2014).
71. Xu,X. etal. Effect of trimetazidine on recurrent angina pectoris and left ventricular structure in elderly multivessel coronary heart disease patients with diabetes mellitus after drug-eluting stent implantation: a single-centre, prospective, randomized, double-blind study at 2-year follow-up. Clin. Drug Investig. 34, 251–258 (2014).
72. Vidal-Petiot,E. etal. Cardiovascular event rates and mortality according to achieved systolic and diastolic blood pressure in patients with stable coronary artery disease: an international cohort study. Lancet 388, 2142–2152 (2016).
73. Tsika,E.P., Poolimenos,L.E., Boudoulas,K.A. &Manolis,A.I. The Jcurve in arterial hypertension: fact or fallacy? Cardiology 129, 126–135 (2014).
74. Ponikowski,P. etal. 2016 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure: the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) ofthe ESC. Eur. J.Heart Fail. 18, 891–975 (2016). 75. Gao,D., Ning,N., Niu,X., Hao,G. & Meng,Z. Trimetazidine: a meta-analysis of randomised controlled trials in heart failure. Heart 97, 278–286 (2011).
76. Martin,R.I. etal. Atrial fibrillation associated with ivabradine treatment: meta-analysis of randomised controlled trials. Heart 100, 1506–1510 (2014).
77. Scirica,B.M. etal. Effect of ranolazine, an antianginal agent with novel electrophysiological properties, on the incidence of arrhythmias in patients with non ST-segment elevation acute coronary syndrome: results from the Metabolic Efficiency with Ranolazine for Less Ischemia in NonST-Elevation Acute Coronary Syndrome Thrombolysis in Myocardial Infarction36 (MERLIN-TIMI36) randomized controlled trial. Circulation 116, 1647–1652 (2007).
78. Reiffel,J.A. etal. The HARMONY trial: combined ranolazine and dronedarone in the management ofparoxysmal atrial fibrillation: mechanistic and therapeutic synergism. Circ. Arrhythm. Electrophysiol. 8, 1048–1056 (2015).
79. Danchin,N., Marzilli,M., Parkhomenko,A. &Ribeiro,J.P. Efficacy comparison of trimetazidine with therapeutic alternatives in stable angina pectoris: a network meta-analysis. Cardiology 120, 59–72 (2011).
80. Timmis,A.D., Chaitman,B.R. & Crager,M. Effects of ranolazine on exercise tolerance and HbA1c in patients with chronic angina and diabetes. Eur.Heart J. 27, 42–48 (2006).
81. Kosiborod,M. etal. Evaluation of ranolazine in patients with type2 diabetes mellitus and chronic stable angina: results from the TERISA randomized clinical trial (type2 diabetes evaluation of ranolazine in subjects with chronic stable angina). J. Am. Coll. Cardiol. 61, 2038–2045 (2013).
82. Elliott,W.J. & Meyer,P.M. Incident diabetes in clinical trials of antihypertensive drugs: a network meta-analysis. Lancet 369, 201–207 (2007).
83. Jerling,M. Clinical pharmacokinetics of ranolazine. Clin. Pharmacokinet. 45, 469–491 (2006).
84. Schnell,K. etal. The prevalence of clinically relevant comorbid conditions in patients with physiciandiagnosed COPD: a cross-sectional study using data from NHANES 1999–2008. BMC Pulm. Med. 12, 26 (2012).
85. Rutten,F.H. etal. Beta-blockers may reduce mortality and risk of exacerbations in patients with chronic obstructive pulmonary disease. Arch. Intern. Med. 170, 880–887 (2010).
86. Hiatt,W.R., Stoll,S. & Nies,A.S. Effect of betaadrenergic blockers on the peripheral circulation in patients with peripheral vascular disease. Circulation 72, 1226–1231 (1985).
87. George,C.F. Beta-receptor blocking agents. Prescribers J. 14, 93–98 (1974).
88. Joint Formulary Committee. British National Formulary Vol.65 (Pharmaceutical Press, 2013).
89. Paravastu,S.C., Mendonca,D.A. & Da Silva,A. Betablockers for peripheral arterial disease. CochraneDatabase Syst. Rev. 9, CD005508 (2013).
90. Miller,J.M. & Zipes,D.P. in Heart Disease. ATextbook of Cardiovascular Medicine 6thedn (edsBraunwald,E., Zipes,D.P. & Libby,P.) 711–739 (Saunders, 2001).
91. De Leo,S., Lee,S.Y. & Braverman,L.E. Hyperthyroidism. Lancet 388, 906–918 (2016).
92. Masini,N.D., Northridge,D.B. & Hall,R.J.C. Severe coronary vasospasm associated with hyperthyroidism causing myocardial infarction. Br. Heart J. 74, 700–701 (1995).
93. Abbate,A. Sympathectomy as a treatment for refractory coronary artery spasm. Int. J.Cardiol. 161, e7–e9 (2012). 94. Cattaneo,M., Poretta,A.P. & Gallino,A. Ranolazine: drug overview and possible role in primary microvascular angina management. Int. J.Cardiol. 181, 376–381 (2015).
95. Venkataraman,R., Belardinelli,L., Blackburn,B., Heo,J. & Iskandrian,A.E. A study of the effects of ranolazine using automated quantitative analysis of serial myocardial perfusion images. JACC Cardiovasc. Imaging 2, 1301–1309 (2009).
96. Tagliamonte,E. etal. Effects of ranolazine on noninvasive coronary flow reserve in patients with myocardial ischemia but without obstructive coronary artery disease. Echocardiography 32, 516–521 (2015).
97. Mehta,P.K. etal. Ranolazine improves angina in women with evidence of myocardial ischemia but no obstructive coronary artery disease. JACC Cardiovasc. Imaging 4, 514–522 (2011).
98. Maddox,T.M. etal. Angina at 1year after myocardial infarction: prevalence and associated findings. Arch. Intern. Med. 168, 1310–1316 (2008).
99. National Institutes of Health/National Heart, Lung, and Blood Institute. Morbidity & Mortality: 2012 Chart Book on Cardiovascular, Lung, Blood Diseases.National Heart, Lung and Blood Institute https://www.nhlbi.nih.gov/files/docs/research/ 2012_ChartBook_508.pdf (2012).
100. Ferrari R, et al. Expert consensus document: A ‘diamond’ approach to personalized treatment of angina. Nature Reviews Cardiology. 15,120–132 (2018).







