ThS. BS TRẦN CÔNG DUY
TS. BS HOÀNG VĂN SỸ
Khoa Nội Tim Mạch, Bệnh viện Chợ Rẫy
Bộ môn Nội, Đại học Y Dược TP. Hồ Chí Minh
1. ĐẠI CƯƠNG
Suy tim là một tình trạng lâm sàng có liên quan với sự suy giảm khả năng biến đổi các cơ chất chuyển hóa thành cơ chất năng lượng cao [1,5,25,27,37]. Nhiều chứng cứ cho thấy rằng suy tim và hầu hết các yếu tố nguy cơ như đái tháo đường, tăng huyết áp và bệnh động mạch vành có tình trạng gia tăng oxy hóa axit béo và giảm oxy hóa glucose ở cơ tim [28,29,31]. Những thay đổi chuyển hóa trong suy tim gây ra tình trạng giảm nồng độ adenosine triphosphate (ATP) ở tim và giảm đáng kể phosphocreatine, nguồn dự trữ phosphate năng lượng cao chính của tim.
Điều hòa chuyển hóa của tim rõ ràng là một công cụ quan trọng để điều trị các bệnh nhân suy tim và/hoặc các tình trạng tăng nguy cơ suy tim như bệnh tim thiếu máu cục bộ và đái tháo đường. Không như các thuốc ảnh hưởng huyết động, trimetazidine tác động trực tiếp ở mức tế bào cơ tim bằng cách tăng sử dụng phosphate năng lượng cao, từ đó cải thiện tính co bóp và giảm đau thắt ngực. Bài viết tổng quan này sẽ xem xét những lợi ích của trimetazidine ở bệnh nhân suy tim từ cơ chế bệnh sinh đến y học chứng cứ để hiểu rõ hơn về vai trò của một thuốc tác động chuyển hóa và áp dụng trong thực hành lâm sàng hàng ngày.
2. NHỮNG THAY ĐỔI CHUYỂN HÓA TRONG SUY TIM
Sự sử dụng axit béo tự do tại cơ tim trong suy tim là hậu quả của quá trình kém thích nghi dẫn đến rối loạn sản xuất phosphate năng lượng cao [31]. Quá trình kém thích nghi này rõ ràng hơn ở bệnh nhân đái tháo đường. Các nghiên cứu chỉ ra rằng mặc dù nồng độ glucose huyết tương cao nhưng những bệnh nhân này sử dụng axit béo nhiều hơn ở tế bào cơ tim và có mối liên quan trực tiếp giữa mức độ đề kháng insulin với rối loạn chức năng thất trái [21,39]. Những thay đổi này có liên quan với tăng sử dụng oxy và giảm sản xuất năng lượng và hiệu suất chuyển hóa [30]. Các nghiên cứu nhận thấy bệnh nhân suy tim sung huyết tăng sử dụng 50% axit béo đi kèm với giảm thu nhận 60% glucose so với các đối tượng không suy tim [28]. Sự oxy hóa glucose cần ít hơn tỉ số oxy trên phân tử adenosine triphosphate (ATP) được sản xuất so với quá trình oxy hóa axit béo; do đó, sử dụng axit béo ít hiệu quả về mặt chuyển hóa so với sử dụng glucose và dẫn đến giảm sản xuất ATP, ít phosphate năng lượng cao cho chuyển hóa tế bào và co bóp cơ tim. Do đó, oxy hóa glucose được ưa thích hơn axit béo khi thiếu oxy như giảm tưới máu mô cơ tim. Những thay đổi chuyển hóa xảy ra trong suy tim dẫn đến giảm 30% đến 40% nồng độ ATP tim và giảm đáng kể phân tử dự trữ năng lượng chính, phosphocreatinine [5,25,27,37]. ATP cần thiết cho hầu hết các quá trình chuyển hóa của tế bào; lượng ATP trong tế bào cơ tim giảm dẫn đến giảm hoạt động của canxi lưới cơ tương/bào tương-ATPase (SERCA) và rối loạn thư giãn chủ động vào đầu thì tâm trương. Điều đó cũng gây ra thiếu ATP cho chu kỳ bắc cầu actin-myosin, dẫn đến rối loạn chức năng tâm trương thất trái. Ảnh hưởng của oxy hóa glucose trên chức năng thất trái được chứng minh ở mô hình động vật sau khi thắt động mạch vành, chức năng thất trái hồi phục tốt hơn nếu glucose được sử dụng thay vì axit béo [18]. Do đó, điều hòa chuyển hóa của tim là một liệu pháp hữu ích để điều trị các bệnh nhân suy tim và/hoặc các tình trạng tăng nguy cơ suy tim như bệnh tim thiếu máu cục bộ và đái tháo đường.
3. TIẾP CẬN ĐIỀU TRỊ CHUYỂN HÓA NĂNG LƯỢNG TẠI CƠ TIM
Một số thuốc có ảnh hưởng đến các quá trình chuyển hóa trong suy tim, tác dụng ở các mức độ khác nhau của việc sử dụng glucose hoặc axit béo. Các thuốc này bao gồm etomoxir, perhexiline, ranolazine, pyruvate, dichloroacetate, và trimetazidine [12]. Trong các thuốc này, trimetazidine là thuốc duy nhất được phát hiện cải thiện chuyển hóa ở tim, không ảnh hưởng đến tần số tim, huyết áp và có những lợi ích lâm sàng đáng kể trong bệnh tim thiếu máu cục bộ và suy tim. Trimetazidine được chấp thuận sử dụng trong thực hành lâm sàng ở hơn 100 quốc gia trên khắp thế giới [5]. Tất cả các thuốc còn lại có ứng dụng lâm sàng hạn chế hoặc những vấn đề về tính an toàn làm hạn chế việc sử dụng thuốc. Ranolazine được chấp thuận điều trị đau thắt ngực nhưng không hiệu quả trong suy tim.
Một số nghiên cứu cho thấy rằng trimetazidine làm tăng sự sản xuất ATP tại tim và tác dụng này có liên quan ý nghĩa với cải thiện lâm sàng và bảo vệ tim [14, 38]. Fragasso và cs chỉ ra tỉ số phosphocreatine/ATP, một chỉ số sản xuất năng lượng tại tim, thấp hơn ở các bệnh nhân bệnh động mạch vành và bệnh nhân suy tim so với đối tượng bình thường. Ở những bệnh nhân này, điều trị trimetazidine tăng sản xuất 33% phosphate năng lượng cao, đưa đến nồng độ tương tự như những người bình thường [14] (Hình 1).
Brottier và cs lần đầu tiên đánh giá ảnh hưởng của điều trị dài hạn trimetazidine trên nền điều trị chuẩn ở các bệnh nhân bệnh cơ tim thiếu máu cục bộ tiến triển (phân độ NYHA [New York Heart Association] III-IV) và phát hiện rằng tình trạng lâm sàng và chức năng thất trái cải thiện so với bệnh nhân dùng giả dược [2].
Rosano G.M.C và cs là nhóm tác giả đầu tiên cung cấp chứng cứ rằng điều hòa chuyển hóa của tim bị suy giảm chức năng bằng cách sử dụng trimetazidine mang lại những lợi ích lâm sàng trên chức năng tim và biến cố lâm sàng [34]. Nhóm tác giả đã kết luận rằng trimetazidine hiệu quả trong cải thiện chức năng tâm thu và tâm trương thất trái ở bệnh nhân đái tháo đường kèm suy tim, bệnh nhân suy tim do bệnh tim thiếu máu cục bộ và bệnh nhân cao tuổi rối loạn chức năng thất trái (Hình 2) [34,40]. Những phát hiện ban đầu này được khẳng định bởi các nghiên cứu tiếp theo mở rộng chứng cứ cho các bệnh nhân suy tim không do thiếu máu cục bộ và sau tái thông mạch vành [6,7,13,17,24,35,36].
Các bệnh nhân suy tim phân suất tống máu thất trái giảm có diễn tiến tự nhiên suy giảm tiến triển chức năng thất trái mặc dù được điều trị nội khoa tối ưu. Chức năng thất trái có thể được cải thiện bằng các biện pháp can thiệp làm tăng trực tiếp co bóp cơ tim hoặc giảm sự tiêu thụ oxy. Các thuốc tăng co bóp cơ tim sẽ làm tăng tiêu thụ oxy và về dài hạn sẽ cạn kiệt nguồn dự trữ phosphate năng lượng cao, dẫn đến giảm chức năng của SERCA và tích lũy Ca2+, gây ra tăng nguy cơ rối loạn nhịp tim. Đây là lý do tại sao tất cả các thuốc này làm tăng nguy cơ tử vong (chủ yếu do rối loạn nhịp tim) ở bệnh nhân suy tim. Mặt khác, các thuốc giảm tiêu thụ oxy thông qua các cơ chế khác nhau (giảm tần số tim, giảm tiền tải hoặc hậu tải) như ức chế men chuyển, ức chế beta, kháng thụ thể mineralocorticoid, ivabradine, và sacubitril/valsartan (LCZ696) cải thiện co bóp cơ tim và kết cục dài hạn [4,26].
Trimetazidine cải thiện chức năng thất trái khi sử dụng dài hạn (Bảng 1). Không như tiếp cận truyền thống, trimetazidine tác động trực tiếp ở mức tế bào cơ tim và bằng cách tăng phosphate năng lượng cao, thuốc này cải thiện co bóp cơ tim và giảm đau thắt ngực. Tăng ATP cũng dẫn đến cải thiện chức năng tâm trương và giảm nồng độ Ca2+ tự do ở lưới cơ tương trong thì tâm trương, do đó giảm nguy cơ rối loạn nhịp tim. Giảm xuất hiện rối loạn nhịp tim ở bệnh nhân sử dụng trimetazidine được chứng minh ở những bệnh nhân suy tim do và không do thiếu máu cục bộ [4, 26]. Sự cải thiện chức năng thất trái trong các nghiên cứu đã được đánh giá trong một phân tích gộp của Gao và cs kết luận rằng trimetazidine cải thiện phân suất tống máu thất trái ở bệnh nhân suy tim do thiếu máu cục bộ và không do thiếu máu cục bộ (sự khác biệt trung bình so với giả dược lần lượt là 7,4% và 8,7%) [19]. Những lợi ích này tương tự như ức chế men chuyển.
Tác dụng có lợi của ức chế oxy hóa axit béo tự do với trimetazidine không chỉ giới hạn ở tim mà còn có tác dụng ở cơ xương, tăng sức cơ và giảm mất khối cơ [10,11]. Nhìn chung, tác dụng trung tâm và ngoại biên của trimetazidine dẫn đến cải thiện khả năng gắng sức, phân độ NYHA và chất lượng cuộc sống (Hình 3) [3].
Trimetazidine cải thiện tiên lượng ở bệnh nhân suy tim phân suất tống máu thất trái giảm theo một nghiên cứu đa trung tâm của Fragasso [16]. Trong nghiên cứu quốc tế, đoàn hệ, đa trung tâm này, trimetazidine giảm 30% tử vong chung và tử vong do tim mạch; giảm 10,4% nhập viện vì suy tim trong 5 năm với cải thiện sống còn không nhập viện 7,8 tháng trong 5 năm. Các nghiên cứu tiếp theo cho các kết quả tương tự và các phân tích gộp gần đây đã khẳng định tác dụng của trimetazidine đối với tử vong và bệnh tật. Bốn phân tích gộp đã đánh giá ảnh hưởng của trimetazidine lên chức năng thất trái, khả năng hoạt động và các kết cục lâm sàng ở bệnh nhân suy tim (Bảng 2). Tất cả phân tích gộp này kết luận rằng trimetazidine cải thiện phân độ NYHA, khả năng gắng sức, phân suất tống máu thất trái và giảm nhập viện do suy tim [19, 20, 41,42]. Hai trong bốn phân tích gộp cũng cho thấy tác dụng có lợi của trimetazidine trên tử vong do mọi nguyên nhân.
Chứng cứ về vai trò của trimetazidine ở bệnh nhân suy tim đã được xác nhận bởi hướng dẫn thực hành lâm sàng năm 2016 của Hội Tim Châu Âu. Ở bệnh nhân suy tim phân suất tống thất trái giảm có triệu chứng (NYHA II – IV) do đau thắt ngực ổn định, trimetazidine được khuyến cáo điều trị nếu còn đau thắt ngực mặc dù đã điều trị với ức chế beta (mức độ khuyến cáo: IIb, mức độ chứng cứ: A). Hướng dẫn của Hội Tim Châu Âu khẳng định điều trị trimetazidine hiệu quả và an toàn ở bệnh nhân suy tim [32]. Hơn nữa, trong quá trình đánh giá lợi ích/nguy cơ của trimetazidine, Cơ Quan Dược Phẩm Châu Âu thừa nhận tác dụng có lợi của trimetazidine ở bệnh nhân suy tim do bệnh tim thiếu máu cục bộ [9].
4. KẾT LUẬN
Các tác dụng của trimetazidine trên các thông số chức năng và kết cục lâm sàng trong suy tim có liên quan với tính an toàn tốt. Vì không ảnh hưởng tần số tim hoặc huyết áp, trimetazidine có thể được bổ sung an toàn và hiệu quả vào các thuốc tim mạch khác trong suy tim. Sự điều hòa chuyển hóa ở tim với trimetazidine nên luôn luôn được xem xét trong điều trị bệnh nhân suy tim khi có chỉ định. Chứng cứ của trimetazidine trong suy tim ủng hộ vai trò đã được xác nhận của thuốc này trong bệnh tim thiếu máu cục bộ, trong đó thuốc có thể được sử dụng trong chuỗi bệnh lý từ đau thắt ngực đến suy tim. Hiệu quả của trimetazidine ở bệnh nhân đái tháo đường và bệnh tim mạch cho thấy thuốc nên được sử dụng sớm khi phát hiện sự thay đổi chức năng tim. Tác dụng của thuốc này ở người cao tuổi được chứng minh tốt và có liên quan với sự cải thiện chất lượng cuộc sống. Do đó, trimetazidine là một lựa chọn điều trị quan trọng đối với bệnh nhân suy tim với lợi ích đáng kể trên chất lượng cuộc sống và tuổi thọ của bệnh nhân.
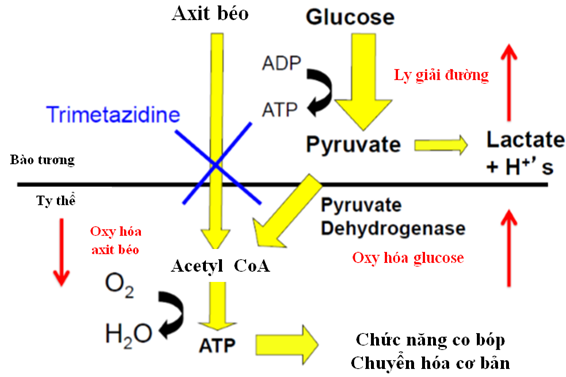
Hình 1. Cơ chế tác dụng của trimetazidine ở bệnh nhân suy tim [22].
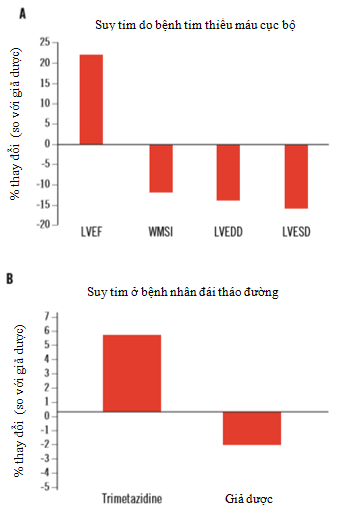
Hình 2. Ảnh hưởng của trimetazidine đối với chức năng thất trái ở bệnh nhân suy tim.(A) Phần trăm thay đổi chức năng thất trái (các chỉ số khác nhau) ở bệnh nhân suy tim do bệnh tim thiếu máu cục bộ được điều trị trimetazidine (so với giả dược). P < 0,05 đối với tất cả so sánh [40]. (B) Phần trăm thay đổi (so với ban đầu) phân suất tống máu thất trái ở bệnh nhân đái tháo đường kèm suy tim được điều trị trimetazidine. P < 0,01 so với giả dược [34]. Từ viết tắt: LVEDD (left ventricular end-diastolic diameter): đường kính thất trái cuối tâm trương; LVEF (left ventricular ejection fraction): phân suất tống máu thất trái; LVESD (left ventricular end-systolic diameter): đường kính thất trái cuối tâm thu; WMSI (wall motion score index): chỉ số điểm vận động vùng.
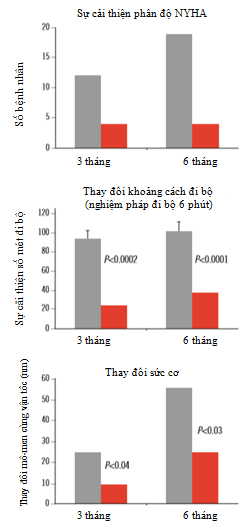
Hình 3. Ảnh hưởng của trimetazidine đối với khả năng gắng sức và sức cơ ở bệnh nhân suy tim phân suất tống máu thất trái giảm [3].Cột màu xám: điều trị trimetazidine; cột màu đỏ: giả dược.
Bảng 1. Các thử nghiệm lâm sàng về trimetazidine ở bệnh nhân suy tim phân suất tống máu thất trái giảm
|
Thử nghiệm |
Thiết kế nghiên cứu |
Theo dõi |
Sự cải thiện EF |
Các kết cục khác |
|
Brottier và cs [2] |
Nghiên cứu mù đôi có đối chứng với giả dược |
6 tháng |
9,3% |
Cải thiện khó thở |
|
Fragasso và cs [15] |
Nghiên cứu mù đôi có đối chứng với giả dược, trao đổi chéo |
a)15ngày b) 6tháng |
a) 5,9% b) 8,5%(P < 0,001) |
Cải thiện đường kính và thể tích thất trái cuối tâm thu và cuối tâm trương |
|
Rosano và cs [34] |
Nghiên cứu mù đôi có đối chứng với giả dược |
6 tháng |
5,4% |
Cải thiện đường kính thất trái cuối tâm trương, chỉ số điểm vận động vùng và tỉ số sóng E/A |
|
Vitale và cs [40] |
Nghiên cứu mù đôi có đối chứng với giả dược |
6 tháng |
7,4% |
Cải thiện đường kính thất trái cuối tâm thu và cuối tâm trương, chỉ số điểm vận động vùng, phân độ NYHA và chất lượng cuộc sống |
|
DiNapol và cs [8] |
Nghiên cứu mở, so sánh với điều trị thường quy đơn thuần |
a) 6 tháng b) 12tháng |
a) 2 % b) 10%(P < 0,001) |
Cải thiện phân độ NYHA, thể tích thất trái cuối tâm thu và cuối tâm trương
|
|
Fragasso và cs [17] |
Nghiên cứu mù đôi có đối chứng với giả dược, trao đổi chéo |
3 tháng |
5% (P=0,003) |
Cải thiện tỉ số phosphocreatinine/ATP ở tim, phân độ NYHA và hệ thống tương đương chuyển hóa |
|
Fragasso và cs [13] |
Nghiên cứu mở, so sánh với điều trị thường quy đơn thuần |
13 ± 3 tháng |
7% |
Cải thiện phân độ NYHA và thể tích thất trái cuối tâm thu
|
|
Sisakian và cs [35] |
Nghiên cứu mở, so sánh với điều trị thường quy đơn thuần |
3 tháng |
3,5 % |
Cải thiện sự dung nạp với hoạt động thể lực trong nghiệm pháp đi bộ 6 phút |
Bảng 2. Các phân tích gộp đánh giá tác dụng của trimetazidine ở bệnh nhân suy tim
|
Tác giả |
Số TNLS / Số bệnh nhân |
Tiêu chuẩn đánh giá |
Kết quả |
|
Gao và cs [19] |
17/955 |
Khả năng hoạt động |
Phân độ NYHA -0,41 (P<0,01) Thời gian gắng sức +30,26 giây (P<0,006) |
|
Các thông số siêu âm tim |
LVEF +7,37% trong suy tim do BTTMCB (P<0,01); LVEF+8,72% trong suy tim không do BTTMCB (P<0,01); LVESV-10,37ml(P<0,00001) LVEDV -4,70 ml (P=0,15) |
||
|
Tử vong do mọi nguyên nhân |
RR = 0,29;KTC 95%: 0,17 – 0,49(P<0,00001) |
||
|
Biến cố tim mạch và nhập viện |
RR = 0,42; KTC 95%: 0,30 – 0,58(P<0,00001) |
||
|
Zhang và cs [41] |
16/884 |
Khả năng hoạt động |
Phân độ NYHA: -0,57 (P<0,0003) Thời gian gắng sức: +63,75 giây (P<0,00001) |
|
Các thông số siêu âm tim |
LVEF +6,46% (P<0,00001); |
||
|
Peptide bài natri niệu |
BNP -203,40 pg/ml (P<0,0002) |
||
|
Tử vong do mọi nguyên nhân |
RR = 0,47; KTC 95%: 0,12 – 1,78 (P=0,27) |
||
|
Nhập viện do nguyên nhân tim mạch |
RR = 0,43; KTC 95%: 0,21 – 0,91 (P=0,03) |
||
|
Zhou, Chen [42] |
19/994 |
Khả năng hoạt động |
Phân độ NYHA -0.55 (P<0,001) Thời gian gắng sức +18,58 giây (P=0,153) |
|
Các thông số siêu âm tim |
LVEF +7.3% (P<0,001) |
||
|
Peptide bài natri niệu |
BNP -157.1 pg/ml (P<0,001) |
||
|
Tử vong do mọi nguyên nhân |
RR = 0,47; KTC 95%: 0,12 – 1,78 (P=0,27) |
||
|
Nhập viện do nguyên nhân tim mạch |
RR = 0,43; KTC 95%: 0,21 – 0,91 (P=0,03) |
||
|
Grajek, Michalak [20] |
3/326 |
Tử vong do mọi nguyên nhân |
RR=0,28;KTC 95%: 0,16 – 0,49(P<0,0001) |
Từ viết tắt: TNLS: thử nghiệm lâm sàng; LVEF ( leftventricularejectionfraction): phân suất tống máu thất trái;LVEDV (leftventricularend-diastolicvolume): thể tích thất trái cuối tâm trương;LVESV (leftventricular end-systolicvolume): thể tích thất trái cuối tâm thu;LVEDD (leftventricularend-diastolicdiameter): đường kính thất trái cuối tâm trương;LVESD (leftventricularend-systolic diameter): đường kính thất trái cuối tâm thu;RR (riskratio): tỉ số nguy cơ.
TÀI LIỆU THAM KHẢO
1. Beer M, Seyfarth T, Sandstede J, Landschutz W, Lipke C, Kostler H. Absolute concentrations of high-energy phosphate metabolites in normal, hypertrophied, and failing human myocardium measured noninvasively with 31P-SLOOP magnetic resonance spectroscopy. J Am Coll Cardiol. 2002;40:1267- 1274.
2. Brottier L, Barat JL, Combe C, Boussens B, Bonnet J, Bricaud H. Therapeutic value of a cardioprotective agent in patients with severe ischaemic cardiomyopathy. Eur Heart J. 1990;11:207-212.
3. Caminiti G, Marazzi G, Iellamo F, Volterrani M, Rosano GMC. Effect of trimetazidine on exercise capacity and muscle strength in patients with HFrEF. Eur J Heart Fail. 2016;18(suppl S1):78. Abstract P335.
4. Cera M, Salerno A, Fragasso G, et al. Beneficial electrophysiological effects of trimetazidine in patients with postischemic chronic heart failure. J Cardiovasc Pharmacol Ther. 2010;15(1):24-30.
5. Conway MA, Allis J, Ouwerkerk R, Niioka T, Rajagopalan B, Radda GK. Detection of low phosphocreatine to ATP ratio in failing hypertrophied human myocardium by 31P magnetic resonance spectroscopy. Lancet. 1991;338:973-976.
6. Di Napoli P, Di Giovanni P, Gaeta MA, DApolito G, Barsotti A. Beneficial effects of trimetazidine treatment on exercise tolerance and B-type natriuretic peptide and troponin T plasma levels in patients with stable ischemic cardiomyopathy. Am Heart J. 2007;154(3):602.e1-e5.
7. Di Napoli P, Di Giovanni P, Gaeta MA, Taccardi AA, Barsotti A. Trimetazidine and reduction in mortality and hospitalization in patients with ischemic dilated cardiomyopathy: a post hoc analysis of the Villa Pini dAbruzzo Trimetazidine Trial. J Cardiovasc Pharmacol. 2007;50(5):585-589.
8. Di Napoli P, Taccardi AA, Barsotti A. Long term cardioprotective action of trimetazidine and potential effect on the inflammatory process in patients with ischaemic dilated cardiomyopathy. Heart. 2005; 91:161-165.
9. European Medicines Agency. Assessment report for trimetazidine containing medicinal products. Available at: http://www. ema.europa.eu/docs/en_GB/document_library/Referrals_document/Trimetazdine_31/WC500133925.pdf. Published September 3, 2012. Accessed August 2017.
10. Ferraro E, Giammarioli AM, Caldarola S, et al. The metabolic modulator trimetazidine triggers autophagy and counteracts stress-induced atrophy in skeletal muscle myotubes. FEBS J. 2013;280(20):5094-5108.
11. Ferraro E, Pin F, Gorini S, et al. Improvement of skeletal muscle performance in ageing by the metabolic modulator Trimetazidine. J Cachexia Sarcopenia Muscle. 2016;7(4):449-457.
12. Fillmore N, Mori J, Lopaschuk GD. Mitochondrial fatty acid oxidation alterations in heart failure, ischaemic heart disease and diabetic cardiomyopathy. Br J Pharmacology. 2014;171:2080- 2090.
13. Fragasso G, Palloshi A, Puccetti P, et al. A randomized clinical trial of trimetazidine, a partial free fatty acid oxidation inhibitor, in patients with heart failure. J Am Coll Cardiol. 2006;48(5):992-998.
14. Fragasso G, Perseghin G, De Cobelli F, et al. Effects of metabolic modulation by trimetazidine on left ventricular function and phosphocreatine/adenosine triphosphate ratio in patients with heart failure. Eur Heart J. 2006;27:942-948.
15. Fragasso G, Piatti PM, Monti L, et al. Short- and long-term beneficial effects of partial free fatty acid inhibition in diabetic patients with ischemic dilated cardiomyopathy. Am Heart J. 2003;146:1-8.
16. Fragasso G, Rosano G, Baek SH, et al. Effect of partial fatty acid oxidation inhibition with trimetazidine on mortality and morbidity in heart failure: results from an international multicentre retrospective cohort study. Int J Cardiol. 2013;163(3):320- 325.
17. Fragasso G, Salerno A, Lattuada G, et al. Effect of partial inhibition of fatty acid oxidation by trimetazidine on whole body energy metabolism in patients with chronic heart failure. Heart. 2011;97(18):1495-1500.
18. Gambert S, Vergely C, Filomenko R, et al. Adverse effects of free fatty acid associated with increased oxidative stress in postischemic isolated rat hearts. Mol Cell Biochem. 2006;283(1-2):147-152.
19. Gao D, Ning N, Niu X, Hao G, Meng Z. Trimetazidine: a metaanalysis of randomised controlled trials in heart failure. Heart. 2011;97(4):278-286.
20. Grajek S, Michalak M. The effect of trimetazidine added to pharmacological treatment on all-cause mortality in patients with systolic heart failure. Cardiology. 2015;131:22-29.
21. Herrero P, Peterson LR, McGill JB, et al. Increased myocardial fatty acid metabolism in patients with type 1 diabetes mellitus. J Am Coll Cardiol. 2006;47(3):598-604.
22. Lopatin YM, Rosano GMC, Fragasso G, et al. Rationale and bene?ts of trimetazidine by acting on cardiac metabolism in heart failure. International Journal of Cardiology. 2015, doi: 10.1016/j.ijcard.2015.11.060.
23. Marazzi G, Gebara O, Vitale C, et al. Effect of trimetazidine on quality of life in elderly patients with ischemic dilated cardiomyopathy. Adv Ther. 2009;26(4):455-461.
24. Morgan EE, Young ME, McElfresh TA, et al. Chronic treatment with trimetazidine reduces the upregulation of atrial natriuretic peptide in heart failure. Fundam Clin Pharmacol. 2006;20(5):503-505.
25. Nascimben L, Friedrich J, Liao R, Pauletto P, Pessina AC, Ingwall JS. Enalapril treatment increases cardiac performance and energy reserve via the creatine kinase reaction in myocardium of Syrian myopathic hamsters with advanced heart failure. Circulation. 1995;91:1824-1833.
26. Nesterova IV, Kutuzova AE, Sveshnikov IuG, Sitnikova MIu, Nedoshivin AO. Effect of treatment with trimetazidine on characteristics of arrhythmia and indicators of heart rhythm in patients with chronic cardiac failure [in Russian]. Ter Arkh. 2003;75(3):61-64.
27. Neubauer S, Remkes H, Spindler M, et al. Downregulation of the Na+-creatine cotransporter in failing human myocardium and in experimental heart failure. Circulation. 1999;100:1847- 1850.
28. Paolisso G, Gambardella A, Galzerano D, et al. Total body and myocardial substrate oxidation in congestive heart failure. Metabolism. 1994;43:174-179.
29. Paulson DJ, Crass MF III. Endogenous triacylglycerol metabolism in diabetic heart. Am J Physiol Heart Circ Physiol. 1982;242:H1084-H1094.
30. Peterson LR, Herrero P, Schechtman KB, et al. Effect of obesity and insulin resistance on myocardial substrate metabolism and efficiency in young women. Circulation. 2004;109:2191- 2196.
31. Peyton RB, Jones RN, Attarian D, et al. Depressed high-energy phosphate content in hypertrophied ventricles of animal and man: the biologic basis for increased sensitivity to ischemic injury. Ann Surg. 1982;196:278-284.
32. Ponikowski P, Voors AA, Anker SD, et al; Authors/Task Force Members. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur J Heart Fail. 2016;18(8):891-975.
33. Rosano GM, Vitale C, Onorati D, Fini M. Quality of life in elderly patients with ischemic cardiopathy [in Italian]. Ital Heart J. 2004;5(suppl 2):16S-22S.
34. Rosano GM, Vitale C, Sposato B, Mercuro G, Fini M. Trimetazidine improves left ventricular function in diabetic patients with coronary artery disease: a double-blind placebo-controlled study. Cardiovasc Diabetol. 2003;2:16-24.
35. Sisakian H, Torgomyan A, Barkhudaryan A. The effect of trimetazidine on left ventricular systolic function and physical tolerance in patients with ischaemic cardiomyopathy. Acta Cardiol. 2007;62(5):493-499.
36. Thrainsdottir IS, von Bibra H, Malmberg K, Rydén L. Effects of trimetazidine on left ventricular function in patients with type 2 diabetes and heart failure. J Cardiovasc Pharmacol. 2004;44(1):101-108.
37. Tian R, Nascimben L, Kaddurah-Daouk R, Ingwall JS. Depletion of energy reserve via the creatine kinase reaction during the evolution of heart failure in cardiomyopathic hamsters. J Mol Cell Cardiol. 1996;28:755-765.
38. Tuunanen H, Engblom E, Naum A, et al. Trimetazidine, a metabolic modulator, has cardiac and extracardiac benefits in idiopathic dilated cardiomyopathy. Circulation. 2008;118(12):1250-1258.
39. Tuunanen H, Ukkonen H, Knuuti J. Myocardial fatty acid metabolism and cardiac performance in heart failure. Curr Cardiol Rep. 2008;10(2):142-148.
40. Vitale C, Wajngaten M, Sposato B, et al. Trimetazidine improves left ventricular function and quality of life in elderly patients with coronary artery disease. Eur Heart J. 2004;25(20):1814-1821.
41. Zhang L, Lu Y, Jiang H, et al. Additional use of trimetazidine in patients with chronic heart failure: a meta-analysis. J Am Coll Cardiol. 2012;59:913-922.
42. Zhou X, Chen J. Is treatment with trimetazidine beneficial in patients with chronic heart failure? PLoS ONE. 2014;9:e94660.







