ĐẠI CƯƠNG
Đái tháo đường típ 2 là một yếu tố tiên lượng quan trọng của các biến cố tim mạch trong tương lai bất kể có hiện diện của bệnh tim thiếu máu cục bộ hay không [1,2].
ThS. BS TRẦN CÔNG DUY
Khoa Nội Tim Mạch, Bệnh viện Chợ Rẫy
Bộ môn Nội, Đại học Y Dược TP. Hồ Chí Minh
Các bệnh nhân đái tháo đường không kèm bệnh tim thiếu máu cục bộ có tiên lượng tương tự với các bệnh nhân bệnh tim thiếu máu cục bộ không kèm đái tháo đường, và các bệnh nhân bệnh tim thiếu máu cục bộ kèm đái tháo đường có tỉ lệ tử vong do tim mạch gấp đôi các bệnh nhân bệnh tim thiếu máu cục bộ không kèm đái tháo đường [3,4]. Rối loạn chuyển hóa glucose và hội chứng đề kháng insulin là các yếu tố chủ yếu trong sự gia tăng xơ vữa động mạch và diễn tiến lâm sàng của các bệnh tim mạch. Sự thay đổi chuyển hóa glucose gây ra những tác dụng tim mạch bất lợi ở hai mức độ: (i) trên chức năng thành mạch máu và (ii) trên sự điều hòa chuyển hóa năng lượng tế bào.
ẢNH HƯỞNG TRÊN MẠCH MÁU VÀ CƠ CỦA RỐI LOẠN CHUYỂN HÓA GLUCOSE
Ảnh hưởng trực tiếp trên mạch máu của đái tháo đường típ 2 được nhận biết qua trung gian của rối loạn chức năng nội mô [5]. Ngoài ra, khi nội mô tổn thương, sự cân bằng giữa các chất hoạt mạch – chất có thể gây ra co mạch (thông qua endothelin-1 [ET-1] và thromboxane A2) hoặc dãn mạch (thông qua nitric oxide và các prostaglandin khác như prostacyclin) – có thể chuyển sang sự gia tăng sản xuất các chất co mạch, khởi phát chu trình luẩn quẩn và thúc đẩy thêm xơ vữa động mạch [6]. Tăng đường huyết cấp tính có thể gây rối loạn dãn mạch liên quan nội mô [7]. Ngoài ra, mối liên quan độc lập giữa tình trạng không thể tăng lưu lượng máu cơ tim với kiểm soát đường huyết dài hạn cho thấy rằng tăng đường huyết có ý nghĩa quan trọng đối với rối loạn chức năng mạch máu [8]. Ngoài ra, rối loạn tác dụng của insulin ở đái tháo đường típ 2 cũng được tìm thấy ở cả cơ tim và cơ xương [9,10]. Sự sử dụng glucose ở tim và cơ xương cánh tay tỉ lệ nghịch với nồng độ axit béo tự do trong huyết thanh và sự gia tăng dòng axit béo từ mô mỡ đến mô khác, dẫn đến bất thường chuyển hóa chất béo, tham gia và khuếch đại nhiều rối loạn chuyển hóa cơ bản đặc trưng của hội chứng đề kháng insulin và đái tháo đường típ 2 [12]. Các phát hiện trước đây cũng nhận thấy tình trạng tăng nồng độ axit béo tự do không chỉ làm rối loạn sử dụng glucose ở cơ tim và cơ xương mà còn gây ra thay đổi chuyển hóa của nội mô mạch máu dẫn đến bệnh tim mạch sớm [13].
ẢNH HƯỞNG CHUYÊN BIỆT CỦA RỐI LOẠN CHUYỂN HÓA GLUCOSE TRÊN HIỆU SUẤT CHUYỂN HÓA CỦA TẾ BÀO
Vì glucose là cơ chất năng lượng chính trong cơ thể nên rối loạn sử dụng glucose ở tim bệnh nhân đái tháo đường có thể đặc biệt gây hại. Tình trạng tăng oxy hóa axit béo tự do ở tim làm giảm oxy hóa glucose, trong khi ngược lại, tăng oxy hóa glucose sẽ ức chế quá trình oxy hóa axit béo tự do. Thực ra, oxy hóa axit béo tự do là nguồn năng lượng ít hiệu quả hơn oxy hóa glucose (về mặt sản xuất adenosine triphosphate [ATP] trên các phân tử oxy [O2 ] tiêu thụ) và điều này giải thích tại sao tăng tỉ lệ oxy hóa axit béo làm giảm hiệu suất của tim [14].
ẢNH HƯỞNG TRỰC TIẾP CỦA THIẾU MÁU CỤC BỘ TRÊN CHUYỂN HÓA CỦA CƠ TIM
Ngoài đái tháo đường, thiếu máu cục bộ cơ tim gây ra những hậu quả chuyển hóa lớn tại tim làm cho thiếu máu cục bộ cơ tim trở thành một vấn đề chuyển hóa. Trái tim khỏe mạnh lấy phần lớn năng lượng từ con đường axit béo tự do, chiếm khoảng 2/3 năng lượng sản xuất (ATP), nguồn năng lượng khác bắt nguồn từ oxy hóa glucose và lactate. Trong các tình trạng giảm oxy, các tế bào cơ tim đáp ứng với thiếu máu cục bộ cơ tim nhẹ – trung bình bằng cách tăng thu nhận glucose để tạo ra đủ ATP nhằm duy trì khuynh độ ion và cân bằng nội mô canxi vì quá trình ly giải đường cần ít oxy trên phân tử ATP hơn oxy hóa axit béo tự do. Ngoài ra, thiếu máu cục bộ cơ tim nặng nhanh chóng gây ra mất thăng bằng giữa nhu cầu oxy mô tim và lưu lượng máu mạch vành, dẫn đến thay đổi về chức năng, chuyển hóa và hình thái của cơ tim. Ở mức độ tế bào, sự thu nhận glucose giảm và tăng chuyển thành lactate; sự thu nhận lactate ở tim chuyển sang sản xuất lactate, và pyrovate hầu hết được chuyển sang lactate, do đó tăng toan hóa tế bào và ít sản xuất ATP hơn. Những thay đổi chuyển hóa này dẫn đến sự phá vỡ cân bằng nội mô tế bào, thay đổi cấu trúc màng tế bào, và cuối cùng chết tế bào [14]. Do đó, các ảnh hưởng có hại trên tim của đái tháo đường là hậu quả của các cơ chế mạch máu và chuyển hóa ở cơ tim. Trong tình huống này, làm giảm nồng độ axit béo tự do huyết tương hoặc giảm sử dụng axit béo tự do ở tế bào có thể giúp giảm sự phụ thuộc của tim vào axit béo tự do.
TIẾP CẬN ĐIỀU TRỊ CHUYỂN HÓA Ở BỆNH NHÂN BỆNH TIM THIẾU MÁU CỤC BỘ VÀ ĐÁI THÁO ĐƯỜNG
Khả năng cải thiện sự ưa thích cơ chất cho chuyển hóa ở tim của bệnh nhân đái tháo đường là vấn đề lý thú. Đặc biệt, tăng tỉ lệ chuyển hóa glucose và giảm oxy hóa axit béo tự do là tiếp cận điều trị rất hấp dẫn. Trimetazidine chuyển sự sản xuất năng lượng từ axit béo tự do sang oxy hóa glucose và bảo tồn năng lượng tế bào bằng cách tăng nồng độ phosphat năng lượng cao ở cơ tim (Hình 1) [15,16]. Dựa vào cơ sở này, các nghiên cứu lâm sàng đã chứng minh lợi ích lâm sàng của trimetazidine ở bệnh nhân bệnh tim thiếu máu cục bộ [17] và hiện tại được chỉ định điều trị cơn đau thắt ngực bởi Hội Tim Châu Âu (European Society of Cardiology [ESC]) [18]. Trong khuyến cáo của ESC năm 2013 về điều trị bệnh mạch vành ổn định, trimetazidine được xếp ngang hàng với các thuốc chống đau thắt ngực thường quy (nitrate tác dụng dài, nicorandil, ivabradine). Hướng dẫn của ESC 2013 nêu rõ “Trimetazidine (35 mg x 2 lần/ngày) thêm vào trên nền thuốc ức chế beta giúp cải thiện tình trạng thiếu máu cục bộ cơ tim xuất hiện khi gắng sức. Ở ngưới bệnh đái tháo đường, trimetazidine cải thiện HbA1c và đường huyết và tăng hấp thu glucose vùng cánh tay (tức là sử dụng glucose ở mô ngoại vi)” [18].
Trimetazidine dường như đặc biệt hiệu quả khi có hiện diện của tăng đường huyết và tăng insulin máu [19] thường được quan sát ở các tình trạng đề kháng insulin. Vì những lý do này, trimetazidine rất hiệu quả ở bệnh nhân đái tháo đường kèm bệnh tim thiếu máu cục bộ ổn định và rối loạn chức năng thất trái [20]. Nghiên cứu DIETRIC của Rodríguez Padial L và cộng sự (cs) ở 580 bệnh nhân đái tháo đường típ 2 và bệnh mạch vành được tiến hành để đánh giá tác dụng chống đau thắt ngực của trimetazidine [21]. Bệnh nhân được ghi nhận hồ sơ lâm sàng ban đầu, khám thực thể, xét nghiệm, ECG và thực hiện nghiệm pháp gắng sức và theo dõi trong 6 tháng. Kết quả nghiên cứu cho thấy giảm số cơn đau thắt ngực (2,8 so với 0,9; P < 0,001) và giảm số viên nitroglycerin mỗi tuần (2,5 so với 0,7; P < 0,001). Trong nghiệm pháp gắng sức tại thời điểm 6 tháng, thời gian gắng sức tăng (441 so với 391 giây; P < 0,001); thời gian đến khi xuất hiện đoạn ST chênh tăng (214 so với 209 giây; P = 0,02); đoạn ST chênh ít hơn (1,7 so với 1,2; P < 0,001), và bệnh nhân dung nạp tốt với gắng sức.
Một nghiên cứu của Marazzi G. và cs theo dõi điện tâm đồ lưu động 24 giờ khẳng định rằng ở bệnh nhân đái tháo đường và đau thắt ngực ổn định mạn tính, bổ sung trimetazidine vào điều trị nội khoa chuẩn làm giảm số lần đoạn ST chênh xuống, số cơn thiếu máu cục bộ cơ tim yên lặng và tổng gánh nặng thiếu máu cục bộ [22]. Vì rối loạn chuyển hóa glucose là yếu tố nguy cơ lớn nhất của tái hẹp sau tái thông mạch vành qua da [23], điều trị nội khoa tối ưu các bệnh nhân này là điều bắt buộc. Trong bệnh cảnh này, nghiên cứu của Xu X. và cs cho thấy điều trị hỗ trợ với trimetazidine sau đặt stent phủ thuốc ở bệnh nhân cao tuổi bệnh nhiều nhánh mạch vành kèm đái tháo đường có thể mang lại tác dụng có lợi trên đau thắt ngực tái phát cũng như chức năng thất trái [24]. Đây là nghiên cứu đơn trung tâm, tiến cứu, ngẫu nhiên, mù đôi. Từ tháng 01/2010 đến 09/2010, 700 bệnh nhân bệnh mạch vành và đái tháo đường ≥ 65 tuổi trải qua chụp mạch vành tại bệnh viện An Zhen (Bắc Kinh, Trung Quốc) được phân ngẫu nhiên vào nhóm trimetazidine hoặc giả dược sau đặt stent phủ thuốc trên nền điều trị bệnh mạch vành thường quy. Sau 2 năm, các bệnh nhân ở nhóm trimetazidine (n = 255) cải thiện có ý nghĩa tỉ lệ mới mắc (P = 0,024) và độ nặng cơn đau thắt ngực (P = 0,011). Chức năng và cấu trúc thất trái ở nhóm trimetazidine tương đối ổn định sau 2 năm theo dõi, trong khi giảm ở nhóm chứng (n = 255) với sự khác biệt ý nghĩa giữa các nhóm (P < 0,01).
Shehata M. tiến hành một nghiên cứu trên 100 bệnh nhân mạch vành kèm đái tháo đường có rối loạn chức năng thận (độ lọc cầu thận trung bình 48 ± 16 ml/phút/1,73 m2) được can thiệp mạch vành qua da [25]. Những bệnh nhân này được điều trị bằng trimetazine MR 35 mg 2 lần/ngày trong 72 giờ, bắt đầu 48 giờ trước thủ thuật. Kết quả nghiên cứu nhận thấy trimetazidine giảm nguy cơ tổn thương thận do thuốc cản quang (định nghĩa là creatinin huyết thanh tăng hơn 0,5 mg/dL hoặc hơn 25% so với ban đầu). Tỉ lệ tổn thương thận do thuốc cản quang là 12% ở nhóm trimetazidine và 28% ở nhóm chứng (P < 0,05). Đồng thời trimetazidine cũng hạn chế được tổn thương cơ tim liên quan với thủ thuật, bằng chứng là nồng độ c-Troponin I đo ở các thời điểm 6 giờ, 12 giờ và 24 giờ sau can thiệp ở nhóm trimetazidine đều thấp hơn có ý nghĩa so với nhóm chứng. Do đó, điều trị trimetazidine ở bệnh nhân bệnh tim thiếu máu cục bộ kèm đái tháo đường trải qua can thiệp mạch vành qua da mang lại nhiều tác dụng hữu ích.
TÁC DỤNG CHUYÊN BIỆT CỦA TRIMETAZIDINE Ở BỆNH NHÂN BỆNH TIM THIẾU MÁU CỤC BỘ VÀ ĐÁI THÁO ĐƯỜNG
Như đã khẳng định ở trên, trimetazidine tăng cường sử dụng glucose ở cơ tim thay vì axit béo tự do, điều này có lợi trong bệnh cảnh cơ tim rối loạn chức năng chuyển hóa. Các ảnh hưởng này có thể xảy ra trên cơ tim và cơ xương; do đó, tác dụng của trimetazidine trên chuyển hóa glucose có thể phụ thuộc vào sự cải thiện hiệu suất tim [26] và sự cải thiện sử dụng glucose ngoại biên. Ngoài ra, trimetazidine cũng làm giảm sự phóng thích ET-1 (Hình 2) [27, 28] có liên quan với độ nặng thiếu máu cục bộ cơ tim và rối loạn chức năng; nồng độ ET-1 tương quan với tiên lượng. Tác dụng giảm toan hóa nội bào của trimetazidine ở cơ tim thiếu máu cục bộ [29] có thể ảnh hưởng không chỉ chức năng cơ tim mà còn chức năng nội mô. Bằng cách giảm tổn thương nội mô, trimetazidine có thể ức chế phóng thích ET-1, từ đó sẽ giảm tổn thương cơ tim và cải thiện chuyển hóa glucose. Khả năng thứ hai là trimetazidine có thể ức chế phóng thích ET-1 đơn giản bằng cách giảm tác dụng của thiếu máu cục bộ cơ tim mạn tính. Ngoài ra, trimetazidine có thể cải thiện cả sự hồi phục cơ tim và phóng thích ET-1 sau thiếu máu cục bộ cơ tim khi hiện diện nồng độ cao triglyceride [30]. Qua việc xem xét mối liên quan giữa nồng độ ET-1 và bất thường chuyển hóa glucose, lợi ích của trimetazidine trên chuyển hóa glucose có thể một phần do giảm nồng độ ET-1.
KẾT LUẬN
Đái tháo đường ngày càng trở bên phổ biến trên thế giới. Hầu hết bệnh nhân đái tháo đường sẽ xuất hiện các biến chứng tim mạch, trong đó bệnh tim thiếu máu cục bộ thường gặp nhất và có thể diễn tiến âm thầm. Ở những bệnh nhân này, bệnh tim thiếu máu cục bộ nên được điều trị tích cực. Các thuốc tác dụng trực tiếp trên chuyển hóa tế bào cơ tim có thể mang lại tác dụng đặc biệt hữu ích [31]. Trimetazidine bằng cách tác dụng trực tiếp ở mức tế bào cơ tim, ức chế một phần oxy hóa axit béo, cải thiện toàn bộ quá trình chuyển hóa ở tim, và từ đó tăng đề kháng của tim với thiếu máu cục bộ và giảm sự suy giảm chức năng thất trái do giảm tưới máu mạn tính và các cơn thiếu máu cục bộ cơ tim lặp lại. Vì vậy, điều hòa chuyển hóa tế bào cơ tim nên là mục tiêu quan trọng ở bệnh nhân bệnh tim thiếu máu cục bộ và đái tháo đường. Vì các tác dụng trên chuyển hóa cơ tim và lợi ích đã xác định trên thiếu máu cục bộ cơ tim và chức năng thất trái, trimetazidine nên luôn được xem là điều trị cần thiết cho bệnh nhân đái tháo đường kèm bệnh tim thiếu máu cục bộ.
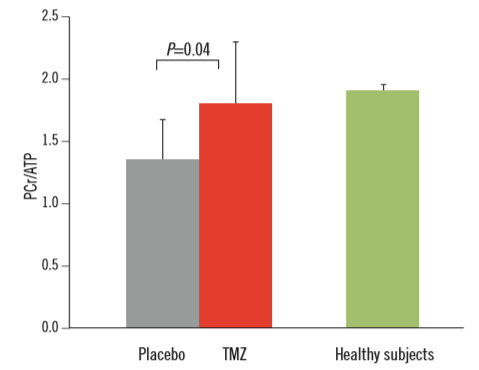
Hình 1. Quang phổ cộng hưởng từ 31P in vivo đánh giá ảnh hưởng của điều trị trimetazidine 3 tháng trên tỉ số phosphocreatinine/ adenosine triphosphate (PCr/ATP) ở thất trái của bệnh nhân suy tim.Biểu đồ cho thấy sự cải thiện quan trọng về dự trữ năng lượng tế bào do trimetazidine (TMZ) qua chứng cứ tăng ý nghĩa PCr/ATP so với giả dược (placebo). Sau khi sử dụng trimetazidine, nồng độ PCr/ATP tương tự như nhóm chứng khỏe mạnh (healthy subjects) [15,16].
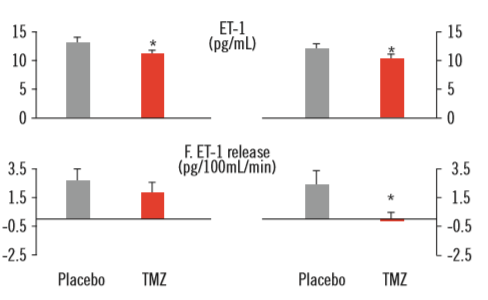
Hình 2. Endothelin-1 ở tình trạng ban đầu (trái) và cuối nghiên cứu ở các bệnh nhân bệnh cơ tim do đái tháo đường sau 15 ngày sử dụng trimetazidine (TMZ) (cột đỏ) và giả dược (placebo) (cột xám). Khi dùng trimetazidine, endothelin-1 và sự phóng thích endothelin-1 ở cẳng tay giảm có ý nghĩa so với giả dược, cho thấy cải thiện chức năng nội mô. Trị số được trình bày ở dạng trung bình ± độ lệch chuẩn. *P<0.05 [27].
TÀI LIỆU THAM KHẢO
1. King H, Aubert RE, Herman WH. Global burden of diabetes, 1995-2025: prevalence, numerical estimates, and projections. Diabetes Care. 1998;21:1414-1431.
2. Kanters SD, Banga JD, Stolk RP, Algra A. Incidence and determinants of mortality and cardiovascular events in diabetes mellitus: a meta-analysis. Vasc Med. 1999;4:67-75.
3. Haffner SM, Lehto S, Ronnemaa T, Pyorala K, Laakso M. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med. 1998;339:229-234.
4. Eliasson M, Jansson JH, Lundblad D, Naslund U. The disparity between long-term survival in patients with and without diabetes following a first myocardial infarction did not change between 1989 and 2006: an analysis of 6,776 patients in the Northern Sweden MONICA Study. Diabetologia. 2011;54:2538-2543.
5. Piatti PM, Monti LD, Galli L, et al. Relationship between endothelin-1 concentrations and metabolic alterations typical of the Insulin Resistance Syndrome. Metabolism. 2000;49:748-752.
6. Lüscher TF, Richard V, Tschudi M, Yang ZH, Boulanger C. Endothelial control of vascular tone in large and small coronary arteries. J Am Coll Cardiol. 1990;15:519-527.
7. Ceriello A, Taboga C, Tonutti L, et al. Evidence for an independent and cumulative effect of postprandial hypertriglyceridemia and hyperglycemia on endothelial dysfunction and oxidative stress generation: effects of short- and long-term simvastatin treatment. Circulation. 2002;106:1211-1218.
8. Yokoyama I, Momomura S, Ohtake T, et al. Reduced myocardial flow reserve in non insulin-dependent diabetes mellitus. J Am Coll Cardiol. 1997;30:1472-1477.
9. Anderson EJ, Kypson AP, Rodriguez E, Anderson CA, Lehr EJ, Neufer PD. Substrate-specific derangements in mitochondrial metabolism and redox balance in the atrium of the type 2 diabetic human heart. J Am Coll Cardiol. 2009;54:1891-1898.
10. Aguer C, McCoin CS, Knotts TA, et al. Acylcarnitines: potential implications for skeletal muscle insulin resistance. FASEB J. 2015;29:336-345.
11. Nuutila P, Knuuti MJ, Raitakari M, et al. Effect of antilipolysis on heart and skeletal muscle glucose uptake in overnight fasted humans. Am J Physiol. 1994;267:E941-E946.
12. Lewis GF, Carpentier A, Adeli K, Giacca A. Disordered fat storage and mobilization in the pathogenesis of insulin resistance and type 2 diabetes. Endocr Rev. 2002;23:201-229.
13. Steinberg HO, Baron AD. Vascular function, insulin resistance and fatty acids. Diabetologia. 2002;45:623-634.
14. Fillmore N, Mori J, Lopaschuk GD. Mitochondrial fatty acid oxidation alterations in heart failure, ischaemic heart disease and diabetic cardiomyopathy. Br J Pharmacol. 2014;171:20802090.
15. Fragasso G, De Cobelli F, Perseghin G, et al. Effects of metabolic modulation by trimetazidine on left ventricular function and phosphocreatine/adenosine triphosphate ratio in patients with heart failure. Eur Heart J. 2006;27:942-948.
16. Perseghin G, Fiorina P, De Coblelli F, et al. Cross-sectional assessment of the effect of kidney and kidney-pancreas transplantation on resting left ventricular energy metabolism in type 1 diabetic-uremic patients: a phosphorous-31 magnetic resonance spectroscopy study. J Am Coll Cardiol. 2005;46:10851092.
17. Rosano GM, Vitale C, Fragasso G. Metabolic therapy for patients with diabetes mellitus and coronary artery disease. Am J Cardiol. 2006;98:14J-18J.
18. 2013 ESC guidelines on the management of stable coronary artery disease. The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J. 2013;34:2949-3003.
19. Fragasso G, Montano C, Perseghin G, et al. The anti-ischemic effect of trimetazidine in patients with postprandial myocardial ischemia is unrelated to meal composition. Am Heart J. 2006;151:1238.e1-e8.
20. Fragasso G, Piatti PM, Monti L, et al. Short- and long-term beneficial effects of partial free fatty acid inhibition in diabetic patients with ischemic dilated cardiomyopathy. Am Heart J. 2003;146:e18.
21. Rodríguez Padial L, Maicas Bellido C, Velázquez Martín M, Gil Polo B. A prospective study on trimetazidine effectiveness and tolerability in diabetic patients in association to the previous treatment of their coronary disease. DIETRIC study. Rev Clin Esp. 2005;205(2):57-62.
22. Marazzi G, Wajngarten M, Vitale C, et al. Effect of free fatty acid inhibition on silent and symptomatic myocardial ischemia in diabetic patients with coronary artery disease. Int J Cardiol. 2007;120:79-84.
23. Piatti P, Di Mario C, Monti LD, et al. Association of insulin resistance, hyperleptinemia, and impaired nitric oxide release with in-stent restenosis in patients undergoing coronary stenting. Circulation. 2003;108:2074-2081.
24. Xu X, Zhang W, Zhou Y, et al. Effect of trimetazidine on recurrent angina pectoris and left ventricular structure in elderly multivessel coronary heart disease patients with diabetes mellitus after drug-eluting stent implantation: a single-centre, prospective, randomized, double-blind study at 2-year follow-up. Clin Drug Investig. 2014;34:251-258.
25. Shehata M. Impact of trimetazidine on incidence of myocardial injury and contrast-induced nephropathy in diabetic patients with renal dysfunction undergoing elective percutaneous coronary intervention. Am J Cardiol 2014;114:389-394.
26. Fragasso G, Spoladore R, Cuko A, Palloshi A. Modulation of fatty acids oxidation in heart failure patients by selective pharmacological inhibition of 3-ketoacyl coenzyme-A thiolase. Curr Clin Pharmacol. 2007;2:190-196.
27. Monti LD, Setola E, Fragasso G, et al. Metabolic and endothelial effects of trimetazidine on forearm skeletal muscle in patients with type 2 diabetes and ischemic cardiomyopathy. Am J Physiol Endocrinol Metab. 2006;290:E54-E59.
28. Fragasso G, Piatti PM, Monti L, et al. Acute effects of heparin administration on the ischemic threshold of patients with coronary artery disease: evaluation of the protective role of the metabolic modulator trimetazidine. J Am Coll Cardiol. 2002;39:413-419.
29. Maridonneau-Parini I, Harpey C. Effects of trimetazidine on membrane damage induced by oxygen free radicals in human red cells. Br J Clin Pharmacol. 1985;20:148-151.
30. Monti LD, Allibardi S, Piatti PM, et al. Triglycerides impair postischemic recovery in isolated hearts: roles of endothelin-1 and trimetazidine. Am J Physiol Heart Circ Physiol. 2001;281:H1122-H1130.
31. Fragasso G, Salerno A, Spoladore R, Cera M, Montanaro C, Margonato A. Effects of metabolic approach in diabetic patients with coronary artery disease. Curr Pharm Des. 2009;15:857862.







