ThS.BSCK2 Thượng Thanh Phương
- ĐẶT VẤN ĐỀ
Huyết khối tĩnh mạch (Venous ThromboEmbolism-VTE), bao gồm thuyên tắc phổi (Pulmonary Embolism-PE) và huyết khối tĩnh mạch sâu (Deep Venous Thrombosis-DVT), là nguyên nhân đáng kể gây tử vong mẹ ở các nước phát triển. Những thay đổi sinh lý bình thường trong thai kỳ bản thân đã có tình trạng tăng đông, nếu kết hợp thêm trên nền các yếu tố nguy cơ (YTNC) mắc phải hoặc di truyền của bệnh nhân thì nguy cơ VTE càng gia tăng. VTE ở phụ nữ mang thai cao hơn ở phụ nữ cùng tuổi không mang thai, nó tăng dần trong thai kỳ và đạt đỉnh điểm trong giai đoạn hậu sản. Các nghiên cứu quan sát ghi nhận VTE liên quan đến thai nghén cao gấp 6 lần so với dân số chung, với nguy cơ tuyệt đối lên đến 12,2/10.000 so với 2/10.000 ở phụ nữ không mang thai4,6. Đó là về độ lớn, còn mức độ trầm trọng thì sao? Số liệu dịch tể ghi nhận VTE gây tử vong mẹ dẫn đầu ở Anh, Ireland và là nguyên nhân thứ 6 ở Hoa Kỳ. Trong đó 9,2% số ca tử vong liên quan đến thai kỳ là do PE6,10. Tuy nhiên việc tiếp cận về dự phòng, chẩn đoán và điều trị bệnh lý này trên phụ nữ mang thai, 1 đối tượng khá đặc biệt mà việc quyết định sẽ liên quan đến cả 2 sinh mạng rõ ràng là 1 thách thức trong thực hành lâm sàng. Công việc chẩn đoán đòi hỏi sự nhạy bén vì nhiều triệu chứng của thai kỳ cũng giống với triệu chứng của VTE. Các thang điểm được sử dụng cho dân số chung không được kiểm định trên phụ nữ mang thai. Lựa chọn phương pháp chẩn đoán hình ảnh cần phải tính đến nguy hại đối với thai và sự thay đổi độ chính xác của xét nghiệm (độ nhạy và độ đặc hiệu) trong thai kỳ. Quyết định xử trí lại càng phải cân nhắc: sản phụ nào cần dự phòng? chọn lựa chế độ kháng đông trong thai kỳ thế nào? Chiến lược tiêu sợi huyết (TSH), can thiệp qua catheter, phẫu thuật lấy huyết khối khi có chỉ định trong các trường hợp nặng, liệu có an toàn cho mẹ và thai? Ở bài viết này chúng ta cùng bàn bạc 4 câu hỏi được đặt ra từ thực tế lâm sàng:
- Thai kỳ làm thay đổi sinh bệnh gì và YTNC cho VTE có gì khác biệt?
- Sản phụ nào cần dự phòng VTE?
- Chẩn đoán VTE như thế nào?
- Xử trí cần lưu ý gì?
- GIẢI QUYẾT VẤN ĐỀ
- Thai kỳ làm thay đổi sinh bệnh gì và YTNC cho VTE có gì khác biệt?
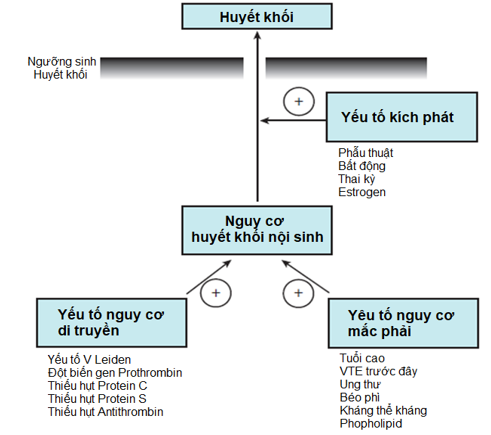
Hình 1: Sinh bệnh hình thành VTE 2
Như chúng ta đã biết, sự thành lập VTE xuất phát từ tam chứng Virchow với 3 nhóm YTNC là tổn thương nội mạc mạch máu, ứ trệ lưu thông máu và tình trạng tăng đông. Các đối tượng bị VTE thường xảy ra trên nền sẵn có YTNC huyết khối nội sinh (có thể do di truyền hay mắc phải), dưới tác động thêm vào của yếu tố kích phát làm vượt ngưỡng sinh huyết khối VTE. Bản thân thai kỳ đã là một tình trạng tăng đông sinh lý để chuẩn bị tốt cho việc ngăn ngừa chảy máu tại thời điểm chuyển dạ. Các yếu tố đông máu II, VII, VIII, IX, X, XII, yếu tố von Willebrand và fibrin tăng, protein S giảm, và tăng đề kháng với protein C hoạt hóa được ghi nhận trong thai kỳ. Giảm vận tốc dòng chảy tĩnh mạch, dãn tĩnh mạch và cản trở hồi lưu tĩnh mạch do tử cung ngày càng lớn dẫn đến ứ trệ dòng máu. Bên cạnh đó, tình trạng chấn thương mạch máu trong lúc chuyển dạ, đặc biệt khi sử dụng thêm các thiết bị hỗ trợ trong lúc chuyển dạ và việc mổ lấy thai, càng làm tăng nguy cơ huyết khối sau sinh. Tổng hợp lại những yếu tố này đã góp phần cho 6% đến 11% VTE liên quan đến thai kỳ10,15.
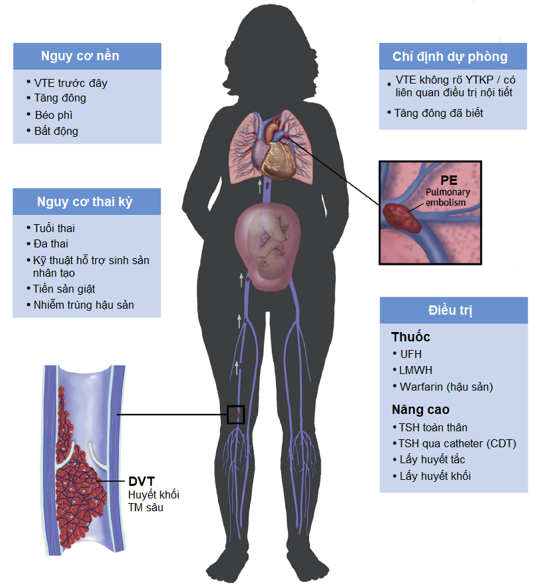
Hình 2: VTE trong thai kỳ cùng các biện pháp dự phòng và điều trị 10
Như vậy rõ ràng về mặt cơ sở lý luận và số liệu dịch tễ cho thấy thai kỳ tăng nguy cơ VTE. Những YTNC phổ biến nhất của VTE trong dân số chung vẫn còn hiện diện trong thai kỳ cộng thêm vào là những YTNC chuyên biệt của thai kỳ. Nguy cơ này không hằng định trong suốt thai kỳ mà tăng dần theo tuổi thai, cao nhất trong 2 tuần đầu sau sinh. Các dữ liệu quan sát ghi nhận, so với phụ nữ không mang thai, sản phụ sẽ có nguy cơ VTE cao gấp 2 lần trong tam cá nguyệt đầu và tam cá nguyệt thứ hai, cao hơn 9 lần trong tam cá nguyệt thứ ba và đạt đỉnh cao nhất lên đến 80 lần ở thời điểm 2 đến 6 tuần đầu sau sinh. Tình trạng sẩy thai cũng tăng nguy cơ VTE cao hơn 2 lần so với dân số không mang thai.
Tiền sử bệnh lý tăng đông và mổ lấy thai chiếm phần lớn trong dân số sản phụ bị VTE sau sinh, với các tỷ lệ lần lượt được ghi nhận 40%-50% và 19%-64%. Sinh mổ mang nguy cơ VTE cao hơn 4,9 lần (khoảng tin cậy-KTC 95%: 3,8-6,3) so với sinh ngã âm đạo, nhưng không hẳn chỉ do bản thân của việc mổ lấy thai mà có thể do tác động yếu tố gây nhiễu vì những sản phụ này có thể đã có bệnh đi kèm từ trước nên mới được chỉ định mổ lấy thai. Tiền sản giật làm tăng nguy cơ VTE trong thời kỳ hậu sản (tỷ suất mới mắc: 1,6; KTC 95%: 1,01-2,53), nhưng bản thân nó lại không làm tăng VTE giai đoạn trước sinh (tỷ suất mới mắc: 1,03; KTC 95%: 0,76-1,39).
Sản phụ có tiền sử VTE là một yếu tố nguy cơ mạnh cho xuất hiện VTE liên quan đến thai kỳ. Độ nặng của nguy cơ thay đổi phụ thuộc vào VTE trước đó là không rõ yếu tố kích phát (3,6%), rõ yếu tố kích phát thoáng qua (1,1%), hoặc liên quan đến việc sử dụng hormone ngoại sinh (6,4%). Khuyến cáo của Hội bác sĩ phụ khoa Mỹ (ACOG-American College of Gynecology) đề nghị xét nghiệm tầm soát hội chứng kháng thể kháng phospholipid và tăng đông di truyền, bao gồm yếu tố V Leiden (FVL) và đột biến gen prothrombin G20210A (PT G20210A), cũng như thiếu hụt antithrombin III, protein C và protein S cho tất cả phụ nữ mang thai có tiền sử VTE1,14.
So với những phụ nữ mang thai nói chung, sản phụ mắc bệnh tăng đông di truyền có nguy cơ cao gấp 15 lần (KTC 95%: 10,8 đến 22,0) đối với VTE, nguy cơ tuyệt đối với DVT là 146/10.000 và PE là 43/10.000 phụ nữ mang thai. Trong số những sản phụ không có tiền sử VTE, mức độ nguy cơ thay đổi tùy theo loại bệnh tăng đông chuyên biệt và tiền sử gia đình có bị VTE hay không. Bản thân tiền sử gia đình đã làm tăng nguy cơ VTE lên đến 4 lần, ngay cả khi không có bệnh tăng đông. Bệnh tăng đông di truyền có nguy cơ VTE cao nhất trong thai kỳ là FVL đồng hợp tử (OR: 34,4; KTC 95%: 9,9 đến 120,1), đột biến gen PT G20210A đồng hợp tử (OR: 26,4; 95 % CI: 1,2 đến 559,3), FVL dị hợp tử (OR: 8,3; 95% CI: 5,4 đến 12,7) và đột biến gen PT G20210A dị hợp tử (OR: 6,8; KTC 95%: 2,5 đến 18,8).
Thiếu hụt các yếu tố chống đông máu nội sinh cũng làm tăng nguy cơ VTE, mặc dù ghi nhận ít hơn bệnh tăng đông di truyền. Thiếu hụt protein C, protein S và antithrombin III mang OR lần lượt là 4,8 (95% CI: 2,2 đến 10,7), 3,2 (95% CI: 1,5 đến 6,9) và 4,7 (95% CI: 1,30 đến 17,0), nguy cơ này sẽ tăng thêm nếu sản phụ có thêm tiền sử gia đình bị VTE. Tình trạng tăng đông mắc phải, chủ yếu là hội chứng kháng phospholipid sẽ làm tăng nguy cơ VTE liên quan đến thai kỳ từ 5% đến 12%. Đó là các YTNC nội tại từ bản thân bệnh nhân. Vậy các yếu tố từ bên ngoài có tác động gì trên tổng gánh nguy cơ VTE của sản phụ?
Kỹ thuật hỗ trợ sinh sản (Assisted Reproduction Technologies-ART) có những tiến bộ vượt bậc trong những năm gần đây nhưng chính nó làm xấu thêm nguy cơ cho VTE thai kỳ. Điều trị kích thích buồng trứng làm tăng nguy cơ VTE lên 2-3 lần so với dân số mang thai nói chung. Điều này được lý giải là do nồng độ estradiol vượt trên mức sinh lý, dẫn đến sự cô đặc và kích hoạt hệ thống đông máu. Ngoài ra do sự thoát dịch ổ bụng có chứa estrogen qua hệ thống bạch huyết vào ống ngực và tĩnh mạch dưới đòn trái, do đó VTE liên quan đến ART được ghi nhận thường xảy ra ở chi trên. Phần lớn các trường hợp VTE đi kèm ART xảy ra trong tam cá nguyệt đầu, với nguy cơ tăng gấp 5-10 lần và không có sự khác biệt đáng kể trong tam cá nguyệt thứ hai và thứ ba. Dữ liệu ghi nhận 8% phụ nữ điều trị ART có hội chứng quá kích buồng trứng (ovarian hyperstimulation syndrome-OHSS) và có nguy cơ VTE cao gấp 100 lần trong tam cá nguyệt đầu tiên. Nó xảy ra sớm hơn (trung bình là 18 ngày so với 57 ngày ở sản phụ không có OHSS). Tình trạng đa thai không làm tăng nguy cơ VTE trong 3 tháng đầu, nhưng làm tăng nguy cơ trong giai đoạn trước sinh gấp 2,1-2,6 lần. Ngược lại phụ nữ không mang thai được điều trị ART thì lại không làm tăng nguy cơ. Thụ tinh trong ống nghiệm (in vitro fertilization) cũng làm tăng nguy cơ VTE qua nghiên cứu sổ bộ ở Thụy Điển ghi nhận HR cho VTE sau khi thụ tinh trong ống nghiệm là 1,77 (95% CI 1,41-2,23) trong toàn thai kỳ và 4,22 (95% CI 2,46-7,20) trong tam cá nguyệt đầu tiên8.Tiền sử VTE hoặc bệnh tăng đông, kết hợp với điều trị ART hiện còn thiếu dữ liệu để kết luận về nguy cơ VTE.
- Sản phụ nào cần dự phòng VTE?
Bất kể có tình trạng tăng đông và nguy cơ VTE tăng trong thai kỳ, việc dự phòng huyết khối thường quy cho tất cả các sản phụ là không có lợi. Dự phòng sẽ có nguy cơ chảy máu ở mẹ lên đến 2% kèm theo các tác động như loãng xương và giảm tiểu cầu liên quan heparin (Heparin-Induced Thrombocytopenia-HIT). Warfarin đi qua nhau thai và có liên quan đến tăng tỷ lệ sẩy thai, dị tật bẩm sinh, xuất huyết thai và các hậu quả về thần kinh lâu dài, khiến nó trở thành là thuốc nhóm D theo theo phân loại của FDA. Fondaparinux và các thuốc kháng đông đường uống không phải kháng Vitamin K (NOAC) đi qua nhau thai, nhưng tác dụng lâm sàng trên kết cục thai nhi chưa xác định rõ, do đó nó không được khuyến cáo trong thai kỳ. Heparin không phân đoạn (UnFractionated Heparin-UFH) và heparin trọng lượng phân tử thấp (Low Molecular Weight Heparin-LMWH) có độ an toàn thuận lợi nhất, nhưng nhiều sản phụ lại cho rằng việc tiêm thuốc hàng ngày gây đau, bất tiện và tăng chi phí điều trị. Ngoài ra các yếu tố khác như khả năng vào chuyển dạ không thể đoán trước, việc đặt catheter ngoài màng cứng trong đẻ không đau và nguy cơ mổ lấy thai khẩn cấp góp phần làm phức tạp thêm việc sử dụng LMWH có tác dụng kéo dài. Vì những lý do này, khởi trị dự phòng trong thai kỳ thường được chỉ định trong thời kỳ hậu sản với thời gian dùng ngắn hơn và có thể dùng warfarin đường uống. Trong giai đoạn trước sinh, điều trị dự phòng huyết khối cần cân nhắc trên các YTNC lâm sàng và tuổi thai.
Ở những phụ nữ có tiền căn VTE, điều trị kháng đông dự phòng giúp làm giảm đáng kể tỷ lệ VTE tái phát trong giai đoạn trước và sau sinh đồng thời không làm tăng đáng kể xuất huyết nặng, thiếu xương, gãy xương do loãng xương, hoặc HIT. Nguy cơ VTE giảm khoảng 75%, với tỷ suất mới mắc 0,9% – 2,8% trước sinh và 1,7% sau sinh. Các nghiên cứu đã gợi ý rằng những sản phụ trước đó có VTE liên quan với thai kỳ hoặc có liên quan sử dụng thuốc tránh thai thì có nhiều khả năng bị VTE tái phát trong thai kỳ hơn những sản phụ có VTE vô căn hoặc không liên quan đến hormone trước đó. Do đó, các khuyến cáo đề nghị rằng kháng đông dự phòng có lợi ở phụ nữ có tiền sử VTE trước sinh hoặc bị VTE vô căn hoặc có liên quan đến điều trị hormone và tiền căn VTE sau sinh bất kể nguyên nhân là gì12.
Giảm nguy cơ VTE nhiều nhất với điều trị dự phòng thường được ghi nhận ở những bệnh nhân có cả 2 tiền sử gia đình bị VTE và hoặc FVL đồng hợp tử hoặc bị đột biến gen PT 20210A đồng hợp tử. Những bệnh nhân này, giảm 47/1.000 VTE trong cả 2 giai đoạn trước và sau sinh. Đối với những người không có tiền sử gia đình VTE hoặc có các biến thể dị hợp tử, mức giảm được ghi nhận tương ứng là 13/1.000 và 10/1.000. Những bệnh nhân có tiền sử gia đình VTE và thiếu antithrombin III, protein C hoặc protein S, điều trị dự phòng giúp giảm 13/1.000 bệnh nhân bị VTE13.
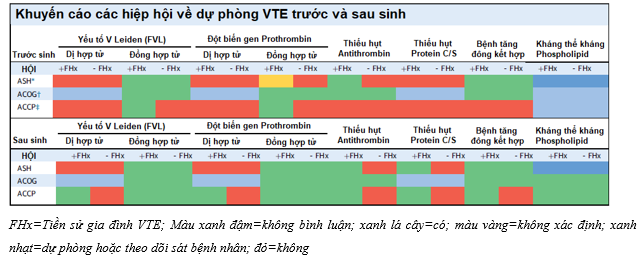
Bảng 1: Khuyến cáo của các hiệp hội về dự phòng VTE trước và sau sinh10
Ở những bệnh nhân có hội chứng kháng phospholipid và tiền sử sẩy thai tái phát, sử dụng kết hợp aspirin liều thấp và heparin có thể làm giảm 50% sẩy thai và nên được xem xét trong giai đoạn trước sinh và tiếp tục đến 6 tuần sau sinh. Đối với tất cả các bệnh nhân có chỉ định, điều trị dự phòng huyết khối nên được bắt đầu càng sớm càng tốt trong ba tháng đầu và tiếp tục cho đến 6 tuần sau sinh10. Điều quan trọng cần lưu ý là bệnh nhân thiếu protein C hoặc protein S được điều trị bằng warfarin có nguy cơ hoại tử da là biến chứng hiếm gặp.
Nhìn chung, các nghiên cứu liên quan đến dự phòng huyết khối trên bệnh nhân ART rất khác nhau liên quan đến loại và liều lượng thuốc, dẫn đến chiến lược điều trị lý tưởng còn chưa rõ. Do đó, dự phòng huyết khối không được khuyến cáo thường quy cho những bệnh nhân này. Một nghiên cứu so sánh tỷ suất mới mắc VTE ở bệnh nhân ART được điều trị bằng LMWH ± aspirin so với không dùng thuốc kháng đông hoặc thuốc kháng tiểu cầu cho thấy xu hướng tăng VTE ở nhóm không điều trị, nhưng điều này chưa đạt mức ý nghĩa thống kê. Ngoài ra, dự phòng aspirin hoặc LMWH ở bệnh nhân ART không cho thấy cải thiện tỷ lệ mang thai thành công. Ngược lại, trên bệnh nhân bị OHSS, nguy cơ VTE trong ba tháng đầu tăng gấp 100 lần, dự phòng bằng LMWH được chỉ định trong 3 tháng đầu. Những sản phụ có tiền sử bị VTE hoặc bệnh tăng đông, nguy cơ thêm vào do sử dụng ART là không rõ ràng. Dữ liệu hiện có hạn chế đã chỉ ra rằng cả đột biến gen FVL và PT G20210A đều không làm thay đổi nguy cơ huyết khối ở phụ nữ điều trị ART. Do đó, chiến lược dự phòng huyết khối ở những bệnh nhân này giống với những bệnh nhân không điều trị ART, vẫn được quyết định bởi tiền sử huyết khối và bệnh huyết khối nền của họ.
Không có nghiên cứu nào trên phụ nữ mang thai so sánh trực tiếp giữa dự phòng bằng LMWH với UFH; tuy nhiên, từ dữ liệu trên dân số chung, LMWH có độ an toàn và hiệu quả ngang bằng với UFH. LMWH có đáp ứng điều trị dễ dự đoán hơn, tỷ lệ loãng xương và HIT thấp hơn, mặc dù UFH có thể được ưu tiên ở những bệnh nhân bị rối loạn chức năng thận (mức lọc cầu thận GFR <30 ml/phút) hoặc ở những người nào cần đảo ngược hiệu quả kháng đông nhanh chóng, chẳng hạn như giai đoạn trước khi phẫu thuật hoặc chuyển dạ. UFH dự phòng được tiêm dưới da mỗi 12 giờ trong thai kỳ, liều 5.000 U là liều dự phòng tiêu chuẩn và có thể không phù hợp khi tuổi thai lớn dần và cần điều chỉnh liều theo tam cá nguyệt (5.000 đến 7.500 U trong tam cá nguyệt đầu, 7.500 đến 10.000 U trong tam cá nguyệt thứ hai và 10.000 U ở tam cá nguyệt thứ ba). Đối với LMWH dự phòng, hiện tại còn thiếu sự đồng thuận dựa trên bằng chứng liên quan đến chiến lược dùng thuốc tối ưu như enoxaparin 40 mg/mỗi ngày tiêm dưới da, điều chỉnh theo cân nặng (0,5 mg/kg tiêm dưới da 2 lần/ngày) hoặc liều trung gian (được định nghĩa là cao hơn liều dự phòng nhưng ít hơn liều điều trị) (Bảng 2).
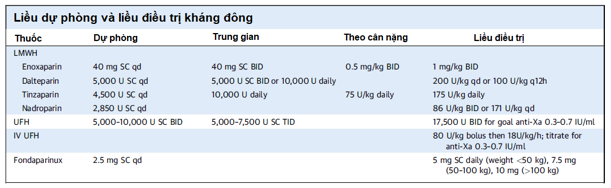
Bảng 2: Chiến lược liều dự phòng và liều điều trị kháng đông 10
BID=2 lần mỗi ngày; TID=3 lần mỗi ngày; qd=mỗi ngày; q12h=mỗi 12g; SC=tiêm dưới da
Một nghiên cứu ngẫu nhiên so sánh enoxaparin liều dự phòng với liều dựa trên cân nặng ở bệnh nhân béo phì (chỉ số khối cơ thể BMI ≥35 kg/m2) sau mổ lấy thai không cho thấy có sự khác biệt ý nghĩa về tỷ lệ biến cố VTE hoặc xuất huyết nặng. Các nghiên cứu không ngẫu nhiên khác so sánh các chiến lược dùng thuốc cũng không cho thấy sự khác biệt về hiệu quả hoặc độ an toàn giữa các liều khác nhau. Vì thế, các hướng dẫn khuyến cáo phải ngưng ít nhất 24 giờ giữa liều LMWH cuối cùng với thời điểm đặt catheter ngoài màng cứng nếu dùng liều cao hơn liều dự phòng (so với chỉ ngưng 12 giờ khi dùng liều dự phòng), và Hiệp hội Huyết học Hoa Kỳ (ASH-American Society of Hematology) khuyến cáo nên dùng LMWH liều dự phòng hơn là các chế độ liều khác. Khuyến cáo của ACCP (American College of Chest Physicians) và ACOG (American College of Obstetricians and Gynecologists) ủng hộ việc sử dụng cả 2 chế độ liều dự phòng và liều trung gian1,13. Hiện tại, một nghiên cứu ngẫu nhiên có đối chứng so sánh giữa LMWH liều dự phòng và liều hiệu chỉnh theo cân nặng ở những bệnh nhân có tiền sử VTE đang được tuyển mộ (NCT01828697).
Khi gần đến thời điểm chuyển dạ dự kiến, chiến lược chờ chuyển dạ tự nhiên kết hợp với ngừng sử dụng LMWH dự phòng tại thời điểm bắt đầu vào chuyển dạ sẽ có lợi hơn so với chiến lược sinh chủ động theo hoạch định kèm với việc ngừng thuốc từ 12 đến 24 giờ trước đó (12 giờ cho liều dự phòng; 24 giờ cho liều cao hơn). Tại sao như thế? Vì chuyển dạ tự nhiên ít bị các biến chứng ở mẹ và con hơn và cũng cần ít phương tiện can thiệp y khoa hơn. Ngoài ra 1 chọn lựa khác là chuyển LMWH sang UFH 2 lần/ngày từ khi thai 36 đến 37 tuần tuổi để cải thiện khả năng tiếp cận với gây tê ngoài màng cứng. Như chúng ta đã biết, phần lớn chảy máu khi chuyển dạ là thứ phát do tách nhau thai. Chảy máu sẽ được kiểm soát bởi co hồi cơ tử cung ngay sau tống xuất thai, làm tắc các mạch máu tử cung hơn là bởi các yếu tố đông máu (YT đông máu là đích nhắm của các điều trị kháng đông). Ngoài ra, chảy máu còn do rách mô mềm và chấn thương trong lúc chuyển dạ, yếu tố này thường lại nhạy với hiện diện điều trị kháng đông. LMWH dự phòng có thể tiếp tục lại từ 4 đến 12 giờ sau khi sinh và 4 giờ sau khi rút catheter ngoài màng cứng. Sau sinh, lợi ích của điều trị dự phòng kéo dài đến 6 tuần, sau thời điểm đó nguy cơ tuyệt đối giảm xuống <1/10.000, do đó có thể chấp nhận việc ngừng thuốc12,15.
- Chẩn đoán VTE như thế nào?
Điều quan trọng trong chẩn đoán là cần cân bằng giữa nguy hại của test chẩn đoán với nhu cầu cần xác định chẩn đoán để khởi trị VTE. Nhiều triệu chứng trong thai kỳ, chẳng hạn như phù chân và khó thở bị chồng lấp lên triệu chứng của VTE. Và các mô hình, thuật toán để tiên đoán nguy cơ mắc VTE sử dụng trên dân số không mang thai, như tiêu chuẩn Wells, điểm số Geneva sửa đổi và SimpliRED D-dimer vẫn chưa được xác thực trên dân số mang thai. Xét nghiệm D-dimer không đáng tin cậy chẩn đoán VTE trong thai kỳ vì bình thường chúng liên tục tăng và vượt quá giới hạn “loại trừ” trong tam cá nguyệt thứ hai và thứ ba. Điều này được giải thích là do sự gia tăng hoạt động của thrombin và tiêu sợi huyết, cũng như các hiện tượng bong nhau thai và tiền sản giật, góp phần làm giảm độ đặc hiệu của xét nghiệm này. Tuy nhiên, một nghiên cứu gần đây đã xem xét việc sử dụng D-dimer kết hợp với thuật toán với các dấu hiệu lâm sàng của DVT, ho ra máu và PE làm tăng khả năng cho chẩn đoán. PE đã được loại trừ an toàn ở 498 sản phụ, loại trừ 32% đến 65% trong số họ phải chụp mạch phổi cắt lớp vi tính (Computed Tomography Pulmonary Angiogram-CTPA), do đó đã giảm được bức xạ cho thai nhi10.
Để chẩn đoán DVT có triệu chứng ở phụ nữ có thai, siêu âm duplex tĩnh mạch là tiêu chuẩn chẩn đoán. Tuy nhiên, không giống như trên dân số chung 80% DVT là nằm ở bắp chân, phần lớn DVT trong thai kỳ nằm ở đoạn gần, liên quan đến các tĩnh mạch chậu (62%), và chỉ có 6% ở tĩnh mạch bắp chân. Vị trí sâu của các tĩnh mạch chậu đùi kết hợp với thai trong tử cung làm khó khăn cho việc khảo sát siêu âm duplex tĩnh mạch đè ép, và về mặt lý thuyết nó sẽ gây giảm độ nhạy và độ đặc hiệu của test chẩn đoán này. Để cải thiện độ chính xác trong chẩn đoán, chiến lược siêu âm tĩnh mạch lặp lại 3-7 ngày sau đó nên được khảo sát. Tuy nhiên 1 nghiên cứu trên sản phụ VTE có triệu chứng, siêu âm duplex tĩnh mạch hàng ngày được thực hiện trong 7 ngày liên tục. Trong số những sản phụ được xác nhận sau cùng có DVT, tất cả đều đã được ghi nhận ngay khi thực hiện siêu âm duplex tĩnh mạch đè ép ban đầu và điều này cho thông tin rằng ngay cả trong thai kỳ, siêu âm duplex cũng có độ nhạy tương đối thích hợp. Nếu nguồn lực sẵn có, chụp cộng hưởng từ là 1 lựa chọn hình ảnh khác đã được kiểm định tính đúng và có thể phát hiện DVT bụng vùng chậu gấp đôi khi được so sánh với siêu âm (98,5% so với 42,0%). Hạn chế của phương thức này là chi phí cao, khả năng tiếp cận, thời gian làm và thời gian cho kết quả MRI. Đó là về DVT, còn chẩn đoán PE trong thai kỳ thì sao?
Trong dân số chung, chẩn đoán PE phụ thuộc vào hình ảnh lồng ngực, bao gồm CTPA, chụp V/Q (pulmonary scintigraphy -V/Q scan) và chụp cộng hưởng từ mạch máu ngực (chest Magnetic Resonance Angiography-MRA). Sự phức tạp trong lựa chọn phương thức hình ảnh xác định chẩn đoán là vấn đề phơi nhiễm xạ và chất cản quang của mẹ và thai. Chụp CTPA và V/Q đều nhiễm xạ, tăng nguy cơ ung thư ở mẹ, đặc biệt ở vú, và còn tùy thuộc vào tuổi thai mà liều lượng bức xạ dùng có thể làm tăng nguy cơ chậm phát triển thai nhi, tật đầu nhỏ và khiếm khuyết trí tuệ sau này. Mức độ nhiễm xạ của mẹ với CTPA cao hơn so với quét V/Q, với liều ảnh hưởng và hấp thụ trung bình ở vú là 21 mSv và 44 mGy, so với 1,04 mSv và 0,28 mGy khi quét V/Q. Tuy nhiên, dữ liệu gần đây đã chỉ ra rằng các kỹ thuật hình ảnh hiện đại đã làm giảm mức độ phơi nhiễm bức xạ vú xuống thấp nhất đến 3-4 mGy và có tác động không đáng kể trên nguy cơ ung thư mẹ. Ngược lại, liều bức xạ với CTPA ở thai nhi thấp hơn chỉ tại mức 0,01 đến 0,66 mGy so với 0,1 đến 0,5 mGy khi quét V/Q và liều lượng trong cả 2 test chẩn đoán này đều dưới ngưỡng tích lũy tối đa được chấp nhận là 50 mGy9. Tuy nhiên quét V/Q thường không sẵn có và kết quả cũng khó xác định. Tỷ lệ âm tính giả khi quét V/Q và CTPA trong thai kỳ tương tự nhau ở mức tương ứng là 0,5% (KTC 95%: 0,2 – 1,3) và 0,4% (KTC 95%: 0,2 – 1,3). Một phân tích tổng hợp đánh giá độ nhạy của cả 2 test trong thai kỳ cho thấy độ nhạy trung bình là 83% cho CTPA và 100% cho quét V/Q, mặc dù cả hai đều có khoảng dao động từ 0 đến 100%. MRA có ưu điểm là không nhiễm xạ; tuy nhiên, dữ liệu trên động vật cho thấy phơi nhiễm gadolinium trong bào thai có thể gây các bất thường về phát triển xương và nội tạng của thai. Ngoài ra về mặt lý thuyết nó còn có mối quan ngại gây hại cho thai nhi do tác động của từ tính và xung tần số radio, mặc dù điều này chưa được chứng minh.
Tóm lại, dữ liệu an toàn của MRA chưa được biết rõ, mức độ phơi nhiễm bức xạ của thai nhi giữa CTPA và V/Q bằng nhau nhưng CTPA có khả năng tiếp cận lâm sàng thuận lợi hơn và cho kết quả nhanh hơn, nên CTPA là phương pháp hình ảnh có lợi nhất6,10,15.
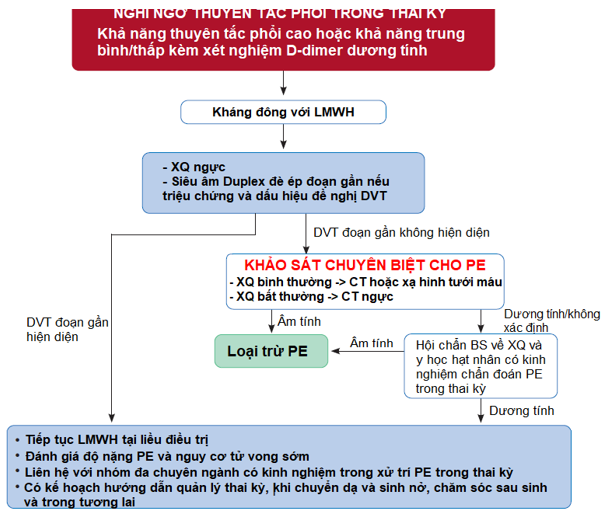
Nếu X-quang ngực bất thường, xem xét nguyên nhân khác.
DVT trong tĩnh mạch chậu có thể không được loại trừ bởi siêu âm đè ép (CUS). Nếu toàn bộ chân bị sưng, hoặc đau mông hoặc các triệu chứng gợi ý đến huyết khối vùng chậu xem xét chụp cộng hưởng từ để loại trừ DVT.
Kỹ thuật CT phải đảm bảo mức độ phơi nhiễm bức xạ của thai nhi rất thấp
Hình 3: Lưu đồ chẩn đoán và xử trí PE ở sản phụ theo ESC 20196
- Xử trí cần lưu ý gì?
Tất cả sản phụ được chẩn đoán VTE cần được điều trị kháng đông toàn thân. Đối với những bệnh nhân không dung nạp hoặc có chống chỉ định thuốc kháng đông, lưới lọc tĩnh mạch chủ dưới (IVC filter) có thể được xem xét.
Điều trị kháng đông
Thuốc kháng đông đường uống quen thuộc dùng lâu đời là kháng vitamin K (VKAs), thuốc này đi qua nhau thai và có liên quan đến những bệnh lý của thai được xác định rõ trong tam cá nguyệt đầu tiên. Sử dụng VKAs trong ba tháng giữa lại có thể gây xuất huyết ở thai và trẻ sơ sinh, cũng như bong nhau thai và nó còn có thể liên quan đến dị tật hệ thần kinh trung ương thai nhi trong tương lai. Thuốc NOAC thì bị chống chỉ định ở bệnh nhân mang thai. Chỉ còn LMWH và UFH là những thuốc kháng đông có nhiều bằng chứng nhất để điều trị VTE trong thai kỳ vì chúng làm giảm tỷ lệ tử vong và VTE tái phát. Ở phụ nữ không mang thai, khi so sánh với UFH, điều trị LMWH có hiệu quả tương đương về giảm VTE tái phát, nguy cơ chảy máu do mọi nguyên nhân và giảm nhiều hơn các biến chứng về huyết khối, chảy máu nặng và tử vong. Ngược lại với VKAs và NOAC, LMWH không đi qua nhau thai, và do đó không gây nguy cơ xuất huyết bào thai hoặc gây quái thai6,15Với những đặc điểm này, LMWH là điều trị kháng đông được ưu tiên trong thời kỳ mang thai ở những bệnh nhân có mức lọc cầu thận (GFR) > 30 ml/phút. Ở những người có GFR < 30 ml/phút, thì nên sử dụng UFH. Ở những bệnh nhân bị HIT, các hướng dẫn từ ACOG, ACCP và ASH khuyến cáo dùng LMWH vì nó không đi qua nhau thai. Fondaparinux cũng là một lựa chọn với bằng chứng không qua nhau thai nhưng khả năng gây hại thai nhi thì chưa rõ1,12,13. Do điều trị LMWH phải chích, gây đau và tăng chi phí, như vậy câu hỏi được đặt ra là có thể chuyển sang uống VKAs từ tam cá nguyệt thứ 2 được không? Nguyên tắc chung xử trí trong thai kỳ, lý tưởng là an toàn cho cả mẹ và thai, nhưng nếu không được cả 2 thì sẽ ưu tiên an toàn cho mẹ. Ở sản phụ mang van cơ học, chứng cứ cho thấy ‘VKAs an toàn cho mẹ, LMWH an toàn cho thai’ nên VKAs thường được chỉ định từ tam cá nguyệt thứ 2 cho đến tuần 36 của thai kỳ15. Còn trong bối cảnh VTE, LMWH đã có nhiều bằng chứng bảo vệ mẹ tốt hơn nên việc đánh đổi uống VKAs có tiềm năng gây các biến chứng trên thai cần phải cân nhắc kỹ và chia sẽ quyết định với bệnh nhân.
Liều điều trị UFH và LMWH sử dụng trong thai kỳ được trình bày trong bảng 2. UFH thường được bắt đầu bằng truyền tĩnh mạch liên tục và chuyển sang UFH tiêm dưới da hiệu chỉnh liều 2 lần/ngày, hoặc bắt đầu ngay lập tức với liều hiệu chỉnh 2 lần/ngày nhằm đạt aPTT hoặc mức anti-Xa trong ngưỡng trị liệu. Chiến lược về liều LMWH lý tưởng ở bệnh nhân mang thai còn hạn chế và hầu hết các khuyến cáo đều dựa trên dân số không mang thai, và điều này gây quan ngại về dược động học thay đổi trong thai kỳ. Trong 1 nghiên cứu chiến lược về liều LMWH 1 lần/ngày so với 2 lần/ngày ở bệnh nhân VTE không mang thai cho thấy không có sự khác biệt về nguy cơ VTE tái phát hoặc chảy máu. Các nghiên cứu trên bệnh nhân mang thai dùng liều đơn so với dùng 2 lần/ngày không cho thấy sự khác biệt về tỷ lệ chảy máu, nhưng đó chỉ là các nghiên cứu quan sát và cỡ mẫu rất nhỏ. Mặc dù có bằng chứng cho thấy 74%-91% bệnh nhân điều trị LMWH có nồng độ kháng Xa dưới ngưỡng trị liệu và thường phải tăng liều từ 10% đến 20% để đạt mức đích, nhưng việc theo dõi thường xuyên mức kháng Xa đã không được chứng minh là có lợi ích rõ ràng. Ngoài ra, một lượng lớn sản phụ (n> 35.000) qua theo dõi đơn trung tâm dùng LMWH liều hiệu chỉnh theo mức kháng Xa (mức đích cho hoạt tính đỉnh anti-Xa trong huyết tương là 0,5-1,0 IU/ml) so với LMWH được hiệu chỉnh theo cân nặng (tinzaparin 175 IU/kg x 1 lần/ngày). Kết quả cho thấy không tìm thấy sự khác biệt có ý nghĩa về liều LMWH trung bình, nguy cơ mất máu ở mẹ, hoặc biến cố thuyên tắc huyết khối tái phát giữa 2 nhóm. Tuy nhiên, việc theo dõi nồng độ anti-Xa là hữu ích ở bệnh nhân VTE tái phát, suy thận hoặc béo phì để đảm bảo nồng độ này nằm trong khoảng điều trị. Lưu ý là trong các trường hợp này, nồng độ anti-Xa đỉnh thường đạt được 4 đến 6 giờ sau khi dùng thuốc, và hiệu chỉnh liều để đạt mức 0,6-1,2 U/ml. Mức anti-Xa kiểm tra sau mỗi 4 đến 6 tuần hoặc sau khi có hiệu chỉnh liều.
Khi sản phụ sắp đến thời điểm sinh, BS lâm sàng có thể chọn chuyển từ LMWH loại dùng 1 lần/ngày sang loại dùng 2 lần/ngày, hoặc sang dùng UFH nhằm cho phép rút ngắn thời gian bán thải, ngăn ngừa tình trạng chuyển dạ trong điều kiện kháng đông hoàn toàn và cho phép sản phụ có thể tiếp cận được với tê trục thần kinh (tê tủy hoặc ngoài màng cứng). Những sản phụ được điều trị bằng LMWH, cần cân nhắc kỹ lưỡng việc sinh theo hoạch định vào khoảng tuần thứ 39 và phối hợp chăm sóc đa ngành. Trong các tình huống nguy cơ cao, như ở những bệnh nhân có PE gần đây, LMWH có thể chuyển sang truyền UFH liên tục ≥36 giờ trước khi sinh và UFH được ngừng 4-6 giờ trước khi sinh nhằm bình thường hóa thời gian aPTT hoặc mức anti-Xa10,15.
Ở sản phụ có nguy cơ thấp, đang điều trị bằng LMWH hoặc những người đang được điều trị dự phòng liều cao, nên bỏ qua liều LMWH buổi tối và tiến hành khởi phát chuyển dạ hoặc sinh mổ vào sáng hôm sau, với gây tê trục thần kinh bắt đầu ≥ 24 giờ sau liều LMWH cuối cùng.
Điều trị kháng đông có liên quan đến tăng nguy cơ xuất huyết sau sinh, vì vậy giai đoạn ba của cuộc chuyển dạ nên luôn được điều trị tích cực bằng oxytocin với liều hiệu chỉnh. Việc bổ sung oxytocin không liên quan đến bất kỳ sự thay đổi lớn nào về tim mạch, nhưng sẽ giúp lượng máu mất đi thấp hơn đáng kể. Trong 1 nghiên cứu hồi cứu đơn trung tâm, sản phụ được chuyển từ LMWH dùng ngày 1 lần sang dạng điều chỉnh theo cân nặng 2 lần/ngày ở tuần thứ 37. Ở những người ngừng kháng đông khi bắt đầu chuyển dạ tự nhiên, có xu hướng (OR: 1,9; KTC 95%: 0,6-5,8; p = 0,29) tăng nguy cơ xuất huyết sau sinh (> 500 ml) so với những người sinh theo hoạch định và được ngưng thuốc kháng đông trước đó 24 giờ. Đối với sinh ngã âm đạo, sản phụ dùng LMWH có nguy cơ xuất huyết sau sinh (> 500 ml) cao hơn 1,9 lần (KTC 95%: 1,1-3,5; p = 0,029) so với những phụ nữ không điều trị LMWH, nhưng không có sự khác biệt có ý nghĩa trên tiêu chí xuất huyết hậu sản nặng (> 1.000 ml) và không có sự khác biệt có ý nghĩa về nguy cơ xuất huyết sau sinh ở bệnh nhân mổ lấy thai (OR: 2,9; KTC 95%: 0,5-19,4; p = 0,26)10,15.
Sau khi sinh, LMWH hoặc UFH có thể bắt đầu lại 24 giờ sau khi rút catheter ngoài màng cứng, 6 đến 12 giờ sau khi sinh ngã âm đạo, hoặc 12 đến 24 giờ sau khi mổ lấy thai, nếu không có chảy máu. Vì nguy cơ VTE lên đến đỉnh điểm ở 2 tuần sau sinh, điều trị kháng đông nên tiếp tục ít nhất 6 tuần sau sinh và lý tưởng là 3 tháng. Độ dài thêm của điều trị phụ thuộc vào nguyên nhân nền của VTE6,15.
Trong thời kỳ hậu sản, sản phụ cho con bú có thể tiếp tục dùng kháng đông trước sinh như LMWH hoặc UFH, hoặc chuyển sang warfarin hoặc fondaparinux. Dữ liệu còn hạn chế về tính an toàn và tác dụng phụ của VKAs trên chảy máu trẻ sơ sinh, thuốc này đã được chứng minh là an toàn qua các nghiên cứu quan sát, với lượng thuốc không phát hiện được hoặc rất thấp trong sữa mẹ, có thể do kích thước phân tử, điện tích, dạng ưa mỡ, và tính sinh khả dụng qua đường uống. Thuốc NOAC không được khuyến cáo vì chưa được nghiên cứu rộng rãi trong thai kỳ và dữ liệu an toàn còn chưa được thiết lập10,15.
Lưới lọc TM chủ dưới (IVC filter)
Những bệnh nhân bị VTE khi đang điều trị nội khoa đã đủ liều hoặc có chống chỉ định kháng đông, đặt lưới lọc là một lựa chọn. Đặt lưới lọc chủ yếu được thực hiện dưới màn soi huỳnh quang, và mức độ phơi nhiễm bức xạ lên thai nhi được cho là không đáng kể theo Ủy ban Bảo vệ Phóng xạ Quốc tế. Chưa có ghi nhận về việc đặt lưới lọc dưới hướng dẫn của siêu âm nội mạch ở người mang thai, nhưng đó cũng có thể là một lựa chọn để loại bỏ phơi nhiễm bức xạ. Về mặt thủ thuật có thể tiếp cận qua đường cảnh hoặc đường đùi mà không có sự khác biệt về độ an toàn hoặc ảnh hưởng đến thai kỳ7.
Trong 1 tổng quan hệ thống ghi nhận, lưới lọc TM chủ dưới dường như không làm tăng đáng kể bệnh suất hoặc tử suất thai nhi, nhưng có liên quan đến bệnh suất ở mẹ 8,8%-11,3%, tần suất này cũng tương tự như tỷ lệ biến chứng trên dân số không mang thai. Các biến chứng được ghi nhận bao gồm: dọa sinh non ngay sau thủ thuật (có thể cải thiện bằng thuốc giảm co), tụ máu sau phúc mạc và phù chân thoáng qua. Một số nghiên cứu khác đã báo cáo các biến chứng của lưới lọc về sự dịch chuyển, nghiêng, gãy và co hồi, điều này liên quan đến sự giãn nở tĩnh mạch khi chuyển dạ, co bóp và những thay đổi về đường kính TM chủ dưới. Với những đặc điểm này, sinh mổ sẽ thích hợp hơn cho sản phụ có lưới lọc TM chủ dưới. Điều quan trọng cần lưu ý là hiện tại chúng ta còn thiếu dữ liệu liên quan đến độ an toàn lâu dài của đặt lưới lọc TM chủ dưới nói chung. Theo đó, việc đặt lưới lọc chỉ nên dành riêng cho những bệnh nhân có chống chỉ định với liệu pháp kháng đông7.
Điều trị nâng cao
Các điều trị như tiêu sợi huyết hoặc lấy huyết khối qua catheter (Catheter Directed Thrombolysis-CDT), có thể được xem xét ở những bệnh nhân bị DVT đoạn gần có đe dọa chi với 2 biểu hiện là viêm TM trắng đau (Phlegmasia Alba Dolens-PAD) còn gọi “chân sữa-milk leg” hoặc viêm TM xanh đau (Phlegmasia Cerulean Dolens-PCD). PE massive đe dọa tính mạng (huyết áp tâm thu dai dẳng <90 mm Hg trong ít nhất 15 phút hoặc cần hỗ trợ inotrop) thường cần các điều trị nâng cao, bao gồm tiêu sợi huyết toàn thân, tiêu sợi huyết qua catheter-CDT, phẫu thuật lấy huyết khối, lấy huyết khối qua catheter, hoặc ECMO (ExtraCorporeal Membrane Oxygenation). Việc dùng những điều trị này cũng có thể được xem xét ở những bệnh nhân có PE submassive (không tụt HA, nhưng hoặc bị rối loạn chức năng thất phải hoặc hoại tử cơ tim)3,5,11.
Điều trị qua catheter-CDT
CDT là một lựa chọn tiếp cận qua da (không phẫu thuật) với mục đích đưa thuốc TSH trực tiếp vào mạch máu tổn thương mà cần hoặc không cần có sự hỗ trợ siêu âm (EKOS, Boston Scientific Company, Marlborough, Massachusetts). Trong một nghiên cứu trên 11 phụ nữ mang thai bị DVT được điều trị bằng phương pháp CDT dược cơ học, 9 phụ nữ (đạt > 90%) có ly giải cục máu đông và không có biến chứng nặng hoặc hội chứng hậu huyết khối tại thời điểm điều trị và qua theo dõi trung vị 20 tháng. Mặc dù hầu hết phụ nữ chọn bỏ thai sau điều trị nhưng 3 trong số 11 người vẫn mang thai đủ tháng và sinh nở thành công. Trong một nghiên cứu khác trên 11 phụ nữ bị DVT vùng chậu đùi được điều trị bằng CDT và/hoặc thuốc tiêu sợi huyết dược cơ học, tất cả đều có thông tĩnh mạch gần hoặc hoàn toàn sau khi điều trị, sinh ra những đứa trẻ đủ tháng, khỏe mạnh. Liều bức xạ có khác nhau, nhưng số ít các trường hợp cho thấy mức độ phơi nhiễm của thai nhi vượt quá giới hạn tối đa được chấp nhận. Theo đó, CDT không được khuyến cáo sử dụng thường quy và nên tránh trong tam cá nguyệt đầu tiên, chỉ dành cho trường hợp bị đe dọa tính mạng/chi hoặc thất bại điều trị nội khoa trong tam cá nguyệt thứ hai và thứ ba.
Ở bệnh nhân PE, các nghiên cứu chỉ ra rằng CDT làm giảm tỷ số thất phải/thất trái nhanh hơn và có ý nghĩa hơn so với chỉ dùng kháng đông. Dữ liệu về lợi ích lâu dài của CDT còn thiếu vì các nghiên cứu quan sát cho thấy không có lợi ích lâu dài về chức năng thất phải hoặc tử vong. Thêm vào đó, CDT có liên quan với nguy cơ chảy máu cao hơn và không có nghiên cứu nào bao gồm cả phụ nữ có thai5,6.
Tiêu sợi huyết toàn thân
Tiêu sợi huyết toàn thân như alteplase và tenecteplase nhằm thủy phân các phân tử fibrin. Các thuốc này cải thiện nhanh hơn huyết động, triệu chứng và xác suất sống sót của bệnh nhân đồng thời giảm không ý nghĩa tổn thương thất phải (RV) và PE tái phát. Tuy nhiên, như được mô tả trong các tổng quan hệ thống và phân tích tổng hợp, những lợi ích quan sát chung này lại đi kèm với tăng đáng kể nguy cơ chảy máu nặng (OR: 2,91; KTC 95%: 1,95-4,36) và xuất huyết nội sọ hoặc tử vong (OR: 3,18; KTC 95%: 1,25-8,11)3,10.
Trong thai kỳ, alteplase không đi qua nhau thai với số lượng đủ để gây ra rối loạn đông máu ở thai nhi. Một tổng quan hệ thống các nghiên cứu ở sản phụ trước và sau sinh có điều trị bằng tiêu sợi huyết toàn thân ghi nhận tỷ lệ sống sót của bà mẹ lên đến 94% (KTC 95%: 86%-98%), nhưng có 28,4% (KTC 95%: 19%-40%) nguy cơ chảy máu nặng ở mẹ, chủ yếu xảy ra giai đoạn sau sinh do xuất huyết âm đạo hoặc chảy máu ổ bụng sau mổ lấy thai5. Tử vong thai nhi hoặc trẻ sơ sinh trước, trong hoặc ngay sau khi dùng thuốc tiêu sợi huyết được báo cáo là 12% trong khi đó 35,1% sản phụ được điều trị thuốc tiêu sợi huyết được ghi nhận gây sinh non (150). Tuy nhiên dựa vào thời điểm xảy ra những biến cố này cho thấy thai chết lưu có thể liên quan nhiều đến những thay đổi huyết động học được gây ra bởi PE hơn là do chính bản thân điều trị thuốc tiêu sợi huyết5,6.
Các điều trị nâng cao khác
Lấy huyết khối qua da (hút huyết khối, phân mảnh huyết khối qua catheter, hoặc khoan cắt huyết khối), phẫu thuật lấy huyết khối và ECMO là những điều trị xâm lấn thêm vào trên những bệnh nhân PE massive hoặc submassive không cải thiện với điều trị tiêu sợi huyết hoặc bị chống chỉ định. Trong một báo cáo về 7 phụ nữ mang thai được điều trị bằng lấy huyết khối qua da, tỷ lệ sống của mẹ là 86,1% (KTC 95%: 71%-95%), nguy cơ chảy máu nặng là 20% (KTC 95%: 1% -72%), và nguy cơ tử vong thai là 25% (KTC 95%: 1%-81%) . Phẫu thuật lấy huyết khối có kết quả tốt nhưng phụ thuộc rất nhiều vào chuyên môn tại địa phương và sự sẵn có của máy tim phổi nhân tạo. Trong một báo cáo khác trên 21 bệnh nhân trước và sau sinh, 93,8% có cải thiện huyết động đáng kể. Tỷ lệ sống sót của mẹ là 86,1% (31 trên 36) với 2 ca tử vong xảy ra sau phẫu thuật và 3 ca tử vong do thiếu oxy não liên quan đến biến cố cấp tính5,10. Chảy máu nặng xảy ra 20% và thai chết lưu 20% trong các trường hợp. Dữ liệu về việc sử dụng ECMO trong thai kỳ chủ yếu được giới hạn trong hội chứng suy hô hấp cấp với các báo cáo chỉ trong trường hợp PE massive, tất cả đều cho thấy tỷ lệ sống sót của mẹ cao mà không bị chảy máu nặng, nhưng ý nghĩa của kết luận này bị hạn chế bởi số trường hợp đánh giá còn ít và ECMO cũng phụ thuộc rất nhiều vào đội ngũ và ekip được huấn luyện.
- KẾT LUẬN
VTE liên quan đến thai kỳ là nguyên nhân hàng đầu gây bệnh suất và tử suất ở mẹ. Các dữ liệu cung cấp bằng chứng hiện tại còn rất ít, chủ yếu là báo cáo loạt ca. Những thay đổi sinh lý bình thường trong thai kỳ có yếu tố tăng đông, làm tăng nguy cơ nền do vậy cần phân tầng nguy cơ nhằm xác định những sản phụ có lợi ích lớn nhất từ chiến lược dự phòng. Đối với sản phụ đã có biểu hiện lâm sàng của VTE, chiến lược tiếp cận chẩn đoán cần phải xem xét cả 2 tác động lên mẹ và thai. Bên cạnh đó cần lưu ý thay đổi khả năng diễn giải xét nghiệm (liên quan đến độ nhạy/độ đặc hiệu) khác hơn so với dân số không mang thai. Một khi VTE đã được chẩn đoán, chọn chế độ kháng đông cần phải dựa trên tuổi thai, nguy cơ biến chứng của mẹ và thai quanh cuộc chuyển dạ. Nhiều liệu pháp điều trị xâm lấn tiến bộ khác nhau có thể cứu sống sản phụ, nhưng nguy cơ bệnh tật và tử vong thai nhi vẫn còn là điều đáng quan ngại. VTE thai kỳ đã đưa ra nhiều thách thức đặc biệt, yêu cầu BS lâm sàng phải tiếp cận đa phương diện, phối hợp đa ngành, trên nền các khuyến cáo lấy bệnh nhân làm trung tâm để cùng chia sẽ quyết định nhằm đưa ra chiến lược chăm sóc toàn diện nhất.
TÀI LIỆU THAM KHẢO CHÍNH
- ACOG (2018), “Thromboembolism in pregnancy Obstet Gynecol. “, Practice Bulletin No 196, 132, pp.e1-e17.
- Brett J. Carroll, Gregory Piazza (2020), “Venous Thromboembolic Disease”, Vascular Medicine – A Companion to Braunwald’s Heart Disease – 3rd edition.
- C. Marti, G. John et al (2015), “Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis”, Eur Heart J, 36, pp.605-14.
- CDC (2020), “Pregnancy Mortality Surveillance System – Center for Disease Control and Prevention.”, pp.www.cdc.gov.
- G. Martillotti, F. Boehlen et al (2017), “Treatment options for severe pulmonary embolism during pregnancy and the postpartum period: a systematic review”, J Thromb Haemost, 15, pp.1942-50.
- Konstantinides SV, Meyer G et al (2019), “2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS).”, Eur Heart J, 41, pp.543-603.
- L. Duffett, Carrier M (2017), “Inferior vena cava filters”, J Thromb Haemost, 15, pp.3-12.
- M. Sennstrom, K. Rova et al (2017), “Thromboembolism and in vitro fertilization – a systematic review”, Acta Obstet Gynecol Scand, 96, pp.1045-52.
- N.A. Ntusi, P. Samuels et al (2016), “Diagnosing cardiac disease during pregnancy: imaging modalities”, Cardiovasc J Afr, 27, pp.95-103.
- Nichols KM (2020), “Venous Thromboembolism Associated With Pregnancy”, J Am Coll Cardiol, 76, pp.2128-41.
- P. Devis, M.G. Knuttinen (2017), “Deep venous thrombosis in pregnancy: incidence, pathogenesis and endovascular management”, Cardiovasc Diagn Ther, 7, pp.S309-S19.
- S.M. Bates, A. Rajasekhar et al (2018), “American Society of Hematology 2018 guidelines for management of venous thromboembolism: venous thromboembolism in the context of pregnancy”, Blood Adv, 2, pp.3317-59.
- S.M. Bates, I.A. Greer et al (2012), “VTE, thrombophilia, antithrombotic therapy, and pregnancy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines”, Chest, 141, pp.e691s-e736s.
- S.M. Bates, S. Middeldorp et al (2016), “Guidance for the treatment and prevention of obstetric-associated venous thromboembolism “, J Thromb Thrombolysis, 41, pp.92-128.
- Vera Regitz-Zagrosek, JolienW. Roos-Hesselink (2018), “ESC Guidelines for the management of cardiovascular disease during pregnancy”, European Heart Journal.







