Lời ngỏ
Suy van tĩnh mạch xảy ra với tần suất cao, nhất là ở người cao tuổi do tình trạng lão hóa các lá van cũng như do thoái triển của thành tĩnh mạch, kèm theo đó là nhiều yếu tố mắc phải như thời gian sống và hoạt động kéo dài, đứng hoặc ngồi lâu, mang vác vật nặng, béo phì, thai kỳ, tiền căn huyết khối tĩnh mạch và cũng thường gặp do yếu tố di truyền từ gia đình.
Trích từ International Angiology 2014, vol. 33, No. 2; 126-139
Người dịch: BSCK 2 Trần Công Quyền
Trưởng khoa lồng ngực, mạch máu, bướu cổ – Bệnh viện Bình Dân, thành phố Hồ Chí Minh
Hiệu Đính: PGS. TS. BS. Nguyễn Văn Trí
Chủ tịch Hội Lão Khoa Hồ Chí Minh
Các thuốc trợ tĩnh mạch (Venoactive drugs: VADs) tuy đang được sử dụng rộng rãi nhưng hiểu biết của chúng ta thật sự chưa tương xứng cả về chẫn đoán lẫn điều trị. Do vậy, việc cập nhật hiểu biết về VADs sẽ giúp ích rất lớn trong việc điều trị suy van tĩnh mạch mạn tính. Trân trọng giới thiệu cùng quý đồng nghiệp về một tổng quan đã
được đăng tải trong tạp chí International Angiology, tháng 4 năm 2014.
Giới thiệu
Thuốc trợ tĩnh mạch bao gồm nhiều nhóm thuốc, một số
được tổng hợp nhưng đa số có nguồn gốc từ thực vật. Gần
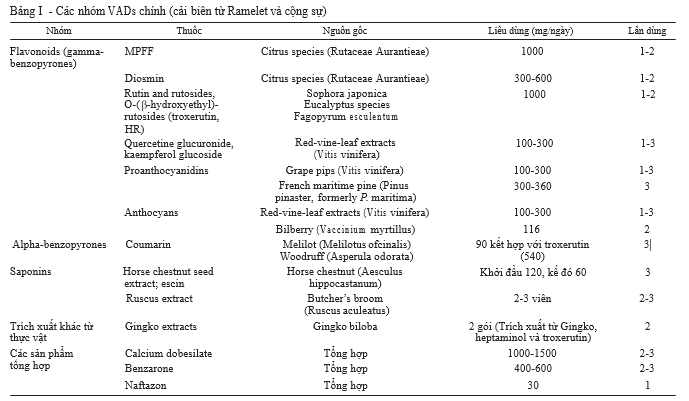
đây, có năm nhóm thuốc đã được mô tả trong các ấn phẩm1, 2, nguồn gốc và liều dùng được tóm tắt trong bảng I.
Các VADs thường ở dạng hỗn hợp; thí dụ, thuốc trích xuất từ măng tây được đưa ra thị trường là hỗn hợp từ măng tây (ruscus aculeatus), hesperidine (trong vỏ trái có múi như cam chanh), methyl chalcone (một loại men) và ascorbic acid (vitamin C). Cũng như vậy các flavonoid phân đoạn được tinh chế và vi hạt hóa (micronised purified flavonoid fraction: MPFF) là một hỗn hợp được vi hạt hóa của diosmin (90%) và các flavonoid (bao gồm hesperidin, diosmetin, linarin, isorhoifolin: 10%) hoặc trích xuất từ cây bạch quả (gingko biloba) được pha trộn với heptaminol và troxerutin.
Một số thực phẩm chức năng (dietary supplements),
được cho là có tác dụng điều trị, đã tạo ra một số nhầm lẫn trong những năm gần đây. Thực phẩm chức năng, không giống như những thuốc điều trị suy tĩnh mạch đã
được đăng ký, chưa cho thấy được hiệu quả và do đó chưa được các nhà thẩm quyền y tế cấp phép khi đưa ra thị trường. Vì những lý do trên, chúng tôi sẽ không xem xét đến các thực phẩm chức năng trong bài viết này. Tuy nhiên, một số VADs mô tả ở đây được xem là thuốc ở một số quốc gia nhưng lại là thực phẩm dinh dưỡng (food supplements) ở các quốc gia khác. Thí dụ, chất trích xuất từ lá nho đỏ (Vitis vinifera) được ghi nhận là thuốc điều trị ở bảy quốc gia thành viên Liên minh Châu
Âu (EU), nhưng lại là thực phẩm chức năng ở tám quốc gia khác cũng thuộc EU.
Trong bài báo này, chúng tôi sẽ tóm lược các tác dụng dược lý khác nhau của VADs và sự phát triển của các khuyến cáo trong việc sử dụng thuốc. Cuối cùng chúng tôi sẽ trình bày một loạt khuyến cáo mới dựa trên các bằng chứng hiện có. Điềm nổi bật xuyên suốt bài báo này là những tiến bộ gần đây trong phòng thí nghiệm và trên lâm sàng đã làm thay đổi hiểu biết của chúng ta về tác dụng cũng như cách sử dụng VADs. Song song đó, chúng tôi cũng tổng hợp các khuyến cáo trước đây nhằm có được cái nhìn toàn diện, bao quát hơn về vấn đề này.3
Cơ chế tác dụng
Mặc dù chúng ta chưa hiểu hết về cơ chế tác dụng của các VADs nhưng rõ ràng là, VADs có tác dụng trên cả hệ thống tuần hoàn lớn và hệ thống vi tuần hoàn. Chúng tác
động lên những thay đổi tại van và thành tĩnh mạch, gây
nên tăng áp lực tĩnh mạch – venous hypertension (VH), nhờ vậy làm giảm bớt bệnh lý vi tĩnh mạch. Chính tình trạng tăng áp lên các mạch máu nhỏ là nguyên nhân dẫn
đến bệnh lý vi tuần hoàn tĩnh mạch.4-6 Trước đây, người
ta cho rằng, tình trạng tăng áp lực tĩnh mạch là hậu quả trực tiếp từ sự khiếm khuyết của van tĩnh mạch. Điều này xảy ra do sự dãn quá mức của tĩnh mạch bởi sự suy yếu của thành tĩnh mạch và/hoặc của trương lực tĩnh mạch. Kết quả là, nhiều nghiên cứu lúc bấy giờ đã tập trung vào tác động của VADs trên trương lực tĩnh mạch. Gần đây hơn, xu hướng nghiên cứu lại nghiêng về tác dụng của VADs lên quá trình viêm mạn tính trên van và các tĩnh mạch lớn cũng như nhỏ.
Tác dụng trên trương lực tĩnh mạch
Hầu hết các nhóm VADs chính đều cho thấy tác dụng làm tăng trương lực tĩnh mạch, bao gồm MPFF,7-9 rutin và rutosides,10 escin,11 trích xuất măng tây12 và calcium dobesilate.13 Hầu hết các loại thuốc tác động bằng cách
điều chỉnh lại tín hiệu thuộc hệ noradrenaline, giảm chuyển hóa norepinephrine như trong trường hợp của MPFF và hydroxyethyl-rutosides,7, 8, 14-16 hoặc bằng cách đồng vận với thụ thể giao cảm á1 (á1-adrenergic) trên thành tĩnh mạch như trong trường hợp sử dụng trích xuất măng tây.17, 18 Ngược lại, thuốc trích xuất từ hạt dẻ ngựa (horse chestnut) lại khởi phát co mạch trên tĩnh mạch chủ của chuột theo cơ chế phụ thuộc canxi nhưng lại ức chế tác dụng của phenylephrine – một đồng vận của thụ thể giao cảm á (á-adrenergic).19
Tác dụng trên quá trình viêm của van và thành tĩnh mạch
Hầu hết VADs đã được chứng minh có hoạt tính kháng viêm. Một số có tác dụng trên nhiều giai đoạn của quá trình viêm và khả năng kháng viêm của các loại thuốc này có lẽ là yếu tố chính giải thích cho tác dụng có lợi của VADs trong điều trị suy tĩnh mạch mạn tính (CVD). Nhóm flavonoids được biết đến như một nhóm chất có
hoạt tính chống oxy hóa (antioxidant) tiềm năng và
đã được nghiên cứu trên nhiều lĩnh vực điều trị khác nhau ngoài vấn đề suy tĩnh mạch mạn tính, có thể kể đến ung thư, viêm khớp và tim mạch.20-24
Những hoạt tính này bao gồm việc ngăn ngừa sản xuất các chất oxy hóa, tăng cường việc thải bỏ các gốc tự do để từ đó ngăn chặn chúng tấn công vào các tế bào đích, chặn đứng sự lan rộng của các phản
ứng oxy hóa, và vì vậy tăng cường khả năng chống
oxy hóa vốn có của tế bào.24 Cụ thể, thuốc MPFF và rutosides có khả năng thải bỏ rất mạnh các gốc tự do trên nhiều hệ thống thử nghiệm25-28. VADs ở các nhóm khác như escins,11, 29 proanthocyanidines từ hạt nho,30, 31 vỏ cây thông biển Pháp (French maritime pine),32-35 và calcium dobesilate,36-38 cũng cho thấy tác dụng tương tự.
Cùng với tác dụng giảm stress oxy hóa, một vài VADs còn có tác dụng trên nhiều vị trí của quá trình viêm. Lấy thí dụ, proanthocyanidin từ hạt nho làm giảm sự biểu hiện của các phân tử gây kết dính tế bào bằng tế bào nội mô của những tĩnh mạch đã được cấy và hoạt hóa39. MPFF làm giảm sự biểu hiện của các phân tử gây kết dính bằng các bạch cầu hạt và bạch cầu đơn nhân ở những bệnh nhân có suy tĩnh mạch mạn tính.40, 41
Tương tự, rutosides làm giảm biểu hiện của gen liên quan đến quá trình viêm bằng các đại thực bào đã được hoạt hóa,42 và chất trích xuất vỏ cây thông biển Pháp làm giảm sự biểu hiện gen ICAM-1 cũng như làm giảm sự kết dính của lympho T được cấy lên tế bào sừng ở người (keratinocytes).43
Bằng phương pháp gây tăng áp lực tĩnh mạch trên loài gặm nhấm, Bergan và cộng sự44 đã đưa ra những phân tích chi tiết và bao quát nhất về tầm quan trọng của quá trình viêm cũng như khả năng kháng viêm của VADs. Trong thực nghiệm làm thuyên tắc tĩnh mạch, các chất chỉ điểm quá trình viêm (ví dụ như chất đánh dấu sự di chuyển và kết dính của bạch cầu) tăng cao ngay sau một giờ xuất hiện tăng áp lực tĩnh mạch. Trong những thí nghiệm có liên quan đến tạo ra dò động tĩnh mạch, dòng máu phụt ngược qua van dưới áp lực tĩnh mạch cao
được ghi nhận sau 7 ngày và gia tăng đáng kể ở ngày thí
nghiệm thứ 21 và 42. Những thay đổi về hình thái của van tiến triển song song trong suốt khoảng thời gian này, sau đó cấu trúc van hoàn toàn biến mất ở ngày 42.
Điều trị với MPFF đường uống, tùy theo liều sử dụng, cho thấy đã làm giảm các dấu hiệu viêm và làm giảm
đáng kể dòng máu phụt ngược.
Những thí nghiệm này đã nhấn mạnh vị trí trung tâm của quá trình viêm trong nhiều tác động bất lợi của tình trạng tăng áp lực tĩnh mạch, và cũng chỉ ra rằng, các thuốc trợ tĩnh mạch như MPFF ít nhất có tiềm năng ngăn ngừa sự tiến triển của suy tĩnh mạch mạn tính cũng như các thể lâm sàng khác của nó.
Tác dụng trên tính thấm mao mạch (hiện tượng phù)
Việc kiểm soát tính thấm vi mạch rất phức tạp và hiện vẫn còn là một lĩnh vực đang được nghiên cứu. Tuy nhiên, rõ ràng là, hiện tượng tăng tính thấm và dẫn đến phù sau đó không chỉ được kích hoạt bởi sự tăng áp lực vi mạch. Cụ thể hơn, những nghiên cứu gần đây đã nêu bật lên vai trò của cơ chế viêm trong việc hình thành hiện tượng tăng tính thấm. Cơ chế này liên quan đến sự tương tác giữa bạch cầu đa nhân và tế bào nội mô, bao gồm sự kích hoạt, kết dính, kết tập và giải phóng những phân tử oxy phản ứng45-49. Với tác dụng chống oxy hóa và kháng viêm, nhiều nhóm VADs chính như MPFF50-52, rutosides53-55, escin11, 56, chiết xuất măng tây57-59, chiết xuất hạt nho31 và calcium dobesilate60, 61 đã cho thấy hiệu quả trong việc làm giảm tình trạng tăng tính thấm mao mạch.
Yếu tố tăng trưởng nội mô mạch máu (VEGF) được biết
đến như một yếu tố then chốt trong việc điều hòa tính thấm mao mạch62, 63. Nồng độ VEGF tăng cao trong huyết tương của những bệnh nhân suy tĩnh mạch mạn tính, đặc biệt là những đối tượng có sự biến đổi cấu trúc da64-66. Điều trị với MPFF làm giảm rõ rệt nồng độ VEGF huyết tương ở những bệnh nhân này và do đó, nồng độ VEGF huyết tương đã được đề nghị trở thành chất chỉ điểm đánh giá hiệu quả của liệu trình điều trị bằng MPFF65.
Những thay đổi da liên quan đến bất thường mao mạch
Trong suy tĩnh mạch mạn tính, hiện tượng tăng áp lực tĩnh mạch kéo dài dẫn đến quá trình viêm mạn tính và
được xem như một yếu tố quan trọng của tình trạng thay
đổi cấu trúc da67, 68. Sự phát tán các phân tử kết dính nội mô có thể dẫn đến sự tẩm nhuận bạch cầu quanh mạch máu. Điều này dẫn tới sự tái cấu trúc và hủy hoại mô da qua trung gian nguyên bào sợi thông qua hiện tượng tăng sinh mạch máu và xơ hóa65, 69-71. Cùng với sự lão hóa nguyên bào sợi, tình trạng tăng stress oxy hóa kéo dài mà chủ yếu do sự giải phóng những phân tử oxy phản ứng từ bạch cầu đa nhân và đại thực bào, được cho là nguyên nhân chính dẫn đến việc hình thành các ổ loét tĩnh mạch hoạt động mạn tính ở chân68, 72-75.
Việc gia tăng nhận thức về tầm quan trọng của van tĩnh mạch ở các tĩnh mạch nhỏ và tĩnh mạch cận mao mạch thúc đẩy nhu cầu tìm hiểu về cơ chế biến đổi tổ chức dưới da. Hiện nay người ta phát hiện ra những tĩnh mạch nhỏ nông chi dưới chứa một lượng lớn các van hai lá
điển hình, tập trung chủ yếu ở những mạch máu có
đường kính nhỏ hơn 100 µm và luôn hiện diện ở những mạch máu có đường kính ở khoảng 18 µm76, 77. Một nghiên cứu gần đây đã chỉ ra rằng, sự mất chức năng của các van tĩnh mạch nhỏ nông có thể xảy ra độc lập với dòng máu phụt ngược trong tĩnh mạch hiển lớn cũng như các nhánh nhỏ của nó. Quan trọng hơn, sự thoái hóa và suy giảm chức năng van trong những vi mạch này gây ra hiện tượng phụt ngược máu vào mạng lưới tĩnh mạch trong da. Điều này dẫn đến những biến đổi nghiêm trọng về cấu trúc da trên những bệnh nhân suy tĩnh mạch mạn tính78.
Như đã chứng minh với các thí nghiệm ở trên về tăng áp lực tĩnh mạch trên loài gặm nhấm44, hiệu quả kháng viêm và giảm stress oxy hóa của VADs có thể bảo vệ các van tĩnh mạch nhỏ và ngăn chặn dòng máu phụt ngược, đồng
thời các thuốc này cũng có tác dụng ngăn chặn sự hình thành các vết loét triển ở những bệnh nhân suy tĩnh mạch mạn tính bằng cách ngăn cản quá trình tái cấu trúc mô da.
Vai trò của thụ thể cảm giác trong hình thành các triệu chứng của tĩnh mạch
Hầu hết các nghiên cứu gần đây đã chỉ ra rằng, tần suất và độ nặng của triệu chứng suy van tĩnh mạch mạn tính tăng đồng thời với độ nghiêm trọng của bệnh hoặc với phân độ lâm sàng CEAP79-83. Tuy nhiên, một vài nghiên cứu khác lại cho rằng, mối tương quan này rất lỏng lẻo84,85, hay nói cách khác, những đối tượng suy van tĩnh mạch mạn tính nhẹ nhưng lại mang điểm số đánh giá cao86. Một yếu tố gây nhiễu có thể gặp phải là sự xuất hiện đồng thời bệnh lý thần kinh ngoại biên ở một vài bệnh nhân suy van tĩnh mạch mạn tính nặng, bởi vì cảm nhận đau và một vài triệu chứng khác của bệnh có thể bị suy giảm87-89. Một điều rõ ràng là, các triệu chứng suy van tĩnh mạch mạn tính điển hình ở chân rất thường gặp ngay cả ở những thể nhẹ nhất của bệnh (điểm lâm sàng CEAP
0s và 1)90-92. Trong một mẫu dân số ngẫu nhiên ở Edin-
burgh, Scotland, độ tuổi từ 18 đến 64 và không quan sát hay sờ được những dấu hiệu của suy tĩnh mạch mạn tính, người ta ghi nhận có 32.8% đối tượng có triệu chứng đau
chân và 28.9% xuất hiện chuột rút91. Báo cáo gần đây của Vein Consulting Program (VCP) – một nghiên cứu đoàn hệ lớn đã được thực hiện với trên 90,000 bệnh nhân điều trị ngoại trú từ 20 quốc gia đều được tầm soát bệnh suy tĩnh mạch mạn tính khi khám ở bác sĩ đa khoa – ghi nhận có 19.7% bệnh nhân có triệu chứng cơ năng ở chân điển hình của suy van tĩnh mạch mạn tính mà không có bất kỳ một triệu chứng thực thể nào, cũng như được xếp vào nhóm C0s và 21.7% khác được xếp vào nhóm C193.
Cơ chế chính xác giải thích triệu chứng đau cũng như các triệu chứng điển hình khác, đặc biệt là ở các giai đoạn sớm nhất của bệnh, vẫn chưa được hiểu rõ nhưng những nghiên cứu gần đây đã giả thuyết rằng quá trình viêm đóng vai trò then chốt94-96. Những sợi thần kinh giao cảm C có mặt trong nội mạc và trung mạc của tĩnh mạch, bao quanh những tiểu tĩnh mạch của da, đóng vai trò thụ thể cảm giác đáp ứng kích thích trước những tác nhân gây viêm. Quá trình viêm dường như diễn ra ở tất cả các giai đoạn và mọi độ nặng của bệnh, thậm chí ngay cả trước khi xuất hiện những tổn thương mô rõ rệt, và có thể là nguyên nhân của nhiều triệu chứng. Vì vậy, hoạt tính kháng viêm của VADs có tiềm năng cải thiện triệu chứng ở mọi giai đoạn của bệnh, kể cả những bệnh nhân thuộc nhóm CEAP C0s.
Thoát lưu bạch huyết
Chức năng bạch huyết suy giảm trong suy tĩnh mạch mạn tính, đặc biệt với những bệnh nhân ở các giai đoạn tiến triển của bệnh và được chứng minh có cải thiện ở những bệnh nhân có bàng hệ tĩnh mạch sau khi làm giảm dòng máu phụt ngược bằng phương pháp cắt bỏ tĩnh mạch hiển100. Một nghiên cứu gần đây cho rằng, sự tích tụ bất thường của các phân tử lipid, gia tăng áp lực mô và tình trạng viêm mạn tính ở những tĩnh mạch bàng hệ kết hợp với nhau gây rối loạn chức năng bạch huyết và làm giảm số lượng bạch mạch. Một vài VADs bao gồm
á-benzopyrones (coumarin) ở dạng độc lập hoặc kết hợp với rutin102, 103, MPFF104 và calcium dobesilate105 đã được chứng minh làm cải thiện sự thoát lưu bạch huyết trên
động vật thí nghiệm.
Rối loạn lý tính máu
Những thay đổi về lý tính của máu là vấn đề thường gặp trong bệnh suy tĩnh mạch mạn tính, bao gồm tăng độ nhớt máu và tăng kết tập hồng cầu. Một vài VADs đã
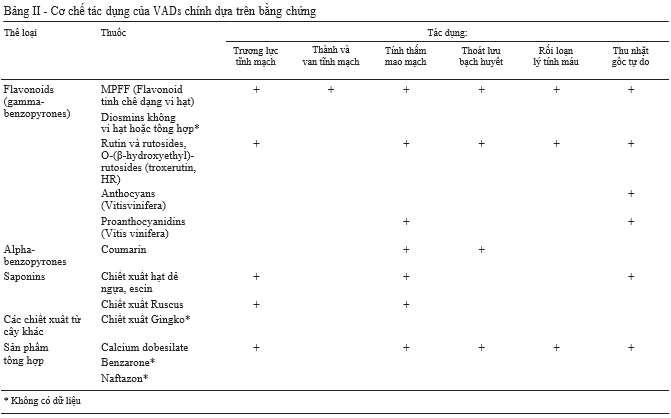
được chứng minh làm giảm độ nhớt máu và/hoặc kết tập hồng cầu như MPFF106, troxerutin107 và calcium dobesilate108. Những tác dụng dược lý của VADs được tổng hợp trong Bảng II.
Hiệu quả điều trị của VADs trên triệu chứng và phù do suy tĩnh mạch
Hiệu quả và tính an toàn của VADs trong điều trị triệu chứng và phù nề do suy tĩnh mạch mạn tính đã được đánh giá trong một số lượng lớn các nghiên cứu lâm sàng cỡ mẫu nhỏ. Kết quả là, toàn bộ những kết luận về tính hiệu quả của các sản phẩm này dựa trên chủ yếu từ những phân tích gộp, hồi cứu tài tiệu và tuyên bố đồng thuận hơn là từ những thử nghiệm lâm sàng lớn riêng biệt. Trong phần này, chúng tôi sẽ xem xét lại những biến chuyển của các khuyến cáo trong việc sử dụng VADs qua nhiều ấn phẩm mang tính bước ngoặt trước khi đề xuất một số khuyến cáo dựa trên các chứng cứ hiện có.
Phân tích gộp Cochrane
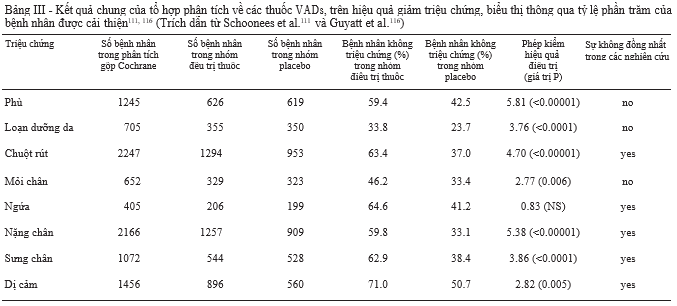
Phân tích gộp là mô hình kiểu mẫu và mang tính khách quan nhất trong việc tổng hợp kết quả của nhiều nghiên cứu lâm sàng nhỏ, tiêu biểu là phân tích gộp Cochrane. Kết quả từ những phân tích này đã có những đóng góp không nhỏ trong quá trình phát triển của các khuyến cáo cho việc sử dụng nhiều VADs khác nhau. Hồi cứu tài liệu và phân tích gộp Cochrane năm 2005 là sự tổng hợp của tổng cộng 59 thử nghiệm lâm sàng ngẫu nhiên liên quan đến một số nhóm thuốc khác nhau của VADs109. Trong số này, có 44 nghiên cứu, bao gồm 23 thử nghiệm trên rutosides, 10 trên MPFF và 6 trên calcium dobesilate, được coi là có thiết kế phù hợp và chất lượng. Các biến số về kết cục lâm sàng được xem xét đến bao gồm các triệu chứng thực thể khách quan như phù nề và rối loạn dinh dưỡng, cùng với một loạt các triệu chứng chủ quan như cảm giác đau ở chân, nặng chân, chuột rút, tê chân và cảm giác sưng. Khi tất cả VADs được xem xét cùng nhau, lợi ích quan trọng của việc điều trị đã được
chủ quan như cảm giác đau ở chân, nặng chân, chuột rút, tê chân và cảm giác sưng. Khi tất cả VADs được xem xét cùng nhau, lợi ích quan trọng của việc điều trị đã được chứng minh cho tất cả các biến số kết cục ngoại trừ tình trạng ngứa và viêm loét tĩnh mạch. Tỷ lệ bệnh nhân giảm đau hoàn toàn vượt trội đáng kể ở nhóm sử dụng VADs so với nhóm dùng giả dược (63% so với 37%, P<0.00001); và kết quả cũng cải thiện ngoạn mục với triệu chứng nặng chân (60% so với 33%, P <0.00001), cảm giác sưng (63% so với 38%, P <0,0001), chuột rút (68% so với 45%, P = 0,003), và tê chân (46% so với 33%, P <0,006). Hầu hết các biến số giữa các nghiên cứu đều không đồng nhất bởi các nghiên cứu sử dụng các loại thuốc khác nhau, thiết kế và tiêu chuẩn nhận bệnh nhân cũng khác nhau. Kết quả được tóm tắt trong bảng III. Tổng số trường hợp gặp tác dụng phụ so với giả dược không có sự khác biệt, mặc dù hầu hết các nghiên cứu chỉ được tiến hành trong một khoảng thời gian ngắn.
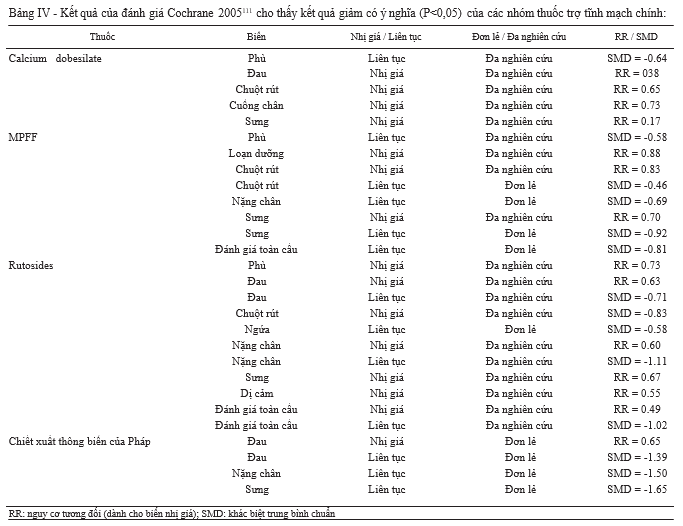
Dựa trên kết quả nhiều nghiên cứu, các phân tích dưới nhóm cho từng loại VADs cũng đã được thực hiện, trong đó, calcium dobesilate, MPFF và rutosides đều cho thấy khả năng cải thiện ngoạn mục trên triệu chứng phù nề cũng như cho thấy có hiệu quả đối với một loạt triệu chứng khác, dựa trên kết quả của một hoặc một số nghiên cứu (Bảng IV). Chiết xuất vỏ cây thông biển của Pháp cho hiệu quả làm giảm triệu chứng đau, nặng và sưng chân dựa trên một nghiên cứu được chấp nhận (độ lệch chuẩn trung bình = -1.39 với triệu chứng đau; -1.50
đối với nặng chân và -1.65 đối với sưng). Tác dụng phụ không khác biệt giữa nhóm điều trị bằng calcium dobesilate, MPFF và rutosides so với nhóm điều trị bằng giả dược.
Những đánh giá riêng biệt cửa Cochrane dành cho chiết xuất hạt dẻ ngựa110 và chiết xuất vỏ cây thông Pháp111 cũng được công bố sau đó. Một phân tích gộp của 6 thử
nghiệm trên chiết xuất hạt dẻ ngựa cho thấy triệu chứng phù thuyên giảm có ý nghĩa dựa trên kích thước chân, và 7 thử nghiệm có đối chứng cho thấy hiệu quả làm giảm đau chân so với giả dược. Tác dụng phụ thường nhẹ và hiếm gặp. Tuy nhiên, đối với chiết xuất vỏ cây thông biển của Pháp, hiện tại chỉ có 2 thử nghiệm lâm sàng cho bệnh cảnh suy tĩnh mạch mạn tính và cả 2 thử nghiệm này không cung cấp đủ bằng chứng để xếp loại khuyến cáo.
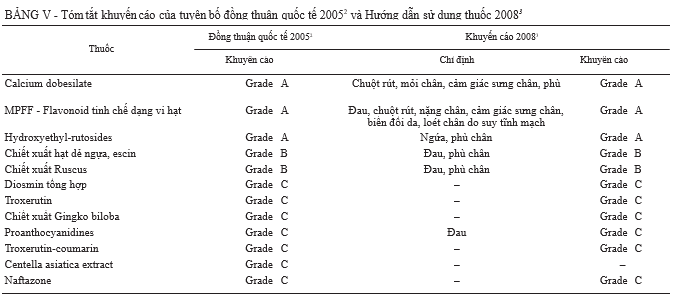
Tuyên bố đồng thuận quốc tế 2005
Những bằng chứng được công bố về tính hiệu quả, an toàn và vai trò của thuốc trợ tĩnh mạch đã được đánh giá bởi một hội đồng gồm 14 chuyên gia đến từ nhiều quốc gia khác nhau mà tại các quốc gia đó, những nhóm thuốc này đã được sử dụng trên lâm sàng. Trong khuôn khổ Hội nghị lần thứ 13 của European Society for clinical Hemorheology ở Siena, Ý vào tháng Sáu năm 2005, các chuyên gia này đã họp và đưa ra một tuyên bố đồng thuận quốc tế.2 Kết quả của 83 nghiên cứu ngẫu nhiên có đối chứng và phân tích gộp liên quan đến hiệu quả của VADs trên các triệu chứng của suy tĩnh mạch mạn tính đã được đánh giá và phân thích dựa trên kinh nghiệm lâm sàng của các chuyên gia. Các loại thuốc này sau đó được phân loại vào một trong ba cấp độ khuyến cáo tùy theo các mức chứng cứ như sau:
Nhóm A – nhiều thử nghiệm lâm sàng ngẫu nhiên với cỡ mẫu lớn, các phân tích gộp có kết quả đồng nhất. Nhóm B – Thử nghiệm lâm sàng ngẫu nhiên với cỡ mẫu nhỏ, chỉ có 1 thử nghiệm ngẫu nhiên.
Nhóm C – Các thử nghiệm đối chứng khác, thử nghiệm đối chứng không ngẫu nhiên.
Tất cả những kết luận được công bố phản ánh quan điểm của tất cả hoặc phần lớn các thành viên tham gia. Trên cơ sở này, calcium dobesilate, MPFF và hydroxyeth- yl-rutosides được phân loại ở Nhóm A, chiết xuất hạt dẻ ngựa và chiết xuất măng tây ở Nhóm B, và các loại VADs khác ở Nhóm C (bảng V). Các tác giả nhấn mạnh rằng tất cả các loại thuốc được liệt kê trong Bảng IV đã
được chứng minh hiệu quả trong ít nhất là một thử nghiệm ngẫu nhiên; các thuốc trong Nhóm A và B được công bố trong y văn có những bằng chứng tốt hơn về hiệu quả và vì vậy mà có mức khuyến cáo mạnh hơn. Các chuyên gia cũng xem xét về chỉ định của VADs, và kết luận rằng thuốc được chỉ định để làm giảm triệu chứng ở tất cả các cấp độ của suy tĩnh mạch mạn tính, từ CEAP cấp C0s đến C6s.
Khuyến cáo năm 2008 về quản lý bệnh tĩnh mạch mạn tính chi dưới:
Khuyến cáo năm 20083 cũng đánh giá hiệu quả và tính an toàn của VADs. Dựa trên các kết luận từ các phân tích gộp Cochrane và tuyên bố đồng thuận quốc tế 2005 (mô tả ở bảng V), khuyến cáo này khẳng định lại tác dụng làm giảm phù và triệu chứng của suy tĩnh mạch mạn tính.
Các tác giả của khuyến cáo cũng đã cân nhắc sử dụng VADs để điều trị bệnh thuộc giai đoạn CEAP C6. Vài nghiên cứu đã gợi ý về hiệu quả của MPFF trong điều trị loét tĩnh mạch ở chân. Một phân tích gộp 5 thử nghiệm, trong đó MPFF đường uống được thêm vào như 1 phương pháp điều trị phụ trợ, theo sau phương pháp
băng ép và chăm sóc vết loét. Kết quả MPFF đã làm tăng tỷ lệ lành vết loét, đặc biệt trên các vết loét lớn (RRR=40; 95% Cl= 6-87, ở những vết loét 5 -10 cm2) và những vết loét lâu dài (RRR= 44; 95% Cl= 6-97, theo dõi 6-12 tháng).112 Mặc dù không được xếp loại như là một VADs nhưng trong báo cáo Cochrane năm 2012 với
11 nghiên cứu cho thấy, pentoxifylline cũng có tác dụng hỗ trợ cho phương pháp băng ép trong điều trị loét tĩnh mạch (RR=2.2; 95% Cl 1.5- 3.4) và có thể cũng có hiệu quả nếu sử dụng riêng lẻ (RR=1.6; 95% Cl 1.1 – 2.1). Về tính an toàn, khuyến cáo kết luận VADs khá an toàn, ngoại trừ coumarin và benzarone có thể gây độc gan. Vài tác dụng phụ của VADs bao gồm rối loạn tiêu hoá, phát ban da và rối loạn hệ thần kinh tự động như đau đầu, chóng mặt, mất ngủ.
Khuyến cáo cũng đưa ra hướng dẫn về chỉ định cho VADs:
– VADs là thuốc được sử dụng đầu tay đối với phù và các triệu chứng khác của suy tĩnh mạch mạn tính ở mọi giai đoạn bệnh.
– Ở những giai đoạn tiến triển, VADs có thể kết hợp với phẫu thuật, can thiệp nội mạch như chích xơ, đốt nhiệt và/ hoặc liệu pháp băng ép. Các VADs có thể làm tăng hiệu quả của liệu pháp băng ép.
– Không nên kết hợp các VADs với nhau.
Tổng quan 2011
Perrin và Ramelet gần đây đã đề nghị thăm dò một bộ khuyến cáo về việc dùng VADs dựa trên hệ thống GRADE (Grading of Recommendation Assessment, Development and Evaluation).115, 116 Hệ thống GRADE khác với các cách phân loại khác ở chỗ những khuyến cáo về điều trị và mức độ của bằng chứng sẽ dựa vào từng cấp độ riêng biệt của hệ thống này. Khuyến cáo
được xếp loại mạnh (grade 1) hoặc yếu (grade 2), bằng chứng được đánh giá mức độ cao (grade A), trung bình (grade B) và thấp (grade C). Quan trọng hơn, hệ thống GRADE nhận định rằng các nghiên cứu quan sát lớn có thể cung cấp bằng chứng với mức độ vừa hoặc thậm chí là cao, đặc biệt nếu như nghiên cứu đó dự đoán trước . Từ đó MPFF và Rutoside được khuyến cáo cấp độ mạnh với bằng chứng ở mức độ trung bình (1B ở cả 2 thuốc). Chiết xuất từ cây dẻ ngựa và măng tây được khuyến cáo ở mức yếu hơn vì mức độ bằng chứng thấp (2C). Độ an toàn của các thuốc kể trên cũng được xác nhận, nhưng các tác giả nhấn mạnh vào một số hiếm trường hợp giảm bạch cầu hạt do calcium dobesilate. Do đó, calcium dobesilate ít được khuyên dùng mặc dù bằng chứng ở mức độ trung bình (2B). Các tác giả cũng khẳng định MPFF nên được sử dụng trong điều trị hỗ trợ trong loét tĩnh mạch chân với mức bằng chứng trung bình (1B).
Cuối cùng mặc dù còn thiếu những bằng chứng chứng minh hiệu quả đặc trưng trên từng phân độ CEAP, nhưng có thể kết luận rằng tất cả các giai đoạn bệnh đều
được hưởng lợi ích từ việc sử dụng VADs.
Cập nhật khuyến cáo 2014: Vị trí hiện tại.
KHUYẾN CÁO VỀ HIỆU QUẢ VÀ TÍNH AN TOÀN CỦA VADs.
Trong bản khuyến cáo hiện hành, chúng tôi đưa ra những hướng dẫn về việc sử dụng hệ thống phân loại GRADE làm cơ sở cho việc điều trị bằng VADs. Những khuyến cáo này bắt nguồn từ khuyến cáo trước đó của Perrin và Ramellet114, với sự chỉnh lý dựa trên việc cập nhật một số bằng chứng mới cũng như lượng giá lại những dữ liệu cũ để đánh giá tốt hơn vị trí của từng nhóm thuốc.
Các bằng chứng thu thập được gần đây chủ yếu tập trung vào tác dụng giảm phù do tĩnh mạch của 4 loại VADs (MPFF, hydroxyethyl-rutosides, chiết xuất măng tây và diosmin), dựa trên việc đo chu vi mắt cá chân118. Cả 4 thuốc đều làm giảm chu vi mắt cá chân có ý nghĩa hơn so với giả dược. Mức giảm đáng chú ý ghi nhận được ở nhóm MPFF (-0.80 0.53cm), hydroxyethyl-rutosides (-0.58 0.31cm), chiết xuất măng tây (-0.58 0.47) (với P<0.0001 trong mỗi trường hợp) nhưng mức giảm này lại không có ý nghĩa khi sử dụng diosmin đơn độc (-0.2 0.5cm). Khi so sánh mỗi thuốc với nhau, MPFF rõ ràng có mức giảm phù chân tốt hơn cả hydroxyethyl – được tỉ lệ đối tượng được điều trị có hiệu quả là rất lớn.115 rutosides lẫn chiết xuất măng tây, trong khi mức giảm phù khi so sánh hai loại này không cho thấy sự khác biệt
Liên quan đến hiệu quả trong việc làm giảm phù và triệu chứng suy tĩnh mạch mạn tính ở chi dưới, MPFF và Rutoside đã có những chứng cứ quan trọng từ những thử nghiệm nhỏ cũng như trong những phân tích gộp. Theo đó, MPFF có một nghiên cứu quan sát lớn là RELIEF.117 có ý nghĩa.
Trong những nghiên cứu mở gần đây về việc sử dụng phối hợp chiết xuất măng tây, hesperidin methylchalcone và acid ascorbic ở 65 phụ nữ thuộc nhóm CEAP C2s và người ta ghi nhận được mức cải thiện đáng kể trong thời gian đổ đầy tĩnh mạch (đo bằng máy đo thể tích) tương ứng với mức cải thiện về triệu chứng cơ năng trên những bệnh nhân này119.
Gần đây, lợi ích của calcium dobesilate đối với hiện tượng phù và các triệu chứng suy tĩnh mạch đã được đánh giá bằng bốn thử nghiệm lâm sàng ngẫu nhiên với kết quả trái ngược.Trong ba nghiên cứu, bao gồm 256120, 253121 và 49122 bệnh nhân, calcium dobesil- ate giúp làm giảm thể tích hay chu vi chi dưới đáng kể hơn nhiều so với giả dược (lần lượt -64.7 cm3 ở tuần thứ
8, P < 0.0002120; -12.2 mL/L ở tuần thứ 4, P=0.011121; và -1.6 cm ở tuần thứ 7 sau điều trị, P<0.05)122, và hai trong số các nghiên cứu này120,122 đã ghi nhận được sự cải thiện có ý nghĩa về các triệu chứng. Trong nghiên cứu thứ tư với 509 bệnh nhân thuộc nhóm phân loại CEAP C1 đến C6, người ta nhận thấy không có sự khác biệt có ý nghĩa giữa tác dụng của calcium dobesilate và nhóm giả dược về cải thiện chất lượng sống (37.8 điểm đối với calcium dobesilate và 38.2 điểm đối với giả dược), phù chi (đều giảm chu vi mắt cá 3.3 cm ở cả hai nhóm) hay những triệu chứng suy tĩnh mạch mạn tính nghiêm trọng (số trung bình giảm trên thang VAS = 9 đến 13.2 mm) sau 3 tháng điều trị123.
Cuối cùng, 2 nghiên cứu đối chứng với giả dược của chiết xuất lá cây nho đỏ với 248124 và 71125 bệnh nhân có phân loại CEAP C3 – C4a cho thấy mức giảm có ý nghĩa thể tích chi dưới (-19.9±8.9 ml; 95%Cl= – 37.5 đến 2.3, P=0.27) và đau chân (-6.6±3.3 mm theo thang VAS, 95% Cl= -13.1 đến 0.1, P= 0.047) sau 12 tuần điều trị,124 cũng như giảm chu vi mắt cá chân (-0.39±0.09 cm ở nhóm VADs so với 0.29±0.09 cm ở nhóm chứng, P<0.0001) sau 6 tuần điều trị.125
Tổng quan của Perrin và Ramelet tồn tại 2 vấn đề cần được xem xét chi tiết.114 Đầu tiên nghiên cứu RELIEF là một nghiên cứu quan sát tiến cứu lớn với 5052 bệnh nhân, phân loại CEAP từ C0 đến C4 ở 23 quốc gia, được điều trị bằng MPFF trong 6 tháng. Tất cả bệnh nhân đều được xác định đang tồn tại dòng phụt ngược ở tĩnh mạch chi dưới.117 Các biến số kết cục bao gồm: tỷ lệ bệnh nhân có triệu chứng suy tĩnh mạch, mức độ đau chân đo bằng thang điểm VAS; phù được đo bằng chu vi chân, sự thay đổi của phân loại lâm sàng CEAP và chất lượng sống. Kết quả được phân tích trên cả hai nhóm đối tượng có dòng máu phụt ngược hoặc không. Tất cả các biến số kết cục đều cải thiện một cách đáng kể và có một số kết cục đạt được hiệu quả điều trị rất lớn. Ví dụ, tỷ lệ bệnh nhân đau chi dưới giảm từ 71,2% xuống 23,2% ở nhóm có dòng phụt ngược và 72,3% xuống 15,1% ở nhóm chứng (P<0.001 ở cả hai nhóm). Mức độ đau giảm từ 3.89cm xuống còn 1.43cm ở nhóm có và 3.59cm xuống 1.12cm ở nhóm không có dòng máu phụt ngược. Thêm vào đó, tỷ lệ bệnh nhân CEAP C3 và C4 giảm xuống, nhóm C0
đến C2 tăng lên một cách có ý nghĩa. Cải thiện chất lượng cuộc sống (QoL), chủ yếu được đánh giá sau 2 tháng (trung bình tăng thêm 8.5 điểm theo thang đo toàn cầu GIS với giới hạn từ 0(xấu) đến 100(tốt)), xa hơn nữa sau 4 tháng (tăng thêm 5.0 điểm) và 6 tháng (tăng thêm 4.0 điểm). Nghiên cứu RELIEF cũng cung cấp bằng chứng dài hạn về tính an toàn của MPFF trên một mẫu lớn bệnh nhân. Nhìn chung, đây là một nghiên cứu với cỡ mẫu lớn cho thấy tầm quan trọng và sự ổn định trong hiệu quả điều trị. Vì thế thử nghiệm này cho bằng chứng có chất lượng vừa về hiệu quả và tính an toàn của MPFF dù là thử nghiệm kiểu nhãn mở.
Vấn đề thứ 2 liên quan đến tình trạng giảm bạch cầu hạt do sử dụng calcium dobesilate. Thoạt đầu có 3 báo cáo nhỏ từ thập niên 90, và 2 trong số đó nói rằng calcium dobesilate có liên quan.126-128 Các phân tích theo sau đã cho ra những con số ước lượng về tỷ lệ lưu hành và yếu tố nguy cơ liên quan đến calcium dobesilate.129-131
Nhưng dù sao, tình trạng giảm bạch cầu hạt là một vấn đề nghiêm trọng, gây ra tỉ lệ tử vong 10%. Một nghiên cứu bệnh chứng trên dân số chung ở Tây Ban Nha đã xác
định calcium dobesilate là một trong số rất ít các loại thuốc có nguy cơ cao gây ra giảm bạch cầu hạt vì kết quả cho thấy, thuốc có liên quan với gần 70% số trường hợp giảm bạch cầu hạt.132
Điều này cho thấy rằng, hiện tại chúng ta đang có nhiều loại thuốc trợ tĩnh mạch tốt, ít lo ngại về tác dụng phụ và do đó, cần cân nhắc giữa lợi ích và nguy cơ trong việc sử dụng calcium dobesilate, ngay cả mức nguy cơ thấp giảm bạch cầu hạt.
Cần phải nhấn mạnh rằng, coumarine và benzarone là 2 loại VADs duy nhất bị rút khỏi thị trường vì độc tính trên gan gây tử vong của chúng.133, 134
Để có cái nhìn tổng thể về các số liệu trong số phát hành này, chúng tôi tóm tắt các khuyến cáo trong bảng VI theo phân loại GRADE. Cần phải chú ý rằng, các khuyến cáo của MPFF là rất mạnh dựa trên những lợi ích rõ ràng với chất lượng chứng cứ ở mức độ vừa (Grade 1B), nhưng vẫn cần có thêm nhiều bằng chứng hơn135 dù đã có những nghiên cứu gần đây.
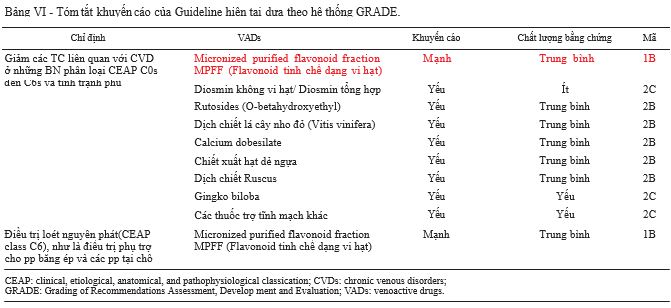
Thứ 2, khuyến cáo trong việc sử dụng calcium dobesil- ate hiện nay chỉ ở mức độ yếu do chưa có sự đánh giá chắc chắn về các nguy cơ mặc dù chất lượng bằng chứng
ở mức độ vừa (2B). Đối với trường hợp này, khuyến cáo phản ánh kết quả thuyết phục từ các nghiên cứu về tác dụng phụ liên quan đến độ an toàn của loại thuốc này. Hydroxyethyl-rutoside, chiết xuất hạt cây dẻ ngựa, chiết xuất măng tây và chiết xuất lá cây nho đỏ đều được khuyến cáo ở mức yếu dựa trên mức độ chứng cứ vừa (2B), còn các VADs khác cũng khuyến cáo ở mức yếu do mức độ chứng cứ thấp (2C).
Các khuyến cáo trên được được đưa ra như chỉ định để là giảm các triệu chứng và tình trạng phù do suy tĩnh mạch ở bệnh nhân phân loại CEAP từ C0s đến C6s. MPFF vẫn duy trì ở mức khuyến cáo mạnh do có mức độ chứng cứ vừa (1B) trong điều trị phụ trợ loét tĩnh mạch chân.114
VAI TRÒ CỦA VADS TRONG ĐIỀU TRỊ SUY TĨNH MẠCH:
Bản cập nhật khuyến cáo này là một lời khẳng định cho những kết luận trong khuyến cáo năm 20083 về việc sử dụng VADs đề giảm các triệu chứng của suy tĩnh mạch mạn tính và phù ở mọi giai đoạn bệnh. Chúng tôi nay tiến xa hơn và nhấn mạnh vai trò trung tâm và duy nhất của VADs trong điều trị bệnh nhân suy tĩnh mạch mạn tính có triệu chứng ở giai đoạn sớm nhất mà trước đây phương pháp băng ép là trị liệu duy nhất ở nhóm bệnh
nhân này. Dù sao, ở những nước có khí hậu nóng,136 khi mà bệnh nhân không tuân thủ phương pháp băng ép thì VADs là lựa chọn thay thế duy nhất. Tầm quan trọng của việc điều trị ngay cả ở những bệnh nhân CEAP giai
đoạn C0s được nhấn mạnh trong nghiên cứu gần đây,93
bởi nghiên cứu cho thấy khoảng 20% bệnh nhân đến khám bệnh với bất kỳ lí do gì ở phòng khám đa khoa đều có triệu chứng ở giai đoạn C0s. Ở giai đoạn tiến triển nặng hơn, VADs có thể dùng phối hợp với chích xơ, phẫu thuật và/hoặc liệu pháp băng ép. MPFF có thể cân nhắc điều trị phụ trợ trên những BN loét chi dưới đặc biệt là những vết loét lớn và kéo dài.112
Những nghiên cứu của Bergan và cộng sự chỉ ra rằng,44
VADs có thể phòng ngừa được sự thoái hoá van và thành tĩnh mạch thông qua quá trình giảm stress oxy hoá và ngăn cản phản ứng viêm. Tuy nhiên chúng ta vẫn cần thêm nhiều bằng chứng để khẳng định liệu việc sử dụng sớm các thuốc trợ tĩnh mạch có giúp ngăn ngừa hoặc làm chậm tiến triển suy tĩnh mạch mạn tính hay không. Điều này vẫn cần được nghiên cứu bằng những thử nghiệm lâm sàng trong tương lại. Tóm lại, các bằng chứng hiện tại chỉ nhấn mạnh vai trò to lớn của VADs trong điều trị suy tĩnh mạch mạn tính.
Tài liệu tham khảo
1. Ramelet AA, Kern P, Perrin M. Varicose veins and telangiectasias. Paris: Elsevier, 2004.
2. Ramelet AA, Boisseau MR, Allegra C, Nicolaides A, Jaeger K, Carpentier P et al. Veno-active drugs in themanagement of chronic venous disease. An international consensus statement: current medical position, prospective views and final resolution. Clin Hemor- heol Microcirc 2005;33(4):309-19.
3. Nicolaides AN, Allegra C, Bergan J, Bradbury A, Cairols M, Carpentier P et al. Management of chronic venous disorders of the lower limbs: guidelines according to scienti fic evidence. Int Angiol
2008;27(1):1-59.
4. Eberhardt RT, Raffetto JD. Chronic venous insufficiency. Circula- tion 2005;111(18):2398-409.
5. Bergan JJ, Schmid-Schonbein GW, Smith PD, Nicolaides AN, Boisseau MR, Eklof B. Chronic venous disease. N Engl J Med 2006;
355(5):488-98.
6. Atta HM. Varicose veins: role of mechanotransduction of venous hypertension. Int J Vasc Med 2012;2012:538627.
7. Ibegbuna V, Nicolaides AN, Sowade O, Leon M, Geroulakos G. Venous elasticity after treatment with Daflon 500 mg. Angiology
1997;48(1):45-9.
8. Gargouil YM, Perdrix L, Chapelain B, Gaborieau R. Effects of
Daflon 500 mg on bovine vessels contractility. Int Angiol 1989;8(4
Suppl):19S-22S.
9. Tsouderos Y. Venous tone: are the phlebotonic properties predic- tive of a therapeutic benefit? A comprehensive view of our experience with Daflon 500 mg. Z Kardiol 1991;80 Suppl 7:95-101.
10. Frick RW. Three treatments for chronic venous insufficiency: escin, hydroxyethylrutoside, and Daflon. Angiology 2000;51(3): 197- 205.
11. Guillaume M, Padioleau F. Veinotonic effect, vascular protection, antiinflammatory and free radical scavenging properties of horse chestnut extract. Arzneimittelforschung 1994;44(1):25-35.
12. Bouskela E, Cyrino FZ, Marcelon G. Effects of Ruscus extract on the internal diameter of arterioles and venules of the hamster cheek pouch microcirculation. J Cardiovasc Pharmacol 1993;22(2):221-4.
13. Androulakis G, Panoysis PA. Plethysmographic confirmationof the beneficial effect of calcium dobesilate in primary varicose veins. Angiology 1989;40(1):1-4.
14. Araujo D, Viana F, Osswald W. Diosmin therapy alters the in vitro metabolism of noradrenaline by the varicose human saphenous vein. Pharmacol Res 1991;24(3):253-6.
15. Araujo D, Gulati O, Osswald W. Effects of two venotropic drugs on inactivation and O-methylation of catecholamines in an isolated
Juteau N, Bakri F, Pomies JP, Foulon C, Rigaudy P, Pillion G et al. The human saphenous vein in pharmacology: effect of a new micronized flavonoidic fraction (Daflon 500 mg) on norepinephrine induced contraction. Int Angiol 1995;14(3 Suppl 1):8-13.
17. Rubanyi G, Marcelon G, Vanhoutte PM. Effect of temperature on the responsiveness of cutaneous veins to the extract of Ruscus aculea- tus. Gen Pharmacol 1984;15(5):431-4.
18. Bouskela E, Cyrino FZ, Marcelon G. Possible mechanisms for the venular constriction elicited by Ruscus extract on hamster cheek pouch. J Cardiovasc Pharmacol 1994;24(1):165-70.
19. Raffetto JD, Khalil RA. Ca(2+)-dependent contraction by the saponoside escin in rat vena cava: implications in venotonic treatment of varicose veins. J Vasc Surg 2011;54(2):489-96.
20. Manthey JA, Grohmann K, Guthrie N. Biological properties of citrus flavonoids pertaining to cancer and inflammation. Curr Med Chem 2001;8(2):135-53.
21. Benavente-Garcia O, Castillo J. Update on uses and properties of citrus flavonoids: new findings in anticancer, cardiovascular, and anti-inflammatory activity. J Agric Food Chem 2008; 56(15):
6185-205.
22. Garcia-Lafuente A, Guillamon E, Villares A, Rostagno MA, Martinez JA. Flavonoids as anti-inflammatory agents: implications in cancer and cardiovascular disease. Inflamm Res 2009;58(9):537-52.
23. Wu CH, Wu CF, Huang HW, Jao YC, Yen GC. Naturally occurring flavonoids attenuate high glucose-induced expression of proinflammatory cytokines in human monocytic THP-1 cells. Mol Nutr Food Res 2009;53(8):984-95.
24. Akhlaghi M, Bandy B. Mechanisms of flavonoid protection against myocardial ischemia-reperfusion injury. J Mol Cell Cardiol
2009;46(3):309-17.
25. Shukla VK, Sethi AK, Garg SK, Ganguly NK, Kulkarni SK. Effect of venoruton on hypoxic stress-induced neurotoxicity in mice and oxygen free radical generation by human neutrophils. Arch Int Pharmacodyn Ther 1989;299:127-33.
26. Cypriani B, Limasset B, Carrie ML, Le Doucen C, Roussie M, de Paulet AC et al. Antioxidant activity of micronized diosmin on oxygen species from stimulated human neutrophils. Biochem Pharmacol 1993;45(7):1531-5.
27. Jean T, Bodinier MC. Mediators involved in inflammation: effects of Daflon 500 mg on their release. Angiology1994;45(6 Pt 2):554-9.
28. Blasig IE, Loewe H, Ebert B. Effect of troxerutin and methionine on spin trapping of free oxy-radicals. Biomed Biochim Acta
1988;47(10-11):S252-5.
29. Matsuda H, Li Y, Murakami T, Ninomiya K, Yamahara J, Yoshi- kawa M. Effects of escins Ia, Ib, IIa, and IIb from horse chestnut, the seeds of Aesculus hippocastanum L., on acute inflammation in animals. Biol Pharm Bull 1997;20(10):1092-5.human
30. Maffei Facino R, Carini M, Aldini G, Bombardelli E, Morazzoni P, Morelli R. Free radicals scavenging action and anti-enzyme activities of procyanidines from Vitis vinifera. A mechanism for their capillary protective action. Arzneimittelforschung 1994;44(5): 592- 601.
31. Maffei Facino R, Carini M, Aldini G, Berti F, Rossoni G, Bombardelli E et al. Procyanidines from Vitis vinifera seeds protect rabbit heart from ischemia/reperfusion injury: antioxidant intervention and/or iron and copper sequestering ability. Planta Med
1996;62(6):495-502.
32. Packer L, Rimbach G, Virgili F. Antioxidant activity and biologic properties of a procyanidin-rich extract from pine (Pinus maritima) bark, pycnogenol. Free Radic Biol Med 1999;27(5-6):704-24.
33. Cho KJ, Yun CH, Packer L, Chung AS. Inhibition mechanisms of bioflavonoids extracted from the bark of Pinus maritima on the expression of proinflammatory cytokines. Ann N Y Acad Sci
2001;928: 141-56.
34. Rohdewald P. A review of the French maritime pine bark extract (Pycnogenol), a herbal medication with a diverse clinical pharmacology. Int J Clin Pharmacol Ther 2002;40(4):158-68.
35. Iravani S, Zolfaghari B. Pharmaceutical and nutraceutical effects of Pinus pinaster bark extract. Res Pharm Sci 2011;6(1):1-11.
36. Brunet J, Farine JC, Garay RP, Hannaert P. In vitro antioxidant properties of calcium dobesilate. Fundam Clin Pharmacol 1998;12(2):
205-12.
37. Szabo ME, Haines D, Garay E, Chiavaroli C, Farine JC, Hannaert P et al. Antioxidant properties of calcium dobesilate in ischemic/reperfused diabetic rat retina. Eur J Pharmacol
2001;428(2):277-86.
38. Alda O, Valero MS, Pereboom D, Serrano P, Azcona JM, Garay RP. In vitro effect of calcium dobesilate on oxidative/ inflammatory stress in human varicose veins. Phlebology 2011;26(8):332-7.
39. Sen CK, Bagchi D. Regulation of inducible adhesion molecule expression in human endothelial cells by grape seed proanthocyanidin extract. Mol Cell Biochem 2001;216(1-2):1-7.
40. Shoab SS, Porter J, Scurr JH, Coleridge-Smith PD. Endothelial activation response to oral micronised flavonoid therapy in patients with chronic venous disease–a prospective study. Eur J Vasc Endovasc Surg 1999;17(4):313-8.
41. Shoab SS, Porter JB, Scurr JH, Coleridge-Smith PD. Effect of oral micronized purified flavonoid fraction treatment on leukocyte adhesion molecule expression in patients with chronic venous disease: a pilot study. J Vasc Surg 2000;31(3):456-61.
42. Kauss T, Moynet D, Rambert J, Al-Kharrat A, Brajot S, Thiolat D et al. Rutoside decreases human macrophagederived inflammatory mediators and improves clinical signs in adjuvant-induced arthritis. Arthritis Res Ther 2008;10(1):R19.
43. Bito T, Roy S, Sen CK, Packer L. Pine bark extract pycnogenol downregulates IFN-gamma-induced adhesion of T cells to keratinocytes by inhibiting inducible ICAM-1 expression. Free Radic Biol Med 2000;28(2):219-27.
44. Bergan JJ, Pascarella L, Schmid-Schonbein GW. Pathogenesis of primary chronic venous disease: Insights from animal models of venous hypertension. J Vasc Surg 2008;47(1):183-92.
45. Tinsley JH, Wu MH, Ma W, Taulman AC, Yuan SY. Activated neutrophils induce hyperpermeability and phosphorylation of adherens junction proteins in coronary venular endothelial cells. J Biol Chem 1999;274(35):24930-4.
46. He P, Wang J, Zeng M. Leukocyte adhesion and microvessel permeability. Am J Physiol Heart Circ Physiol 2000;278(5): H1686-94.
47. DiStasi MR, Ley K. Opening the flood-gates: how neutrophilendothelial interactions regulate permeability. Trends Immunol 2009;30(11):547-56.
48. Curry FR, Noll T. Spotlight on microvascular permeability. Cardiovasc Res 2010;87(2):195-7.
49. He P. Leucocyte/endothelium interactions and microvessel permeability: coupled or uncoupled? Cardiovasc Res 2010;87(2):
281-90.
50. Godfraind T. Effect of a flavonoid preparation (S 5682) on experimental capillary permeability increase in rat paw and rabbit skin. Int Angiol 1988;7(2 Suppl):17-9.
51. Bouskela E, Donyo KA. Effects of oral administration of purified micronized flavonoid fraction on increasedmicrovascular permeability induced by various agents and on ischemia/reperfusion in diabetic hamsters. Int J Microcirc Clin Exp 1995;15(6):293-300.
52. Bouskela E, Donyo KA. Effects of oral administration of purified micronized flavonoid fraction on increased microvascular permeability induced by various agents and on ischemia/reperfusion in the hamster cheek pouch. Angiology 1997;48(5):391-9.
53. Blumberg S, Clough G, Michel C. Effects of hydroxyethyl rutosides upon the permeability of single capillaries in the frog mesentery. Br J Pharmacol 1989;96(4):913-9.
54. Kendall S, Towart R, Michel CC. Effects of hydroxyethylrutosides on the permeability of microvessels in the frog mesentery. Br J Pharmacol 1993;110(1):199-206.
55. Gabor M. The effect of O-(beta-hydroxyethyl)-rutosides (HR) on the skin capillary resistance of rats. Arzneimittelforschung
1981;31(3):442-5.
56. Bisler H, Pfeifer R, Kluken N, Pauschinger P. +AFs-Effects of horse-chestnut seed extract on transcapillary filtration in chronic venous insufficiency+AF0. Dtsch Med Wochenschr 1986;111(35):
1321-9.
Ruscus extract and of the flavonoid hesperidine methylchalcone on increased microvascular permeability induced by various agents in the hamster cheek pouch. J Cardiovasc Pharmacol 1993;22(2):
225-30.
58. Bouskela E, Cyrino FZ, Marcelon G. Possible mechanisms for the inhibitory effect of Ruscus extract on increased microvascular permeability induced by histamine in hamster cheek pouch. J Cardiovasc Pharmacol 1994;24(2):281-5.
59. Svensjo E, Bouskela E, Cyrino FZ, Bougaret S. Antipermeability effects of Cyclo 3 Fort in hamsters with moderate diabetes. Clin Hemorheol Microcirc 1997;17(5):385-8.
60. Brunet J, Farine JC, Garay RP, Hannaert P. Angioprotective action of calcium dobesilate against reactive oxygen species-induced capillary permeability in the rat. Eur J Pharmacol 1998;358(3):
213-20.
61. Hannaert P, Brunet J, Farine JC, Garay RP. Antioxidant- Angioprotective Actions of Calcium Dobesilate in Diabetic Rats. International Journal of Angiology 1999;8(5):2-4.
62. Bates DO, Curry FE. Vascular endothelial growth factor increases hydraulic conductivity of isolated perfused microvessels. Am J Physiol 1996;271(6 Pt 2):H2520-8.
63. Bates DO. Vascular endothelial growth factors and vascular permeability. Cardiovasc Res 2010;87(2):262-71.
64. Shoab SS, Scurr JH, Coleridge-Smith PD. Increased plasma vascular endothelial growth factor among patients with chronic venous disease. J Vasc Surg 1998;28(3):535-40.
65. Shoab SS, Scurr JH, Coleridge-Smith PD. Plasma VEGF as a marker of therapy in patients with chronic venous disease treated with oral micronised flavonoid fraction -a pilot study. Eur J Vasc Endovasc Surg 1999;18(4):334-8.
66. Howlader MH, Coleridge Smith PD. Relationship of plasma vascular endothelial growth factor to CEAP clinical stage and symptoms in patients with chronic venous disease. Eur J Vasc Endovasc Surg 2004;27(1):89-93.
67. Coleridge Smith PD. Deleterious effects of white cells in the course of skin damage in CVI. Int Angiol 2002; 21(2 (Suppl 1))
:S26-32.
68. Chen WY, Rogers AA. Recent insights into the causes of chronic leg ulceration in venous diseases and implications on other types of chronic wounds. Wound Repair Regen 2007;15(4):434-49.
69. Peschen M, Grenz H, Grothe C, Schopf E, Vanscheidt W. Patterns of epidermal growth factor receptor, basic fibroblast growth factor and transforming growth factor-beta3 expression in skin with chronic venous insuf- ficiency. Eur J Dermatol 1998;8(5):334-8.
70. Peschen M, Lahaye T, Hennig B, Weyl A, Simon JC, Vanscheidt
W. Expression of the adhesion molecules ICAM- 1, VCAM-1, LFA-1
venous insufficiency. Acta Derm Venereol 1999;79(1):27-32.
71. Pappas PJ, You R, Rameshwar P, Gorti R, DeFouw DO, Phillips CK et al. Dermal tissue fibrosis in patients with chronic venous insufficiency is associated with increased transforming growth factor-beta1 gene expression and protein production. J Vasc Surg
1999;30(6):1129-45.
72. James TJ, Hughes MA, Cherry GW, Taylor RP. Evidence of oxidative stress in chronic venous ulcers. Wound Repair Regen 2003;
11(3):172-6.
73. Wlaschek M, Scharffetter-Kochanek K. Oxidative stress in chron- ic venous leg ulcers. Wound Repair Regen 2005;13(5):452-61.
74. Clark RA. Oxidative stress and “senescent” fibroblasts in non-healing wounds as potential therapeutic targets. J Invest Derma- tol 2008;128(10):2361-4.
75. Wall IB, Moseley R, Baird DM, Kipling D, Giles P, Laffa fian I et al. Fibroblast dysfunction is a key factor in the non-healing of chronic venous leg ulcers. J Invest Dermatol 2008;128(10):2526-40.
76. Phillips MN, Jones GT, van Rij AM, Zhang M. Micro-venous valves in the superficial veins of the human lower limb. Clin Anat
2004;17(1):55-60.
77. Caggiati A, Phillips M, Lametschwandtner A, Allegra C. Valves in small veins and venules. Eur J Vasc Endovasc Surg 2006;32(4):
447-52.
78. Vincent JR, Jones GT, Hill GB, van Rij AM. Failure of microvenous valves in small superficial veins is a key to the skin changes of venous insufficiency. J Vasc Surg 2011;54(6 Suppl):
62S-9S.
79. Kahn SR, MLan C E, Lamping DL, Kurz X, Berard A, Abenhaim LA. Relationship between clinical classifi- cation of chronic venous disease and patient-reported quality of life: results from an interna- tional cohort study. J Vasc Surg 2004;39(4):823-8.
80. Langer RD, Ho E, Denenberg JO, Fronek A, Allison M, Criqui MH. Relationships between symptoms and venous disease: the San Diego population study. Arch Intern Med 2005;165(12):1420-4.
81. Saarinen J, Suominen V, Heikkinen M, Saaristo R, Zeitlin R, Vainio J et al. The profi le of leg symptoms, clinical disability and reflux in legs with previously operated varicose disease. Scand J Surg
2005;94(1):51-5.
82. Chiesa R, Marone EM, Limoni C, Volonte M, Petrini O. Chronic venous disorders: correlation between visible signs, symptoms, and presence of functional disease. J Vasc Surg 2007;46(2):322-30.
83. Guex JJ, Enrici E, Boussetta S, Avril L, Lis C, Taieb C. Correla- tions between ankle circumference, symptoms, and quality of life demonstrate the clinical relevance of minimal leg swelling reduction: results of a study in 1,036 Argentinean patients. Dermatol Surg 2008;
34(12): 1666-75.
84. Bradbury A, Evans CJ, Allan P, Lee AJ, Ruckley CV, Fowkes FG. The relationship between lower limb symptoms and superficial and deep venous reflux on duplex ultrasonography: The Edinburgh Vein Study. J Vasc Surg 2000;32(5):921-31.
85. Bradbury A, Evans C, Allan P, Lee A, Ruckley CV, Fowkes FG. What are the symptoms of varicose veins? Edinburgh vein study cross sectional population survey. Br Med J 1999;318(7180):353-6.
86. Howlader MH, Smith PD. Symptoms of chronic venous disease and association with systemic inflammatory markers. J Vasc Surg
2003;38(5):950-4.
87. Shami SK, Shields DA, Farrah J, Scurr JH, Coleridge Smith PD. Peripheral nerve function in chronic venous insufficiency. Eur J Vasc Surg 1993;7(2):195-200.
88. Padberg FT, Jr., Maniker AH, Carmel G, Pappas PJ, Silva MB, Jr., Hobson RW, 2nd. Sensory impairment: a feature of chronic venous insufficiency. J Vasc Surg 1999;30(5):836-42.
89. Reinhardt F, Wetzel T, Vetten S, Radespiel-Troger M, Hilz MJ, Heuss D et al. Peripheral neuropathy in chronic venous insufficiency. Muscle Nerve 2000;23(6):883-7.
90. Kroger K, Ose C, Rudofsky G, Roesener J, Hirche H. Symptoms in individuals with small cutaneous veins. Vasc Med 2002;7(1):13-7.
91. Ruckley CV, Evans CJ, Allan PL, Lee AJ, Fowkes FG. Telangiec- tasia in the Edinburgh Vein Study: epidemiology and association with trunk varices and symptoms. Eur J Vasc Endovasc Surg 2008;36(6):
719-24.
92. Andreozzi GM, Signorelli S, Di Pino L, Garozzo S, Cacciaguerra G, Leone A et al. Varicose symptoms without varicose veins: the hypotonic phlebopathy, epidemiology and pathophysiology. The Acireale project. Minerva Cardioangiol 2000;48(10):277-85.
93. Rabe E, Guex JJ, Puskas A, Scuderi A, Fernandez Quesada F. Epidemiology of chronic venous disorders in geographically diverse populations: results from the Vein Consult Program. Int Angiol
2012;31(2):105-15.
94. Danziger N. Pathophysiology of pain in venous disease. J Mal
Vasc 2007;32(1):1-7.
95. Boisseau MR. Leukocyte involvement in the signs and symptoms of chronic venous disease. Perspectives for therapy. Clin Hemorheol Microcirc 2007;37(3):277-90.
96. Vital A, Carles D, Serise JM, Boisseau MR. Evidence for unmy- elinated C fibres and inflammatory cells in human varicose saphenous vein. Int J Angiol 2010;19(2):e73-7.
97. Bull RH, Gane JN, Evans JE, Joseph AE, Mortimer PS. Abnormal lymph drainage in patients with chronic venous leg ulcers. J Am Acad Dermatol 1993;28(4):585-90.
98. Mortimer PS. Evaluation of lymphatic function: abnormal lymph drainage in venous disease. Int Angiol 1995;14(3 Suppl 1):S32-5.







