Vấn đề tìm nguồn gốc của đột quỵ do thiếu máu cục bộ hoặc cơn thiếu máu não tạm thời (TIA) là một vần đề quan trọng sau biến cố.
TS Phạm Hữu Văn
Rung nhĩ là một trong những mục tiêu được tầm soát. Để tầm soát bằng theo dõi điện tâm đồ là phương pháp thường đùng, nhưng theo dõi thời gian bao nhiêu để có kết quả tốt lại là một vấn đề quan trọng. Trong chuyên đề này chúng tôi muốn trình bày đánh giá hệ thống và phân tích gộp về vấn đề này.
Một số vấn đề vể rung nhĩ
Rung nhĩ (AF) là một vấn đề y tế toàn cầu với các bằng chứng cho thấy tính phổ biến và tỷ lệ ngày càng tăng trên toàn thế giới. Một tổng quan hệ thống các nghiên cứu dựa vào dân số trên toàn thế giới ước tính số lượng các cá nhân bị AF trong năm 2010 là 33,5 triệu và có khoảng 5 triệu ca mới mỗi năm. Năm 1990, tỷ lệ bị bệnh được điều chỉnh theo tuổi ước tính số người bị AF trên 100.000 dân là 570 nam và 360 nữ; các ước tính tỷ lệ mắc được điều chỉnh theo tuổi trên 100.000 người trong mỗi năm là 61 ở nam và 44 nữ. Trong năm 2010, tỷ lệ bị bệnh tăng lên 596 và 373 và tỷ suất tăng lên đến 78 và 60 ở nam và nữ, tương ứng. Tỷ lệ bị bệnh điều chỉnh theo tuổi trên 100.000 dân cao nhất ở Bắc Mỹ (700-775) và thấp nhất ở Nhật Bản và Hàn Quốc (250-325). Tỷ lệ này ở Trung Quốc cũng tương đối thấp (325-400). Ở Việt Nam chúng ta chưa có con số thống kê cụ thể.
Sự phổ biến của AF phụ thuộc vào dân số nghiên cứu; nguy cơ tăng theo độ tuổi và có bệnh nền tim mạch. Các dữ liệu sau đây chủ yếu xuất phát từ các nghiên cứu trong đó dựa vào điện tâm đồ (ECG) đã thu được trong nội trú hơn là theo dõi ngoại trú. Sự phổ biến của AF kịch phát, trong đó có nhiều khả năng được phát hiện dưới sự theo dõi ngoại trú cao hơn rất nhiều.
AF không phổ biến ở trẻ sơ sinh và trẻ em, hiện nay hầu như luôn luôn xảy ra kết hợp với bệnh tim thực thể. Người lớn trẻ tuổi khỏe mạnh cũng có nguy cơ thấp; trong một báo cáo, ví dụ, chỉ có 5 / > 122.000 người được đánh giá tổng quát có AF bằng tầm soát trên ECG.
Sự phổ biến của AF lớn hơn ở người cao tuổi. Mối quan hệ này đã được chứng minh trong các nghiên cứu ATRIA, một nghiên cứu cắt ngang gần 1,9 triệu đối tượng trong một tổ chức chăm sóc sức khỏe tại Hoa Kỳ. Các kết quả đã được ghi nhận sau đây:
● Tỷ lệ tổng thể AF là 1%; 70% ít nhất ở tuổi 65 và 45% là ≥75 tuổi.
● Tỷ lệ AF dao động từ 0,1% số người lớn ở tuổi > 55 đến 9% ở độ tuổi ≥80 tuổi.
● Tỷ lệ cao hơn ở nam so với nữ (1,1 so với 0,8%), một sự khác biệt nhìn thấy ở mọi lứa tuổi. Trong số các đối tượng trên 50 tuổi, AF thường gặp ở người da trắng hơn người da đen (2,2 so với 1,5%) .
Mô hình tương tự đã được báo cáo trong một nghiên cứu tiến cứu đoàn hệ dựa vào dân số châu Âu 6808 người ≥ 55 tuổi. Sự phổ biến của AF là 5,5%, từ 0,7% trong những tuổi từ 55 đến 59 và 17,8% cho những người ≥ 85 tuổi. Các tỷ lệ cao hơn ở nam nhiều hơn nữ (6,0 so với 5,1%).
Trong một nghiên cứu cộng đồng trên 1,4 triệu bệnh nhân ở Anh và xứ Wales, tỷ lệ chuẩn hóa theo tuổi của AF giữa năm 1994 và năm 1998 tăng 22 và 14% ở đàn ông và phụ nữ, tương ứng.
AF dưới lâm sàng(Subclinical AF) là một khái niệm mới, đề cập đến các cơn AF không có triệu chứng ở bệnh nhân không có tiền sử AF, được phát hiện chỉ bằng các kỹ thuật giám sát. Như đã đề cập ở trên, sự phổ biến của AF phụ thuộc vào dân số nghiên cứu. Tỷ lệ cũng bị ảnh hưởng theo thời gian, độ nhạy và độ đặc hiệu của kỹ thuật sàng lọc.
Có thể nói rung nhĩ:
• Một yếu tố nguy cơ hàng đầu đối cho đột quỵ não
• Phổ biến hơn ở những người trên 60 tuổi
• Thường không có triệu chứng, làm cho người bệnh khó nhận biết là mình có rung nhĩ.
Điều quan trọng hơn đó là:
• AF có thể được kiểm soát có hiệu quả.
• Khoảng 15% của tất cả những người bị đột quỵ có AF.
• Biết và kiểm soát đúng AF có thể ngăn chặn đột quỵ.
• Trên 80% đột quỵ ở những người có AF có thể được ngăn chặn. Đột quỵ ở bệnh nhân có kết quả AF tồi tệ hơn đột quỵ không liên quan đến AF, bao gồm cả tỷ lệ tử vong cao hơn, tái phát đột quỵ và suy giảm chức năng và phụ thuộc hơn. Mặc dù các hướng dẫn hiện xác định chiến lược điều trị có hiệu quả cho việc quản lý AF để giảm nguy cơ đột quỵ, các chiến lược này thường được vận dụng hoặc hiểu biết không thích hợp. Cả bác sĩ và bệnh nhân hiểu biết và thái độ đóng một vai trò quan trọng trong sự thành công của chiến lược hiện hành để quản lý AF nhằm ngăn ngừa đột quỵ.
Thời gian theo dõi điện tâm đồ ở các bệnh nhân đột quỵ thiếu máu chưa rõ nguồn gốc
Rung nhĩ là nguyên nhân chính gây đột quỵ. Trong khi nghiên cứu tiêu chuẩn tiếp theo biến cố bao gồm theo dõi điện tâm đồ (ECG), thời gian tối ưu để phát hiện AF còn chưa rõ ràng. Người ta thực hiện một “Tổng quan hệ thống và phân tích gộp” để xác định xem thời gian theo dõi ECG sau biến cố thiếu máu cục bộ có liên quan đến việc phát hiện của AF.
Các phương pháp và kết quả
Các nghiên cứu tiến cứu báo cáo tỷ lệ AF mới chẩn đoán bằng điện tâm đồ.
Theo dõi và phân tích ECG kéo dài hơn 12 giờ ở những bệnh nhân mới bị đột quỵ hoặc TIA. Nghiên cứu loại trừ các bệnh nhân đột quỵ do xuất huyết hoặc đã được chẩn đoán có AF trước đây. Tổng số có 31 bài viết đáp ứng tiêu chuẩn thu nhận. Khi đánh giá thời gian theo dõi như là một biến liên tục (p – giá trị < 0,001), người ta đã nhận thấy thời gian theo dõi dài hơn được liên kết với sự phát hiện tăng lên của AF.
Đột quỵ là nguyên nhân hàng đầu của tình trạng tàn phế và là nguyên nhân tử vong đứng thứ hai trên toàn thế giới. Thuyên tắc tim mạch (Cardio-embolism) do AF là một nguồn quan trọng của đột quỵ thiếu máu cục bộ, chỉ đứng sau bệnh xơ vữa động mạch não. Trong khi sự chú ý đáng kể đã tập trung vào việc điều trị và phòng ngừa AF, việc xác định xem AF kịch phát là nguyên nhân của đột quỵ thiếu máu cục bộ thoáng qua hoặc cơn thiếu máu (TIA) nguồn gốc không rõ (cryptogenic) vẫn còn là một thách thức. Việc chẩn đoán AF mới sau khi bị đột quỵ hoặc TIA xảy ra ở 10 % số người, trong khi thêm 11 % AF mới có thể được phát hiện trong 30 ngày liên tục trên theo dõi ECG. Tuy nhiên, phát hiện AF kịch phát bằng theo dõi ECG có thể khó khăn vì bệnh nhân có thể không có triệu chứng hoặc có thời gian dài giữa các cơn. Mặc dù Trường môn tim mạch Hoa Kỳ và Hiệp hội Đột quỵ gần đây đã cập nhật khuyến nghị để hỗ trợ việc sử dụng theo dõi AF kéo dài trong 30 ngày sau khi đột quỵ không rõ nguồn gốc (Class IIa; mức chứng cứ C), cần bằng chứng nhiều hơn nữa là cần thiết để hỗ trợ cho khuyến cáo này.
Với những điều như trên, dựa trên các hướng dẫn thông báo PRISMA, xem xét lại một cách hệ thống và phân tích gộp đã được tiến hành để đánh giá mối quan hệ giữa thời gian theo dõi ECG sau đột quỵ hoặc TIA không rõ nguồn gốc và phát hiện AF mới.
Phương pháp tiêu chuẩn đủ điều kiện thử nghiệm ngẫu nhiên có đối chứng (Randomized control trials: RCT) và các nghiên cứu quan sát tiền cứu ở Anh được xem xét cho đến tận ngày 04 tháng 8 năm 2014. Bất kỳ nghiên cứu được công bố trước ngày 04 tháng 8 năm 2014 hội đủ điều kiện để thu nhận vào nghiên cứu được xác định sớm nhất đã được công bố vào tháng 10 năm 1985. Tiêu chuẩn thu nhận là bệnh nhân mới được chẩn đoán đột quỵ thiếu máu cục bộ và / hoặc TIA người đã trải qua theo dõi ECG cho tối thiểu là 12 giờ. Tiêu chuẩn loại trừ như đã trình bầy ở trên. Ngoài ra, tóm tắt và nghiên cứu hồi cứu đã được loại trừ.
Nguồn Thông tin, Chiến lược tìm kiếm, Chiến lược và Khai thác dữ liệu của nghiên cứu (Bảng 1) liên quan đến tìm kiếm chi tiết trên Pubmed / MEDLINE, Embase, thư viện Cochrane, thử nghiệm lâm sàng đăng ký, thư mục có liên quan và Google Scholar. Có tổng cộng 20.479 bài báo tiềm năng được xác định khi đánh giá ban đầu đã được sàng lọc cho phù hợp bằng cách sử dụng tiêu đề (thực hiện bằng CD, ES, MN, HT, và JW). Tổng cộng có 89 nghiên cứu còn lại sau khi sàng lọc khởi đầu (Hình 1). Những nghiên cứu này đã hiểu rõ các tóm tắt đầy đủ và được 4 tác giả xem xét lại (được thực hiện bằng CD, ES, MN, và HT ) và được dẫn giải để loại trừ của 58 nghiên cứu bổ sung. Các nghiên cứu thuần tập cuối cùng của bài viết được sử dụng trong phân tích này bao gồm 31 nghiên cứu: 3 RCTs và 28 nghiên cứu quan sát tiền cứu. Tất cả 31 nghiên cứu đã trải qua khai thác dữ liệu chính. Đối với nghiên cứu kiểm tra nhiều hơn một phương thức để phát hiện AF trong cùng một nhóm bệnh nhân, dữ liệu bệnh nhân được đưa cho mỗi người; do đó, con số cuối cùng của nghiên cứu tỷ lệ AF cụ thể vượt quá 31 (hình 1). Sự khác nhau liên quan đến bài viết hoặc khai thác dữ liệu đã được giải quyết giữa tất cả 5 tác giả khác.
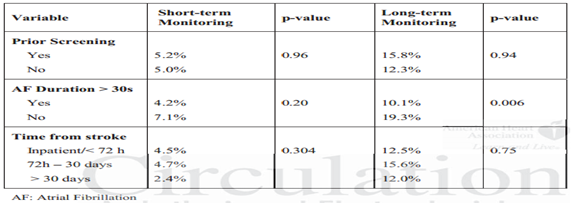
Bảng 1.Các phân tích phân nhóm thời gian theo dõi ngắn hạn và dài hạn.
Mục dữ liệu và kết quả các biện pháp. Ba phương pháp được sử dụng để giải quyết các mục tiêu của nghiên cứu. Thứ nhất, phân tích gộp của tất cả nghiên cứu đã được tiến hành bằng cách sử dụng tỷ lệ AF được chẩn đoán mới sau đột quỵ thiếu máu cục bộ như một tiêu chí quan trọng. Hồi quy gộp sau đó được sử dụng để đánh giá mối quan hệ giữa thời gian theo dõi, tỷ lệ AF mới được chẩn đoán. Thứ hai, phân tích gộp riêng trong thời gian ngắn (7 ngày) theo dõi ECG được thực hiện để so sánh sự khác biệt về tỷ lệ AF mới được chẩn đoán giữa hai chiến lược này. Nguồn gốc tiềm tàng của tính không đồng nhất cho mỗi phân nhóm này đã được khảo sát dựa trên các biến số đặc hiệu như được mô tả dưới đây. Cuối cùng, một phân tích gộp 3 RCT được tiến hành để xác định độ chênh (odds) của việc phát hiện AF với việc theo dõi theo dõi ECG dài hạn đối lại với ngắn hạn.
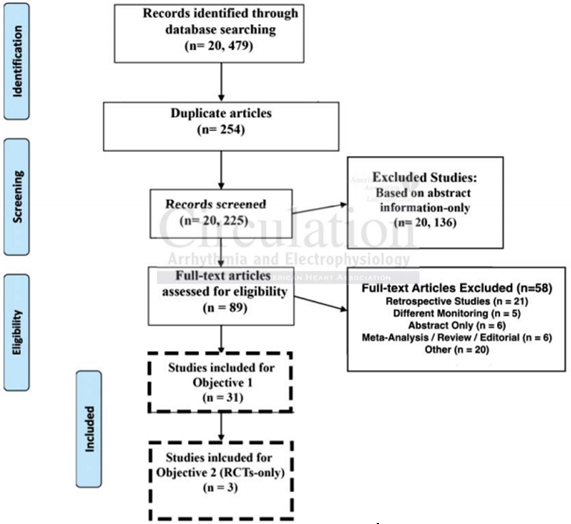
Hình 1.Sơ đồ dòng chảy cho việc lựa chọn nghiên cứu để nhận thử nghiệm ngẫu nhiên có đối chứng.
Các tiền biến đặc hiệu cho các phân nhóm phân tích được chiết xuất ở thời điểm xem xét nghiên cứu và đưa vào một hình thức khai thác dữ liệu chuẩn. Các biến này được thể hiện trong bảng bằng chứng và đi kèm: sàng lọc AF trước khi thời gian nghiên cứu (được định nghĩa là bất kỳ theo dõi ECG liên tục trước khi bắt đầu nghiên cứu); xác định trước các tiêu chí để chẩn đoán AF dựa trên việc theo dõi ECG (AF > 30s đối lại không xác định cụ thể) và thời gian từ sự cố đột quỵ hoặc TIA để bắt đầu theo dõi (loại < 72 giờ, 72 giờ – 30 ngày, hoặc > 30 ngày).
Phương pháp thống kê
Tổng cộng, bốn phân tích gộp riêng rẽ được thực hiện (tỷ lệ AF mới được chẩn đoán trong tất cả các nghiên cứu, trong các nghiên cứu theo dõi ngắn hạn, trong các nghiên cứu theo dõi lâu dài và trong các nghiên cứu ngẫu nhiên có đối chứng). Tỷ lệ phát hiện AF là chỉ số quan trọng cho tất cả các phân tích, ngoại trừ các RCT, trong đó biến số gộp là tỉ lệ chênh lệch phát hiện AF bằng dài hạn so với theo dõi ngắn hạn. Tất cả các phân tích sử dụng các mô hình tác động ngẫu nhiên. Biện pháp không đồng nhất được đánh giá bằng cách sử dụng số liệu thống kê Q và I2. Giá trị cao hơn của mỗi biện pháp đề xuất không đồng nhất giữa các nghiên cứu trong phân tích và nên nhắc lại phân nhóm phân tích sâu hơn để xác định tốt hơn những nguyên nhân của sự không đồng nhất. Mô hình phân tích gộp hiệu quả ngẫu nhiên được phân tầng mang tính riêng biệt trên cơ sở các biến xác định trước được thực hiện trong các phân tích phân nhóm của các nhóm theo dõi ngắn hạn và dài hạn. Mô hình tác động ngẫu nhiên được chọn cho hầu hết các phân tích như một mức độ cao của sự biến đổi đã được dự kiến trong các nghiên cứu tiền cứu bao gồm trong các phân tích gộp. Tuy nhiên, đối với các phân tích phân nhóm cụ thể cho 3 nghiên cứu ngẫu nhiên có đối chứng, một mô hình cố định có hiệu lực đã được sử dụng như là một mức rất thấp của biến đổi đã được dự đoán trước. Cuối cùng, một hồi quy gộp sử dụng các mô hình khả năng tối đa mà không giới hạn thời gian giám sát được thực hiện bao gồm tất cả các nghiên cứu trong mô hình. Như thời gian theo dõi trong những ngày không được phân bố bình thường, điều này đã được đăng nhập khi chuyển đổi để cho phép các mô hình đáp ứng các giả định của sự bình thường và phương sai bằng nhau. Phân tích và con số thống kê thế hệ được thực hiện bằng phần mềm phân tích gộp toàn diện (Comprehensive Meta-Analysis software) (BioStat Inc. , Englewood, NJ).
Phân tích gộp tất các các nghiên cứu toàn bộ 8715 bệnh nhân được đưa vào từ 31 nghiên cứu. Tỷ lệ tổng thể của AF mới được phát hiện bằng theo dõi ECG tiếp sau đột quỵ thiếu máu cục bộ hoặc TIA là 7,4 % (CI 95 % : 5,6 % , 9,7 %) (Hình 2A). Không đồng nhất có ý nghĩa được quan sát dựa trên số liệu thống kê Q cao 435,2 (p < 0,0001) và I2 của 90,12 % (Hình 2A).

Hình 2. Biểu đồ với tỷ lệ phát hiện AF: ( A) Tất cả; (B), theo dõi ECG ngắn hạn (72 giờ); và (C) theo dõi ECG dài hạn (≥ 7 ngày)
Hồi quy gộp sử dụng các mô hình khả năng tối đa không hạn chế để xác định mối quan hệ giữa thời gian theo dõi, tỷ lệ phát hiện AF thể hiện mối quan hệ dương đáng kể về mặt thống kê giữa tỷ lệ phát hiện AF và thời gian theo dõi (P < 0,001 cho độ dốc và ngưỡng chặn, R2: 62,1 %) (Hình 3). Mở rộng thời gian theo dõi ECG từ 24 giờ đến 30 ngày làm tăng tỷ lệ bệnh nhân được chẩn đoán AF từ 4,38 % đến 15,2 %, tiếp tục giám sát kéo dài đến 180 ngày dẫn đến những phát hiện AF ở 29.15 %.
Phân tích gộp các nghiên cứu với một trong hai trong theo dõi ECG ngắn hoặc dài hạn.
Phân tích gộp riêng rẻ được thực hiện trên các nghiên cứu với hoặc theo dõi ECG ngắn hạn (72 giờ) hoặc dài hạn (7 ngày) (Hình 2). Trong số 31 nghiên cứu, có 15 loại ngắn hạn và 16 dài hạn. Tỷ lệ mới được chẩn đoán AF theo dõi ECG ngắn hạn là 5,1 % (CI 95 %: 3,4 %, 7,5 %). Không đồng nhất được quan sát thấy một cách có ý nghĩa, với một số liệu thống kê của Q là 285,8 (p < 0,0001) và I2 là 91,3 % (Hình 2B). Tỷ lệ mới được chẩn đoán AF theo dõi ECG dài hạn là 15 % (95 % CI : 11 % , 19 %). Số lượng không đồng nhất có ý nghĩa thống kê với một thống kê của Q là 66.03 (p < 0,0001 ) và của I2 là 75,77 % (Bảng 1).
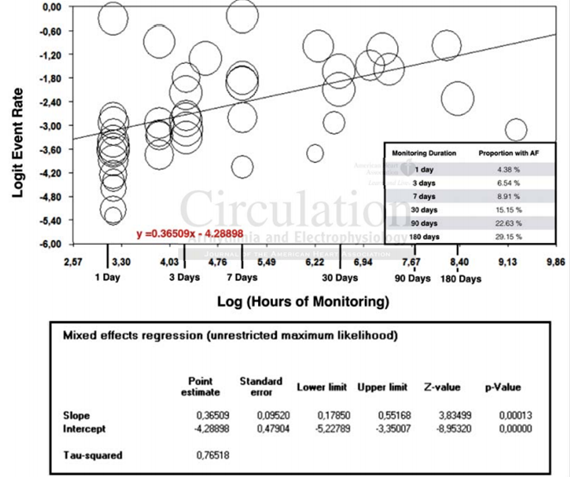
Hình 3: Phân tích hồi quy gộp đánh giá mối quan hệ giữa thời gian theo dõi AF và tỉ lệ biến cố AF. Trục Y: logarit của tỉ lệ tai biến. Trục X: logarit số giờ theo dõi. Mỗi vòng tròn đại diện cho một nghiên cứu. Kích thước vòng tròn khác nhau tùy theo số lượng đối tượng bao gồm trong mỗi nghiên cứu, với các nghiên cứu có số lượng lớn hơn có các vòng lớn hơn.
Khi đánh giá nguyên nhân của sự không đồng nhất thông qua việc sử dụng các phân tích nhóm nhỏ, chỉ có biến số xác định AF được xác định trước trong các nghiên cứu theo dõi lâu dài đã được tìm thấy có nguồn quan trọng của tính không đồng nhất (p = 0,006) (Bảng 1).
Theo dõi dài hạn đối lại với theo dõi ngắn hạn trong các thử nghiệm ngẫu nhiên có đối chứng. Tổng cộng có 3 RCT với 1.113 bệnh nhân so sánh trực tiếp theo dõi dài hạn với ngắn hạn để phát hiện khởi đầu các AF mới, với cỡ mẫu khác nhau từ 100 đến 572 người tham gia. Nhìn chung, theo dõi lâu dài đã được liên kết với một tỷ lệ chênh 7.26 phát hiện AF so với theo dõi ngắn hạn truyền thống (mô hình hiệu ứng cố định tỷ lệ chênh 7,26; CI 95 %: 4,04-13,04, p < 0,001). Không có sự không đồng nhất được quan sát thấy trong các nghiên cứu ( I2 = 0 %, p = 0,394) (Hình 4).
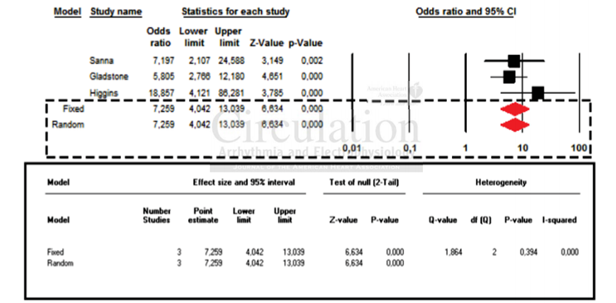
Hình 4. Biểu đồ các RCT so sánh dài hạn với theo dõi ngắn hạn.
Từ các kết quả trên có thể nhận định như sau:
Rung nhĩ là một nguyên nhân quan trọng của đột quỵ chưa rõ nguồn gốc, chịu trách nhiệm từ 20% đến 58 % của tất cả các biến cố não thiếu máu cục bộ. Tuy nhiên, việc phát hiện AF có thể khó bắt được và thời gian chính xác của việc giám sát sau đột quỵ chưa rõ nguồn gốc hiện vẫn chưa biết. Như vậy, mục đích chính của nghiên cứu này là xác định tăng thời gian theo dõi ECG được liên kết với một tỷ lệ lớn hơn phát hiện AF mới được chẩn đoán. Người ta thấy việc tăng thời gian theo dõi từ 24 giờ đến 30 ngày đã tăng gấp ba lần các phát hiện AF và kéo dài thời gian theo dõi đến 180 ngày tiếp tục tăng tỷ lệ chẩn đoán AF tới gần 30 %. Phát hiện này đã được hỗ trợ bằng 2 phân tích riêng biệt, kiểm tra ảnh hưởng của thời gian là cả một biến liên tục và lưỡng phân (dichotomous). Ngoài ra, một phân tích gộp các RCT đã chứng minh việc theo dõi lâu dài được kết hợp với tỷ lệ chênh đến 7 lần so với chẩn đoán AF bằng theo dõi ngắn hạn, tăng tỷ lệ chẩn đoán AF sau khi đột quỵ thiếu máu cục bộ hoặc TIA. Những kết quả này ủng hộ những thay đổi hướng dẫn gần đây đưa ra ít nhất 30 ngày theo dõi ECG sau đột quỵ chưa rõ nguồn gốc.
Mặc dù những phát hiện này, thời gian tối ưu theo dõi ECG sau đột quỵ thiếu máu cục bộ hoặc TIA vẫn chưa được xác định. Các kết quả nghiên cứu cho thấy nếu chúng ta mở rộng theo dõi ECG vô thời hạn, chúng ta sẽ tiếp tục chẩn đoán AF với một tỷ lệ ngày càng tăng. Tuy nhiên, chúng ta không thể kết luận rõ ràng các cơn AF từ xa từ các biến cố thiếu máu cục bộ não thực sự gây bệnh. Nếu chúng ta giả định một mối quan hệ nhân quả tồn tại mà không có bằng chứng rõ ràng, chúng ta có khả năng có thể chịu một số lượng lớn các bệnh nhân để can thiệp có nguy cơ cao như khởi đầu của thuốc chống đông máu mà không có một lợi ích rõ ràng. Như vậy, tiếp tục nghiên cứu là cần thiết để xác định xem việc phát hiện và điều trị của AF với theo dõi dài hạn thực sự cải thiện kết quả.
Mặc dù trong nghiên cứu này người ta không thể xác định thời gian tối ưu để theo dõi, nhưng đã chứng minh trong 30 ngày, gần 1/5 (một phần năm) số bệnh nhân bị đột quỵ chưa rõ nguồn gốc sẽ được chẩn đoán với AF. Đây là một phát hiện quan trọng đối với các thày thuốc điều trị các bệnh nhân, bệnh nhân đột quỵ thiếu máu cục bộ chưa rõ nguồn gốc có yếu tố nguy cơ rung nhĩ và nhiều yếu tố dự báo cho biến cố tắc mạch tái phát có thể được hưởng lợi từ các thuốc chống đông theo kinh nghiệm trong quá trình theo dõi ECG.
Những kết quả nghiên cứu phải được hiểu trong bối cảnh các thiết kế nghiên cứu. Không đồng nhất có ý nghiã được quan sát giữa các nghiên cứu phân tích gộp. Xác định các nguồn không đồng nhất này có khả năng có thể giúp tiếp tục xác định các phân nhóm bệnh nhân, trong đó giám sát dài hạn có nhiều khả năng để tăng cường phát hiện AF. Bất chấp nỗ lực để xác định các nguồn tiềm tàng của tính không đồng nhất ưu tiên, phân tích nhóm sử dụng các biến này đã thất bại để giải thích đầy đủ vấn đề này. Trong thực tế, nguồn duy nhất của tính không đồng nhất, người ta xác định các nghiên cứu đã có tiêu chí được xác định trước để chẩn đoán AF trong theo dõi ECG. Có thể giải thích cho sự bất lực để phát hiện nguồn của tính không đồng nhất do hầu hết các nghiên cứu còn nhỏ, trong đó giới hạn khả năng để phát hiện sự khác biệt trong nghiên cứu. Tuy nhiên, có thể có thêm nguồn không đồng nhất mà người ta đã không thể bao gồm: tuân thủ của bệnh nhân với sự theo dõi ECG; chất lượng khác nhau của các nghiên cứu; vị trí địa lý và đặc điểm bệnh nhân không được báo cáo. Một hạn chế của nghiên cứu này là không thể đánh giá trực tiếp tần số và thời gian ghi các cơn AF bao gồm trong các nghiên cứu. Mặc dù các cơn dài hơn và thường xuyên hơn của rung nhĩ sẽ thêm đáng kể hỗ trợ mối quan hệ nhân quả với đột quỵ chưa rõ nguồn gốc, điều này có thể không được liên quan lâm sàng như bất kỳ thời gian hoặc tần số phát hiện AF là đủ khả năng để xem xét thuốc chống đông máu ở những bệnh nhân có nguy cơ cao. Ngoài ra, người ta phân tích tổng hợp ngắn hạn và theo dõi dài hạn, trong đó phát hiện một sự khác biệt gần 10 % trong tỷ lệ chẩn đoán AF, tương tự như sự khác biệt tỷ lệ tìm thấy trong y văn hiện nay và củng cố hiệu lực của các kết quả này.
Kết luận
Từ kết quả của các nghiên cứu nhận thấy thời gian dài theo dõi ECG sau đột quỵ thiếu máu cục bộ hoặc cơn thiếu máu não cục bộ tạm thời làm tăng tỷ lệ chẩn đoán AF.
Các nghiên cứu trong tương lai là cần thiết để xác định thời gian tối ưu của việc theo dõi lâu dài tương ứng với mức giảm lớn nhất của hậu quả, chủ yếu là đột quỵ tái phát và tử vong.
Tài liệu tham thảo
1. Khoo CW, Lip GY. Clinical outcomes of acute stroke patients with atrial fibrillation. Expert Rev Cardiovasc Ther. 2009;7:371-374.
2. Healey JS, Connolly SJ, Gold MR, Israel CW, Van Gelder IC, Capucci A, Lau CP, Fain E, Yang S, Bailleul C, Morillo CA, Carlson M, Themeles E, Kaufman ES, Hohnloser SH. Subclinical atrial fibrillation and the risk of stroke. N Engl J Med. 2012;366:120-129.
3. January CT, Wann LS, Alpert JS, Calkins H, Cleveland JC, Jr., Cigarroa JE, Conti JB, Ellinor PT, Ezekowitz MD, Field ME, Murray KT, Sacco RL, Stevenson WG, Tchou PJ, Tracy CM, Yancy CW. 2014 aha/acc/hrs guideline for the management of patients with atrial fibrillation: Executive summary: A report of the american college of cardiology/american heart association task force on practice guidelines and the heart rhythm society. J Am Coll Cardiol. 2014;64:e1- 76.
4. Jauch EC, Saver JL, Adams HP, Jr., Bruno A, Connors JJ, Demaerschalk BM, Khatri P, McMullan PW, Jr., Qureshi AI, Rosenfield K, Scott PA, Summers DR, Wang DZ, Wintermark M, Yonas H, American Heart Association Stroke C, Council on Cardiovascular N, Council on Peripheral Vascular D, Council on Clinical C. Guidelines for the early management of patients with acute ischemic stroke: A guideline for healthcare professionals from the american heart association/american stroke association. Stroke. 2013;44:870-947.
5. Kernan WN, Ovbiagele B, Black HR, Bravata DM, Chimowitz MI, Ezekowitz MD, Fang MC, Fisher M, Furie KL, Heck DV, Johnston SC, Kasner SE, Kittner SJ, Mitchell PH, Rich MW, Richardson D, Schwamm LH, Wilson JA, American Heart Association Stroke Council CoC, Stroke Nursing CoCC, Council on Peripheral Vascular D. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack: A guideline for healthcare professionals from the american heart association/american stroke association. Stroke. 2014;45:2160-2236.
6. Moher D, Liberati A, Tetzlaff J, Altman DG, Group P. Preferred reporting items for systematic reviews and meta-analyses: The prisma statement. J Clinical Epidemiol. 2009;62:1006-1012.
7. Gladstone DJ, Spring M, Dorian P, Panzov V, Thorpe KE, Hall J, Vaid H, O’Donnell M, Laupacis A, Cote R, Sharma M, Blakely JA, Shuaib A, Hachinski V, Coutts SB, Sahlas DJ, Teal P, Yip S, Spence JD, Buck B, Verreault S, Casaubon LK, Penn A, Selchen D, Jin A, Howse D, Mehdiratta M, Boyle K, Aviv R, Kapral MK, Mamdani M. Atrial fibrillation in patients with cryptogenic stroke. N Engl J Med. 2014;370:2467-2477.
8. Higgins P, MacFarlane PW, Dawson J, McInnes GT, Langhorne P, Lees KR. Noninvasive cardiac event monitoring to detect atrial fibrillation after ischemic stroke: A randomized, controlled trial. Stroke. 2013;44:2525-2531
9. Sanna T, Diener HC, Passman RS, Di Lazzaro V, Bernstein RA, Morillo CA, Rymer MM, Thijs V, Rogers T, Beckers F, Lindborg K, Brachmann J. Cryptogenic stroke and underlyingatrial fibrillation. N Engl J Med. 2014;370:2478-2486.
10. Barthelemy JC, Feasson-Gerard S, Garnier P, Gaspoz JM, Da Costa A, Michel D, Roche F. Automatic cardiac event recorders reveal paroxysmal atrial fibrillation after unexplained strokes or transient ischemic attacks. Ann Noninvasive Electrocardiol. 2003;8:194-199.
11. Cotter PE, Martin PJ, Ring L, Warburton EA, Belham M, Pugh PJ. Incidence of atrial fibrillation detected by implantable loop recorders in unexplained stroke. Neurol. 2013;80:1546- 1550. 12. Dangayach NS, Kane K, Moonis M. Paroxysmal atrial fibrillation in cryptogenic stroke. Ther Clin Risk Manag. 2011;7:33-37.
13. Dion F, Saudeau D, Bonnaud I, Friocourt P, Bonneau A, Poret P, Giraudeau B, Regina S, Fauchier L, Babuty D. Unexpected low prevalence of atrial fibrillation in cryptogenic ischemic stroke: A prospective study. J Interv Card Electrophysiol. 2010;28:101-107.
14. Etgen T, Hochreiter M, Mundel M, Freudenberger T. Insertable cardiac event recorder in detection of atrial fibrillation after cryptogenic stroke: An audit report. Stroke. 2013;44:2007- 2009.
15. Flint AC, Banki NM, Ren X, Rao VA, Go AS. Detection of paroxysmal atrial fibrillation by 30-day event monitoring in cryptogenic ischemic stroke: The stroke and monitoring for paf in real time (smart) registry. Stroke. 2012;43:2788-2790.
16. Grond M, Jauss M, Hamann G, Stark E, Veltkamp R, Nabavi D, Horn M, Weimar C, Kohrmann M, Wachter R, Rosin L, Kirchhof P. Improved detection of silent atrial fibrillation using 72-hour holter ecg in patients with ischemic stroke: A prospective multicenter cohort study. Stroke. 2013;44:3357-3364.
17. Gunalp M, Atalar E, Coskun F, Yilmaz A, Aksoyek S, Aksu NM, Sivri B. Holter monitoring for 24 hours in patients with thromboembolic stroke and sinus rhythm diagnosed in the emergency department. Adv ther. 2006;23:854-860.
18. Jabaudon D, Sztajzel J, Sievert K, Landis T, Sztajzel R. Usefulness of ambulatory 7-day ecg monitoring for the detection of atrial fibrillation and flutter after acute stroke and transient ischemic attack. Stroke. 2004;35:1647-1651.
19. Kallmunzer B, Breuer L, Hering C, Raaz-Schrauder D, Kollmar R, Huttner HB, Schwab S, Kohrmann M. A structured reading algorithm improves telemetric detection of atrial fibrillation after acute ischemic stroke. Stroke. 2012;43:994-999.
20. Kamel H, Navi BB, Elijovich L, Josephson SA, Yee AH, Fung G, Johnston SC, Smith WS. Pilot randomized trial of outpatient cardiac monitoring after cryptogenic stroke. Stroke. 2013;44:528-530.
21. Rem JA, Hachinski VC, Boughner DR, Barnett HJ. Value of cardiac monitoring and echocardiography in tia and stroke patients. Stroke. 1985;16:950-956.
22. Ritter MA, Kochhauser S, Duning T, Reinke F, Pott C, Dechering DG, Eckardt L, Ringelstein EB. Occult atrial fibrillation in cryptogenic stroke: Detection by 7-day electrocardiogram versus implantable cardiac monitors. Stroke. 2013;44:1449-1452.
23. Rizos T, Guntner J, Jenetzky E, Marquardt L, Reichardt C, Becker R, Reinhardt R, Hepp T, Kirchhof P, Aleynichenko E, Ringleb P, Hacke W, Veltkamp R. Continuous stroke unit electrocardiographic monitoring versus 24-hour holter electrocardiography for detection of paroxysmal atrial fibrillation after stroke. Stroke. 2012;43:2689-2694.
24. Rizos T, Rasch C, Jenetzky E, Hametner C, Kathoefer S, Reinhardt R, Hepp T, Hacke W, Veltkamp R. Detection of paroxysmal atrial fibrillation in acute stroke patients. Cerebrovasc Dis. 2010;30:410-417.
25. Schuchert A, Behrens G, Meinertz T. Impact of long-term ecg recording on the detection of paroxysmal atrial fibrillation in patients after an acute ischemic stroke. Pacing Clin Electrophysiol. 1999;22:1082-1084.
26. Simova I, Mateev H, Katova T, Haralanov L, Dimitrov N. Telemonitoring boosts atrial fibrillation detection in cyptogenic stroke patients – preliminary findings. Cardiol Angiol. 2013;1:47-57.
27. Stahrenberg R, Weber-Kruger M, Seegers J, Edelmann F, Lahno R, Haase B, Mende M, Wohlfahrt J, Kermer P, Vollmann D, Hasenfuss G, Groschel K, Wachter R. Enhanced detection of paroxysmal atrial fibrillation by early and prolonged continuous holter monitoring in patients with cerebral ischemia presenting in sinus rhythm. Stroke. 2010;41:2884-2888.
28. Suissa L, Lachaud S, Mahagne MH. Optimal timing and duration of continuous electrocardiographic monitoring for detecting atrial fibrillation in stroke patients. J Stroke Cerebrovasc Dis. 2013;22:991-995.
29. Sulter G, Elting JW, Langedijk M, Maurits NM, De Keyser J. Admitting acute ischemic stroke patients to a stroke care monitoring unit versus a conventional stroke unit: A randomized pilot study. Stroke. 2003;34:101-104.
30. Thakkar S, Bagarhatta R. Detection of paroxysmal atrial fibrillation or flutter in patients with acute ischemic stroke or transient ischemic attack by holter monitoring. Indian heart J. 2014;66:188-192.
31. Tu HT, Spence S, Kalman JM, Davis SM. Twenty-eight day holter monitoring is poorly tolerated and insensitive for paroxysmal atrial fibrillation detection in cryptogenic stroke. Intern Med J. 2014;44:505-508.
32. Wachter R, Weber-Kruger M, Seegers J, Edelmann F, Wohlfahrt J, Wasser K, Gelbrich G, Hasenfuss G, Stahrenberg R, Liman J, Groschel K. Age-dependent yield of screening for undetected atrial fibrillation in stroke patients: The find-af study. J Neurol. 2013;260:2042-2045.
33. Wallmann D, Tuller D, Wustmann K, Meier P, Isenegger J, Arnold M, Mattle HP, Delacretaz E. Frequent atrial premature beats predict paroxysmal atrial fibrillation in stroke patients: An opportunity for a new diagnostic strategy. Stroke. 2007;38:2292-2294.
34. Gumbinger C, Krumsdorf U, Veltkamp R, Hacke W, Ringleb P . Continuous Monitoring versus HOLTER ECG for Detection of Atrial Fibrillation in Patients with Stroke. Eur J Neurol. 2012;19:253-257.
35. Doliwa Sobocinski P, Anggardh Rooth E, Frykman Kull V, von Arbin M, Wallen H, Rosenqvist M. Improved screening for silent atrial fibrillation after ischaemic stroke. Europace. 2012;14:1112-1116.
36. Bansil S, Karim H. Detection of Atrial Fibrillation in Patients with Acute Stroke. J Stroke Cerebrovasc Dis. 2004;13:12-15.
37. Jickling GC, Stamova B, Ander BP, Zhan X, Liu D, Sison SM, Verro P, Sharp FR. Prediction of cardioembolic, arterial, and lacunar causes of cryptogenic stroke by gene expression and infarct location. Stroke. 2012;43:2036-2041.
38. Reiffel JA. Atrial fibrillation and stroke: Epidemiology. Am J Med. 2014;127:e15-16.
39. Koudstaal PJ, van Gijn J, Klootwijk AP, van der Meche FG, Kappelle LJ. Holter monitoring in patients with transient and focal ischemic attacks of the brain. Stroke. 1986;17:192-195.
40. Lazzaro MA, Krishnan K, Prabhakaran S. Detection of atrial fibrillation with concurrent holter monitoring and continuous cardiac telemetry following ischemic stroke and transient ischemic attack. J Stroke Cerebrovasc Dis. 2012;21:89-93.
41. Alan Cheng, MD. Kapil Kumar, MD. Overview of atrial fibrillation. This topic last updated:Oct 21, 2014.
42. Leonard I Ganz, MD, FHRS, FACC. Epidemiology of and risk factors for atrial fibrillation. This topic last updated:Oct 21, 2014.







