BS. HUỲNH ANH KIỆT
BS. NGUYỄN THANH HIỀN
- Khoa nội TM, BV Đại Học Y Dược, Tp. Hồ Chí Minh
1. Giới thiệu
Nhiễm trùng do vi khuẩn và virus nặng có thể gây rối loạn đông máu, được định nghĩa là bất kỳ sự thay đổi hoặc rối loạn đông cầm máu dẫn đến chảy máu, đông máu hoặc cả hai.1 Cụ thể hơn, sự mất cân bằng điều hòa giữa tạo huyết khối và tiêu sợi huyết có thể dẫn đến đông máu, chảy máu quá mức, hoặc cả hai, tùy thuộc vào phản ứng miễn dịch và viêm của bệnh nhân thay đổi theo thời gian. 2 3 Thuốc chống huyết khối sử dụng ngày càng tăng trên toàn thế giới, với tốc độ gia tăng hàng năm dự đoán gần 8% trong khoảng thời gian từ 2022 đến 2029, tỷ lệ này tại các nước ở Châu Âu khoảng 15%–20%. 4 5 Do đó, việc sử dụng thuốc chống huyết khối ở những bệnh nhân bị nhiễm trùng nặng là một thách thức lâm sàng thường gặp. Các quyết định lâm sàng nên cân bằng giữa nguy cơ huyết khối và chảy máu liên quan đến nhiễm trùng nặng cũng như tiền căn bệnh huyết khối động mạch và/hoặc tĩnh mạch cần dùng thuốc chống huyết khối. Bài viết này nhằm cập nhật hướng dẫn hiện nay về sử dụng thuốc chống huyết khối ở bệnh nhân nhiễm trùng huyết.
2. Sinh lý bệnh của hoạt hoá tiểu cầu và rối loạn đông máu trong nhiễm trùng huyết
Thuật ngữ viêm huyết khối đề cập đến nguyên nhân hình thành huyết khối liên quan đến viêm và được sử dụng để mô tả sinh lý bệnh tổn thương nội mô mạch máu và/hoặc không còn chức năng chống huyết khối và kháng viêm. 6 Kết quả là, cả hai cơ chế viêm tế bào và thể dịch của giám sát miễn dịch (immune surveillance) đều được kích hoạt. Trong các bệnh nhiễm trùng cấp tính, tình trạng viêm huyết khối có thể tạo huyết khối vi mạch, đây là dấu hiệu đặc trưng của bệnh, đã được báo cáo trong các nghiên cứu bệnh nhân hội chứng suy hô hấp cấp tính do tác nhân gây bệnh qua đường hô hấp tử vong và gây ra phản ứng viêm liên quan với tổn thương phổi cấp tính. 7 Phản ứng viêm huyết khối này ngày càng được xác nhận do bệnh vi-rút Corona 2019 (Covid-19). 8Phản ứng này đối với nhiễm trùng huyết cũng xảy ra sau tổn thương thiếu máu cục bộ-tái tưới máu9 (ischaemia–reperfusion injury), chấn thương, thải ghép, tuần hoàn ngoài cơ thể và có thể gây biến chứng DIC (đông máu rải rác nội mạch). 2 Tình trạng viêm huyết khối, mất chức năng tế bào nội mô và phản ứng viêm toàn thân dẫn đến tổn thương thể dịch và tế bào.
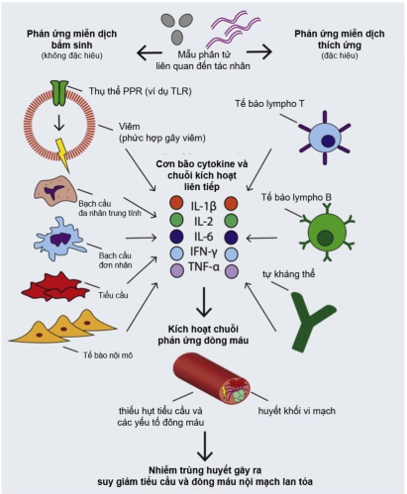
Hình 1: Sinh lý bệnh của rối loạn đông máu trong nhiễm trùng huyết.10
2.1 Sinh lý bệnh của hoạt hóa tiểu cầu trong nhiễm trùng huyết
Phản ứng tiểu cầu tăng lên trong quá trình nhiễm trùng huyết 11. Tiểu cầu có các thụ thể mẫu phân tử liên quan đến tổn thương (DAMP) như TLR 4 (Toll-like receptor 4), được kích hoạt bởi nội độc tố của vi khuẩn 12. Nồng độ các hormone như epinephrine và 5-hydroxytryptamine trong máu tăng lên trong quá trình nhiễm trùng huyết cũng làm tăng phản ứng tiểu cầu thông qua các thụ thể chuyên biệt 13,14. Tương tác giữa các con đường đông máu nội bào và ngoại bào đóng vai trò quan trọng, nhiễm trùng huyết cũng liên quan đến việc tăng tạo thrombin bởi dòng thác đông máu, kích hoạt tiểu cầu thông qua các thụ thể liên quan protease (PAR, protease- associated receptors) 1 và 4 15.
Sau khi kích hoạt tiểu cầu, một số quá trình liên quan trực tiếp đến nhiễm trùng huyết xảy ra. Các hạt dày đặc và alpha kết hợp với màng tế bào 15. Các hạt đậm đặc rất giàu adenosine diphosphate, chất này tiếp tục kích hoạt tiểu cầu thông qua các thụ thể P2Y 1 và P2Y 12, trong khi các hạt alpha chứa P-selectin làm trung gian kích hoạt bạch cầu thông qua liên kết với phân tử P-selectin GP (PSGL)-1; chemokine; và các yếu tố gây đông máu. Kết tập tiểu cầu, hình thành vi huyết khối hoặc cục máu đông, bằng cách kích hoạt GPIIb/IIIa, kết nối bởi fibrinogen hoặc yếu tố von Willebrand (vWF). Mức độ tổng hợp fibrinogen và vWF tăng lên trong quá trình nhiễm trùng huyết, vWF cũng tạo thuận lợi cho tiểu cầu bám vào nội mạc mạch máu 16. Tương tác cơ học cũng làm tăng hiệu quả kết tập tiểu cầu do chúng thay đổi từ hình đĩa sang hình sao 17. Kích thích cyclo‑oxygenase tiểu cầu trong quá trình kích hoạt tiểu cầu tạo ra eicosanoids điều hòa viêm Thromboxane A2 và prostaglandin E2 18.
Có bằng chứng cho thấy các cytokine được giải phóng trong quá trình nhiễm trùng huyết cũng có thể kích hoạt trực tiếp tiểu cầu, ví dụ IL-6 có thể kích thích glycoprotein thụ thể collagen (GP) VI 19. Nhiễm trùng huyết cũng liên quan đến việc tăng giải phóng tiểu cầu từ tủy xương dẫn đến tăng tiểu cầu, qua trung gian là tăng nồng độ trompoetin và tăng cường hoạt động của các cytokine như IL-6 20. Hình 2 cho thấy vai trò của dòng tiểu cầu và đông máu ở bệnh nhân nhiễm trùng huyết.
2.2 Sinh lý bệnh của hoạt hóa quá trình đông máu trong nhiễm trùng huyết
Tổn thương nội mô do độc tố vi khuẩn dẫn đến điều hòa lại yếu tố mô, kích hoạt yếu tố VII và con đường đông máu ngoại sinh 21 (Hình 2). Tương tác với con đường đông máu nội sinh thông qua kích hoạt yếu tố VIIa bởi yếu tố IX. Việc tạo ra thrombin cũng dẫn đến kích hoạt tiểu cầu và ngược lại, tiểu cầu được kích hoạt góp phần tạo ra trombin qua màng và giải phóng các yếu tố đông máu khi thoái hóa. Cùng với sự gia tăng các yếu tố thúc đẩy đông máu, quá trình tiêu sợi huyết được thực hiện qua trung gian bởi chất ức chế tiêu sợi huyết có thể kích hoạt bằng thrombin (TAFI) 22.
Các quá trình này có liên quan đến những thay đổi đáng kể trong động học của cục máu đông fibrin, bao gồm giảm đường kính sợi fibrin và tăng mật độ mạng lưới cũng như độ đục của cục máu đông và diện tích ly giải 23.
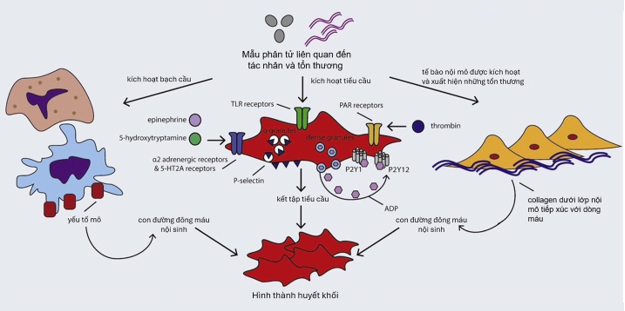
Hình 2. Vai trò của tiểu cầu và quá trình đông máu ở bệnh nhân nhiễm trùng huyết10.
3. Bệnh nhân nhiễm trùng nặng đang điều trị kháng kết tập tiểu cầu
3.1. Bệnh nhân có nhiều yếu tố nguy cơ tim mạch và các yếu tố tăng them (Patients with multiple cardiovascular risk factors and enhancers)
Hướng dẫn gần đây của Hội Tim Mạch Châu Âu đã phân loại nguy cơ tim mạch cao hoặc rất cao đối với bệnh nhân không có bệnh tim mạch do xơ vữa động mạch (ASCVD), dựa trên sự hiện diện của nhiều yếu tố nguy cơ, nguy cơ suốt đời cao gây ASCVD, và gánh nặng mảng xơ vữa động mạch có bằng chứng. Bệnh nhân có tiền căn can thiệp mạch vành qua da mà không ghi nhận nhồi máu cơ tim (MI) được nêu trong phần bệnh nhân dùng kháng kết tập tiểu cầu đơn.
Mặc dù axit acetylsalicylic (ASA) không nên dùng thường xuyên cho bệnh nhân không có tiền sử bệnh xơ vữa động mạch có triệu chứng, các khuyến cáo cho rằng ASA cân nhắc dùng ở bệnh nhân bệnh mạch vành hoặc bệnh động mạch ngoại biên đáng kể được ghi nhận trên hình ảnh hoặc đái tháo đường có tổn thương cơ quan và/hoặc tồn tại lâu dài và/hoặc nhiều yếu tố nguy cơ khác.24 25,26 Hơn nữa, mức độ canxi động mạch vành cao (hầu hết ≥100 Agatston) 27 đã được đề xuất là yếu tố làm tăng nguy cơ tim mạch, giúp đánh giá và phân loại nguy cơ tim mạch và xác định những bệnh nhân có thể nhận được lợi ích ròng từ việc điều trị dự phòng bằng ASA liều thấp.
Các yếu tố nguy cơ tim mạch tăng nguy cơ tạo huyết khối, thúc đẩy sự tiến triển của mảng xơ vữa động mạch, và có thể làm giảm đáp ứng miễn dịch khi nhiễm trùng nặng. Do rối loạn chức năng miễn dịch và tỷ lệ đề kháng kháng sinh cao, bệnh nhân mắc bệnh đái tháo đường típ 2 có nguy cơ nhiễm trùng cao và tỷ lệ nhiễm trùng huyết cao gấp 2 đến 6 lần so với các đối tượng mắc bệnh đái tháo đường không phải típ 2.28
Hiệu quả và an toàn của việc tiếp tục dùng ASA liều thấp ở bệnh nhân có tình trạng giảm tiểu cầu trầm trọng và nhiễm trùng nặng chưa được nghiên cứu trong các thử nghiệm lâm sàng ngẫu nhiên (RCTs), vì giảm tiểu cầu là tiêu chí loại trừ trong tất cả các RCT về thuốc chống huyết khối. Tuy nhiên, không có nguy cơ chảy máu tăng lên ở các nơi ngoài ICU ở bệnh nhân ung thư có ASCVD với số lượng tiểu cầu <100 × 10^9/L dùng ASA (số lượng tiểu cầu trung bình ở bệnh nhân giảm tiểu cầu là 32 × 10^9/L), cho thấy bằng chứng về nguy cơ/lợi ích, ủng hộ dùng ASA ngay cả bệnh nhân giảm tiểu cầu độ nhẹ đến trung bình. Đặc biệt, ASA có tác dụng chống viêm ở liều cao hơn so với liều phòng ngừa bệnh tim mạch, mặc dù một số dữ liệu cho thấy tác dụng chống viêm gián tiếp ở liều thấp hơn. Tuy nhiên, việc bắt đầu sử dụng ASA trong quá trình nhập viện do nhiễm virus SARS-CoV-2 không làm giảm tỷ lệ tử vong so với giả dược mặc dù rút ngắn thời gian nằm viện đáng kể. Tuy nhiên, một số nghiên cứu quan sát và phân tích tổng hợp đã gợi ý lợi ích sống sót của điều trị chống kết tập tiểu cầu, chủ yếu là ASA, bắt đầu trong quá trình nhập viện đặc biệt ở bệnh nhân nhiễm trùng nặng hoặc nhiễm trùng huyết. Cần cân nhắc thêm về việc dùng kháng đông dự phòng bằng heparin có trọng lượng phân tử thấp (LMWH) hoặc không phân đoạn (UFH) ở tất cả bệnh nhân nhiễm trùng nặng đang nằm tại giường hoặc có đông máu do nhiễm trùng (SIC), nhằm giảm nguy cơ thuyên tắc tĩnh mạch (VTE). Một số tình huống có gánh nặng huyết khối cao, bao gồm SARS-CoV-2, có thể dùng liều cao hơn liều dự phòng (trung gian hoặc điều trị). Việc sử dụng heparin ở liều dự phòng hoặc cao hơn nên cân nhắc với nguy cơ chảy máu ở từng bệnh nhân.29
Các tác giả khuyến cáo những bệnh nhân đã sử dụng ASA liều thấp do nguy cơ tim mạch cao và rất cao bởi nhiều yếu tố nguy cơ, nhưng không có tiền sử mắc bệnh tim mạch xơ vữa có triệu chứng (ASCVD), ASA liều thấp nên được duy trì, nhưng có thể cần điều chỉnh tùy theo diễn tiến của nhiễm trùng nặng và mức độ SIC (sepsis-induced coagulopathy, đông máu do nhiễm trùng, bảng 1) và giảm tiểu cầu (ý kiến đồng thuận 1 và bảng 2).
Bảng 1. Bảng điểm đánh giá rối loạn đông máu do nhiễm trùng huyết (SIC)29
| Chỉ số | Điểm 0 | Điểm 1 | Điểm 2 |
| Thời gian Prothrombin (PT-INR) | >1.2 | 1.2–1.4 | >1.4 |
| Số lượng tiểu cầu (x10^9/L) | >150 | 100–149 | <100 |
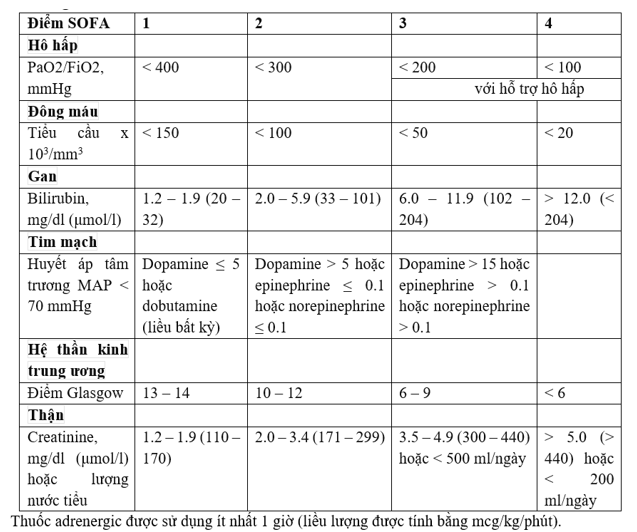
| Tổng điểm SOFAb (hô hấp, tim mạch, gan, và thận) | 0 | 1 | ≥2 |
Ghi chú:
- SOFA, Đánh giá suy đa cơ quan; INR, tỷ lệ chuẩn hóa quốc tế.
- Được điều chỉnh từ Iba et al.35
- Tổng điểm SIC ≥4 tương ứng với DIC ≥ 5 36
- Điểm SOFA trong đánh giá SIC không bao gồm triệu chứng liên quan tinh thần vì nó được thiết kế nhằm đánh giá lâm sàng liên quan nhiễm trùng huyết
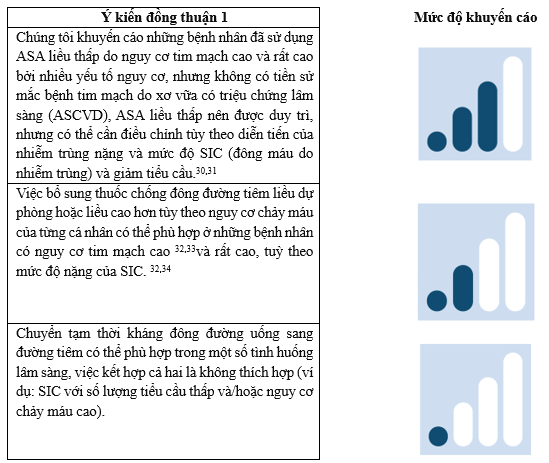
Bảng 2: Liệu pháp chống huyết khối ở bệnh nhân có nhiều yếu tố nguy cơ tim mạch và không có tiền sử ASCVD có triệu chứng29
| Bệnh cảnh lâm sàng | Trong thời gian nhiễm trùng | Sau khi khỏi bệnh |
| Nhiễm trùng nặng chỉ dùng chống huyết khối dự phòng khi có chỉ định | Không dùng chống kết tập tiểu cầu thường quy, SAPT theo chỉ định trước đó.
Kháng đông dự phòng ª |
SAPT theo chỉ định trước đó
Không dùng kháng đông dự phòng thường quy b |
| Nhiễm trùng nặng và số lượng tiểu cầu ≥20 × 109/L | Không dùng chống kết tập tiểu cầu thường quy, SAPT theo chỉ định trước đó
Kháng đông dự phòng |
SAPT theo chỉ định trước đó
Không dùng kháng đông dự phòng thường quy b |
| Nhiễm trùng nặng và số lượng tiểu cầu <20 × 109/L | Không dùng chống kết tập tiểu cầu
Kháng đông dự phòng cho bệnh nhân có nguy cơ huyết khối cao |
SAPT theo chỉ định trước đó
Không dùng kháng đông dự phòng thường quy b |
| Nhiễm trùng nặng và số lượng tiểu cầu <20 × 109/L và suy đa cơ quan | Không dùng thuốc chống huyết khối | SAPT theo chỉ định trước đó
Không dùng kháng đông dự phòng thường quy b |
ASCVD, bệnh tim mạch do xơ vữa động mạch; SAPT, liệu pháp kháng kết tập tiểu cầu đơn, thường là aspirin liều thấp.
a Có thể dùng thuốc kháng đông liều điều trị ở những bệnh nhân không có nguy cơ chảy máu cao.
b Có thể xem xét dự phòng huyết khối ở những bệnh nhân có nguy cơ cao (bất động kéo dài, tiền sử huyết khối tĩnh mạch, tuổi cao, béo phì, ung thư, rối loạn đông máu, tăng nồng độ D-dimer và hoạt tính viêm cao) và nguy cơ chảy máu thấp.
3.2. Bệnh nhân đang dùng kháng kết tập tiểu cầu đơn
Theo các khuyến cáo hiện nay, liệu pháp kháng kết tập tiểu cầu đơn (SAPT, single antiplatelet therapy), chủ yếu dùng ASA liều thấp ở bệnh nhân có bệnh tim mạch do xơ vữa (ASCVD, atherosclerotic cardiovascular disease) có triệu chứng ổn định hoặc tái thông mạch máu trước đó mà không có tiền sử nhồi máu cơ tim. 24,26 Bệnh nhân ASCVD dễ nhiễm virus, vi khuẩn gây nhiễm trùng và nhiễm trùng huyết nặng hơn. Hơn nữa, những người sống sót sau nhiễm trùng huyết tăng nguy cơ bị các biến cố mạch máu lớn trong tương lai. 35
Chảy máu tăng theo mức độ giảm tiểu cầu, đặc biệt đối với số lượng tiểu cầu <25 × 10 G/L, với tỷ lệ chảy máu khoảng 15%/năm ở bệnh nhân giảm tiểu cầu 36 so với khoảng 0,07%/năm ở người bình thường.37 Bằng chứng về hiệu quả và độ an toàn SAPT ở bệnh nhân tim mạch giảm tiểu cầu còn hạn chế do những bệnh nhân này bị loại khỏi các thử nghiệm tim mạch. Các biến cố thiếu máu cục bộ và chảy máu cấp tính ở bệnh nhân giảm tiểu cầu do nhiều nguyên nhân khác nhau có liên quan đến tỷ lệ tử vong tăng gấp 4 đến 5 lần so với các đối tượng không bị giảm tiểu cầu37 36
Axit acetylsalicylic được sử dụng để phòng ngừa thứ phát không làm tăng đáng kể tình trạng xuất huyết nặng với số lượng tiểu cầu >20 × 10 G/L 92 trong khi với tiểu cầu =<20 × 10/9/L, dữ liệu không ủng hộ tiếp tục dùng SAPT. Tuy nhiên, dữ liệu về SAPT trong giảm tiểu cầu nặng và nhiễm trùng huyết còn thiếu. Xuất huyết tiêu hóa trong quá trình điều trị chống huyết khối có thể phòng ngừa được bằng các thuốc bảo vệ dạ dày bao gồm thuốc ức chế bơm proton (PPI), 38 nên được sử dụng trong nhiễm trùng huyết, bệnh đông máu liên quan nhiễm trùng huyết (SIC) giảm tiểu cầu và/hoặc LMWH dự phòng khi dùng SAPT. 39 Chiến lược dùng thuốc nên dựa theo điểm SIC và SOFA (đồng thuận 2, bảng1, 3, 4)
Bảng 3. Điểm SOFA

3.3. Bệnh nhân đang dùng kháng tiểu cầu kép
Khi bệnh nhân bị nhiễm trùng nặng đang dùng kháng tiểu cầu kép (DAPT) bao gồm ASA và thuốc ức chế P2Y12, các nghiên cứu quan sát lớn ủng hộ sự an toàn của tiếp tục DAPT trong bối cảnh này, nhưng bằng chứng từ các nghiên cứu ngẫu nhiên về sự cân bằng giữa hiệu quả và tính an toàn, đặc biệt tiến trình của SIC còn thiếu. 43 44 Đối với hầu hết bệnh nhân được điều trị bằng ASA và clopidogrel, có thể ngừng ASA hoặc clopidogrel 45 và bắt đầu sử dụng SAPT từ 3 đến 6 tháng sau khi can thiệp mạch vành qua da (PCI) và/hoặc hội chứng mạch vành cấp (ACS), tăng nguy cơ huyết khối trong stent không đáng kể. 46
Điều quan trọng là, ở những bệnh nhân bị nhiễm trùng huyết nặng khi dùng ticagrelor hoặc clopidogrel, các tương tác thuốc tiềm ẩn có ý nghĩa lâm sàng với các thuốc kháng sinh phải được xem xét do sự biến đổi sinh học phụ thuộc CYP450 của chúng. Hơn nữa, khoảng 25% trong số bệnh nhân dùng ticagrelor bị khó thở liên quan thuốc, và có thể cần chẩn đoán phân biệt. 47 Cần thận trọng với clopidogrel nếu có rối loạn chức năng gan trong quá trình nhiễm trùng nặng vì điều này có thể làm giảm hiệu quả kháng kết tập tiểu cầu. Ticagrelor cũng chống chỉ định ở bệnh nhân suy gan nặng do tăng nồng độ thuốc trong máu dẫn dến tăng nguy cơ chảy máu.
Vì thrombin cũng là một chất kích hoạt tiểu cầu mạnh, nên thuốc chống đông máu cũng có thể làm giảm kích hoạt tiểu cầu, 48 49 bên cạnh việc làm giảm khả năng cầm máu thứ phát. Do đó, liệu pháp chống huyết khối nên được điều chỉnh cẩn thận ở bệnh nhân dùng DAPT bị nhiễm trùng nặng cần dùng thuốc kháng đông hoặc đang bị rối loạn đông máu (ý kiến đồng thuận 3, bảng 1, 3,4).
 4. Bệnh nhân đang dùng thuốc kháng đông đường uống
4. Bệnh nhân đang dùng thuốc kháng đông đường uống
Thuốc chống đông máu, bao gồm antitrombin và thrommodulin hòa tan, có thể giúp kết cục lâm sàng tốt hơn ở bệnh nhân có bệnh đông máu do nhiễm trùng huyết bằng cách cải thiện chức năng các cơ quan, đặc biệt với bệnh nhân có tiền căn bệnh đông máu.51
Trong phân tích tổng hợp 24 thử nghiệm (14.767 bệnh nhân) đề cập đến nhiều vấn đề khác nhau thuốc chống đông máu trong nhiễm trùng huyết, chỉ bệnh nhân bị DIC liên quan đến nhiễm trùng huyết có tỉ lệ tử vong giảm.52 Tuy nhiên, có nguy cơ chảy máu tăng lên và chỉ có năm nghiên cứu sử dụng heparin làm thuốc chống đông máu. Một phân tích tổng hợp gồm 9 nghiên cứu với liều dự phòng heparin không phân đoạn hoặc heparin trọng lượng phân tử thấp trong nhiễm trùng huyết ghi nhận giảm đáng kể tỷ lệ tử vong mà không làm tăng nguy cơ xuất huyết. 52
Trong thực hành, nên xem xét tương tác thuốc với từng loại kháng đông đường uống (OAC, oral anticoagulation), kháng vitamin K (VKA, Vitamin K Antagonist) hoặc thuốc kháng đông đường uống trực tiếp (DOAC, Direct oral anticoagulants) dựa trên sự biến đổi sinh học liên quan đến P-glycoprotein- và/hoặc CYP450. Các loại thuốc cạnh tranh dưới dạng chất nền, chất ức chế hoặc chất tăng cường hoạt động của chúng có thể ảnh hưởng đến hiệu quả và/hoặc độ an toàn của warfarin; do đó, việc theo dõi INR phải thường xuyên hơn để điều chỉnh liều lượng. Dabigatran bị chống chỉ định dùng với các thuốc ức chế P-glycoprotein mạnh bao gồm thuốc kháng nấm azole, một số thuốc kháng vi rút, trong khi nên thận trọng khi dùng cùng clarithromycin. Nên giảm liều Edoxaban bằng các chất ức chế P-glycoprotein mạnh, và rivaroxaban và apixaban không được khuyến cáo dùng với các thuốc có chứa chất ức chế mạnh cả P-glycoprotein và CYP3A4 (thuốc chống nấm azole và thuốc ức chế protease HIV) (ý kiến đồng thuận 4, bảng 3,4).


Bảng 4. Sử dụng thuốc ở bệnh nhân đang dùng thuốc chống huyết khối, điểm SOFA là 1, và SIC tăng dần29
| Điểm SIC | Cận lâm sàng | Bệnh nhân dùng SAPT | Bệnh nhân dùng DAPT | Bệnh nhân dùng OAC lâu dài | Bệnh nhân dùng OAC sau biến cố huyết khối gần đây |
| SIC score = 2 | Số lượng tiểu cầu 100–149 × 109/L hoặc tỉ lệ PT 1.2–1.4 | Không thay đổi | <3 tháng sau PCI hoặc ACS: không thay đổi
3-6 tháng: xem xét ức chế P2Y12 hoặc ASA >6 tháng sau PCI/ACS: ASA hoặc ức chế P2Y12 |
Không thay đổi | Không thay đổi |
| SIC score = 3 | Số lượng tiểu cầu 100–149 × 109/L và tỉ lệ PT 1.2–1.4 | Số lượng tiểu cầu ≥20 × 10^9/L: Không thay đổi | <3 tháng sau PCI hoặc ACS: không thay đổi hoặc cân nhắc dùng thuốc ức chế P2Y12 hoặc ASA | Số lượng tiểu cầu 100–149 × 109/L và tỷ lệ PT 1,2–1,4: không thay đổi | Số lượng tiểu cầu 100–149 × 109/L và tỷ lệ PT 1,2–1,4: không thay đổi |
| Hoặc số lượng tiểu cầu <100 × 109/L Hoặc tỉ lệ PT >1.4 | Số lượng tiểu cầu <20 × 109/L: ngưng SAPT | Xem xét sử dụng ASA nếu số lượng tiểu cầu <20 × 109/L 3–6 tháng sau PCI/ACS: dùng ức chế P2Y12 hoặc ASA Xem xét dùng ASA nếu số lượng tiểu cầu <20 × 109/L ≥6 tháng sau PCI/ACS: ASA hoặc clopidogrel Xem xét không dùng SAPT nếu số lượng tiểu cầu <20 × 109/L |
Số lượng tiểu cầu <100 × 109/L
Thay đổi VKA/DOAC thành heparinc ở liều dự phòng hoặc trung bình |
Số lượng tiểu cầu 50– 100 × 109/L Đổi VKA/DOAC sang heparin liều điều trị, chia làm hai liều hàng ngày | |
| SIC score = 5 | Lượng tiểu cầu <100 × 109/L và tỉ lệ PT >1.4 | Số lượng tiểu cầu ≥20 × 10^9/L: không thay đổi
Số lượng tiểu cầu <20 × 109/L: ngừng SAPT |
<1 tháng sau PCI hoặc ACS: không thay đổi nếu số lượng tiểu cầu ≥20 × 109/L hoặc xem xét dùng thuốc ức chế P2Y12 (clopidogrel) hoặc ASA Xem xét đơn trị liệu SAPT-ASA nếu có tiểu cầu
<20×109/L 1–3 tháng sau PCI/ACS: Thuốc ức chế P2Y12 (clopidogrel) hoặc ASA Xem xét đơn trị liệu SAPT–ASA nếu có tiểu cầu <20×109/L ≥3 tháng sau PCI/ACS: ASA hoặc clopidogrel Xem xét không dùng kháng kết tập tiểu cầu nếu số lượng tiểu cầu <20 × 109/L |
Số lượng tiểu cầu ≥30 × 109/L: không thay đổi
Số lượng tiểu cầu <30 × 109/L: ngưng dùng heparinc |
Số lượng tiểu cầu ≥30 × 109/L: không thay đổi
Số lượng tiểu cầu 30– 50 × 109/L: dùng heparinc liều dự phòng
Số lượng tiểu cầu <30 × 109/L: ngưng dùng heparin c |
Chú thích:
Các thuốc điều trị nên được xem xét dựa trên đặc điểm cá nhân của từng bệnh nhân và có thể không phù hợp nếu nguy cơ huyết khối stent đe dọa tính mạng cao hoặc các đặc điểm khác của bệnh nhân cho thấy nguy cơ chảy máu của DAPT hoặc chất ức chế P2Y12 cao hơn (ticagrelor hoặc prasugrel) nguy cơ huyết khối.
ACS, hội chứng mạch vành cấp; APT, liệu pháp chống kết tập tiểu cầu; DAPT, liệu pháp chống kết tập tiểu cầu kép; OAC, thuốc kháng đông đường uống; PT, thời gian prothrombin; SAPT, liệu pháp chống tiểu cầu đơn; VKA, chất đối kháng vitamin K.
a Định nghĩa và điểm SIC và SOFA được trình bày trong Bảng 1 và Dữ liệu bổ sung trực tuyến, Bảng S3, tương ứng.
b Thuyên tắc huyết khối gần đây (Biến cố xảy ra trong vòng 3 tháng trước).
c Heparin: heparin có trọng lượng phân tử thấp (LMWH) ở liều lượng chỉ định cho bệnh nhân có độ thanh thải creatinine >30 mL/phút, cần chỉnh liều khi độ thanh thải creatinine 15–30 mL/phút; Dùng heparin không phân đoạn (UFH) nếu thanh thải creatinine <15 mL/phút.
d Liều LMWH điều trị nên được giảm khi độ thanh thải creatinine <30–40 mL/phút, hoặc chuyển sang UFH. Nếu độ thanh thải creatinine <15 mL/phút, chỉ sử dụng UFH.
Bảng 5: Dùng thuốc ở bệnh nhân đang điều trị kháng đông, điểm SOFAa tối thiểu là 2, và điểm SICa tăng29
| Điểm SIC | Bệnh nhân dùng SAPT | Bệnh nhân dùng DAPT | Bệnh nhân dùng OAC dài hạn | Bệnh nhân dùng OAC do biến cố huyết khối gần đây | |
| 3 | Số tiểu cầu 100–149 x 109/L và tỷ số PT 1.2-1.4
|
Không thay đổi | <3 tháng sau PCI hoặc ACS: không thay đổi
3-6 tháng: cân nhắc dùng thuốc ức chế P2Y12 hoặc ASA (SAPT) ≥6 tháng: SAPT |
Không thay đổi | Không thay đổi |
| 4 | Số tiểu cầu 100–149 x 109/L và tỷ số PT 1.2-1.4
Số tiểu cầu <100 x 109/L hoặc tỷ số PT >1.4 |
Số lượng tiểu cầu ≥20 × 109/L: không thay đổi
Số lượng tiểu cầu <20 × 109/L: ngừng SAPT |
<1 tháng sau PCI /ACS: không thay đổi hoặc cân nhắc dùng thuốc ức chế P2Y12 (clopidogrel) hoặc ASA (SAPT)
Cân nhắc SAPT với ASA nếu số lượng tiểu cầu <20 × 109/L 1–3 tháng sau PCI hoặc ACS: không thay đổi hoặc thuốc ức chế P2Y12 hoặc ASA Cân nhắc SAPT với ASA nếu số lượng tiểu cầu <20 × 109/L 3–6 m sau PCI/ACS: thuốc ức chế P2Y12 hoặc ASA Cân nhắc SAPT với ASA nếu tiểu cầu <20 × 109/L ≥6 m sau PCI/ACS: SAPT Xem xét không có SAPT nếu số lượng tiểu cầu <20 × 109/L |
Số lượng tiểu cầu 100–149 × 109/L và tỷ lệ PT 1,2–1,4: không thay đổi
Số lượng tiểu cầu 50– 100 × 109/L: đổi VKA/DOAC thành liều điều trị heparin d, chia thành 2 liều/ngày |
Số lượng tiểu cầu 100–149 × 109/L và tỷ lệ PT 1,2–1,4: không thay đổi
Số lượng tiểu cầu 50– 100 × 109/L: đổi VKA/DOAC thành liều điều trị heparin d, chia thành 2 liều/ngày |
| 6
|
Số tiểu cầu <100 x 109/L và tỷ số PT >1.4 | Số lượng tiểu cầu ≥20 × 109/L: không thay đổi
Số lượng tiểu cầu <20 × 109/L: ngưng SAPT |
<1 tháng sau PCI hoặc ACS: không thay đổi nếu tiểu cầu ≥20 × 109/ L; xem xét thuốc ức chế P2Y12 (clopidogrel) hoặc ASA (SAPT) nếu tiểu cầu >20 × 109/L
Xem xét SAPT với ASA nếu tiểu cầu <20 × 109/L 1–3 m sau PCI/ACS: Thuốc ức chế P2Y12 (clopidogrel) hoặc ASA Xem xét SAPT với ASA nếu số lượng tiểu cầu <20 × 109/L ≥3 m sau PCI/ACS: SAPT Xem xét không có SAPT nếu số lượng tiểu cầu <20 × 109/L |
Số tiểu cầu 30–50 x 109/L: liều heparin dự phòng
Số tiểu cầu <30 x 109/L: ngưng heparin |
Số tiểu cầu 30–50 x 109/L: liều heparin dự phòng
Số tiểu cầu <30 x 109/L: ngưng heparin |
Chú thích:
Những đề xuất điều trị này nên được xem xét dựa trên đặc điểm của từng bệnh nhân và có thể không phù hợp nếu nguy cơ cao huyết khối trong stent đe dọa tính mạng hoặc các đặc điểm khác của bệnh nhân cho thấy nguy cơ chảy máu của DAPT hoặc thuốc ức chế P2Y12 (ticagrelor hoặc prasugrel) lớn hơn nguy cơ huyết khối.
ACS, hội chứng mạch vành cấp; APT, liệu pháp kháng kết tập tiểu cầu; DAPT, liệu pháp kháng kết tập tiểu cầu kép; OAC, thuốc kháng đông đường uống; PT, thời gian protrombin; SAPT, liệu pháp kháng kết tập tiểu cầu đơn; VKA, thuốc kháng vitamin K.
a Các định nghĩa và điểm số của SIC và SOFA tương ứng được cung cấp trong Bảng 1 và dữ liệu bổ sung trực tuyến, Bảng S3.
b Thuyên tắc huyết khối gần đây đề cập đến một sự kiện xảy ra trong vòng 3 tháng trước đó.
c Nên giảm liều điều trị LMWH khi độ thanh thải creatinine <30–40 mL/phút, hoặc chuyển sang dùng UFH. Nếu độ thanh thải creatinine < 15 mL/phút, chỉ sử dụng UFH.
d Heparin: heparin trọng lượng phân tử thấp (LMWH) khi độ thanh thải creatinine >30 mL/phút, chỉnh liều nếu độ thanh thải creatinine 15–30 mL/phút; Dùng heparin không phân đoạn (UFH) nếu độ thanh thải creatinine <15 mL/phút.
5. Kết luận và định hướng tương lai
Bệnh nhân nhiễm trùng huyết có chỉ định rõ ràng dùng thuốc chống huyết khối đơn hoặc kết hợp trước đây hay nguy cơ huyết khối cao nên được điều trị thuốc chống huyết khối. Liệu pháp chống huyết khối nên được duy trì trong suốt thời gian nằm viện, có tính đến tiến triển của bệnh đông máu liên quan nhiễm trùng huyết (SIC) và mức độ giảm tiểu cầu.
Ở những bệnh nhân đang điều trị chống huyết khối bị nhiễm trùng nặng hoặc nhiễm trùng huyết, tỷ lệ tử vong vẫn cao mặc dù có nhiều biện pháp điều trị tích cực do tình trạng viêm phức tạp và các tác dụng điều hòa miễn dịch khác của nhiễm trùng huyết. Ngoài điều trị tình trạng và nguyên nhân nhiễm trùng, cần áp dụng nhiều biện pháp phối hợp, đặc biệt tập trung vào phương pháp mới thay đổi tình trạng viêm huyết khối (thromboinflammation) ở nhóm bệnh nhân này. Tóm tắt chiến lược chung dùng thuốc chống huyết khối ở bệnh nhân nhiễm trùng nặng nêu ở hình 3.
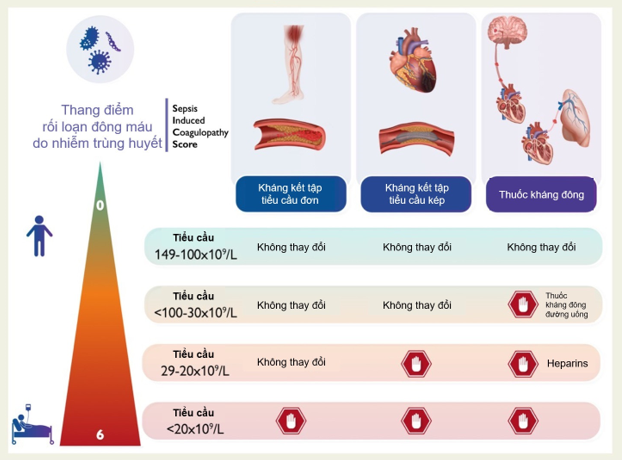
Hình 3. Tóm tắt chiến lược chung dùng thuốc chống huyết khối ở bệnh nhân nhiễm trùng
Vi khuẩn và vi rút là tác nhân phổ biến gây nhiễm trùng nặng nên bệnh nhân cần nhập viện và hỗ trợ các cơ quan ở mức độ khác nhau. Những bệnh nhân đang điều trị bằng liệu pháp chống huyết khối đơn hoặc kết hợp có nguy cơ tim mạch cao và rất cao bị nhiễm trùng nặng và các biến chứng liên quan trong thời gian ngắn và dài hạn hơn so với dân số chung. Với mức độ nghiêm trọng ngày càng tăng, nhiễm trùng liên quan đến rối loạn đông máu và đòi hỏi phải điều chỉnh liệu pháp chống huyết khối tùy theo bệnh tim mạch tiềm ẩn, chỉ định điều trị, tình trạng lâm sàng và tiên lượng của bệnh nhân. Khi số lượng tiểu cầu dưới 100 × 109/L, những bệnh nhân đã dùng thuốc chống đông máu đường uống (OAC), nên sử dụng heparin và nên dừng khi số lượng tiểu cầu dưới 30 × 109 /L. Bệnh nhân đang điều trị kháng tiểu cầu kép (DAPT) nên được chuyển sang điều trị kháng tiểu cầu đơn (SAPT) bằng thuốc ức chế P2Y12 hoặc axit acetylsalicylic liều thấp (ASA). Liệu pháp kháng tiểu cầu đơn bằng ASA có thể tốt hơn ở những bệnh nhân này khi số lượng tiểu cầu dưới 30 × 10 G/L. Khi số lượng tiểu cầu dưới 20 × 109/L, nên ngừng điều trị chống huyết khối, ngoại trừ những bệnh nhân mắc hội chứng mạch vành cấp mới đây, tức là <3 tháng, có thể xem xét dùng ASA liều thấp29.
Tài liệu tham khảo:
- Iba T, Levi M, Levy JH. Sepsis-Induced Coagulopathy and Disseminated Intravascular Coagulation. Semin Thromb Hemost. Feb 2020;46(1):89-95. doi:10.1055/s-0039-1694995
- Jackson SP, Darbousset R, Schoenwaelder SM. Thromboinflammation: challenges of therapeutically targeting coagulation and other host defense mechanisms. Blood. Feb 28 2019;133(9):906-918. doi:10.1182/blood-2018-11-882993
- Delabranche X, Helms J, Meziani F. Immunohaemostasis: a new view on haemostasis during sepsis. Ann Intensive Care. Dec 2 2017;7(1):117. doi:10.1186/s13613-017-0339-5
- Adelborg K, Grove EL, Sundbøll J, Laursen M, Schmidt M. Sixteen-year nationwide trends in antithrombotic drug use in Denmark and its correlation with landmark studies. Heart. Dec 1 2016;102(23):1883-1889. doi:10.1136/heartjnl-2016-309402
- García Rodríguez LA, Cea Soriano L, de Abajo FJ, et al. Trends in the use of oral anticoagulants, antiplatelets and statins in four European countries: a population-based study. Eur J Clin Pharmacol. Mar 2022;78(3):497-504. doi:10.1007/s00228-021-03250-6
- Tanguay JF, Geoffroy P, Sirois MG, et al. Prevention of in-stent restenosis via reduction of thrombo-inflammatory reactions with recombinant P-selectin glycoprotein ligand-1. Thromb Haemost. Jun 2004;91(6):1186-93. doi:10.1160/th03-11-0701
- Tomashefski JF, Jr., Davies P, Boggis C, Greene R, Zapol WM, Reid LM. The pulmonary vascular lesions of the adult respiratory distress syndrome. Am J Pathol. Jul 1983;112(1):112-26.
- Levy JH, Iba T, Olson LB, Corey KM, Ghadimi K, Connors JM. COVID-19: Thrombosis, thromboinflammation, and anticoagulation considerations. Int J Lab Hematol. Jul 2021;43 Suppl 1(Suppl 1):29-35. doi:10.1111/ijlh.13500
- Stark K, Massberg S. Interplay between inflammation and thrombosis in cardiovascular pathology. Nat Rev Cardiol. Sep 2021;18(9):666-682. doi:10.1038/s41569-021-00552-1
- Giustozzi M, Ehrlinder H, Bongiovanni D, et al. Coagulopathy and sepsis: Pathophysiology, clinical manifestations and treatment. Blood Rev. Nov 2021;50:100864. doi:10.1016/j.blre.2021.100864
- Akinosoglou K, Theodoraki S, Xanthopoulou I, et al. Platelet reactivity in sepsis syndrome: results from the PRESS study. Eur J Clin Microbiol Infect Dis. Dec 2017;36(12):2503-2512. doi:10.1007/s10096-017-3093-6
- Vallance TM, Zeuner MT, Williams HF, Widera D, Vaiyapuri S. Toll-Like Receptor 4 Signalling and Its Impact on Platelet Function, Thrombosis, and Haemostasis. Mediators Inflamm. 2017;2017:9605894. doi:10.1155/2017/9605894
- Keularts IM, van Gorp RM, Feijge MA, Vuist WM, Heemskerk JW. alpha(2A)-adrenergic receptor stimulation potentiates calcium release in platelets by modulating cAMP levels. J Biol Chem. Jan 21 2000;275(3):1763-72. doi:10.1074/jbc.275.3.1763
- Hahn PY, Wang P, Tait SM, Ba ZF, Reich SS, Chaudry IH. Sustained elevation in circulating catecholamine levels during polymicrobial sepsis. Shock. Oct 1995;4(4):269-73. doi:10.1097/00024382-199510000-00007
- Parker WA, Storey RF. Antithrombotic therapy for patients with chronic coronary syndromes. Heart. Jun 2021;107(11):925-933. doi:10.1136/heartjnl-2020-316914
- Dempfle CE. Coagulopathy of sepsis. Thromb Haemost. Feb 2004;91(2):213-24. doi:10.1160/th03-03-0182
- Ince C, Mayeux PR, Nguyen T, et al. THE ENDOTHELIUM IN SEPSIS. Shock. Mar 2016;45(3):259-70. doi:10.1097/shk.0000000000000473
- Kiers D, van der Heijden WA, van Ede L, et al. A randomised trial on the effect of anti-platelet therapy on the systemic inflammatory response in human endotoxaemia. Thromb Haemost. Aug 30 2017;117(9):1798-1807. doi:10.1160/th16-10-0799
- Houck KL, Yuan H, Tian Y, et al. Physical proximity and functional cooperation of glycoprotein 130 and glycoprotein VI in platelet membrane lipid rafts. J Thromb Haemost. Sep 2019;17(9):1500-1510. doi:10.1111/jth.14525
- Kaser A, Brandacher G, Steurer W, et al. Interleukin-6 stimulates thrombopoiesis through thrombopoietin: role in inflammatory thrombocytosis. Blood. Nov 1 2001;98(9):2720-5. doi:10.1182/blood.v98.9.2720
- Tapper H, Herwald H. Modulation of hemostatic mechanisms in bacterial infectious diseases. Blood. Oct 1 2000;96(7):2329-37.
- Rosenberg RD, Aird WC. Vascular-bed–specific hemostasis and hypercoagulable states. N Engl J Med. May 20 1999;340(20):1555-64. doi:10.1056/nejm199905203402007
- Thomas MR, Outteridge SN, Ajjan RA, et al. Platelet P2Y12 Inhibitors Reduce Systemic Inflammation and Its Prothrombotic Effects in an Experimental Human Model. Arterioscler Thromb Vasc Biol. Dec 2015;35(12):2562-70. doi:10.1161/atvbaha.115.306528
- Visseren FLJ, Mach F, Smulders YM, et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. Sep 7 2021;42(34):3227-3337. doi:10.1093/eurheartj/ehab484
- Cosentino F, Grant PJ, Aboyans V, et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. Jan 7 2020;41(2):255-323. doi:10.1093/eurheartj/ehz486
- Knuuti J, Wijns W, Saraste A, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. Jan 14 2020;41(3):407-477. doi:10.1093/eurheartj/ehz425
- Akintoye E, Afonso L, Bengaluru Jayanna M, Bao W, Briasoulis A, Robinson J. Prognostic Utility of Risk Enhancers and Coronary Artery Calcium Score Recommended in the 2018 ACC/AHA Multisociety Cholesterol Treatment Guidelines Over the Pooled Cohort Equation: Insights From 3 Large Prospective Cohorts. J Am Heart Assoc. Jun 15 2021;10(12):e019589. doi:10.1161/jaha.120.019589
- Schuetz P, Castro P, Shapiro NI. Diabetes and sepsis: preclinical findings and clinical relevance. Diabetes Care. Mar 2011;34(3):771-8. doi:10.2337/dc10-1185
- Gigante B, Levy JH, van Gorp E, et al. Management of patients on antithrombotic therapy with severe infections: a joint clinical consensus statement of the ESC Working Group on Thrombosis, the ESC Working Group on Atherosclerosis and Vascular Biology, and the International Society on Thrombosis and Haemostasis. European Heart Journal. 2023;44(32):3040-3058. doi:10.1093/eurheartj/ehad388
- Schulman S, Sholzberg M, Spyropoulos AC, et al. ISTH guidelines for antithrombotic treatment in COVID-19. J Thromb Haemost. Oct 2022;20(10):2214-2225. doi:10.1111/jth.15808
- Trieu TK, Birkeland K, Kimchi A, Kedan I. Comprehensive collection of COVID-19 related prosthetic valve failure: a systematic review. J Thromb Thrombolysis. Apr 2023;55(3):474-489. doi:10.1007/s11239-022-02746-x
- Poulakou G, Dimakakos E, Kollias A, et al. Beneficial Effects of Intermediate Dosage of Anticoagulation Treatment on the Prognosis of Hospitalized COVID-19 Patients: The ETHRA Study. In Vivo. Jan-Feb 2021;35(1):653-661. doi:10.21873/invivo.12305
- Nadkarni GN, Lala A, Bagiella E, et al. Anticoagulation, Bleeding, Mortality, and Pathology in Hospitalized Patients With COVID-19. J Am Coll Cardiol. Oct 20 2020;76(16):1815-1826. doi:10.1016/j.jacc.2020.08.041
- Rentsch CT, Beckman JA, Tomlinson L, et al. Early initiation of prophylactic anticoagulation for prevention of coronavirus disease 2019 mortality in patients admitted to hospital in the United States: cohort study. Bmj. Feb 11 2021;372:n311. doi:10.1136/bmj.n311
- Ou SM, Chu H, Chao PW, et al. Long-Term Mortality and Major Adverse Cardiovascular Events in Sepsis Survivors. A Nationwide Population-based Study. Am J Respir Crit Care Med. Jul 15 2016;194(2):209-17. doi:10.1164/rccm.201510-2023OC
- Adelborg K, Corraini P, Darvalics B, et al. Risk of thromboembolic and bleeding outcomes following hematological cancers: A Danish population-based cohort study. J Thromb Haemost. Aug 2019;17(8):1305-1318. doi:10.1111/jth.14475
- Baigent C, Blackwell L, Collins R, et al. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet. May 30 2009;373(9678):1849-60. doi:10.1016/s0140-6736(09)60503-1
- Scally B, Emberson JR, Spata E, et al. Effects of gastroprotectant drugs for the prevention and treatment of peptic ulcer disease and its complications: a meta-analysis of randomised trials. Lancet Gastroenterol Hepatol. Apr 2018;3(4):231-241. doi:10.1016/s2468-1253(18)30037-2
- Falanga A, Leader A, Ambaglio C, et al. EHA Guidelines on Management of Antithrombotic Treatments in Thrombocytopenic Patients With Cancer. Hemasphere. Aug 2022;6(8):e750. doi:10.1097/hs9.0000000000000750
- Ouyang Y, Wang Y, Liu B, Ma X, Ding R. Effects of antiplatelet therapy on the mortality rate of patients with sepsis: A meta-analysis. J Crit Care. Apr 2019;50:162-168. doi:10.1016/j.jcrc.2018.12.004
- Ye Z, Reintam Blaser A, Lytvyn L, et al. Gastrointestinal bleeding prophylaxis for critically ill patients: a clinical practice guideline. Bmj. Jan 6 2020;368:l6722. doi:10.1136/bmj.l6722
- Moayyedi P, Eikelboom JW, Bosch J, et al. Pantoprazole to Prevent Gastroduodenal Events in Patients Receiving Rivaroxaban and/or Aspirin in a Randomized, Double-Blind, Placebo-Controlled Trial. Gastroenterology. Aug 2019;157(2):403-412.e5. doi:10.1053/j.gastro.2019.04.041
- Chow JH, Yin Y, Yamane DP, et al. Association of prehospital antiplatelet therapy with survival in patients hospitalized with COVID-19: A propensity score-matched analysis. J Thromb Haemost. Nov 2021;19(11):2814-2824. doi:10.1111/jth.15517
- Santoro F, Nuñez-Gil IJ, Vitale E, et al. Antiplatelet therapy and outcome in COVID-19: the Health Outcome Predictive Evaluation Registry. Heart. Jan 2022;108(2):130-136. doi:10.1136/heartjnl-2021-319552
- Khan SU, Singh M, Valavoor S, et al. Dual Antiplatelet Therapy After Percutaneous Coronary Intervention and Drug-Eluting Stents: A Systematic Review and Network Meta-Analysis. Circulation. Oct 13 2020;142(15):1425-1436. doi:10.1161/circulationaha.120.046308
- Capodanno D, Baber U, Bhatt DL, et al. P2Y(12) inhibitor monotherapy in patients undergoing percutaneous coronary intervention. Nat Rev Cardiol. Dec 2022;19(12):829-844. doi:10.1038/s41569-022-00725-6
- Arora S, Shemisa K, Vaduganathan M, et al. Premature Ticagrelor Discontinuation in Secondary Prevention of Atherosclerotic CVD: JACC Review Topic of the Week. J Am Coll Cardiol. May 21 2019;73(19):2454-2464. doi:10.1016/j.jacc.2019.03.470
- Sumaya W, Parker WAE, Fretwell R, et al. Pharmacodynamic Effects of a 6-Hour Regimen of Enoxaparin in Patients Undergoing Primary Percutaneous Coronary Intervention (PENNY PCI Study). Thromb Haemost. Jul 2018;118(7):1250-1256. doi:10.1055/s-0038-1657768
- Shimizu M, Natori T, Tsuda K, et al. Thrombin-induced platelet aggregation -effect of dabigatran using automated platelet aggregometry. Platelets. 2020;31(3):360-364. doi:10.1080/09537104.2019.1624707
- Eisen DP, Reid D, McBryde ES. Acetyl salicylic acid usage and mortality in critically ill patients with the systemic inflammatory response syndrome and sepsis. Crit Care Med. Jun 2012;40(6):1761-7. doi:10.1097/CCM.0b013e318246b9df
- Iba T, Levy JH. Sepsis-induced Coagulopathy and Disseminated Intravascular Coagulation. Anesthesiology. 2020;132(5):1238-1245. doi:10.1097/aln.0000000000003122
- Umemura Y, Yamakawa K, Ogura H, Yuhara H, Fujimi S. Efficacy and safety of anticoagulant therapy in three specific populations with sepsis: a meta-analysis of randomized controlled trials. J Thromb Haemost. Mar 2016;14(3):518-30. doi:10.1111/jth.13230
- Li X, Liu Z, Luo M, et al. Therapeutic effect of low-molecular-weight heparin on adult sepsis: a meta-analysis. Ann Palliat Med. Mar 2021;10(3):3115-3127. doi:10.21037/apm-21-169
- Mar PL, Gopinathannair R, Gengler BE, et al. Drug Interactions Affecting Oral Anticoagulant Use. Circ Arrhythm Electrophysiol. Jun 2022;15(6):e007956. doi:10.1161/circep.121.007956
- Darwish OS, Strube S, Nguyen HM, Tanios MA. Challenges of anticoagulation for atrial fibrillation in patients with severe sepsis. Ann Pharmacother. Oct 2013;47(10):1266-71. doi:10.1177/1060028013500938
- Vardeny O, Kim K, Udell JA, et al. Effect of High-Dose Trivalent vs Standard-Dose Quadrivalent Influenza Vaccine on Mortality or Cardiopulmonary Hospitalization in Patients With High-risk Cardiovascular Disease: A Randomized Clinical Trial. JAMA. 2021;325(1):39-49. doi:10.1001/jama.2020.23649
- Vamos EP, Pape UJ, Curcin V, et al. Effectiveness of the influenza vaccine in preventing admission to hospital and death in people with type 2 diabetes. Cmaj. Oct 4 2016;188(14):E342-e351. doi:10.1503/cmaj.151059
- Modin D, Claggett B, Køber L, et al. Influenza Vaccination Is Associated With Reduced Cardiovascular Mortality in Adults With Diabetes: A Nationwide Cohort Study. Diabetes Care. Sep 2020;43(9):2226-2233. doi:10.2337/dc20-0229
- Modin D, Claggett B, Jørgensen ME, et al. Flu Vaccine and Mortality in Hypertension: A Nationwide Cohort Study. J Am Heart Assoc. Mar 15 2022;11(6):e021715. doi:10.1161/jaha.121.021715
- Fröbert O, Götberg M, Erlinge D, et al. Influenza Vaccination After Myocardial Infarction: A Randomized, Double-Blind, Placebo-Controlled, Multicenter Trial. Circulation. Nov 2 2021;144(18):1476-1484. doi:10.1161/circulationaha.121.057042
- Ciszewski A, Bilinska ZT, Brydak LB, et al. Influenza vaccination in secondary prevention from coronary ischaemic events in coronary artery disease: FLUCAD study. Eur Heart J. Jun 2008;29(11):1350-8. doi:10.1093/eurheartj/ehm581
- Jaiswal V, Ang SP, Yaqoob S, et al. Cardioprotective effects of influenza vaccination among patients with established cardiovascular disease or at high cardiovascular risk: a systematic review and meta-analysis European Journal of Preventive Cardiology. 2022;29(14):1881-1892. doi:10.1093/eurjpc/zwac152
- Hung IF, Leung AY, Chu DW, et al. Prevention of acute myocardial infarction and stroke among elderly persons by dual pneumococcal and influenza vaccination: a prospective cohort study. Clin Infect Dis. Nov 1 2010;51(9):1007-16. doi:10.1086/656587
- Marchandot B, Curtiaud A, Trimaille A, Sattler L, Grunebaum L, Morel O. Vaccine-induced immune thrombotic thrombocytopenia: current evidence, potential mechanisms, clinical implications, and future directions. European Heart Journal Open. 2021;1(2)doi:10.1093/ehjopen/oeab014
- Pavord S, Scully M, Hunt BJ, et al. Clinical Features of Vaccine-Induced Immune Thrombocytopenia and Thrombosis. New England Journal of Medicine. 2021;385(18):1680-1689. doi:10.1056/NEJMoa2109908
- Greinacher A, Thiele T, Warkentin TE, Weisser K, Kyrle PA, Eichinger S. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. New England Journal of Medicine. 2021;384(22):2092-2101. doi:10.1056/NEJMoa2104840
- Mandal AKJ, Kho J, Ioannou A, Van den Abbeele K, Missouris CG. Covid-19 and in situ pulmonary artery thrombosis. Respir Med. Jan 2021;176:106176. doi:10.1016/j.rmed.2020.106176







