THS.BS PHẠM NGỌC ĐAN
BS. NGUYỄN NGỌC QUỲNH TRÂM
BS. NGUYỄN THANH HIỀN
I. TỔNG QUAN
Bệnh phổi tắc nghẽn mạn tính (COPD) là nguyên nhân thứ tư về tần suất mắc bệnh và nhập viện trên toàn thế giới1, dự đoán vươn lên hàng thứ ba vào năm 2030.2COPD làm gia tăng tử vong tim mạch, là nguyên nhân dẫn đến các rối loạn nhịp, trong đó rung nhĩ là rối loạn nhịp hay gặp nhất và ảnh hưởng xấu đến COPD.3-5 Nhiều nghiên cứu cho thấy rung nhĩ trên bệnh nhân COPD có kết cục xấu hơn nhóm rung nhĩ không kèm COPD.6 Rung nhĩ trên bệnh nhân COPD có liên quan đến sự giảm nhanh của chức năng phổi, gia tăng biến cố tim mạch và tử vong dài hạn.7Giảm chức năng phổi cũng làm tăng nguy cơ khởi phát rung nhĩ. Một nghiên cứu đoàn hệ của Buch và cộng sự năm 2003 ghi nhận tăng 1.8 lần nguy cơ khởi phát rung nhĩ khi 60% ≤ FEV₁ < 80% so với FEV₁ ≥ 80%. Bên cạnh đó, so với nhóm FEV₁ ≥ 80%, nguy cơ nhập viện vì rung nhĩ cao hơn 1.3 lần ở nhóm 60% ≤ FEV₁ < 80% và cao hơn 1.8 lần ở nhóm FEV₁ < 60%.8FEV1 và FVC là yếu tố nguy cơ độc lập của rung nhĩ (không phụ thuộc vào tuổi, giới tính, phì đại thất trái và nồng độ BNP).9Tắc nghẽn thông khí trung bình/nặng (FEV1/FVC < 0.70 và FEV1 <80% giá trị dự đoán) cũng liên quan đến tỉ lệ mắc rung nhĩ cao hơn.10
COPD là một trong những yếu tố nguy cơ chính của rung nhĩ. Tỉ lệ rung nhĩ trên bệnh nhân COPD mức độ nặng cao hơn khoảng 4 lần so với bệnh nhân không COPD.8 Mặc dù tỉ lệ mắc bệnh và tử vong ngắn hạn của rung nhĩ mới khởi phát trên bệnh nhân COPD cao, tuy nhiên việc điều trị các bệnh lý tim mạch trên bệnh nhân COPD thường bị bỏ qua trong thực hành lâm sàng. Đánh giá các yếu tố nguy cơ giúp tiếp cận hiệu quả trong việc tầm soát rung nhĩ mới khởi phát trên bệnh nhân COPD nguy cơ cao và cải thiện tình trạng lâm sng, cũng như cải thiện tiên lượng bệnh nhân COPD. Bài viết này nhằm mục đích nêu lên những vấn đề cần quan tâm và lưu ý trong chẩn đoán và điều trị rung nhĩ ở bệnh nhân COPD.
II. DỊCH TỄ HỌC
Tỉ lệ hiện mắc COPD toàn cầu khoảng 11%11, tỉ lệ mắc COPD ở bệnh nhân rung nhĩ trên 65 tuổi lên đến 23%.12,13 Trong số những bệnh nhân rung nhĩ, đợt cấp COPD có mối liên hệ với nguy cơ nhập viện liên quan đến rung nhĩ cao hơn trong giai đoạn 90 ngày đầu sau đợt cấp.14,15
Bệnh nhân COPD tăng 28% nguy cơ rung nhĩ, góp phần làm tăng tần suất đợt cấp COPD và tình trạng giãn nhĩ trái.15 Tỉ lệ mắc rung nhĩ ở bệnh nhân COPD giai đoạn ổn định dao động từ 4.7% đến 15%; tỉ lệ này cao hơn đáng kể ở bệnh nhân COPD giai đoạn rất nặng (khoảng 20-30%).16 Khoảng 30% trường hợp COPD nhập viện có rối loạn nhịp xảy ra đồng thời, trong đó 22.1% là rung nhĩ.17
III. SINH LÝ BỆNH
Tình trạng thiếu oxy mô mạn ở bệnh nhân COPD là nguyên nhân gây ra những thay đổi về cấu trúc mạch máu phổi và huyết động, đóng vai trò là yếu tố khởi phát rung nhĩ.18,19 Ngoài ra, tăng áp lực nhĩ phải mạn tính có liên quan đến sự dãn và tái tạo xơ hóa nhĩ phải, cũng như làm tăng nguy cơ phát triển rung nhĩ.20
Một số cơ chế liên quan đến COPD góp phần khởi phát và tiến triển rung nhĩ được tóm tắt trong Hình 1.
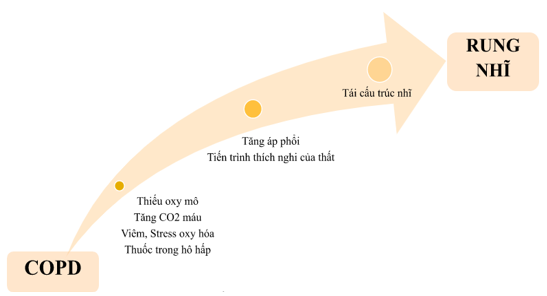
Hình 1: Cơ chế liên quan đến COPD góp phần khởi phát và tiến triển rung nhĩ
Các bất thường về trao đổi khí (thiếu oxy máu, tăng CO2 máu,…) có thể gây co mạch máu phổi và tăng áp động mạch phổi thứ phát, dẫn đến phì đại thất phải và rối loạn chức năng tâm trương.8,21,22 Thiếu oxy máu mạn làm thay đổi biểu hiện của yếu tố cảm ứng thiếu oxy mô (hypoxia-inducible factor 1, HIF-1), tăng tình trạng viêm hệ thống và stress oxy hóa, từ đó thúc đẩy tái cấu trúc tiền xơ hóa nhĩ.23
1. Các ổ kích thích nằm ngoài tĩnh mạch phổi (Non-pulmonary vein foci, NPVF): Các ổ kích thích ngoài tĩnh mạch phổi là những vị trí quan trọng khởi phát và duy trì rung nhĩ ở 20% bệnh nhân.24 Rung nhĩ khởi phát từ những ổ kích thích ngoài tĩnh mạch phổi này là do tái cấu trúc nhĩ phải, xảy ra thường xuyên hơn ở những bệnh nhân COPD so với bệnh nhân rung nhĩ không COPD.18 Dãn nhĩ phải là hệ quả của bệnh mạch máu phổi tiến triển, tăng áp lực động mạch phổi và tăng áp lực thất phải bắt nguồn từ bất tương xứng tưới máu/thông khí (V/Q mismatch). Cơ chế bệnh sinh này có mối tương quan với sự gia tăng các ổ kích thích ngoài tĩnh mạch phổi do tình trạng quá tải thể tích kéo dài hoặc do sự căng thành của nhĩ phải.20
2. Tăng CO2 máu: Tăng CO2 máu làm tăng đáng kể giai đoạn trơ hiệu quả của nhĩ và làm chậm dẫn truyền từ nhĩ. Khi đưa nồng độ CO2 về lại mức bình thường, giai đoạn trơ hiệu quả của nhĩ sẽ nhanh chóng được khôi phục, tuy nhiên sự dẫn truyền của nhĩ vẫn còn chậm, điều này cho thấy rằng tình trạng tăng CO2 có thể tạo ra chất nền gây rung nhĩ, ngay cả sau khi được điều chỉnh bình thường.25 Trong đợt cấp COPD, rung nhĩ xảy ra thường xuyên hơn với mức PaCO2 cao hơn và với áp lực tâm thu động mạch phổi cao hơn.26
3. Dãn và xơ hóa nhĩ: Căng thành và xơ hóa nhĩ tạo thành cơ chất gây loạn nhịp tim. Những thay đổi về sự phân bố và kích hoạt kênh ion của cơ tim gây tái cấu trúc điện thế của nhĩ phải, góp phần làm tăng tính dễ rối loạn nhịp tim.27 Cụ thể, tái cấu trúc nhĩ tạo thuận lợi cho vòng vào lại và góp phần gây ra rối loạn nhịp.28 Các nghiên cứu thăm dò điện sinh lý tim tại nhĩ phải ở những bệnh nhân tăng áp động mạch phổi vô căn cho thấy dẫn truyền chậm liên quan đến các bất thường của vùng cơ tim và giảm điện thế mô29, làm chậm cả dẫn truyền nhĩ và thời gian kích hoạt nhĩ là yếu tố cần thiết để khởi phát và duy trì rung nhĩ.27
Động mạch phổi tập trung nhiều các đường dẫn truyền của hệ thần kinh giao cảm. Sự gia tăng hoạt động giao cảm kéo dài trên mạch máu phổi gây khó thở và giảm khả năng gắng sức, góp phần thúc đẩy khởi phát suy tim phải.30 Suy tim tiến triển là do những thay đổi cấu trúc của cơ tim liên quan đến sự giảm các thụ thể beta, tăng tái cấu trúc cơ tim và làm chết tế bào theo chu trình.31,32 Hoạt động giao cảm đều tăng kéo dài trên cả hai nhóm bệnh nhân COPD thiếu oxy máu và oxy máu bình thường.33,34 Kích hoạt giao cảm quá mức làm tăng tính nhạy với các rối loạn nhịp nguy hiểm tính mạng và tăng tỉ lệ tử vong ở bệnh nhân tăng áp động mạch phổi.35
Tình trạng viêm hệ thống và stress oxy hóa là một trong những cơ chế bệnh lý chính trong COPD36, cũng như khởi phát và duy trì rung nhĩ.37 Các bằng chứng thực nghiệm cho thấy stress oxy hóa góp phần gây rối loạn chức năng tế bào cơ tim, làm tế bào cơ tim chết do hoại tử hoặc theo chu trình, dẫn đến làm tái cấu trúc cơ tim, kích hoạt các ổ kích thích thường bắt nguồn từ thành tĩnh mạch phổi, gây ra rung nhĩ.38
Ngoài ra, các thuốc sử dụng cho bệnh phổi mạn (thuốc đồng vận beta, thuốc kháng cholinergic, thuốc methylxanthine và corticosteroid đường uống,…) gần đây đã được đề xuất như một cơ chế sinh lý bệnh khởi phát rung nhĩ trong COPD.8
- Xu hướng sử dụng các thuốc đồng vận beta tác dụng ngắn và dài hiện nay có thể làm tăng nhẹ nguy cơ rung nhĩ trong COPD.39 Thuốc đồng vận beta có khả năng gây rối loạn nhịp do tác động lên thời gian khử cực, tái cực và phân bố kali tế bào qua trung gian thụ thể beta.40 Một liều Salbutamol hít đã được ghi nhận làm tăng dẫn truyền nút nhĩ – thất bằng cách rút ngắn giai đoạn trơ hiệu quả của nhĩ, tạo thuận lợi cho việc khởi phát rung nhĩ và có thể giải thích được tỉ lệ rối loạn nhịp tim gia tăng trên bệnh nhân COPD.41
- Thuốc kháng cholinergic ức chế sự kiểm soát tần số tim của hệ thần kinh phó giao cảm, có liên quan đến tăng tỉ lệ nhịp tim nhanh.42 Tác giả Ogale và cộng sự cũng báo cáo việc tăng nguy cơ rối loạn nhịp liên quan đến thuốc Ipratropium.43
- Hiện nay, việc sử dụng Corticosteroids có liên quan đến tăng gấp đôi nguy cơ rung nhĩ.44 Đặc biệt những đợt cấp COPD nặng được điều trị bằng Corticosteroid toàn thân liều cao theo khuyến cáo của GOLD có liên quan đến tăng nguy cơ mắc rung nhĩ, gợi ý rằng Corticosteroids có thể có tác dụng trực tiếp gây rối loạn nhịp tim.45
Bệnh đa hồng cầu thứ phát do tình trạng thiếu oxy máu mạn làm tăng độ nhớt của máu, góp phần làm nặng thêm tình trạng tăng áp động mạch phổi. Huyết khối động mạch phổi có thể tạo ra từ tình trạng viêm đường dẫn khí ngoại biên ở bệnh nhân COPD, dẫn đến tăng áp động mạch phổi cấp tính, làm dãn nhĩ phải.46
Tóm tắt các cơ chế sinh lý bệnh khác nhau rung nhĩ trong COPD nêu ở hình 2.
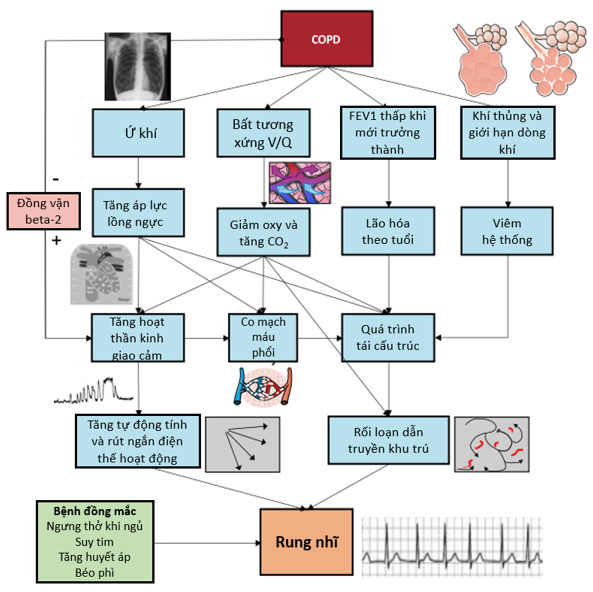
Hình 2: Cơ chế sinh lý bệnh khác nhau COPD và rung nhĩ47
IV. ĐIỀU TRỊ RUNG NHĨ TRÊN BỆNH NHÂN COPD
Khi đã xác định chẩn đoán rung nhĩ, chúng ta cần thực hiện chiến lược điều trị rung nhĩ toàn diện theo chỉ dẫn ABC của ESC (còn gọi là con đường ABC: the so-called ABC pathway: “A”—dự phòng đột quỵ với chống đông; “B”—điều trị triệu chứng tốt hơn, với quyết định kiểm soát tần số hay nhịp với đặt bệnh nhân vào trung tâm; và “C”—điều trị các yếu tố nguy cơ tim mạch và bệnh kết hợp, bao gồm chú ý cả thay đổi lối sống). Kháng đông để dự phòng đột quỵ là rất quan trọng. Tuy nhiên cần biết rằng, chỉ 1/10 bệnh nhân tử vong kết hợp với rung nhĩ là liên quan đến đột quỵ, trong khi 7/10 bệnh nhân tử vong liên quan đến tim mạch. Vì vậy, điều trị tối ưu COPD và bệnh kết hợp hợp lý là vô cùng quan trọng (con đường C). Trước một bệnh nhân rung nhĩ và COPD, lực chọn chiến lược kiểm soát nhịp hay tần số cũng tuân theo hướng dẫn hiện hành. Trong quá trình điều trị, cần tổ chức hội chẩn giữa các chuyên khoa để đảm bảo dùng thuốc đúng nhất, không bỏ sót các nguyên nhân đi kèm 47,52.
Bảng 1. Chỉ định và chống chỉ định chuyển nhịp
| Chỉ định | Chống chỉ định |
| ■ Huyết động không ổn định (Hemodynamic instability ):
■ Thiếu máu cục bộ cơ tim đe dọa tính mạng ■ Rối loạn ý thức ■ Tụt HA nghiêm trọng ■ Suy tim xung huyết tiến triển ■ Cơn RN đầu tiên (first episode) ■ Chọn kiểm soát nhịp dài hạn (Long-term rhythm control ) ■ RN dai dẳng có triệu chứng (Symptomatic persistent AF ) ■ RN cơn kèm triệu chứng không thường xuyên (Infrequent symptomatic episodes ) ■ RN với nguyên nhân có thể đảo ngược được (Potentially reversible cause ) |
■ RN không triệu chứng or t/c nhẹ, kèm bệnh kết hợp, cao tuổi (>80), tổng trạng chung kém
■ Khả năng chuyển nhịp thành công thấp or duy trì nhịp xoang khó: • RN kéo dài >1 năm • Nhĩ trái lớn (>5cm or thể tích >40 mL/m2) • RN tái phát THƯỜNG XUYÊN dù uống thuốc duy trì thích hợp or mới chuyển nhịp • Chưa ĐT khỏi NN gây RN (cường giáp, VMNT, bệnh van tim…)
|
1. Kiểm soát nhịp:
Chỉ định và chống chỉ định chuyển nhịp trong rung nhĩ được tóm tắt ở bảng 1. Quy trình chuyển nhịp bằng thuốc hay shock điện cũng tương tự như bệnh nhân rung nhĩ chung. Tỉ lệ thành công chuyển nhịp bằng shock điện là 70-90%. Amiodarone là thuốc được sử dụng phổ biến để kiểm soát nhịp trên bệnh nhân rung nhĩ kèm COPD mặc dù thuốc có tác dụng phụ gây độc tính trên phổi (Bệnh nhân COPD có nguy cơ cao bị độc tính trên phổi do Amiodarone) 6,48, 51. Bệnh nhân rung nhĩ kèm COPD có khả năng thành công chuyển nhịp cũng như duy trì nhịp xoang thấp.49,50
Các yếu tố liên quan đến việc tăng nguy cơ tái phát rung nhĩ sau khi chuyển nhịp chủ động bao gồm lớn tuổi, nữ giới, hút thuốc lá, béo phì, tiền căn chuyển nhịp trước đó, tăng huyết áp, đái tháo đường, COPD, ngưng thở khi ngủ, suy thận, cường giáp, bệnh tim cấu trúc và suy tim 48-50.
Theo dõi sau điều trị thuốc chống loạn nhịp là rất quan trọng. Cần đánh giá tần số tim, độ rộng QRS, và khoảng QTc, cũng như định kỳ thử chức năng thận, kali và magne vì bất thường điện giải có thể thúc đẩy loạn nhịp. khi sử dụng thuốc chống loạn nhịp để điều trị rung nhĩ ở bệnh nhân COPD, chúng ta cần thảo luận với bệnh nhân về vấn đề sử dụng amiodarone nếu có. Trước khi bắt đầu amiodarone, cần kiểm tra trước cho bệnh nhân test chức năng tim phổi, XQ ngực, khám mắt, thử máu đánh giá chức năng gan và tuyến giáp. Những test này, ngoại trừ PFT, nên kiểm tra lại mỗi 3-6 tháng (bảng 2) 70.
| Bảng 2. Tác dụng không mong muốn của Amiodarone và theo dõi người bệnh* | ||
| Cơ quan bị ảnh hưởng | Tác dụng phụ có thể xảy ra | Cận lâm sàng hỗ trợ chẩn đoán |
| Phổi* | Viêm phổi mô kẽ và xơ hóa phổi | Chụp X-quang ngực mỗi 6 tháng
Đánh giá chức năng hô hấp mỗi 12 tháng |
| Tuyến giáp* | Rối loạn chức năng tuyến giáp (suy giáp và cường giáp) | Kiểm tra chức năng tuyến giáp mỗi 3-6 tháng |
| Gan* | Độc gan (tăng men gan) | Kiểm tra chức năng gan mỗi 3-6 tháng |
| Mắt* | Rối loạn thị giác (nhìn mờ, nhạy cảm/sợ ánh sáng) Cặn lắng vi thể giác mạc |
Khám mắt mỗi 12 tháng |
| Da* | Da đổi màu xanh-xám | Thăm khám lâm sàng |
*Nên đánh giá kỹ các triệu chứng của người bệnh và dấu hiệu lâm sàng tại phòng khám mỗi 3 đến 6 tháng.
2. Kiểm soát tần số:
Mục tiêu là kiểm soát tần số trong khoảng 70-80 lần/ph lúc nghỉ và 90-115 lần/ph lúc gắng sực trung bình. Theo hướng dẫn Hội Tim mạch Châu Âu (ESC) 2020, kiểm soát tần số với thuốc chẹn kênh canxi không phải dihydropyridine (NDCC) được khuyến cáo là lựa chọn đầu tay trên bệnh nhân rung nhĩ kèm COPD52. Chiến lược dùng thuốc để kiểm soát đáp ứng thất nêu ở hình 3
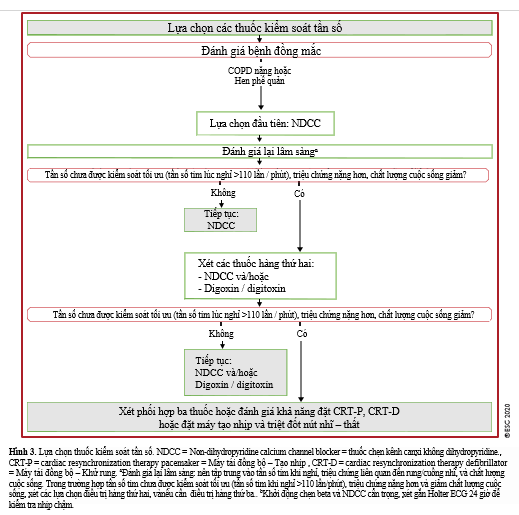
Các nghiên cứu hiện tại cho thấy không có chống chỉ định khi sử dụng các thuốc chẹn beta chọn lọc trên tim ở bệnh nhân COPD.53,54 Bên cạnh đó, thuốc chẹn beta trên bệnh nhân rung nhĩ kèm COPD không chỉ làm giảm nguy cơ tử vong chung mà còn làm giảm nguy cơ đợt cấp COPD. Một phân tích gộp gồm 15 nghiên cứu hồi cứu trên 21.596 bệnh nhân COPD cho thấy điều trị với chẹn beta chọn lọc β1 giảm 28% tỉ lệ tử vong và giảm 38% đợt cấp.55 Tuy nhiên, trong thực hành lâm sàng thuốc chẹn beta ít được kê đơn ở bệnh nhân COPD do tác dụng phụ co thắt phế quản.56 Chẹn beta cần chỉnh liều và theo dõi mỗi vài tuần, thuốc có thể kém dung nạp đối với bệnh nhân COPD cao tuổi có bệnh phối hợp.56Trong thực hành lâm sàng, chúng ta cần sử dụng liều thấp trước, khi COPD thật ổn định và không nên dùng cho bệnh nhân COPD giai đoạn cuối (giai đoạn D) vì dễ gây đợt cấp COPD.
Digoxin là thuốc chủ yếu kiểm soát tần số thất rung nhĩ trong nhiều năm. Thuốc khởi phát tương đối chậm và kiểm soát tần số chủ yếu qua gia tăng trương lực phó giao cảm ở nút nhĩ thất và có thể không ức chế nổi tình trạng cường giao cảm. vì vậy, thuốc đóng vai trò hỗ trợ và được quan tâm như là điều trị bổ sung ở bệnh nhân suy chức năng thất trái. Tuy nhiên, ở bệnh nhân dãn nhĩ và tăng áp phổi, như ở bệnh nhân COPD, digoxin có thể là biện pháp thay thế cho tình trạng dung nạp kém chẹn beta và ức chế kênh calcium69.
Gần đây, một số tác giả đề nghị sử dụng tĩnh mạch magnesium sulfate 4g/1h để hỗ trợ kiểm soát tần số thất cho bệnh nhân chưa đạt mục tiêu khi dùng chẹn beta, ức chế kênh calcium. Nghiên cứu cho thấy thuốc có hiệu quả kéo dài 12-24h sau sử dụng. sử dụng sớm thuốc này có thể làm giảm khả năng phải nhập viện. thuốc chỉ dùng cho bệnh nhân có EF bảo tồn và HA tốt (hình 4)70.

Hình 4. Kiểm soát tần số trong nghiên cứu RISTRA-AF cho bệnh nhân với “một trái tim khỏe mạnh” (good ♥). Một trái tim khỏe là khi EF > 50% (dựa trên kết quả siêu âm tim gần nhất hoặc đánh giá lâm sàng) và không có bằng chứng suy tim mất bù 70.
Nếu tần số không thể đạt được bằng thuốc và tình trạng huyết động của bệnh nhân suy sụp, nên shock điện chuyển nhịp.
- Dự phòng thuyên tắc: Chỉ định kháng đông, nguy cơ xuất huyết,… theo các hướng dẫn hiện hành, tương đồng với bệnh nhân rung nhĩ không COPD.
- Cắt đốt: Chỉ định, nguy cơ,… theo các hướng dẫn hiện hành, tương đồng với bệnh nhân rung nhĩ không COPD. Trên bệnh nhân rung nhĩ đã cắt đốt, COPD là một trong những yếu tố liên quan đến giảm kết cục ngắn hạn, tăng nhập viện, đột quỵ và tử vong18,57-59 và tăng nguy cơ rung nhĩ mới khởi phát trên bệnh nhân cắt đốt.60 Nếu trong thủ thuật đòi hỏi an thần sâu, bệnh nhân COPD có thể có nguy cơ ứ CO2.
V. ĐIỀU TRỊ COPD TRÊN BỆNH NHÂN RUNG NHĨ
1. Thuốc dãn phế quản:
Thuốc dãn phế quản là phương pháp điều trị chính của COPD. Thuốc dãn phế quản được chứng minh an toàn trên bệnh nhân COPD kèm bệnh lý tim mạch thông qua thử nghiệm SUMMIT61 và ASCENT-COPD.62 Thuốc đồng vận beta-2 dạng hít và thuốc kháng cholinergic đều có liên quan đến nhịp nhanh.63 Đối với thuốc đồng vận beta-2 dạng hít, tăng nguy cơ rung nhĩ được chủ yếu thấy khi mới sử dụng thuốc trong 30 ngày đầu, và thuốc có tác dụng ngắn nguy cơ cao hơn so với thuốc có tác dụng dài.39,64 Nguy cơ rối loạn nhịp ở bệnh nhân điều trị với thuốc kháng cholinergic yếu hơn nhiều, thuốc làm tăng nguy cơ nhịp nhanh và rung nhĩ chỉ được báo cáo trong vài nghiên cứu.39,63 Corticosteroid dạng hít dường như không làm tăng nguy cơ rung nhĩ.63,64 Các loại thuốc điều trị COPD đường uống (bao gồm Corticosteroid và Theophylline) đều có liên quan đến tăng nguy cơ rung nhĩ.39,45,64 Tác dụng phụ của thuốc điều trị COPD trên bệnh nhân rung nhĩ, tương tác thuốc với các loại thuốc kiểm soát tần số và kiểm soát nhịp được tóm tắt trong Bảng 5.
| Nóm thuốc | Hiệu quả điều trị | Tăng nguy cơ rung nhĩ | Tương tác với các thuốc chống loạn nhịp | Rối loạn nhịp tim khác |
| Đồng vận beta-2 | ||||
| Tác dụng ngắn | Cải thiện chức năng phổi và triệu chứng | Có39,64 | Thuốc chẹn β không chọn lọc có thể gây co thắt phế quản và giảm tác dụng dãn phế quản của đồng vận beta-2 | Nhịp nhanh xoang lúc nghỉ |
| Tác dụng dài | – Cải thiện chức năng phổi, triệu chứng, tình trạng sức khỏe
– Dự phòng đợt cấp trung bình – nặng |
|||
| Kháng cholinergic | ||||
| Tác dụng ngắn | Cải thiện chức năng phổi và triệu chứng | Không39,63 | Nhịp tim nhanh không đặc hiệu | |
| Tác dụng dài | – Cải thiện chức năng phổi, triệu chứng, tình trạng sức khỏe
– Dự phòng đợt cấp trung bình – nặng |
|||
| Methylxanthines
Theophylline |
– Hiện ít dùng
– Cải thiện nhẹ chức năng phổi |
Có39,64 | – Thuốc đối kháng Canxi làm tăng nguy cơ ngộ độc Theophyllin
– Hạ Kali máu do Theophyllin làm tăng nguy cơ ngộ độc Digoxin |
– Nhịp nhanh xoang
– Ngoại tâm thu trên thất – Rối loạn nhịp thất |
| Corticosteroids | ||||
| Steroid hít | – Dự phòng đợt cấp trung bình – nặng
– Cải thiện hạn chế chức năng phổi, triệu chứng, tình trạng sức khỏe |
Không64 | ||
| Steroid uống | – Không hiệu quả trong điều trị duy trì
– Trong đợt cấp: Cải thiện chức năng phổi, giảm khó thở, giảm thất bại điều trị, giảm tỉ lệ tái phát |
Có45,64 | Rối loạn nhịp thất | |
| Kháng sinhMacrolides | Dự phòng đợt cấp | Không63 | Nguy cơ QT dài khi phối hợp với Amiodarone hoặc Sotalol | Khoảng QTc dài |
| Ức chế Phospho-diesterase-4
Roflflumilast |
Dự phòng đợt cấp | Không63 | ||
Bảng 5: Điều trị COPD trên bệnh nhân rung nhĩ47
2. Điều trị khác bao gồm:
- Cải thiện oxy máu và giảm CO2 máu: Thiếu oxy máu và tăng CO2 máu có liên quan đến khởi phát rung nhĩ, vì vậy khuyến cáo hướng dẫn điều chỉnh các rối loạn này trong đợt cấp COPD5, mặc dù hiệu quả của phương thức điều trị bao gồm oxy liệu pháp và thông khí không xâm lấn chưa được chứng kminh có ảnh hưởng đến khởi phát hay tiến triển của rung nhĩ.65
- Phục hồi chức năng tim phổi: can thiệp vận động thể lực dưới hướng dẫn của CPET. Tác động có lợi của việc thay đổi yếu tố nguy cơ và vận động thể lực được thấy trên bệnh nhân rung nhĩ hoặc COPD.66-68
- Bệnh nhân rung nhĩ béo phì: kiểm soát yếu tố nguy cơ bao gồm giảm cân và vận động thể lực theo chương trình mục tiêu giúp cải thiện thành công lâu dài của triệt đốt rung nhĩ.66,67
- Các biện pháp can thiệp khác như giảm cân, cai rượu, ngưng hút thuốc lá, các biện pháp can thiệp lối sống khác ảnh hưởng trên tác dụng chống loạn nhịp ở bệnh nhân rung nhĩ kèm COPD cần được khảo sát thêm.68
KẾT LUẬN
Dữ liệu từ các nghiên cứu không ngẫu nhiên trên bệnh nhân rung nhĩ gợi ý rằng COPD có liên quan đến gia tăng rung nhĩ tái phát sau shock điện chuyển nhịp và giảm tỉ lệ thành công cắt đốt. Tỉ lệ mắc bệnh phổi tắc nghẽn mạn tính ở bệnh nhân rung nhĩ lên đến 23%. COPD nên được nghĩ đến trên mỗi bệnh nhân rung nhĩ có triệu chứng nổi bật là khó thở mạn tính hoặc giảm khả năng gắng sức, và suy tim được xem là một chẩn đoán phân biệt quan trọng. Cần có những nghiên cứu đoàn hệ tiến cứu trong tương lai trên bệnh nhân rung nhĩ để xác định mối tương quan giữa COPD và rung nhĩ, cũng như lợi ích điều trị bệnh phổi tắc nghẽn mạn tính hoặc rung nhĩ ở nhóm đối tượng bệnh nhân này, và làm rõ sự cần thiết của sàng lọc COPD thường quy và hiệu quả chi phí cho việc này.
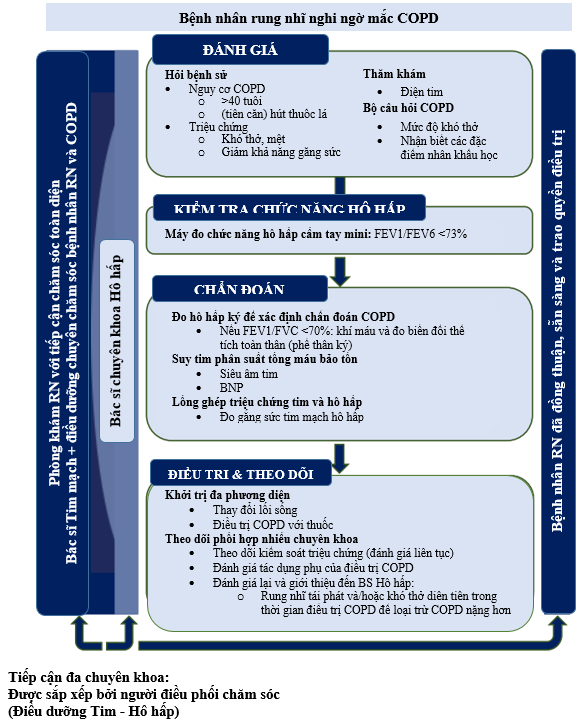
Hình 5. Gợi ý lưu đồ chăm sóc toàn diện, bao gồm cận lâm sàng và điều trị bệnh phổi tắc nghẽn mạn tính trên bệnh nhân rung nhĩ. Tỉ lệ FEV trong 1 giây/FEV trong 6 giây (FEV1/FEV6). RN, Rung nhĩ; COPD, bệnh phổi tắc nghẽn mạn tính; FEV1, thể tích khí thở ra gắng sức trong 1 giây đầu tiên; FVC, dung tích sống gắng sức.
TÀI LIỆU THAM KHẢO
- Global, regional, and national age-sex-specific mortality and life expectancy, 1950-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2018; 392 (10159):1684-1735. doi: 10.1016/s0140-6736(18)31891-9
- Adeloye D, Chua S, Lee C, et al. Global and regional estimates of COPD prevalence: Systematic review and meta-analysis. Journal of global health. 2015;5(2):020415. doi: 10.7189/jogh.05.020415
- Curkendall SM, DeLuise C, Jones JK, et al. Cardiovascular disease in patients with chronic obstructive pulmonary disease, Saskatchewan Canada cardiovascular disease in COPD patients. Annals of epidemiology. 2006; 16 (1):63-70. doi: 10.1016/j.annepidem.2005.04.008
- Chen X, Lin M, Wang W. The progression in atrial fibrillation patients with COPD: a systematic review and meta-analysis. Oncotarget. 2017; 8 (60):102420-102427. doi: 10.18632/oncotarget.22092
- Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. European heart journal. 2016; 37(38):2893-2962. doi: 10.1093/eurheartj/ehw210
- Durheim MT, Holmes DN, Blanco RG, et al. Characteristics and outcomes of adults with chronic obstructive pulmonary disease and atrial fibrillation. Heart. 2018; 104(22):1850-1858. doi: 10.1136/heartjnl-2017-312735
- Méndez-Bailón M, Lopez-de-Andrés A, de Miguel-Diez J, et al. Chronic obstructive pulmonary disease predicts higher incidence and in hospital mortality for atrial fibrillation. An observational study using hospital discharge data in Spain (2004-2013). International journal of cardiology. 2017; 236:209-215. doi: 10.1016/j.ijcard.2017.02.017
- Buch P, Friberg J, Scharling H, Lange P, Prescott E. Reduced lung function and risk of atrial fibrillation in the Copenhagen City Heart Study. The European respiratory journal. 2003; 21(6):1012-6. doi: 10.1183/09031936.03.00051502
- Shibata Y, Watanabe T, Osaka D, et al. Impairment of pulmonary function is an independent risk factor for atrial fibrillation: the Takahata study. International journal of medical sciences. 2011; 8(7):514-22. doi: 10.7150/ijms.8.514
- Li J, Agarwal SK, Alonso A, et al. Airflow obstruction, lung function, and incidence of atrial fibrillation: the Atherosclerosis Risk in Communities (ARIC) study. Circulation. 2014; 129(9):971-80. doi: 10.1161/circulationaha.113.004050
- Buist AS, McBurnie MA, Vollmer WM, et al. International variation in the prevalence of COPD (the BOLD Study): a population-based prevalence study. Lancet. 2007;370(9589):741-50. doi: 10.1016/s0140-6736(07)61377-4
- Proietti M, Laroche C, Drozd M, et al. Impact of chronic obstructive pulmonary disease on prognosis in atrial fibrillation: A report from the EURObservational Research Programme Pilot Survey on Atrial Fibrillation (EORP-AF) General Registry. American heart journal. 2016; 181:83-91. doi: 10.1016/j.ahj.2016.08.011
- Rodríguez-Mañero M, López-Pardo E, Cordero A, et al. A prospective study of the clinical outcomes and prognosis associated with comorbid COPD in the atrial fibrillation population. International journal of chronic obstructive pulmonary disease. 2019; 14:371-380. doi: 10.2147/copd.S174443
- Xiao X, Han H, Wu C, et al. Prevalence of Atrial Fibrillation in Hospital Encounters With End-Stage COPD on Home Oxygen: National Trends in the United States. Chest. 2019; 155(5):918-927. doi: 10.1016/j.chest.2018.12.021
- Hirayama A, Goto T, Shimada YJ, Faridi MK, Camargo CA, Jr., Hasegawa K. Acute Exacerbation of Chronic Obstructive Pulmonary Disease and Subsequent Risk of Emergency Department Visits and Hospitalizations for Atrial Fibrillation. Circulation Arrhythmia and electrophysiology. 2018; 11(9):e006322. doi: 10.1161/circep.118.006322
- Konecny T, Park JY, Somers KR, et al. Relation of chronic obstructive pulmonary disease to atrial and ventricular arrhythmias. The American journal of cardiology. 2014; 114(2):272-7. doi: 10.1016/j.amjcard.2014.04.030
- Desai R, Patel U, Singh S, et al. The burden and impact of arrhythmia in chronic obstructive pulmonary disease: Insights from the National Inpatient Sample. International journal of cardiology. 2019; 281:49-55. doi: 10.1016/j.ijcard.2019.01.074
- Roh SY, Choi JI, Lee JY, et al. Catheter ablation of atrial fibrillation in patients with chronic lung disease. Circulation Arrhythmia and electrophysiology. 2011; 4(6):815-22. doi: 10.1161/circep.110.960435
- Kang H, Bae BS, Kim JH, Jang HS, Lee BR, Jung BC. The relationship between chronic atrial fibrillation and reduced pulmonary function in cases of preserved left ventricular systolic function. Korean circulation journal. 2009; 39(9):372-7. doi: 10.4070/kcj.2009.39.9.372
- Wanamaker B, Cascino T, McLaughlin V, Oral H, Latchamsetty R, Siontis KC. Atrial Arrhythmias in Pulmonary Hypertension: Pathogenesis, Prognosis and Management. Arrhythmia & electrophysiology review. 2018; 7(1):43-48. doi: 10.15420/aer.2018.3.2
- Elia D, Caminati A, Zompatori M, et al. Pulmonary hypertension and chronic lung disease: where are we headed? European respiratory review: an official journal of the European Respiratory Society. 2019; 28(153)doi: 10.1183/16000617.0065-2019
- Lainscak M, Dagres N, Filippatos GS, Anker SD, Kremastinos DT. Atrial fibrillation in chronic non-cardiac disease: where do we stand? International journal of cardiology. 2008; 128(3):311-5. doi: 10.1016/j.ijcard.2007.12.078
- Linz D, McEvoy RD, Cowie MR, et al. Associations of Obstructive Sleep Apnea With Atrial Fibrillation and Continuous Positive Airway Pressure Treatment: A Review. JAMA cardiology. 2018; 3(6):532-540. doi: 10.1001/jamacardio.2018.0095
- Yamaguchi T, Tsuchiya T, Miyamoto K, Nagamoto Y, Takahashi N. Characterization of non-pulmonary vein foci with an EnSite array in patients with paroxysmal atrial fibrillation. Europace. 2010; 12(12):1698-706. doi: 10.1093/europace/euq326
- Stevenson IH, Roberts-Thomson KC, Kistler PM et al. Atrial electrophysiology is altered by acute hypercapnia but not hypoxemia: implications for promotion of atrial fibrillation in pulmonary disease and sleep apnea. Heart rhythm. 2010; 7(9):1263-70. doi: 10.1016/j.hrthm.2010.03.020
- Terzano C, Romani S, Conti V, Paone G, Oriolo F, Vitarelli A. Atrial fibrillation in the acute, hypercapnic exacerbations of COPD. European review for medical and pharmacological sciences. 2014; 18(19):2908-17. doi:
- Cirulis MM, Ryan JJ, Archer SL. Pathophysiology, incidence, management, and consequences of cardiac arrhythmia in pulmonary arterial hypertension and chronic thromboembolic pulmonary hypertension. Pulmonary circulation. 2019; 9(1):2045894019834890. doi: 10.1177/2045894019834890
- Nattel S, Burstein B, Dobrev D. Atrial remodeling and atrial fibrillation: mechanisms and implications. Circulation Arrhythmia and electrophysiology. 2008; 1(1):62-73. doi: 10.1161/circep.107.754564
- Medi C, Kalman JM, Ling LH, et al. Atrial electrical and structural remodeling associated with longstanding pulmonary hypertension and right ventricular hypertrophy in humans. Journal of cardiovascular electrophysiology. 2012; 23(6):614-20. doi: 10.1111/j.1540-8167.2011.02255.x
- Heindl S, Lehnert M, Criée CP, Hasenfuss G, Andreas S. Marked sympathetic activation in patients with chronic respiratory failure. American journal of respiratory and critical care medicine. 2001; 164(4):597-601. doi: 10.1164/ajrccm.164.4.2007085
- Bristow MR, Anderson FL, Port JD, et al. Differences in beta-adrenergic neuroeffector mechanisms in ischemic versus idiopathic dilated cardiomyopathy. Circulation. 1991; 84(3):1024-39. doi: 10.1161/01.cir.84.3.1024
- Francis GS, McDonald KM, Cohn JN. Neurohumoral activation in preclinical heart failure. Remodeling and the potential for intervention. Circulation. 1993; 87(5 Suppl):Iv90-6. doi:
- Volterrani M, Scalvini S, Mazzuero G, et al. Decreased heart rate variability in patients with chronic obstructive pulmonary disease. Chest. 1994; 106(5):1432-7. doi: 10.1378/chest.106.5.1432
- Linz D, Ukena C, Mahfoud F, Neuberger HR, Böhm M. Atrial autonomic innervation: a target for interventional antiarrhythmic therapy? Journal of the American College of Cardiology. 2014; 63(3):215-24. doi: 10.1016/j.jacc.2013.09.020
- Ciarka A, Doan V, Velez-Roa S, Naeije R, van de Borne P. Prognostic significance of sympathetic nervous system activation in pulmonary arterial hypertension. American journal of respiratory and critical care medicine. 2010; 181(11):1269-75. doi: 10.1164/rccm.200912-1856OC
- Kirkham PA, Barnes PJ. Oxidative stress in COPD. Chest. 2013; 144(1):266-273. doi: 10.1378/chest.12-2664
- Goudis CA. Chronic obstructive pulmonary disease and atrial fibrillation: An unknown relationship. Journal of cardiology. 2017; 69(5):699-705. doi: 10.1016/j.jjcc.2016.12.013
- Huang CX, Liu Y, Xia WF, Tang YH, Huang H. Oxidative stress: a possible pathogenesis of atrial fibrillation. Medical hypotheses. 2009; 72(4):466-7. doi: 10.1016/j.mehy.2008.08.031
- Wilchesky M, Ernst P, Brophy JM, Platt RW, Suissa S. Bronchodilator use and the risk of arrhythmia in COPD: part 2: reassessment in the larger Quebec cohort. Chest. 2012; 142(2):305-311. doi: 10.1378/chest.11-1597
- Cazzola M, Imperatore F, Salzillo A, et al. Cardiac effects of formoterol and salmeterol in patients suffering from COPD with preexisting cardiac arrhythmias and hypoxemia. Chest. 1998; 114(2):411-5. doi: 10.1378/chest.114.2.411
- Kallergis EM, Manios EG, Kanoupakis EM, et al. Acute electrophysiologic effects of inhaled salbutamol in humans. Chest. 2005; 127(6):2057-63. doi: 10.1378/chest.127.6.2057
- Singh S, Loke YK, Enright P, Furberg CD. Pro-arrhythmic and pro-ischaemic effects of inhaled anticholinergic medications. Thorax. 2013; 68(1):114-6. doi: 10.1136/thoraxjnl-2011-201275
- Ogale SS, Lee TA, Au DH, Boudreau DM, Sullivan SD. Cardiovascular events associated with ipratropium bromide in COPD. Chest. 2010; 137(1):13-9. doi: 10.1378/chest.08-2367
- Christiansen CF, Christensen S, Mehnert F, Cummings SR, Chapurlat RD, Sørensen HT. Glucocorticoid use and risk of atrial fibrillation or flutter: a population-based, case-control study. Archives of internal medicine. 2009; 169(18):1677-83. doi: 10.1001/archinternmed.2009.297
- van der Hooft CS, Heeringa J, Brusselle GG, et al. Corticosteroids and the risk of atrial fibrillation. Archives of internal medicine. 2006; 166(9):1016-20. doi: 10.1001/archinte.166.9.1016
- Sin DD, Man SF. Why are patients with chronic obstructive pulmonary disease at increased risk of cardiovascular diseases? The potential role of systemic inflammation in chronic obstructive pulmonary disease. Circulation. 2003; 107(11):1514-9. doi: 10.1161/01.cir.0000056767.69054.b3
- Simons SO, Elliott A, Sastry M, et al. Chronic obstructive pulmonary disease and atrial fibrillation: an interdisciplinary perspective. European heart journal. 2021; 42(5):532-540. doi: 10.1093/eurheartj/ehaa822
- Ecker V, Knoery C, Rushworth G, et al. A review of factors associated with maintenance of sinus rhythm after elective electrical cardioversion for atrial fibrillation. Clinical cardiology. 2018; 41(6):862-870. doi: 10.1002/clc.22931
- Pisters R, Nieuwlaat R, Prins MH, et al. Clinical correlates of immediate success and outcome at 1-year follow-up of real-world cardioversion of atrial fibrillation: the Euro Heart Survey. Europace. 2012; 14(5):666-74. doi: 10.1093/europace/eur406
- Emren SV, Kocabaş U, Duygu H, et al. The role of HATCH score in predicting the success rate of sinus rhythm following electrical cardioversion of atrial fibrillation. Kardiologia polska. 2016; 74(9):978-84. doi: 10.5603/KP.a2016.0044
- Jackevicius CA, Tom A, Essebag V, et al. Population-level incidence and risk factors for pulmonary toxicity associated with amiodarone. The American journal of cardiology. 2011; 108(5):705-10. doi: 10.1016/j.amjcard.2011.04.024
- Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. European heart journal. 2021; 42(5):373-498. doi: 10.1093/eurheartj/ehaa612
- Salpeter S, Ormiston T, Salpeter E. Cardioselective beta-blockers for chronic obstructive pulmonary disease. The Cochrane database of systematic reviews. 2005 (4): Cd003566. doi: 10.1002/14651858.CD003566.pub2
- Ni Y, Shi G, Wan H. Use of cardioselective β-blockers in patients with chronic obstructive pulmonary disease: a meta-analysis of randomized, placebo-controlled, blinded trials. The Journal of international medical research. 2012; 40(6):2051-65. doi: 10.1177/030006051204000602
- Du Q, Sun Y, Ding N, Lu L, Chen Y. Beta-blockers reduced the risk of mortality and exacerbation in patients with COPD: a meta-analysis of observational studies. PloS one. 2014; 9(11):e113048. doi: 10.1371/journal.pone.0113048
- Canepa M, Franssen FME, Olschewski H, et al. Diagnostic and Therapeutic Gaps in Patients With Heart Failure and Chronic Obstructive Pulmonary Disease. JACC Heart failure. 2019; 7(10):823-833. doi: 10.1016/j.jchf.2019.05.009
- Gu J, Liu X, Tan H, et al. Impact of chronic obstructive pulmonary disease on procedural outcomes and quality of life in patients with atrial fibrillation undergoing catheter ablation. Journal of cardiovascular electrophysiology. 2013; 24(2):148-54. doi: 10.1111/j.1540-8167.2012.02448.x
- Arora S, Lahewala S, Tripathi B, et al. Causes and Predictors of Readmission in Patients With Atrial Fibrillation Undergoing Catheter Ablation: A National Population-Based Cohort Study. Journal of the American Heart Association. 2018; 7(12)doi: 10.1161/jaha.118.009294
- Seara JG, Roubin SR, Gude Sampedro F, et al. Risk of atrial fibrillation, stroke, and death after radiofrequency catheter ablation of typical atrial flutter. Clinical research in cardiology : official journal of the German Cardiac Society. 2014; 103(7):543-52. doi: 10.1007/s00392-014-0682-6
- Chen K, Bai R, Deng W, et al. HATCH score in the prediction of new-onset atrial fibrillation after catheter ablation of typical atrial flutter. Heart rhythm. 2015; 12(7):1483-9. doi: 10.1016/j.hrthm.2015.04.008
- Brook RD, Anderson JA, Calverley PM, et al. Cardiovascular outcomes with an inhaled beta2-agonist/corticosteroid in patients with COPD at high cardiovascular risk. Heart. 2017; 103(19):1536-1542. doi: 10.1136/heartjnl-2016-310897
- Wise RA, Chapman KR, Scirica BM, et al. Effect of Aclidinium Bromide on Major Cardiovascular Events and Exacerbations in High-Risk Patients With Chronic Obstructive Pulmonary Disease: The ASCENT-COPD Randomized Clinical Trial. Jama. 2019; 321(17):1693-1701. doi: 10.1001/jama.2019.4973
- Lahousse L, Verhamme KM, Stricker BH, Brusselle GG. Cardiac effects of current treatments of chronic obstructive pulmonary disease. The Lancet Respiratory medicine. 2016; 4(2):149-64. doi: 10.1016/s2213-2600(15)00518-4
- Huerta C, Lanes SF, García Rodríguez LA. Respiratory medications and the risk of cardiac arrhythmias. Epidemiology (Cambridge, Mass). 2005; 16(3):360-6. doi: 10.1097/01.ede.0000158743.90664.a7
- Köhnlein T, Windisch W, Köhler D, et al. Non-invasive positive pressure ventilation for the treatment of severe stable chronic obstructive pulmonary disease: a prospective, multicentre, randomised, controlled clinical trial. The Lancet Respiratory medicine. 2014; 2(9):698-705. doi: 10.1016/s2213-2600(14)70153-5
- Pathak RK, Middeldorp ME, Lau DH, et al. Aggressive risk factor reduction study for atrial fibrillation and implications for the outcome of ablation: the ARREST-AF cohort study. Journal of the American College of Cardiology. 2014; 64(21):2222-31. doi: 10.1016/j.jacc.2014.09.028
- Middeldorp ME, Pathak RK, Meredith M, et al. PREVEntion and regReSsive Effect of weight-loss and risk factor modification on Atrial Fibrillation: the REVERSE-AF study. Europace. 2018; 20(12):1929-1935. doi: 10.1093/europace/euy117
- Tsai LL, McNamara RJ, Moddel C, Alison JA, McKenzie DK, McKeough ZJ. Home-based telerehabilitation via real-time videoconferencing improves endurance exercise capacity in patients with COPD: The randomized controlled TeleR Study. Respirology (Carlton, Vic). 2017; 22(4):699-707. doi: 10.1111/resp.12966
- Lopez. CM. Management of Atrial Fibrillation in Patients With Chronic Obstructive Pulmonary Disease. Journal of Cardiovascular Nursing. 2005. Vol. 20, No. 2, pp 133–140
- Vilson.DR et al: Clinical decision support to Optimize Care of patients with Atrial Fibrillation or flutter in the Emergency department: protocol of a stepped-wedge cluster randomized pragmatic trial (O’CAFÉ trial). Trials. 2023. https://doi.org/10.1186/s13063-023-07230-2







