PGS.TS.BS. NGUYỄN TUẤN VŨ
TS.BS. NGUYỄN NGỌC PHƯƠNG THƯ
Đại học Y Khoa Phạm Ngọc Thạch
TÓM TẮT
Ngưng thở tắc nghẽn khi ngủ (Obstructive Sleep Apnea – OSA) là một hội chứng nằm trong các rối loạn nhịp thở liên quan giấc ngủ. Nó đặc trưng bởi các đợt tái phát tắc nghẽn đường hô hấp trên hoàn toàn (ngưng thở) hoặc một phần (giảm thở), ảnh hưởng đến 34% nam giới trung niên và 17% nữ giới trung niên. Buồn ngủ ban ngày quá mức là một triệu chứng chính, và sự hiện diện của nó đánh dấu một căn bệnh nghiêm trọng có liên quan đến việc tăng nguy cơ mắc các kết cục bệnh tim mạch bất lợi. Tỉ lệ mắc OSA ở các bệnh nhân mắc hội chứng mạch vành mạn tương đối cao (30% – 50%). Những nghiên cứu gần đây đã chứng minh OSA là yếu tố nguy cơ độc lập làm tăng nguy cơ mắc bệnh động mạch vành với nhiều cơ chế khác nhau như stress oxit hóa, phản ứng viêm hệ thống góp phần gây vôi hóa mạch vành và bất ổn mảng xơ vữa. Tuy nhiên đây là một yếu tố nguy cơ có thể điều chỉnh được. Điều trị OSA với nhiều biện pháp từ thay đổi lối sống đến các thiết bị hỗ trợ như CPAP cho thấy giúp giảm xuất hiện các biến cố tim mạch mới, kéo dài thời gian xảy ra biến cố cũng như giảm tỉ lệ tử vong do bệnh tim mạch. Nhìn chung, ngưng thở tắc nghẽn khi ngủ là một vấn đề phổ biến ở bệnh nhân tim mạch nói chung và bệnh động mạch vành mạn nói riêng nhưng thường chưa được quan tâm đúng mức và điều trị OSA giúp cải thiện ngoạn mục các kết cục tim mạch.
Từ khóa: Ngưng thở tắc nghẽn khi ngủ, hội chứng động mạch vành mạn.
I. TỔNG QUAN VỀ NGƯNG THỞ TẮC NGHẼN KHI NGỦ
1. Giới thiệu
Rối loạn nhịp thở khi ngủ (Sleep Disordered Breathing – SBD) bao gồm một số tình trạng mà trong đó hội chứng ngưng thở khi ngủ do tắc nghẽn (Obstructive Sleep Apnea – OSA) là thường gặp nhất1. Các tình trạng khác bao gồm ngưng thở khi ngủ kiểu trung ương (mất cân bằng trong kiểm soát hô hấp do tăng nhạy cảm hóa học, đặc biệt xảy ra ở bệnh nhân suy tim), hoặc hội chứng giảm thông khí do béo phì, là một tình trạng giảm thông khí do thiếu phản xạ với carbondioxit1. Bài viết này chúng tôi tập trung phân tích về hội chứng ngưng thở khi ngủ do tắc nghẽn.
OSA được đặc trưng bởi tình trạng đè sụp vùng hầu họng tái diễn trong khi ngủ. Sinh lý bệnh của OSA được cho là do đa yếu tố và bao gồm việc giảm kích thước đường hô hấp trên có thể do thay đổi cả về mặt giải phẫu và chức năng (béo phì hoặc thay đổi cấu trúc hàm mặt) – (Hình 1), tăng khả năng xẹp của vùng hầu họng do giảm phản xạ bù trừ thần kinh cơ và thiếu phản xạ bảo vệ hầu họng trong khi ngủ1. Kích thước đường hô hấp trên giảm và sức cản tăng lên có thể dẫn đến hiện tượng ngáy do sự rung của khẩu cái mềm, lưỡi gà và/hoặc thành bên của hầu họng1. Xẹp đường hô hấp trên có thể hoàn toàn, dẫn đến ngưng thở do tắc nghẽn (OSA) được định nghĩa là giảm lưu lượng khí trên 90% liên quan đến các cử động hô hấp tái diễn 1. Sự đè sụp bán phần hay còn gọi là giảm thở, được định nghĩa là giảm thông khí hơn 30% và độ bão hòa oxy giảm hơn 3% so với mức cơ bản hoặc có vi thức giấc1. Do thời lượng ngắn (3–15 giây), bệnh nhân không cảm nhận được các vi thức giấc nhưng vẫn gây ra tình trạng giấc ngủ bị gián đoạn. Đặc biệt, tình trạng thiếu oxy không liên tục có vai trò quan trọng trong sinh lý bệnh của chứng ngưng thở, giảm thở và các hậu quả kéo theo bao gồm buồn ngủ ban ngày quá mức, các bệnh lý tim mạch đi kèm và tăng nguy cơ tử vong do mọi nguyên nhân, thường gặp trong OSA mức độ nặng. OSA hiện được coi là một vấn đề sức khỏe cộng đồng lớn ảnh hưởng đến 5%–15% dân số nói chung, tăng tuyến tính theo độ tuổi lên tới ít nhất 60–65 tuổi2.
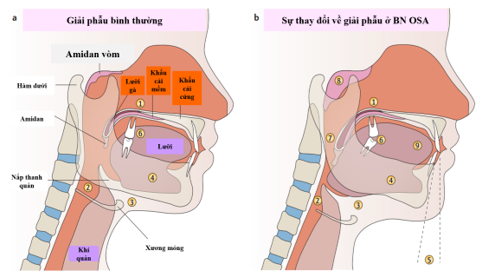
Hình 1. Những thay đổi về giải phẫu ở bệnh nhân mắc OSA
(Nguồn: Lévy P et al, Nature Reviews Disease Primers, 2015) 1
2. Dịch tễ
Tỉ lệ mắc OSA cao trên toàn thế giới (Hình 2). Hơn nữa, một số nghiên cứu gần đây thậm chí còn cho thấy tỉ lệ hiện mắc đang gia tăng, điều này có thể phản ánh tỉ lệ ngày càng tăng của những người thừa cân và béo phì. Vào cuối những năm 2000, 13% nam giới và 6% nữ giới trong độ tuổi 30–70 bị rối loạn nhịp thở khi ngủ từ trung bình đến nặng [chỉ số ngưng thở-giảm thở (Apnea Hypopnea Index – AHI) ≥15] so với 5% nam giới và 4% nữ giới vào năm 19933. Tùy thuộc vào độ tuổi và giới tính, các tác giả kết luận rằng tỉ lệ hiện mắc OSA đã tăng 14–55% kể từ đầu những năm 1990.
OSA phổ biến ở người cao tuổi, tăng đáng kể ở những người trên 65 tuổi 4, với tỉ lệ lên tới 80% đối với AHI >5 trong một số nghiên cứu 2. OSA thường liên quan đến các bệnh đồng mắc. Các bất thường về tim mạch và chuyển hóa được quan sát thấy ở tới 50% bệnh nhân mắc OSA 5. Trên thực tế, OSA là nguyên nhân phổ biến nhất gây tăng huyết áp thứ phát kháng thuốc6 và gây ra tình trạng mất trũng huyết áp về đêm7. Ở bệnh nhân mắc hội chứng động mạch vành (HCĐMV) mạn, tỉ lệ OSA tương đối cao dao động từ 30% – 50% 8.
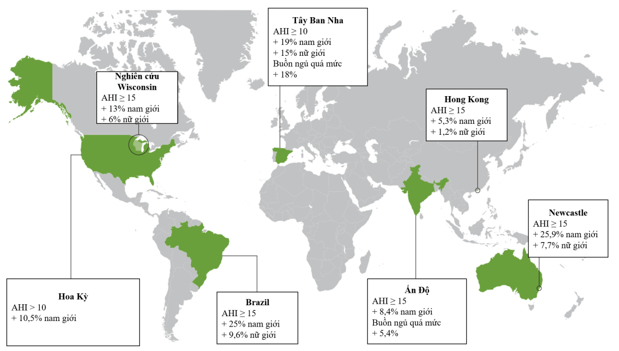
Hình 2. Tỉ lệ hiện mắc OSA tại các khu vực trên thế giới
(Nguồn: Lévy P et al, Nature Reviews Disease Primers, 2015) 1
3. Yếu tố nguy cơ
Các yếu tố nguy cơ của OSA được trình bày trong bảng sau:
Bảng 1. Các yếu tố nguy cơ của OSA
(Nguồn: Lévy P et al, Nature Reviews Disease Primers, 2015) 1
| Yếu tố nguy cơ | Đặc điểm |
| Tuổi cao | + Độ tuổi trung bình khi chẩn đoán là từ 40 đến 50 tuổi.
+ Ti lệ OSA dường như tăng theo tuổi và ổn định sau khoảng 65 tuổi. |
| Giới Nam | + Nam giới bị ảnh hưởng nhiều gấp hai đến ba lần so với phụ nữ cùng độ tuổi tiền mãn kinh.
+ Lý do cho sự chênh lệch này vẫn chưa được hiểu rõ hoàn toàn; tuy nhiên, ảnh hưởng của nội tiết tố lên khả năng kiểm soát hô hấp và kích hoạt cơ đường hô hấp trên trong khi ngủ và phân bổ mỡ theo giới tính dường như giải thích một số khác biệt này. + Tỉ lệ mắc OSA ở phụ nữ tăng lên sau thời kỳ mãn kinh, có thể do mỡ cơ thể được phân bổ lại ở phần trên cơ thể, bao gồm cả cổ. |
| Béo phì | + Là yếu tố nguy cơ mạnh nhất.
+ Nguy cơ OSA tăng dần khi chỉ số BMI tăng và thậm chí còn cao hơn khi chu vi cổ ngày càng tăng. Điều này có lẽ liên quan nhiều nhất đến việc thu hẹp đường hô hấp trên do mô mỡ dư thừa. + Trong một nghiên cứu dựa trên dân số với hơn 1.000 đối tượng trải qua nghiên cứu về giấc ngủ, OSAS (được định nghĩa là AHI ≥15) xuất hiện ở 11% nam giới có chỉ số BMI bình thường, ở 21% những người có chỉ số BMI từ 25 trở lên. và 30kg/m2, và ở 63% số người béo phì (BMI >30kg/m2).Xu hướng tương tự cũng được quan sát thấy ở phụ nữ: 3% những người có cân nặng bình thường đáp ứng các tiêu chí của OSA, 9% những người thừa cân và 22% những người béo phì (BMI >30kg/m2). |
| Hẹp đường hô hấp trên do bất thường sọ mặt và mô mềm | + Khoảng cách cằm – móng < 1,5 cm, mức độhọng lớn hơn 2/4 và sự hiện diện của nghiến răng quá mức đã được xác định là những yếu tố dự báo hữu ích về OSA với giá trị tiên đoán dương là 95%, giá trị tiên đoán âm 49%, độ nhạy 40%, độ đặc hiệu 96% nếu có cả ba đặc điểm.
+ Một cách tiếp cận đơn giản hơn để đánh giá tình trạng hẹp đường hô hấp trên là điểm Mallampati, được đánh giá bằng cách yêu cầu bệnh nhân há miệng và thè lưỡi ra nhiều nhất có thể khi ngồi. Điểm số phụ thuộc vào khả năng hiển thị của trụ cơ, khẩu cái mềm và lưỡi gà. |
| Tính di truyền gia đình | |
| Hút thuốc lá | |
| Viêm sung huyết niêm mạc mũi | |
| Mãn kinh, Hậu mãn kinh | |
| Các tình trạng bệnh lý (như tăng huyết áp, đái tháo đường, hội chứng Marfan, bệnh to đầu chi, suy giáp, bệnh thận giai đoạn cuối, suy tim sung huyết, bệnh phổi tắc nghẽn mãn tính, rối loạn thần kinh và mang thai) | |
| Thuốc và chất gây nghiện (bao gồm rượu, thuốc benzodiazepin và ma túy) | |
4. Chẩn đoán
Chẩn đoán OSA dựa trên các bản ghi giấc ngủ, hoặc đo đa ký giấc ngủ đầy đủ, bao gồm các tín hiệu sinh lý thần kinh, tim và hô hấp (Hình 3)9. Bệnh nhân chỉ được coi là mắc OSA khi xảy ra chứng ngưng thở khi ngủ do tắc nghẽn và phải gây ra các triệu chứng (Bảng 2). Điều quan trọng là chứng ngưng thở khi ngủ được phát hiện trong bản ghi giấc ngủ mà không có bất kỳ triệu chứng nào thường không được coi là OSA, ngoại trừ nếu chỉ số ngưng thở-giảm thở (Apnea Hypopnea Index – AHI) >15 (lần/ giờ ngủ) 10.
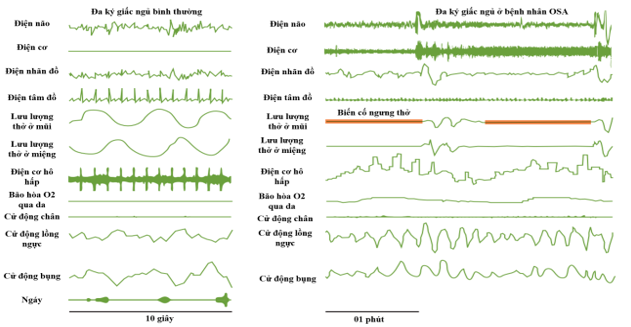
Hình 3. Đặc điểm đa ký giấc ngủ ở bệnh nhân OSA và người bình thường
(Nguồn: Lévy P et al, Nature Reviews Disease Primers, 2015) 1
Bảng 2. Tiêu chuẩn chẩn đoán ngưng thở tắc nghẽn khi ngủ
(Nguồn: Epstein LJ et al, J Clin Sleep Med, 2009) 11
| A | B | C |
| Buồn ngủ ban ngày nhiều không giải thích được | Có ≥ 2 trong các yếu tố sau không giải thích được:
+ Ngáy to > 3 lần/tuần. + Cảm giác ngạt thở lúc ngủ. + Giấc ngủ không làm hồi phục sự mệt mỏi. + Khó tập trung. + Mệt mỏi ban ngày. + Tiểu đêm > 1 lần/đêm. |
Chỉ số ngưng thở – giảm thở (AHI) ≥ 5 lần/giờ. |
| Hội chứng ngưng thở tắc nghẽn khi ngủ = A / B + C HOẶC AHI ≥ 15 lần/giờ. | ||
Sau khi được chẩn đoán xác định, các tác giả dựa vào AHI và độ bão hòa oxy để phân mức độ ngưng thở tắc nghẽn khi ngủ (Bảng 3) cho người bệnh nhằm có chiến lược quản lý phù hợp.
Bảng 3. Phân độ ngưng thở tắc nghẽn khi ngủ
(Nguồn: Epstein LJ et al, J Clin Sleep Med, 2009) 11
| Mức độ nhẹ | Mức độ trung bình | Mức độ nặng | |
| AHI | 5 – 15 lần/giờ. | 15 – 30 lần/giờ. | >30 lần/giờ. |
| Độ bão hòa oxy < 90% | < 5% thời gian ngủ. | 5 – 20 % thời gian ngủ. | >20% thời gian ngủ. |
II. MỐI LIÊN QUAN GIỮA NGƯNG THỞ TẮC NGHẼN KHI NGỦ VÀ HỘI CHỨNG ĐỘNG MẠCH VÀNH MẠN
1. Sinh lý bệnh
Các biến cố ngưng thở tắc nghẽn kết hợp một loạt các yếu tố gây stress kích hoạt các cơ chế góp phần vào sự khởi đầu và tiến triển của các bệnh về tim, mạch máu và chuyển hóa. Nhịp thở bị tắc nghẽn gây ra áp lực âm đáng kể trong lồng ngực, làm căng các cấu trúc trong lồng ngực, đặc biệt là tâm nhĩ của tim và các mạch máu lớn. Sự cản trở hô hấp cũng gây ra tình trạng thiếu oxy máu và tăng thán máu. Stress do thiếu oxy càng được khuếch đại hơn nữa do quá trình tái oxy hóa bình thường sau một nhịp ngưng thở (thiếu oxy không liên tục), dẫn đến việc tạo ra các gốc oxy hóa tự do(Reactive Oxygen Species – ROS)và yếu tố viêm. Các biến cố ngưng thở cũng đi kèm với sự thức giấc khi ngủ, dẫn đến tình trạng giấc ngủ bị gián đoạn và có thể bị thiếu hụt, điều này có thể kích hoạt một loạt các cơ chế bệnh sinh chủ yếu xoay quanh hoạt hóa hệ thần kinh giao cảm, stress oxy hóa, và phản ứng viêm 1.
Tình trạng thiếu oxy không liên tục sẽ kích hoạt các thụ thể hóa học ngoại biên (nằm trong thể cảnh), kiểm soát một phần phản xạ thông khí đối với việc giảm hàm lượng oxy trong máu và làm tăng áp suất riêng phần trong máu của carbon dioxide (CO2). Ngoài ra, các phản xạ hóa học này làm tăng dẫn truyền hệ thần kinh giao cảm, kích hoạt hệ thống renin, angiotensin II và aldosterone, đồng thời tăng cường hoạt động co mạch. Suy giảm phản xạ áp lực, giảm nồng độ oxit nitric (NO) dãn mạch, tăng sản xuất Endothelin và tăng biểu hiện thụ thể cũng có thể làm thay đổi hoạt động co mạch và thúc đẩy tăng huyết áp hệ thống. Ngoài ra, người ta đã chứng minh rằng tình trạng thiếu oxy không liên tục liên quan đến chứng tăng CO2ngắt quãng, điều này không chỉ dẫn đến tăng độ nhạy cảm với chất co mạch Endothelin 1 mà còn làm tăng độ nhạy cảm với canxi nội bào 1 (Hình 4).
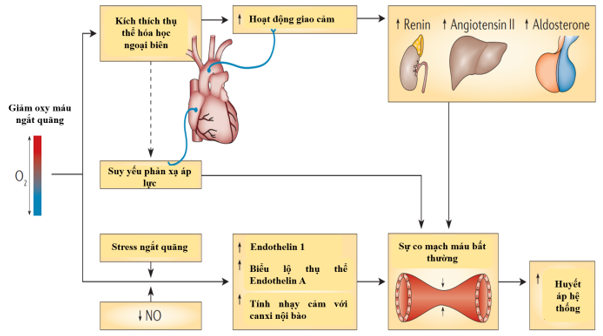
Hình 4. Cơ chế bệnh sinh kích hoạt hệ thần kinh tự chủ gây tăng huyết áp ở bệnh nhân OSA
(Nguồn: Lévy P et al, Nature Reviews Disease Primers, 2015) 1
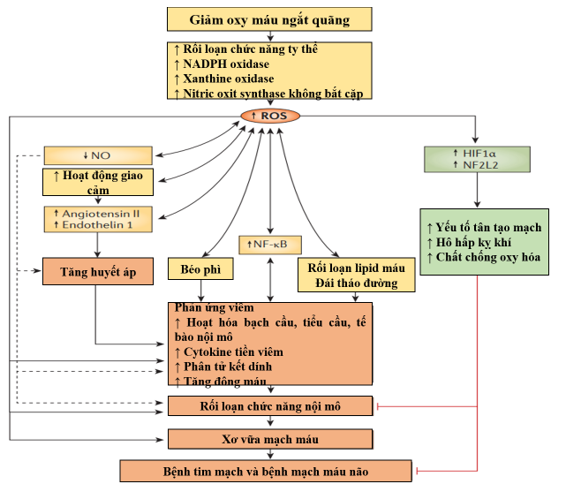
Hình 5. Cơ chế bệnh sinh stress oxy hóa thúc đẩy đến các bệnh tim mạch ở bệnh nhân OSA
(Nguồn: Lévy P et al, Nature Reviews Disease Primers, 2015) 1
Tình trạng giảm oxy máu ngắt quãng gây ra việc sản xuất các gốc oxy hóa tự do (ROS), dẫn đến stress oxy hóa bằng cách gây ra rối loạn chức năng ty thể, kích hoạt NADPH oxydase và xanthine oxydase và tạo ra nitric oxit synthase không bắt cặp. Sự tương tác của ROS với oxit nitric (NO) càng thúc đẩy quá trình oxy hóa đồng thời làm giảm sinhkhả dụng của NO và do đó thúc đẩy tăng huyết áp, viêm, rối loạn chức năng nội mô, tăng đông máu và xơ vữa động mạch1. Sự gia tăng phụ thuộc vào ROS trong hoạt hóa giao cảm, nồng độ angiotensin II và Endothelin 1 góp phần gây tăng huyết áp. Đồng thời, ROS có thể điều chỉnh lại nhiều yếu tố phiên mã nhạy cảm với oxy hóa khử, chẳng hạn như yếu tố hạt nhân-κB (NF-κB), yếu tố cảm ứng-1α do thiếu oxy (HIF1α) và yếu tố hạt nhân có nguồn gốc từ hồng cầu típ 2 (NF2L2). NF-κB điều phối các quá trình viêm khác nhau dẫn đến rối loạn chức năng nội mô và xơ vữa động mạch. Ngược lại, HIF1α và NF2L2, cũng được điều chỉnh theo mức độ ROS, có liên quan đến các cơ chế bảo vệ, có thể chống lại một số tác động có hại của ROS1 (Hình 5).
2. Y học chứng cứ
Ngày nay, với sự phát triển của các công cụ chẩn đoán, các giả thuyết sinh bệnh học của OSA dẫn đến HCĐMV mạn đã dần được chứng minh qua nhiều nghiên cứu lớn nhỏ. Tác giả Katherine và cộng sự đã thực hiên nghiên cứu bệnh – chứng trên các đối tượng gồm nhóm chứng khỏe mạnh (n=7), và các bệnh nhân OSA chưa được điều trị (n=7) 12. Các tế bào nội mô động mạch vành của con người được ủ trong môi trường 5% huyết thanh của từng đối tượng trong 4 giờ. PCR định lượng được thực hiện để đánh giá nồng độ của các yếu tố viêm có nguồn gốc nội mô (ICAM-1, VCAM-1, IL-8, P-selectin, CCL5 và CXCL12).Kết quả cho thấy nồng độ của các yếu tố viêm này ở bệnh nhân OSA cao hơn so với những người khỏe mạnh (Hình 6) 12.
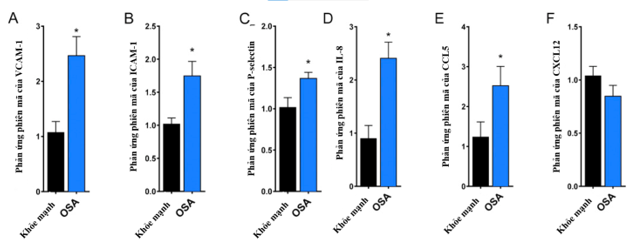
Hình 6. Sự khác biệt về phản ứng viêm của tế bào nội mô ở bệnh nhân OSA và nhóm chứng
(Nguồn: Katherine E. Zychowski et al, Atherosclerosis, 2016) 12
Năm 2021, tác giả Ozen K. Basoglu và cộng sự đã thực hiện nghiên cứu hồi cứu trên 2.361 người tham gia chưa từng được điều trị và sẽ được thực hiện đa ký giấc ngủ nhằm chẩn đoán OSA và làm xét nghiệm bilan lipid máu, từ đó tìm ra mối tương quan giữa chúng 13. Kết quả ghi nhận trong số 2361 bệnh nhân (tuổi trung bình 49,6 ± 11,9 tuổi; 68,9% nam giới), chỉ số ngưng thở giảm thở 36,6 ± 28,4 lần/giờ), 185 (7,8%) không mắc OSA và 2176 (92,2%) thỏa tiêu chí chẩn đoán OSA. Tỉ lệ rối loạn lipid máu cao (57%-66%) ở bệnh nhân OSA và đặc biệt tăng ở nhóm OSA mức độ nặng so với các nhóm khác (p < 0,05)13. Mặc dù cholesterol toàn phần và LDL-cholesterol không khác nhau giữa những người có và không có OSA, nhưng có sự khác biệt có ý nghĩa của mức cholesterol non HDL (p = 0,020), triglycerid (p = 0,001) và mức HDL-cholesterol (p = 0,018) ở bệnh nhân OSAso với những người không mắc OSA13. Non-HDL-cholesterol có mối tương quan đáng kể với mức độ nghiêm trọng của OSA (p < 0,001) và các thông số thiếu oxy (p < 0,01), trong khi cholesterol LDL không có mối tương quan13 (Hình 7).

Hình 7. Mối tương quan giữa AHI và Non HDL Cholesterol
(Nguồn: Ozen K. Basoglu et al, Sleep Medicine, 2021) 13
Faith S. Luyster cùng cộng sự đã nghiên cứu điều tra mối liên quan giữa chứng ngưng thở khi ngủ và sự hiện diện của vôi hóa động mạch vành (ĐMV) trong một nhóm đoàn hệ gồm nam giới và phụ nữ trung niên không có bệnh tim mạch từ trước, được phân loại theo chỉ số khối cơ thể (BMI) (BMI < 30 so với ≥ BMI 30)14. Những người tham gia được chụp cắt lớp vi tính để đo mức độ vôi hóa ĐMV và ghi đa ký giấc ngủ tại nhà để phát hiện chứng ngưng thở khi ngủ. Sự hiện diện của vôi hóa ĐMV được xác định khi điểm Agatston > 0. Chứng ngưng thở khi ngủ được phân tích một cách phân loại bằng chỉ số ngưng thở khi ngủ (AHI). Mẫu bao gồm chủ yếu là nam giới (61%) và người da trắng (56%), với độ tuổi trung bình là 61 tuổi. Tỉ lệ mắc vôi hóa ĐMV là 76%. Trong số những người tham gia có chỉ số BMI < 30 (n = 139), AHI ≥ 15 (so với AHI < 5) có liên quan đến tỉ lệ mắc vôi hóa ĐMV gấp 2,7 lần. Ngược lại, ở những người tham gia có chỉ số BMI ≥ 30, chứng ngưng thở khi ngủ không liên quan độc lập đến vôi hóa ĐMV. Tóm lại, chứng ngưng thở khi ngủ có liên quan độc lập với gánh nặng mảng xơ vữa động mạch sớm ở những người không béo phì14 (Hình 8).
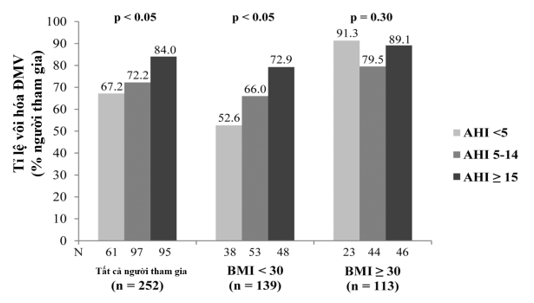
Hình 8. Phân bố vôi hóa ĐMV theo BMI và AHI
(Nguồn: Faith S. Luyster et al, Am J Cardiol, 2014) 14
Một nghiên cứu đoàn hệ tiến cứu gần đây của nhóm tác giả đến từ Brazil cũng điều tra mối liên quan giữa OSA với tình trạng xơ vữa ĐMV dưới lâm sàng15. Các tác giả đã phân tích 1.956 người tham gia với điểm vôi hóa ĐMV sẵn có ở thời điểm ban đầu (tuổi trung bình, 49 ± 8 tuổi; 57,9% nữ; 32,4% mắc OSA). Trong các phân tích được điều chỉnh đồng biến (n = 1.247; thời gian theo dõi trung bình là 5,1 ± 0,9 năm), các tác giả đã tìm thấy mối liên quan đáng kể giữa OSA và tỉ lệ mắc xơ vữa động mạch dưới lâm sàng (OR = 1,26; KTC 95%: 1,06-1,48)15. Mối liên quan này mạnh hơn trong số những người tự nhận thấy có triệu chứng buồn ngủ nhiều vào ban ngày (Excessive Daytime Sleepiness – EDS) với OR = 1,66; KTC 95%: 1,30-2,12; p = 0,02815. Ngoài ra, các tác giả cũng phân tích sự tiến triển của vôi hóa ĐMV ở 319 người tham gia vàghi nhận có mối tương quanthuận đối với OSA (β = 1,084; KTC 95%: 0,032-2,136; p = 0,043) và OSA kèmEDS (β = 1,651; KTC 95%: 0,208-3,094; p = 0,025)15 (Hình 9).
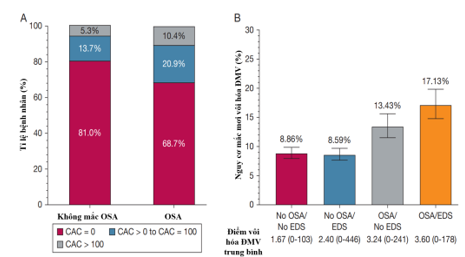
Hình 9. Phân bố nguy cơ vôi hóa động mạch vành theo OSA và EDS
(Nguồn: Diego R. Mazzotti et al, Chest, 2024) 15
Không chỉ dừng lại ở khía cạnh tìm ra mối tương quan giữa OSA và xơ vữa ĐMV, nhiều nghiên cứu cũng tập trung đánh giá chuyên sâu đặc điểm của mảng xơ vữa mạch vành ở người bệnh OSA có HCĐMV mạn, tiêu biểu là nghiên cứu của Adeline Tan và cộng sự sử dụng công cụ siêu âm nội mạch vành (IntraVascular UltraSound – IVUS) 16. Trong số 93 bệnh nhân, 32 người (34,4%) mới được chẩn đoán OSA từ trung bình đến nặng (AHI>15). So với những bệnh nhân không mắc OSA hoặc OSAmức độ nhẹ, những bệnh nhân mắc OSA từ trung bình đến nặng có tổng thể tích mảng xơ vữa lớn hơn (461,3 ± 250,4 mm3 so với 299,2 ± 135,6 mm3, p = 0,001)16 (Hình 10).
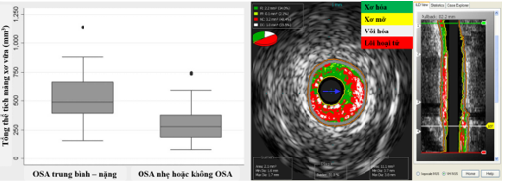
Hình 10. Mối liên quan giữa OSA và đặc điểm mảng xơ vữa mạch vành
(Nguồn: Adeline Tan et al, Chest, 2014) 16
Tác giả Y. Peker và cộng sự đã thực hiện nghiên cứu đoàn hệ tiến cứu trên 308 người ngáy khi ngủ (245 nam và 63 nữ) với độ tuổi trung bìnhlà 49,0 ± 9,9 tuổi vào năm 1991. Dữ liệu được thu thập thông qua Sổ bộ xuất viện của Bệnh viện Thụy Điển, Sổ bộ nguyên nhân tử vong quốc gia, biểu đồ lâm sàng và bảng câu hỏi17. Trong 7 năm, HCĐMV đã được quan sát thấy ở 17 (16,2%) trong số 105 bệnh nhân có OSA so với 11 (5,4%) trong số 203 người ngủ ngáy không có OSA. Chẩn đoán OSA lúc ban đầu có liên quan đến việc tăng nguy cơ phát triển HCĐMVkhi phân tích đa biến. Trong nhóm OSA, HCĐMV mạn được xác nhận ở 16 (24,6%) trong số 65 bệnh nhân được điều trị không đầy đủ so với 1 (3,9%) trong số 26 đối tượng được điều trị hiệu quả. Điều trị hiệu quả OSA làm giảm nguy cơ này. Từ đó, các tác giả kết luận rằng những người mắc chứng ngưng thở khi ngủ ở tuổi trung niên có nguy cơ cao mắc bệnh động mạch vành nếu không được điều trị hiệu quả, điều này cần được xem xét trong các mô hình phòng ngừa bệnh tim mạch17 (Hình 11).
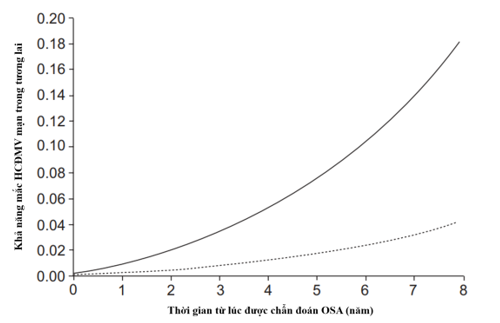
Hình 11. Phân bố xác suất mắc HCĐMV mạn theo thời gian mắc OSA
(Nguồn: Y. Peker et al, European Respiratory Journal, 2006) 17
III. ĐIỀU TRỊ NGƯNG THỞ TẮC NGHẼN KHI NGỦ Ở BỆNH NHÂN MẮC HỘI CHỨNG ĐỘNG MẠCH VÀNH MẠN
Năm 2022, Hiệp hội Tim khu vực Châu Á – Thái Bình Dương đã công bố đồng thuận về việc chẩn đoán và quản lý người bệnh OSA ở những bệnh nhân có bệnh tim mạch 18. Phương pháp điều trị đầu tiên đối với OSA mức độ nhẹ là điều trị bảo tồn, bao gồm sự kết hợp giữa giảm cân, liệu pháp ngủ theo tư thế, điều trị tối ưu cho chứng nghẹt mũi và liệu pháp phục hồi chức năng. Cần lưu ý rằng liệu pháp phục hồi chức năng đòi hỏi phải đào tạo đầy đủ các chuyên gia chăm sóc sức khỏe, điều này có thể hạn chế ở một số khu vực trong khu vực Châu Á – Thái Bình Dương. Một số chuyên gia nhấn mạnh rằng việc tham vấn ý kiến với chuyên gia về giấc ngủ được khuyến khích ở những bệnh nhân mắc OSA từ trung bình đến nặng hoặc đối với những bệnh nhân mắc OSA nhẹ nếu bác sĩ tim mạch chưa được đào tạo qua vấn đề này. Đồng thuận này cũng lưu ý rằng có thể cần phải giới thiệu cho người bệnh đến bác sĩ tai mũi họng hoặc nha khoa để có các liệu pháp thay thế ở một số bệnh nhân mắc OSA từ trung bình đến nặng18 (Hình 12).
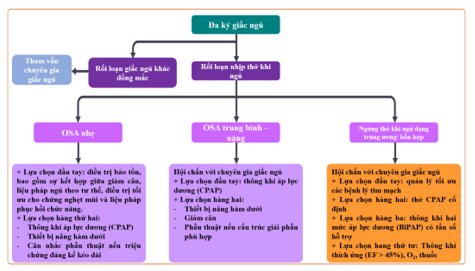
Hình 12. Chiến lược đề xuất quản lý bệnh nhân OSA có bệnh tim mạch
(Nguồn: Jack Wei Chieh Tan et al, Eur Cardiol, 2022) 18
Để có thể đưa ra đồng thuận quản lý bệnh nhân OSA có bệnh tim mạch, rất nhiều nghiên cứu trước đây đã được triển khai nhằm chứng minh lợi ích lâu dài của các phương pháp điều trị. Một trong những nghiên cứu đầu tiên xác nhận ích lợi của việc điều trị OSA đó là nghiên cứu củaOlivier Milleroncùng cộng sự được công bố trên Tạp chí Tim Châu Âu năm 2004 19. Các tác giả thực hiện tiến cứu 54 bệnh nhân (tuổi trung bình 57,3 ± 10,1 tuổi) mắc cả HCĐMV (≥ 70% hẹp động mạch vành) và OSA (AHI>= 15). Ở 25 bệnh nhân, OSA được điều trị bằng thông khí áp lực dương liên tục (Continous Positive Airway Pressure – CPAP) (n = 21) hoặc phẫu thuật đường hô hấp trên (n = 4); 29 bệnh nhân còn lại từ chối điều trị OSA. Thời gian theo dõi trung bình là 86,5 ± 39 tháng. Hai nhóm giống nhau về mặt tuổi tác, chỉ số khối cơ thể, tiền sử hút thuốc, tăng huyết áp, tăng cholesterol máu, đái tháo đường, số lượng mạch vành bị bệnh, phân suất tống máu thất trái. Việc điều trị các yếu tố nguy cơ khác ngoài OSA là tương tự nhau ở hai nhóm. Kết cục chính của nghiên cứu (gồm tử vong do tim mạch, hội chứng mạch vành cấp tính, nhập viện vì suy tim hoặc cần tái thông mạch vành) ghi nhận được ở 6 (24%) người trong nhóm có điều trị OSA và 17 (58%) người không điều trịvớip< 0,0119. Điều trị OSA làm giảm đáng kể nguy cơ xuất hiện các biến cố chính (HR = 0,24; KTC 95%: 0,09–0,62; p < 0,01)19 (Hình 13).
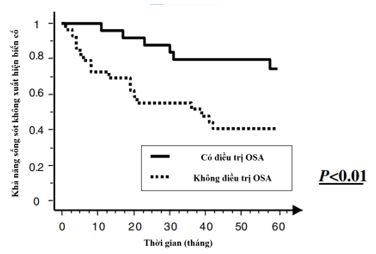
Hình 13. Phân bố khả năng sống còn không biến cố theo tình trạng điều trị OSA
(Nguồn: Olivier Milleron et al, European Heart Journal, 2004) 19
Liam S. Doherty cùng cộng sự đã thực hiện một nghiên cứu theo dõi dài hạn trên 168 bệnh nhân mắc OSA đã bắt đầu điều trị bằng CPAP ít nhất 5 năm trước với thời gian theo dõi trung bình là 7,5 năm20. Mục tiêu là so sánh kết cục tim mạch của những bệnh nhân không dung nạp CPAP (nhóm không được điều trị, 61 bệnh nhân) với những bệnh nhân tiếp tục điều trị bằng CPAP (107 bệnh nhân).Kết quả cho thấy bệnh nhân được điều trị bằng CPAP có AHI trung bình (48,3 [33,6;66,4]) cao hơn nhóm không được điều trị (36,7 [27,4; 55]) với p = 0,02. Tử vong do bệnh tim mạch chiếm tỉ lệ nhiều hơn ở nhóm không được điều trị (14,8%) so với nhóm được điều trị bằng CPAP trong thời gian theo dõi (1,9%) với p = 0,009 20, nhưng các kết cục tăng huyết áp, rối loạn nhịp hoặc đột quỵ mới không ghi nhận sự khác biệt có ý nghĩa giữa hai nhóm 20. Tổng số biến cố tim mạch (tử vong và bệnh tim mạch mới) phổ biến hơn ở nhóm không được điều trị so với nhóm được điều trị bằng CPAP (tương ứng là 31% so với 18%; p < 0,05)20 (Hình 14).
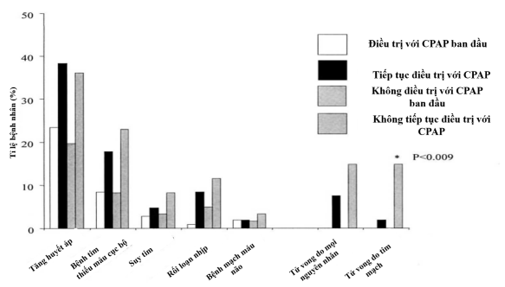
Hình 14. Các kết cục tim mạch ở bệnh nhân OSA có và không điều trị CPAP
(Nguồn: Liam S. Doherty et al, Chest, 2005) 20
Ở bệnh nhân OSA, trong thì tâm thu, áp lực xuyên thành thất trái tăng từ 120mmHg lên 160 mmHg do sự tăng áp lực âm màng phổi (−40 mmHg)21. Tình trạng này gần nhân tương đương với khi có tăng huyết áp (ví dụ, 160 mmHg). Khi đượcđiều trị với CPAP, áp lực xuyên thành thất trái giảm đinhờ tăng áp lực âm màng phổi thành +10 mmHg. Đó chính là cơ chế mới được phát hiện gần đây cho liệu pháp CPAP giúp cải thiện các biến cố tim mạch ở bệnh nhân mắc OSA 21 (Hình 15).
Nhằm đánh giá tác động thực sự của CPAP đối với bệnh nhân OSA, tác giảJose M Marin cùng cộng sự đã tiến hành một nghiên cứu quan sát để so sánh tỉ lệ mắc các biến cố tim mạch gây tử vong và không gây tử vong ở những người ngáy đơn thuần, bệnh nhân OSA không được điều trị, bệnh nhân OSA được điều trị bằng CPAP và nam giới khỏe mạnh được tuyển chọn từ dân số chung22.Dân số nghiên cứu gồm264 nam giới khỏe mạnh, 377 người ngáy đơn thuần, 403 người mắc OSA ở mức độ nhẹ đến trung bình không được điều trị, 235 người mắc bệnh nặng không được điều trị và 372 người mắc bệnh và được điều trị bằng CPAP. Kết quả cho thấy những bệnh nhân mắc bệnh nặng không được điều trị có tỉ lệ mắc các biến cố tim mạch gây tử vong (1,06 trên 100 người-năm) và các biến cố tim mạch không gây tử vong (2,13 trên 100 người-năm) cao hơn một cách có ý nghĩa thống kê so với những bệnh nhân mắc bệnh nhẹ-trung bình không được điều trị, những người ngáy đơn thuần, bệnh nhân điều trị bằng CPAP và những người tham gia khỏe mạnh. Phân tích đa biến điều chỉnh theo các yếu tố gây nhiễu tiềm ẩn cho thấy OSAmức độ nặng không được điều trị làm tăng đáng kể nguy cơbiến cố tim mạch tử vong (OR = 2,87, KTC 95%: 1,17–7,51) và không gây tử vong (OR = 3,17, KTC 95%: 1,12–7·51) so với những người tham gia khỏe mạnh22 (Hình 16).
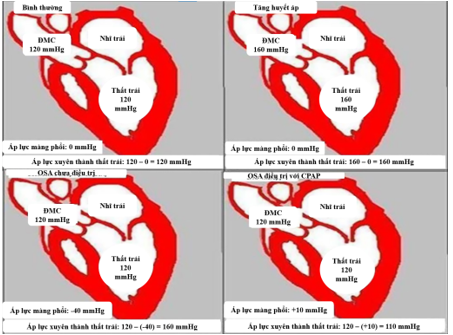
Hình 15. Cơ chế giảm áp lực xuyên thành thất trái của liệu pháp CPAP ở bệnh nhân OSA
(Nguồn: Peker Y et al, Anatol J Cardiol, 2023) 21
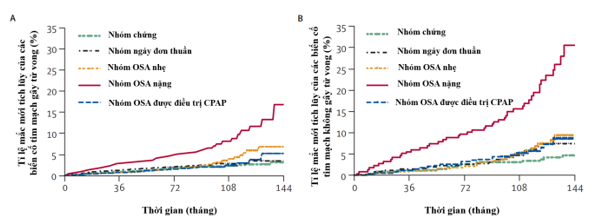
Hình 16. Biến cố tim mạch tử vong và không tử vong tích lũy của các nhóm bệnh nhân OSA
(Nguồn: Jose M Marin et al, Lancet, 2005) 22
Đối với những bệnh nhân trải qua can thiệp mạch vành (CTMV) qua da, điều trị OSA cũng cho thấy mang lại lợi ích bảo vệ lâu dài. Điều này được chứng minh qua nghiên cứu đoàn hệ hồi cứu củaAndrew Cassar và cộng sự với một nhóm bệnh nhân mắc OSA được chẩn đoán bằng phương pháp đa ký giấc ngủ từ năm 1992 đến năm 2004 (AHI>= 15)23.Sau đó, có 371 ngườiphải thực hiện CTMV qua da, được phân loại theo liệu họ có được điều trị OSA (n = 175) hay không điều trị (n = 196). Các kết cục chính là tử vong do tim, tử vong chung, các biến cố tim mạch nặng (đau thắt ngực nặng, nhồi máu cơ tim, CTMV qua da, mổ bắc cầu động mạch vành hoặc tử vong) và các biến cố tim mạch hoặc mạch máu não nặng23. Kết quả ghi nhận được nhóm bệnh nhân được điều trị OSA có số ca tử vong do tim (3%; KTC 95%: 0% – 6%)thấp hơn đáng kể khi so sánh với bệnh nhân OSA không được điều trị (10%; KTC 95%: 5% – 14%) sau 5 năm theo dõi với p = 0,02723 (Hình 17).
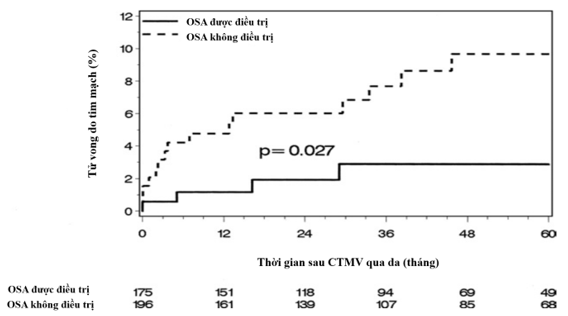
Hình 17. Kết cục tử vong do tim mạch giữa hai nhóm bệnh nhân có và không điều trị OSA
(Nguồn: Andrew Cassar et al, JACC, 2007) 23
IV. KẾT LUẬN
OSA là một vấn đề phổ biến ở bệnh nhân tim mạch nói chung và bệnh nhân có hội chứng động mạch vành mạn nói riêng. Đây là một yếu tố nguy cơ đã được chứng minh làm gia tăng các biến cố tim mạch nhưng hiện nay chưa được quan tâm đúng mức mặc dù đây là yếu tố có thể điều chỉnh được. Điều trị OSA một cách toàn diện tùy theo mức độ bệnh và có sự phối hợp đa chuyên khoa là điều cần thiết giúp cải thiện các kết cục tim mạch một cách ngoạn mục, giúp giảm các biến cố tim mạch và tỉ lệ tử vong.
TÀI LIỆU THAM KHẢO
- Lévy P, Kohler M, McNicholas WT, et al. Obstructive sleep apnoea syndrome. Nature Reviews Disease Primers. 2015/06/25 2015;1(1):15015. doi:10.1038/nrdp.2015.15
- Young T, Peppard PE, Gottlieb DJ. Epidemiology of obstructive sleep apnea: a population health perspective. Am J Respir Crit Care Med. May 1 2002;165(9):1217-39. doi:10.1164/rccm.2109080
- Peppard PE, Young T, Barnet JH, Palta M, Hagen EW, Hla KM. Increased prevalence of sleep-disordered breathing in adults. Am J Epidemiol. May 1 2013;177(9):1006-14. doi:10.1093/aje/kws342
- Punjabi NM. The epidemiology of adult obstructive sleep apnea. Proc Am Thorac Soc. Feb 15 2008;5(2):136-43. doi:10.1513/pats.200709-155MG
- McNicholas WT, Bonsigore MR. Sleep apnoea as an independent risk factor for cardiovascular disease: current evidence, basic mechanisms and research priorities. Eur Respir J. Jan 2007;29(1):156-78. doi:10.1183/09031936.00027406
- Pedrosa RP, Drager LF, Gonzaga CC, et al. Obstructive sleep apnea: the most common secondary cause of hypertension associated with resistant hypertension. Hypertension. Nov 2011;58(5):811-7. doi:10.1161/hypertensionaha.111.179788
- Portaluppi F, Provini F, Cortelli P, et al. Undiagnosed sleep-disordered breathing among male nondippers with essential hypertension. J Hypertens. Nov 1997;15(11):1227-33. doi:10.1097/00004872-199715110-00006
- Wali SO, Alsharif MA, Albanji MH, et al. Prevalence of obstructive sleep apnea among patients with coronary artery disease in Saudi Arabia. J Saudi Heart Assoc. Oct 2015;27(4):227-33. doi:10.1016/j.jsha.2015.03.004
- Kuna ST, Badr MS, Kimoff RJ, et al. An official ATS/AASM/ACCP/ERS workshop report: Research priorities in ambulatory management of adults with obstructive sleep apnea. Proc Am Thorac Soc. Mar 2011;8(1):1-16. doi:10.1513/pats.2009-042WS
- Sateia MJ. International classification of sleep disorders-third edition: highlights and modifications. Chest. Nov 2014;146(5):1387-1394. doi:10.1378/chest.14-0970
- Epstein LJ, Kristo D, Strollo PJ, Jr., et al. Clinical guideline for the evaluation, management and long-term care of obstructive sleep apnea in adults. J Clin Sleep Med. Jun 15 2009;5(3):263-76.
- Zychowski KE, Sanchez B, Pedrosa RP, et al. Serum from obstructive sleep apnea patients induces inflammatory responses in coronary artery endothelial cells. Atherosclerosis. Nov 2016;254:59-66. doi:10.1016/j.atherosclerosis.2016.09.017
- Basoglu OK, Tasbakan MS, Kayikcioglu M. Could non-HDL-cholesterol be a better marker of atherogenic dyslipidemia in obstructive sleep apnea? Sleep Med. Dec 2021;88:29-35. doi:10.1016/j.sleep.2021.09.021
- Luyster FS, Kip KE, Aiyer AN, Reis SE, Strollo PJ, Jr. Relation of obstructive sleep apnea to coronary artery calcium in non-obese versus obese men and women aged 45-75 years. Am J Cardiol. Dec 1 2014;114(11):1690-4. doi:10.1016/j.amjcard.2014.08.040
- Peixoto de Miranda É JF, Mazzotti DR, Santos RB, et al. Incident Coronary Calcium Score in Patients With OSA With and Without Excessive Sleepiness: Brazilian Longitudinal Study of Adult Health. Chest. Jan 2024;165(1):202-212. doi:10.1016/j.chest.2023.06.025
- Tan A, Hau W, Ho HH, et al. OSA and coronary plaque characteristics. Chest. Feb 2014;145(2):322-330. doi:10.1378/chest.13-1163
- Peker Y, Carlson J, Hedner J. Increased incidence of coronary artery disease in sleep apnoea: a long-term follow-up. European Respiratory Journal. 2006;28(3):596-602. doi:10.1183/09031936.06.00107805
- Tan JWC, Leow LC, Wong S, et al. Asian Pacific Society of Cardiology Consensus Statements on the Diagnosis and Management of Obstructive Sleep Apnoea in Patients with Cardiovascular Disease. Eur Cardiol. Feb 2022;17:e16. doi:10.15420/ecr.2021.59
- Milleron O, Pillière R, Foucher A, et al. Benefits of obstructive sleep apnoea treatment in coronary artery disease: a long-term follow-up study. European Heart Journal. 2004;25(9):728-734. doi:10.1016/j.ehj.2004.02.008
- Doherty LS, Kiely JL, Swan V, McNicholas WT. Long-term effects of nasal continuous positive airway pressure therapy on cardiovascular outcomes in sleep apnea syndrome. Chest. Jun 2005;127(6):2076-84. doi:10.1378/chest.127.6.2076
- Peker Y, Akdeniz B, Altay S, et al. Obstructive Sleep Apnea and Cardiovascular Disease: Where Do We Stand? Anatol J Cardiol. 2023;27(7):375-389. doi:10.14744/AnatolJCardiol.2023.3307
- Marin JM, Carrizo SJ, Vicente E, Agusti AG. Long-term cardiovascular outcomes in men with obstructive sleep apnoea-hypopnoea with or without treatment with continuous positive airway pressure: an observational study. Lancet. Mar 19-25 2005;365(9464):1046-53. doi:10.1016/s0140-6736(05)71141-7
- Cassar A, Morgenthaler TI, Lennon RJ, Rihal CS, Lerman A. Treatment of Obstructive Sleep Apnea Is Associated With Decreased Cardiac Death After Percutaneous Coronary Intervention. Journal of the American College of Cardiology. 2007/10/02/ 2007;50(14):1310-1314. doi:https://doi.org/10.1016/j.jacc.2007.06.028







