“Design, recruitment and baseline characteristics of the EMPA-KIDNEY trial”, Nephrol Dial Transplant. 2022; 37:1317-1329 doi: 10.1093/ndt/gfac040
Lược dịch và hiệu đính: ThS.BS. MAI TRỌNG TRÍ
Bệnh viện Nhân dân 115
LƯỢC ĐỒ TÓM TẮT
TÓM TẮT
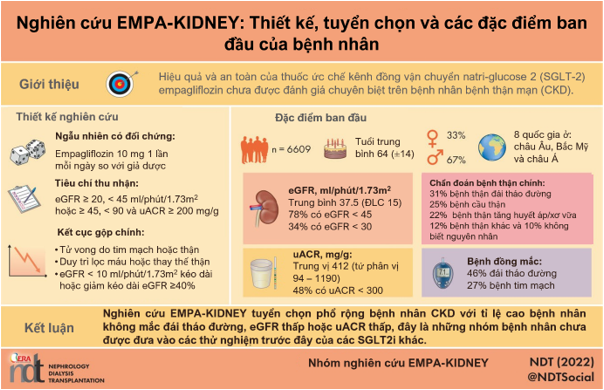
Giới thiệu. Hiệu quả của thuốc ức chế kênh đồng vận chuyển natri-glucose 2 (SGLT-2) empagliflozin trên bệnh thận và bệnh tim mạch chưa được đánh giá chuyên biệt ở nhóm bệnh nhân bệnh thận mạn (CKD).
Phương pháp. Nghiên cứu EMPA-KIDNEY là một nghiên cứu ngẫu nhiên, mù đôi có nhóm chứng được triển khai trên toàn cầu nhằm đánh giá việc dùng hàng ngày empagliflozin 10 mg trên giảm nguy cơ tiến triển bệnh thận hoặc tử vong tim mạch ở bệnh nhân CKD. Bệnh nhân có hoặc không có đái tháo đường (ĐTĐ) được thu nhận nếu có độ lọc cầu thận ước tính (eGFR) ≥20 nhưng <45 mL/phút/1,73 m2 hoặc eGFR ≥45 nhưng <90 mL/phút/1,73 m2 kèm tỉ số albumin:creatinine (uACR) ≥200 mg/g. Thiết kế nghiên cứu được tinh gọn, với việc phối hợp giữa các địa điểm nghiên cứu giữ ở mức tối thiểu và chỉ những thông tin quan trọng mới được thu thập.
Kết quả. Từ 15/05/2019 đến 16/04/2021, 6609 người bệnh từ tám quốc gia ở Châu Âu, Bắc Mỹ và Đông Á được đưa vào phân ngẫu nhiên. Tuổi trung bình trong nghiên cứu là 63,8 [độ lệch chuẩn (SD) 13,9)]; 2192 (33%) là nữ và 3570 (54%) không có tiền căn ĐTĐ. Trung bình eGFR là 37,5 mL/phút/1,73 m2 (SD 14,8), gồm 5185 (78%) bệnh nhân có eGFR <45 mL/phút/1,73 m2. Trung vị uACR là 412 mg/g) (tứ phân vị 1 đến tứ phân vị 3 là 94–1190), với uACR <300 mg/g trên 3194 bệnh nhân (48%). Nguyên nhân của bệnh thận gồm bệnh thận đái tháo đường [n = 2057 (31%)], bệnh cầu thận [n = 1669 (25%)], tăng huyết áp/bệnh mạch máu thận [n = 1445 (22%)], khác [n = 808 (12%)] và vô căn [n = 630 (10%)].

Kết luận. EMPA-KIDNEY sẽ giúp đánh giá hiệu quả và tính an toàn của empagliflozin trên một phổ dân số nghiên cứu rộng có bệnh thận mạn có nguy cơ tiến triển bệnh thận.
Từ khóa: bệnh tim mạch, CKD, thử nghiệm lâm sàng, empagliflozin, ức chế kênh đồng vận chuyển sodium-glucose 2
Đăng ký nghiên cứu: Clinicaltrials.gov: NCT03594110; EuDRACT: 2017-002971-24.
GIỚI THIỆU
Bệnh thận mạn (CKD) thường là bệnh diễn tiến, với albumin niệu là yếu tố nguy cơ quan trọng chỉ dấu việc suy giảm nhanh chóng chức năng thận [1]. Làm chậm tiến triển và tránh bệnh thận giai đoạn cuối (BTGĐC, hay còn gọi là suy thận [2]), là mục tiêu rất quan trọng do BTGĐC liên quan đến tăng tử vong, bệnh tật, các biến cố bất lợi ảnh hưởng đến chất lượng sống và gánh nặng chi phí khi điều trị thay thế thận. Thuốc ức chế hệ renin–angiotensin (RAS) giảm tiểu đạm và làm chậm diễn tiến của bệnh thận ở bệnh nhân tiểu đạm [3–5]. Bệnh nhân CKD cũng gia tăng nguy cơ bệnh tim mạch [6, 7], đặc biệt là bệnh tim cấu trúc, suy tim và đột tử [8–10]. Gia tăng nguy cơ bệnh mạch vành cũng xuất hiện trên bệnh nhân CKD [6]. Kiểm soát huyết áp (HA) và lipoprotein cholesterol tỉ trọng thấp (LDL) ở bệnh nhân CKD giảm nguy cơ tim mạch [11, 12], nhưng vẫn còn nguy cơ tồn dư dù đã can thiệp. Vì vậy cần có các phương pháp điều trị mới có thể thêm vào các điều trị hiện tại một cách an toàn đồng thời làm chậm diễn tiến đến BTGĐC và giảm được nguy cơ tim mạch trên nhóm bệnh nhân CKD.
Ức chế kênh đồng vận chuyển natri-glucose 2 (SGLT-2) thải glucose niệu và làm tăng thải natri, giúp giảm cân và HA cũng như haemoglobin glycate hóa (HbA1c) [13]. Nghiên cứu EMPA-REG OUTCOME trên empagliflozin là nghiên cứu có nhóm chứng lớn đầu tiên đánh giá kết cục tim mạch được báo cáo ở nhóm ức chế SGLT-2 trên bệnh nhân ĐTĐ típ 2 (ĐTĐ) [14]. Kết quả cho thấy empagliflozin không những giảm nguy cơ bệnh tim mạch xơ vữa mà còn giảm nguy cơ nhập viện vì suy tim cũng như tiến triển hay xấu hơn bệnh thận [15]. Sau đó, một số nghiên cứu có nhóm chứng đánh giá kết cục tim mạch của việc sử dụng các ức chế SGLT-2 khác cũng báo cáo lợi ích tương tự [14, 16, 17]. Các nghiên cứu của nhóm ức chế SGLT-2 trên bệnh nhân suy tim hoặc bệnh thận mạn cũng cho thấy giảm được nguy cơ tương đối biến cố về suy tim hoặc thận tương tự nhau ở bệnh nhân có và không có ĐTĐ [18–22].
Các nghiên cứu có nhóm chứng như CREDENCE và DAPA-CKD chuyên biệt trên nhóm bệnh nhân CKD đều được ngưng sớm vì lợi ích rõ ràng theo khuyến cáo của các ủy ban giám sát dữ liệu [18, 23, 24]. Nghiên cứu CREDENCE cho thấy canagliflozin 100 mg giảm nguy cơ tiến triển bệnh thận hoặc tử vong tim mạch ở nhóm dân số nghiên cứu gồm 4401 người bệnh trưởng thành mắc ĐTĐ típ 2 và bệnh thận ĐTĐ có đạm niệu [tiêu chuẩn thu nhận về thận: độ lọc cầu thận ước tính (eGFR) ≥30 nhưng <90 mL/phút/1,73 m2 và tỉ số albumin:creatinine (uACR) >300 nhưng ≤5000 mg/g khi thêm vào liều dung nạp tối đa ức chế hệ RAS] [23]. Nghiên cứu DAPA-CKD cho thấy dapagliflozin 10 mg giảm nguy cơ bệnh thận tiến triển hoặc tử vong tim mạch trên nhóm dân số gồm 4304 bệnh nhân trưởng thành có eGFR ≥ 25 nhưng ≤75 mL/phút/1,73 m2 và uACR ≥200 nhưng ≤5000 mg/g có hoặc không có ĐTĐ típ 2 (98% đang dùng ức chế RAS) [18, 24]. Phân tích dưới nhóm từ nghiên cứu DAPA-CKD cho thấy lợi ích trên thận cũng mở rộng ở nhóm CKD có tiểu đạm không ĐTĐ, gồm viêm cầu thận không dùng ức chế miễn dịch [25–27]. Cần đánh giá thêm về tác dụng của ức chế SGLT-2 ở bệnh nhân CKD vì nghiên cứu DAPA-CKD chỉ cung cấp giới hạn các thông tin về hiệu quả trên nhóm bệnh nhân không có ĐTĐ [25], và loại trừ một số nguyên nhân gây bệnh thận cũng như những bệnh nhân có albumin niệu thấp (chiếm phần lớn trong tổng số người CKD) [18, 23, 24].
Thiết kế nghiên cứu EMPA-KIDNEY được hoàn tất năm 2018, trước khi kết quả của CREDENCE và DAPA-CKD công bố. Mục đích chính là đánh giá hiệu quả của empagliflozin trên tiến triển bệnh thận trên một phổ rộng bệnh nhân CKD có nguy cơ diễn tiến thành BTGĐC, gồm cả bệnh nhân có và không có ĐTĐ và có và không có albumin niệu. Cơ sở của việc đánh giá empagliflozin trên phổ rộng bệnh nhân với nguy cơ tiến triển CKD dựa trên kết quả từ EMPA-REG OUTCOME [15] và các dữ liệu từ một số nghiên cứu lâm sàng và thử nghiệm khác đã cho thấy ức chế SGLT-2 tăng thải glucose niệu, giảm huyết áp và tiểu đạm [28–30]. Quan sát cho thấy có sự giảm tức thời eGFR khi mới dùng ức chế SGLT-2, là kết quả của sự điều chỉnh cơ chế phản hồi ống cầu thận thông qua việc giảm tái hấp thu natri ở ống lượn gần gây ra co tiểu động mạch đến cầu thận [15, 31]. Điều này có thể làm giảm các tổn thương gây ra bởi việc tăng áp lực lọc ở cầu thận gây nên tình trạng siêu lọc trên bệnh nhân ĐTĐ, béo phì hoặc có số lượng nephron thấp (ví dụ như người có eGFR thấp) [32–34]. Dữ liệu từ EMPA-REG OUTCOME cũng đề ra giả thiết— điều mới được chứng minh bởi các nghiên cứu EMPEROR [20, 21]— rằng empagliflozin có tiềm năng ngăn ngừa hoặc điều trị một số loại bệnh tim mạch có sẵn ở người CKD [8, 9, 14, 15, 35]. Các thông tin khác về cơ sở của nghiên cứu EMPA-KIDNEY được mô tả chi tiết trong một bài báo khác [13]. Việc tạo dựng các bằng chứng rõ ràng về tính hiệu quả và an toàn trên toàn bộ bệnh nhân CKD có hay không có ĐTĐ có tầm quan trọng với sức khỏe cộng đồng vì có đến 50–70% bệnh nhân CKD không có ĐTĐ trên toàn thế giới [36, 37]. Trong bài báo này, chúng tôi mô tả thiết kế, quy trình tuyển bệnh và đặc điểm ban đầu của nghiên cứu EMPA-KIDNEY trong bối cảnh những dữ liệu đã công bố của các nghiên cứu khác. [18, 23–25].
PHƯƠNG PHÁP NGHIÊN CỨU
Mục tiêu
Nghiên cứu EMPA-KIDNEY nhằm phân ngẫu nhiên ∼6000 người có tiền căn CKD dùng empagliflozin 10 mg mỗi ngày so với nhóm chứng nhằm đánh giá hiệu quả của empagliflozin đến thời gian xuất hiện kết cục gộp chính gồm tiến triển bệnh thận hoặc tử vong tim mạch (Hình 1). Tiến triển bệnh thận được định nghĩa gồm BTGĐC, tử vong do thận, sự suy giảm eGFR <10 mL/phút/1,73 m2 kéo dài hoặc giảm kéo dài ≥40% eGFR từ lúc phân ngẫu nhiên. Các kết cục phụ quan trọng là đánh giá hiệu quả của empagliflozin lên thời gian đến nhập viện vì suy tim hoặc tử vong tim mạch, nhập viện vì bất kỳ nguyên nhân gì và tử vong do mọi nguyên nhân. Những đánh giá khác được phân tích gồm tính an toàn và các kết quả sinh hóa.
Thiết kế EMPA-KIDNEY được tinh gọn, với việc phối hợp giữa các địa điểm nghiên cứu giữ ở mức tối thiểu và chỉ những thông tin quan trọng mới được thu thập. Nghiên cứu tập trung vào các kết quả lâm sàng quan trọng, dễ nhận biết với việc thu thập dữ liệu chủ yếu dựa vào thông tin được báo cáo bởi người tham gia nghiên cứu được ghi lại khi phỏng vấn trực tiếp trên nền tảng web thiết kế riêng và creatinine huyết thanh được đo tập trung tại một trung tâm.
Tuyển lựa
Người lớn ≥18 tuổi đủ điều kiện tham gia nghiên cứu, được nghiên cứu viên tại nơi nghiên cứu đánh giá không cần hoặc không phù hợp sử dụng ức chế SGLT-2 . Đối tượng tham gia cần có CKD và nguy cơ bệnh tiến triển. Tiêu chí này được thực hiện tại phòng xét nghiệm địa phương ở hai thời điểm ít nhất 3 tháng trước nghiên cứu và ngay lúc tầm soát có eGFR ≥20 nhưng <45 mL/ph/1,73 m2 hoặc eGFR ≥45 nhưng <90 mL/phút/1,73 m2 với uACR ≥200 mg/g. eGFR trong nghiên cứu được ước tính dựa trên creatinine theo công thức Chronic Kidney Disease Epidemiology Collaboration [39]. Người tham gia nghiên cứu cũng được điều trị với một thuốc ức chế hệ RAS với liều phù hợp, trừ khi không dung nạp hoặc không có chỉ định. Hình 2 cung cấp các tiêu chí thu nhận loại trừ của nghiên cứu. Đề cương nghiên cứu ban đầu loại trừ người tham gia đang dùng ức chế miễn dịch hoặc >10 mg prednisolone. Đề cương nghiên cứu phiên bản 2.0 đã bỏ tiêu chí loại trừ này trừ khi người tham gia đang dùng prednisolone >45mg hoặc dùng ức chế miễn dịch tiêm tĩnh mạch trong vòng 3 tháng trước nghiên cứu. Theo yêu cầu từ nhà tài trợ, đề cương nghiên cứu phiên bản 2.0 loại trừ các bệnh nhân ĐTĐ típ 1 (không có lo ngại về tính an toàn được báo cáo bởi ủy ban giám sát dữ liệu)
| Kết cục chính
Lần đầu xuất hiện một trong số các biến cố: (i) Tiến triển bệnh thận (được định nghĩa là BTGĐC *, suy giảm kéo dài† eGFR <10 mL/phút/1,73 m2, tử vong do thận, giảm kéo dài† ≥40% eGFR từ lúc phân ngẫu nhiên); hoặc (ii) Tử vong tim mạch
Các kết cục phụ quan trọng‡ 1. Lần đầu nhập viện vì suy tim hoặc tử vong tim mạch 2. Nhập viện vì nguyên nhân bất kỳ (lần đâu hoặc tái nhập viện) 3. Tử vong do mọi nguyên nhân |
*BTGĐC= bệnh thận giai đoạn cuối, và gồm khởi trị của chạy thận lâu dài hoặc được ghép thận; eGFR= độ lọc cầu thận ước tính, với creatinine được đo từ phòng xét nghiệm trung tâm khi có thể.
† Thuật ngữ ‘kéo dài’ được dùng khi:
(a) Được đo 2 lần liên tiếp ở những lần khám chính thức liên tiếp (cách nhau ít nhất 30 ngày); hoặc
(b) Được đo ở lần theo dõi định kỳ cuối cùng hoặc lần thăm khám chính thức cuối cùng trước tử vong (hoặc rút khỏi nghiên cứu hoặc mất dấu).
‡ Các kết cục phụ khác gồm: kết cục riêng rẽ từng thành phần trong kết cục chính, gộp của tử vong tim mạch và BTGĐC. Chi tiết về kế hoạch phân tích của các kết cục lâm sàng và xét nghiệm được cung cấp trong Kế Hoạch Phân Tích Dữ Liệu (xem phần phụ lục).
HÌNH 1: Các kết cục quan trọng của EMPA-KIDNEY
Sàng lọc, chạy thử, phân ngẫu nhiên và theo dõi
Ở thời điểm sàng lọc, các thông tin về bệnh sử, thuốc đang dùng, huyết áp, kết quả xét nghiệm và các thông tin quan trọng khác được thu thập và nhập trực tiếp trên hệ thống của nghiên cứu. Các đối tượng phù hợp tham gia nghiên cứu sau đó được sử dụng giả dược một lần/ngày trong 15 tuần và được phân ngẫu nhiên trong khoảng thời gian từ tuần 8-12. Mục tiêu của giai đoạn chạy thử trước nghiên cứu nhằm xác định những đối tượng có khả năng không tuân thủ đề cương nghiên cứu và theo dõi. Cũng trong giai đoạn này, nghiên cứu viên đánh giá xem bệnh nhân có cần thuốc ức chế SGLT-2 không cũng như cho liều ức chế RAS phù hợp (theo chăm sóc chuẩn). Nghiên cứu viên cũng toàn quyền quyết định khi nào bệnh nhân cần lọc thận cũng như các điều trị phù hợp khác để quản lý các nguy cơ tim mạch, bệnh thận tiến triển theo hướng dẫn khuyến cáo hiện hành.
Người tham gia được phân ngẫu nhiên vào tuần 8-12 ở giai đoạn chạy thử sau khi đảm bảo không có bất kì biến cố bất lợi nghiêm trọng hay bất thường nào xảy ra trong giai đoạn này cũng như đồng thuận theo nghiên cứu ít nhất 3 năm. Các thông tin quan trọng được thu thập gồm tiền căn nhiễm khuẩn huyết từ đường niệu, suy tim, bệnh thần kinh ngoại biên, loét bàn chân, nhiễm trùng hoặc hoại tử chi, tiền căn hút thuốc và uống rượu, chất lượng cuộc sống bằng bảng EQ5D-5L, huyết áp, cân nặng, chiều cao, vòng eo, vòng hông, các xét nghiệm creatinine, kali, chức năng gan, haemoglobin/haematocrit, N-terminal pro-B-type natriuretic peptide và uACR.
Các thăm khám được xếp lịch ở tháng thứ 2, thứ 6 và mỗi 6 tháng sau đó cho đến khi kết thúc nghiên cứu. Ở mỗi lần thăm khám, các thông tin quan trọng gồm bất kỳ phương pháp điều trị thay thế thận, các biến cố bất lợi nghiêm trọng như nhiễm trùng tiểu, nhiễm trùng sinh dục, tăng kali, tổn thương thận cấp và mất nước được ghi nhận cùng một số thông tin được quan tâm khác. Bảng câu hỏi về chất lượng cuộc sống EQ5D-5L được thực hiện vào tháng thứ 18 và ở lần khám theo dõi cuối cùng.
| Tiêu chí thu nhận
1. ≥ 18 tuổi 2. Có bằng chứng bệnh thận tiến triển hoặc nguy cơ bệnh thận tiến triển được xác định bởi xét nghiệm tại chỗ trong ít nhất 3 tháng trước và tại thời điểm tầm soát: (a) CKD-EPI eGFR ≥ 20 và < 45 mL/phút/1,73 m2; hoặc (b) CKD-EPI eGFR ≥ 45 và < 90 mL/phút/1,73 m2 với uACR ≥ 200 mg/g (hoặc tỉ số protein/creatinine ≥ 300 mg/g) 3. Nghiên cứu viên tại chỗ đánh giá đối tượng nghiên cứu không cần hoặc không phù hợp dùng empagliflozin (hoặc bất kỳ thuốc ức chế SGLT-2 hoặc SGLT-1/2 nào) 4. Dùng ức chế hệ RAS với liều thích hợp trừ khi không có chỉ định dùng hoặc không dung nạp |
| Tiêu chí loại trừ
Khi có bất kỳ một trong số các tiêu chí sau: (i) Đang dùng ức chế SGLT-2 hoặc SGLT-1/2 (ii) Đái tháo đường típ 2 có tiền căn bệnh tim mạch xơ vữa+ với eGFR > 60 mL/phút/1,73 m2 tại thời điểm sàng lọc (iii) Dùng kết hợp ACEI và ARB‡ (iv) Chạy thận kéo dài, ghép thận hoặc có kế hoạch ghép thận (v) Bệnh thận đa nang (vi) Tiền căn hoặc có kế hoạch phẫu thuật giảm béo (vii) Nhiễm ceton trong 5 năm trước đây (viii)Triệu chứng hạ áp*, hoặc huyết áp tâm thu < 90 hay > 180 mmHg ở thời điểm sàng lọc (ix) ALT hoặc AST > 3 lần giới hạn trên lúc sàng lọc (x) Dị ứng empagliflozin hoặc các thuốc ức chế SGLT-2 khác (xi) Dùng ức chế miễn dịch tiêm tĩnh mạch trong 3 tháng hoặc dùng liều tương đương > 45 mg* (xii) Dùng thuốc nghiên cứu trong 30 ngày trước thời điểm sàng lọc (xiii)Tiền sử kém tuân trị với tái khám hoặc dùng thuốc (xiv) Tiền sử y khoa gợi ý khả năng bệnh nhân không thể theo đến hết nghiên cứu (như bệnh phổi nặng, ung thư trừ ung thư da không phải u sắc tố, mới nghiện rượu hoặc thuốc kích thích) (xv) Đang mang thai, cho con bú hoặc có khả năng sinh con (ngoại trừ ngừa thai hiệu quả cao) (xvi) Đái tháo đường típ 1 (từ đề cương phiên bản 2.0)
Các đối tượng cũng sẽ bị loại trừ nếu: (i) Không tuân thủ trong quá trình chạy thử (ii) Không đồng ý phân ngẫu nhiên và theo dõi trong 3 năm (iii) Nghiên cứu viên tại chỗ đánh giá không phù hợp phân ngẫu nhiên (iv) Nhiễm ceton, nhồi máu cơ tim, đột quỵ, nhập viện vì suy tim hoặc nhiễm trùng tiểu hoặc có tổn thương thận cấp trong thời gian chạy thử. |
*Theo khai báo của người tham gia nghiên cứu ở lần khám sàng lọc và phân ngẫu nhiên
+Nhồi máu cơ tim, đau thắt ngực, đột quỵ, bệnh động mạch ngoại biên (hoặc đoạn chi dưới)
‡Hoặc ức chế renin phối hợp với ACEI hay ARB.
HÌNH 2: Tiêu chí thu nhận hoặc loại trừ chính của nghiên cứu
Phân tích thống kê và kết cục
EMPA-KIDNEY là nghiên cứu dựa trên số lượng biến cố và dự định kéo dài đến khi có 1070 đối tượng tham gia có kết cục chính. Kết quả này cung cấp độ mạnh thống kê 90% với giá trị p hai đuôi 0,05 để cho thấy sự khác biệt về giảm nguy cơ tương đối 18% ở kết cục chính. Thuật ngữ “kéo dài” được định nghĩa gồm 2 lần liên tiếp giảm eGFR hoặc đo ở lần thăm khám cuối hoặc đo lần cuối trước tử vong (hoặc rút khỏi nghiên cứu). BTGĐC được định nghĩa gồm được ghép thận, khởi đầu của chạy thận định kỳ (kéo dài hơn 90 ngày).
KẾT QUẢ
Đặc điểm dân số được phân ngẫu nhiên
Trong số 6609 bệnh nhân được phân ngẫu nhiên, 2648 (40%) từ châu Âu, 1717 (26%) từ Bắc Mỹ, 1632 (25%) từ Trung Quốc và Malaysia và 612 (9%) từ Nhật (Bảng 1 và Phụ lục, Bảng S4). Các đặc điểm về chủng tộc, tuổi và giới được trình bày tại Bảng 1. Có 3039 (46%) bệnh nhân có ĐTĐ gồm 69 người bệnh ĐTĐ típ 1 (những bệnh nhân đái tháo đường típ 1 không được thu nhận nữa từ Đề cương phiên bản 2.0 theo yêu cầu từ nhà tài trợ, không phải từ yêu cầu của Hội Đồng Điều Hành nghiên cứu). Bệnh nhân ĐTĐ có tuổi trung bình lớn hơn người không ĐTĐ (68,6 so với 59,8 tuổi) và thường bị bệnh tim mạch hơn [1104/3039 (36%) so với 661/3570 (19%)] (Bảng 1).
eGFR trung bình ở thời điểm phân ngẫu nhiên là 37,5 mL/phút/1,73 m2 (ĐLC 14,8), thấp hơn một chút ở bệnh nhân ĐTĐ so với người không ĐTĐ [36,0 (13,9) so với 38.7 (15,4) mL/phút/1,73 m2].
Trung vị uACR là 412 mg/g [Q1–Q3 94–1190], với khoảng một nửa [3194/6609 (48%)] có uACR <300 mg/g. Trung vị uACR là 586 mg/g (Q1–Q3 256–1272) với người có eGFR ≥45 mL/phút/1,73 m2 và 354 (69–1154) với người có eGFR <45. uACR thấp hơn một chút ở người ĐTĐ so với người không ĐTĐ [348 mg/g (Q1–Q3 68–1293) so với 461 (128–1117)].
Ở người ĐTĐ, ∼85% dùng ức chế hệ RAS ở thời điểm mới bắt đầu nghiên cứu bất kể mức đạm niệu. Trong số những người không ĐTĐ, 89% có uACR ≥200 mg/g được dùng ức chế RAS, so với 78% uACR <200 mg/g. Các nguyên nhân không dùng ức chế RAS lúc khởi đầu nghiên cứu (n = 996) bao gồm không chỉ định (nguyên do protein niệu quá thấp) trong 239 (24%), không dung nạp trong 277 (28%), nguyên nhân khác 296 (30%) và không biết nguyên nhân 184 (18%). Bảng S5 và S6 phần phụ lục cung cấp chi tiết về các thuốc dùng khác ở thời điểm phân ngẫu nhiên theo tình trạng đái tháo đường và khu vực.
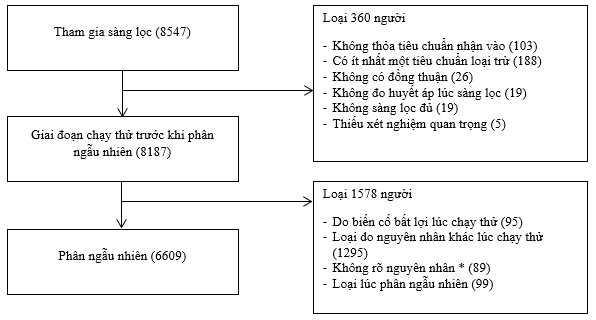
* không được ghi nhận là rút khỏi giai đoạn chạy thử và không tham gia lần khám phân ngẫu nhiên
HÌNH 3: Lưu đồ quá trình thu tuyển nghiên cứu EMPA-KIDNEY.
Bảng 1. Đặc điểm chung dân số nghiên cứu phân loại theo tình trạng đái tháo đường
| ĐTĐ | |||
| Đặc điểm | Chung
(N=6609) |
Có
(n=3039) |
Không
(n=3570) |
| Tuổi (năm) | |||
| Trung bình (ĐLC) | 63.8 (13.9) | 68.6 (9.9) | 59.8 (15.4) |
| <60 | 2252(34) | 545(18) | 1707(48) |
| ≥60 – <70 | 1720(26) | 969(32) | 751(21) |
| ≥70 | 2637(40) | 1525(50) | 1112(31) |
| Giới | |||
| Nam | 4417 (67) | 2044 (67) | 2373(66) |
| Nữ | 2192 (33) | 995 (33) | 1197 (34) |
| Khu vực | |||
| Châu Âu (Anh, Đức, Ý) | 2648 (40) | 1050 (35) | 1598 (45) |
| Bắc Mỹ (Mỹ, Canada) | 1717 (26) | 1066 (35) | 651 (18) |
| Trung Quốc, Malaysia | 1632 (25) | 632 (21) | 1000 (28) |
| Nhật Bản | 612(9) | 291 (10) | 321 (9) |
| Chủng tộc (tất cả khu vực) | |||
| Da trắng | 3859 (58) | 1809 (60) | 2050 (57) |
| Da đen | 262 (4) | 173 (6) | 89 (2) |
| Châu Á | 2393 (36) | 1008 (33) | 1385 (39) |
| Đa chủng tộc | 21 (<1) | 10 (<1) | 11 (<1) |
| Khác | 74 (1) | 39 (1) | 35 (1) |
| Tiền căn | |||
| ĐTĐ | |||
| Có | 3039 (46) | 3039 (100) | |
| Không | 3570 (54) | 3570 (100) | |
| Bệnh tim mạcha | |||
| Có | 1765 (27) | 1104 (36) | 661 (19) |
| Không | 4844 (73) | 1935 (64) | 2909 (81) |
| Suy tim | |||
| Có | 658 (10) | 431 (14) | 227 (6) |
| Không hoặc thiếu dữ liệu | 5951 (90) | 2608 (86) | 3343 (94) |
| Bệnh động mạch ngoại biên | |||
| Có | 470 (7) | 318 (10) | 152 (4) |
| Không | 6139 (93) | 2721 (90) | 3418 (96) |
| Khám lâm sàng | |||
| HA tâm thu (mmHg) | |||
| Trung bình (ĐLC) | 136.5 (18.3) | 139.2 (18.8) | 134.3 (17.5) |
| <130 | 2398 (36) | 960 (32) | 1438 (40) |
| ≥130–<145 | 2189 (33) | 958 (32) | 1231 (34) |
| ≥145 | 2022 (31) | 1121 (37) | 901 (25) |
| HA tâm trương (mmHg) | |||
| Trung bình (ĐLC) | 78.1 (11.8) | 75.5 (11.4) | 80.2 (11.7) |
| <75 | 2580 (39) | 1471 (48) | 1109 (31) |
| ≥75–<85 | 2052 (31) | 873 (29) | 1179 (33) |
| ≥85 | 1977 (30) | 695 (23) | 1282 (36) |
| Chỉ số khối cơ thể (kg/m2) | |||
| Trung bình (ĐLC) | 29.7 (6.8) | 31.8 (7.1) | 28.0 (5.9) |
| <25 | 1620 (25) | 464 (15) | 1156 (32) |
| ≥25–<30 | 2296 (35) | 929 (31) | 1367 (38) |
| ≥30 | 2677 (41) | 1636 (54) | 1041 (29) |
| Thiếu dữ liệu | 16 (<1) | 10 (<1) | 6 (<1) |
| Cận lâm sàng | |||
| HbA1c (mmol/mol) | |||
| Trung bình (ĐLC) | 45.0 (13.6) | 54.9 (14.3) | 36.6 (4.0) |
| <39 | 2683 (41) | 209 (7) | 2474 (69) |
| ≥39–<48 | 1837 (28) | 805 (26) | 1032 (29) |
| ≥48 | 1978 (30) | 1978 (65) | |
| Thiếu dữ liệu | 111 (2) | 47 (2) | 64 (2) |
| <75 | 2740 (90) | ||
| ≥75 | 252 (8) | ||
Bảng 1. Tiếp theo
| ĐTĐ | |||
| Đặc điểm | Chung
(N=6609) |
Có
(n=3039) |
Không
(n=3570) |
| NT-proBNP (ng/L) | |||
| Trung vị (Tứ phân vị) | 190.3 (93.5–477.7) | 238.3 (106.7–604.0) | 163.3 (83.9–388.9) |
| <110 | 2391 (36) | 899 (30) | 1492 (42) |
| ≥110–<330 | 2061 (31) | 967 (32) | 1094 (31) |
| ≥330 | 1979 (30) | 1119 (37) | 860 (24) |
| Thiếu dữ liệu | 178 (3) | 54 (2) | 124 (3) |
| Haematocrit (%) | |||
| Trung bình (ĐLC) | 39.1 (5.1) | 38.4 (5.1) | 39.7 (5.1) |
| <37% | 1818 (28) | 938 (31) | 880 (25) |
| ≥37–<41% | 1888 (29) | 878 (29) | 1010 (28) |
| ≥41% | 2252 (34) | 843 (28) | 1409 (39) |
| Thiếu dữ liệu | 651 (10) | 380 (13) | 271 (8) |
| eGFR (mL/phút/1,73m2)b | |||
| Trung bình (ĐLC) | 37.5 (14.8) | 36.0 (13.9) | 38.7 (15.4) |
| <30 | 2280 (34) | 1148 (38) | 1132 (32) |
| ≥30–<45 | 2905 (44) | 1359 (45) | 1546 (43) |
| ≥45 | 1424 (22) | 532 (18) | 892 (25) |
| uACR (mg/g)b | |||
| Trung vị (Tứ phân vị) | 412 (94–1190) | 348 (68–1293) | 461 (128–1117) |
| <30 | 1332 (20) | 649 (21) | 683 (19) |
| ≥30–<300 | 1862 (28) | 941 (31) | 921 (26) |
| ≥300 | 3415 (52) | 1449 (48) | 1966 (55) |
| Phân loại nguy cơ KDIGO | |||
| Thấp, trung bình hay cao | 1698 (26) | 730 (24) | 968 (27) |
| Rất cao | 4911 (74) | 2309 (76) | 2602 (73) |
| Sử dụng ức chế RAS | |||
| uACR <200 mg/g | |||
| Không dùng | 510 (19) | 217 (16) | 293 (22) |
| Có dùng | 2214 (81) | 1179 (84) | 1035 (78) |
| uACR ≥200 mg/g | |||
| Không dùng | 486 (13) | 237 (14) | 249 (11) |
| Có dùng | 3399 (87) | 1406 (86) | 1993 (89) |
Giá trị được thể hiện dưới dạng n (%) trừ khi được ghi chú khác
a Được định nghĩa là có tiền căn suy tim. đột quỵ, cơn thoáng thiếu máu não, bệnh động mạch ngoại biên.
b Được đo ở phòng xét nghiệm trung tâm ở thời điểm phân ngẫu nhiên hoặc phòng xét nghiệm địa phương ở thời điểm gần với phân ngẫu nhiên.
Tiền căn đái tháo đường được định nghĩa khi người bệnh báo có tiền căn đái tháo đường bất kỳ loại nào, sử dụng thuốc hạ đường huyết và HbA1c ≥ 48 mmol/mol ở thời điểm phân ngẫu nhiên. NT-proBNP, N-terminal pro B-type natriuretic peptide.
BÀN LUẬN
Nghiên cứu EMPA-KIDNEY đánh giá tính an toàn và hiệu quả của việc thêm empagliflozin 10 mg trên nền chăm sóc tiêu chuẩn ở 6609 người bệnh thận mạn. Sự đơn giản trong tiêu chí chọn bệnh nhằm mục đích tối đa hóa khả năng tuyển lựa được một phổ rộng bệnh nhân bệnh thận mạn có nguy cơ tiến triển. Vào thời điểm tuyển bệnh hơn phân nửa bệnh nhân không có đái tháo đường, khoảng ba phần tư người bệnh có eGFR <45 mL/phút/1,73 m2 và phân nửa người bệnh có albuminuria <300 mg/g. Với phổ rộng người bệnh có CKD được phân ngẫu nhiên trong nghiên cứu EMPA-KIDNEY và do vậy có được những đối tượng thường bị loại trừ trong các nghiên cứu trước đây của các thuốc ức chế SGLT-2 khác [18, 23–25]. Ví dụ, chỉ 31% (2057/6609) đối tượng thạm gia nghiên cứu EMPA-KIDNEY được nghiên cứu viên đánh giá chẩn đoán bệnh thận chính là do đái tháo đường so với 58% (2510/4304) trong DAPA- CKD và tất cả 4401 bệnh nhân tham gia nghiên cứu CREDENCE (Bảng 2). Kết quả nghiên cứu DAPA-CKD ở bệnh thận không ĐTĐ dựa trên 128 kết cục chính ở 1398 bệnh nhân[18]. Trong khi đó một số lượng lớn hơn người bệnh không ĐTĐ ở nghiên cứu EMPA-KIDNEY sẽ cho nhiều hơn nữa thông tin có giá trị về hiệu quả của empagliflozin trên kết cục tim mạch-thận ở những đối tượng này. Chúng tôi dự đoán rằng khoảng 40–50% kết cục chính trong nghiên cứu EMPA- KIDNEY sẽ xuất hiện ở người không ĐTĐ. Đặc biệt, EMPA-KIDNEY có được 1669 người bệnh có bệnh cầu thận trong đó 817 (49%) có bệnh thận IgA và 195 (12%) có xơ hóa cầu thận khu trú (90% được báo cáo kết quả sinh thiết).
EMPA-KIDNEY thu nhận tỉ lệ lớn người bệnh có eGFR thấp — một bất thường phổ biến ở những bệnh nhân đi khám phòng khám thận (chiếm phần lớn các điểm nghiên cứu). Trong số những bệnh nhân ĐTĐ tham gia EMPA-KIDNEY, eGFR trung bình và uACR trung vị ở thời điểm tuyển lựa lần lượt là 36.0 mL/phút/1,73 m2 và 348 mg/g, so với 43.8 mLv2/1,73 m2 và 1016.5 mg/g trong nghiên cứu DAPA- CKD và 56.2 mL/phút/1,73 m2 và 927 mg/g trong CREDENCE (Bảng 2). Do đó EMPA-KIDNEY sẽ giúp đánh giá được lợi ích trên thận của thuốc ức chế SGLT-2 tiếp tục có hiệu quả ở mức chức năng thận giảm thấp theo như ghi nhận từ nghiên cứu CREDENCE và DAPA-CKD [18, 23, 25].
Bảng 2. Đặc điểm về thận và chẩn đoán bệnh thận chính theo nghiên cứu và theo tiền căn đái tháo đường
| Chung | Có ĐTĐ | Không ĐTĐ | |||||
| Đặc điểm | EMPA-KIDNEY | EMPA-KIDNEY | DAPA-CKD | CREDENCE | EMPA-KIDNEY | DAPA-CKD | |
| Số lượng | 6609 | 3039 | 2906 | 4401 | 3570 | 1398 | |
| eGFR (mL/phút/1,73 m2) | |||||||
| Trung bình (độ lệch chuẩn) | 37.5 (14.8) | 36.0 (13.9) | 43.8 (12.6) | 56.2 (18.2) | 38.7 (15.4) | 41.7 (11.7) | |
| uACR (mg/g) | |||||||
| Trung vị (Tứ phân vị) | 412 (94–1190) | 348 (68–1293) | 1017 | 927 (463–1833) | 461 (128–1117) | 861 | |
| Chẩn đoán chính bệnh thận | |||||||
| Bệnh thận đái tháo đường | 2057 (31) | 2057 (68) | 2510 (86) | 4401 (100) | 0 (0) | 0 (0) | |
| Bệnh thận tăng huyết áp | 1445 (22) | 401 (13) | 203 (7) | 1044 (29) | 494 (35) | ||
| Bất kỳ bệnh cầu thận nào | 1669 (25) | 172 (6) | 97 (3) | 1497 (42) | 598 (43) | ||
| Bệnh thận IgA | 817 (12) | 59 (2) | 38 (1) | 758 (21) | 232 (17) | ||
| Xơ hóa cầu thận khu trú từng phần | 195 (3) | 34 (1) | 22 (1) | 161 (5) | 93 (7) | ||
| Bệnh cầu thận màng | 96 (1) | 13 (<1) | 10 (<1) | 83 (2) | 33 (2) | ||
| Sang thương tối thiểu | 14 (<1) | 4 (<1) | 2 (<1) | 10 (<1) | 9 (1) | ||
| Bệnh cầu thận khác | 547 (8) | 62 (2) | 25 (1) | 485 (14) | 231 (17) | ||
| Khác | 808 (12) | 203 (7) | 49 (2) | 605 (17) | 139 (10) | ||
| Ống thận mô kẽ (Bao gồm tắc nghẽn) | 468 (7) | 101 (3) | 30 (1) | 367 (10) | 117 (8) | ||
| Khác | 340 (5) | 102 (3) | 19 (1) | 238 (7) | 22 (2) | ||
| Không rõ | 630 (10) | 206 (7) | 47 (2) | 424 (12) | 167 (12) | ||
| Sinh thiết thận trước đây | 1862 (28) | 354 (12) | 373 (13) | 1508 (42) | 500 (36) | ||
Dữ liệu được trình bày dưới dạng n (%) trừ khi được chú thích khác
Nguồn: CREDENCE: N Engl J Med 2019;380:2295–306; DAPA-CKD: NDT 2020;35:1700–11 and Lancet Diabetes Endocrinol 2021;9:22–31.
Đánh giá liệu tiểu đạm có phải là yếu tố cần thiết để ức chế SGLT-2 có hiệu quả hay không vẫn còn là một câu hỏi quan trọng vì có một phần lớn người bệnh giảm eGFR mà không có albumin niệu [43], trong khi trước đó CREDENCE và DAPA-CKD cung cấp các bằng chứng về tính hiệu quả của nhóm thuốc ở những người có đạm niệu [18, 23, 25]. Nếu các giả thiết về cơ chế rằng các ức chế SGLT-2 làm chậm diễn tiến CKD thông qua giảm áp lực trong cầu thận là đúng [13], thì lợi ích trên thận có thể được dự báo là ít hơn so với những bệnh nhân không có albumin niệu (một chỉ dấu của tăng áp trong cầu thận). Các kết quả từ phân tích gộp các nghiên cứu của thuốc ức chế SGLT-2 ở bệnh nhân ĐTĐ típ 2 gợi ý các lợi ích trên thận có thể mở rộng ở những người không có đạm niệu [44], cũng như các phân tích về mức độ suy giảm eGFR trong các nghiên cứu trên bệnh nhân suy tim [20, 21, 45, 46]. Chúng tôi dự đoán rằng khoảng 20% kết cục chính của EMPA-KIDNEY sẽ xuất hiện ở bệnh nhân có albumin thấp ở thời điểm tuyển bệnh.
Kết cục chính của EMPA-KIDNEY gồm giảm ≥40% eGFR từ lúc ban đầu so với mức độ giảm ≥50% eGFR như trong định nghĩa của DAPA-CKD [18] và gấp đôi creatinine (với mức giảm ≥ 57% eGFR) được áp dụng trong nghiên cứu CREDENCE [23]. Mục đích của EMPA-KIDNEY nhằm tuyển được một tỉ lệ lớn hơn những người bệnh có albumin niệu thấp và không ĐTĐ và những đối tượng này được dự đoán tiến triển bệnh thận sẽ chậm hơn so với những bệnh nhân đái tháo đường có đạm niệu [47]. Việc chọn mức giảm eGFR thấp hơn giúp đảm bảo những bệnh nhân không đái tháo đường và có albumin niệu thấp cũng góp phần cho các kết cục chính quan trọng. Tuy nhiên khi nghiên cứu sử dụng các can thiệp, như các ức chế SGLT-2, có thể làm giảm tức thời eGFR và do đó việc lựa chọn mức độ giảm eGFR ít có thể làm giảm đi độ đặc hiệu của việc đánh giá hiệu quả trên giảm tiến triển bệnh thận về lâu dài [48–51]. Do vậy nghiên cứu EMPA-KIDNEY chuẩn bị trước một số phân tích thăm dò nhằm đánh giá hiệu quả của empagliflozin trên kết cục gộp gồm tiến triển bệnh thận và tử vong tim mạch sử dụng thêm ngưỡng khác của độ giảm eGFR, từ đó có thể tạo sự đồng bộ khi so sánh giữa ba nghiên cứu sau này.
KẾT LUẬN
Nghiên cứu EMPA-KIDNEY sẽ giúp đánh giá hiệu quả trên tim mạch-thận và tính an toàn của empagliflozin ở một phổ rộng người bệnh thận mạn có nguy cơ tiến triển bệnh thận.
TÀI TRỢ
EMPA-KIDNEY được tài trợ bởi Boehringer Ingelheim và Eli Lilly, thông qua quỹ nghiên cứu cho trường đại học Oxford. EMPA-KIDNEY được điều hành bởi Hội Đồng Nghiên Cứu Y Sinh thuộc trường Đại Học Oxford.
TÀI LIỆU THAM KHẢO
- Fox CS, Matsushita K,Woodward M et al. Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without diabetes: a meta-analysis. Lancet 2012; 380: 1662–1673
- Levin A, Agarwal R, Herrington WG et al. International consensus definitions of clinical trial outcomes for kidney failure: 2020. Kidney Int 2020; 98: 849–859
- Jafar TH, Schmid CH, Landa M et al. Angiotensin-converting enzyme inhibitors and progression of nondiabetic renal disease. A meta-analysis of patient-level data. Ann Intern Med 2001; 135: 73–87
- Lewis EJ, Hunsicker LG, Clarke WR et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001; 345: 851–860
- Brenner BM,Cooper ME, de ZeeuwDet al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001; 345: 861–869
- TonelliM,Muntner P, LloydAet al. Risk of coronary events in people with chronic kidney disease compared with those with diabetes: a population level cohort study. Lancet 2012; 380: 807–814
- GoAS, ChertowGM, FanDet al. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med 2004; 351: 1296–1305
- Park M, Hsu CY, Li Y et al. Associations between kidney function and subclinical cardiac abnormalities in CKD. J Am Soc Nephrol 2012; 23: 1725–1734
- Foley RN, Parfrey PS, Kent GM et al. Long-term evolution of cardiomyopathy in dialysis patients. Kidney Int 1998; 54: 1720–1725
- Suzuki T, Agarwal SK, Deo R et al. Kidney function and sudden cardiac death in the community: the Atherosclerosis Risk in Communities (ARIC) study. Am Heart J 2016; 180: 46–53
- Cholesterol Treatment Trialists Collaboration. Impact of renal function on the effects of LDL cholesterol lowering with statin-based regimens: a meta-analysis of individual participant data from 28 randomised trials. Lancet Diabetes Endocrinol 2016; 4: 829–839
- Ninomiya T, Perkovic V, Turnbull F et al. Blood pressure lowering and major cardiovascular events in people with and without chronic kidney disease: meta-analysis of randomised controlled trials. BMJ 2013; 347: f5680
- Herrington WG, Preiss D, Haynes R et al. The potential for improving cardio-renal outcomes by sodium-glucose co-transporter-2 inhibition in people with chronic kidney disease: a rationale for the EMPA-KIDNEY study. Clin Kidney J 2018; 11: 749–761
- Zinman B, Wanner C, Lachin JM et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes.NEngl J Med 2015; 373: 2117– 2128
- Wanner C, Inzucchi SE, Lachin JMet al. Empagliflozin and progression of kidney disease in type 2 diabetes. N Engl J Med 2016; 375: 323–334
- Neal B, Perkovic V, Mahaffey KWet al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med 2017; 377: 644–657
- Wiviott SD, Raz I, Bonaca MP et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2019; 380: 347–357
- Heerspink HJL, Stefansson BV, Correa-Rotter R et al. Dapagliflozin in patients with chronic kidney disease. N Engl J Med 2020; 383: 1436–1446
- McMurray JJV, Solomon SD, Inzucchi SE et al. Dapagliflozin in patientswith heart failure and reduced ejection fraction. N Engl J Med 2019; 381: 1995–2008
- Packer M, Anker SD, Butler J et al. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med 2020; 383: 1413–1424
- Anker SD, Butler J, Filippatos G et al. Empagliflozin in heart failure with a preserved ejection fraction. N Engl J Med 2021; 385: 1451–1461
- Staplin N, Roddick AJ, Emberson J et al. Net effects of sodium-glucose co-transporter-2 inhibition in different patient groups: a meta-analysis of large placebo-controlled randomized trials. EClinicalMedicine 2021; 41: 101163
- Perkovic V, Jardine MJ, Neal B et al. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med 2019; 380: 2295–2306
- Wheeler DC, Stefansson BV, Batiushin M et al. The dapagliflozin and prevention of adverse outcomes in chronic kidney disease (DAPACKD) trial: baseline characteristics. Nephrol Dial Transplant 2020; 35: 1700–1711
- Wheeler DC, Stefansson BV, Jongs N et al. Effects of dapagliflozin on major adverse kidney and cardiovascular events in patients with diabetic and non-diabetic chronic kidney disease: a prespecified analysis from the DAPA-CKD trial. Lancet Diabetes Endocrinol 2021; 9: 22–31
- Wheeler DC, Toto RD, Stefansson BV et al. A pre-specified analysis of the DAPA-CKD trial demonstrates the effects of dapagliflozin on major adverse kidney events in patients with IgA nephropathy. Kidney Int 2021; 100: 215–224
- Wheeler DC, Jongs N, Stefansson BV et al. Safety and efficacy of dapagliflozin in patients with focal segmental glomerulosclerosis: a prespecified analysis of the DAPA-CKD trial. Nephrol Dial Transplant 2021; doi: 10.1093/ndt/gfab335
- Ferrannini E, Baldi S, Frascerra S et al. Shift to fatty substrate utilization inresponse to sodium-glucose cotransporter 2 inhibition in subjects without diabetes and patients with type 2 diabetes. Diabetes 2016; 65: 1190–1195
- Al-Jobori H, Daniele G, Cersosimo E et al. Empagliflozin and kinetics of renal glucose transport in healthy individuals and individuals with type 2 diabetes. Diabetes 2017; 66: 1999–2006
- Bays HE, Weinstein R, Law G et al. Canagliflozin: effects in overweight and obese subjects without diabetes mellitus. Obesity (Silver Spring) 2014; 22: 1042–1059
- Vallon V, Thomson SC. The tubular hypothesis of nephron filtration and diabetic kidney disease. Nat Rev Nephrol 2020; 16: 317–336
- Ogna A, Forni Ogna V, BochudM et al. Association between obesity and glomerular hyperfiltration: the confounding effect of smoking and sodium and protein intakes. Eur J Nutr 2016; 55: 1089–1097
- Tonneijck L, Muskiet MH, Smits MM et al. Glomerular hyperfiltration in diabetes: mechanisms, clinical significance, and treatment. J Am Soc Nephrol 2017; 28: 1023–1039
- Helal I, Fick-Brosnahan GM, Reed-Gitomer B et al. Glomerular hyperfiltration: definitions, mechanisms and clinical implications. Nat Rev Nephrol 2012; 8: 293–300
- HerringtonWG, Savarese G,Haynes R et al. Cardiac, renal, and metabolic effects of sodium-glucose co-transporter 2 inhibitors: a position paper from the European Society of Cardiology ad-hoc task force on sodium glucose co-transporter 2 inhibitors. Eur J Heart Fail 2021; 23: 1260–1275
- Jha V, Garcia-Garcia G, Iseki K et al. Chronic kidney disease: global dimension and perspectives. Lancet 2013; 382: 260–272
- United States Renal Data System. 2014 Annual Data Report: Atlas of End-stage Renal Disease in the United States. Bethesda, MD: National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, 2014
- Meeker-O’Connell A, Glessner C, Behm M et al. Enhancing clinical evidence by proactively building quality into clinical trials. Clin Trials 2016; 13: 439–444
- Levey AS, Stevens LA, Schmid CH et al. A new equation to estimate glomerular filtration rate. Ann InternMed 2009; 150: 604–612
- Pocock SJ, Simon R. Sequential treatment assignment with balancing for prognostic factors in the controlled clinical trial. Biometrics 1975; 31: 103–115
- Baigent C, Herrington WG, Coresh J et al. Challenges in conducting clinical trials in nephrology: conclusions from a Kidney Disease- Improving GlobalOutcomes (KDIGO) Controversies Conference. Kidney Int 2017; 92: 297–305
- Herrington WG, Staplin N, Haynes R. Kidney disease trials for the 21st century: innovations in design and conduct. Nat Rev Nephrol 2020; 16: 173–185
- Levey AS, Coresh J. Chronic kidney disease. Lancet 2012; 379: 165–180
- Neuen BL, Young T, Heerspink HJL et al. SGLT2 inhibitors for the prevention of kidney failure in patients with type 2 diabetes: a systematic review and meta-analysis. Lancet Diabetes Endocrinol 2019; 7: 845–854
- Zannad F, Ferreira JP, Pocock SJ et al. Cardiac and kidney benefits of empagliflozin in heart failure across the spectrum of kidney function: insights from EMPEROR-Reduced. Circulation 2021; 143: 310–321
- Jhund PS, Solomon SD, Docherty KF et al. Efficacy of dapagliflozin on renal function and outcomes in patients with heart failure with reduced ejection fraction: results of DAPA-HF. Circulation 2021; 143: 298–309
- Haynes R, Staplin N, Emberson J et al. Evaluating the contribution of the cause of kidney disease to prognosis in CKD: results from the Study of Heart and Renal Protection (SHARP). Am J Kidney Dis 2014; 64: 40–48
- Levey AS, Inker LA, Matsushita K et al. GFR decline as an end point for clinical trials in CKD: a scientific workshop sponsored by the National Kidney Foundation and the US Food and Drug Administration. Am J Kidney Dis 2014; 64: 821–835
- Perkovic V, Koitka-Weber A, Cooper ME et al. Choice of endpoint in kidney outcome trials: considerations from the EMPA-REG OUTCOME trial. Nephrol Dial Transplant 2020; 35: 2103–2111
- Oshima M, Neal B, Toyama T et al. Different eGFR decline thresholds and renal effects of canagliflozin: data from the CANVAS program. J Am Soc Nephrol 2020; 31: 2446–2456
- Neuen B, Tighiouart H, Heerspink H et al. Acute treatment effects on GFR in randomized clinical trials of kidney disease progression. J Am Soc Nephrol 2022; 33: 291–303







