MỤC TIÊU
Dữ liệu tiền lâm sàng cho thấy linagliptin, thuốc ức chế men dipeptidyl peptidase-4, có thể làm giảm sự bài tiết albumin niệu.
PER-HENRIK GROOP, MD, DMSC1,2,3MARK E. COOPER, MBBS, PHD3VLADO PERKOVIC, MBBS, PHD4ANGELA EMSER, PHD5HANS-JUERGEN WOERLE, MD5MAXIMILIAN VON EYNATTEN, MD5
From the 1Folkhälsan Institute of Genetics, Folkhälsan Research Center, Biomedicum Helsinki, Helsinki, Finland; the 2Division of Nephrology, Department of Medicine, Helsinki University Central Hospital, Helsinki, Finland; the 3Baker IDI Heart and Diabetes Institute, Melbourne, Victoria, Australia; the 4George Institute for Global Health, Sydney, New South Wales, Australia; and 5Boehringer Ingelheim PharmaGmbH & Co. KG, Ingelheim, Germany.
Người biên dịch: Bs Trần Vũ Minh Thư
Trưởng khoa Nội Tim Mạch 4 – BV Tim Tâm Đức
Khả năng làm giảm albumin niệu của linagliptin ở những bệnh nhân đã dùng thuốc ức chế hệ renin angiotensin-aldosterone (RAAS) được phân tích từ dữ liệu gộp của 4 thử nghiệm pha III, ngẫu nhiên, mù đôi, đối chứng với giả dược, 24 tuần, có thiết kế nghiên cứu tương tự nhau.
THIẾT KẾ VÀ PHƯƠNG PHÁP NGHIÊN CỨU
Phân tích gộp của 4 nghiên cứu đã hoàn tất được tiến hành trên 217 bệnh nhân đái tháo đường type 2 có albumin niệu (được định nghĩa tỷ lệ albumin/creatinin niệu [UACR] 30-3000mg/g creatinin) trong khi vẫn đang dùng liều ổn định thuốc ức chế RAAS. Bệnh nhân tham gia nghiên cứu được chia ngẫu nhiên thành hai nhóm, một nhóm nhận linagliptin 5mg/ngày (n=162), một nhóm nhận giả dược (n=55). Tiêu chí chính là thay đổi phần trăm trung bình nhân UACR ở tuần 24 so với mức ban đầu.
KẾT QUẢ
UACR ở tuần 24 giảm khoảng 32% (95% CI -42 đến-21; P <0.05)ở nhóm bệnh nhân dùng linagliptin so với 6% (95% CI -27đến+23)ở nhóm bệnh nhân dùng placebo, sự khác biệt giữa hai nhóm là 28% (95% CI -47 đến-2; P = 0.0357). Sự khác biệt giữa hai nhóm về sự thay đổi HbA1c ở tuần 24 so với mức ban đầu là -0,61% (-6,7 mmol/mol) ưu thế ở nhóm dùng linagliptin (95%CI -0.88 đến-0.34% [-9.6 đến-3.7 mmol/mol]; P<0.0001). Tuy nhiên, hiệu quả giảm albumin niệu của linagliptin không bị ảnh hưởng bởi chủng tộc hay HbA1c và huyết áp tâm thu (SBP) trước hoặc sau điều trị.
KẾT LUẬN
Linagliptin thêm vào bệnh nhân đái tháo đường type 2 có rối loạn chức năng thận đang dùng thuốc ức chế RAAS làm giảm đáng kể albumin niệu. Biểu hiện này độc lập với sự thay đổi đường huyết hoặc SBP. Nghiên cứu tiền cứu về hiệu quả trên thận của linagliptin đang tiến hành.
Việc gia tăng xuất độ của bệnh thận mạn, được định nghĩa là sự tăng bài tiết albumin niệu và/hoặc giảm độ lọc cầu thận (GFR), là vấn đề sức khỏe cộng đồng lớn ảnh hưởng đến khoảng 13% dân số nước Mỹ (1,2). Bệnh thận do đái tháo đường là nguyên nhân hàng đầu dẫn đến bệnh thận giai đoạn cuối (ESRD) ở các quốc gia phát triển, cả xuất độ và tỷ lệ mới mắc đang tăng lên đáng kể trên toàn thế giới. Sự phát triển của albumin niệu là bước quan trọng trong tiến triển bệnh thận do đái tháo đường và sự nặng lên của albumin niệu là yếu tố dự đoán quan trọng của bệnh thận tiến triển (3,4). Số liệu dịch tể học cho thấy 39 và 10% bệnh nhân đái tháo đường type 2 có tiểu đạm vi thể và đại thể(5). Ngoài ra, albumin niệu (cao hay thấp) dự đoán nguy cơ tim mạch (CV) ở bệnh nhân đái tháo đường type 2 và dân số chung (3,4,6,7). Các khuyến cáo khuyên nên đánh giá albumin niệu mỗi năm ở tất cả bệnh nhân đái tháo đường type 2 từ lúc chẩn đoán, và các khuyến cáo hiện tại trong điều trị bệnh thận ở bệnh nhân đái tháo đường type 2 hướng trực tiếp đến sự can thiệp đa yếu tố, bao gồm giảm huyết áp, cải thiện đường huyết và lipid máu, và giảm albumin niệu (1,8).
Thuốc RAAS giúp bảo vệ thận và hệ tim mạch ngoài khả năng hạ áp (9,10),và lợi ích của những thuốc này còn liên quan với những thay đổi đồng thời albumin niệu. Do đó, việc giảm albumin niệu ở bệnh nhân đái tháo đường type 2 có liên quan đến việc giảm đáng kể nguy cơ tiến triển đến ESRD (11-13). Những đặc điểm này cho thấy albumin niệu có thể là mục tiêu điều trị quan trọng để phòng ngừa tiến triển của bệnh thận do đái tháo đường và cũng có thể bảo vệ hệ tim mạch. Tuy nhiên, mặc dù hiện nay bệnh thận mạn được điều trị chuẩn theo khuyến cáo, bao gồm thuốc ức chế RAAS, nhiều bệnh nhân đái tháo đường typ 2 còn albumin niệu và tiếp tục diễn tiến đến ESRD (14,15). Các lựa chọn điều trị thêm vào bổ sung lợi ích của điều trị hiện tại vẫn đang là nhu cầu cần thiết.
Những nghiên cứu thực nghiệm gần đây cho thấy lợi ích trên thận của điều trị dựa trên incretin (16-22). Trong một mô hình trên chuột về tổn thương mạch máu thận (endothelial
nitric oxide synthase knockoutmice), cùng dùng linagliptin, thuốc ức chế men dipeptidyl
peptidase-4 (DPP-4) chọn lọc cao đường uống, và ức chế thụ thể angiotensin (ARB) telmisartan cùng làm giảm albumin niệu và xơ hóa cầu thận. Những kết quả này xảy ra độc lập với bất kỳ thay đổi về chuyển hóa glucose vì đáp ứng của tế bào β với linagliptin giảm đi do đã dùng streptozotocin, một độc chất đối với tế bào β, ở những con chuột này (16). Tuy nhiên, chứng cứ lâm sàng liên quan đến hiệu quả trên thận của điều trị dựa trên incretin ở bệnh nhân đái tháo đường type 2 là quá ít (23,24), và bằng chứng đưa ra kết luận để diễn giải những đặc điểm từ mô hình trên động vật sang người vẫn chưa quan sát được ở những thử nghiệm lâm sàng ngẫu nhiên. Tuy nhiên, sự bài tiết albumin niệu, được đánh giá bằng tỉ lệ albumin/creatinin (UACR), thường được thu thập trong các chương trình phát triển lâm sàng liên quan đến bệnh nhân đái tháo đường. Thật vậy, một thuận lợi của dữ liệu được thu thập trong quá trình phát triển thuốc là cơ hội để thu thập dữ liệu từ các nghiên cứu riêng lẻ, giúp phân tích sâu hơn nữa. Trong nghiên cứu này, chúng tôi sử dụng dữ liệu được thu thập trong suốt quá trình phát triển linagliptin để kiểm định giả thuyết rằng linagliptin có thể làm giảm albumin niệu ở bệnh nhân đái tháo đường type 2 và rối loạn chức năng thận.
THIẾT KẾ VÀ PHƯƠNG PHÁP NGHIÊN CỨU
Phân tích hồi cứu này sử dụng dữ liệu từ chương trình phát triển linagliptin toàn cầu. Dữ liệu được bao gồm 4 thử nghiệm lâm sàng pha III từ giữa tháng 1 năm 2008 đến tháng 5 năm 2010 để đánh giá độ an toàn và hiệu quả của linagliptin ở bệnh nhân đái tháo đường type 2 (25-28) (Supplementary bảng 1). Cả bốn thử nghiệm này đều ngẫu nhiên, mù đôi, và có đối chứng với giả dược, với thời gian nghiên cứu, định nghĩa tiêu chí chính, và đánh giá độ an toàn tương tự nhau, vì thế cho phép tập hợp dữ liệu lại với nhau (Supplementary Sơ đồ 1). Thiết kế và kết quả của bốn nghiên cứu riêng lẻ đã được mô tả chi tiết trước đó (25-28).
Tóm lược, bệnh nhân được chọn cho mỗi thử nghiệm của bốn thử nghiệm này có tuổi 18-80, đái tháo đường type 2, BMI ≤ 40 kg/m2, và hoặc chưa điều trị (HbA1c 7.0 – 11.0%) [53-97mmol/mol] lúc tầm soát) hoặc đã dùng một hoặc hai thuốc hạ đường huyết uống (HbA1c 6.5 – 10.5%) [48-91mmol/mol] lúc tầm soát). Bệnh nhân đưa vào nghiên cứu được nhận ngẫu nhiên hoặc giả dược hoặc linagliptin 5mg thêm vào điều trị đã có từ trước. Kết qủa chính về hiệu quả của thuốc của cả bốn nghiên cứu là sự thay đổi HbA1c ở tuần 24 so với lúc ban đầu.
Đánh giá độ an toàn ở bốn nghiên cứu là giống nhau và đã được xác định trước. Kết quả an toàn của từng nghiên cứu trước đã được báo cáo (25-28). Đánh giá chức năng thận bao gồm độ lọc cầu lọc cầu thận ước tính (eGFR) theo công thức the Modification of Diet in Renal Disease và độ thanh thải Creatinin theo công thức Cockcroft-Gault. Albumin niệu được định nghĩa bằng UACR tử mẫu nước tiểu một thời điểm lúc ban đầu và sau 12 và 24 tuần điều trị. Tất cả đánh giá nước tiểu và máu được thực hiện ở phòng xét nghiệm trung tâm (MDS Pharma Services Central Laboratories and Covance Laboratories). Vi đạm niệu được định nghĩa là UACR 30-300 mg/g Cr lúc ban đầu, và tiểu đạm đại thể là UACR 300-3000mg/g Cr lúc ban đầu. Các giai đoạn của bệnh thận mạn được phân loại dựa trên hệ thống phân loại của the National Kidney Foundation’s Kidney Disease Outcomes Quality Initiative (1).
Phân tích sự an toàn bao gồm tần suất và mức độ của tác dụng phụ (AEs), dấu hiệu sinh tồn (chẳng hạn như huyết áp tâm thu [SBP] và huyết áp tâm trương), đo các chỉ số xét nghiệm lâm sàng, và đánh giá hạ đường huyết. Lặp lại việc đo huyết áp cho bệnh nhân được thực hiện ở mỗi lần thăm khám sau khi ngồi nghỉ tối thiểu 5 phút.
Các tiêu chí
Tiêu chí chính của phân tích gộp này là sự thay đổi phần trăm trung bình nhân UACR ở tuần 24 so với mức ban đầu. Tiêu chí phụ là sự thay đổi HbA1c và đường huyết đói (FPG) ở tuần 24 so với mức ban đầu.
Phương pháp thống kê
Dân số trong 4 nghiên cứu (n=2472) được nhận ngẫu nhiên ít nhất một liều thuốc nghiên cứu (bệnh nhân được điều trị: nhóm giả dược, n=679; nhóm linagliptin, n=1793). Trong dân số này, các đối tượng được thu nhận để phân tích nếu họ có các đặc điểm sau: UACR ban đầu 30-3000mg/g Cr, eGFR ban đầu ≥ 30 mL/phút/1.73m2, đang được điều trị với liều ổn định thuốc ức chế men chuyển (ACEIs), ARBs, hoặc cả hai trong ít nhất 4 tuần trước khi tiến hành nghiên cứu và từ lúc bắt đầu đưa vào nghiên cứu cho đến ngày đo UACR cuối cùng trong vòng 24 tuần điều trị.
Tất cả các phân tích về hiệu quả thuốc được thể hiện trong bộ phân tích đầy đủ. Phân tích bao gồm các bệnh nhân được nhận ít nhất một liều thuốc nghiên cứu, có đo các chỉ số liên quan đến tiêu chí lúc ban đầu, và ít nhất một lần trong quá trình điều trị. Các dữ liệu bị mất được xử lý bằng cách sử dụng các số liệu trong kỳ thăm khám cuối cùng. Bởi vì phân phối bị lệch nên số liệu UACR được chuyển log10 trước khi phân tích và những thay đổi so với ban đầu được phân tích bởi ANCOVA và được điều chỉnh vì chuyển log10 các giá trị ban đầu. Kết quả của phân tích được chuyển ngược để đạt được trung bình nhân tỷ lệ UACR của giá trị tuần 24 so với giá trị ban đầu và tương ứng 95% CI; sau đó được biểu diễn bằng sự thay đổi phần trăm trung bình nhân điều chỉnh của tỷ lệ UACR ở tuần 24 so với giá trị ban đầu, như đã được báo cáo trước đây(29). Kết quả UACR được tính toán cho phân tích gộp và cho bốn nghiên cứu riêng lẻ. Hơn nữa, phân tích dưới nhóm được thực hiện cho các yếu tố sau: chủng tộc (Châu Á, da trắng); HbA1c ban đầu (thấp hơn, cao hơn hoặc bằng trung bình); và SBP ban đầu (thấp hơn, cao hơn hoặc bằng trung bình). Tất cả đối tượng trong phân tích gộp nhận đồng thời thuốc ACEIs, ARBs, hoặc cả hai. Để đánh giá thêm việc sử dụng đồng thời thuốc ức chế hệ RAAS có thể ảnh hưởng đến hiệu quả của linagliptin trên albumin niệu hay không, bộ phân tích độ nhạy được làm thêm. Bộ phân tích này dùng để kiểm tra tiêu chí chính và gồm những bệnh nhân không được điều trị với thuốc ức chế RAAS nhưng có đặc điểm UACR và eGFR ban đầu như đã nêu trên.
Sự thay đổi HbA1c ở tuần 24 so với mức ban đầu được đánh giá bằng ANCOVA, với điều trị, nghiên cứu, và rửa trôi như hiệu ứng phân loại cố định và HbA1c ban đầu như một biến số. Mô hình tương tự với sự thêm vào biến số FPG ban đầu được sử dụng để đánh giá thay đổi FPG ở tuần 24 so với ban đầu. Sự giảm HbA1c trong nhóm linagliptin được phân tầng thành tứ phân vị dựa trên sự thay đổi ở tuần 24 so với ban đầu: <0.1, 0.1-0.59, 0.60-0.99, and ≥1.0%(<1.1, 1.1-6.5, 6.6-10.8, và≥10.9mmol/mol). Hiệu quả trên SBP sau điều trị trong nhóm linagliptin được phân thành ba loại dựa trên sự thay đổi giá trị cuối cùng so với ban đầu: SBP giảm > 1.0 mmHg, SBP ổn định với thay đổi tối thiểu giữa -1.0 và +1.0 mmHg và SBP tăng >1.0 mmHg. Sự khác biệt giữa thay đổi phần trăm trung bình nhân UACR qua tứ phân vị HbA1c và phân loại SBP được kiểm tra bằng ANOVA F-test để xác định chúng có khác biệt có ý nghĩa thống kê hay không. Đánh giá sự an toàn được tiến hành dựa trên dữ liệu điều trị. Tất cả những phân tích được thực hiện bằng phần mềm SAS, phiên bản 9.2 (SAS Institute Inc.,Cary, NC).
KẾT QUẢ
Sự sắp xếp bệnh nhân được thể hiện trong Hình 1. Trong số 2472 bệnh nhân đươc điều trị trong 4 thử nghiệm lâm sàng, 564 bệnh nhân có albumin niệu (UACR 30-3,000 mg/g Cr) và eGFR ≥30 mL/min/1.73 m2 lúc tầm soát. Hơn nữa, trong số 564 bệnh nhân này, 217 bệnh nhân nhận liều ổn định ACEIs và/hoặc ARBs ban đầu và trong suốt 24 tuần điều trị và được dùng trong bộ phân tích chính (Hình 1). Lưu ý, chỉ 7 bệnh nhân bị loại ra khỏi phân tích vì UACR >3,000mg/g Cr. Bộ phân tích độ nhạy bao gồm 249 bệnh nhân đái tháo đường type 2 và có albumin niệu trước đây không được điều trị với thuốc ức chế RAAS (Hình 1).
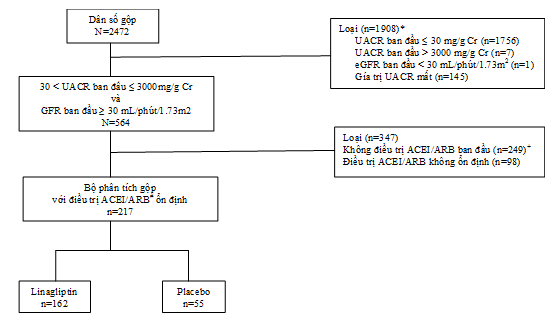
Hình 1: Phân bố bệnh nhân. *Bệnh nhân có thể có hơn một tiêu chuẩn loại trừ. +183 bệnh nhân nhận linagliptin; 66 bệnh nhân nhận placebo.#Ít nhất 4 tuần lễ trước trước nghiên cứu và từ lúc bắt đầu nghiên cứu cho đến ngày đo UACR sau cùng trong vòng 24 tuần điều trị.
Đặc điểm nhân trắc học, lâm sàng, sinh hóa, cũng như điều trị cơ bản ban đầu, được cân bằng giữa hai nhóm điều trị (Bảng 1). Nói chung, đa số bệnh nhân (71%) là da trắng. Tuổi trung bình và HbA1c ban đầu của dân số nghiên cứu là 60.7 ± 9.6 và8.3 ±0.9% (67.2 ± 9.8mmol/mol),và 68% bệnh nhân có đái tháo đường type 2 hơn 5 năm. Khi mới đưa vào nghiên cứu đa số bệnh nhân có tiểu đạm vi thể (84%) và suy thận nhẹ hoặc không suy thận (88%); 68 và 35% số bệnh nhân dùng ACEIs hoặc ARBs lúc tầm soát, với chỉ 3% đối tượng nghiên cứu dùng cả hai thuốc ức chế RAAS.
Bảng 1: Đặc điểm lâm sàng ban đầu và nhân trắc học dân số tham gia nghiên cứu
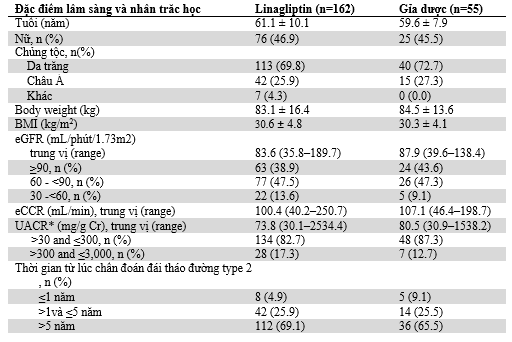
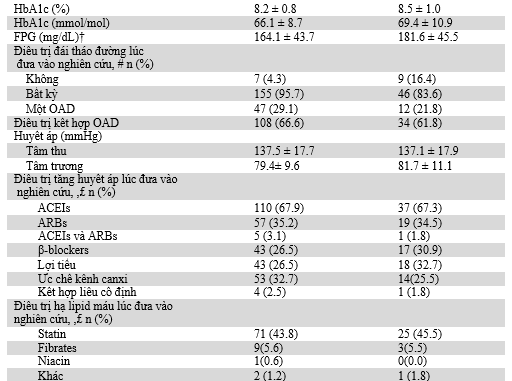
Dữ liệu được biểu diễn như sau trung bình ± SD trừ khi được yêu cầu khác đi. *Dữ liệu UACR ban đầu có sẵn ở 226 bệnh nhân (170 nhận linagliptin; 56 nhận giả dược). †Dữ liệu FPG ban đầu có sẵn ở 210 bệnh nhân (156 nhận linagliptin; 54 nhận giả dược). # Được theo dõi khoảng 4 tuần thải trừ, nếu được yêu cầu. £Bệnh nhân có thể đang dùng hơn một thuốc. eCCR, độ thanh thải creatinin ước tính; OAD, thuốc hạ đường huyết uống.
Hiệu quả
Gía trị UACR trung vị tương tự giữa hai nhóm điều trị lúc ban đầu 73.8(30.1-2,534.4) và80.5 (30.9-1,538.2)mg/g Crở nhóm linagliptin và giả dược (bảng 1). Sau 24 tuần điều trị, thay đổi phần trăm trung bình nhân điều chỉnh UACR so với ban đầu cao hơn hẳn với linagliptin (-32% [95% CI -42 đến-21];P <0.05) so vớigiả dược(-6%[95% CI -27 đến+23]), với sự khác biệt giữa hai nhóm -28% (95% CI -47đến-2; P = 0.0357) (Hình2A vàB).Lưu ý, hiệu quả giảm albumin niệu thấy được sau 12 tuần điều trị (-29%[95% CI-40 đến -17];P<0.05; khác biệt giữa hai nhóm: -25% [95% CI -46 đến +3]; P = 0.0750) (Hình2A vàB).
Phân tích dưới nhóm của tiêu chí chính được thực hiện đối với chủng tộc, HbA1c ban đầu, và SBP ban đầu. Đối với mỗi phân tích, không có tương tác quan trọng có ý nghĩa thống kê giữa phân nhóm điều trị và phân nhóm có liên quan. Hiệu quả toàn diện của linagliptin phù hợp với kết quả phân tích chính (Hình 2C và phụ lục hình 2).
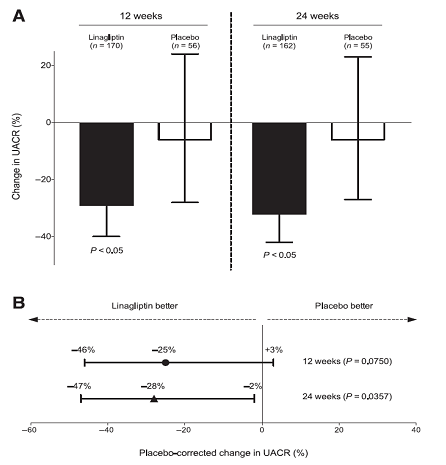
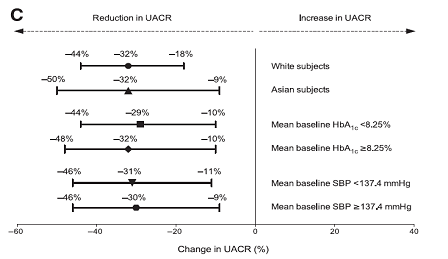
Hình 2– A: Thay đổi phần trăm trung bình nhân UACR đã hiệu chỉnh ở tuần 12 và 24 so với ban đầu (■, linagliptin; □, giả dược); P < 0,05 so với ban đầu. Thanh sai số miêu tả 95% CIs. B: Thay đổi phần trăm trung bình nhân UACR đã hiệu chỉnh so với placebo ở tuần 12 so với ban đầu (n=226; P=0.0750; ●) và 24 tuần (n=217; P=0.0357; ▲). Thanh sai số miêu tả 95% CIs. C: Thay đổi phần trăm trung bình nhân UACR đã hiệu chỉnh so với ban đầu ở tuần 24 được phân tầng bởi chủng tộc, trung bình HbA1c ban đầu, và SBP trung bình ban đầu ở nhóm linagliptin. ●, bệnh nhân da trắng (n=113); ▲, bệnh nhân Châu Á (n=45, điều trị x yếu tố chủng tộc, P=0,7397); ■, HbA1c ban đầu trung bình <8.25% (n=97); ♦, HbA1c ban đầu trung bình ≥8.25% (n=65; điều trị x HbA1c ban đầu, P=0.8100); ▼, SBP ban đầu trung bình <137.4 mmHg (n=88); SBP ban đầu trung bình ≥137.4 mmHg (n=74; điều trị x yếu tố SBP ban đầu, P=0.6475). Thanh sai số miêu tả 95%.
Chúng tôi khảo sát thêm hiệu quả của linagliptin trên UACR ở bệnh nhân rối loạn chức năng thận không được điều trị thuốc ức chế hệ RAAS trước đó. Phân tích độ nhạy này cho thấy có giảm đáng kể UACR ở tuần 24 so với ban đầu với linagliptin (-30% [95% CI-40 đến-19]; P <0.05; n = 183). Sự khác biệt giữa hai nhóm -17% (95% CI -38 đến +12) thể hiện khuynh hướng tương tự bộ phân tích ban đầu nhưng không có ý nghĩa thống kê (P=0,2301; N=249).
Các yếu tố có khả năng ảnh hưởng lớn đến tiêu chí chính được xem xét bao gồm sự cải thiện đường huyết và biến đổi huyết áp hoặc chức năng thận trong suốt 24 tuần điều trị ở hai nhóm. Như mong đợi, linagliptin làm giảm đáng kể HbA1c. Thay đổi HbA1c trung bình hiệu chỉnh ở tuần 24 so với ban đầu là -0.66% (-7.2 mmol/mol) ở nhóm linagliptin so với -0.05% (-0.05 mmol/mol) ở nhóm giả dược (Hình 3A), với sự khác biệt giữa hai nhóm là -0.61% (-6.7 mmol/mol) ưu thế ở nhóm linagliptin (95% CI -0.88 đến -0.34%[-9.6 đến -3.7 mmol/mol]; P < 0.0001). HbA1c cũng được phân thành tứ phân vị dựa trên sự thay đổi ở tuần 24 so với ban đầu. Thay đổi phần trăm trung bình nhân UACR ở tuần 24 đối với linagliptin qua các phân loại có sự khác biệt không có ý nghĩa thống kê (Hình 3B). Hơn nữa, kết quả quan trọng được nhận thấy ở thay đổi trung bình hiệu chỉnh đường huyết đói tuần 24 so với ban đầu (-8.88 mg/dL với linagliptin so với +16,22 mg/dL với giả dược; khác biệt giữa hai nhóm -25.1 mg/dL [95% CI -38.55 đến -11.65];P = 0.0003).
Chúng tôi phát hiện không có sự biến đổi SBP có ý nghĩa lâm sàng giữa giá trị cuối cùng so với ban đầu ở những đối tượng được điều trị với linagliptin hoặc giả dược (Hình 3C). SBP được phân thành 3 loại dựa trên thay đổi giá trị cuối cùng so với ban đầu. Thay đổi phần trăm trung bình nhân UACR ở tuần 24 đối với linagliptin qua các phân độ này có sự khác biệt không có ý nghĩa thống kê (Hình 3D). Không có khác biệt đáng kể giữa sự phân bố các thuốc ức chế RAAS khác nhau lúc ban đầu. Hơn nữa, sự thay đổi thuốc hạ áp khác trong suốt nghiên cứu là hiếm và nói chung cân bằng giữa hai nhóm (dữ liệu không được nêu ra).
Cuối cùng, eGFR trung vị ban đầu tương tự giữa hai nhóm linagliptin và giả dược 83.6 (35.8–189.7) and 87.9 (39.6–138.4) mL/min/1.73 m2 (Bảng 1). Không có sự thay đổi có ý nghĩa lâm sàng được quan sát giữa giá trị sau cùng và ban đầu ở cả hai nhóm (trung vị -1.3 và -0.2 mL/phút/1.73m2).
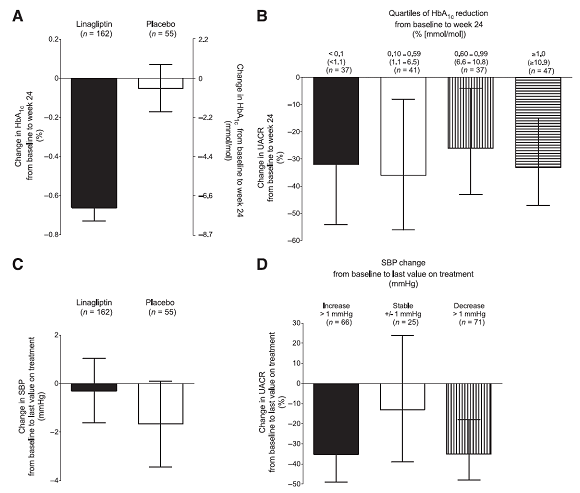
Hinh 3- A: Thay đổi HbA1c trung bình điều chỉnh ở tuần 24 so với ban đầu (■, linagliptin; □, giả dược). Có sự khác biệt giữa hai nhóm -0.61% (-6.7 mmol/mol) ưu thế ở nhóm linagliptin (95% CI -0.88 đến -0.34% [-9.6 đến -3.7 mmol/mol]; P <0.0001). Thanh sai số miêu tả SE. BThay đổi phần trăm trung bình nhân UACR đã hiệu chỉnh bằng tứ phân vị giảm HbA1c ở nhóm linagliptin: ■, < giảm HbA1c 0.1% (<1,1 mmol/L); □, giảm HbA1c 0.10-0.59% (1.1-6.5 mmol/L); giảm HbA1c 0.60-0.99% (6.6-10.8 mmol/L); , giảm HbA1c ≥1.0% (≥10,9 mmol/L); P ≥ 0.05 (ANOVA F-test). Thanh sai sốmiêu tả 95% CIs. C: thay đổi SBP trung bình điều chỉnh từ giá trị sau cùng trong suốt quá trình điều trị so với ban đầu (■, linagliptin; □, giả dược). Thanh sai số miêu tả SE. DThay đổi phần trăm trung bình nhân UACR đã hiệu chỉnh bằng phân loại thay đổi SBP ở nhóm linagliptin: ■, tăng SBP >1.0mmHg; □, -1.0 mmHg ≤ thay đổi SBP ≤ +1.0 mmHg; giảm SBP >1.0mmHg; P ≥ 0.05 (ANOVA F-test). Thanh sai sốmiêu tả 95% CIs.
Sự an toàn
Trong số các đối tượng tham gia vào phân tích gộp này, linagliptin là an toàn và được dung nạp tốt. Tỉ lệ mới mắc toàn bộ của AEs lâm sàng tương tự giữa nhóm linagliptin và giả dược (63.0 so với 63.6%) (phụ lục Bảng 2). Tỉ lệ mới mắc AEs của rối loạn chức năng thận và nước tiểu tương tự giữa hai nhóm điều trị (4.3 so với 5.5%). Tỉ lệ bệnh nhân có AEs do thuốc hơi cao hơn với linagliptin so với placedo (14.2 so với 7.3%). Sự khác biệt này nhiều khả năng có liên quan đến tỷ lệ hạ đường huyết do thuốc cao hơn ở nhóm linagliptin (8.6 so với 0.0%). Cần lưu ý, tất cả các đối tượng nghiên cứu trong nhóm linagliptin bị hạ đường huyết được báo cáo đang dùng sulfonylureas trước khi nhận vào nghiên cứu. Không có trường hợp hạ đường huyết nào được ghi nhận ở bệnh nhân chỉ điều trị với linagliptin hoặc kết hợp với metformin. Ngoài ra, không có biến cố hạ đường huyết nghiêm trọng nào (nghĩa là biến cố cần hỗ trợ của người khác để cung cấp đường, glucagon, hoặc các hoạt động hồi sức khác) được báo cáo.
KẾT LUẬN
Phân tích gộp của bốn thử nghiệm lâm sàng pha III này từ chương trình phát triển lâm sàng đã chứng minh linagliptin là giảm đáng kể albumin niệu so với ban đầu khoảng 28% so với placebo sau 24 tuần điều trị. Cần lưu ý, sự ảnh hưởng lên albumin niệu được nhận thấy từ tuần 12 của điều trị. Ngoài ra, hiệu quả giảm albumin niệu của linagliptin hằng định ở phân nhóm bệnh nhân có liên quan như phân nhóm bệnh nhân được phân loại theo chủng tộc, HbA1c ban đầu, và SBP ban đầu. Phân tích này cho thấy linagliptin có thể có ảnh hưởng trực tiếp trên thận ở đái tháo đường type 2 và những thử nghiệm tiền cứu đã chứng minh giả thuyết này.
Nhiều yếu tố lâm sàng được biết có ảnh hưởng đến sự bài tiết albumin niệu ở đái tháo đường type 2, như sự thay đổi SBP hoặc mất chức năng thận. Tuy nhiên, chúng tôi không tìm thấy sự thay đổi SBP và eGFR có ý nghĩa lâm sàng trong suốt 24 tuần điều trị ở cả 2 nhóm, cho thấy sự an toàn trên thận và huyết động của linagliptin. Hơn nữa, đối với linagliptin, không có sự khác biệt có ý nghĩa thống kê giữa thay đổi phần trăm trung bình nhân UACR qua các phân loại của SBP đối với giá trị sau cùng. Điều này chứng minh rằng huyết áp không ảnh hưởng đáng kể đến lên hiệu quả của linagliptin trên UACR trong phân tích chúng tôi.
Thêm vào đó, thay đổi tăng đường huyết là yếu tố có khả năng gây nhiễu. Thật sự, những nghiên cứu can thiệp đã cho thấy hiệu quả cải thiện duy trì việc kiểm soát đường huyết làm giảm sự tiến triển của biến chứng vi mạch ở bệnh nhân đái tháo đường type 2 sau điều trị dài hạn (30-32). Vì vậy, người ta đang nỗ lực xem xét sự giảm albumin niệu có thể đi kèm với sự cải thiện kiểm soát đường huyết sau điều trị ngắn hạn. Tuy nhiên, bằng chứng về hiệu quả của kiểm soát đường huyết ngắn hạn (vài tháng hơn vài năm) trên albumin niệu ở bệnh nhân đái tháo đường chưa kết luận được. Sự cải thiện HbA1c sau 52 tuần truyền insulin – từ 9.5 xuống 7.3% (80.3 xuống 56.3 mmol/mol) – không liên quan đến bất kỳ sự thay đổi có ý nghĩa các thông số về thận, như GFR hoặc sự bài tiết albumin niệu, ở bệnh nhân đái tháo đường phụ thuộc insulin và sự bài tiết albumin niệu tăng (30-300 mg/24h) (33). Hơn nữa, một nghiên cứu trước đây của Tuttle và cộng sự (34) công bố rằng kiểm soát đường huyết nghiêm ngặt làm giảm HbA1c từ 8.4 xuống 6.9% (68 xuống 52 mmol/mol) sau 3 tuần điều trị insulin tích cực. Mặc dù huyết động tại thận đáp ứng với tăng nồng độ amino acid huyết tương được cải thiện , giảm HbA1c nhanh không làm thay đổi đáng kể sự bài tiết albumin niệu. Cùng đặc điểm này, cải thiện đường huyết không cải thiện tiểu đạm vi thể ở dân số thanh thiếu niên với đái tháo đường phụ thuộc insulin áp dụng hoặc chế độ điều trị quy ước tích cực hoặc truyền insulin lên đến 8 tháng (35). Những kết quả này cho thấy không có sự ảnh hưởng lớn của kiểm soát đường huyết ngắn hạn lên sự bài tiết albumin niệu. Tuy nhiên, tách biệt chính xác giữa sự phụ thuộc ngắn hạn và dài hạn hơn giữa kiểm soát đường huyết và tiến triển của bệnh thận ở đái tháo đường type 2 là khó khăn. Phân tích của chúng tôi không thể hiện mối liên quan trực tiếp giữa kiểm soát đường huyết ngắn hạn và và thay đổi UACR. Chúng tôi tìm thấy không có sự khác biệt có ý nghĩa thống kê giữa sự thay đổi phần trăm trung bình nhân UACR và thay đổi HbA1c ở tuần 24 đối với linagliptin. Thật sự, bệnh nhân chỉ giảm nhẹ HbA1c cho thấy thay đổi tương tự UACR được so sánh với những bệnh nhân giảm nhiều HbA1c (>1.1% [12.0 mmol/mol]) sau 24 tuần điều trị với linagliptin.
Cơ chế linagliptin giúp cải thiện hiệu quả của thuốc ức chế RAAS ở thận vẫn cần được giải thích đầy đủ. Gỉa thuyết về khả năng làm giảm albumin niệu của linagliptin là kết quả lần đầu được tìm thấy từ một nghiên cứu thực nghiệm trên động vật đánh giá hiệu quả trên thận cùng với telmisartan ở chuột bị đái tháo đường knockout nitric oxide synthase (16). Trong mô hình tổn thương thận mạch máu, 11 tuần điều trị kết hợp làm giảm đáng kể sự bài tiết albumin niệu, độc lập với thay đổi đường huyết, và hiệu quả lớn hơn khi chỉ dùng thuốc ức chế RAAS. Bằng chứng cho thấy hiệu quả giảm albumin niệu của linagliptin có thể do giảm tổn thương prodocyte và sự chuyển dạng myofibroblast (36) cũng như kết quả cải thiện đáp ứng viêm ở thận thông qua sự tăng hoạt động của glucagon-like peptide-1 (GLP-1) (16,36) hoặc sự ức chế tumor necrosis factor-a(16). Hơn nữa, việc điều trị với linagliptin làm giảm osteopontin, chất đánh dấu sự vôi hóa mạch máu và tiến triển bệnh thận (16). Kết quả này được ủng hộ thêm bởi nhiều nghiên cứu thực nghiệm khác về thuốc ức chế DPP-4 cho thấy lợi ích của sitagliptin và vildagliptin trên albumin niệu và chức năng thận ở mô hình bệnh thận do đái tháo đường (18-20). Cũng có những bằng chứng từ nghiên cứu thực nghiệm cho thấy điều trị với đối kháng thụ thể GLP-1, như exendin-4 hoặc liraglutide, làm giảm stress oxid hóa và sự bài tiết albumin niệu thông qua việc tăng sự biểu lộ thụ thể GLP-1 (22) hoặc thông qua protein kinase A- sự ức chế qua trung gian của oxidase NADPH thận, độc lập với hiệu quả giảm đường huyết (17). Liên kết lại với nhau, những đặc điểm tiền lâm sàng này đưa ra khả năng ảnh hưởng trên thận của thuốc ức chế DPP-4 hoặc thậm chí tất cả các trị liệu dựa trên incretin. Tuy nhiên, những biến đổi trong cách thiết kế nghiên cứu thực nghiệm, nồng độ thuốc, và sự khác biệt về dược lý giữa các thuốc như thời gian bán hủy, xâm nhập mô, chuyển hóa thuốc, và bài tiết thuốc, không cho phép ngoại suy kết quả từ nghiên cứu trên động vật vào điều kiện lâm sàng ở người.
Đến bây giờ, chứng cứ lâm sàng của điều trị dựa trên incretin ở bệnh nhân đái tháo đường type 2 là hiếm. Một nghiên cứu gần đây ngẫu nhiên, mù đôi, so sánh sitagliptin với sulfonylurease glipizide hơn 54 tuần ở bệnh nhân đái tháo đường type 2 và suy thận vừa đến nặng (23). Mặc dù có sự cải thiện HbA1c rõ so với ban đầu (khoảng -0.8% [-8.7 mmol/mol] ở thời điểm cuối nghiên cứu, sitagliptin có liên quan với tăng UACR từ ban đầu khoảng +18 và +6% sau 24 và 54 tuần điều trị (23). Trong một nghiên cứu khác sử dụng GLP-1 analog đường tiêm, Ryuge và cộng sự (24) tìm thấy liraglutide không có liên quan đến bất kỳ sự thay đổi chức năng thận hoặc albumin niệu sau 24 tuần điều trị ở bệnh nhân có bệnh thận do đái tháo đường. Tuy nhiên, những dữ liệu này phải được diễn giải thận trọng vì cả hai nghiên cứu là nghiên cứu quan sát đánh giá các thông số về thận và không được thiết kế chuyên biệt để đánh giá thay đổi albumin niệu (23,24). Những thử nghiệm lâm sàng có kiểm soát, ngẫu nhiện, tiền cứu hiện tại cần thiết để đánh giá ảnh hưởng thận của điều trị dựa trên incretin ở bệnh nhân đái tháo đường type 2. Nghiên cứu mới bắt đầu gần đây MARLINA (Efficacy, Safety & Modificationof Albuminuria in Type 2Diabetes Subjects with Renal Diseasewith LINAgliptin) (NCT01792518)được thiết kế đặc biệt để đánh giá khả năng làm giảm albumin niệu của linagliptin. Ngoài ra, bằng chứng ảnh hưởng thận của linagliptin cũng mong được phát hiện từ thử nghiệm CAROLINA (CARdiovascularOutcome Study of LINAgliptin VersusGlimepiride in Patients with Type 2Diabetes) (NCT01243424).Nghiên cứu này nhằm đánh giá hiệu quả lâu dài của linagliptin trên tỷ lệ bệnh tật và tử vong khi so sánh trực tiếp sulfonylurea glimepiride và sẽ cung cấp nhiều kết quả liên quan đến hậu quả trên hệ tim mạch không lệ thuộc vào khác biệt về kiểm soát đường huyết (37). Hơn nữa, thử nghiệm này cũng sẽ cho phép nghiên cứu viên so sánh tiến triển bệnh thận , kể cả những thay đổi albumin niệu và/hoặc eGFR. Cần lưu ý, chất đánh dấu tổn thương thận , như suy thận và/hoặc albumin niệu, là vài tiêu chí nhận bệnh nghiên cứu đã được xác định trước trong thử nghiệm CAROLINA. Thử nghiệm CARMELINA (CArdiovascular Safety& Renal Microvascular OutcomE Studywith LINAgliptin) (NCT01897532)cũng mới bắt đầu gần đây. Nghiên cứu này tuyển vào hơn 8000 đối tượng đái tháo đường type 2 và rối loạn chức năng thận và nhằm để tìm hiểu hiệu quả và độ an toàn của linagliptin so với giả dược ở ca hai biến chứng hệ tim mạch và vi mạch máu thận.
Bởi vì phân tích gộp của chúng tôi là hồi cứu, vài giới hạn về phương pháp luận cần được xem xét. Mặc dù dữ liệu gộp từ các nghiên cứu cho phép các nhà điều tra kiểm định giả thuyết ban đầu sử dụng cỡ mẫu thích hợp, phân tích của chúng tôi liên quan đến các thử nghiệm lâm sàng không được thiết kế từ đầu để đánh giá sự thay đổi UACR. Vì lí do này, các kết quả của nghiên cứu này nên được diễn giải từ đầu đối với việc đặt ra giả thuyết. Ngoài ra, hầu hết bệnh nhân trong bộ dữ liệu phân tích ban đầu được điều trị với nhiều thuốc hạ áp, và sự khác biệt về sự ức chế RAAS ổn định trong điều trị ban đầu có thể làm sai lệch kết quả của chúng tôi. Tuy nhiên, điều trị hạ áp lúc đưa vào nghiên cứu cân bằng giữa hai nhóm, và bệnh nhân cần điều chỉnh liều thuốc ức chế RAAS bị loại ra khỏi bộ dữ liệu phân tích ban đầu. Hơn nữa, thay đổi albumin niệu không xảy ra đồng thời với bất kỳ sự thay đổi huyết áp, cho thấy không có ảnh hưởng của điều trị hạ áp ban đầu lên hiệu quả làm giảm albumin niệu của linagliptin. Giới hạn khác là đánh giá UACR dựa trên một mẩu nước tiểu; điều này có thể làm giảm sự chính xác của kết quả vì sự tiết albumin niệu thay đổi ở mỗi bệnh nhân. Tuy nhiên, albumin niệu được đánh giá ở ba thời điểm độc lập (lúc ban đầu, 12 và 24 tuần), và được thực hiện ở một phòng xét nghiệm trung tâm để giảm thiểu sai số. Hơn nữa, kết quả của phân tích gộp này bị giới hạn trong những bệnh nhân đái tháo đường type 2 và có mức độ tiểu đạm UACR 30-3000 mg/g Cr đang dùng liều ổn định thuốc ức chế RAAS. Vì vậy, kết quả này không thể ngoại suy cho tất cả bệnh nhân đái tháo đường type 2 và bệnh thận. Cuối cùng, mặc dù protein niệu/albumin niệu là một yếu tố dự đoán tăng nguy cơ tim mạch của đái tháo đường, nhưng nó chỉ liên quan đến giảm tiến triển của chức năng thận và nguy cơ toàn bộ của ESRD ở bệnh nhân đái tháo đường type 2 có protein/albumin niệu rõ (38). Tuy nhiên, việc phòng ngừa albumin niệu mới khởi phát không làm giảm nguy cơ bệnh thận mạn trong đái tháo đường (39,40). Vì vậy, phân tích này không thể cung cấp bằng chứng để kết luận về cải thiện hậu quả trên thận lâu dài với linagliptin.
Tóm lại, phân tích gộp này phát hiện linagliptin thêm vào điều trị ACEI hoặc ARB ổn định làm giảm đáng kể albumin niệu sau 24 tuần điều trị. Dữ liệu của chúng tôi ủng hộ giả thuyết giảm albumin niệu nhiều hơn với cặp đôi ức chế RAAS và DPP-4. Để chứng minh cho những đặc điểm của giả thuyết này, nghiên cứu lâm sàng tiền cứu đã bắt đầu. Những nỗ lực như vậy sẽ nêu ra vấn đề y khoa quan trọng cần thiết chưa được giải quyết ở bệnh nhân đái tháo đường type 2 và bệnh thận.
MỤC LỤC
1. National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis 2002; 39:S1–266
2. Coresh J, Selvin E, Stevens LA, et al. Prevalence of chronic kidney disease in the United States. JAMA 2007;298:2038– 2047
3. de Zeeuw D, Remuzzi G, Parving HH, et al. Albuminuria, a therapeutic target for cardiovascular protection in type 2 diabetic patients with nephropathy. Circulation 2004;110:921–927
4. Ninomiya T, Perkovic V, de Galan BE, et al.; ADVANCE Collaborative Group. Albuminuria and kidney function independently predict cardiovascular and renal outcomes in diabetes. J Am Soc Nephrol 2009;20:1813–1821
5. Parving HH, Lewis JB, Ravid M, Remuzzi G, Hunsicker LG; DEMAND investigators. Prevalence and risk factors for microalbuminuria in a referred cohort of type II diabetic patients: a global perspective. Kidney Int 2006;69:2057–2063
6. Gerstein HC, Mann JF, Yi Q, et al.; HOPE Study Investigators. Albuminuria and risk of cardiovascular events, death, and heart failure in diabetic and nondiabetic individuals. JAMA 2001;286:421–426
7. Matsushita K, van der Velde M, Astor BC, et al.; Chronic Kidney Disease Prognosis Consortium. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet 2010;375:
2073–2081
8. American Diabetes Association. Standards of medical care in diabetes–2012. Diabetes Care 2012;35(Suppl 1):S11–S63
9. Brenner BM, Cooper ME, de Zeeuw D, et al.; RENAAL Study Investigators. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001;345:861–869
10. Lewis EJ, Hunsicker LG, ClarkeWR, et al.; Collaborative Study Group. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001;345:851–860
11. de Zeeuw D, Remuzzi G, Parving HH, et al. Proteinuria, a target for renoprotection in patients with type 2 diabetic nephropathy: lessons from RENAAL. Kidney Int 2004;65:2309–2320
12. Eijkelkamp WB, Zhang Z, Remuzzi G, et al. Albuminuria is a target for renoprotective therapy independent from blood pressure in patients with type 2 diabetic nephropathy: post hoc analysis from the Reduction of Endpoints in NIDDM with the Angiotensin II Antagonist Losartan (RENAAL) trial. J Am Soc Nephrol 2007;18:1540–1546
13. Pohl MA, Blumenthal S, Cordonnier DJ, et al. Independent and additive impact of blood pressure control and angiotensin II receptor blockade on renal outcomes in the irbesartan diabetic nephropathy trial: clinical implications and limitations. J Am Soc Nephrol 2005;16:3027–3037
14. Keane WF, Zhang Z, Lyle PA, et al.; RENAAL Study Investigators. Risk scores for predicting outcomes in patients with type 2 diabetes and nephropathy: the RENAAL study. Clin J Am Soc Nephrol 2006;1:761–767
15. Remuzzi G, Benigni A, Remuzzi A. Mechanisms of progression and regression of renal lesions of chronic nephropathies and diabetes. J Clin Invest 2006; 116:288–296
16. Alter ML, Ott IM, von Websky K, et al. DPP-4 inhibition on top of angiotensin receptor blockade offers a new therapeutic approach for diabetic nephropathy. Kidney Blood Press Res 2012;36:119–130
17. Hendarto H, Inoguchi T, Maeda Y, et al. GLP-1 analog liraglutide protects against oxidative stress and albuminuria in streptozotocin-induced diabetic rats via protein kinase A-mediated inhibition of renal NAD(P)H oxidases. Metabolism 2012;61:1422–1434
18. Hocher B, Reichetzeder C, Alter ML. Renal and cardiac effects of DPP4 inhibitorsdfrom preclinical development to clinical research. Kidney Blood Press Res 2012;36:65–84
19. Liu WJ, Xie SH, Liu YN, et al. Dipeptidyl peptidase IV inhibitor attenuates kidney injury in streptozotocin-induced diabetic rats. J Pharmacol Exp Ther 2012;340: 248–255
20. Mega C, de Lemos ET, Vala H, et al. Diabetic nephropathy amelioration by a low-dose sitagliptin in an animal model of type 2 diabetes (Zucker diabetic fatty rat). Exp Diabetes Res 2011;2011:162092
21. Panchapakesan U, Mather A, Pollock C. Role of GLP-1 and DPP-4 in diabetic nephropathy and cardiovascular disease. Clin Sci (Lond) 2013;124:17–26
22. Park CW, Kim HW, Ko SH, et al. Longterm treatment of glucagon-like peptide-1 analog exendin-4 ameliorates diabetic nephropathy through improving metabolic anomalies in db/db mice. J Am Soc Nephrol 2007;18:1227–1238
23. Arjona Ferreira JC, Marre M, Barzilai N, et al. Efficacy and safety of sitagliptin versus glipizide in patients with type 2 diabetes and moderate-to-severe chronic renal insufficiency. Diabetes Care 2013; 36:1067–1073
24. Ryuge A, Minoru K, Yu K, et al. Examination of the effects of liraglutide on diabetic nephropathy. Kidney Res Clin Pract 2012;31:A70
25. Del Prato S, Barnett AH, Huisman H, Neubacher D, Woerle HJ, Dugi KA. Effect of linagliptin monotherapy on glycaemic control and markers of b-cell function in patients with inadequately controlled type 2 diabetes: a randomized controlled trial. Diabetes Obes Metab
2011;13:258–267
26. Haak T, Meinicke T, Jones R, Weber S, von Eynatten M, Woerle HJ. Initial combination of linagliptin and metformin improves glycaemic control in type 2 diabetes: a randomized, double-blind, placebo-controlled study. Diabetes Obes Metab 2012;14:565–574
27. Owens DR, Swallow R, Dugi KA, Woerle HJ. Efficacy and safety of linagliptin in persons with type 2 diabetes inadequately
controlled by a combination of metformin and sulphonylurea: a 24-week randomized study. Diabet Med 2011;28: 1352–1361
28. Taskinen MR, Rosenstock J, Tamminen I, et al. Safety and efficacy of linagliptin as add-on therapy to metformin in patients
with type 2 diabetes: a randomized, double-blind, placebo-controlled study. Diabetes Obes Metab 2011;13:65–74







