BS.CKII. LÝ ÍCH TRUNG1
ThS.BSNT. NGUYỄN NHẬT TÀI2
1Trưởng khoa Tim mạch can thiệp, Bệnh viện Chợ Rẫy
2Bộ môn Nội tổng quát, Trường Y, Đại học Y Dược TP. HCM
Mục tiêu chuyên đề
- Hiểu được cơ sở, nguyên lý của kháng đông trong can thiệp mạch vành
- Sử dụng thuốc kháng đông trong can thiệp mạch vành
- Lựa chọn kháng đông cá thể hóa cho một số trường hợp cụ thể
TỔNG QUAN
Trong hai thập kỷ qua, đã có sự ra đời của nhiều loại thuốc mới nhằm cải thiện kết cục cho bệnh nhân sau can thiệp mạch vành qua da (PCI). Tối ưu hóa hiệu quả phòng ngừa thiếu máu cục bộ đồng thời giảm thiểu biến chứng chảy máu vẫn là nền tảng của thực hành dược lý hiện đại. Đáng chú ý, giai đoạn này chứng kiến sự tiến bộ trong PCI nhờ sử dụng đường vào động mạch quay, các thuốc ức chế thụ thể P2Y12 mạnh hơn, cùng với sự xuất hiện của các thang điểm dự đoán nguy cơ chảy máu (như CRUSADE). Những tiến bộ này, kết hợp với cải thiện công nghệ của stent phủ thuốc, đã giúp giảm thiểu đồng thời nguy cơ thiếu máu cục bộ và biến cố chảy máu trong PCI.
Heparin, enoxaparin và bivalirudin hiện là những thuốc kháng đông được sử dụng rộng rãi nhất trong thực hành PCI hiện nay và là nền tảng của các khuyến cáo từ các hội tim mạch lớn. Chuyên đề này sẽ bàn luận về cơ sở sinh học của xơ vữa – huyết khối và vai trò trung tâm của nó là thrombin; dược lý của các thuốc kháng đông đang được dùng hiện nay và các mục tiêu điều trị trong tương lai. Đồng thời, chúng ta cũng sẽ xem xét các thử nghiệm kinh điển làm nền tảng cho việc sử dụng kháng đông ở bệnh nhân STEMI, NSTEMI và được thực hiện PCI chương trình.
SINH LÝ BỆNH CỦA XƠ VỮA – HUYẾT KHỐI
Hệ thống đông máu phản ánh sự tương tác phức tạp giữa các protein đông máu, tiểu cầu và màng phospholipid của tế bào, không chỉ ở tế bào nội mô mạch máu mà còn ở nhiều loại tế bào viêm như bạch cầu đơn nhân và tế bào cơ trơn mạch máu. Nội dung dưới đây tập trung vào các yếu tố đông máu là mục tiêu điều trị, mặc dù các phác đồ chống huyết khối hiện đại còn có những tác động lên huyết khối qua trung gian tiểu cầu và chức năng nội mô mạch máu.
Vai trò trung tâm của Thrombin
Sự phá vỡ tính toàn vẹn của lớp nội mô và sự biểu hiện các phân tử gây huyết khối như tissue factor (TF) (hay là yếu tố mô) dẫn đến kích hoạt các protein đông máu hòa tan (Hình 1). Dòng thác đông máu này hội tụ vào sự hình thành yếu tố Xa hoạt hóa (FXa) và phức hợp prothrombinase, từ đó chuyển prothrombin thành thrombin.
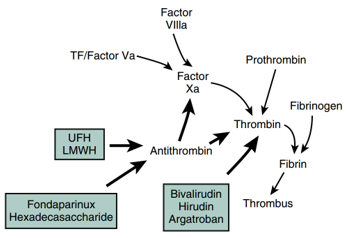
Hình 1. Mối liên quan giữa các yếu tố đông máu và huyết khối động mạch
Sự tạo thành thrombin dẫn đến nhiều tác động thúc đẩy hình thành huyết khối. Cụ thể: (1) Thrombin xúc tác chuyển fibrinogen thành fibrin, tạo nên cấu trúc cục máu đông (2) Thrombin hoạt hóa các yếu tố V, VIII và X, qua đó tự khuếch đại quá trình tạo thrombin. Qua hoạt hóa các thụ thể PAR-1 và PAR-4, thrombin kích hoạt tiểu cầu, làm tăng biểu hiện CD40 ligand, P-selectin, thụ thể GP IIb/IIIa và phóng thích các chất có hoạt tính mạch như ADP, serotonin và thromboxane A₂ (TxA₂).
Tác động trực tiếp của thrombin lên tế bào nội mô và cơ trơn làm tăng biểu hiện các phân tử bám dính, tạo điều kiện cho tiểu cầu và bạch cầu bám vào thành mạch. Thrombin làm tăng tính thấm màng nội mô, góp phần vào quá trình viêm qua trung gian tế bào và cytokine trong thành mạch. Thrombin gây giãn mạch khi nội mô còn nguyên vẹn, nhưng gây co mạch khi nội mô bị tổn thương hoặc mất. Ngoài ra, thrombin thúc đẩy sản xuất cytokine từ nguyên bào sợi và có tác dụng kích thích tăng sinh (Hình 2).
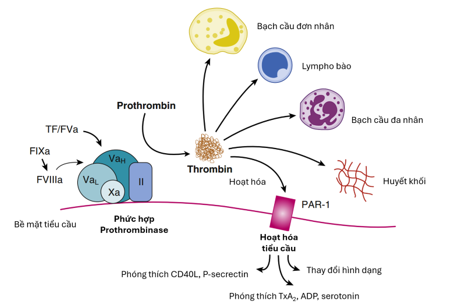
Hình 2. Vai trò trung tâm của thrombin trong hình thành huyết khối và phản ứng viêm
Mặc dù thrombin có thời gian bán hủy ngắn, trong bối cảnh nội mô bình thường, hoạt động của thrombin được kiểm soát chặt chẽ nhờ cơ chế phản hồi âm. Antithrombin là một glycoprotein chuỗi đơn do gan sản xuất, có khả năng gắn với thrombin, FXa và FIXa theo tỷ lệ tương đương. Tác dụng của antithrombin tăng lên hơn một nghìn lần khi gắn với heparin chứa chuỗi pentasaccharide. Pentasaccharide này giúp heparin gắn vào antithrombin và làm tăng ái lực gắn với thrombin và các yếu tố đông máu khác. Antithrombin cũng được hoạt hóa bởi heparan sulfate trên bề mặt tế bào nội mô.
Ngoài ra, thrombin còn bị bất hoạt thông qua gắn kết với thrombomodulin và protein C cùng protein S, từ đó bất hoạt các yếu tố Va và VIIIa ở phía thượng nguồn, đồng thời thúc đẩy giải phóng TPA (tissue plasminogen activator hay hoạt hóa plasminogen mô).
Như vậy, thrombin giữ vai trò trung tâm trong đáp ứng của thành mạch đối với tổn thương do bóng và stent trong PCI và vẫn là mục tiêu điều trị then chốt nhằm phòng biến chứng thiếu máu cục bộ trong PCI. Sơ đồ cấu trúc phân tử thrombin được thể hiện ở Hình 3. Các vị trí nhận diện cơ chất riêng biệt tham gia vào quá trình gắn heparin, fibrinogen và thrombomodulin; trong khi vị trí xúc tác (catalytic site) chịu trách nhiệm cho hoạt tính serine protease sẽ bị phong tỏa bởi các thuốc ức chế thrombin trực tiếp.
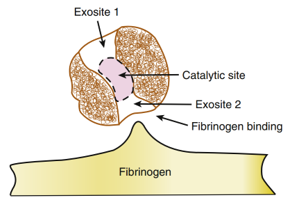
Hình 3. Các vị gắn kết trên phân tử thrombin
Cơ sở của việc dùng kháng đông trong PCI
Trong quá trình PCI, nguy cơ huyết khối hình thành là đáng kể do nhiều cơ chế phối hợp. Trước hết, ngược lại với nội mô lành mạnh, vốn chủ động chống lại huyết khối, các bề mặt nhân tạo khi máu tiếp xúc với các dụng cụ có bề mặt nhân tạo như sheath, catheter, wire, bóng và stent sẽ thúc đẩy quá trình đông máu thông qua một chuỗi các cơ chế phức tạp liên kết với nhau, bao gồm sự hấp phụ protein, bám của tiểu cầu, bạch cầu và hồng cầu, sinh thrombin và kích hoạt hệ thống bổ thể (Hình 4).
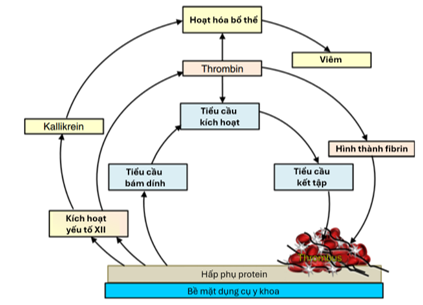
Hình 4. Cơ chế hình thành huyết khối trên bề mặt các dụng cụ trong can thiệp mạch vành
Ngoài ra, thao tác can thiệp còn có thể gây tổn thương nội mô, làm lộ collagen và yếu tố mô (TF), kích hoạt cả đường đông máu nội sinh lẫn ngoại sinh, thúc đẩy hình thành thrombin. Bên cạnh đó, sự chiếm chỗ của dụng cụ trong lòng mạch gây giảm dòng chảy cục bộ, tạo môi trường ứ trệ thuận lợi cho fibrin và cục máu đông hình thành. Bề mặt bóng và stent sau khi nong cũng có tính sinh huyết khối cao cho tới khi được tái tạo nội mô hoàn toàn. Tổng hợp các yếu tố này khiến huyết khối trong thủ thuật trở thành biến chứng thường trực cần được phòng ngừa.
Vì vậy, sử dụng kháng đông trong PCI là bắt buộc để giảm sự hình thành thrombin và hạn chế lắng đọng fibrin trên bề mặt dụng cụ; các thuốc như UFH, enoxaparin hay bivalirudin sẽ được trình bày chi tiết ở phần tiếp theo. Mục tiêu chung là duy trì mức chống đông phù hợp trong toàn bộ thủ thuật nhằm ngăn huyết khối trong thủ thuật và đảm bảo an toàn tối ưu cho bệnh nhân.
CÁC THUỐC KHÁNG ĐÔNG TRONG CAN THIỆP MẠCH VÀNH QUA DA
Heparin không phân đoạn (Unfractionated Heparin – UFH)
Heparin không phân đoạn (UFH) là một nhóm glycosaminoglycan dị hợp với các chiều dài khác nhau (5.000-30.000 Da) có ái lực cao với antithrombin. Sự gắn kết này làm tăng khả năng bất hoạt enzym của antithrombin trên thrombin, FXa và FIXa, nhưng tác dụng mạnh nhất vẫn là trên thrombin. UFH được coi là thuốc kháng thrombin gián tiếp vì tác dụng của nó phụ thuộc vào việc đồng thời gắn vào antithrombin và thrombin (Hình 5A). Khoảng hai phần ba các chế phẩm UFH chứa các phân tử ngắn (<18 saccharide) không đủ chiều dài để gắn đồng thời antithrombin và thrombin, do đó không biểu hiện hoạt tính kháng thrombin. Tuy nhiên, tác dụng kháng FXa của heparin không phụ thuộc vào việc gắn đồng thời với cả antithrombin và FXa, nên tác dụng antithrombin vẫn được quan sát ở UFH với kích thước chiều dài saccharide thay đổi.
Hạn chế của UFH bao gồm: kích hoạt tiểu cầu, phụ thuộc mức antithrombin, gắn không đặc hiệu với protein huyết tương và không ức chế được thrombin đã gắn vào cục máu đông. Thêm vào đó, sự gắn trực tiếp với platelet factor IV (yếu tố tiểu cầu IV) có thể gây giảm tiểu cầu do heparin (HIT) ở 1–3% bệnh nhân được điều trị. Sự hoạt hóa tiểu cầu do heparin được chứng minh qua tăng biểu hiện các phân tử kết dính trên bề mặt tiểu cầu.
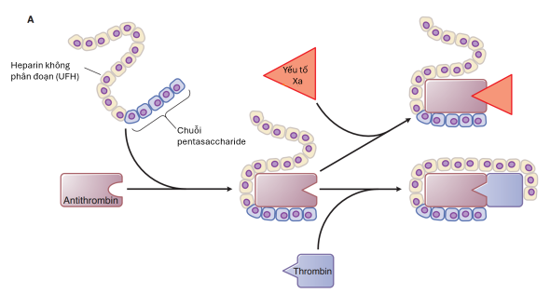
Hình 5A. Cơ chế tác động của heparin không phân đoạn (UFH). Heparin gắn vào antithrombin, làm tăng ức chế yếu tố Xa; chỉ các chuỗi heparin đủ dài (≥18 đơn vị saccharide) mới bắc cầu và ức chế được thrombin.
Theo dõi
UFH gắn mạnh vào các protein huyết tương, dẫn đến mức heparin tự do trong tuần hoàn khó dự đoán. Thuốc có biến thiên đáng kể về tác dụng chống đông nên cần được theo dõi chặt chẽ. Phần lớn tác dụng kháng đông của UFH là ngắn hạn. Các hạn chế khác gồm cần phải truyền tĩnh mạch liên tục và biến chứng hiếm nhưng nghiêm trọng là giảm tiểu cầu do heparin (HIT). UFH thường được theo dõi bằng aPTT, nhưng có sự khác biệt giữa các thuốc thử aPTT thương mại. Một vấn đề khác là aPTT kéo dài khi nồng độ heparin vượt quá 1 U/mL. Điều này thường xảy ra trong phẫu thuật bắc cầu động mạch vành và can thiệp mạch vành qua da khi sử dụng liều heparin rất cao. Trong những trường hợp này, việc theo dõi được thực hiện bằng thời gian đông máu hoạt hóa (ACT). Các nghiên cứu trước đây trong thời kỳ chỉ sử dụng aspirin đã xác định một cửa sổ điều trị hẹp cho UFH và mức ACT thấp hơn có thể liên quan đến tần suất thiếu máu cục bộ cao hơn. Mức ACT thấp đến khoảng 200 giây không liên quan đến tần suất thiếu máu cục bộ thấp hơn, nhưng mức ACT cao hơn và liều UFH theo cân nặng có thể dẫn đến chảy máu nhiều hơn. Cần lưu ý rằng các loại thiết bị khác nhau để đo ACT có thể cho kết quả khác nhau. Các hướng dẫn trong PCI khuyến cáo mức ACT từ 200–250 giây sau liều bolus UFH ban đầu 50–70 U/kg khi sử dụng các chất ức chế GP IIb‐IIIa. Khi không sử dụng chất ức chế GPIIb/IIIa, mục tiêu là mức ACT 250–300 giây (với thiết bị HemoTec) hoặc 300–350 giây (với thiết bị Hemochron) sau liều bolus ban đầu 70–100 U/kg UFH.
Hóa giải
Heparin có thời gian bán thải tương đối ngắn; tuy nhiên, đáp ứng của thuốc trở nên phi tuyến tính khi dùng ở liều điều trị. Thời gian bán thải của heparin tăng từ khoảng 30 phút sau khi tiêm bolus tĩnh mạch 25 U/kg lên 60 phút với bolus 100 U/kg và lên 150 phút với bolus 400 U/kg. Protamine sulfate đường tĩnh mạch có thể được sử dụng khi cần đảo ngược tác dụng của heparin ngay lập tức. Khi bệnh nhân đang truyền heparin liên tục, chỉ cần xem xét lượng heparin được dùng trong 1–2 giờ trước đó để tính liều protamine vì thời gian bán thải ngắn. Truyền protamine chậm giúp giảm nguy cơ nhịp chậm và hạ huyết áp (không truyền nhanh hơn 20 mg/phút và không quá 50 mg trong 10 phút). Sau khi dùng protamine, aPTT sẽ trở về bình thường. Vì protamine có nguồn gốc từ tinh trùng cá, bệnh nhân có tiền sử dị ứng với cá có thể được tiền điều trị bằng corticosteroid và/hoặc kháng histamine.
Heparin trọng lượng phân tử thấp
LMWH (3000-5000 Dalton) được phát triển nhằm tạo hiệu quả kháng đông ổn định và dự đoán được hơn so với UFH. Do có chuỗi polysaccharide ngắn hơn, LMWH có ái lực mạnh hơn với yếu tố Xa, đồng thời ít tác dụng trực tiếp lên thrombin. Thuốc cũng gắn protein huyết tương ít hơn, dẫn đến sinh khả dụng cao hơn, thời gian bán thải dài hơn và hồ sơ chống đông ổn định hơn. Các LMWH khác nhau về đặc tính, thể hiện qua tỷ lệ anti-Xa/thrombin, như enoxaparin 4:1 và dalteparin 2:6. Enoxaparin là thuốc được nghiên cứu nhiều nhất và hiện là LMWH duy nhất được khuyến cáo trong PCI.
LMWH có thể dùng đường tĩnh mạch hoặc dưới da với liều cố định hoặc theo cân nặng mà không cần theo dõi thường quy, ngoại trừ các trường hợp đặc biệt như suy thận, béo phì hoặc trẻ em. Nhờ ít gắn protein, LMWH có thanh thải ít phụ thuộc liều và giảm nguy cơ chảy máu hơn UFH thông qua giảm tính thấm thành mạch, giảm hoạt hóa tiểu cầu và giảm nguy cơ HIT, mặc dù bằng chứng lâm sàng về điểm này vẫn chưa hoàn toàn đồng nhất.
Theo dõi
Mặc dù các thử nghiệm trước đây cho thấy LMWH an toàn khi phối hợp với các thuốc ức chế GP IIb/IIIa, việc theo dõi mức độ kháng đông vẫn rất quan trọng, đặc biệt ở các nhóm nguy cơ cao như người lớn tuổi, béo phì hoặc suy thận. Vì LMWH chỉ tác động tối thiểu lên thrombin, thuốc chỉ làm thay đổi aPTT nhẹ. Không giống UFH, vốn được theo dõi bằng ACT. LMWH không làm kéo dài ACT một cách đáng kể nên ACT không thể sử dụng đáng tin cậy trong PCI.
Đo nồng độ anti-Xa phản ánh chính xác nhất mức độ chống đông của LMWH, do thuốc chủ yếu có hoạt tính chống yếu tố Xa. Nồng độ anti-Xa đạt đỉnh sau 3–5 giờ khi dùng LMWH dưới da, nhưng kéo dài hơn ở bệnh nhân suy thận. Dù chưa xác định rõ ngưỡng tối ưu, nhiều nghiên cứu gợi ý khoảng điều trị 0,5–1,8 IU/mL. Một số phương pháp xét nghiệm POCT đã được phát triển nhưng chưa phổ biến trong thực hành.
Một số xét nghiệm tại giường như Heptest hoặc HEMONOX CT cho thấy sự tương quan tốt với nồng độ anti-Xa, trong đó HEMONOX CT đã được chứng minh có khả năng theo dõi enoxaparin trong PCI ngay cả khi phối hợp với GP IIb/IIIa. Dù các dữ liệu này còn hạn chế, chúng cho thấy tiềm năng của POCT trong những bối cảnh cần theo dõi sát hơn.
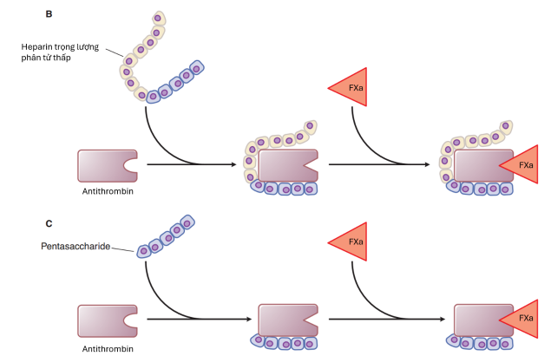
Hình 5B và 5C. Cơ chế tác dụng của Heparin trọng lượng phân tử thấp (LMWH) và Fondaparinux (chuỗi pentasaccharide tổng hợp). B. LMWH có khả năng khuếch đại ức chế yếu tố Xa bởi antithrombin lớn hơn so với ức chế thrombin, vì ít nhất một nửa các chuỗi LMWH (trọng lượng phân tử trung bình 4.500–5.000 Da) quá ngắn để nối antithrombin với thrombin. C. Pentasaccharide chỉ tăng tốc ức chế yếu tố Xa bởi antithrombin; pentasaccharide quá ngắn để nối antithrombin với thrombin.
Theo dõi LMWH không bắt buộc trong mọi trường hợp, nhưng hữu ích ở bệnh nhân nguy cơ chảy máu cao, như người lớn tuổi, tiền sử xuất huyết tiêu hóa hoặc suy thận. Độ thanh thải hoạt tính anti-Xa của LMWH liên quan chặt chẽ tới mức lọc cầu thận và giảm thanh thải làm tăng nguy cơ chảy máu nặng. Ở bệnh nhân béo phì, liều LMWH dựa theo cân nặng cho thấy nồng độ anti-Xa đạt mức điều trị với enoxaparin đến 144 kg, dalteparin đến 190 kg và tinzaparin đến 165 kg.
Cho đến khi có khuyến cáo thống nhất về theo dõi LMWH, hướng dẫn hiện nay đề xuất bổ sung liều dựa trên thời điểm dùng liều gần nhất. Không cần thêm chống đông nếu bệnh nhân dùng enoxaparin trong vòng 8 giờ trước PCI. Nếu liều cuối cách 8–12 giờ, cần bolus enoxaparin IV 0,3 mg/kg tại thời điểm PCI. Nếu quá 12 giờ, nên dùng phác đồ chống đông tiêu chuẩn khác.
Hóa giải
Thời gian bán hủy của LMWH là 3–6 giờ sau khi tiêm dưới da, nhưng kéo dài hơn ở bệnh nhân mắc bệnh thận. Protamine sulfate chỉ đảo ngược một phần tác dụng của LMWH vì thuốc chỉ trung hòa được hoạt tính chống yếu tố IIa, trong khi hầu như không ảnh hưởng đến hoạt tính chống yếu tố Xa. Khi cần đảo ngược tác dụng ngay lập tức, khuyến cáo dùng 1 mg protamine sulfate cho mỗi 100 đơn vị anti-Xa của LMWH đã dùng trong 8 giờ trước đó (tương đương 1 mg enoxaparin bằng 100 đơn vị anti-Xa). Nếu chảy máu vẫn tiếp diễn, có thể dùng liều thứ hai với 0,5 mg protamine sulfate cho mỗi 100 đơn vị anti-Xa (hoặc mỗi 1 mg enoxaparin đã dùng). Liều tối đa cho một lần dùng protamine sulfate là 50 mg.
Fondaparinux
Fondaparinux là một pentasaccharide tổng hợp, mô phỏng chuỗi hoạt tính sinh học của heparin khi tương tác với antithrombin. Do các phân tử này ngắn, tác dụng chính là ức chế FXa. Những thuốc này có thời gian bán hủy tương đối dài, do đó chỉ cần dùng một lần mỗi ngày. Chúng không thể đảo ngược bằng protamine và nếu cần phải đảo ngược thì phải dùng yếu tố VII đậm đặc. Fondaparinux không ảnh hưởng đến APTT, PT hay ACT và do đó không cần theo dõi định kỳ. Khi cần, có thể sử dụng xét nghiệm anti-Xa đặc hiệu cho fondaparinux, nhưng không có khoảng điều trị rõ ràng như LMWH. Ở liều điều trị, nồng độ đỉnh khi đạt trạng thái ổn định nên vào khoảng 1,20–1,26 mg/L sau 3 giờ. Hiện tại không có xét nghiệm tại giường nào có thể dùng trong PCI.
Nhóm thuốc ức chế trực tiếp thrombin
Thuốc ức chế thrombin trực tiếp là các phân tử nhỏ gắn vào thrombin (cả dạng tự do và gắn fibrin) và ức chế quá trình chuyển fibrinogen thành fibrin cũng như kích hoạt các yếu tố FV, FVII và FIX. Chúng có đặc tính dự đoán hơn heparin vì không hoạt hóa tiểu cầu và không gắn vào protein huyết tương. Do không kích hoạt tiểu cầu, thuốc không tương tác với yếu tố tiểu cầu 4, loại trừ khả năng giảm tiểu cầu do heparin (HIT) qua trung gian miễn dịch. Vì vậy, thuốc ức chế thrombin trực tiếp là lựa chọn an toàn thay thế heparin cho PCI ở bệnh nhân có HIT. Hai thuốc hiện có thể dùng trong PCI là bivalirudin và argatroban.
Bivalirudin
Bivalirudin là đồng phân tổng hợp của hirudin, bị thrombin phân giải chậm và chỉ ức chế thrombin tạm thời. Thuốc có tác dụng nhanh, đạt mức ACT điều trị trong 5 phút và thời gian bán hủy ngắn khoảng 25 phút, giúp giảm nguy cơ chảy máu, phù hợp sử dụng trong PCI. Các nghiên cứu cho thấy bivalirudin làm giảm tỷ lệ chảy máu so với heparin khi dùng cùng thuốc tiêu sợi huyết trong nhồi máu cơ tim cấp và đau thắt ngực không ổn định.
Theo dõi
Thuốc thường được dùng ngay trước PCI với liều bolus 0,75 mg/kg IV, sau đó truyền liên tục 1,75 mg/kg/giờ. Bivalirudin được thải trừ qua thận; không cần điều chỉnh liều nếu CrCl ≥30 mL/phút. Nếu CrCl 10–29 mL/phút, giảm tốc độ truyền còn 1 mg/kg/giờ, và giảm còn 0,25 mg/kg/giờ nếu bệnh nhân đang chạy thận nhân tạo. Truyền có thể tiếp tục đến 4 giờ sau PCI theo quyết định của bác sĩ. Bivalirudin có thể làm tăng các xét nghiệm đông máu: aPTT, PT, INR và ACT. Theo dõi thường quy không bắt buộc nhưng có thể thực hiện bằng ACT. Trong thử nghiệm REPLACE-2, ACT trung vị 5 phút sau bolus và truyền liên tục là 358 giây. Nếu ACT <225 giây, cần bolus bổ sung 0,3 mg/kg; nếu >225 giây, không cần theo dõi thêm. Nhờ thời gian bán hủy ngắn (~25 phút), không cần kiểm tra ACT trước khi rút sheath.
Argatroban
Argatroban là thuốc ức chế thrombin trực tiếp tổng hợp nhỏ, gắn hồi phục vào vị trí hoạt động của thrombin. Thuốc được chuyển hóa qua gan và có thời gian bán hủy khoảng 45 phút. Khi dùng phối hợp với liệu pháp tiêu sợi huyết, argatroban cho thấy tỷ lệ TIMI III cao hơn so với heparin, nhưng không khác biệt về tổng tử vong, nhồi máu tái phát, tái thông mạch hay đột quỵ thiếu máu. Nhóm argatroban có xu hướng giảm chảy máu không đáng kể.
Theo dõi
Thuốc có thể làm tăng nhiều xét nghiệm: aPTT, PT, ACT và ecarin clotting time (ECA-T) – xét nghiệm chỉ nhạy với thuốc ức chế thrombin trực tiếp. Có mối quan hệ liều-tác dụng rõ ràng với argatroban, bất kể xét nghiệm sử dụng. Khác với UFH, argatroban làm thay đổi các thông số đông máu nhanh hơn, tăng nhanh sau khi bắt đầu và trở về bình thường nhanh sau khi ngừng thuốc. ACT là phương pháp phù hợp nhất để theo dõi tác dụng argatroban trong PCI.
Ở bệnh nhân có hoặc có nguy cơ HIT, argatroban nên bắt đầu với 25 mcg/kg/phút và bolus 350 mcg/kg truyền tĩnh mạch qua đường lớn trong 3–5 phút. ACT được kiểm tra 5–10 phút sau bolus. Thủ thuật PCI có thể tiến hành nếu ACT >300 giây, đồng thời cần tuân thủ các khuyến cáo về theo dõi và điều chỉnh liều.
Hiện chưa có thuốc đảo ngược đặc hiệu cho các thuốc ức chế thrombin trực tiếp. Ở những người khỏe mạnh với chức năng thận bình thường, các chỉ số đông máu sẽ trở về bình thường trong vòng khoảng 1 giờ sau khi ngừng truyền thuốc. Recombinant yếu tố VIIa có thể giúp giảm một phần tác dụng chảy máu của các thuốc này. Chạy thận nhân tạo có thể loại bỏ khoảng 25% bivalirudin hoặc argatroban.
Bảng 1: Thuốc kháng đông trong các thủ thuật tim mạch
| Thuốc kháng đông | Cơ chế tác dụng | Khởi phát tác dụng (thời gian bán hủy) | Phương pháp theo dõi | Theo dõi POC có sẵn | Thuốc hóa giải |
| Heparin không phân đoạn | Bất hoạt các yếu tố IIa (thrombin), IXa, Xa, XIa và XIIa | Tác dụng ngay khi truyền TM (30–90 phút, phụ thuộc liều) | aPTT | ACT | Protamine sulfate (1mg mỗi 100UI UFH), liều tối đa bolus là 50mg |
| Heparin trọng lượng phân tử thấp | Bất hoạt thrombin (ít ái lực hơn) và yếu tố Xa (ái lực cao hơn) | Tác dụng ngay (Tĩnh mạch 3–5 giờ, tiêm tưới da 3-6 giờ) | Anti-Xa | Không có | Hóa giải 1 phần với Protamin Sulfate (1mg mỗi 100 đơn vị anti-Xa hoặc 1 mg mỗi 1 mg enoxaparin) |
| Bivalirudin | Ức chế thrombin thoáng qua | <5 phút khi truyền TM ( 25 phút, kéo dài hơn nếu suy thận) |
ACT | ACT | Không |
| Argatroban | Ức chế thrombin có thể hồi phục | Tác dụng ngay khi truyền TM ( 30–60 phút) | aPTT | ACT | Không |
| Fondaparinux | Bất hoạt yếu tố Xa | 2 giờ khi tiêm dưới da (17–21 giờ) | Anti-Xa | Không có | Không |
(Vui lòng xem tiếp trong kỳ sau)
TÀI LIỆU THAM KHẢO
- Hartshorne T, Chew DP. Anticoagulation in percutaneous coronary intervention. In: Topol EJ, Teirstein PS, eds. Textbook of Interventional Cardiology. 8th ed. Elsevier; 2019:187-197.
- Rao SV, O’Donoghue ML, Ruel M, et al. 2025 ACC/AHA/ACEP/NAEMSP/SCAI Guideline for the Management of Patients With Acute Coronary Syndromes: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2025;151(13):e771-e862. doi:10.1161/CIR.0000000000001309
- Byrne RA, Rossello X, Coughlan JJ, et al. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J. 2023;44(38):3720-3826. doi:10.1093/eurheartj/ehad191
- Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40(2):87-165. doi:10.1093/eurheartj/ehy394
- Jaffer IH, Fredenburgh JC, Hirsh J, Weitz JI. Medical device-induced thrombosis: what causes it and how can we prevent it?. J Thromb Haemost. 2015;13 Suppl 1:S72-S81. doi:10.1111/jth.12961
- Weitz JI. Blood coagulation and anticoagulant, fibrinolytic, and antiplatelet drugs. In: Brunton LL, Chabner BA, Knollmann BC, eds. Goodman & Gilman’s The Pharmacological Basis of Therapeutics. 12th ed. McGraw-Hill; 2011:849-876.
- Yost GW, Steinhubl SR. Monitoring and Reversal of Anticoagulation and Antiplatelets. Interv Cardiol Clin. 2013;2(4):643-663. doi:10.1016/j.iccl.2013.05.008
- Stone GW, Witzenbichler B, Guagliumi G, et al. Bivalirudin during primary PCI in acute myocardial infarction. N Engl J Med. 2008;358(21):2218-2230. doi:10.1056/NEJMoa0708191
- Steg PG, van ‘t Hof A, Hamm CW, et al. Bivalirudin started during emergency transport for primary PCI. N Engl J Med. 2013;369(23):2207-2217. doi:10.1056/NEJMoa1311096
- Shahzad A, Kemp I, Mars C, et al. Unfractionated heparin versus bivalirudin in primary percutaneous coronary intervention (HEAT-PPCI): an open-label, single centre, randomised controlled trial. Lancet. 2014;384(9957):1849-1858. doi:10.1016/S0140-6736(14)60924-7
- Han Y, Guo J, Zheng Y, et al. Bivalirudin vs heparin with or without tirofiban during primary percutaneous coronary intervention in acute myocardial infarction: the BRIGHT randomized clinical trial. JAMA. 2015;313(13):1336-1346. doi:10.1001/jama.2015.2323
- Erlinge D, Omerovic E, Fröbert O, et al. Bivalirudin versus Heparin Monotherapy in Myocardial Infarction. N Engl J Med. 2017;377(12):1132-1142. doi:10.1056/NEJMoa1706443
- Montalescot G, Zeymer U, Silvain J, et al. Intravenous enoxaparin or unfractionated heparin in primary percutaneous coronary intervention for ST-elevation myocardial infarction: the international randomised open-label ATOLL trial. Lancet. 2011;378(9792):693-703. doi:10.1016/S0140-6736(11)60876-3
- Fifth Organization to Assess Strategies in Acute Ischemic Syndromes Investigators, Yusuf S, Mehta SR, et al. Comparison of fondaparinux and enoxaparin in acute coronary syndromes. N Engl J Med. 2006;354(14):1464-1476. doi:10.1056/NEJMoa055443
- Steg PG, Mehta S, Jolly S, et al. Fondaparinux with UnfracTionated heparin dUring Revascularization in Acute coronary syndromes (FUTURA/OASIS 8): a randomized trial of intravenous unfractionated heparin during percutaneous coronary intervention in patients with non-ST-segment elevation acute coronary syndromes initially treated with fondaparinux. Am Heart J. 2010;160(6):1029-1034.e1. doi:10.1016/j.ahj.2010.07.037
- Ferguson JJ, Califf RM, Antman EM, et al. Enoxaparin vs unfractionated heparin in high-risk patients with non-ST-segment elevation acute coronary syndromes managed with an intended early invasive strategy: primary results of the SYNERGY randomized trial. JAMA. 2004;292(1):45-54. doi:10.1001/jama.292.1.45
- Kastrati A, Neumann FJ, Schulz S, et al. Abciximab and heparin versus bivalirudin for non-ST-elevation myocardial infarction. N Engl J Med. 2011;365(21):1980-1989. doi:10.1056/NEJMoa1109596
- Stone GW, McLaurin BT, Cox DA, et al. Bivalirudin for patients with acute coronary syndromes. N Engl J Med. 2006;355(21):2203-2216. doi:10.1056/NEJMoa062437
- Montalescot G, White HD, Gallo R, et al. Enoxaparin versus unfractionated heparin in elective percutaneous coronary intervention. N Engl J Med. 2006;355(10):1006-1017. doi:10.1056/NEJMoa052711
- Stabile E, Nammas W, Salemme L, et al. The CIAO (Coronary Interventions Antiplatelet-based Only) Study: a randomized study comparing standard anticoagulation regimen to absence of anticoagulation for elective percutaneous coronary intervention. J Am Coll Cardiol. 2008;52(16):1293-1298. doi:10.1016/j.jacc.2008.07.026
- Kastrati A, Neumann FJ, Mehilli J, et al. Bivalirudin versus unfractionated heparin during percutaneous coronary intervention. N Engl J Med. 2008;359(7):688-696. doi:10.1056/NEJMoa0802944
- Schulz S, Mehilli J, Neumann FJ, et al. ISAR-REACT 3A: a study of reduced dose of unfractionated heparin in biomarker negative patients undergoing percutaneous coronary intervention. Eur Heart J. 2010;31(20):2482-2491. doi:10.1093/eurheartj/ehq330
- Huang J, Li N, Li Z, Hou XJ, Li ZZ. Low-Dose Unfractionated Heparin with Sequential Enoxaparin in Patients with Diabetes Mellitus and Complex Coronary Artery Disease during Elective Percutaneous Coronary Intervention. Chin Med J (Engl). 2018;131(7):764-769. doi:10.4103/0366-6999.228251
- Li ZZ, Tao Y, Wang S, et al. Unfractionated Heparin with Sequential Enoxaparin in Patients with Complex Coronary Artery Lesions during Percutaneous Coronary Intervention. Chin Med J (Engl). 2018;131(20):2417-2423. doi:10.4103/0366-6999.243559
- Drouet L, Bal dit Sollier C, Martin J. Adding intravenous unfractionated heparin to standard enoxaparin causes excessive anticoagulation not detected by activated clotting time: results of the STACK-on to ENOXaparin (STACKENOX) study. Am Heart J. 2009;158(2):177-184. doi:10.1016/j.ahj.2009.05.022
- Gurbel PA, Rout A, Tantry US. Monitoring and Reversal of Anticoagulation and Antiplatelet Agents. In: Dangas GD, Di Mario C, Thiele H, et al., eds. Interventional Cardiology: Principles and Practice. 3rd ed. John Wiley & Sons; 2022: 491-502. https://doi.org/10.1002/9781119697367.ch46.







