BS. HUỲNH ANH KIỆT*
BS. NGUYỄN THANH HIỀN
*Khoa nội TM, BV Đại Học Y Dược, Tp Hồ Chí Minh
GIỚI THIỆU
Sốc tim (Cardiogenic Shock – CS) là tình trạng suy tuần hoàn cấp tính nguy kịch, đặc trưng bởi giảm tưới máu mô và rối loạn huyết động tiến triển do suy chức năng bơm của tim, dẫn đến suy đa cơ quan nếu không được can thiệp kịp thời. Trong bối cảnh này, hỗ trợ tuần hoàn cơ học tạm thời (temporary Mechanical Circulatory Support – tMCS) đã trở thành chiến lược điều trị trọng yếu, giúp ổn định huyết động, duy trì tưới máu cơ quan, và đóng vai trò cầu nối hồi phục (Bridge-to-Recovery), cầu nối ra quyết định (Bridge-to-Decision) hoặc chuẩn bị cho điều trị triệt để như ghép tim hoặc đặt thiết bị hỗ trợ thất lâu dài (durable Ventricular Assist Device – VAD).
Tuy nhiên, việc đặt tMCS vẫn còn nhiều thách thức, do thiếu các thử nghiệm ngẫu nhiên có đối chứng ngoài nhóm sốc tim do nhồi máu cơ tim cấp (Acute Myocardial Infarction – AMI-CS) và ngừng tim kháng trị. Phần lớn bằng chứng hiện nay dựa trên dữ liệu quan sát và đồng thuận chuyên gia, đặc biệt ở sốc tim không do thiếu máu cục bộ (non-ischemic CS), khiến thời điểm khởi trị, tiêu chí lựa chọn và chiến lược tối ưu hóa thiết bị vẫn còn nhiều tranh luận. Do đó, hiểu rõ cơ chế hoạt động, chỉ định và vai trò của tMCS, cùng với can thiệp sớm, phối hợp đa chuyên khoa (shock team) là chìa khóa giúp cải thiện tiên lượng, giảm tử vong và tăng cơ hội hồi phục hoặc ghép tim cho bệnh nhân sốc tim [1, 2].
DỊCH TỄ HỌC
Sốc tim là một hội chứng đe dọa tính mạng được định nghĩa bởi giảm tưới máu cơ quan do rối loạn chức năng tim nguyên phát (cơ tim, van tim, dẫn truyền, màng tim). Hậu quả huyết động là giảm cung lượng tim dẫn đến tụt huyết áp và thiếu máu mô hệ thống. Suy giảm co bóp làm khởi phát vòng xoắn bệnh lý: cung lượng tim thấp và tụt huyết áp làm giảm tưới máu cơ tim, nặng thêm thiếu máu cục bộ và tiếp tục giảm chức năng bơm, đồng thời kích hoạt các vòng đáp ứng toàn thân (viêm, co mạch, giữ muối–nước), cuối cùng gây tổn thương đa cơ quan (thận, gan, não) và toan chuyển hóa – kiểu hình sốc huyết–chuyển hóa (hemometabolic shock) ở giai đoạn muộn.
Về nguyên nhân, nhồi máu cơ tim cấp vẫn chiếm ưu thế: các sổ bộ đương đại ghi nhận ≈81% biến cố CS liên quan ACS/AMI, và AMI-CS vẫn là nguyên nhân tử vong hàng đầu ở bệnh nhân AMI. Tỷ lệ sốc tim kèm AMI đã giảm đáng kể theo thời gian nhờ tái tưới máu sớm bằng can thiệp mạch vành qua da: từ mức lịch sử tới ~20% xuống 5–10% (STEMI 5–7%). Bên cạnh AMI, non-AMI CS ngày càng phổ biến: suy tim cấp mất bù (HF-CS) (de novo hoặc cấp trên nền mạn) có thể chiếm >50% trong một số sổ bộ; sốc sau phẫu thuật tim (PCCS) xảy ra ~1–5% nhưng nặng và thường cần dụng cụ hỗ trợ cơ học; các biến chứng cơ học của hội chứng vành cấp (Hở van hai lá cấp, thủng vách liên thất, vỡ thành tự do) đòi hỏi chẩn đoán nhanh bằng siêu âm tim; ngoài ra còn có viêm cơ tim tối cấp, Takotsubo (tỷ lệ CS ~9%), bệnh van giai đoạn cuối và suy thất phải [3, 4].
Mặc dù đã tiến bộ, CS vẫn đi kèm tử vong ngắn hạn rất cao (~30–60%, thường >40%), nhưng các dữ liệu gần đây cho thấy xu hướng cải thiện sống còn. Ở bệnh nhân sốc tim do nhồi máu cơ tim cấp (Killip IV), tử vong nội viện giảm từ 62,2% (1997) xuống 36,3% (2017) tại Thụy Sĩ; ở Tokyo từ 38,5% (2007) xuống 27,2% (2016); trong khi thử nghiệm SHOCK (1993–1997) báo cáo tử vong 53%, các đoàn hệ Hoa Kỳ với quy trình tiêu chuẩn hóa đạt ~28%. Những cải thiện này chủ yếu nhờ: (1) tái tưới máu sớm (PCI) – nền tảng điều trị được thử nghiệm SHOCK chứng minh giảm tử vong 6 tháng và dài hạn; (2) hỗ trợ tuần hoàn cơ học tạm thời (tMCS) như Impella, VA-ECMO – cầu nối phục hồi cơ quan hoặc đến liệu pháp bền vững, góp phần cải thiện sống còn; và (3) đội sốc tim đa chuyên khoa cùng phác đồ chuẩn hóa, giúp chẩn đoán sớm, can thiệp kịp thời và giảm tử vong [5, 6].
ĐỊNH NGHĨA SỐC TIM
Sốc tim là tình trạng giảm tưới máu mô nghiêm trọng do suy chức năng bơm của tim, dẫn đến tụt huyết áp kéo dài và suy đa cơ quan. Thử nghiệm SHOCK (SHould we emergently revascularize Occluded Coronaries for Cardiogenic Shock) đã đặt nền móng cho định nghĩa kinh điển của sốc tim, kết hợp giữa bằng chứng lâm sàng (tụt huyết áp, thiểu niệu, da chi lạnh, lactate > 2 mmol/L) và huyết động học đặc trưng (Cardiac Index ≤ 2,2 L/phút/m², PCWP ≥ 15 mmHg). Định nghĩa này, đặc biệt trong bối cảnh sốc tim do nhồi máu cơ tim cấp (AMI-CS), đã chứng minh lợi ích sống còn rõ rệt của tái tưới máu sớm (PCI hoặc CABG) so với điều trị nội khoa đơn thuần, đồng thời trở thành nền tảng cho các phác đồ xử trí hiện nay.
Trong thực hành hiện đại, dù không còn yêu cầu bắt buộc đo huyết động xâm lấn để chẩn đoán, các thông số huyết động học vẫn giữ vai trò quan trọng trong phân tầng nguy cơ và tiên lượng. Đặc biệt, Cardiac Power Output (CPO < 0,6 W) được xem là chỉ số dự báo tử vong mạnh nhất, và đặt catheter động mạch phổi (PAC) vẫn cần thiết trong các trường hợp sốc tiến triển nhanh, viêm cơ tim tối cấp hoặc nguyên nhân không rõ để xác định cơ chế bệnh sinh và lựa chọn thiết bị hỗ trợ tuần hoàn cơ học (MCS) phù hợp. Như vậy, định nghĩa sốc tim hiện đại kế thừa từ thử nghiệm SHOCK, kết hợp biểu hiện lâm sàng, chỉ số huyết động và dấu hiệu sinh hóa, giúp chuẩn hóa chẩn đoán, phân tầng mức độ nặng và định hướng chiến lược điều trị hiệu quả trong thực hành tim mạch cấp cứu [7].
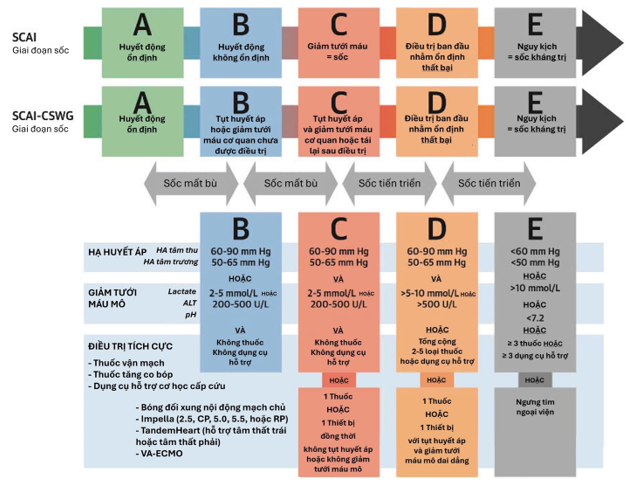
HỆ THỐNG PHÂN LOẠI SỐC TIM THEO SCAI VÀ GIÁ TRỊ TIÊN LƯỢNG
Phân loại sốc tim theo SCAI (2019, cập nhật 2021–2022) là hệ thống đánh giá chuẩn hóa, đơn giản và thực tiễn tại giường, được ACC, AHA, SCCM và STS công nhận, nhằm phân tầng mức độ nặng, định hướng xử trí và tiên lượng lâm sàng cho bệnh nhân sốc tim (Cardiogenic Shock – CS). SCAI chia sốc tim thành 5 giai đoạn tiến triển (Stage A–E), phản ánh liên tục mức độ rối loạn tuần hoàn và giảm tưới máu mô.
- Giai đoạn A (“At risk”): Bệnh nhân chưa có biểu hiện sốc tim nhưng có nguy cơ cao do tổn thương tim cấp (như nhồi máu cơ tim diện rộng hoặc suy tim cấp/mạn mất bù). Huyết áp và tưới máu vẫn bình thường.
- Giai đoạn B (“Beginning” – tiền sốc): Có biểu hiện huyết động bất ổn nhẹ, như hạ huyết áp tương đối (SBP < 90 mmHg) hoặc nhịp nhanh, nhưng chưa có giảm tưới máu mô. Đây là giai đoạn tiền sốc, chủ yếu biểu hiện bằng tụt huyết áp đơn thuần.
- Giai đoạn C (“Classic Shock”): Giảm tưới máu mô rõ, cần can thiệp điều trị (dùng thuốc, bù dịch hoặc hỗ trợ cơ học) để khôi phục tưới máu. Đây là giai đoạn sốc tim điển hình, biểu hiện bằng tụt huyết áp, thiểu niệu, da lạnh, lactate tăng, thường là giai đoạn mà tất cả bệnh nhân sốc tim đều trải qua.
- Giai đoạn D (“Deteriorating/Doom”): Bệnh nhân xấu dần, không đáp ứng với điều trị ban đầu, có diễn tiến huyết động xấu đi hoặc tăng nhu cầu hỗ trợ vận mạch/MCS, báo hiệu nguy cơ tiến triển nhanh đến suy tuần hoàn không hồi phục.
- Giai đoạn E (“Extremis”): Là giai đoạn cuối cùng, biểu hiện suy tuần hoàn kháng trị hoặc ngừng tim đang hồi sức (CPR), cần biện pháp hỗ trợ tuần hoàn cơ học nâng cao như VA-ECMO hoặc thiết bị MCS đa thất. Đây là tình trạng tối cấp, tương ứng INTERMACS profile 1 – “crash and burn”.
Sự xuất hiện của giảm tưới máu mô và nhu cầu can thiệp là ranh giới chuyển từ giai đoạn tiền sốc (B) sang sốc thực sự (C–E).
Các nghiên cứu xác thực cho thấy phân loại SCAI có giá trị tiên lượng mạnh mẽ và liên quan chặt chẽ với tỷ lệ tử vong. Mỗi khi bệnh nhân tăng một bậc SCAI, nguy cơ tử vong tăng rõ rệt. Trong một phân tích đoàn hệ lớn, tỷ lệ tử vong trong viện tăng dần theo giai đoạn: A (3,0%), B (7,1%), C (12,4%), D (40,4%), và E (67,0%). Ngoài ra, tính động của SCAI cũng mang ý nghĩa tiên lượng: bệnh nhân tăng bậc SCAI trong quá trình nằm viện có kết cục xấu hơn đáng kể. Ví dụ, ở nhóm AMI-CS nhập viện giai đoạn C, tỷ lệ sống còn chỉ còn 55% nếu chuyển sang D và 17% nếu chuyển sang E [7, 8].
Phân loại SCAI là công cụ đánh giá chuẩn hóa, đơn giản và hiệu quả tại giường bệnh, giúp phân tầng mức độ sốc tim, dự đoán tiên lượng và định hướng chiến lược điều trị sớm. Đây hiện là chuẩn mực quốc tế trong quản lý sốc tim, được áp dụng rộng rãi trong phân loại, nghiên cứu và ra quyết định can thiệp lâm sàng (hình 1).
Hình 1. Các Biến Số Lâm Sàng và Thông Số Xác Định Các Giai Đoạn Sốc Tim theo Hội Tim Mạch Can Thiệp Hoa Kỳ [9].
SINH LÝ BỆNH SỐC TIM
Sốc tim là hậu quả của tổn thương tim nguyên phát, gây suy giảm nghiêm trọng khả năng bơm máu của tim và dẫn đến giảm tưới máu hệ thống. Tình trạng này có thể phát sinh từ suy tim cấp (acute cardiac failure) như nhồi máu cơ tim cấp (AMI), viêm cơ tim cấp, hở van tim cấp, hoặc mất bù cấp của suy tim mạn (HF-CS). Giảm co bóp cơ tim đột ngột do hoại tử hoặc “stunning” cơ tim làm giảm thể tích nhát bóp (SV) và cung lượng tim (CO), gây tụt huyết áp, trong khi rối loạn giãn nở tâm trương làm tăng áp lực cuối tâm trương thất trái (LVEDP), kéo theo tăng áp lực mao mạch phổi bít (PCWP) và áp lực tĩnh mạch trung tâm (CVP). Hạ huyết áp kết hợp với tăng áp lực cuối tâm trương thất làm giảm áp lực tưới máu mạch vành, khởi phát vòng xoắn thiếu máu cơ tim – giảm co bóp, khiến chức năng tim ngày càng suy sụp.
Trước sự giảm cung lượng tim và huyết áp, cơ thể kích hoạt phản ứng bù trừ thần kinh–nội tiết (Sympathetic Nervous System-SNS và renin–angiotensin–aldosterone system-RAAS). Ban đầu, cơ chế này giúp duy trì huyết áp, nhưng khi kéo dài sẽ trở nên bất lợi (maladaptive). Hoạt hóa giao cảm quá mức gây nhịp nhanh và co mạch mạnh, làm tăng hậu gánh và căng thành thất, từ đó tăng tiêu thụ oxy cơ tim và làm nặng thêm thiếu máu cục bộ – hiện tượng này được gọi là “vòng xoắn thiếu máu cơ tim” (ischemic spiral). Song song đó, hoại tử cơ tim và thiếu máu mô kích thích phóng thích cytokine tiền viêm (TNF-α, IL-6) và nitric oxide (NO), gây rối loạn nội mô và giãn mạch toàn thân, hình thành kiểu hình sốc hỗn hợp tim–giãn mạch, làm tụt huyết áp nặng thêm và tiên lượng xấu hơn.
Ứ huyết là dấu ấn đặc trưng của sốc tim. Trong CS cấp, ứ huyết xuất hiện do tăng đột ngột áp lực đổ đầy thất trái, dẫn đến phù phổi cấp, giảm oxy máu, và tăng công hô hấp. Hạ oxy mô và viêm phổi gây co mạch phổi phản xạ, làm tăng hậu gánh thất phải (RV). Khi thất phải suy, vách liên thất di lệch trái, gây giảm đổ đầy thất trái (interventricular dependence), từ đó giảm thêm cung lượng tim. Đồng thời, tăng CVP và co mạch tĩnh mạch gây ứ máu tạng và gan, được xem là yếu tố then chốt gây tổn thương cơ quan hơn cả giảm CO đơn thuần.
Khi sốc tiến triển, bệnh nhân bước vào giai đoạn suy đa cơ quan (Multiorgan Dysfunction) hoặc sốc huyết–chuyển hóa (Hemometabolic Shock) – nguyên nhân tử vong chính trong CS nặng. Thận bị tổn thương do giảm tưới máu (CO thấp) và ứ tĩnh mạch (CVP cao), dẫn đến hoạt hóa RAAS, giữ muối–nước, làm tăng quá tải thể tích và gây tổn thương thận cấp. Tổn thương gan xuất phát từ giảm tưới máu tạng kết hợp với ứ huyết tĩnh mạch, dẫn đến viêm gan thiếu oxy (shock liver), rối loạn đông máu, và tăng tính thấm ruột, tạo điều kiện cho chuyển vị vi khuẩn và nội độc tố, kích hoạt phản ứng viêm toàn thân (SIRS). Giảm tưới máu não gây rối loạn tri giác, lú lẫn hoặc hôn mê – dấu hiệu suy tim tối cấp. Khi thiếu oxy mô toàn thân kéo dài, chuyển hóa chuyển sang yếm khí, gây tăng acid lactic và toan chuyển hóa nặng, làm giảm co bóp cơ tim, giãn mạch, và tổn thương cơ quan lan tỏa.
Tóm lại, sốc tim là hội chứng rối loạn huyết động phức tạp do suy chức năng bơm của tim, đặc trưng bởi giảm cung lượng tim, ứ huyết, rối loạn phản ứng viêm và chuyển hóa, dẫn đến suy đa cơ quan tiến triển. Nếu không được can thiệp sớm để phá vỡ vòng xoắn bệnh lý giữa giảm tưới máu – ứ huyết – viêm – toan hóa, bệnh nhân sẽ nhanh chóng rơi vào tình trạng sốc huyết–chuyển hóa và tử vong không tránh khỏi [2, 10-13].
QUÁ TRÌNH HÌNH THÀNH VÀ PHÁT TRIỂN CỦA CÁC THIẾT BỊ HỖ TRỢ TUẦN HOÀN CƠ HỌC (MECHANICAL CIRCULATORY SUPPORT – MCS)
Quá trình hình thành và phát triển của các thiết bị hỗ trợ tuần hoàn cơ học (MCS) bắt đầu từ thập niên 1950 với việc John Gibbon phát minh máy tim–phổi (cardiopulmonary bypass-CPB), mở ra kỷ nguyên của phẫu thuật tim hở và hỗ trợ tuần hoàn nhân tạo. Tiếp đó, Clauss (1961) giới thiệu nguyên lý đối xung động mạch, đặt nền cho bóng đối xung động mạch chủ (IABP), và DeBakey (1964) phát triển thiết bị hỗ trợ thất trái (LVAD) đầu tiên. Đến thập niên 1970, ECMO được ứng dụng lâm sàng, cho phép hỗ trợ tim–phổi toàn phần. Trong giai đoạn 1970–1990, các thiết bị thế hệ đầu tiên hoạt động theo dòng mạch đập (pulsatile flow) như HeartMate XVE, tuy nhiên cồng kềnh và độ bền thấp. Từ 1990–2000, công nghệ dòng liên tục (continuous-flow – CF) với bơm trục (axial-flow pump) ra đời, giúp thiết bị nhỏ gọn, bền và êm hơn, tiêu biểu là HeartMate II, mang lại tỷ lệ sống 2 năm tương đương ghép tim. Sau năm 2000, thế hệ LVAD thứ ba ứng dụng công nghệ treo từ (magnetic levitation), giảm ma sát và nguy cơ huyết khối, với đại diện tiêu biểu là HeartMate 3 (HM3) và CentriMag System. Toàn bộ tiến trình này đánh dấu sự tiến hóa vượt bậc trong công nghệ tim mạch hiện đại, chuyển từ hỗ trợ tạm thời ngoại vi sang hỗ trợ lâu dài và thay thế tim hoàn toàn, giúp giảm biến chứng huyết học và cải thiện đáng kể tiên lượng sống còn cho bệnh nhân suy tim giai đoạn cuối (hình 2) [14-16].
Hình 2. Các thông số kỹ thuật và đặc điểm của các thiết bị hỗ trợ tuần hoàn cơ học tạm thời (tMCS)
| Thông số | Impella RP Flex | RA–PA pVAD | VA–ECMO | IABP | Impella CP | Impella 5.5 |
| Dòng chảy tối đa | 3,0 – 4,0 L/phút | 4,0 – 5,0 L/phút | 5,0 – 7,0 L/phút | 0,5 – 1,0 L/phút | 3,0 – 4,3 L/phút | 5,0 – 6,0 L/phút |
| Tốc độ bơm tối đa | 33.000 vòng/phút | 7.500 vòng/phút | 6.000 vòng/phút | Không áp dụng | 46.000 vòng/phút | 33.000 vòng/phút |
| Cơ chế hoạt động | Bơm dòng trục liên tục (từ nhĩ phải → ĐMP) | Bơm ly tâm liên tục (từ nhĩ phải → ĐMP) | Bơm ly tâm liên tục (từ nhĩ phải → ĐMC) | Bóng bơm–xả theo chu kỳ (ĐMC) | Bơm dòng trục liên tục (từ thất trái → ĐMC) | Bơm dòng trục liên tục (từ thất trái → ĐMC) |
| Kích cỡ sheath | 23F, tĩnh mạch (peel-away) | 29 hoặc 31F, tĩnh mạch (dòng vào) | 15–24F động mạch, 19–25F tĩnh mạch | 7–8F động mạch | 14F động mạch (peel-away) | 23F động mạch (peel-away) |
| Vị trí thường đặt | Tĩnh mạch cảnh trong | Tĩnh mạch cảnh trong | TM đùi (hút máu) / ĐM đùi (trả máu) | ĐM đùi hoặc ĐM nách | ĐM đùi hoặc ĐM nách | ĐM nách |
| Giảm tải thất trái trực tiếp | – | – | – | – | +++ | +++ |
| Giảm tải thất phải trực tiếp | + | + | + | – | – | – |
| Ảnh hưởng lên hậu tải | – | – | ↑↑↑ | ↓↓ | ↓ | ↓ |
| Tưới máu động mạch vành | – | – | ↑↑ | ↑↑ | ↑↑ | ↑↑ |
2025 ACC Concise Clinical Guidance – Cardiogenic Shock (Sinha SS et al.). Chú thích: RA: nhĩ phải; PA: động mạch phổi; AO: động mạch chủ; LV: thất trái; RV: thất phải; pVAD: thiết bị hỗ trợ thất qua da; VA–ECMO: hệ thống tuần hoàn ngoài cơ thể tĩnh–động mạch (veno–arterial extracorporeal membrane oxygenation); IABP: bóng đối xung nội động mạch chủ; tMCS: hỗ trợ tuần hoàn cơ học tạm thời; dấu “+” biểu thị mức độ hiệu quả hoặc tác động (tăng dần theo số lượng dấu “+”); dấu “↑”/“↓” biểu thị tăng hoặc giảm tác động sinh lý.
CHỈ ĐỊNH HỖ TRỢ TUẦN HOÀN CƠ HỌC TẠM THỜI TRONG SỐC TIM
Hỗ trợ tuần hoàn cơ học tạm thời (tMCS – Temporary Mechanical Circulatory Support) được xem là một chiến lược điều trị quan trọng trong sốc tim đe dọa tính mạng và trong các can thiệp tim mạch nguy cơ cao. Mục tiêu của tMCS là ổn định huyết động, tăng cung lượng tim, giảm tải công cơ tim, và phục hồi tưới máu cơ quan đích, qua đó ngăn ngừa tiến triển đến suy đa cơ quan.
Chỉ định chính của tMCS là sốc tim kháng trị, khi bệnh nhân không đáp ứng với điều trị nội khoa tối ưu, bao gồm bù dịch, thuốc vận mạch, hoặc inotrope. Việc tăng nhanh liều thuốc vận mạch, tụt huyết áp kéo dài hoặc tình trạng giảm tưới máu dai dẳng là dấu hiệu cảnh báo cần hỗ trợ cơ học sớm. Theo phân tầng SCAI, tMCS thường được triển khai ở giai đoạn D (Deteriorating) hoặc E (Extremis), đặc biệt khi xuất hiện các ngưỡng huyết động nặng như huyết áp tâm thu < 90 mmHg, MAP < 65 mmHg, CI ≤ 2,2 L/phút/m², PCWP > 15 mmHg, CPO < 0,6 W, hoặc lactate ≥ 2 mmol/L kèm thiểu niệu, toan chuyển hóa [1, 2].
Về nguyên nhân, tMCS thường được sử dụng trong các tình huống có khả năng hồi phục hoặc cần cầu nối điều trị, bao gồm nhồi máu cơ tim cấp (AMI-CS), biến chứng cơ học sau nhồi máu (Thủng vách liên thất, hở van hai lá cấp), suy tim cấp mất bù (HF-CS), viêm cơ tim tối cấp (Fulminant Myocarditis), sốc sau phẫu thuật tim (Postcardiotomy Shock), rối loạn nhịp đe dọa tính mạng, hoặc suy thất phải đơn độc trong bối cảnh thuyên tắc phổi cấp, nhồi máu cơ tim thất phải, hoặc sau ghép tim.
Theo các hướng dẫn AHA và ESC, việc sử dụng tMCS cần mang tính chọn lọc, không áp dụng thường quy. tMCS ngắn hạn được xem xét (Class IIa, Level B–C) ở bệnh nhân sốc tim kháng trị, đóng vai trò cầu nối hồi phục (bridge-to-recovery) hoặc cầu nối ra quyết định (bridge-to-decision). IABP không được khuyến cáo thường quy trong sốc tim do nhồi máu cơ tim cấp (Class III), nhưng có thể xem xét (Class IIa) ở bệnh nhân có biến chứng cơ học sau nhồi máu. VA-ECMO được khuyến cáo trong các trường hợp ngừng tim có hồi sức (ECPR) hoặc sốc giai đoạn SCAI D/E, trong khi Impella hoặc LVAD nên được cân nhắc ở bệnh nhân suy thất trái nặng, PAWP tăng, LVEF thấp, không đáp ứng điều trị nội khoa [17, 18].
Mục tiêu điều trị của hỗ trợ tuần hoàn cơ học tạm thời được xây dựng dựa trên chiến lược cầu nối (Bridge Strategy), nhằm duy trì huyết động ổn định, bảo vệ cơ quan đích và tối ưu hóa kết cục lâm sàng. Thứ nhất, bắc cầu đến hồi phục (Bridge to Recovery – BTR) được áp dụng trong các bệnh lý có khả năng hồi phục cơ tim, như viêm cơ tim cấp hoặc sốc tim sau nhồi máu cơ tim cấp. Thứ hai, bắc cầu đến quyết định (Bridge to Decision – BTD) hoặc bắc cầu đến bắc cầu (Bridge to Bridge – BTB) được sử dụng khi tiên lượng chưa rõ ràng, cần thời gian đánh giá khả năng ghép tim (Heart Transplantation – HTX) hoặc cấy thiết bị hỗ trợ thất lâu dài (durable Left Ventricular Assist Device – LVAD). Thứ ba, bắc cầu đến ghép tim hoặc điều trị đích (Bridge to Transplantation – BTT / Bridge to Destination – BTD) hướng đến duy trì huyết động ổn định trong thời gian chờ ghép hoặc trước khi cấy LVAD lâu dài. Cuối cùng, bắc cầu đến can thiệp (Bridge to Procedure) được áp dụng trong các can thiệp tim mạch nguy cơ cao (High-Risk Percutaneous Coronary Intervention – HR-PCI), đặc biệt ở bệnh nhân có phân suất tống máu thất trái < 35%, tổn thương thân chung động mạch vành trái, hoặc chỉ còn một nhánh động mạch vành thông duy nhất [19-21].
Tóm lại, tMCS là biện pháp chiến lược và cứu vãn trong điều trị sốc tim kháng trị và các can thiệp tim mạch phức tạp, giúp duy trì tưới máu cơ quan, bảo tồn chức năng tim, và tạo điều kiện cho hồi phục hoặc chuyển tiếp sang các biện pháp điều trị triệt để. Quyết định đặt thiết bị cần dựa trên đánh giá huyết động, phân tầng SCAI, và nguyên nhân bệnh lý, đồng thời được triển khai bởi đội phản ứng sốc tim đa chuyên khoa, nhằm đạt hiệu quả tối ưu và an toàn cao nhất cho người bệnh.
QUY TRÌNH CHỈ ĐỊNH VÀ LỰA CHỌN PHƯƠNG TIỆN HỖ TRỢ TUẦN HOÀN CƠ HỌC TẠM THỜI [22].
BÓNG ĐỐI XUNG NỘI ĐỘNG MẠCH CHỦ
Bóng đối xung động mạch chủ (Intra-Aortic Balloon Pump – IABP) là thiết bị hỗ trợ tuần hoàn cơ học tạm thời (tMCS) thụ động, có lịch sử lâu đời và vẫn được xem là phương tiện được sử dụng phổ biến nhất nhờ tính an toàn, dễ thao tác và chi phí thấp.
Cơ chế hoạt động của IABP dựa trên nguyên lý đối xung (counterpulsation). Thiết bị gồm một bóng hình trụ bằng polyethylen, gắn trên catheter 7–8 Fr, thường được đặt qua da vào động mạch đùi, đầu bóng nằm ở động mạch chủ xuống đoạn gần. Khi van động mạch chủ đóng (thì tâm trương), bóng được bơm căng bằng khí heli, đẩy máu ngược dòng và tăng áp lực động mạch chủ tâm trương, qua đó tăng tưới máu động mạch vành và cải thiện cung cấp oxy cho cơ tim. Ngược lại, ngay trước thì tâm thu, bóng xẹp nhanh chóng, tạo ra hiệu ứng hút, làm giảm áp lực cuối tâm trương động mạch chủ, từ đó giảm hậu gánh (afterload) và giảm công cơ tim.
Về hiệu quả huyết động, IABP giúp giảm nhu cầu tiêu thụ oxy cơ tim, giảm áp lực cuối tâm trương thất trái (LVEDP) và áp lực mao mạch phổi bít (PCWP), đồng thời tăng nhẹ cung lượng tim (CO) khoảng 0,5–1,0 L/phút. Biểu đồ áp lực–thể tích (PV loop) cho thấy giảm hậu gánh nhẹ, tăng thể tích nhát bóp (SV), song không làm thay đổi co bóp cơ tim (ESPVR không đổi). Nhờ đó, IABP cải thiện chức năng tâm trương và giảm tải thất trái mà không gây biến đổi đáng kể về huyết động toàn thân.
Kích thước bóng thường từ 30–50 mL, lựa chọn dựa trên chiều cao bệnh nhân; bóng 40 mL phù hợp với người trưởng thành trung bình, trong khi bóng 50 mL có thể mang lại hiệu quả huyết động tốt hơn nhờ tăng xả tâm thu và tăng bơm máu tâm trương. Thiết bị có thể đặt qua động mạch đùi hoặc động mạch nách (giúp bệnh nhân vận động trong thời gian chờ ghép tim hoặc hỗ trợ thất trái lâu dài – LVAD).
Về hiệu quả lâm sàng, nghiên cứu ngẫu nhiên có đối chứng IABP-SHOCK II cho thấy IABP không làm giảm tỷ lệ tử vong 30 ngày ở bệnh nhân nhồi máu cơ tim cấp biến chứng sốc tim (AMI-CS), cũng như không cải thiện tiên lượng dài hạn. Do đó, hướng dẫn ESC đã hạ mức khuyến cáo sử dụng IABP trong AMI-CS xuống Class III, Mức bằng chứng B, tức là không khuyến cáo sử dụng thường quy. Tuy nhiên, IABP vẫn có vai trò cầu nối (bridge) ở bệnh nhân có biến chứng cơ học của nhồi máu cơ tim cấp, như hở van hai lá cấp (acute MR) hoặc thông liên thất sau nhồi máu (PIVSD), giúp giảm hậu gánh, cải thiện dòng máu tống ra động mạch chủ và giảm luồng shunt qua vách liên thất. Ngoài ra, trong sốc tim không do nhồi máu (non-AMI CS) hoặc suy tim cấp mất bù (ADHF-CS), IABP có thể được xem xét (Class IIa/IIb), đặc biệt khi sốc đi kèm tăng sức cản mạch hệ thống (SVR) hoặc hở van hai lá trung bình – nặng, với vai trò cầu nối đến ghép tim hoặc thiết bị hỗ trợ thất lâu dài [23-25].
Chống chỉ định tuyệt đối của IABP bao gồm hở van động mạch chủ nặng, bóc tách hoặc phình động mạch chủ, xơ vữa nặng động mạch chủ, rối loạn nhịp không có mạch (như rung thất) và bệnh động mạch ngoại biên nặng. Chống chỉ định tương đối gồm xơ vữa nặng đoạn động mạch chủ xuống, phẫu thuật động mạch chủ ngực gần đây, hoặc xoắn động mạch chậu nặng.
Mặc dù có những giới hạn, IABP vẫn là thiết bị có độ an toàn cao nhất trong nhóm tMCS, với tỷ lệ biến chứng thấp hơn rõ rệt so với Impella hay VA-ECMO. Tỷ lệ chảy máu dao động 4–39% (trung bình 12,9%), thiếu máu chi 1,5–2,3%, đột quỵ 3,1%, và nhiễm trùng <1%. Nhờ đó, IABP thường được xem là lựa chọn ổn định, chi phí thấp, và dễ quản lý nhất trong các hình thức hỗ trợ tuần hoàn cơ học tạm thời.
Theo dõi và vận hành IABP đòi hỏi điều chỉnh thời điểm bơm–xẹp bóng chính xác: bóng phải xẹp ngay trước tâm thu để giảm áp lực đỉnh, tạo điều kiện tống máu thất trái hiệu quả. Việc xẹp muộn có thể làm tăng hậu gánh, triệt tiêu lợi ích huyết động. Vị trí đầu catheter cần nằm ngay dưới chỗ tách động mạch dưới đòn trái, được xác định qua x-quang ngực định kỳ. Chống đông hệ thống có thể được cân nhắc khi hỗ trợ 1:1 và khuyến cáo khi hỗ trợ 1:2 hoặc 1:3 chu kỳ tim. Một số nghiên cứu hiện đại cho thấy bỏ heparin có thể an toàn hơn trong một số tình huống, giúp giảm nguy cơ chảy máu mà không làm tăng huyết khối.
Tóm lại, IABP là thiết bị hỗ trợ huyết động thụ động, đơn giản, ít biến chứng và chi phí thấp nhất trong nhóm tMCS, đóng vai trò quan trọng trong điều trị sốc tim và cầu nối trước các can thiệp triệt để hơn. Mặc dù các thử nghiệm lớn không chứng minh lợi ích tử vong trong AMI-CS, IABP vẫn giữ vị trí đáng tin cậy trong các biến chứng cơ học sau nhồi máu, suy tim cấp có SVR cao, hoặc giai đoạn cầu nối ghép tim/thiết bị lâu dài, với mức độ an toàn và khả năng vận hành cao trong thực hành lâm sàng hiện nay.
OXY HÓA MÀNG NGOÀI CƠ THỂ TĨNH MẠCH-ĐỘNG MẠCH
VA-ECMO (Veno-Arterial Extracorporeal Membrane Oxygenation) là phương thức hỗ trợ tuần hoàn cơ học hiệu quả và linh hoạt, có khả năng cung cấp hỗ trợ tim phổi toàn phần và được triển khai nhanh chóng trong tình huống cấp cứu. Đây là chiến lược hàng đầu trong hỗ trợ tuần hoàn tạm thời (t-MCS) cho bệnh nhân sốc tim kháng trị (SCAI giai đoạn D hoặc E) hoặc ngừng tim cần hồi sức tim phổi nâng cao (CPR).
Về cơ chế, hệ thống VA-ECMO gồm bơm ly tâm (centrifugal pump) và bộ trao đổi oxy (oxygenator) nằm trong mạch tuần hoàn kín. Thiết bị có khả năng thay thế cả chức năng tim và phổi, cung cấp lưu lượng tuần hoàn cao nhất trong các loại t-MCS (thường 3,0–7,0 L/phút, trung bình khoảng 5,2 ± 1,3 L/phút). Cấu hình ngoại biên thường được sử dụng, với máu tĩnh mạch được rút ra qua canuyn lớn (17–24 Fr) đặt ở tĩnh mạch đùi hoặc nhĩ phải, sau đó máu được oxy hóa và bơm ngược dòng qua canuyn động mạch (14–19 Fr) đặt ở động mạch đùi vào động mạch chủ. Tuy nhiên, chính dòng máu ngược này gây tăng hậu tải thất trái — nhược điểm sinh lý quan trọng nhất của VA-ECMO [26, 27].
Tăng hậu tải thất trái do dòng máu ngược gây cản trở mở van động mạch chủ, làm giảm thể tích tống máu thất trái, tăng áp lực cuối tâm trương (LVEDP), gây giãn thất, tăng lực căng thành cơ tim, tăng tiêu thụ oxy, và làm nặng thêm tình trạng phù phổi. Khi van động mạch chủ không mở, máu bị ứ trong thất trái và gốc động mạch chủ, dễ dẫn đến hình thành huyết khối nội tâm mạc hoặc trong gốc ĐMC, có thể gây thuyên tắc hệ thống nguy hiểm.
Theo dõi liên tục, chuyên sâu là yếu tố sống còn trong quản lý VA-ECMO. Về huyết động, cần đặt đường động mạch và tĩnh mạch trung tâm để theo dõi liên tục huyết áp và áp lực tĩnh mạch trung tâm. Khuyến khích đặt catheter động mạch ở động mạch quay phải để phát hiện sớm tình trạng thiếu oxy khu trú (Harlequin syndrome). Catheter động mạch phổi (PAC) được khuyến cáo sử dụng thường xuyên trong sốc tim trung bình–nặng, giúp đánh giá áp lực mao mạch phổi bít (PAWP) và chức năng thất phải, đồng thời tối ưu hóa dịch truyền, thuốc vận mạch và thông số ECMO. Siêu âm tim qua thành ngực (TTE) là công cụ quan trọng, không chỉ đánh giá chức năng thất mà còn giúp phát hiện huyết khối nội tâm mạc, giãn thất trái, và theo dõi sự mở van động mạch chủ qua chỉ số LVOT-VTI.
Một biến chứng điển hình của VA-ECMO ngoại biên là thiếu oxy khu trú vùng đầu cổ (Harlequin syndrome), xảy ra khi chức năng thất trái hồi phục sớm hơn phổi. Máu ít oxy từ thất trái hòa trộn với dòng máu giàu oxy từ ECMO, gây thiếu oxy vành và não. Do đó, cần theo dõi khí máu động mạch từ chi trên phải (động mạch quay phải) để phát hiện sớm tình trạng này. Ngoài ra, việc theo dõi lactate huyết, SvO₂/ScvO₂, và ΔPCO₂ giúp đánh giá tưới máu cơ quan và cân bằng cung–cầu oxy. Cần chống đông toàn thân bằng heparin với mục tiêu ACT 180–200 giây hoặc aPTT 50–60 giây, song đây cũng là thách thức lớn do nguy cơ chảy máu cao.
Theo dõi biến chứng tại chi và thiết bị là yêu cầu bắt buộc. Do canuyn động mạch đùi có kích thước lớn, thiếu máu chi là biến chứng phổ biến; cần kiểm tra mạch, màu da và Doppler mạch máu thường xuyên. Đặt thêm canuyn tưới máu ngược dòng (distal perfusion catheter) có thể giúp phòng ngừa biến chứng này. Cần theo dõi sát chảy máu, tán huyết và huyết khối bằng xét nghiệm và quan sát trực tiếp hệ thống.
Để khắc phục nhược điểm tăng hậu gánh thất trái, cần cân nhắc chiến lược giảm tải thất (venting) ngay khi lập kế hoạch ECMO. Các phương pháp giảm tải gồm cơ học và không cơ học. Về cơ học, Impella (ECPELLA/ECMELLA) là lựa chọn phổ biến, giúp hút máu trực tiếp từ thất trái và đẩy xuôi dòng vào động mạch chủ, giảm PVA và phòng ngừa ứ máu, dù đi kèm nguy cơ chảy máu, tan máu và thiếu máu chi cao hơn. Bóng đối xung động mạch chủ (IABP) cũng thường được phối hợp, giúp giảm hậu gánh, tăng tưới máu vành, nhưng hiệu quả giảm tải thấp hơn Impella và không nhất quán về cải thiện sống còn. Ngoài ra, có thể dùng thông liên nhĩ nhân tạo (atrial septostomy) hoặc mở thất trái phẫu thuật (LV vent).
Các biện pháp không cơ học gồm giảm lưu lượng ECMO, dùng inotrope để mở van động mạch chủ, hoặc dùng thuốc giãn mạch để giảm hậu gánh. Tuy nhiên, inotrope làm tăng tiêu thụ oxy và căng thành cơ tim, còn giãn mạch có thể giới hạn bởi tụt huyết áp.
Chống chỉ định tuyệt đối và tương đối của kỹ thuật trao đổi oxy qua màng ngoài cơ thể (Extracorporeal Membrane Oxygenation – ECMO) cần được xem xét như một phần không thể tách rời trong quá trình lựa chọn bệnh nhân phù hợp để can thiệp. Việc chỉ định ECMO trong bối cảnh tim mạch hoặc hô hấp đòi hỏi đánh giá toàn diện, cân nhắc lợi ích – nguy cơ, và định hướng mục tiêu điều trị rõ ràng, nhằm tối ưu hóa hiệu quả lâm sàng và tránh sử dụng kỹ thuật trong những trường hợp vô ích về mặt tiên lượng.
Thứ nhất, về chống chỉ định tuyệt đối, ECMO không được chỉ định ở các bệnh nhân có tổn thương cơ quan ngoài tim không hồi phục hoặc bệnh lý giai đoạn cuối, vì khi đó kỹ thuật này không còn mang lại giá trị cứu sống thực sự. Cụ thể, các trường hợp suy đa cơ quan không hồi phục, tổn thương thần kinh trung ương nặng (đặc biệt là xuất huyết hoặc nhồi máu não lan tỏa, tổn thương não thiếu oxy không hồi phục), bệnh gan hoặc thận mạn giai đoạn cuối, ung thư tiến triển giai đoạn cuối đều được xếp vào nhóm chống chỉ định tuyệt đối. Trong bối cảnh VA-ECMO, các bệnh lý cấu trúc tim mạch như hở van động mạch chủ nặng (severe aortic regurgitation) hoặc bóc tách động mạch chủ (aortic dissection) được xem là chống chỉ định tuyệt đối, do dòng máu ngược của ECMO làm tăng đáng kể hậu gánh thất trái, gây giãn thất, phù phổi và giảm hiệu quả hỗ trợ tuần hoàn. Tương tự, các dị tật tim chưa được sửa chữa, chẳng hạn thông liên thất (VSD) gây luồng shunt phải–trái, có thể làm nặng thêm tình trạng thiếu oxy hệ thống khi phối hợp với ECMO và vì vậy không được khuyến cáo chỉ định. Ngoài ra, trong các trường hợp suy tim giai đoạn cuối không có chỉ định ghép tim hoặc thiết bị hỗ trợ lâu dài, ECMO chỉ nên được sử dụng như biện pháp tạm thời trong 24–72 giờ nhằm đánh giá khả năng hồi phục thần kinh hoặc cân nhắc hướng điều trị tiếp theo.
Thứ hai, chống chỉ định tương đối phản ánh những yếu tố làm giảm hiệu quả hoặc tăng nguy cơ biến chứng nghiêm trọng, đòi hỏi đánh giá cá thể hóa từng trường hợp. Những yếu tố này bao gồm rối loạn đông máu nặng hoặc không thể chống đông toàn thân, vì ECMO đòi hỏi duy trì chống đông liên tục bằng heparin để ngăn huyết khối trong hệ thống tuần hoàn ngoài cơ thể. Bệnh nhân có xuất huyết nội sọ mới hoặc đang tiến triển được xem là có nguy cơ chảy máu chí mạng khi sử dụng ECMO. Bệnh động mạch ngoại biên nặng (Peripheral Arterial Disease – PAD) hoặc hạn chế đường vào mạch máu lớn là chống chỉ định tương đối, đặc biệt trong VA-ECMO, vì tăng nguy cơ thiếu máu chi cấp tính tại vị trí đặt canuyn. Tuổi cao, đặc biệt ≥80 tuổi, là yếu tố tiên lượng độc lập liên quan đến tỷ lệ tử vong cao và thường được xem là chống chỉ định tương đối, song quyết định cần dựa vào tình trạng sinh lý hơn là tuổi mốc tuyệt đối. Bên cạnh đó, các bệnh nhân có bệnh lý mạn tính không hồi phục, ung thư tiến triển, tuân thủ điều trị kém hoặc thiếu hỗ trợ xã hội cũng không phải là ứng viên phù hợp cho ECMO. Trong lĩnh vực hô hấp, đặc biệt với VV-ECMO, thời gian thở máy kéo dài với FiO₂ > 0,9 và áp lực bình nguyên > 30 cmH₂O trong ≥7 ngày là yếu tố tiên lượng xấu và thường được xem là chống chỉ định tương đối, mặc dù nhiều trung tâm ECMO hiện nay không còn coi đây là giới hạn tuyệt đối [13, 24, 27].
Cuối cùng, quyết định đặt ECMO dựa vào sự đồng thuận của đa chuyên khoa, bao gồm bác sĩ tim mạch, hồi sức, phẫu thuật tim. Tiêu chí chọn bệnh nhân dựa trên khả năng hồi phục thực sự của tổn thương, khả năng cải thiện chức năng thần kinh, và tiến tới các chiến lược điều trị lâu dài như ghép tim hoặc hỗ trợ thất lâu dài (durable LVAD). ECMO chỉ nên được chỉ định khi nguyên nhân gây sốc tim hoặc suy hô hấp còn khả năng hồi phục, hoặc khi bệnh nhân có thể trở thành ứng viên cho điều trị triệt để về sau (bridge to recovery, bridge to transplant, hoặc bridge to device). Tránh chỉ định ECMO trong các tình huống không có mục tiêu điều trị rõ ràng hoặc không có kỳ vọng hợp lý về hồi phục chức năng, vì điều này không những không cải thiện tiên lượng mà còn làm gia tăng gánh nặng chi phí, nguy cơ biến chứng (chảy máu, huyết khối, nhiễm trùng, tan máu) và vấn đề đạo đức trong thực hành lâm sàng hiện đại.
Tóm lại, VA-ECMO là thiết bị hỗ trợ tim phổi toàn diện và hiệu quả nhất trong sốc tim kháng trị, nhưng gây tăng hậu gánh thất trái đáng kể, có thể dẫn đến giãn thất, phù phổi và huyết khối buồng tim. Do đó, theo dõi huyết động liên tục, siêu âm tim định kỳ, quản lý chống đông chặt chẽ và chiến lược giảm tải thất chủ động là những yếu tố cốt lõi giúp tối ưu hóa hiệu quả điều trị và cải thiện tiên lượng cho bệnh nhân.
Tóm lại, VA-ECMO là phương tiện hỗ trợ tim phổi tạm thời có hiệu quả cao trong điều trị sốc tim kháng trị, giúp duy trì huyết động và trao đổi khí toàn diện, song làm tăng đáng kể hậu gánh thất trái, dễ dẫn đến giãn thất, phù phổi và hình thành huyết khối nội buồng tim nếu không được kiểm soát thích hợp. Vì vậy, theo dõi huyết động liên tục, siêu âm tim định kỳ, quản lý chống đông nghiêm ngặt và áp dụng chiến lược giảm tải thất chủ động là những yếu tố then chốt giúp tối ưu hóa hiệu quả điều trị và cải thiện tiên lượng bệnh nhân. Đồng thời, việc đánh giá chỉ định và chống chỉ định ECMO phải được thực hiện nghiêm ngặt, có cơ sở khoa học và mang tính cá thể hóa, với sự phối hợp đa chuyên khoa nhằm lựa chọn đúng đối tượng, xác định rõ mục tiêu điều trị và hạn chế can thiệp không cần thiết, qua đó đảm bảo ECMO được sử dụng an toàn, hợp lý và hiệu quả.
IMPELLA
Hệ thống Impella là thiết bị hỗ trợ tuần hoàn cơ học tạm thời (temporary Mechanical Circulatory Support – tMCS) dạng bơm dòng trục (axial-flow pump), hoạt động theo nguyên lý vít Archimedes, hút máu từ thất trái (Left Ventricle – LV) và bơm lên động mạch chủ lên (ascending aorta) để giảm tải thất trái và cải thiện huyết động. Các biến thể của Impella gồm Impella 2.5 (2,5 L/phút), Impella CP (3,5–4,0 L/phút), Impella 5.0/5.5 (5–6 L/phút) dùng cho hỗ trợ dài ngày, và Impella RP hỗ trợ thất phải (Right Ventricle – RV). Về sinh lý, Impella giúp giảm áp lực cuối tâm trương (LVEDP), giảm sức căng thành cơ tim, tăng huyết áp trung bình (MAP), cải thiện tưới máu vành và giảm áp lực mao mạch phổi bít (PAWP). Trong vận hành, thiết bị cần đặt chính xác dưới siêu âm tim (TTE/TEE) và theo dõi liên tục lưu lượng, huyết áp, vị trí bơm để tránh sự cố hút (suction), tan máu hoặc sai vị trí.
Về lâm sàng, Impella cải thiện rõ rệt chỉ số tim (Cardiac Index – CI) so với bóng đối xung động mạch chủ (IABP), dù không làm giảm tử vong 30 ngày (ISAR-SHOCK). Tuy nhiên, thử nghiệm DanGer Shock cho thấy giảm tử vong 180 ngày ở nhóm STEMI-CS được điều trị bằng Impella CP, và dữ liệu J-PVAD registry ghi nhận LVEF tăng từ 24,9 ± 14,2% lên 44,0 ± 16,6%, gợi ý khả năng phục hồi cơ tim. Dù vậy, thiết bị vẫn có nguy cơ biến chứng như chảy máu, thiếu máu chi, tan máu, huyết khối, đột quỵ hoặc tổn thương van tim, đòi hỏi chống đông bằng heparin và giám sát chặt chẽ. Ngoài ra, Impella có vai trò quan trọng trong chiến lược ECPELLA (VA-ECMO + Impella) giúp giảm hậu gánh LV và cải thiện hồi phục cơ tim, dù tăng nguy cơ chảy máu và tan máu. Nhìn chung, Impella là thiết bị tMCS tiên tiến, mang lại hiệu quả giảm tải thất trái và ổn định huyết động đáng kể, nhưng cần quản lý đa chuyên khoa và theo dõi sát để tối ưu hóa hiệu quả và hạn chế biến chứng [14, 19, 28].
ECPELLA
Chiến lược ECPELLA (hoặc ECMELLA) là phương pháp hỗ trợ tuần hoàn cơ học tạm thời (t-MCS) kết hợp giữa trao đổi oxy qua màng ngoài cơ thể đường tĩnh mạch–động mạch (VA-ECMO) và bơm dòng vi trục qua van động mạch chủ (Impella), được áp dụng ngày càng rộng rãi trong sốc tim kéo dài, kháng trị hoặc ngừng tim cần hồi sức nâng cao. Về cơ chế sinh lý, VA-ECMO cung cấp hỗ trợ tuần hoàn và hô hấp toàn diện, nhưng làm tăng hậu gánh thất trái, trong khi Impella giúp giảm tải thất trái (LV unloading), giảm áp lực thành cơ tim và diện tích áp lực–thể tích (PVA), qua đó thúc đẩy hồi phục cơ tim. Sự kết hợp này mang lại tác dụng hiệp đồng huyết động, khi VA-ECMO đảm bảo lưu lượng toàn thân còn Impella chủ động xả thất trái, giúp ổn định huyết động, giảm tiêu thụ oxy và hạn chế ứ máu, huyết khối trong thất trái. Các nghiên cứu quan sát và dữ liệu registry cho thấy ECPELLA cải thiện tỷ lệ sống còn so với VA-ECMO đơn thuần, đặc biệt khi Impella được đặt trong vòng 2 giờ đầu; LVEF cải thiện từ 24,9 ± 14,2% lên 44,0 ± 16,6% tại thời điểm rút thiết bị. Tuy nhiên, chiến lược này đi kèm nguy cơ biến chứng cao hơn, như chảy máu (RR 1,45), tan máu (RR 1,71), thiếu máu chi (RR 1,43) và cần lọc máu (RR 1,54). Trong thực hành, cần chống đông toàn thân bằng heparin không phân đoạn, theo dõi sát oxy hóa, áp lực và vị trí thiết bị; đồng thời điều chỉnh linh hoạt lưu lượng Impella – VA-ECMO để tránh xẹp thất hoặc rối loạn huyết động. Khi hồi phục, trình tự cai máy hợp lý là ngừng VA-ECMO trước, sau đó Impella, dựa trên các chỉ số cải thiện như lactate bình thường, PAWP < 20 mmHg, CPO ≥ 0,6 W. Nhìn chung, ECPELLA là chiến lược hỗ trợ kép mang tính đột phá, kết hợp hiệu quả toàn thân của VA-ECMO với khả năng giảm tải chủ động của Impella, giúp cải thiện tiên lượng ở bệnh nhân sốc tim nặng, nhưng đòi hỏi quản lý đa chuyên khoa chặt chẽ và theo dõi huyết động liên tục để hạn chế biến chứng [5].
CÁC THỬ NGHIỆM NGẪU NHIÊN CÓ ĐỐI CHỨNG (RCTs) VỀ tMCS TRONG SỐC TIM
Các thử nghiệm ngẫu nhiên có đối chứng về hỗ trợ tuần hoàn cơ học tạm thời trong sốc tim chủ yếu tập trung vào sốc tim sau nhồi máu cơ tim ST chênh lên (STEMI-CS), nhưng còn nhiều hạn chế về cỡ mẫu, tiêu chuẩn chọn bệnh, thời điểm can thiệp và thiết kế nghiên cứu. Trong số đó, IABP-SHOCK II là thử nghiệm kinh điển trên 600 bệnh nhân AMI-CS được tái thông mạch sớm, cho thấy bóng đối xung động mạch chủ (IABP) không mang lại lợi ích sống còn sau 30 ngày cũng như sau theo dõi 6 năm, từ đó loại bỏ khuyến cáo sử dụng thường quy IABP. Ngược lại, thử nghiệm DanGer Shock là nghiên cứu đầu tiên chứng minh rằng sử dụng sớm bơm vi trục (microaxial flow pump – Impella) ở bệnh nhân STEMI-CS được chọn lọc kỹ lưỡng giúp giảm tuyệt đối 12,7% tỷ lệ tử vong sau 180 ngày so với điều trị chuẩn, dù hiệu lực ngoại suy còn hạn chế. Một phân tích gộp dữ liệu cá thể (IPD meta-analysis) từ các RCTs có theo dõi 6 tháng cũng cho thấy rằng tMCS, bao gồm VA-ECMO, có thể giảm tử vong ở bệnh nhân STEMI-CS không có tổn thương não thiếu oxy. Các kết quả này gợi ý rằng tăng cường hỗ trợ bằng tMCS, đặc biệt bằng bơm vi trục, có thể mang lại lợi ích cho bệnh nhân sốc tim do suy thất trái ưu thế (LV-dominant CS) có giảm tưới máu hệ thống hoặc huyết động xấu dần. Trong thực hành, việc áp dụng chiến lược điều trị tiêu chuẩn hóa dựa trên phối hợp đa chuyên khoa (shock team), phân tầng theo SCAI, và phối hợp nội khoa – cơ học được xem là hướng tiếp cận toàn diện trong quản lý AMI-CS (hình 3A) và HF-CS (hình 3B).
Hình 3A. Hướng dẫn điều trị shock tim do nhồi máu cơ tim
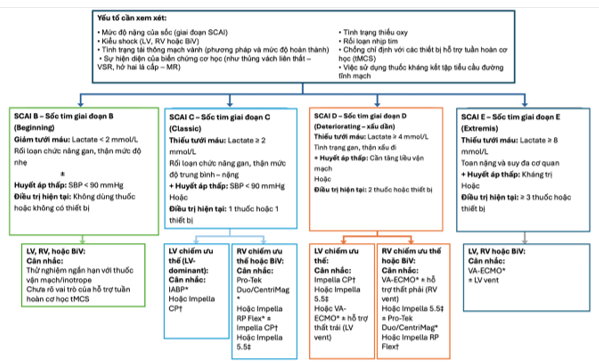
2025 ACC Concise Clinical Guidance – Cardiogenic Shock (Sinha SS et al.). Giải thích viết tắt: AMI (Acute Myocardial Infarction – Nhồi máu cơ tim cấp), BiV (Biventricular – Hỗ trợ hai thất), CS (Cardiogenic Shock – Sốc tim), ECLS-SHOCK (Extracorporeal Life Support in Cardiogenic Shock), IABP (Intra-Aortic Balloon Pump – Bóng đối xung nội động mạch chủ), LV (Left Ventricle – Thất trái), RV (Right Ventricle – Thất phải), MR (Mitral Regurgitation – Hở van hai lá), pMCS (Percutaneous Mechanical Circulatory Support – Thiết bị hỗ trợ tuần hoàn cơ học qua da), RCT (Randomized Controlled Trial – Thử nghiệm ngẫu nhiên có đối chứng), SBP (Systolic Blood Pressure)
Từ góc độ sinh lý bệnh, mục tiêu của hỗ trợ tuần hoàn cơ học tạm thời là giảm tải thất, phục hồi tưới máu hệ thống và bắc cầu đến các liệu pháp điều trị nâng cao như cấy thiết bị hỗ trợ thất trái lâu dài (LVAD), ghép tim, hoặc phục hồi cơ tim. Việc sử dụng tMCS giúp giảm hoặc ngừng thuốc vận mạch – inotrope, hạn chế tổn thương cơ tim do thiếu máu cục bộ kéo dài. Quyết định khởi trị hoặc tăng mức hỗ trợ cần dựa trên dữ liệu huyết động học, lựa chọn thiết bị phù hợp với mức công suất và khả năng giảm tải thất, nhằm đạt chỉ số tim tối ưu khi điều trị nội khoa không còn hiệu quả. Trong thực hành, có thể tăng lưu lượng bơm, nâng cấp thiết bị (ví dụ Impella CP lên 5.5) hoặc kết hợp xả thất (LV venting) trong VA-ECMO nếu giảm tải chưa đầy đủ. Với các bệnh nhân không đủ điều kiện ghép tim hoặc LVAD lâu dài, nên tham vấn chăm sóc giảm nhẹ (palliative care) sớm để định hướng mục tiêu điều trị. Khởi trị tMCS chậm trễ có thể dẫn đến giảm tưới máu cơ quan, suy đa cơ quan và tử vong, do đó cần nhận diện sớm, khởi trị kịp thời và theo dõi sát trong 24 giờ đầu, khi bệnh nhân thường thay đổi giai đoạn SCAI, đặc biệt nhóm SCAI B có nguy cơ tiến triển nặng cao nhất. Cuối cùng, cần các thử nghiệm ngẫu nhiên có đối chứng nhằm xác định nhóm bệnh nhân hưởng lợi tối đa, giúp chuẩn hóa chiến lược chọn thiết bị, thời điểm can thiệp và mức hỗ trợ tối ưu để nâng cao tỷ lệ sống còn và phục hồi chức năng tim.
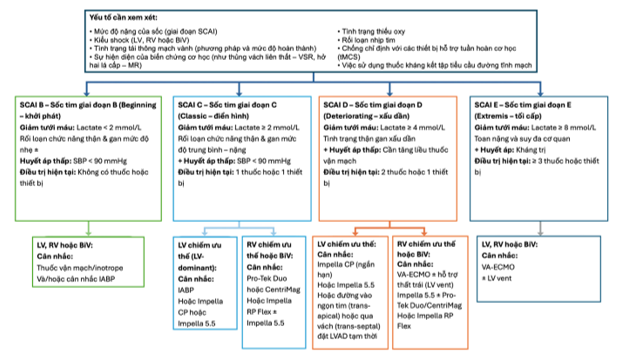
Hình 3B. Hướng dẫn điều trị shock tim do suy tim
2025 ACC Concise Clinical Guidance – Cardiogenic Shock (Sinha SS et al.). Giải thích viết tắt: BTT (Bridge to Transplantation – Cầu nối ghép tim), BTR (Bridge to Recovery – Cầu nối phục hồi chức năng tim), BiV (Biventricular – Hỗ trợ hai thất), CS (Cardiogenic Shock – Sốc tim), HF (Heart Failure – Suy tim), IABP (Intra-Aortic Balloon Pump Therapy – Bóng đối xung nội động mạch chủ), LV (Left Ventricular – Thất trái), LVAD (Left Ventricular Assist Device – Thiết bị hỗ trợ thất trái), pMCS (Percutaneous Mechanical Circulatory Support – Hỗ trợ tuần hoàn cơ học qua da), RCT (Randomized Controlled Trial – Thử nghiệm ngẫu nhiên có đối chứng), RV (Right Ventricular – Thất phải), SBP (Systolic Blood Pressure – Huyết áp tâm thu), SCAI (Society for Cardiovascular Angiography and Interventions – Hiệp hội Can thiệp Tim mạch Hoa Kỳ), tMCS (Temporary Mechanical Circulatory Support – Hỗ trợ tuần hoàn cơ học tạm thời) và VA–ECMO (Veno–Arterial Extracorporeal Membrane Oxygenation – Tuần hoàn ngoài cơ thể tĩnh–động mạch).
THEO DÕI BỆNH NHÂN KHI DÙNG HỖ TRỢ TUẦN HOÀN CƠ HỌC TẠM THỜI
Quản lý bệnh nhân sử dụng hỗ trợ tuần hoàn cơ học tạm thời (tMCS) đòi hỏi theo dõi liên tục và chuyên sâu, được định hướng bởi mức độ nặng của bệnh nhân và bệnh lý nền. Việc đánh giá toàn diện bao gồm yếu tố lâm sàng, xét nghiệm, hình ảnh học và các thông số huyết động. Mục tiêu tổng thể của quá trình theo dõi là phát hiện sớm biến chứng, điều chỉnh thông số thiết bị phù hợp, và đánh giá chức năng tim nội tại để xác định thời điểm thích hợp cho việc cai máy hoặc chuyển sang hỗ trợ lâu dài.
Theo dõi huyết động xâm lấn đóng vai trò then chốt ở bệnh nhân sử dụng tMCS, đặc biệt là những trường hợp sốc tim trung bình đến nặng không đáp ứng điều trị ban đầu. Bệnh nhân nên được đặt đường động mạch và catheter tĩnh mạch trung tâm để theo dõi huyết áp động mạch và áp lực tĩnh mạch trung tâm (CVP) liên tục. Catheter động mạch phổi (PAC) được khuyến cáo sử dụng thường xuyên, đặc biệt trong các trường hợp chẩn đoán khó hoặc sốc tim phức tạp, giúp đo cung lượng tim (CO), chỉ số tim (CI), áp lực động mạch phổi, và sức cản mạch hệ thống (SVR). Mục tiêu huyết động: CI > 2,2 L/phút/m², PCWP < 18 mmHg, CVP < 10–14 mmHg, và MAP duy trì 60–80 mmHg.
Theo dõi xét nghiệm và sinh hóa là bước thiết yếu để đánh giá tình trạng tưới máu cơ quan và hiệu quả hỗ trợ. Lactate là thông số cơ bản, cần đo khi nhập viện và lặp lại định kỳ trong giai đoạn đầu, vì giảm hoàn toàn lactate là yếu tố tiên lượng độc lập của sống sót. Bên cạnh đó, theo dõi độ bão hòa oxy tĩnh mạch trung tâm hoặc trộn (SvO₂/ScvO₂) và chênh lệch áp lực CO₂ (ΔPCO₂) giúp phản ánh cân bằng giữa cung và cầu oxy. Ngoài ra, cần theo dõi thường quy công thức máu, điện giải, chức năng thận – gan, đông máu, khí máu động mạch và troponin. Trong trường hợp cần thiết, lọc máu liên tục (CRRT) được ưu tiên hơn lọc máu ngắt quãng để tránh dao động thể tích và áp lực tuần hoàn [19].
Siêu âm tim là công cụ quan trọng và không thể thiếu trong giám sát bệnh nhân tMCS. Siêu âm qua thành ngực (TTE) cần được thực hiện hằng ngày hoặc nhiều lần trong ngày đầu tiên, giúp đánh giá cung lượng tim, chỉ số tim và tải thất. Dữ liệu hình ảnh thời gian thực hỗ trợ điều chỉnh mức độ hỗ trợ cơ học, hướng dẫn quy trình cai máy, và phát hiện rối loạn huyết động tiềm ẩn. Khi siêu âm không sẵn có, kỹ thuật nhiệt pha loãng xuyên phổi có thể được sử dụng để ước tính trực tiếp chức năng thất trái.
Cần giám sát chặt chẽ các biến chứng liên quan đến thiết bị, bao gồm huyết khối, chảy máu và nhiễm trùng. Theo dõi chi để phát hiện thiếu máu chi, chảy máu, hoặc tổn thương thần kinh nên được thực hiện thường xuyên bằng sờ mạch hoặc siêu âm Doppler. Vị trí đặt canuyn cần được kiểm tra định kỳ, và băng dán trong suốt giúp quan sát chảy máu, máu tụ và nhiễm trùng. Theo dõi chống đông là bắt buộc, bao gồm xét nghiệm aPTT, ACT hoặc anti-Xa để cân bằng giữa nguy cơ huyết khối bơm và chảy máu. Ngoài ra, cần theo dõi chỉ số tan máu (LDH, Hb tự do, bilirubin, màu nước tiểu); khi có dấu hiệu tan máu, phải giảm tốc độ bơm, chỉnh vị trí hoặc rút thiết bị nếu không cải thiện.
Giai đoạn cai máy đòi hỏi theo dõi đặc biệt để xác định hồi phục cơ tim thật sự chứ không chỉ là duy trì huyết động ổn định. Cải thiện huyết áp, lactate và chức năng cơ quan chỉ phản ánh hỗ trợ hiệu quả, chưa chứng minh hồi phục. Các chỉ số huyết động như áp lực mạch (pulse pressure), chỉ số sức mạnh tim (CPO) và chỉ số dao động động mạch phổi (PAPi) hỗ trợ đánh giá khả năng cai máy [19].
Tiêu chuẩn siêu âm đánh giá hồi phục thất trái: LVOT-VTI ≥ 12 cm, LVEF > 25%, và vận tốc S’ ≥ 6 cm/s. Khi cai VA-ECMO, có thể giảm dần lưu lượng 0,5–1 L/phút mỗi lần cho đến mức 1,5–2,0 L/phút; nếu huyết động ổn định, có thể rút canuyn an toàn.
Tóm lại, theo dõi bệnh nhân trên tMCS không chỉ là đảm bảo thiết bị hoạt động, mà là quá trình quản lý toàn diện dựa trên dữ liệu xâm lấn (PAC, arterial line) kết hợp với xét nghiệm sinh hóa và siêu âm tim. Cách tiếp cận này giúp duy trì tưới máu tối ưu, phát hiện sớm biến chứng, và nhận biết dấu hiệu hồi phục cơ tim, giống như chiếc radar dẫn dắt con tàu mong manh vượt qua vùng biển dữ dội để cập bến an toàn [20].
KẾT LUẬN
Sốc tim vẫn là một trong những thách thức lớn của hồi sức tim mạch hiện đại, với tỷ lệ tử vong cao dù đã có nhiều tiến bộ trong chẩn đoán và điều trị. Các thiết bị hỗ trợ tuần hoàn cơ học tạm thời (tMCS) đóng vai trò trung tâm trong việc ổn định huyết động, cải thiện tưới máu và tạo cơ hội phục hồi cơ tim hoặc chuẩn bị cho các chiến lược điều trị nâng cao như ghép tim hay cấy thiết bị hỗ trợ thất lâu dài. Tuy nhiên, bằng chứng hiện có vẫn còn hạn chế, chủ yếu dựa trên các nghiên cứu trong sốc tim do nhồi máu cơ tim cấp, và chưa xác định được hiệu quả rõ ràng trong sốc tim không do thiếu máu cục bộ. Việc lựa chọn thiết bị, thời điểm can thiệp và mức độ hỗ trợ cần được cá thể hóa dựa trên kiểu hình lâm sàng và mức độ suy cơ quan. Quản lý tối ưu đòi hỏi sự phối hợp của đội sốc tim đa chuyên khoa, nhằm ra quyết định nhanh chóng, theo dõi huyết động chính xác và hạn chế biến chứng. Trong tương lai, các nghiên cứu cần tập trung vào việc xác định các kiểu hình sinh lý bệnh cụ thể (endotype) của sốc tim để hướng tới cá thể hóa điều trị, từ đó cải thiện tiên lượng và chất lượng sống cho người bệnh.
TÀI LIỆU THAM KHẢO
- Laghlam D, Lassus J, Mebazaa A. Management of cardiogenic shock: a narrative review. Ann Intensive Care.2024;14(1):45.
- Jung C, Bruno RR, Jumean M, Price S, Krychtiuk KA, Ramanathan K, et al. Management of cardiogenic shock: state-of-the-art. Intensive Care Med. 2024;50(11):1814-29.
- Giao DM, Giugliano RP. Left Ventricular Mechanical Circulatory Support Devices for Cardiogenic Shock After Myocardial Infarction. Cardiol Ther. 2025;14(2):1-17.
- Butt Z, Sharif S, Ahmad M, Daly MJ, O’Neill J, Gentry-Maharaj A, et al. Mechanical circulatory support for infarct-related cardiogenic shock: a systematic review, pairwise and network meta-analysis. Eur Heart J Open. 2025;5(4):oeaf091.
- Martin-Villen L, Adsuar-Gomez A, Garrido-Jimenez JM, Perez-Vela JL, Fuset-Cabanes MP. Mechanical circulatory support in cardiogenic shock. Med Intensiva (Engl Ed).2023;48(8):471-483.
- Basir MB, Lemor A, Gorgis S, Patel KC, Kolski BC, Bharadwaj AS, et al. Early Utilization of Mechanical Circulatory Support in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The National Cardiogenic Shock Initiative. J Am Heart Assoc.2023;12(23):e031401.
- Naidu SS, Baran DA, Jentzer JC, et al. SCAI SHOCK Stage Classification Expert Consensus Update: A Review and Incorporation of Validation Studies. J Am Coll Cardiol. 2022;79(9):933-946.
- Jentzer JC, Rayfield C, Soussi S, Berg DD, Kennedy JN, Sinha SS, et al. Advances in the Staging and Phenotyping of Cardiogenic Shock: Part 1 of 2. J Am Coll Cardiol. 2022;80(3):185-198.
- Kapur NK, Kanwar M, Sinha SS, et al. Advances in the Staging and Phenotyping of Cardiogenic Shock: Part 1 of 2. J Am Coll Cardiol. 2022;80(3):185–198.
- Kislitsina ON, Rich JD, Wilcox JE, Pham DT, Churyla A, Vorovich EB, et al. Shock: Classification and Pathophysiological Principles of Therapeutics. Clin Chest Med. 2019;36(2):297-302.
- Tehrani BN, Truesdell AG, Sherwood MW, et al. A Standardized and Comprehensive Approach to the Management of Cardiogenic Shock. JACC Heart Fail. 2020;8(11):879-891.
- Ranek MJ, Berthiaume JM, Kirk JA, et al. Pathophysiology of heart failure and an overview of therapies. In: Cardiovascular Pathology. 5th ed. Elsevier; 2022. p. 149-221.
- Barnett CF, Brusca SB, Hanff TC, Blumer V, Kalif A, Kanwar M. Management of Cardiogenic Shock Unrelated to Acute Myocardial Infarction. Can J Cardiol. 2023;39(4):406-419.
- Martin-Villen L, Adsuar-Gomez A, Perez-Vela JL, Fuset-Cabanes MP. Mechanical circulatory support in cardiogenic shock patients. Med Intensiva (Engl Ed). 2024;48(1):42-56.
- Moeller CM, Valledor AF, Oren D, et al. Evolution of Mechanical Circulatory Support for Advanced Heart Failure. Prog Cardiovasc Dis. 2024;82:135-146.
- Dugal JK. Advances in Mechanical Circulatory Support (MCS): Literature Review. Int J Res Publ Rev.2025;6(1).
- McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-3726.
- Hollenberg SM, Warner Stevenson L, Ahmad T, et al. 2024 ACC Expert Consensus Decision Pathway on Clinical Assessment, Management, and Trajectory of Patients Hospitalized With Heart Failure: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol. 2024;83(16):1552-1596.
- Bernhardt AM, Copeland H, Desvigne-Nickens P, et al. The International Society for Heart and Lung Transplantation/Heart Failure Society of America Guideline on Acute Mechanical Circulatory Support. J Heart Lung Transplant. 2023;42(4):e1-e64.
- Vlachakis PK, Theofilis P, Leontsinis I, Drakopoulou M, Karakasis P, Oikonomou E, et al. Bridge to Life: Current Landscape of Temporary Mechanical Circulatory Support in Heart-Failure-Related Cardiogenic Shock. J Clin Med. 2024;13(14):4120.
- Potapov E, et al. EACTS/STS/AATS Guidelines on temporary mechanical circulatory support in adult cardiac surgery. Eur J Cardiothorac Surg. 2025.
- Nakata J, Amiya E, Hatano M, Maki H, Kanda Y, Ikari Y, et al. Mechanical circulatory support in cardiogenic shock. J Intensive Care. 2023;11:64.
- Giao DM, Giugliano RP. Left Ventricular Mechanical Circulatory Support Devices for Cardiogenic Shock After Myocardial Infarction. Cardiol Ther. 2025;14(2):1-17.
- Møller JE, Thiele H, Morrow D, et al. Mechanical circulatory support: when, how, and for whom. Eur Heart J.2025;46(16):1480-1492.
- Desai SR, Hwang NC. 2023 ISHLT Guidelines for Mechanical Circulatory Support. J Cardiothorac Vasc Anesth. 2023;37(12):2419-2422.
- Albulushi A, Tawfek A, Al Lawatia H. Evaluating the efficacy and safety of temporary mechanical circulatory support devices in acute cardiogenic shock: A subgroup-specific systematic review. Curr Probl Cardiol. 2024;49(8):102619.
- Moller JE, Thiele H, Zeymer U, et al. Mechanical circulatory support for patients with infarct-related cardiogenic shock: a state-of-the-art review. Heart. 2025;111:heartjnl-2024-324883.
- Abraham J, Blumer V, Burkhoff D. Heart Failure-Related Cardiogenic Shock: Pathophysiology, Evaluation and Management Considerations. J Card Fail. 2021;27(10):1126-1140.







