Mục tiêu nghiên cứu: Đánh giá tính hiệu quả và tính an toàn của viên phối hợp liều cố định (single-pill combination – SPC) telmisartan và amlodipine (T/A) trên bệnh nhân tăng huyết áp Á châu có huyết áp (HA) chưa được kiểm soát thỏa đáng với đơn trị liệu hay trị liệu phối hợp liều thấp.
Dingliang Zhu,1 Pingjin Gao,1 Nobutaka Yagi,2 và Helmut Schumacher3
1Bệnh viện Ruijin, Trường Y Đại học Shanghai Jiaotong, Viện Tăng Huyết áp Shanghai, 197 Ruijin Road, Shanghai 200025, China
2Nippon Boehringer Ingelheim Co., Ltd, 2-1-1, Osaki, Shinagawa-ku, Tokyo 141-6017, Japan
3Boehringer Ingelheim Pharma GmbH & Co. KG, Binger Straße 173, 55216 Ingelheim, Germany
Phạm Thị Mai Hoà
Khoa Nội Tim mạch – Viện Tim TPHCM
Đối tượng và phương pháp nghiên cứu:Dữ liệu được lấy từ 5 nghiên cứu pha 3, mù đôi, trong 8 tuần, được Boehringer Ingelheim tài trợ: 2 nghiên cứu trên bệnh nhân không đáp ứng amlodipine (dữ liệu gộp cho amlodipine), 2 nghiên cứu trên bệnh nhân không đáp ứng telmisartan (dữ liệu gộp cho telmisartan), và 1 nghiên cứu trên bệnh nhân không đáp ứng với phối hợp telmisartan và amlodipine liều thấp.
Kết quả:Sau 8 tuần điều trị, mức giảm trung bình so với ban đầu của HA tâm trương (HATTr; tiêu chí chính), HA tâm thu (HATT), tỉ lệ đạt mục tiêu HATT, HATTr và tỉ lệ đáp ứng đều cao hơn ở nhóm dùng phối hợp telmisartan/amlodipine liều cố định (T/A SPC) so với nhóm đơn trị liệu tương ứng. Liều T80/A5 SPC đạt hiệu quả giảm HATTr, HATT tốt hơn, tỉ lệ đạt mục tiêu HATTr cũng như tỉ lệ đáp ứng điều trị cao hơn liều T40/A5 SPC. Biến chứng phù ngoại biên thấp (amlodipine 0.5%, telmisartan 0.0%, và T/A SPC 0.7%).
Bàn luận và kết luận:Trên bệnh nhân Á châu có HA chưa được kiểm soát thỏa đáng với telmisartan và amlodipine đơn trị, trị liệu với T/A SPC cho kết quả hạ áp tốt hơn, tỉ lệ đạt mục tiêu HATTr, HATT và tỉ lệ đáp ứng điều trị cao hơn. Tính an toàn và dung nạp của T/A SPC tương tự đơn trị liệu tương ứng, phù hợp với các kết quả đã được báo cáo trong những nghiên cứu trước.
1. Tổng quan
Trong Đề án Cộng tác Các Nghiên cứu Đoàn hệ Châu Á Thái Bình Dương (Asia Pacific Cohort Studies Collaboration), có đến 66% của một số dưới nhóm bệnh tim mạch trong vùng Châu Á Thái Bình Dương được gán cho là do tăng huyết áp [1]. HA cao liên quan tới nguy cơ gia tăng bệnh tim mạch, đột quị, và bệnh tim trong dân số Nhật Bản [2-4] và Trung Quốc [5]. Nghiên cứu Bằng Chứng Phòng Ngừa Bệnh Tim Mạch từ Các Nghiên Cứu Đoàn Hệ Quan Sát trong Nhóm Nghiên Cứu Nhật Bản (Evidence for Cardiovascular Prevention from Observational Cohorts in Japan Research Group – EPOCH-JAPAN), cho thấy tần suất tăng huyết áp trong dân số Nhật khoảng 20% [6]. Tương tự, trong dân số Hoa, tần suất toàn bộ được báo cáo khoảng 21.5% [7], cao hơn ở người lớn tuổi (59.4%) [8].Ở người Á châu nói chung, tỉ lệ kiểm soát huyết áp thấp, và có sự tương quan lớn hơn giữa HA và nguy cơ bệnh tim mạch [9].
Việc đạt HA mục tiêu nhanh và lâu dài là quan trọng để giảm nguy cơ tim mạch. Ít nhất 75% bệnh nhân tăng huyết áp cần điều trị phối hợp để sớm đạt HA mục tiêu [10], và các khuyến cáo đề nghị nên dùng các phối hợp đơn viên (SPC) liều cố định do tính đơn giản, thuận tiện và kinh tế [11, 12]. SPC cải thiện sự tuân thủ điều trị, kết quả là kiểm soát HA và giảm nguy cơ tim mạch lâu dài tốt hơn [13-15]. Điều trị với SPC cũng làm giảm đáng kể chi phí hàng năm [16, 17]. Sự cải thiện có ý nghĩa mức tuân thủ và khuynh hướng có lợi không đáng kể về HA và tác dụng phụ được quan sát thấy khi dùng SPC so với những kết hợp thuốc tự do [18].
Phối hợp giữa một ức chế hệ renin-angiotensin (RAS) và một ức chế kênh canxi (CCB) được khuyến cáo như là một phối hợp hữu lý điều trị tăng huyết áp [11, 12, 19, 20] và cũng là phối hợp được ưa chuộng trên bệnh nhân có nguy cơ tim mạch cao, bệnh nhân có bằng chứng bệnh lý thận, do có lợi ích bảo vệ tim mạch và thận [21-23]. Telmisartan là thuốc ức chế thụ thể angiotensin (ARB) duy nhất đã được chứng minh làm giảm nguy cơ tim mạch tương đương với thuốc ức chế men chuyển (ACE) ramipril, ở bệnh nhân có nguy cơ tim mạch cao [24], làm giảm HA tốt hơn và ổn định hơn suốt 24 giờ so với các ARB [25] và các hoạt chất hạ áp khác [26]. Một nghiên cứu dưới nhóm của ONTARGET (Ongoing Telmisartan Alone and in Combination with Ramipril Global Endpoint Trial) và TRANSCEND (Telmisartan Randomized Assessment Study in ACE Intolerant Subjects with Cardiovascular Disease) so sánh độ dung nạp của telmisartan và ramipril trên bệnh nhân Á châu với bệnh nhân không Á châu, cho thấy ưu thế dung nạp telmisartan so với ramipril cao hơn ở nhóm Á châu so với không Á châu [27]. Phối hợp đơn viên giữa telmisartan và amlodipine – T/A SPC (MICAMLO) được chấp nhận ở Nhật với liều telmisartan 40mg/amlodipine 5mg (T40/A5) và telmisartan 80mg/amlodipine 5mg (T80/A5) trong điều trị tăng huyết áp trên bệnh nhân không kiểm soát được với đơn trị liệu. T/A SPC được chấp nhận trong điều trị tăng huyết áp như là liệu pháp đầu tay, tăng cường hay thay thế ở Việt Nam (liều T40/A5 và T80/A5) và Malaysia (T40/A5, T40/A10, T80/A5 và T80/A10), và điều trị tăng cường hay thay thế ở Đài Loan (liều T40/A5, T40/A10, T80/A5 và T80/A10) và Hàn Quốc (liều T40/A5 và T80/A10 trong liệu pháp tăng cường hay thay thế, T80/A5 và T40/A10 trong điều trị tăng cường).
Mục tiêu của phân tích này là đánh giá hiệu quả và tính an toàn của T/A SPC trên bệnh nhân tăng huyết áp Á châu có HA chưa đươc kiểm soát thỏa đáng với telmisartan và amlodipine đơn trị hay trị liệu phối hợp liều thấp.
2. Đối tượng và phương pháp nghiên cứu
2.1. Các nghiên cứu:
Các nghiên cứu được Boehringer Ingelheim tài trợ khảo sát phối hợp T/A trên bệnh nhân tăng huyết áp Á châu: hai nghiên cứu trên bệnh nhân không đáp ứng với amlodipine đơn trị (nghiên cứu không đáp ứng A5 (1) [NCT00558064], nghiên cứu không đáp ứng A5 (2) [NCT01103960]), hai nghiên cứu trên bệnh nhân không đáp ứng với telmisartan đơn trị (nghiên cứu không đáp ứng T40 [NCT00550953], nghiên cứu không đáp ứng T80 [NCT01222520]), và một nghiên cứu trên bệnh nhân không đáp ứng với trị liệu phối hợp T/A liều thấp (nghiên cứu không đáp ứng T40/A5 [NCT01286558]) (Bảng 1).
2.2. Đối tượng nghiên cứu
Trong tất cả các nghiên cứu, đối tượng tham gia có tăng huyết áp, từ 20 tuổi trở lên (≥ 18 tuổi trong nghiên cứu không đáp ứng A5 (2)), cả nam và nữ. Bệnh nhân tăng huyết áp thứ phát, có bệnh hệ thống nặng hay chưa ổn định, có tiền căn phù mạch khi dùng ACE hay ARB, phụ nữ mang thai, cho con bú hay dự định có thai bị loại khỏi tất cả nghiên cứu. Ngoài ra, thêm tiêu chuẩn loại trừ khi sàng lọc trong nghiên cứu không đáp ứng T40 và A5 (1) là đang điều trị với ≥ 4 loại thuốc hạ áp, trong nghiên cứu không đáp ứng T80 và T40/A5 là đang điều trị với ≥ 3 thuốc hạ áp. Tất cả các nghiên cứu cũng loại trừ bệnh nhân không tuân thủ dùng thuốc nghiên cứu trong giai đoạn thu thập nhãn mở (open-label run-in period) (được định nghĩa là đã dùng <80% hay >120% thuốc đã kê, dựa trên đếm số viên). Tiêu chuẩn HA nhận vào hay loại trừ được cung cấp trong bảng 1.
Tất cả 5 nghiên cứu được tiến hành tuân thủ theo đề cương, các nguyên tắc viết trong Tuyên ngôn Helsinki, Hội nghị Quốc tế về Điều phối Ba Bên cho các Hướng dẫn Thực hành Tốt Lâm sàng, và các quy định về quản lý có thể áp dụng được. Đề cương nghiên cứu được các hội đồng đạo đức độc lập hay các ban kiểm cơ quan tại từng địa điểm nghiên cứu xét duyệt, và tất cả các bệnh nhân đều cung cấp văn bản ưng thuận trước khi vào nghiên cứu.
2.3. Thiết kế nghiên cứu.
Tất cả 5 nghiên cứu là nghiên cứu pha 3, tiến cứu, đa trung tâm, ngẫu nhiên, kiểm soát tích cực, giả đôi (double-dummy), mù đôi, nhóm song song. Trong tất cả các nghiên cứu, bệnh nhân không đạt HATTr mục tiêu <90mmHg (<80mmHg trong nghiên cứu không đáp ứng T40/A5) sau điều trị trong giai đoạn thu thập nhãn mở được phân nhóm ngẫu nhiên tỉ lệ 1:1 để điều trị mù đôi trong 8 tuần. Chi tiết nghiên cứu được cung cấp trong bảng 1.
Bảng 1: Chi tiết các nghiên cứu (NC)
|
|
NC không đáp ứng A5 (1) |
NC không đáp ứng A5 (2) |
NC không đáp ứng T40 |
NC không đáp ứng T80 |
NC không đáp ứng T/A liều thấp |
|
Mã thử nghiệm |
NCT00558064 |
NCT01103960 |
NCT00550953 |
NCT01222520 |
NCT01286558 |
|
Trích dẫn |
Dữ kiện hồ sơ |
Zhu và cộng sự [28] |
Dữ kiện hồ sơ |
Dữ kiện hồ sơ |
Dữ kiện hồ sơ |
|
Thời gian nghiên cứu |
10/10/2007-27/9/2008 |
28/7/2010-27/8/2011 |
15/10/2007-19/7/2008 |
23/10/2010-18/6/2011 |
22/1/2011-15/10/2011 |
|
Địa điểm nghiên cứu |
41 điểm tại Nhật |
16 điểm khảo sát – 12 điểm tại Cộng Hòa Nhân Dân Trung Hoa, 2 điểm tại Malaysia, và 2 điểm tại Philippine |
5 điểm tại Nhật |
4 điểm tại Nhật |
8 điểm tại Nhật |
|
Tiêu chuẩn HA khi nhận bệnh, bắt đầu giai đoạn thu thập nhãn mở |
HATTr ≥95 và ≤114 mmHg HATT ≥140 và ≤200 mmHg |
HATTr ≥95 nếu đang điều trị hạ áp, hay ≥100 mmHg nếu không điều trị |
HATTr ≥95 và ≤114 mmHg HATT ≥140 và ≤200 mmHg |
HATTr ≥90 và ≤114 mmHg nếu đang điều trị hạ áp, HATTr ≥95 và ≤114 mmHg nếu không điều trị, HATT ≥140 và ≤200 mmHg |
HATTr ≥90 và ≤114 mmHg nếu đang điều trị hạ áp, HATTr ≥95 và ≤114 mmHg nếu không điều trị, HATT ≤200 mmHg |
|
Tiêu chuẩn HA khi nhận bệnh, bắt đầu giai đoạn 8 tuần điều trị mù đôi |
HATTr ≥90 và ≤114 mmHg HATT ≤200 mmHg
|
HATTr ≥90 mmHg
|
HATTr ≥90 và ≤114 mmHg HATT ≥140 và ≤200 mmHg
|
HATTr ≥90 và ≤114 mmHg HATT ≥140 và ≤200 mmHg
|
HATTr ≥80 và ≤114 mmHg HATT ≥140 và ≤200 mmHg
|
|
Tiêu chuẩn HA loại trừ |
HATT/HATTr >200/>114 mmHg khi sàng lọc, lúc bắt đầu giai đoạn thu thập nhãn mở hay điều trị mù đôi HATT/HATTr >200/>114 mmHg hay HATTr <90 mmHg sau 2 tuần thu thập nhãn mở |
HA ≥200/120 mmHg khi sàng lọc hay trong giai đoạn thu thập; ≥180/120 mmHg cuối giai đoạn thu thập |
HATT/HATTr >200/>114 mmHg khi sàng lọc, lúc bắt đầu giai đoạn thu thập nhãn mở hay điều trị mù đôi HATTr <90 mmHg khi bắt đầu giai đoạn thu thập nhãn mở |
|
|
|
Thời gian và điều trị trong giai đoạn thu thập nhãn mở |
A5 ngày 1 lần trong 6 tuần |
A5 ngày 1 lần trong 6 tuần |
T20 ngày 1 lần trong 2 tuần sau đó T40 ngày một lần trong 4 tuần |
T20 trong 2 tuần; T40 trong 2 tuần; T80 trong 4 tuần |
T20 trong 2 tuần; T40 trong 4 tuần; T40/A5 trong 6 tuần |
|
Số bệnh nhân giai đoạn thu thập |
636 |
381 |
357 |
197 |
292 |
|
Thời gian điều trị mù đôi |
8 tuần |
8 tuần |
8 tuần |
8 tuần |
8 tuần |
|
Nhóm điều trị mù đôi |
A5; T20 + A5 trong 2 tuần; T40/A5 SPC trong 6 tuần |
A5; T80/A5 SPC |
T40; T40/A5 SPC |
T80; T80/A5 SPC |
T40/A5 SPC; T80/A5 SPC |
|
Số bệnh nhân trong nhóm phân ngẫu nhiên |
262; 269 |
164; 160 |
158; 156 |
87; 87 |
113; 112 |
A5: amlodipine 5 mg; HA: huyết áp; HATTr: HA tâm trương; HATT: HA tâm thu; NCT: National Clinical Trial, thử nghiệm lâm sàng quốc gia; SPC: single-pill combination, phối hợp đơn viên; T20: telmisartan 20 mg; T40: telmisartan 40 mg; T80: telmisartan 80 mg; T/A: telmisartan và amlodipine.
HATTr và HATT được lấy trị số trung bình đo khi ngồi.
2.4. Đánh giá hiệu quả
Trong cả 5 nghiên cứu, HA và tần số mạch được đo vào buổi sáng, khoảng 24 giờ sau liều cuối cùng. HA khi ngồi được đo trong mỗi lần khám với HA kế đo tay truyền thống được chuẩn hóa, sau khi bệnh nhân đã nghỉ ở tư thế ngồi khoảng 5 phút. HA được đo cùng một tay với tay có giá trị HA cao hơn đã được xác định trong lượt khám sàng lọc, và thường do cùng một người đo trong tất cả các lần khám nghiên cứu. Độ chính xác của trị số HA được tăng cường bởi việc lấy trung bình 3 trị số liên tiếp đo cách nhau khoảng 2 phút. Tần số mạch được đo trong khỏang chờ 2 phút giữa lần đo HA thứ hai và thứ ba.
2.5. Tiêu chí hiệu quả
Trong tất cả các nghiên cứu, tiêu chí chính là sự giảm so với trị số nền tham khảo của trũng HATTr trung bình khi ngồi (24 giờ sau liều cuối) sau 8 tuần điều trị mù đôi. Nền tham khảo được định nghĩa là trị số HA đo được cuối giai đoạn thu thập nhãn mở, ngay trước liều đầu tiên trong giai đoạn điều trị mù đôi. Tiêu chí phụ trong tất cả các nghiên cứu, bao gồm thay đổi trũng HATT khi ngồi so với nền tham khảo; tỉ lệ bệnh nhân đạt HA mục tiêu (trũng HA trung bình khi ngồi < 140/90 mmHg); sự đạt HATTr mục tiêu (trũng HATTr trung bình khi ngồi < 90 mmHg); sự đạt HATT mục tiêu (trũng HATT trung bình khi ngồi < 140 mmHg); tỉ lệ bệnh nhân đạt đáp ứng HATTr (trũng HATTr trung bình khi ngồi < 90 mmHg hay giảm HATTr ≥ 10 mmHg); và tỉ lệ bệnh nhân đạt đáp ứng HATT (trũng HATT trung bình khi ngồi < 140 mmHg hay giảm HATT ≥ 20 mmHg [≥ 15 mmHg trong nghiên cứu không đáp ứng A5 (2)]). Tiêu chí hiệu quả được đánh giá sau 4 và 8 tuần điều trị hoặc qua quan sát cuối cùng trong giai đoạn điều trị mù đôi.
2.6. Đánh giá tính an toàn
Trong cả 5 nghiên cứu, thăm khám lâm sàng, xét nghiệm máu và điện tâm đồ 12 chuyển đạo được thực hiện lúc sàng lọc, phân nhóm ngẫu nhiên và khi kết thúc hay khi rút sớm khỏi nghiên cứu. Tần số mạch và biến cố bất lợi (adverse events – AEs) được ghi nhận trong tất cả lần khám.
2.7. Phân tích thống kê
Trong các phân tích chứng thực của cả 5 nghiên cứu, sự giảm HATTr và HATT sau 8 tuần điều trị mù đôi được phân tích với mô hình phân tích hiệp biến (analysis of covariance – ANCOVA), có điều trị là ảnh hưởng bất biến, trung tâm là ảnh hưởng ngẫu nhiên, và trị số nền tham khảo là hiệp biến; trong nghiên cứu không đáp ứng A5 (2), quốc gia (thay vì trung tâm) được tính đến. Quan sát trũng cuối được dùng để ước tính dữ liệu không trong tiêu chí liên quan trũng HA khi ngồi. Tiêu chí an toàn được tổng kết dạng mô tả.
Các thống kê của bài khái quát này đơn thuần thuộc dạng mô tả. Bộ phân tích đầy đủ, bao gồm tất cả bệnh nhân dùng ít nhất 1 liều thuốc nghiên cứu, được lấy trị số HA nền tham khảo và có ít nhất 1 lần đo HA khi điều trị ngẫu nhiên, được dùng cho phân tích hiệu quả, các đặc tính nền và nhân khẩu học. Bộ phân tích sau điều trị, bao gồm tất cả bệnh nhân được phân nhóm ngẫu nhiên có dùng ít nhất 1 liều thuốc nghiên cứu, được dùng cho phân tích tính an toàn. Các phân tích dùng chương trình SAS phiên bản 9.3 (SAS Institute Inc., Cary, NC, USA).
Dữ liệu trong 5 nghiên cứu được phân thành 3 nhóm – (1) không đáp ứng A5: dữ liệu từ 2 nghiên cứu không đáp ứng amlodipine (dữ liệu chỉ được gộp cho nhóm A5 từ 2 nghiên cứu này); (2) không đáp ứng với T40 hay T80: dữ liệu từ 2 nghiên cứu không đáp ứng với telmisartan; và (3) không đáp ứng với phối hợp T40/A5: dữ liệu từ 1 nghiên cứu không đáp ứng với T40/A5.
3. Kết quả
3.1. Đối tượng nghiên cứu.
Có tất cả 1542 bệnh nhân được nhận vào từ 5 nghiên cứu. Đặc tính nền và nhân khẩu học của các bệnh nhân giống nhau ở 3 nhóm nghiên cứu. Tuổi trung bình 52-57, đa số bệnh nhân (60%) dưới 60 tuổi, và đa số là nam giới trong mỗi dưới nhóm điều trị ở 3 nhóm nghiên cứu (Bảng 2). Tất cả bệnh nhân là Á châu, và >84% không có tiền sử đái tháo đường. Thời gian bị tăng huyết áp trung bình 6.6-8.6 năm. HATT/HATTr trung bình tại thời điểm phân nhóm ngẫu nhiên (trị số nền tham khảo) >140/>95 mmHg trong thử nghiệm không đáp ứng đơn trị liệu và >130/90 trong thử nghiệm không đáp ứng với phối hợp liều thấp (Bảng 2).
Bảng 2: Đặc điểm nền và nhân khẩu học (Bộ phân tích đầy đủ)
|
|
Không đáp ứng A5 |
Không đáp ứng T40 hay T80 |
Không đáp ứng T/A liều thấp |
Tổng cộng |
||||||
|
A5 (n = 416) |
T40/A5 SPC (n = 263) |
T80/A5 SPC (n = 155) |
T40 (n = 158) |
T40/A5 SPC (n = 153) |
T80 (n = 86) |
T80/A5 SPC (n = 87) |
T40/A5 SPC (n = 112) |
T80/A5 SPC (n = 112) |
N = 1542 |
|
|
Tuổi trung bình (SD) |
54.6 (10.0) |
57.0 (9.6) |
52.4 (8.7) |
55.5 (10.2) |
55.6 (9.1) |
54.8 (8.7) |
54.5 (9.0) |
52.8 (9.4) |
54.6 (8.4) |
54.9 (9.5) |
|
Nhóm tuổi, n (%) |
|
|||||||||
|
<50 tuổi |
124 (29.8) |
63 (24.0) |
60 (38.7) |
43 (27.2) |
35 (22.9) |
24 (27.9) |
28 (32.2) |
45 (40.2) |
35 (31.3) |
457 (29.6) |
|
50-<60 tuổi |
159 (38.2) |
100 (38.0) |
65 (41.9) |
62 (39.2) |
66 (43.1) |
34 (39.5) |
31 (35.6) |
40 (35.7) |
49 (43.8) |
606 (39.3) |
|
≥60 tuổi |
133 (32.0) |
100 (38.0) |
30 (19.4) |
53 (33.5) |
52 (34.0) |
28 (32.6) |
28 (32.2) |
27 (24.1) |
28 (25.0) |
479 (31.3) |
|
BMI trung bình (SD) |
25.7 (3.9) |
25.5 (3.2) |
26.1 (3.1) |
25.7 (4.0) |
25.3 (3.6) |
26.4 (4.1) |
25.6 (4.0) |
26.2 (4.0) |
26.1 (4.2) |
25.8 (3.7) |
|
Giới, n (%) |
|
|||||||||
|
Nữ |
147 (35.5) |
71 (27.0) |
78 (50.3) |
35 (22.2) |
42 (27.5) |
12 (14.0) |
20 (23.0) |
24 (21.4) |
23 (20.5) |
452 (29.3) |
|
Nam |
269 (64.7) |
192 (73.0) |
77 (49.7) |
123 (77.8) |
111 (72.5) |
74 (86.0) |
67 (77.0) |
88 (78.6) |
89 (79.5) |
1090 (70.7) |
|
Chủng tộc, n (%) |
|
|||||||||
|
Á châu |
416 (100.0) |
263 (100.0) |
155 (100.0) |
158 (100) |
153 (100) |
86 (100) |
87 (100) |
112 (100) |
112 (100) |
1542 (100) |
|
Đái tháo đường |
|
|||||||||
|
Không |
357 (85.8) |
213 (81.0) |
137 (88.4) |
147 (93.0) |
141 (92.2) |
77 (89.5) |
80 (92.0) |
105 (93.8) |
105 (93.8) |
1362 (88.3) |
|
Có |
59 (14.2) |
50 (19.0) |
18 (11.6) |
11 (7.0) |
12 (7.8) |
9 (10.5) |
7 (8.0) |
7 (6.3) |
7 (6.3) |
180 (11.7) |
|
HATT nền trung bình (SD), mmHg |
145.7 (10.7) |
144.6 (11.8) |
146.4 (12.2) |
144.8 (13.4) |
145.7 (12.2) |
144.3 (14.5) |
143.7 (13.8) |
134.5 (13.6) |
133.7 (10.6) |
143.6 (12.7) |
|
HATTr nền trung bình (SD), mmHg |
96.5 (5.6) |
95.9 (5.0) |
97.2 (5.5) |
96.6 (6.0) |
96.8 (5.3) |
98.5 (6.7) |
98.0 (6.0) |
90.7 (8.0) |
90.1 (6.7) |
95.8 (6.3) |
|
Tần số mạch nền trung bình (SD) |
71.4 (9.4) |
70.6 (8.8) |
70.7 (7.6) |
69.1 (8.5) |
68.8 (7.7) |
71.2 (9.8) |
68.1 (8.3) |
71.1 (9.8) |
71.7 (9.3) |
70.5 (8.9) |
|
Thời gian bệnh trung bình (SD) |
7.5 (8.0) |
6.8 (7.8) |
7.7 (8.9) |
7.1 (7.5) |
7.8 (7.7) |
8.6 (6.1) |
8.3 (6.4) |
7.8 (7.6) |
6.6 (6.8) |
7.5 (8.0) |
A5: amlodipine 5 mg; BMI: body mass index; HATTr: HA tâm trương; HATT: HA tâm thu; SD: standard deviation, độ lệch chuẩn; SPC: single-pill combination, phối hợp đơn viên; T40: telmisartan 40 mg; T80: telmisartan 80 mg; T/A: telmisartan và amlodipine.
Số bệnh nhân trong phân tích này có thể khác với trong các xuất bản từng nghiên cứu, do khác biệt về cách tiếp cận thống kê đối với từng nghiên cứu riêng.
3.2. Hiệu quả
Trong từng nghiên cứu riêng, bình quân điều chỉnh của độ giảm HATTr sau điều trị cao hơn có ý nghĩa ở nhóm T/A SPC so với bất kỳ đơn trị liệu nào (Bảng 3). T80/A5 SPC cũng cho kết quả giảm nhiều hơn so với phối hợp liều thấp ở nhóm không đáp ứng T40/A5 (Bảng 3). Hình 1 biểu thị sự giảm trung bình HATTr và HATT so với nền tham khảo sau 8 tuần điều trị trong 3 nhóm nghiên cứu. Ưu điểm của T/A SPC ổn định qua các nhóm tuổi trong 3 nhóm nghiên cứu (Hình 2(a), 2(b) và 2(c)).

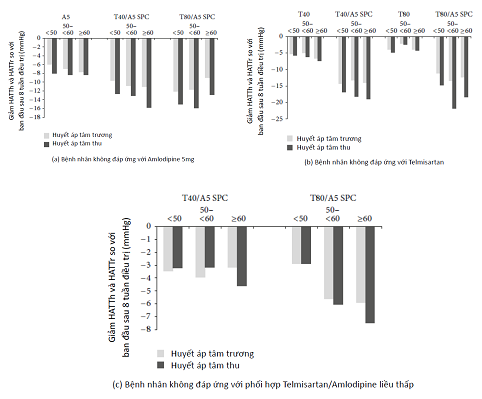
Hình 2:Thay đổi HATTr và HATT so với trị số nền theo nhóm tuổi trong 3 nhóm nghiên cứu sau 8 tuần điều trị với phối hợp T/A. Trục hoành biểu thị trị số HA nền tham khảo, được đo ngay trước liều đầu tiên trong giai đoạn điều trị mù đôi. A5: amlodipine 5 mg; BP: blood pressure, HA: huyết áp; DBP: diastolic blood pressure, HATTr: HA tâm trương; SBP: systolic blood pressure, HATT: HA tâm thu; SPC: single-pill combination, phối hợp đơn viên; T40: telmisartan 40 mg; T80: telmisartan 80 mg; T/A: telmisartan và amlodipine.
Tỉ lệ đạt HA mục tiêu (<140/<90 mmHg) tại tuần thứ 4 và 8 cao hơn với T/A SPC trong nhóm không đáp ứng amlodipine và nhóm không đáp ứng telmisartan, và cũng cao hơn với T80/A5 SPC so với T40/A5 (Bảng 4). Phần trăm bệnh nhân đạt mục tiêu trũng HATTr và HATT khi ngồi và tỉ lệ đáp ứng HATTr và HATT tại tuần thứ 8 cũng cao hơn với T/A SPC so với đơn trị liệu tương ứng (Bảng 4). T80/A5 SPC cho kết quả tỉ lệ đạt HATTr mục tiêu và tỉ lệ đáp ứng HATTr tại tuần thứ 8 và tỉ lệ đạt HATT mục tiêu tại tuần thứ 4 cao hơn so với phối hợp T40/A5 (Bảng 4).
Bảng 4: Tỉ lệ đạt huyết áp mục tiêu và đáp ứng vào tuần 4 và tuần 8 trong 3 nhóm (bộ phân tích đầy đủ).
|
|
Không đáp ứng với A5 |
Không đáp ứng với T40 hay T80 |
Không đáp ứng với T/A liều thấp |
||||||
|
A5 (n = 416) |
T40/A5 SPC (n = 263) |
T80/A5 SPC (n = 155) |
T40 (n = 158) |
T40/A5 SPC (n = 153) |
T80 (n = 86) |
T80/A5 SPC (n = 87) |
T40/A5 SPC (n = 112) |
T80/A5 SPC (n = 112) |
|
|
|
HA < 140/90 mmHg |
||||||||
|
Tuần 4, n (%) |
158 (38.0) |
155 (58.9) |
77 (49.7) |
55 (34.8) |
97 (63.4) |
17 (19.8) |
46 (52.9) |
61 (54.5) |
64 (67.1) |
|
Tuần 8, n (%) |
160 (38.5) |
163 (62.0)* |
100 (64.5) |
59 (37.3) |
113 (73.9) |
20 (23.3) |
59 (67.8) |
68 (60.7) |
71 (63.4) |
|
|
HATT < 140 mmHg |
||||||||
|
Tuần 4, n (%) |
232 (55.8) |
194 (73.8) |
103 (66.5) |
88 (55.7) |
121 (79.1) |
37 (43.0) |
68 (78.2) |
83 (74.1) |
86 (76.8) |
|
Tuần 8, n (%) |
246 (59.1) |
205 (77.9)* |
119 (76.8) |
87 (55.1) |
113 (86.9) |
43 (50.0) |
73 (83.9) |
90 (80.4) |
89 (79.5) |
|
|
HATTr < 90 mmHg |
||||||||
|
Tuần 4, n (%) |
211 (50.7) |
179 (68.1) |
95 (61.3) |
67 (42.4) |
106 (69.3) |
19 (22.1) |
49 (56.3) |
73 (65.2) |
69 (61.6) |
|
Tuần 8, n (%) |
206 (49.5) |
179 (68.1)* |
112 (72.3) |
74 (46.8) |
120 (78.4) |
23 (26.7) |
61 (70.1) |
74 (66.1) |
78 (69.6) |
|
|
HATT < 140 hay giảm ≥ 20 mmHg** |
||||||||
|
Tuần 4, n (%) |
253 (60.8) |
202 (76.8) |
124 (80.0) |
93 (58.9) |
123 (80.4) |
37 (43.0) |
71 (81.6) |
83 (74.8) |
86 (76.8) |
|
Tuần 8, n (%) |
270 (64.9) |
209 (79.5)* |
131 (84.5) |
92 (58.2) |
137 (89.5) |
44 (51.2) |
77 (88.5) |
92 (82.1) |
90 (80.4) |
|
|
HATTr < 90 hay giảm ≥ 10 mmHg |
||||||||
|
Tuần 4, n (%) |
236 (56.7) |
190 (72.2) |
108 (69.7) |
73 (46.2) |
118 (77.1) |
21 (24.4) |
56 (64.4) |
77 (69.4) |
70 (62.5) |
|
Tuần 8, n (%) |
230 (55.3) |
196 (74.5)* |
124 (80.0) |
79 (50.0) |
130 (85.0) |
26 (30.2) |
70 (80.5) |
76 (67.9) |
79 (70.5) |
Số bệnh nhân trong phân tích này có thể khác với từng xuất bản nghiên cứu riêng, do khác biệt tiếp cận thống kê cho từng nghiên cứu riêng.
*Dữ liệu trong thời gian 6 tuần khi bệnh nhân dùng trị liệu T40/A5 và không bao gồm 2 tuần khi bệnh nhân dùng trị liệu T20/A5; **trong nghiên cứu không đáp ứng A5 (2), đáp ứng HATT được định nghĩa < 140 mmHg và/hoặc giảm ≥ 15 mmHg so với ban đầu.
A5: amlodipine 5 mg; HA: huyết áp; HATTr: HA tâm trương; HATT: HA tâm thu; SPC: single-pill combination, phối hợp đơn viên; T20: telmisartan 20 mg; T40: telmisartan 40 mg; T80: telmisartan 80 mg; T/A: telmisartan và amlodipine.
3.3. Tính an toàn
Tỉ lệ xuất hiện các biến cố bất lợi, gián đoạn do tác dụng phụ, và tỉ lệ phù ngoại biên mới mắc trong từng nghiên cứu được cung cấp trong bảng 3. Không có báo cáo tử vong trong giai đoạn điều trị ngẫu nhiên ở cả 5 nghiên cứu. Tổng cộng có 426 bệnh nhân được dùng A5 đơn trị, 245 bệnh nhân với T40 hay T80, và 897 bệnh nhân dùng T/A SPC (Bảng 5). Phần trăm bệnh nhân bị bất kỳ tác dụng phụ nào có trị số thấp hơn khi dùng telmisartan hay T/A SPC so với amlodipine (Bảng 5). Biến cố bất lợi nghiêm trọng xảy ra thấp và tương đương, với amlodipine (đau thắt ngực n = 1 và nhồi máu não n = 1) và T/A SPC (hội chứng Guillain-Barré n = 1, gẫy cẳng tay n = 1, tắc mạch não n = 1, và gẫy xương đòn n = 1); không có báo cáo với telmisartan. Sự xuất hiện hội chứng Guillain-Barré, nhồi máu não, và gẫy xương đòn làm gián đoạn nghiên cứu. Nói chung có ít hơn 2% bệnh nhân trong mỗi nhóm ngừng nghiên cứu do các biến cố bất lợi.
Bảng 3: Hiệu quả và kết quả an toàn trong từng nghiên cứu riêng
|
|
Nghiên cứu không đáp ứng A5 (1) |
Nghiên cứu không đáp ứng A5 (2) |
Nghiên cứu không đáp ứng T40 |
Nghiên cứu không đáp ứng T80 |
Nghiên cứu không đáp ứng phối hợp liều thấp |
|||||
|
Mã thử nghiệm |
NCT00558064 |
NCT01103960 |
NCT00550953 |
NCT01222520 |
NCT01286558 |
|||||
|
Trích dẫn |
Dữ kiện hồ sơ |
Zhu và cộng sự [28] |
Dữ kiện hồ sơ |
Dữ kiện hồ sơ |
Dữ kiện hồ sơ |
|||||
|
Nhóm điều trị mù đôi |
A5 |
T20 + A5 trong 2 tuần; T40/A5 SPC trong 6 tuần |
A5 |
T80/A5 SPC |
T40 |
T40/A5 SPC |
T80 |
T80/A5 SPC |
T40/A5 SPC |
T80/A5 SPC |
|
N, phân ngẫu nhiên |
262 |
269 |
164 |
160 |
158 |
156 |
87 |
87 |
113 |
112 |
|
Bình quân điều chỉnh của khác biệt HATTr sau điều trị*, 95% CI |
|
5.1 (4.0-6.2)** |
|
2.4 (0.7-4.1)† |
|
8.0 (6.4-9.6)** |
|
9.1 (7.1-11.2)** |
|
1.5 (-0.2,3.4) |
|
Tỉ lệ tồng cộng các biến cố bất lợi, n (%) |
78 (29.8) |
81 (30.1) |
33 (20.1) |
33 (20.6) |
35 (22.2) |
47 (30.1) |
14 (16.1) |
12 (13.8) |
26 (23.0) |
19 (17.0) |
|
Tỉ lệ phù ngoại biên, n (%) |
1 (0.4%) |
0 (0.0) |
1 (0.6%) |
1 (0.6%) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
2 (1.8) |
2 (1.8) |
|
Dừng do biến cố bất lợi, n (%) |
2 (0.8%) |
3 (1.1%) |
2 (1.2) |
1 (0.6) |
3 (1.9) |
3 (1.9) |
1 (1.1) |
0 (0.0) |
1 (0.9) |
1 (0.9) |
A5: amlodipine 5 mg; CI: confidence interval, khoảng tin cậy; HATTr: HA tâm trương; NCT: National Clinical Trial, thử nghiệm lâm sàng quốc gia; SPC: single-pill combination, phối hợp đơn viên; T20: telmisartan 20 mg; T40: telmisartan 40 mg; T80: telmisartan 80 mg.
* Hiệu quả điều trị (khác biệt giữa các nhóm điều trị trong việc giảm trũng HATTr khi ngồi so với trị số nền tham khảo sau 8 tuần điều trị mù đôi) được ước lượng bằng bình quân bình phương nhỏ nhất với khoảng tin cậy 95%.
** P < 0.0001, † P < 0.01.
Các biến cố bất lợi thường gặp nhất (xảy ra trên hơn 1 bệnh nhân trong ít nhất 1 trị liệu) là viêm mũi họng, viêm dạ dày ruột, chóng mặt, phù ngoại biên, viên phế quản, và đau lưng (Bảng 5). Viêm mũi họng là biến cố ngoại ý xảy ra cao nhất và có trị số phần trăm bệnh nhân mắc phải nhiều hơn ở nhóm dùng amlodipine (8.7%) và T/A SPC (7%) so với telmisartan (1.6%) (Bảng 5). Tần suất phù ngoại biên thấp và có phần trăm tương đương ở nhóm amlodipine (0.5%) và T/A SPC (0.7%); không có ở nhóm telmisartan (Bảng 5).
Bảng 5: Kết quả an toàn của 8 tuần điều trị với phối hợp T/A hay đơn trị liệu tương ứng
|
|
Amlodipine đơn trị |
Telmisartan đơn trị |
Trị liệu T/A SPC |
|
Số bệnh nhân được điều trị, n |
426 |
245 |
897 |
|
Tổng phơi nhiễm (bệnh nhân – năm) |
66.6 |
31.6 |
151.8 |
|
Số bệnh nhân có bất kỳ biến cố bất lợi, n (%) |
111 (26.10 |
49 (20.0) |
218 (24.3) |
|
Số bệnh nhân bị biến cố bất lợi liên quan đến thuốc, n (%) |
9 (2.1) |
3 (1.2) |
24 (2.7) |
|
Số bệnh nhân bị biến cố bất lợi nghiêm trọng, n (%) |
2 (0.5) |
0 (0) |
4 (0.4) |
|
Số bệnh nhân có biến cố bất lợi dẫn đến ngừng nghiên cứu, n (%) |
4 (0.9) |
4 (1.6) |
9 (1.0) |
|
Các biến cố bất lợi thường gặp nhất xảy ra trên hơn 1 bệnh nhân trong ít nhất một nhóm điều trị, n (%) |
|||
|
Viêm mũi họng |
37 (8.7) |
4 (1.6) |
63 (7.0) |
|
Viêm dạ dày ruột |
4 (0.9) |
5 (2.0) |
4 (0.4) |
|
Chóng mặt |
4 (0.9) |
0 (0) |
8 (0.9) |
|
Phù ngoại biên |
2 (0.5) |
0 (0) |
6 (0.7) |
|
Viêm phế quản |
2 (0.5) |
0 (0) |
5 (0.6) |
|
Đau lưng |
2 (0.5) |
1 (0.4) |
3 (0.3) |
Số bệnh nhân trong phân tích này có thể khác với từng xuất bản nghiên cứu riêng, do khác biệt tiếp cận thống kê cho từng nghiên cứu riêng.
4. Bàn luận
Bệnh nhân tăng huyết áp là một dân số không đồng nhất gồm nhiều kiểu hình tăng huyết áp. Vì vậy, phối hợp các trị liệu có tác động dược lý trên nhiều vị trí sinh lý được kỳ vọng đạt hiệu quả hơn, do khả năng chặn các đáp ứng điều hòa ngược thường xảy ra với đơn trị liệu vốn thường chỉ tác động lên một vị trí duy nhất [29]. Điều trị với SPC giúp kiểm soát HA và giảm nguy cơ tim mạch lâu dài tốt hơn [13, 30-32]. Một nghiên cứu phụ tiền phân nhóm thuộc nhánh hạ HA trong thử nghiệm ASCOT (Anglo-Scandinavian Cardiac Outcomes Trial – Blood Pressure-lowering arm : ASCOT-BPLA) cho thấy kết hợp một thuốc ức chế RAS và một CCB là phối hợp được ưa chuộng và hiệu quả trên bệnh nhân Bắc Á châu [33].
Trong cả 5 nghiên cứu được báo cáo ở đây, T/A SPC hạ HA hiệu quả hơn trên bệnh nhân tăng huyết áp Á châu có HA chưa được kiểm soát thỏa đáng với đơn trị liệu hay trị liệu phối hợp liều thấp. Tỉ lệ đạt HA mục tiêu và tỉ lệ đáp ứng sau 8 tuần cũng cao hơn khi dùng T/A SPC so với đơn trị liệu tương ứng, và tỉ lệ đạt HATTr mục tiêu và đáp ứng cao hơn khi dùng T80/A5 SPC so với liều thấp T/A SPC. Các kết quả có lợi tương tự cũng được quan sát thấy khi dùng T/A SPC trong các nghiên cứu khác ở Châu Á. Trong nghiên cứu Cotalo trên bệnh nhân Nhật Bản có HA chưa được kiểm soát hiệu quả với A5 đơn trị, điều trị với T40/A5 SPC trong 8 tuần làm giảm có ý nghĩa HA trung bình 24 giờ và khi thăm khám lâm sàng, độc lập với thời điểm dùng thuốc; kết quả tương tự trên bệnh nhân có hay không có hội chứng chuyển hóa [34]. Trong một nghiên cứu tiến cứu nhãn mở trên bệnh nhân tăng huyết áp Nhật Bản có HA chưa kiểm soát được khi điều trị với valsartan 80mg/A5 hay candesartan 8mg/A5, chuyển điều trị với T40/A5 cho kết quả giảm có ý nghĩa cả HATT và HATTr lâm sàng trung bình sau 4, 8 và 12 tuần, so với điều trị valsartan 80mg/A5, gợi ý kết cục tim mạch thuận lợi hơn khi dùng phối hợp T40/A5 [35]. Các lợi ích tương tự cũng được thấy khi dùng T40/A5 trong nhóm bệnh nhân lớn tuổi; ngoài ra, T40/A5 cũng được phát hiện thấy khả năng làm tăng đáng kể nồng độ adipoectin, gợi ý hiệu quả tim-chuyển hóa có lợi trên người cao tuổi [36]. Trong một thử nghiệm lâm sàng đa trung tâm, nhãn mở trên bệnh nhân Trung Hoa tăng huyết áp nguy cơ cao có ít nhất 1 yếu tố nguy cơ tim mạch, điều trị với T/A trong 96 tuần có hiệu quả làm giảm mức HA với tỉ lệ đạt mục tiêu chấp nhận được và dung nạp tốt [37].
Các kết quả báo cáo ở đây thống nhất với các kết quả từ những nghiên cứu quốc tế trên bệnh nhân tăng huyết áp nhẹ-đến-trung bình hay nặng chưa được kiểm soát với amlodipine đơn trị [38-41] và gợi ý lợi ích tương tự của phối hợp T/A trên bệnh nhân Á châu. Trong các nghiên cứu quốc tế, phối hợp T/A so với các đơn trị liệu tương ứng cũng làm giảm HA 24 giờ tốt hơn trên bệnh nhân tăng huyết áp nhẹ đến trung bình [42] và hạ HA mạnh hơn có ý nghĩa cũng như tỉ lệ đạt HA mục tiêu và đáp ứng cao hơn đáng kể trên bệnh nhân tăng huyết áp nặng [43]. Phân tích gộp hậu định có dự tính các dữ liệu từ những thử nghiệm lâm sàng cho thấy T/A SPC có hiệu quả và được dung nạp tốt trên bệnh nhân tăng huyết áp, có kèm các yếu tố nguy cơ khác, bao gồm béo phì, đái tháo đường, hội chứng chuyển hóa, suy thận, và tăng HATT [44-46].
Nói chung, điều trị mù đôi 8 tuần với đơn trị liệu hay T/A SPC đều được dung nạp tốt trong cả 5 nghiên cứu. Dữ liệu về độ an toàn và dung nạp thu nhận được sau 8 tuần điều trị mù đôi ngẫu nhiên phù hợp với mức an toàn và dung nạp đã được biết trước đây của telmisartan, amlodipine hay T/A SPC, và không ghi nhận có sự khác biệt lâm sàng quan trọng nào. Trong các nghiên cứu trước đó, trị liệu T/A SPC đi kèm với tỉ lệ phù ngoại biên thấp hơn so với amlodipine đơn trị [38-41]. Tại phân tích trên đây ở bệnh nhân Á châu, tần suất phù ngoại biên thấp, ít hơn 1% ở bệnh nhân dùng amlodipine đơn trị và T/A SPC, không có bệnh nhân nào dùng telmisartan đơn trị được báo cáo. Tỉ lệ phù tổng cộng thấp hơn trong nghiên cứu này có thể liên quan đến khác biệt giữa các nhóm chủng tộc về nguy cơ xảy ra một số biến cố bất lợi.
Các nghiên cứu được báo cáo trên đây chỉ gồm bệnh nhân Nhật Bản, Trung Quốc, Malaysia, và Philippine, do đó có thể hạn chế việc áp dụng các phát hiện này cho bệnh nhân thuộc các nước Á châu khác. Ngoài ra, bản chất được kiểm soát của các nghiên cứu giới hạn khả năng khái quát hóa kết quả cho các thể bệnh đã bị loại khỏi nghiên cứu.
5. Kết luận
Trên bệnh nhân Á châu có HA chưa được kiểm soát thỏa đáng với telmisartan hay amlodipine đơn trị, 8 tuần điều trị với phối hợp T/A cho kết quả hạ HA tốt hơn, tỉ lệ đạt HATTr, HATT mục tiêu và tỉ lệ có đáp ứng cao hơn. Ở bệnh nhân Á châu có HA chưa kiểm soát đủ với T40/A5 SPC, điều trị 8 tuần với T80/A5 SPC cho kết quả hạ HA, tỉ lệ đạt mục tiêu HATTr và có đáp ứng tốt hơn. Tính an toàn và độ dung nạp của T/A SPC tương tự các đơn trị liệu tương ứng, phù hợp với các kết quả đã được báo cáo trong các nghiên cứu trước.







