Giới thiệu: Khoảng 25% bệnh nhân đái tháo đường (ĐTĐ) típ 2 bị bệnh thận mạn (BTM) giai đoạn 3-5 (độ thanh lọc creatinine < 60ml/ph), tuy nhiên vấn đề này thường không được nhận biết hoặc không được quan tâm đúng mức trong thực hành lâm sàng.
André J Scheen
(Đại học Liège, Phân khoa Đái tháo đường, Dinhdưỡng và Rối loạn chuyển hóa, Phân khoa Dược Lâm sàng, Khoa Y, Liège, Bỉ.)
Tổng hợp tài liệu: ThS.BS Trần Viết Thắng
Bộ môn Nội Tiết – ĐHYD TPHCM
Bên cạnh đó, hầu hết các thuốc viên hạ đường huyết đều có những hạn chế khi bị suy thận, hoặc thuốc cần được chỉnh liều hoặc không được sử dụng vì tính an toàn.
Phạm vi: tác giả tìm kiếm y văn để phân tích ảnh hưởng của suy giảm chức năng thận trên dược động học của thuốc hạ đường huyết và mối liên hệ với các hệ quả lâm sàng.
Ý kiến chuyên gia: Dựa trên tính an toàn và ảnh hưởng của dược động học (DĐH), thuốc nên được chỉnh liều dựa theo độ lọc cầu thận hoặc chống chỉ định nếu có BTM nặng, như đối với metformin (nguy cơ nhiễm acid lactic) và nhiều loại sulfonylurea (nguy cơ hạ đường huyết). Tuy vậy hiện tại ngưỡng độ lọc cầu thận cụ thể cho việc sử dụng metformin vẫn còn là vấn đề tranh cãi. Các thuốc hạ đường huyết mới có tính dung nạp tốt hơn trong BTM mặc dù kinh nghiệm lâm sàng vẫn còn khá hạn chế. Thuốc ức chế DPP-4 cũng cần được giảm liều (trừ linagliptin), trong khi đó hiệu quả và tính an toàn của nhóm thuốc ức chế SGLT2 trong BTM như thế nào vẫn chưa sáng tỏ.
Đặt vấn đề
Tỉ lệ BTM do ĐTĐ ở Hoa Kỳ trong khoảng thời gian 1988-2008 tăng nhanh và tương ướng với với sự gia tăng tỉ lệ ĐTĐ. Có nhiều nguyên nhân đưa đến BTM ở bệnh nhân ĐTĐ2, bên cạnh bệnh thận ĐTĐ do sự tăng đường huyết mạn tính là tác động phối hợp của tình trạng xơ hóa mạch máu thận do tăng huyết áp (bệnh đồng mắc thường gặp ở bệnh nhân ĐTĐ típ 2), tình trạng nhiễm trùng tiểu (thường không triệu chứng), sử dụng đồng thời các thuốc độc thận (thường nhất là NSAIDS) hoặc chỉ đơn giản là sự diễn tiến của tuổi.
Thận đóng vai trò chính trong thanh lọc các thuốc hạ đường huyết. Theo NHANES, 39,7% bệnh nhân ĐTĐ típ 2 có bệnh thận mạn ở các mức độ khác nhau. Tỉ lệ bệnh nhân được điều trị với ít nhất một loại thuốc viên hạ đường huyết tăng lên có ý nghĩa, từ 36,3% ở bệnh nhân có bệnh thận giai đoạn 1 lên 62,9% ở nhóm bệnh nhân giai đoạn 4-5. Vì vậy, việc quản lý đường huyết ở bệnh nhân ĐTĐ kèm BTM là một thử thách và vấn đề chính trong thực hành lâm sàng. Tình trạng suy thận có thể tác động đến dược động học của thuốc và làm ảnh hưởng đến sự chọn lựa, liều thuốc và chế độ theo dõi theo mức độ giảm của GFR. Tình huống còn phức tạp hơn ở bệnh nhân cao tuổi, khi mà tình trạng suy thận và việc dùng cùng lúc nhiều thuốc rất thường gặp.
Mục tiêu của bài báo này nhằm cung cấp các phân tích các cập nhật mới nhất về việc sử dụng thuốc điều trị ĐTĐ gồm cả thuốc uống và thuốc tiêm trên bệnh nhân ĐTĐ kèm BTM. Bài trình bày sẽ bắt đầu bằng phần sơ lược về đánh giá chức năng thận ở bệnh nhân ĐTĐ típ 2; tiếp theo, tác giả sẽ trình bày các đặc điểm về dược động học cũng như thông tin về tính hiệu quả và an toàn của các thuốc điều trị ĐTĐ ở bệnh nhân có các mức độ khác nhau của suy thận (Bảng 1 và 2).
Đánh giá chức năng thận và phân loại BTM trong ĐTĐ.
Bảng 1 Phơi nhiễm thuốc (AUC) ở bệnh nhân với các mức độ suy thận khác nhau, dựa theo độ thanh lọc creatinin (ClCr), so với người có chức năng thận bình thường.
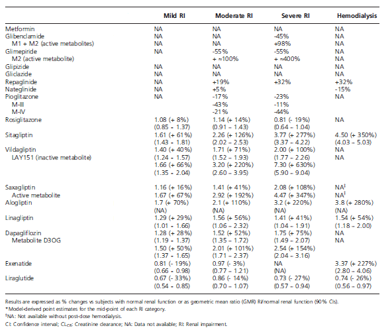
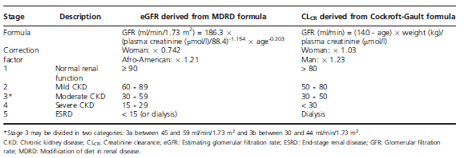
Chức năng thận được đánh giá bởi độ lọc cầu thận (GFR) và được ước tính dựa trên độ thanh lọc creatinin (creatinin clearance, CLcr) bằng công thức Cockroft-Gault. Tuy nhiên, công thức này lại bị sai lệch bởi cân nặng và các yếu tố gây nhiễu khiến GFR ước tính (eGFR) tăng cao hơn so với GFR thực sự ở những người thừa cân/béo phì vốn rất thường gặp ở bệnh nhân ĐTĐ típ 2. Hiện nay, công thức MDRD (modification of diet in renal disease) được ưu tiên chọn lựa hơn trong khảo sát eGFR, mặc dù công thức này cho giá trị thấp hơn thực tế so với những bệnh nhân có GFR > 60ml/ph/1,73 m2 da và không áp dụng cho tất cả dân số. Các giá trị tương ứng với giai đoạn suy thận được tóm tắt trên Bảng 3. Có rất nhiều công thức mới được đề nghị bởi các nhà thận học, tuy nhiên các công thức này chưa được sử dụng trên lâm sàng bởi các nhà đái tháo đường. Tuy nhiên, sự tồn tại đồng thời của 2 công thức, Cockroft-Gault và MDRD, có thể đưa đến sự không đồng bộ trong chỉnh liều thuốc trên lâm sàng.
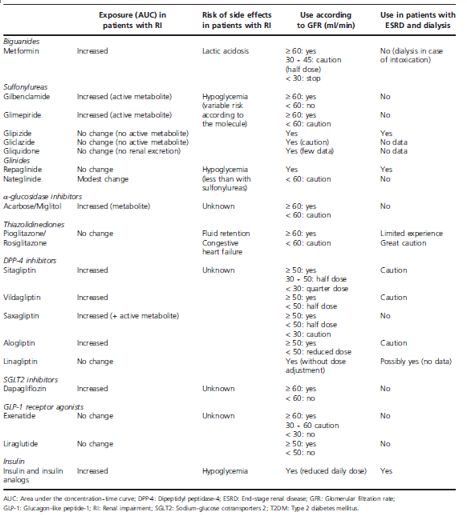
Bảng 2. Các khuyến cáo lâm sàng về việc sử dụng thuốc hạ đường huyết ở bệnh nhân ĐTĐ típ 2 với các mức độ suy thận khác nhau dựa trên GFR
Nhóm biguanide (metformin)
Giữa các hợp chất biguanide, chỉ có metformin còn lại trên thị trường. Hai hợp chất khác là phenformin và buformin đã không còn được sử dụng do có nguy cơ nhiễm acid lactic cao, đặc biệt khi có tình trạng tích tụ thuốc ở bệnh nhân suy thận. Metformin hiện nay được chấp thuận là thuốc điều trị đầu tay trong ĐTĐ típ 2, nhưng có khá nhiều chống chỉ định của metformin do nguy cơ nhiễm acid lactic. Các chống chỉ định sử dụng metformin phần nào đã làm nhiều bệnh nhân ĐTĐ típ 2 mất cơ hội hưởng lợi rất nhiều từ thuốc so với nguy cơ thật sự. Đây là vấn đề thường gặp nhất ở những bệnh nhân có suy thận nhẹ và trung bình, và cần được chú ý nhiều hơn vì chiếm một tỉ lệ khá lớn ở bệnh nhân ĐTĐ típ 2, đặc biệt là ở người cao tuổi.
Metformin được hấp thu chủ yếu ở ruột non và được bài tiết dưới dạng không thay đổi trong nước tiểu. Thời gian bán hủy đào thải (t1/2) của metformin khi sử dụng nhiều lần trong ngày ở bệnh nhân có chức năng thận tốt là khoảng 5 giờ.
DĐH của metformin liều đơn độc ở người có suy thận.
DĐH của metformin được khảo sát ở những người tình nguyện có chức năng thận bình thường và bệnh nhân có mức độ suy thận khác nhau. Sau khi uống metformin, 37,6% thuốc được phát hiện trong nước tiểu, phần còn lại có khả năng lưu lại trên thành ống tiêu hóa. Metformin được đào thải nhanh qua thận với CLR trung bình là 440ml/ph (gần 3-4 lần giá trị của CLcr).
Dược động học của metformin liều nhiều lần và kéo dài
Bệnh nhân ĐTĐ típ 2 tuổi từ 78 đến 80 được sử dụng metformin với liều hoặc 850mg hoặc 1700mg/ngày tùy thuộc vào CLcr thuộc khoảng 30 – 60ml/ph hay lớn hơn 60ml/ph. Sau 2 tháng, nồng độ metformin vẫn duy trì trong ngưỡng điều trị và nồng độ lactat nằm trong giới hạn tham chiếu của tất cả người tham gia nghiên cứu; không có sự khác biệt với người có và không có suy chức năng thận.
Nồng độ đáy của metformin được đo trên 137 bệnh nhân ĐTĐ típ 2 có chức năng thận khác nhau và được lặp lại sau 2 tháng ở 20 người có eGFR < 60 ml/ph/1.73 m2. Người có eGFR > 60, 30 – 60 và < 30 ml/ph/1.73 m2 có trung vị của nồng độ đáy metformin lần lượt là 4,5; 7,71 và 8,88 mmol/l. Điểm đáng chú ý là có sự biến thiên rộng các giá trị trong mỗi nhóm, một số bệnh nhân có nồng độ huyết thanh > 20 mmol/l (> 2.6 mg/ml). Ở bệnh nhân có suy thận nặng (CLcr 15 – 40ml/ph), được dùng metformin với liều 250 – 2000mg mỗi ngày, 1 vài trường hợp có lactat máu cao (>2,7mmol/l) và một trường hợp có nồng độ metformin cao (3 – 5 mg/l), không có mối tương quan giữa nồng độ metformin và nồng độ lactat máu. Vẫn chưa rõ việc đo nồng độ metformin có giúp dự đoán được nguy cơ nhiễm acid lactic hay không, vì vậy đo nồng độ metformin không được khuyến cáo trên lâm sàng.
Metformin và lọc máu.
Metformin không gắn kết với protein huyết tương nên có thể bị thẩm tách dễ dàng. Một nghiên cứu đã được thực hiện nhằm xác định các đặc điểm của metformin trong lọc máu. Metformin có thể bị loại bỏ sau khi trao đổi giữa máu và dịch lọc trong hệ thống tái tuần hoàn. Metformin được thẩm tách ở mức độ cao với độ thanh lọc lên đến 170ml/ph trong điều kiện lọc máu tốt. Vì vậy, lọc máu có thể giúp loại bỏ metformin một cách hiệu quả, đặc biệt ở những bệnh nhân nghi ngờ quá liều, đồng thời giúp hiệu chỉnh toan chuyển hóa ở bệnh nhân nhiễm acid lactic do metformin. Việc nhận biết chính xác nhiễm acid lactic do metformin và lọc máu sớm là bước quan trọng giúp bệnh có thể phục hồi nhanh chóng.
Bảng 3. Phân giai đoạn bệnh thận mạn dựa theo eGFR (công thức MDRD) và theo CLcr (công thức Cockroft-Gault)
Tranh luận về nguy cơ của metformin ở bệnh nhân bị BTM
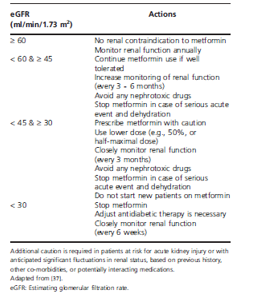
BTM (CLcr<60 ml/ph) là một chống chỉ định kinh điển của metformin ở bệnh nhân ĐTĐ típ 2. Trong trường hợp suy thận, metformin có thể tích tụ, ức chế quá trình tân tạo glucose và gây nhiễm acid lactic, một biến chứng trầm trọng có thể gây tử vong. Tuy nhiên, các dữ liệu gần đây cho thấy metformin có thể được sử dụng thận trọng ở bệnh nhân có CLcr 45 – 60 ml/ph hoặc thậm chí thấp hơn (30 – 45 ml/ph) bằng cách giảm nửa liều và theo dõi chức năng thận thường xuyên. Ở bệnh nhân không có bệnh đi kèm làm tăng nguy cơ nhiễm acid lactic, tăng creatinin huyết thanh (hoặc giảm GFR) được xem là yếu tố nguy cơ của nhiễm acid lactic nhưng không phải một chống chỉ định tuyệt đối. Dù vậy, nhiễm acid lactic vẫn là một biến cố hiếm gặp.
Ba tình huống sau đây có thể giúp lý giải những quan sát khi sử dụng metformin ở người có suy chức năng thận: i) nồng độ creatinin được đo không hằng định và không đúng phương pháp, ii) creatinin bình thường tại thời điểm kê toa metformin và tăng lên không nhận biết sau đó hoặc iii) bác sĩ đánh giá lợi ích của điều trị vượt trội hơn nguy cơ tiềm tàng. Nhiều dữ liệu cho thấy metformin có thể được sử dụng ở BTM trung bình hoặc nhẹ và việc không kê toa metformin ở những bệnh nhân này có thể gây hại nhiều hơn so với lợi ích từ việc phòng ngừa những biến chứng rất hiếm của thuốc. Những kết quả trên đưa đến những đồng thuận mới đây của ADA – EASD về việc metformin có thể được sử dụng cho đến mức GFR là 30ml/ph, và cần được chỉnh liều ở mức 45ml/ph (Bảng 4). Điều này cho thấy rằng việc sử dụng thuốc viên hạ đường huyết là an toàn ngay khi cả eGFR<60ml/ph/1,73 m2 trong thực hành lâm sàng và cả về khía cạnh pháp lý. Tuy nhiên, không nên xem nhẹ nguy cơ nhiễm acid lactic và thuốc có thể phải ngưng ngay khi có tình trạng suy thận không ổn định, hoặc khi có các biến cố cấp tính (như sốt cao), rối loạn tiêu hóa (tiêu chảy, nôn ói) và mất nước.
Bảng 4. Khuyến cáo sử dụng metformin theo eGFR.
Nhóm sulfonylurea
Các thuốc sulfonylurea hiện còn được sử dụng rộng rãi trong điều trị ĐTĐ típ 2 và là chọn lựa đứng ở vị trí thứ 2 sau thất bại với metformin đơn trị liệu. Thuốc làm tăng nguy cơ hạ đường huyết nặng so với metformin và các thuốc hạ đường huyết mới, đặc biệt ở người cao tuổi và bệnh nhân kèm BTM. Một nghiên cứu ở Đức khảo sát các trường hợp mới mắc của hạ đường huyết nặng và yếu tố lâm sàng liên quan. Các đặc điểm có liên quan được xác định gồm: bệnh nhân ĐTĐ típ 2 lớn tuổi, CLcr thấp (46 ± 24 ml/ph), suy thận (chiếm 73%) và dùng kèm nhiều thuốc. Tử vong do hạ đường huyết có tỉ lệ khá cao và là một biến chứng đáng lo ngại ở những bệnh nhân BTM.
Hầu hết các sulfonylurea đều được bài tiết tại thận, dưới dạng nguyên chất hay chất chuyển hóa. Rất ít nghiên cứu DĐH được thực hiện trên sulfonylurea ở bệnh nhân có suy thận, tài liệu hiện có khá cũ hoặc hạn chế về số lượng người tham gia và cả các thông số DĐH (Bảng 1). Sulfonylurea thế hệ 1 như tolbutamide hoặc chlorpropamide được chứng minh là thải qua thận, vì vậy sẽ tăng nguy cơ hạ đường huyết ở bệnh nhân BTM. Hiện nay, các thuốc này đã được thay thế bởi sulfonylurea thế hệ 2.
Glibenclamide (glyburide)
Trong 33.243 người dùng sulfonylurea, tỉ suất hạ đường huyết được chẩn đoán bởi bác sĩ đa khoa cao hơn ở nhóm dùng glibenclamide so với các sulfonylurea khác (glipizide, gliclazide, tolbutamide). Ngoài ra, nguy cơ hạ đường huyết còn có liên hệ với suy thận (OR: 4.32; 95% CI 2.40 – 7.77). Một nghiên cứu bệnh chứng tại Canada đã mô tả tác hại của việc điều trị bằng SU ở bệnh nhân bệnh thận giai đoạn cuối (BTGĐC) có hạ đường huyết trầm trọng và kéo dài. Bệnh nhân có nguy cơ cao gồm những người ăn kém, tiền căn hạ đường huyết, ĐTĐ lâu năm; vì vậy việc chọn lựa một loại thuốc khác cần được cân nhắc ở nhóm bệnh nhân này. So sánh với metformin, glyburide làm tăng nguy cơ hạ đường huyết ở cả bệnh nhân bình thường (OR hiệu chỉnh: 9,0; 95%CI 4,9-16,4) và bệnh nhân có suy giảm chức năng thận (OR 6,0; 95% CI 3,8-9,5). Nghiên cứu này đưa ra kết luận rằng suy thận không làm tăng nguy cơ hạ đường huyết do sử dụng glyburide ở bệnh nhân ĐTĐ típ 2. Dù vậy, một dự án can thiệp cho thấy bằng việc giảm sử dụng glyburide 3 tháng ở bệnh nhân ngoại trú cao tuổi kèm suy thận, mặc dù mức kiểm soát đường huyết không thay đổi nhưng nguy cơ hạ đường huyết lại có xu hướng giảm.
Glimepiride
Glimepiride ít có nguy cơ hạ đường huyết hơn so với glibenclamide trong thực hành lâm sàng. Tuy nhiên, hạ đường huyết nặng xảy ra do glimepiride nhiều hơn, đặc biệt ở người ĐTĐ cao tuổi kèm suy thận. Việc kê sulfonylurea không cân nhắc (một tỉ lệ lớn sử dụng glimepiride theo một nghiên cứu tại Đức), không chú ý đến các chống chỉ định chính – đặc biệt là suy thận – làm tăng đáng kể nguy cơ hạ đường huyết do sulfonylurea ở những bệnh nhân cao tuổi.
Glipizide
Trên người khỏe mạnh tình nguyện, t1/2 đào thải của glipizide trung bình là 3,3 giờ cả sau truyền tĩnh mạch hoặc sử dụng qua đường uống. Độ thanh lọc toàn phần của glipizide là 42,2 ± 5,4 ml/ph. CLr của Glipizide phụ thuộc vào pH nước tiểu, nhưng nó chỉ chiếm trung bình khoảng 5% độ thanh thải toàn bộ của thuốc. Ở bệnh nhân uống 5mg 14C-glipizide, 85% tổng hoạt tính phóng xạ trong huyết tương là glipizide dưới dạng không đổi. Trong nước tiểu, 98% hoạt tính phóng xạ dưới dạng hợp chất đa cực và các chất chuyển hóa này được thải nhanh chóng. Việc sử dụng 14C ở bệnh nhân có suy thận cho thấy lượng đào thải của glipizde dưới dạng không đổi so với người bình thường là giống nhau, nhưng t1/2 của chất chuyển hóa dưới dạng hydroxyl hóa tăng lên đến hơn 20 giờ. Bởi vì các chất chuyển hóa này dưới dạng bất hoạt, sự tích tụ các chất chuyển hóa không làm tăng nguy cơ hạ đường huyết ở bệnh nhân ĐTĐ típ 2 kèm suy thận và do đó việc sử dụng glipizide có lẽ phù hợp hơn là dùng glibenclamide (glyburide) hoặc cả glimepiride ở người ĐTĐ kèm BTM.
Gliclazide
Gliclazide được chuyển hóa ở gan dưới dạng bất hoạt, và được loại bỏ chủ yếu qua đường niệu (80%). DĐH của gliclazide được nghiên cứu trên 6 bệnh nhân ĐTĐ (CLcr= 44ml/ph) và 11 bệnh nhân không ĐTĐ (CLcr trung bình = 13 ml/ph) kèm suy thận ở các mức độ khác nhau, và được so sánh với 9 người tình nguyện (Clcr trung bình = 118 ml/ph). Gliclazide được hấp thụ như nhau trong cả 3 nhóm. Khi đạt nồng độ đỉnh, gliclazide có xu hướng giảm chậm ở nhóm suy thận (t1/2 đào thải ở nhóm ĐTĐ: 14,8 giờ và nhóm không đái tháo đường :22,4 giờ) so với nhóm không có ĐTĐ (12,7 giờ). Tuy nhiên tính dao động trong từng người là khá lớn và sự khác biệt này không có ý nghĩa thống kê. Sự khác biệt giữa các thông số được đo không có ý nghĩa và cũng không có sự tương quan giữa các thông số DĐH và CLcr.
Mặc dù không có nhiều dữ liệu ở bệnh nhân có suy thận nặng, các nghiên cứu cho thấy không có những biến đổi về DĐH của thuốc cũng như không có tăng nguy cơ hạ đường huyết ở người có GFR > 40ml/ph. Tại Thụy Sĩ, gliclazide là sulfonylurea duy nhất được sử dụng ở người có GFR trong khoảng 40-60ml/ph, nhưng phải ngưng sử dụng khi GFR giảm dưới 40ml/ph.
Nhóm ức chế α-glucosidase
Thuốc ức chế α-glucosidase không được khuyến cáo trong điều trị ĐTĐ típ 2 theo đồng thuận gần đây của ADA-EASD, có lẽ do hiệu quả giảm đường huyết và tính dung nạp kém trên đường tiêu hóa ở người Châu Âu. Tuy nhiên, đây là thuốc điều trị phổ biến tại Châu Á. Rất nhiều hợp chất thuộc nhóm thuốc này nhưng các dữ liệu về việc sử dụng trên bệnh nhân kèm BTM rất hiếm.
Acarbose
Acarbose tác động tại chỗ trên ống tiêu hóa và có độ sinh khả dụng hệ thống thấp. Mặc dù <2% thuốc được hấp thu dưới dạng hoạt tính, nhưng bệnh nhân có suy thận nặng (CLcr<25ml/ph) có thể đạt nồng độ cao gấp 5 lần nồng độ huyết tương của acarbose và gấp 6 lần giá trị AUC so với người có chức năng thận bình thường. Các thử nghiệm lâm sàng dài hạn trên bệnh nhân ĐTĐ kèm rối loạn chức năng thận vẫn chưa được thực hiện, điều trị với acarbose trên nhóm bệnh nhân này không được khuyến cáo.
Nhóm thiazolinedione.
Pioglitazone
Pioglitazone và các hoạt chất chuyển hóa được đào thải qua gan, các đặc tính DĐH được xem là phù hợp cho bệnh nhân BTM. Người khỏe mạnh có chức năng thận bình thường (CLcr>80ml/ph), người có suy thận trung bình (CLcr 30-60 ml/ph) và người suy thận nặng (CLcr< 30ml/ph) được dùng pioglitazone 45 mg liều đơn độc hay nhiều lần trong ngày. Các đặc điểm DĐH của pioglitazone và chất chuyển hóa M-III và M-IV được đo sau liều lần đầu và lần cuối cùng (ngày 1 và ngày 12). Đặc điểm DĐH ở người bình thường tương tự người có suy thận trung bình; sự tích tụ pioglitazone và chất chuyển hóa cũng không khác biệt so với người có suy thận. AUC trung bình của pioglitazone và chất chuyển hóa M-III, M-IV giảm ở người có suy thận nặng so với người bình thường (Bảng 1). Điều này được lý giải do sự giảm protein gắn kết ở bệnh nhân có suy thận qua đó làm tăng nồng độ pioglitazone tự do và tăng độ thanh lọc của thuốc (với giả định chức năng nội tại của gan không thay đổi). Trong nghiên cứu này, pioglitazone có tính dung nạp tốt trên bệnh nhân có suy thận mức độ khác nhau vì vậy việc chỉnh liều khi khởi trị cũng như liều duy trì ở những bệnh nhân này có lẽ không cần thiết. Đặc điểm DĐH của pioglitazone cũng tương tư như ở bệnh nhân BTGĐC đang lọc máu và bệnh nhân có chức năng thận bình thường.
Thuốc ức chế men DPP-4
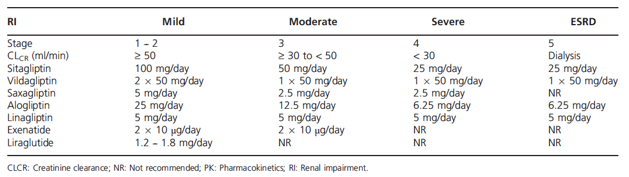
Ức chế men DPP-4 (gliptin) là nhóm thuốc viên hạ đường huyết mới thuộc nhóm hạ đường huyết dựa trên hiệu ứng incretin. Nó giúp cải thiện kiểm soát đường huyết mà không gây hạ đường huyết (trái ngược với sulfonylurea) và trung tính về cân nặng. Nhiều phân tử thuốc đã có mặt trên thị trường với các đặc điểm dược động học khác nhau. Ức chế men DPP-4 đã được đặc biệt nghiên cứu ở bệnh nhân có BTM. Sitagliptin, vildagliptin, saxagliptin và alogliptin được thải với lượng lớn qua thận. Kết quả từ những nghiên cứu DĐH chuyên biệt cho thấy ở các mức độ suy thận khác nhau liều hằng ngày của thuốc ức chế men DPP-4 trên cần được hiệu chỉnh theo eGFR nhằm đạt nồng độ thuốc trong huyết thanh gần giống nhau. Nhiều nghiên cứu chỉ ra rằng khi giảm liều thuốc ở bệnh nhân có suy thận thì tác dụng hạ đường huyết vẫn được duy trì đồng thời bảo đảm tính an toàn của thuốc. Ngược lại với các thuốc trên, linagliptin được thải chủ yếu qua đường mật chứ không phải thận (<5%). Vì vậy, thuốc ức chế men DPP-4 này không cần điều chỉnh liều khi có suy thận và có thể sử dụng ở mọi mức độ suy thận (Bảng 5). Trong tất cả nghiên cứu liên quan đến thuốc ức chế men DPP-4 các dân số sau đây đã được đưa vào: chức năng năng thận bình thường, CLCr > 80ml/ph; suy thận nhẹ, 50 − 80 ml/ph; suy thận trung bình 30 − 50 ml/ph; suy thận nặng, < 30ml/ph; BTGĐC, < 30 ml/ph đang được lọc máu.
Bảng 5. Chỉnh liều nhóm thuốc incretin theo khuyến cáo ở các mức độ tổn thương thận khác nhau dựa trên kết quả các nghiên cứu dược động học
Thuốc ức chế men DPP-4 đang đóng vai trò ngày càng nhiều trong điều trị ĐTĐ2, đặc biệt khi kết hợp với metformin. Nhiều viên phối hợp liều cố định (FDCs) đã lưu hành hoặc sẽ sớm được đưa ra thị trường. Những viên phối hợp liều cố định này chỉ được kê toa khi cả hai thành phần thuốc đều không bị chống chỉ định do có suy thận và cần phải chỉnh liều thuốc của từng thành phần một cách thích hợp.
Sitagliptin
DĐH của liều đơn sitagliptin 50 mg được đánh giá ở bệnh nhân với nhiều mức độ suy thận khác nhau: nhẹ, trung bình, nặng, BTGĐC đang lọc máu và chức năng thận bình thường. So với nhóm có chức năng thận bình thường, diện tích dưới đường cong (AUC) của sitagliptin tăng gấp 1,6; 2,3; 3,8 và 4,5 lần ở nhóm suy thận nhẹ, trung bình, nặng, và BTGĐC (Bảng 1). Dựa trên kết quả này, khuyến cáo cần điều chỉnh liều sitagliptin thành 50 mg/ngày ở suy thận trung bình và thành 25 mg/ngày ở suy thận mức độ nặng để có được nồng độ sitagliptin trong huyết tương tương đương với người có chức năng thận bình thường với liều 100 mg/ngày (Bảng 5).
Vildagliptin
Vildagliptin phần lớn chuyển hóa bằng phản ứng thủy phân và các chất chuyển hóa của nó được thải chủ yếu qua thận. Một lượng nhỏ vildagliptin được thải qua thận dưới dạng thuốc không chuyển hóa (23% sau một liều uống). Vì vậy, tổn thương thận có ảnh hưởng đến DĐH của vildagliptin. AUC trung bình tăng khoảng 32 − 134% và Cmax tăng khoảng 8 − 66% ở bệnh nhân suy thận nhẹ, trung bình, nặng, BTGĐC đang lọc máu khi so với người khỏe mạnh. Lượng vildagliptin được thải ra khi lọc máu rất nhỏ (3%). So với người khỏe mạnh, AUC của chất chuyển hóa chính sau thủy phân, không hoạt tính (LAY151) tăng gấp 1,6-,2,4-,5,4- và 6,7 lần ở nhóm suy thận mức độ nhẹ, trung bình, nặng và BTGĐC, với mối tương quan cao giữa sự thay đổi của phơi nhiễm thuốc với sự giảm GFR (Bảng 1). Việc không có mối tương quan rõ giữa mức tăng phơi nhiễm thuốc và mức độ nặng của suy thận cho thấy thận không chỉ thải thuốc và còn đóng vai trò lớn hơn trong việc chuyển hóa thủy phân vildagliptin. Dưới góc nhìn DĐH, tăng mức độ phơi nhiễm thuốc gấp hai lần cho thấy liều vildagliptin ở bệnh nhân suy thận mức độ trung bình, nặng cần phải giảm còn phân nửa liều hằng ngày của bệnh nhân có chức năng thận bình thường (50 mg một lần/ngày thay vì 50 mg hai lần/ngày) (Bảng 5).
Saxagliptin
Dược động học và tính dung nạp của saxagliptin và các chất chuyển hóa có hoạt tính dược lý của nó, 5-hydroxy saxagliptin ở người không đái tháo đường có suy thận nhẹ, trung bình, nặng và BTGĐC được so sánh với người trưởng thành khỏe mạnh. Tất cả đều được cho liều uống đơn saxaglitpin 10 mg. Sử dụng cách tiếp cận dựa vào mô hình, trung bình hình học AUC∞ của saxagliptin ở người suy thận nhẹ, trung bình hay nặng cao hơn 16, 41 và 108% so với người khỏe mạnh. AUC∞ của 5-hydroxy saxagliptin của người suy thận nhẹ, trung bình, nặng cao hơn người khỏe mạnh 67, 192 và 347% (Bảng 1). Thời gian thải thuốc t1/2 và độ thanh lọc thận CLrcủa saxagliptin và 5-hydroxy saxagliptin tăng tỉ lệ theo mức độ giảm CLcr. Do đó, nửa liều thường dùng của saxagliptin 5 mg (tức là 2,5 mg một lần/ngày) được khuyến cáo đối với bệnh nhân suy thận trung bình, nặng hoặc BTGĐC đang lọc máu, nhưng đối với suy thận mức độ nhẹ thì không cần chỉnh liều.
Alogliptin
Kết quả nghiên cứu DĐH liều đơn alogliptin (50mg) ở bệnh nhân suy thận cho thấy tăng phơi nhiễm thuốc so với người tình nguyện khỏe mạnh: khoảng gấp 1,7-,2,1-,3,2- và 3,8- lần tương ứng ở nhóm suy thận nhẹ, trung bình, nặng và BTGĐC (Bảng 1). Dựa vào kết quả này, để đạt nồng độ alogliptin tương tự người có chức năng thận bình thường thì khuyến cáo phải chỉnh liều thuốc ở bệnh nhân ĐTĐ típ 2 có tổn thương thận trung bình đến nặng, bao gồm cả BTGĐC cần lọc máu (Bảng 5).
Linagliptin
Ảnh hưởng linagliptin lên nhiều mức độ khác nhau của suy thận được đánh giá ở người có và không có ĐTĐ típ 2. Dược động học của linagliptin (5 mg một lần/ngày) được nghiên cứu khi dùng liều đơn và đạt nồng độ ổn định (cho thuốc từ 7 − 10 ngày) ở bệnh nhân có BTM mức độ nhẹ, trung bình, nặng và BTGĐC đang lọc máu so sánh với người có chức năng thận bình thường. Mức thải linagliptin dạng không đổi qua đường thận là < 7% ở mọi nhóm. Mặc dù có khuynh hướng phơi nhiễm thuốc cao hơn (20 − 60%) ở bệnh nhân có BTM so với người chức năng thận bình thường nhưng AUC và Cmax ở trạng thái ổn định nồng độ cho thấy có mức trùng lắp nhau cao và không bị ảnh hưởng bởi mức độ suy thận (Bảng 1). Do đó, BTM ảnh hưởng rất ít lên DĐH của linagliptin, điều này cũng đã được xác nhận trong các phân tích hậu cứu nồng độ linagliptin trong huyết thanh ở chương trình Pha III toàn cầu đánh giá linagliptin 5 mg/ngày trong 24 − 52 tuần ở bệnh nhân ĐTĐ típ 2 với nhiều mức độ suy thận khác nhau.
Một phân tích gộp gồm ba thử nghiệm lâm sàng đánh giá tác động của chức năng thận lên hiệu quả và tính an toàn của linagliptin. Số liệu có trên 2141 bệnh nhân ĐTĐ típ 2 được xếp nhóm theo chức năng thận thành bình thường (n = 1684), BTM nhẹ (n = 418) hay BTM trung bình (n = 39). Linagliptin cho thấy mức thay đổi trung bình của HbA1c hiệu chỉnh với giả dược là đồng nhất nhau giữa các nhóm sau 24 tuần: nhóm chức năng thận bình thường (-0,63%), BTM nhẹ (-0.69%) và BTM trung bình (-0.69%), với sự khác biệt giữa các nhóm là không có ý nghĩa thống kê. Linagliptin nói chung dễ dung nạp với tỉ lệ tác dụng ngoại ý khi dùng linagliptin tương tự nhóm dùng giả dược.
Cuối cùng, một thử nghiệm Pha III gần đây đánh giá hiệu quả và tính an toàn của linagliptin ở bệnh nhân ĐTĐ típ 2 với BTM mức độ nặng (GFR < 30 ml/ph/1,73 m2). Bệnh nhân được điều trị hoặc với linagliptin 5 mg/ngày hoặc với giả dược. Linagliptin giảm HbA1c có ý nghĩa thống kê ở tuần 12 so với nền khi phân tích tổng thể (-0,8 so với -0,2% ở nhóm giả dược) và trong phân tích dưới nhóm ở bệnh nhân kiểm soát đường huyết kém (HbA1c nền ≥ 9%) (-1,5 so với -0,3%). Hạ đường huyết xảy ra nhiều hơn ở nhóm sử dụng linagliptin so với giả dược, quan sát này có thể giải thích được do không đổi liều insulin và/hoặc sulfonylurea sẵn có. Tác dụng ngoại ý khác tương tự nhau giữa nhóm linagliptin và giả dược.
Nhóm ức chế SGLT2
Ức chế SGLT2 là thuốc hạ đường huyết mới tác động chuyên biệt lên thận bằng cách ức chế tái hấp thu lượng glucose đã được lọc, từ đó dẫn đến tăng thải glucose qua nước tiểu. Cơ chế tác động này mang lại nhiều hứa hẹn cho bệnh nhân ĐTĐ típ 2 không chỉ trong việc kiểm soát đường huyết và cả khả năng giảm cân và hạ huyết áp động mạch. Dapagliflozin là thuốc ức chế SGLT2 có nhiều bằng chứng lâm sàng nhất cho đến nay. Các thuốc ức chế SGLT2 khác (canagliflozin, empagliflozin) vẫn đang ở các pha phát triển sau cùng, nhưng chưa ghi nhận nghiên cứu nào đặc biệt về đặc tính DĐH của hai loại thuốc này ở bệnh nhân có suy chức năng thận.
Đồng vận thụ thể GLP-1
Bên cạnh insulin, nhóm đồng vận thụ thể GLP-1 (exenatide và liraglutide, hay lixisenatide) tạo cơ hội mới để điều trị ĐTĐ típ 2. Tuy nhiên, do đặc tính DĐH của những hợp chất này nên có một vài hạn chế đã được ghi nhận khi dùng ở bệnh nhân có suy chức năng thận (Bảng 5).
Các báo cáo ca lâm sàng cho thấy mối liên quan giữa exenatide và liraglutide với tổn thương thận cấp ở bệnh nhân ĐTĐ típ 2. Giải thích cho điều này được cho là do tác dụng phụ đường tiêu hóa với ói tái diễn dẫn đến mất nước và tổn thương thận cấp thứ phát sau đó. Các bác sĩ lâm sàng cần ý thức về tác dụng phụ này và bệnh nhân cũng cần được giáo dục cần phải báo cáo các triệu chứng đường tiêu hóa bất thường hoặc kéo dài. Tuy nhiên, một nghiên cứu đoàn hệ hồi cứu dựa trên số lượng lớn dữ liệu kê khai cho thấy tăng tỉ lệ suy thận cấp ở bệnh nhân đái tháo đường so với bệnh nhân không đái tháo đường nhưng lại không có mối liên quan giữa việc sử dụng exenatide và suy thận cấp.
Exenatide
Đặc điểm DĐH, tính an toàn và tính dung nạp của liều đơn exenatide được đánh giá ở bệnh nhân có suy thận. Exenatide (5 hay 10 μg) được tiêm dưới da ở 31 bệnh nhân (chỉ một có ĐTĐ típ 2) được phân tầng theo chức năng thận: bình thường (CLcr > 80 ml/ph), suy thận nhẹ (50 − 80 ml/ph), suy thận trung bình ( 31 − 50 ml/ph) hay BTGĐC cần lọc máu. Số liệu DĐH được kết hợp với bốn nghiên cứu liều đơn trước đây ở bệnh nhân ĐTĐ típ 2 để khảo sát mối liên hệ giữa độ thanh lọc exenatide (CL/F) và CLcr. T1/2 trung bình của người khỏe mạnh, suy thận nhẹ, suy thận trung bình và BTGĐC lần lượt là 1,5; 2,1; 3,2 và 6,0 giờ. Exenatide nói chung dung nạp tốt ở nhóm suy thận nhẹ và trung bình, nhưng không ở nhóm BTGĐC do buồn nôn và nôn. Do tính dung nạp và đặc điểm DĐH thay đổi ở mức chấp nhận được về mặt lâm sàng ở bệnh nhân suy thận nhẹ và trung bình có thể dùng exenatide ở những bệnh nhân này mà không cần chỉnh liều. Tuy nhiên độ dung nạp kém và thay đổi đáng kể về DĐH khiến liều điều trị hiện tại (5 và10 μg) không thích hợp trong nhóm suy thận nặng hay BTGĐC.
Liraglutide
Để xác định tác động của suy thận mức độ nhẹ lên hiệu quả và tính an toàn của liraglutide ở bệnh nhân ĐTĐ típ 2, sáu thử nghiệm lâm sàng LEAD (Liraglutide Effect and Action in Diabetes) đã được đánh giá trong một phân tích gộp tập trung trên các số liệu của bệnh nhân có chức năng thận bình thường (CLcr > 89 ml/ph), suy thận nhẹ (60 – 89 ml/ph), suy thận trung bình-nặng (< 60 ml/ph). Đối tượng nghiên cứu bao gồm bệnh nhân dùng liraglutide một lần/ngày (1,2 hay 1,8 mg) hoặc giả dược như là đơn trị liệu hoặc kết hợp với các thuốc viên hạ đường huyết trong vòng 26 tuần. Suy thận nhẹ không ảnh hưởng mức khác biệt điều trị dự đoán của HbA1c, cân nặng và huyết áp tâm thu. Liraglutide an toàn và dung nạp tốt ở bệnh nhân suy thận nhẹ, sự thay đổi tỉ lệ tổn thương thận, hạ đường huyết nhẹ hay buồn nôn không có sự khác biệt so với giả dược. Tuy nhiên, có khuynh hướng tăng buồn nôn ở bệnh nhân suy thận trung bình hay nặng khi dùng liraglutide mặc dù số lượng bệnh nhân trong nhóm này quá ít để cho thấy mức ý nghĩa thống kê. Kết luận là suy thận nhẹ không ảnh hưởng lên hiệu quả và tính an toàn của liraglutide.
Insulin người
Gần 50% insulin lưu hành trong máu (tỉ lệ cao hơn đối với insulin ngoại sinh so với nội sinh) được thải qua thận bằng hai con đường riêng biệt: i) lọc qua cầu thận và sau đó tái hấp thu từ lòng ống ở tế bào ống lượn gần thông qua nhập bào và ii) khuếch tán insulin từ mao mạch quanh ống và sau đó gắn kết insulin vào màng đáy của tế bào ống thận. Với GFR thấp hơn thì độ thanh lọc insulin sẽ giảm hơn nữa và tổng nhu cầu insulin ngoại sinh thường giảm. Nếu không dự đoán trước điều này có thể làm tăng nguy cơ hạ đường huyết có triệu chứng. Khuyến cáo chung là khi GFR từ 10 và 50 ml/ph, liều insulin cần giảm 25% và khi GFR giảm < 10 ml/ph thì liều insulin cần giảm 50% so với trước đó.
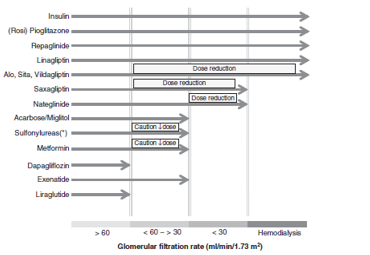
Hình 1. Sử dụng thuốc hạ đường huyết theo mức độ suy thận dựa trên eGFR
Kết luận
BTM mức độ trung bình và nặng (giai đoạn 3-5) chiếm tỉ lệ ngày càng cao ở bệnh nhân ĐTĐ típ 2 (20-25%), đặc biệt là người cao tuổi, nên thuốc hạ đường huyết cần được điều chỉnh phù hợp. Một số thuốc có thể cần phải giảm liều hay ngưng sử dụng trong trường hợp suy thận nặng vì tính an toàn (Hình 1). Kinh nghiệm lâm sàng tại các quốc gia cho thấy nhiều bệnh nhân ĐTĐ típ 2 không được điều trị phù hợp, được sử dụng nhiều thuốc với liều cao hơn mức cho phép khi có giảm chức năng thận hoặc thậm chí sử dụng những thuốc vốn là chống chỉ định trong trường hợp BTM nặng. Mặc dù tình trạng kê toa không phù hợp khá phổ biến, nhưng các tác dụng ngoại ý khá thấp hoặc có thể do không được nhận biết đầy đủ trên lâm sàng. Tác dụng phụ thường gặp và được nhận biết nhiều nhất của thuốc hạ đường huyết ở bệnh nhân ĐTĐ có BTM là: nhiễm acid lactic do metformin, hạ đường huyết do sulfonylurea (hiếm hơn khi dùng glinide) hoặc với cả insulin (kể cả insulin analog), giữ muối nước làm tăng nguy cơ suy tim xung huyết do TZD. DĐH của ức chế DPP-4 (ngoại trừ linagliptin) và đồng vận thụ thể GLP-1 cũng bị ảnh hưởng bời suy thận nên hai thuốc này cũng cần được giảm liều phù hợp. Tuy nhiên, nguy cơ của các thuốc vẫn khá thấp dù sử dụng trên bệnh nhân BTM. Hạ đường huyết do sulfonylurea ở bệnh nhân kèm BTM có thể rất trầm trọng, thậm chí gây tử vong, nguy cơ này giảm đáng kể bằng việc thay thế bằng ức chế DPP-4. Tác dụng ngoại ý của metformin cũng cần được lưu tâm hơn. Metformin là thuốc điều trị đầu tay trong tất cả các hướng dẫn điều trị ĐTĐ típ 2, nhưng được xem là chống chỉ định khi GFR dưới 60ml/ph. Nếu nguyên tắc này được tuân thủ một cách nghiêm ngặt sẽ làm nhiều người mất đi cơ hội được điều trị với loại thuốc hạ đường huyết tốt nhất. Vấn đề này nên được điều chỉnh trong điều trị bệnh nhân suy thận nhẹ đến trung bình.
Sự tăng nhanh tỉ lệ bệnh nhân ĐTĐ kèm BTM, nhất là ở người cao tuổi, đòi hỏi việc theo dõi chức năng thận thường xuyên và sự chọn lựa cũng như chỉnh liều thuốc phù hợp theo GFR. Sự cân nhắc về nguy cơ/lợi ích luôn được đánh giá cẩn thận trên nhóm đối tượng này.
Ý kiến chuyên gia
Nhìn chung, mục tiêu và phương thức điều trị nên phù hợp với đặc điểm của từng bệnh nhân. BTM, biến chứng thường gặp của ĐTĐ típ 2, hiện chiếm tỉ lệ ngày càng cao ở người cao tuổi. Bước đầu tiên là cần chọn lựa phương pháp điều trị thích hợp và theo dõi chức năng thận. Việc chuẩn hóa cách ước tính GFR là cần thiết nhằm tránh những bối rối khi áp dụng các công thức ước tính GFR khác nhau.
Thứ hai, trong tiếp cận với bệnh nhân là trung tâm, việc hiện diện BTM là vấn đề quan trọng cần được xem xét trong chọn lựa thuốc, liều lượng và theo dõi điều trị. Trên đối tượng bệnh nhân ĐTĐ típ 2 kèm BTM hiện chưa có khuyến cáo điều trị nhưng có thể áp dụng theo cách sau đây.
Lựa chọn đầu tiên vẫn là metformin nếu suy thận ổn định với độ thanh thải creatinine (CLcr) > 30ml/ph và chức năng thận được theo dõi thường xuyên. Khi CLcr dưới 45 ml/ph, metformin nên giảm còn nửa liều và ngưng metformin khi CLcr <30 ml/ph. Bệnh nhân và gia đình cũng nên biết cần phải ngưng metformin khi có bất kì tình trạng cấp tính nào, đặc biệt là những tình huống mất nước (tiêu chảy, nôn ói…) nhằm giảm nguy cơ nhiễm acid lactic (biến chứng hiếm nhưng có thể gây tử vong).
Trong trường hợp có chống chỉ định với metformin (CLcr từ 30-45ml/ph nhưng không ổn định hoặc CLcr<30ml/ph), bác sĩ nên chuyển sang ức chế DPP-4 thay vì sulfonylurea nhằm giảm nguy cơ hạ đường huyết do sulfonylurea. Linagliptin, không thải qua thận, có thể được sử dụng với liều thông thường trong khi các thuốc ức chế DPP-4 khác cần phải được giảm liều nhằm đạt nồng độ ổn định trong huyết tương. Với cách nêu trên, việc kiểm soát đường huyết vẫn được duy trì, và tính an toàn vẫn được đảm bảo ở bệnh nhân ĐTĐ típ 2 kèm BTM trung bình đến nặng. Một chọn lựa khác kinh tế hơn là sử dụng glinide và sulfonylurea thải qua thận ít (và chất chuyển hóa không có hoạt tính).
Khi mục tiêu đường huyết không đạt được với metformin đơn trị liệu, việc bổ sung ức chế DPP-4 dường như có lợi hơn so với sulfonylurea. Viên phối hợp liều cố định gliptin và metfromin còn giúp cải thiện sự tuân thủ trong điều trị. Các chọn lựa khác đã đề cập (repaglinide, pioglitazone, acarbose) có thể được xem xét sử dụng mặc dù các bằng chứng lâm sàng trên đối tượng BTM còn ít.
Khi sự kết hợp gliptin-metformin thất bại, lựa chọn tốt nhất là chuyển sang điều trị insulin vì hiện thiếu bằng chứng về sự kết hợp 3 thuốc hoặc sử dụng đồng vận GLP-1 trên bệnh nhân BTM. Điều lưu ý là liều insulin hằng ngày cũng thấp hơn ở người có BTM vì thận thải ra khoảng 50% insulin và nguy cơ hạ đường huyết ở người suy thận cũng cao hơn. Hiện chưa có hướng dẫn nào về sự chỉnh liều của insulin theo GFR.
Sự gia tăng tỉ lệ BTM (đặc biệt là mức độ nhẹ và trung bình) ở bệnh nhân ĐTĐ típ 2 đã thúc đẩy nhu cầu làm sáng tỏ việc sử dụng các loại thuốc hạ đường huyết hiện hành cũng như nhu cầu về một loại thuốc hạ đường huyết mới có tính hiệu quả và an toàn trên nhóm đối tượng này.







