BS. NGUYỄN DƯƠNG KHANG*
BS. NGUYỄN THANH HIỀN**
* Khoa Tim mạch can thiệp, bệnh viện Đại học Y Dược TP. Hồ Chí Minh
** Trung tâm Tim mạch, bệnh viện Đại học Y Dược TP. Hồ Chí Minh
I. TỔNG QUAN
Theo Jeffrey J. Goldberger, Christine M. Albert và Robert J. Myerburg, đột tử do tim (Sudden Cardiac Death: SCD) không phải là một tình trạng nhất quán xảy đến do một chẩn đoán nhất định trước đó. SCD là tử vong tự nhiên do các nguyên nhân tim mạch, có tiền triệu là sự mất ý thức đột ngột xảy ra trong vòng 1 giờ sau các thay đổi cấp tính về tình trạng tim mạch (hình 1) [1]. Thông thường chúng ta không có đầy đủ thông tin về trường hợp đột tử, một số định nghĩa về SCD cho phép khoảng thời gian lên đến 24 giờ và bao gồm cả tử vong trong lúc ngủ. Ít nhất một nửa số trường hợp SCD là không được chứng kiến, do vậy khó biết rõ các tình huống dẫn đến đột tử như thế nào. Bệnh lý tim mạch trước đó có thể đã được biết hoặc chưa được biết, nhưng thời gian và cách thức tử vong là không biết trước. Định nghĩa này nhấn mạnh các thành tố chính: tử vong tự nhiên nhanh chóng, và quan trọng nhất là tử vong không hề biết trước do một nguyên nhân hoặc cơ chế từ tim.Tần suất đột tử trong suy tim là gấp 5 lần tần suất này trong dân số chung, chiếm khoảng 40-50% trường hợp tử vong [2]. Chỉ tính ở Hoa Kỳ, mỗi năm có khoảng 380.000 trường hợp SCD ngoại viện[3], và khoảng 200.000 trường hợp SCD nội viện [4]. Thông thường, tác động của SCD được mô tả bằng quy luật 50: SCD chiếm khoảng 50% số trường hợp tử vong tim mạch, khoảng 50% tất cả trường hợp SCD là biểu hiện đầu tiên của bệnh lý từ tim, và thường SCD xảy ra trong những năm bệnh nhân còn đang làm việc, tức có thể lấy đi đến 50% số năm có thể sống tiếp [5]. Nguyên nhân của đột tử trong suy tim đa số đến từ các rối loạn nhịp thất, hậu quả của các tương tác phức tạp giữa các biến đổi cấu trúc trong suy tim và các yếu tố thúc đẩy từ môi trường bên ngoài [6], [7].

Hình 1. Đột tử do tim dưới góc nhìn thời gian
Điều trị theo khuyến cáo trong suy tim EF giảm được đặt nền tảng dựa trên 4 nhóm thuốc: ức chế hệ RAA (ức chế men chuyển – ACEi, chẹn thụ thể angiotensin – ARB, ức chế angiotensin thụ thể neprilysin – ARNi), chẹn thụ thể beta (beta blocker – BB), đối vận thụ thể mineralcorticoid (mineralcorticoid receptor antagonist – MRA) và ức chế SGLT2 (sodium glucose cotransporter 2 inhibitor – SGLT2i) (hình 2) [8-10]. Tất cả 4 nhóm này đã được chứng minh làm giảm tần suất tái nhập viện vì suy tim và tử vong do mọi nguyên nhân trong suy tim [11]; trong đó, một số được chứng minh có đặc tính chống loạn nhịp và ngăn ngừa đột tử. Trong bài này, chúng tôi sẽ bàn về cơ chế sinh bệnh của rối loạn nhịp và đột tử trong suy tim; sau đó là đặc tính và bằng chứng chống loạn nhịp và đột tử của từng nhóm thuốc trong suy tim
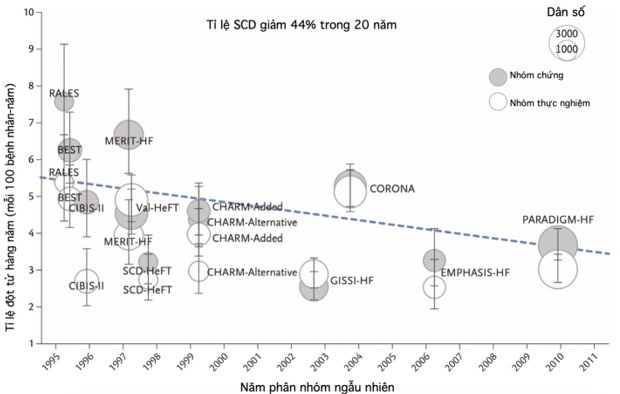
Hình 2. Xu hướng của tần suất đột tử qua các nghiên cứu chính thực hiện trong 20 năm qua [8]
Phân tích gộp dựa trên các nghiên cứu này thu nhận hơn 1.000 bệnh nhân không mang ICD để đánh giá tác động của các liệu pháp dùng thuốc trong giảm thiểu tần suất SCD trong suy tim
II. CƠ CHẾ SINH BỆNH HỌC CỦA RỐI LOẠN NHỊP THẤT VÀ ĐỘT TỬ TRONG SUY TIM
II.1. Yếu tố nguy cơ
II.1.1. Yếu tố nguy cơ chung cho đột tử do tim (bảng 1)
Dự đoán nguy cơ SCD phức tạp hơn việc chỉ đánh giá nguy cơ bệnh mạch vành qua các yếu tố nguy cơ truyền thống của xơ vữa động mạch. Các yếu tố nguy cơ truyền thống có ích trong phân loại nguy cơ dân số và một số mặt về nguy cơ của cá nhân; tuy nhiên lại không hiệu quả trong việc phân biệt nhóm bệnh nhân có nguy cơ SCD với những kết cục khác trong nhóm bệnh mạch vành [12]. Tăng huyết áp rõ ràng là một yếu tố nguy cơ đã được xác định cho bệnh mạch vành, và cũng được xem là yếu tố nguy cơ làm tăng đáng kể tần suất SCD [13]. Tuy nhiên lại không có liên quan nào giữa việc tăng trị số huyết áp tâm thu với tỉ lệ tử vong do đột tử/tử vong do bệnh mạch vành. Chưa có bằng chứng nào về mối quan hệ giữa nồng độ cholesterol và tần suất đột tử do bệnh mạch vành. Tuy vậy, tiền sử đái tháo đường và xu hướng QTc kéo dài trên các bản điện tâm đồ bất kỳ có thể là các dấu hiệu dự đoán SCD. Tiền sử gia đình SCD là một biểu hiện đặc hiệu của dạng bệnh lý này, từ đó có thể giúp xác định các bất thường về gen nhất định có khả năng dẫn đến SCD [1].
Bảng 1. Các yếu tố về gen liên quan với nguy cơ đột tử do tim
| Bệnh lý rối loạn nhịp do gen |
| Hội chứng QT dài, QT ngắn di truyền
Hội chứng Brugada Nhanh thất/rung thất đa hình do catecholamine Hội chứng sóng J Nhanh thất/rung thất đơn độc |
| Bệnh lý cấu trúc di truyền có nguy cơ rối loạn nhịp gây đột tử do tim |
| Bệnh cơ tim phì đại
Loạn sản cơ/Bệnh cơ tim thất Phải |
| Khuynh hướng di truyền dễ bị rối loạn nhịp và đột tử do tim |
| Hội chứng QT dài do thuốc
Rối loạn nhịp do điện giải và chuyển hóa |
| Tác động của gen trên các bệnh lý mắc phải phức tạp |
| Bệnh mạch vành, hội chứng vành cấp
Suy tim sung huyết, bệnh cơ tim dãn |
Công thức chung để đánh giá nguy cơ SCD là xem xét bệnh nền, các yếu tố kích gợi khả dĩ, và các yếu tố điều hòa khác. Bệnh nền có thể là các bất thường về mặt giải phẫu hoặc phân tử (như bệnh lý kênh ion). Các yếu tố kích gợi khả dĩ bao gồm các hoạt động điện lệch chỗ tại thất và hoạt động thể lực hoặc các tình trạng làm tăng kích thích giao cảm khác.
Hút thuốc lá đã được chứng minh có mối liên hệ rõ rệt với mọi kiểu hình bệnh tim thiếu máu cục bộ. Nghiên cứu Frahmingham chỉ ra rằng những người hút thuốc lá có nguy cơ đột tử tăng từ 2 đến 3 lần trong mỗi thập kỷ từ 30 đến 59 tuổi[2]. Hút thuốc lá là yếu tố nguy cơ làm cho nguy cơ đột tử của một người tăng vọt khi bắt đầu hút. Điều quan trọng là nếu một người ngưng hút thuốc thì nguy cơ này có thể đảo ngược được. Với những người đột tử được cứu sống, nếu tiếp tục hút thuốc thì nguy cơ tái phát sẽ cao hơn hẳn những người ngừng hút [1]. Rượu bia có tác động trên tim cách phức tạp hơn. Trong nghiên cứu Physicians’ Health, uống rượu ít – vừa làm giảm nguy đột tử do tim; nhưng nếu uống >= 2 phần mỗi ngày thì lại không ghi nhận tác động tích cực này [14], [15]. Mặt khác, nghiện rượu làm tăng nguy cơ rung nhĩ, nhồi máu cơ tim và suy tim sung huyết [16] – tất cả tình trạng này đều có thể dẫn tới đột tử. Như vậy, có lẽ mối quan hệ giữa rượu bia và đột tử do tim là mối quan hệ hình chữ U; tác động chỉ tích cực nếu uống ít – vừa.
Béo phì cũng có tác động trên tần suất đột tử do tim. Trong nghiên cứu Framingham, cân nặng càng tăng thì tần suất tử vong đột ngột do bệnh mạch vành cũng như tử vong tim mạch nói chung cũng tăng[2].Hoạt động thể lực là một yếu tố kích gợi SCD được biết đến nhiều, nhất là trong giai đoạn tăng nhịp tim lúc vận động và giảm nhịp tim sau khi ngừng vận động [1], nhưng cũng cần nhấn mạnh là hình thành thói quen vận động thể lực cũng sẽ làm giảm đáng kể nguy cơ SCD. Những người hoạt động thể lực gắng sức đột ngột có lẽ dễ bị khởi phát nhồi máu cơ tim và đột tử do tim, đặc biệt là ở những người thường không vận động nhiều hoặc lối sống tĩnh tại. Phân tích từ nghiên cứu của Physicians’ Health cho thấy nguy cơ tương đối của đột tử do tim tăng gấp 17 lần khi tập luyện thể lực nặng và trong 30 phút sau khi tập luyện, so sánh với việc tập luyện nhẹ hoặc lối sống tĩnh tại [17]. Tuy vậy, tỉ lệ tuyệt đối biến cố này rất thấp (1 biến cố/1,5 triệu lần tập thể lực). Việc tập luyện thường xuyên thành thói quen có thể làm giảm nguy cơ này.
Vai trò của các yếu tố xã hội trên yếu tố nguy cơ và tử suất tim mạch đã được biết rõ, tuy vậy vẫn chưa có dữ liệu cụ thể nào liên kết với đột tử do tim. Ở phụ nữ, có báo cáo ghi nhận những người đột tử thường không kết hôn, có ít con cái hơn và có cách biệt về trình độ học vấn với người chồng hơn những người phụ nữ khác cùng độ tuổi, cùng sống tại một vùng cụ thể[18], [19]. Nhóm đột tử cũng thường có tiền sử điều trị tâm lý, hút thuốc lá và uống rượu bia nhiều hơn. Các thay đổi về hành vi (như tĩnh tại) thứ phát sau trầm cảm thường liên quan gần với các biến cố hơn là bản thân tình trạng trầm cảm. Các yếu tố tâm lý kích gợi cấp tính cũng làm tăng nguy cơ biến cố tim mạch, trong đó có đột tử.
II.1.2. Yếu tố nguy cơ của đột tử trong suy tim
Giảm nặng chức năng co bóp thất trái là yếu tố dự báo mạnh mẽ nhất cho tử vong chung và đột tử ở những bệnh nhân bệnh tim thiếu máu cục bộ mạn tính, cũng như ở những bệnh nhân có nguy cơ đột tử do tim do các nguyên nhân khác. Tử suất tăng lên, độc lập với các yếu tố nguy cơ khác, đã được ghi nhận ở những trường hợp có EF > 40%; nhưng tần suất tử vong tăng đáng kể là ở nhóm EF giữa 30% và 40%. EF ≤ 30% là yếu tố nguy cơ độc lập mạnh mẽ nhất cho đột tử do tim, nhưng lại có độ nhạy và độ đặc hiệu thấp. Cũng cần nói thêm, việc xem EF thấp là yếu tố nguy cơ chính dẫn đến việc bỏ lỡ một số lượng lớn trường hợp đột tử ở những bệnh nhân có EF trung gian hoặc bảo tồn với những bệnh lý khác chưa được phát hiện [20]. Việc đo EF nói chung còn có sự biến động lớn giữa các kỹ thuật hình ảnh, cũng như tình trạng bệnh nhân. Sức co bóp cơ tim là một yếu tố chính quyết định EF và vai trò của sức co bóp cơ tim trong nguy cơ đột tử do tim có thể có liên quan với mức độ sẹo cơ tim hoặc bệnh lý cơ tim. Hiện có những thông tin cho rằng tình trạng xơ hóa cơ thất trái có thể là một yếu tố gợi ý biến cố tim mạch tốt hơn phân suất tống máu đơn thuần [21], [22].
Bên cạnh những yếu tố đã được nghiên cứu sâu rộng và được chứng minh là có liên hệ chặt chẽ với đột tử do tim như LVEF giảm và phân độ NYHA cao [23], thì có những yếu tố khác mới hơn và là những cơ hội để phân tầng nguy cơ đột tử do tim chính xác hơn ở những bệnh nhân suy tim. Trong số các tiếp cận phân tầng nguy cơ mới này, một phương thức quan trọng cần nhắc đến là vai trò của cộng hưởng từ tim và các phân tích về gen, cũng như các dấu ấn sinh học mới. Hơn hết, cần nhớ rằng những bệnh nhân suy tim cũng có những bệnh đồng mắc phức tạp khác, và do vậy, nguy cơ góp phần vào tử vong chung cũng như nguy cơ đột tử do tim cũng cần cân nhắc đến nguyên nhân tim mạch và nguyên nhân không do tim mạch (như ung thư, bệnh chuyển hóa,…). Do vậy, phân tầng nguy cơ đột tử do tim ở những bệnh nhân này là phức tạp và khó khăn [24].
– LVEF và phân độ NYHA: LVEF =< 35% ở bệnh nhân NYHA II/III là một yếu tố dự đoán đột tử do tim mạnh mẽ, và là chỉ định chính của ICD trong phòng ngừa nguyên phát đột tử do tim theo ESC [23]. Tuy vậy, một số nghiên cứu cho thấy rằng tần suất sốc điện phù hợp ở những bệnh nhân này có thể không cao như dự đoán[25],[26], chứng tỏ rằng việc phân loại nguy cơ cần được đánh giá lại. Các chứng cứ ủng hộ con số 35% đến từ các nghiên cứu MADIT I, MADIT II và SCD-HeFT được công bố ở khoảng những năm 1996 đến 2005 [27], [28], [29], trong khi điều trị dùng thuốc đã thay đổi đáng kể từ sau giai đoạn đó. Điều hợp lý nên làm là đánh giá lại liều ngưỡng cắt 35% có còn phù hợp đối với những bệnh nhân ngày nay hay không. Tuy vậy, chỉ định Class I của việc sử dụng ICD là một rào cản lớn về pháp lý và y đức để tiến hành nghiên cứu mới nào vì việc phân nhóm ngẫu nhiên sẽ không được thông qua để tiến hành.
– Dấu ấn sinh học: BNP hoặc NT-proBNP có thể là các công cụ tiên lượng hữu ích vì nồng độ càng tăng thì được chứng minh là làm tăng nguy cơ rối loạn nhịp thất và đột tử do tim, trong cả suy tim EF giảm[30] và suy tim EF bảo tồn [31]. Tương tự như vậy, nồng độ troponin T cao cũng làm tăng nguy cơ rối loạn nhịp thất và đột tử do tim ở những bệnh nhân suy chức năng thất trái dù do nguyên nhân thiếu máu cục bộ hay không [32]. Gần đây nhất, miRNA lần đầu được chứng minh là có liên quan với tăng nguy cơ đột tử do tim ở những bệnh nhân suy tim [33]. miRNA là phân tử liên quan với con đường sinh bệnh học của xơ hóa, chết theo chương trình (apoptosis) và tiến trình viêm.
– Hình ảnh học: lớn cả thất trái và nhĩ trái ở những bệnh nhân bệnh cơ tim dãn được chứng minh làm tăng nguy cơ đột tử do tim và/hoặc rối loạn nhịp thất nặng [34]. Siêu âm tim đánh dấu mô cũng có thể là một công cụ hữu ích ở những bệnh nhân này, vì các biến cố rối loạn nhịp được ghi nhận có liên quan với giảm strain chiều dọc toàn thể thất trái và tăng biến dạng cơ học thất trái [35].
Cộng hưởng từ tim giúp đánh giá cả chức năng và hình thái học cơ tim. Một nghiên cứu đa trung tâm tiến cứu gần đây trên 1.508 bệnh nhân bệnh cơ tim dãn không thiếu máu cục bộ đã ghi nhận tăng tin hiệu muộn vùng giữa thành thất trên hơn 3 vùng cơ tim là một yếu tố gợi ý độc lập cả tử vong chung (HR: 2,077; 95% CI: 1,211 – 3,562, p = 0,008) và biến cố rối loạn nhịp nặng (HR: 1,693; 95% CI: 1,084 – 2,644; p = 0,021) [36].
– Dấu ấn điện sinh lý: các đặc điểm ECG như độ dài QRS, đoạn ST, ECG trung bình tín hiệu, sự thay đổi luân phiên sóng T (microvolt T wave alternans) và biến động tần số tim đã được đề nghị là các dấu hiệu tiên lượng rối loạn nhịp thất và đột tử do tim ở bệnh nhân suy tim, dù nguyên nhân là thiếu máu cục bộ hay không [37], [38], [39], [40]. Tuy vậy, giá trị tiên đoán dương của các phương pháp này còn chưa đủ hiệu quả để được xem là công cụ phân tầng nguy cơ [37]. Trên các nghiên cứu điện sinh lý xâm lấn, các kết quả mang lại khá đối nghịch nhau[37], [41],[42]. Trong nghiên cứu MADIT II, việc kích thích xuất hiện các rối loạn nhịp thất khi đang tiến hành điện sinh tim được chứng minh là có liên quan với tăng nguy cơ nhanh thất, nhưng lại không tăng nguy cơ rung thất [42]. Cũng cần nói thêm là sự khác biệt trong dân số chọn mẫu và protocol kích thích có thể dẫn đến sự khác biệt trong kết quả thu được. Tuy vậy, một cơ sở chung là kích thích càng mạnh mẽ thì kết quả thu được có độ đặc hiệu càng thấp.
– Gen: những bệnh nhân suy tim không do thiếu máu cơ tim thường có nguyên nhân là bệnh cơ tim [43], như bệnh cơ tim dãn và bệnh cơ tim do rối loạn nhịp. Hai thể bệnh cơ tim này thường chồng lấp với nhau và thường do các biến đổi về gen mã hóa protein cơ tim [44]. Ghi nhận đặc điểm gen ở những bệnh nhân này có thể giúp ích đáng kể, vì có những đột biến gen nhất định sẽ đặt bệnh nhân bệnh cơ tim vào một nguy cơ cao hơn diễn tiến rối loạn nhịp thất gây tử vong. Đơn cử như đột biến trong gen Lamin A/C (LMNA)[45], [46] và filamin C (FLNC)[47] làm tăng nguy cơ rối loạn nhịp thất nặng. Bên cạnh đó, các đột biến gen ở cầu nối bám (desmosomal) cũng là nguyên nhân các thể rối loạn nhịp nhất định, độc lập với LVEF [48]. Cuối cùng, các đột biến gen đáng kể khác có liên quan với các thể rối loạn nhịp trong bệnh cơ tim dãn/bệnh cơ tim do rối loạn nhịp là các gen như phospholamban (PLN)[49] hoặc protein 20 gắn RNA (RBM20) [50]. Nhận biết được các biến đổi gen đặc hiệu này là vô cùng quan trọng và có thể là một bước tiến mới trên con đường y học cá thể hóa trong suy tim.
– Phân bố giao cảm cơ tim: một yếu tố nguy cơ khác có liên quan chặt chẽ với rối loạn nhịp thất gây tử vong ở bệnh nhân suy tim do thiếu máu cục bộ là tình trạng tăng tính không đồng nhất trong chi phối giao cảm cơ tim. Tình trạng này được ước tính thông qua mức độ giảm chi phối giao cảm trên hình ảnh cơ tim qua chụp PET. Khối lượng cơ tim giảm hoạt tính giao cảm có liên quan với tăng nguy cơ rối loạn nhịp thất và độc lập với các phương pháp khác, như LVEF hay diện tích vùng nhồi máu [51].
II.2. Cơ chế và sinh bệnh học rối loạn nhịp thất

Hình 3. Cơ chế tiền rối loạn nhịp của rối loạn nhịp thất trong suy tim [52]
Cơ chế điện học của ngưng tim được chia thành biến cố liên quan loạn nhịp nhanh và loạn nhịp chậm-vô tâm thu; hoặc rối loạn nhịp sốc điện được và không sốc điện được. Rối loạn nhịp nhanh gồm rung thất và nhanh thất duy trì vô mạch. Rối loạn nhịp chậm-vô tâm thu gồm các trường hợp rối loạn nhịp rất chậm, hoạt động điện vô mạch, và vô tâm thu. Để được xem là cơ chế gây ngưng tim thì rối loạn nhịp rất chậm phải đủ chậm để đưa đến việc tưới máu không hiệu quả và mất tri giác; mà thường là cần tần số tim < 20 lần/phút [1]. Trong trường hợp hoạt động điện vô mạch, tần số sóng có thể nhanh hơn đáng kể, nhưng thường vẫn chậm hơn nhanh thất vô mạch thật sự. Điểm khác biệt quan trọng giữa hoạt động điện vô mạch và nhanh thất vô mạch là nhanh thất vô mạch là rối loạn nhịp có thể sốc điện.
Sự khởi phát của rối loạn nhịp nhanh hoặc nhịp chậm gây tử vong là kết cục của dòng thác rối loạn sinh bệnh học xảy ra từ tương tác phức tạp giữa biến cố mạch vành, tổn thương cơ tim, các thay đổi trong trương lực tự động, và rối loạn chuyển hóa – điện giải của cơ tim. Hiện không có giả thuyết thống nhất nào về cơ chế mà những yếu tố này tương tác với nhau để đưa đến kết cục rối loạn nhịp gây tử vong. Nguy cơ ngưng tim được đặc trưng bởi các bất thường cấu trúc nền tảng và thúc đẩy bởi các rối loạn về chức năng.
Cơ chế rối loạn nhịp thất trong suy tim được tóm tắt trong Hình 3. Sau đây chúng tôi sẽ đề cập cụ thể cơ chế và bằng chứng lâm sàng trong giảm thiểu nguy cơ đột tử do tim cũng như rối loạn nhịp thất của các thuốc điều trị suy tim.
III. ỨC CHẾ HỆ RAA
III.1. ACEi/ARB
Hệ RAA giữ vai trò quan trọng trong sinh bệnh học của HFrEF thông qua quá trình tái cấu trúc cơ tim, xơ hóa mô kẽ, và rối loạn điện giải, từ đó dẫn đến rối loạn nhịp. Hai nhóm thuốc được dùng để ức chế hệ RAA gồm ức chế men chuyển (ACEi) và chẹn thụ thể angiotensin II (ARB). ACEi hoạt động bằng cách ức chế sự chuyển angiotensin I thành angiotensin II; còn ARB thì đối vận chọn lọc thụ thể angiotensin II típ I [53]. Quá trình ức chế này đưa đến nhiều lợi ích quan trọng, bao gồm làm chậm lại tiến trình tái cấu trúc cơ tim, làm dãn mạch, giảm các chất trung gian thần kinh, giảm trương lực giao cảm và nồng độ các cathecholamine, cùng với tác động tích cực trên nồng độ điện giải [54], [55].
Về mặt bằng chứng, chúng ta có những nghiên cứu nền tảng về RAASi trong HFrEF. Nghiên cứu CONSENSUS đánh giá vai trò của enalapril trong HFrEF ghi nhận giảm đáng kể tỉ lệ tử vong dù không ghi nhận khác biệt về đột tử do tim [56]. Các kết quả tương tự cũng được báo cáo trong SOLVD-Prevention [57]. Ở nghiên cứu ELITE, khi so sánh losartan với captopril, losartan làm giảm tỉ lệ tử vong chung mà chủ yếu là nhờ giảm tỉ lệ đột tử do tim [58]. Tuy vậy, đến nghiên cứu ELITE II thì các nhà nghiên cứu lại không ghi nhận khác biệt đáng kể nào về cả tử vong lẫn đột tử do tim [58]. Các nghiên cứu khác như CHARM (nghiên cứu về Candesartan)[59] hay Val-HEFT (nghiên cứu về Valsartan)[60] thì không theo dõi đột tử do tim như là kết cục chính. Ở những bệnh nhân đã mang ICD thì việc dùng ACEi/ARB đã được chứng minh làm giảm số lần sốc điện [61,62]. Một nghiên cứu sổ bộ hồi cứu lớn của Schupp và cộng sự cho thấy việc dùng ACEi/ARB làm giảm tử vong chung ở những bệnh nhân từng có cơn rối loạn nhịp thất được cứu sống. Dù vậy, hiện kết quả từ các phân tích gộp còn chưa nhất quán trong hiệu quả của ACEi/ARB trong giảm tỉ lệ đột tử do tim và rối loạn nhịp thất, dù lợi ích về tử vong chung và tái nhập viện là rõ rệt [63-65]. Một ngoại lệ là trong trường hợp suy tim sau nhồi máu cơ tim thì ACEi được chứng minh giảm 20% tỉ lệ đột tử do tim [66].
III.2. ARNI
ARNi cấu thành từ 2 phần: Valsartan – một loại chẹn thụ thể angiotensin, và Sacubitril – một loại ức chế Neprilysin [67]. Cơ chế phân tử đưa đến đặc tính chống loạn nhịp của ARNi còn chưa được biết rõ hoàn toàn. Xét về cơ chế điện sinh lý, ARNi ảnh hưởng lên điện thế của các ion trong cơ tim. Chang và cộng sự[68] quan sát thấy ARNi có khả năng tăng biểu hiện kênh Kali trên bề mặt, bao gồm kênh KCNH2, KCNE1 và KCNE2. Kết quả dẫn đến rút ngắn thời gian điện thế hoạt động, từ đó có thể cải thiện xu hướng rối loạn nhịp thất, đặc biệt trong bối cảnh suy tim sau nhồi máu cơ tim. Bên cạnh đó, ARNi cũng có tác động tích cực trên điều hòa ion calci qua việc giảm biểu hiện CaMKII và hạn chế thất thoát calci tâm trương do rối loạn kênh RyR2 [69], [70]. Hơn nữa, việc ức chế neprilysin của ARNi làm tăng nồng độ peptide lợi niệu natri trong máu, từ đó có nhiều tác động bảo vệ trên tim hơn nữa bên cạnh ảnh hưởng trên hệ RAA và hệ thần kinh giao cảm [71]. Peptide lợi niệu natri làm tăng nồng độ cGMP nội bài và protein kinase G. Dòng thác này dẫn đến giãn mạch, lợi niệu, ức chế hệ RAA và hệ giao cảm [71]. Peptide lợi niệu natri còn có tính kháng viêm, kháng apoptosis, chống phì đại và chống xơ hóa cơ tim [72], [73], [74]. ARNi cũng được chứng minh làm giảm đáng kể các dấu ấn sinh học liên quan với tiến trình tiền xơ hóa [75].
Nhiều nghiên cứu đã công bố các kết quả củng cố tác động có lợi của ARNi trên rối loạn nhịp thất và đặt ICD [76], [77]. Phân tích dưới nhóm của nghiên cứu PARADIGM-HF, là nghiên cứu nền tảng của ARNi trong suy tim EF giảm, đã cho thấy giảm đáng kể tỉ lệ rối loạn nhịp thất và nguy cơ của SCD [78], [79]. Liu và cộng sự[80] cũng ghi nhận trong một phân tích gộp rằng mặc dù ARNi không có tác động trên tần số của rối loạn nhịp thất thì ARNi có làm giảm đáng kể nguy cơ SCD ở những bệnh nhân suy tim. Một phân tích gộp khác của Pozzi và cộng sự[81] cho thấy ARNi khi so với ACEi/ARB thì ARNi làm giảm đáng kể gánh nặng rối loạn nhịp thất và sốc điện của ICD. Fernandes và cộng sự[82] cũng báo cáo kết quả giảm đáng kể SCD, rối loạn nhịp thất và tỉ lệ ICD phù hợp khi dùng ARNi (bảng 2).
Bảng 2. Các nghiên cứu và phân tích gộp lớn về tác động của ARNi trên rối loạn nhịp thất và đột tử do tim
| Tác giả
(Năm) |
Thiết kế
nghiên cứu |
Số
bệnh nhân |
Kết cục |
| Martens và cộng sự (2019) [76] | Đoàn hệ, hồi cứu, trước vs. sau khởi động ARNi | 151 bệnh nhân HFrEF có ICD | Giảm rối loạn nhịp thất (51 vs. 14, p < 0,001)
Giảm sốc trên ICD (16 vs. 6; p < 0,001) |
| De Diego và cộng sự (2018) [77] | Đoàn hệ, tiến cứu: ARNi vs. ACEi/ARB | 240 bệnh nhân HFrEF có ICD | Giảm rối loạn nhịp thất và sốc trên ICD (0,8% vs. 6,7%; p < 0,02) |
| Russo và cộng sự (2020) [83] | Đoàn hệ, tiến cứu: ARNi | 167 bệnh nhân HFrEF có ICD | Giảm rối loạn nhịp thất (15 vs. 4; p = 0,03)
Giảm sốc trên ICD (13 vs. 3; p = 0,02) |
| Rohde và cộng sự (2020) [78] | Phân tích sau RCT: ARNi vs. ACEi | 8.399 HFrEF | Giảm SCD ở nhớm ICD (HR 0,49; 95% CI 0,25 – 0,99) và nhóm không ICD (HR 0,81; 95% CI 0,67 – 0,98) |
| Curtain và cộng sự (2022)[79] | Phân tích sau RCT: ARNi vs. ACEi | 8.399 HFrEF | Giảm rối loạn nhịp thất (HR 0,76; 95% CI 0,62 – 0,95) |
| Fernandes và cộng sự (2021) [82] | Phân tích gộp: ARNi vs. ACEi/ARB | 11.204 HFrEF | Giảm SCD (OR 0,78; 95% CI 0,63 – 0,96)
Giảm rối loạn nhịp thất (OR 0,45; 95% CI 0,25 – 0,79)
|
| Liu và cộng sự (2022)[80] | Phân tích gộp: ARNi vs. ACEi/ARB/giả dược | 18.500 HFrEF hoặc HFpEF | Không giảm rối loạn nhịp thất (RR 0,86; 95% CI 0,68 – 1,10)
Giảm SCD (RR 0,79; 95% CI 0,70 – 0,90) |
| Mujadzic và cộng sự (2022)[84] | Phân tích gộp: ARNi vs. ACEi/ARB/giả dược | 18.548 HFrEF hoặc HFpEF | Giảm rối loạn nhịp thất & SCD (OR 0,71; 95% CI 0,54 – 0,93)
Giảm sốc trên ICD (OR 0,23; 95% CI 0,11 – 0,47) |
| Pozzi và cộng sự (2023) [81] | Phân tích gộp: ARNi vs. ACEi/ARB | 8.837 HFrEF | Giảm rối loạn nhịp thất (OR 0,78; 95% CI 0,63 – 0,96 với RCT; và RR 0,62; 95% CI 0,53 – 0,72 cho nghiên cứu quan sát
Giảm sốc trên ICD (RR 0,24; 95% CI 0,12 – 0,24) |
HFrEF: heart failure with reduced ejection fraction – suy tim EF giảm; HFpEF: heart failure with preserved ejection fraction – suy tim EF bảo tồn; SCD: sudden cardiac death – đột tử do tim
Nói chung, ARNi dường như có tác động có lợi qua nhiều cơ chế, bao gồm giãn mạch, giảm tác động hệ giao cảm, giảm căng thành thất và xơ hóa, và tác động điều hòa trên các kênh ion như kênh Kali, RyR2, và con đường CaMKII. Các phân tích gộp đã khẳng định hiệu quả của ARNi trong giảm thiểu nguy cơ rối loạn nhịp thất và SCA, tuy cơ chế phân tử chính xác thì còn cần các nghiên cứu sâu hơn nữa.
IV. MRA
MRA là một cách tiếp cận làm hạn chế ảnh hưởng của hệ RAA hơn nữa bằng cách nhắm đến thụ thể aldosterone [85]. Nhóm thuốc này đạt được nhiều lợi ích về tim mạch, bao gồm ngăn ngừa tái cấu trúc điện học của mô cơ tim [86], [87], hạn chế xơ hóa cơ tim và tái cấu trúc thất [88], giảm hoạt tính giao cảm [89], và kết quả có lợi trên chức năng nội mạc mạch máu [90]. Thông qua những cơ chế này, MRA đã được chứng minh là ngăn ngừa SCD.
Nghiên cứu RALES[91], đánh giá việc dùng Spironolactone ở bệnh nhân HFrEF, cho kết quả giảm đáng kể cả tử vong chung và tử vong do tim. Nghiên cứu này cũng cho kết quả giảm 29% nguy cơ SCD. Tương tự như vậy, nghiên cứu EPHESUS [92]khi đánh giá Eplerenone cũng cho kết quả giảm đáng kể tử vong do mọi nguyên nhân, tử vong liên qua tim mạch, và nguy cơ tử vong hoặc tái nhập viện do tim mạch. Đồng thời, nghiên cứu cũng cho thấy MRA giảm đáng kể tỉ lệ SCD [92]. Nhiều phân tích gộp đã cho kết quả tương đồng: MRA làm giảm SCD, do vậy càng nhấn mạnh vai trò của thuốc trong quản lý bệnh nhân HFrEF [93], [94].
V. CHẸN BETA
Các thụ thể beta giao cảm được biểu hiện trên các tế bào cơ tim. Hoạt hóa hệ giao cảm qua việc gắn noradranaline và epinephrine vào các thụ thể này sẽ khởi phát dòng thác phản ứng nội bào bao gồm con đường tín hiệu cAMP/PKA [95]. Con đường tín hiệu này sẽ ảnh hưởng nhiều vị trí tác động khác nhau, bao gồm RyR2, kênh calci type L, phospholamban và những vị trí khác [96], [95]. Kết quả chung của các tín hiệu này là tăng hoạt các chức năng tim: tăng tần số tim (chronotropy), tăng tốc độ dẫn truyền (dromotropy), tăng sức co bóp (inotropy) và cải thiện tốc độ thư giãn (lusitropy) [97]. Tất cả tác động của hệ giao cảm này sẽ tạo điều kiện cho các hoạt động điện lạc chỗ, bao gồm hậu khử cực sớm và hậu khử cực muộn, cũng như các hoạt tính vòng vào lại do rút ngắn thời gian dẫn truyền hoạt dộng, giảm khoảng trơ tuyệt đối, và biến đổi trong dẫn truyền [97]. Như vậy, kích thích hệ beta giao cảm quá mức sẽ có liên quan với rối loạn nhịp.
Chúng ta đều biết có 3 phân nhóm thụ thể beta, với thụ thể beta 1 hiện diện chủ yếu ở mô cơ tim. Các nhóm thuốc chẹn beta do vậy cũng được phân thành nhiều nhóm dựa trên vị trí tác dụng: chẹn thụ thể beta không chọn lọc (ví dụ nadolol, propranolol), chẹn thụ thể beta chọn lọc beta 1 (ví dụ acebutolol, atenolol, esmolol, metoprolol), và chẹn thụ thể beta có kèm các tác dụng khác như giãn mạch, kháng viêm và chống oxy hóa (ví dụ carvedilol, labetalol, nebivolol) [98]. Thuốc chẹn beta làm giảm trương lực giao cảm và các tác động của hệ giao cảm [98]. Nhóm thuốc này cũng làm giảm tự động tính qua việc kéo dài chu chuyển nút xoang và làm giảm vận tốc dẫn truyền nhĩ thất thông qua cơ chế làm giảm calci đi vào tế bào qua các kênh phụ thuộc catecholamine [97]. Bên cạnh đó, thuốc chẹn beta còn có tác dụng chống xơ hóa, cải thiện chức năng thất trái, giảm đường kính thất trái, và làm giảm khối cơ thất trái. Tất cả các lợi ích này đều có ý nghĩa trong việc giảm SCD trong suy tim [97].
Nhiều nghiên cứu đã cho thấy lợi ích của thuốc chẹn beta trong phòng ngừa rối loạn nhịp và SCD trong bối cảnh của suy tim. Nghiên cứu CIBIS II đánh giá hiệu quả của bisoprolol trong HFrEF và cho kết quả lợi ích vượt trội trong cải thiện tử vong, với giảm 42% SCD so với nhóm chứng [99]. Metoprolol trong HFrEF cũng cho lợi ích tương tự trong phòng ngừa SCD qua nghiên cứu MERIT-HF [100]. Nghiên cứu SENIORS đánh giá nebivolol trên dân số HFrEF lớn tuổi, ghi nhận tỉ lệ SCD thấp hơn đáng kể ở nhóm nebivolol [101]. Nghiên cứu COPERNICUS năm 2001 cũng cho thấy carvedilol làm giảm tỉ lệ tử vong, mặc dù không báo cáo cụ thể kết quả về SCD [102]. Bên cạnh các nghiên cứu nền tảng này, đã có nhiều thử nghiệm khác cho kết quả giảm đáng kể tỉ lệ sốc do máy ở bệnh nhân đặt ICD có kèm điều trị với chẹn beta so với nhóm không dùng chẹn beta [103]. Những phân tích gộp cũng ghi nhận lợi ích của chẹn beta trên cả tỉ lệ tử vong và SCD, mà không có khác biệt đáng kể giữa các loại chẹn beta khác nhau [104], [105], [105]. Tuy vậy, gần đây, đã có bằng chứng cho thấy lợi ích vượt trội của chẹn beta không chọn lọc trên kết cục chống rối loạn nhịp. Cụ thể là propranolol được ghi nhận là vượt trội hơn metoprolol trong quản lý bão điện học ở những bệnh nhân đã đặt ICD [106]. Carvedilol cũng được chứng minh làm giảm nguy cơ rối loạn nhịp thất khi so sánh với metoprolol [107]. Những kết quả này cần được kiểm định thêm với các dân số lớn hơn.
Tóm lại, thuốc chẹn beta làm giảm đáng kể nguy cơ rối loạn nhịp thông qua việc ức chế các yếu tố kích gợi dựa trên hoạt tính giao cảm, làm giảm các tiền chất gây vòng vào lại, và làm chậm tần số của nút xoang và nút nhĩ thất. Bằng chứng ủng hộ sử dụng thuốc chẹn beta trong HFrEF là rõ rệt và nhấn mạnh vai trò tiên quyết của thuốc trong làm giảm rối loạn nhịp và SCD trên nhóm bệnh nhân này.
VI. ỨC CHẾ SGLT2 (SGLT2i)
SGLT2i hoạt động chủ yếu dựa trên ức chế chọn lọc thụ thể SGLT2 ở ống lượn gần tại thận, và lợi ích của thuốc trải dài từ chuyển hóa đến tim mạch, bao gồm cả làm giảm tử vong tim mạch ở bệnh nhân HFrEF[108].
Cơ chế chống rối loạn nhịp của SGLT2i còn chưa được biết rõ, nhưng hiện tại đã có một giả thuyết giải thích cho cơ chế này. SGLT2i đã được ghi nhận hoạt tính kháng viêm và chống oxy hóa [109], [110], thông qua kích hoạt protein kinase dựa trên AMP [111], [112], ức chế các inflammasome NLRP3 [113], và giảm các biểu hiện các yếu tố gây viêm. Chính tác động kháng viêm và chống oxy hóa này có thể dẫn tới hoạt tính chống xơ hóa và chống tái cấu trúc cơ tim, từ đó làm giảm cơ chất rối loạn nhịp. Các dữ kiện đã cho thấy sau khi sử dụng SGLT2i, bệnh nhân giảm được khối lượng cơ thất trái, và cải thiện chức năng thất trái [114], [115], [116]. Những thay đổi có lợi này cũng được ghi nhận bên thất phải [117]. Một cơ chế chống rối loạn nhịp khác của SGLT2i là thông qua điều hòa các kênh ion thông qua duy trì ổn định nội mô của nồng độ Ca2+ và Na+ nội bào. Suy tim đặc trưng bởi quá tải Na+ nội bào, thường do tăng biểu hiện kênh Na+/H+ exchanger 1 (NHE1), góp phần gây quá tải Ca2+ trong tế bào chất, từ đó làm tăng rối loạn nhịp [118], [119]. SGLT2i có thể làm giảm nguy cơ này bằng cách làm giảm trực tiếp quá tải Na+ thông qua ức chế kênh natri muộn (INaL) và NHE1 [120]. Hơn nữa, nhóm thuốc này có thể điều hòa gián tiếp hoạt động của CaMKII, từ đó làm giảm thất thoát calci từ lưới nội bào và giới hạn các yếu tố kích gợi rối loạn nhịp như hậu khử cực muộn [121]. SGLT2i cũng được chứng minh là làm bình thường hóa khoảng QT và độ phân tán khoảng QT, do vậy có tiềm năng làm giảm nguy cơ rối loạn nhịp [122], [123]. Các mô hình thử nghiệm đã cho thấy SGLT2i làm giảm được tính dễ bị rối loạn nhịp thất sau thiếu máu cơ tim [124].
Các nghiên cứu lâm sàng, như DAPA-HF[125] và EMPEROR-Reduced [126], lần lượt là nghiên cứu nền tảng của dapagliflozin và empagliflozin ở bệnh nhân HFrEF với kết quả cải thiện rõ rệt tử vong do tim mạch. Các phân tích hậu nghiệm cũng có thấy dapagliflozin làm giảm nguy cơ rối loạn nhịp thất, ngưng tim và SCD [127]. Dù vậy, dữ liệu từ các phân tích gộp còn chưa được thống nhất trong đánh giá hiệu quả giảm SCD hoặc rối loạn nhịp thất của SGLT2i . Cũng cần nhấn mạnh rằng trong số này có nhiều phân tích gộp lấy kết quả từ các nghiên cứu SGLT2i trên nhóm bệnh nhân đái tháo đường thay vì chỉ thu nhận bệnh nhân suy tim. Gần đây hơn, một phân tích gộp của Oates và cộng sự[128] tập trung chủ yếu trên bệnh nhân suy tim đã cho thấy SGLT2i làm giảm nguy cơ SCD ở những bệnh nhân suy tim đang được điều trị bằng thuốc. Nghiên cứu EMPA-ICD đang được tiến hành, đánh giá hiệu quả của SGLT2i trên rối loạn nhịp thất ở bệnh nhân đái tháo đường típ 2 có mang ICD, được kì vọng sẽ cho cái nhìn rõ ràng hơn về hiệu quả chống loạn nhịp của SGLT2i [129]. Các nghiên cứu và phân tích gộp chính về tác động của SGLT2i trên rối loạn nhịp thất và SCD được tổng hợp trong Bảng 3.
Bảng 3.Các nghiên cứu và phân tích gộp chính về tác dụng của SGLT2i trên rối loạn nhịp thất và đột tử do tim
| Tác giả (Năm) | Thiết kế nghiên cứu | Số bệnh nhân | Kết cục |
| Curtain và cộng sự (2021) [127] | RCT – phân tích hậu nghiệm
Dapagliflozin vs. Giả dược |
4.744 bệnh nhân HFrEF | Giảm kết cục gộp gồm rối loạn nhịp thất và SCD (HR 0,79; 95% CI: 0,63 – 0,99) |
| Fernandes và cộng sự (2021)[130] | Phân tích gộp
SGLT2i vs. Giả dược |
63.166 bệnh nhân ĐTĐ2 hoặc suy tim | Giảm SCD (HR 0,72; 95% CI: 0,54 – 0,97)
Không khác biệt về rối loạn nhịp thất |
| Li và cộng sự (2021) [131] | Phân tích gộp
SGLT2i vs. Giả dược |
52.115 bệnh nhân ĐTĐ2 hoặc bệnh thận mạn hoặc suy tim | Giảm rối loạn nhịp thất (RR 0,73; 95% CI: 0,53 – 0,99) |
| Sfairopoulos và cộng sự (2022)[132] | Phân tích gộp
SGLT2i vs. Giả dược |
55.590 bệnh nhân ĐTĐ2 hoặc bệnh thận mạn hoặc suy tim | Không giảm rối loạn nhịp thất (RR 0,84; 95% CI: 0,66 – 1,06)
Không giảm SCD (RR 0,74; 95% CI: 0,50 – 1,08) |
| Yin và cộng sự (2022) [133] | Phân tích gộp
SGLT2i vs. Giả dược |
10.344 HFrEF hoặc HFpEF | Không giảm rối loạn nhịp thất (VT: RR 0,90; 95% CI: 0,44 – 1,82. VF: RR 1,40; 95% CI: 0,73 – 2,67) |
| Oates và cộng sự (2023) [128] | Phân tích gộp
SGLT2i vs. Giả dược |
10.796 HFrEF hoặc HFpEF | Giảm SCD (RR 0,68; 95% CI: 0,48 – 0,95)
Không giảm rối loạn nhịp thất (RR 1,03; 95% CI: 0,83 – 1,29) |
Tóm lại, SGLT2i có tác dụng chống loạn nhịp thông qua nhiều cơ chế, trong đó có hồi phục ổn định nội mô của calci và natri, đảo ngược tiến trình tái cấu trúc cơ tim, cũng như tác động kháng viêm và chống oxy hóa. Mặc dù các dữ kiện hiện tại cho thấy xu hướng bằng chứng ủng hộ tác dụng giảm SCD và rối loạn nhịp thất của SGLT2i thì chúng ta cũng cần các nghiên cứu tiến cứu được thiết kế mạnh hơn để có những kết quả kiểm định các kết quả này một cách chắc chắn hơn.
VII. CÁC THUỐC KHÁC
Vericiguat và omecamtiv mecarbil là các loại thuốc mới trong quản lý HFrEF. Vericiguat là một chất kích hoạt soluble guanylate cyclase (sGC). Thông qua cơ chế điều hòa con đường sGC guanosine monophosphate, vericiguat sẽ làm giãn mạch, từ đó mang lại lợi ích trên hậu tải và sự phì đại cơ thất trái [134], [135]. Nghiên cứu VICTORIA ghi nhận vericiguat làm giảm đáng kể kết cục chính gồm tử vong do tim mạch hoặc nhập viện vì suy tim. Tuy vậy, dữ liệu cụ thể về SCD không được báo cáo [136]. Trong các thử nghiệm tiền lâm sàng trên chuột, vericiguat cho thấy tiềm năng chống loạn nhịp thông qua cải thiện tái cấu trúc cơ thất trái cũng như điện thế tế bào, chủ yếu qua ức chế CaMKII [137]. Chúng ta cần thêm các nghiên cứu lâm sàng khác để kiểm định các kết quả chống loạn nhịp này.
Omecamtiv mecarbil thông qua nghiên cứu GALACTIC-HF (2020) đã cho kết quả làm giảm khiêm tốn nhưng đáng kể kết cục chính gồm nhập viện vì suy tim hoặc tử vong do nguyên nhân tim mạch [138]. Tỉ lệ rối loạn nhịp thất trong dân số omecamtiv mecarbil là tương tự nhóm chứng. Với các kết quả này, khả năng chống loạn nhịp của omecamtiv mecarbil là còn chưa được rõ ràng.
Một nhóm thuốc khác cần được nhắc đến là đồng vận thụ thể GLP1 (GLP1 RA), là một nhóm thuốc được giới thiệu lần đầu trong điều trị ĐTĐ2, cũng có một số tác dụng tích cực trên chuyển hóa [139]. Những nghiên cứu chính của GLP1-RA trong ĐTĐ2 đã cho thấy kết quả giảm đáng kể biến cố tim mạch chính[140], [141], [142]. Nếu xét về dân số HFrEF, có 2 nghiên cứu cần nhắc đến. Nghiên cứu FIGHT, đánh giá liraglutide trong HFrEF, không cho thấy lợi ích đáng kể nào, bao gồm cả LVEF [143]. Một phân tích hậu nghiệm cho thấy tăng nguy cơ rối loạn nhịp và biến cố suy tim [144]. Nghiên cứu thứ hai là LIVE, cho kết quả liraglutide làm tăng tần số tim và các biến cố tim mạch nghiêm trọng, bao gồm cả rối loạn nhịp thất [145]. Các kết quả này làm dấy lên lo ngại về nguy cơ của rối loạn nhịp thất và SCD khi sử dụng liraglutide ở bệnh nhân HFrEF. Tuy vậy, một số phân tích gộp trong dân số ĐTĐ2 không ghi nhận tăng nguy cơ rối loạn nhịp thất hay SCD khi sử dụng GLP1-RA [146], [147]. Do đó, tác động chung của GLP1-RA trên rối loạn nhịp thất và SCD ở dân số HFrEF là còn chưa rõ ràng, cũng như tác dụng chung trong điều trị HFrEF.
Tóm lại, tất cả những loại thuốc mới này là các hướng tiếp cận dùng thuốc mới trong điều trị suy tim, mặc dù dữ liệu về tác dụng chống loạn nhịp còn hạn chế và chưa thống nhất. Các kết quả của những nghiên cứu ban đầu này nhấn mạnh sự cần thiết của các nghiên cứu sâu hơn, đặc biệt là về khả năng chống loạn nhịp và tác dụng của thuốc trên SCD và rối loạn nhịp thất.
VIII. KẾT LUẬN
SCD là một thành tố chính của tử vong ở bệnh nhân HFrEF, với nguyên nhân chính là rối loạn nhịp thất ác tính. Tối ưu hóa điều trị suy tim theo khuyến cáo là một chiến lược hiệu quả để giảm thiểu tần số SCD trong dân số bệnh nhân suy tim. Các nhóm thuốc chủ yếu tác động trên hệ RAA và hệ thần kinh giao cảm, từ đó cải thiện tái cấu trúc và điện học của cơ tim.
Dù có các tác động tốt trên hệ RAA thì ACEi và ARB chưa có kết quả đồng nhất trong giảm SCD hay rối loạn nhịp thất. Các bằng chứng rõ rệt đến hiện tại ủng hộ việc dùng thuốc chẹn beta, ARNi và MRA trong giảm nguy cơ SCD. SGLT2i đã có các bằng chứng ban đầu đầy hứa hẹn, và do vậy cần các nghiên cứu tiến cứu thiết kế tốt để xác nhận tác động chống loạn nhịp của nhóm thuốc này.
Bức tranh can thiệp dùng thuốc trong HFrEF ngày càng được mở rộng với nhiều loại thuốc mới được nghiên cứu. Các thử nghiệm với kết cục chính là tác động trên SCD và rối loạn nhịp thất của các nhóm thuốc mới là hướng đi hiển nhiên để quản lý HFrEF chặt chẽ hơn nữa.
TÀI LIỆU THAM KHẢO
- Goldberger Jeffrey J. ACM, Robert J. Myerburg. Cardiac Arrest and Sudden Cardiac Death Braunwald’s Heart Disease: A Textbook of Cardiovascular Medicine. 12: Elsevier; 2022. p. 1349-86.
- Kannel WB, Plehn JF, Cupples LA. Cardiac failure and sudden death in the Framingham Study. American heart journal. 1988;115(4):869-75.
- Berg KM, Cheng A, Panchal AR, Topjian AA, Aziz K, Bhanji F, et al. Part 7: systems of care: 2020 American Heart Association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation. 2020;142(16_Suppl_2):S580-S604.
- Kolte D, Khera S, Aronow WS, Palaniswamy C, Mujib M, Ahn C, et al. Regional variation in the incidence and outcomes of in-hospital cardiac arrest in the United States. Circulation. 2015;131(16):1415-25.
- Myerburg RJ. Cardiac arrest and sudden cardiac death. Heart disease: a textbook of cardiovascular medicine. 1997:742-56.
- Zipes DP, Wellens HJ. Sudden cardiac death. Circulation. 1998;98(21):2334-51.
- Deo R, Albert CM. Epidemiology and genetics of sudden cardiac death. Circulation. 2012;125(4):620-37.
- Shen L, Jhund PS, McMurray JJV. Declining Risk of Sudden Death in Heart Failure. N Engl J Med. 2017;377(18):1794-5. PubMed PMID: 29091558.
- McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-726. PubMed PMID: 34447992.
- Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022;145(18):e895-e1032. Epub 20220401. PubMed PMID: 35363499.
- Behnoush AH, Khalaji A, Naderi N, Ashraf H, von Haehling S. ACC/AHA/HFSA 2022 and ESC 2021 guidelines on heart failure comparison. ESC Heart Failure. 2023;10(3):1531-44.
- Myerburg RJ, Goldberger JJ. Sudden cardiac arrest risk assessment: population science and the individual risk mandate. JAMA cardiology. 2017;2(6):689-94.
- Bakris GL, Sorrentino M. Hypertension: A companion to braunwald’s heart disease: Elsevier Health Sciences; 2017.
- Djoussé L, Gaziano JM. Alcohol consumption and risk of heart failure in the Physicians’ Health Study I. Circulation. 2007;115(1):34-9.
- Gaziano JM, Gaziano TA, Glynn RJ, Sesso HD, Ajani UA, Stampfer MJ, et al. Light-to-moderate alcohol consumption and mortality in the Physicians’ Health Study enrollment cohort. Journal of the American College of Cardiology. 2000;35(1):96-105.
- Whitman IR, Agarwal V, Nah G, Dukes JW, Vittinghoff E, Dewland TA, Marcus GM. Alcohol abuse and cardiac disease. Journal of the American College of Cardiology. 2017;69(1):13-24.
- Franklin BA, Thompson PD, Al-Zaiti SS, Albert CM, Hivert M-F, Levine BD, et al. Exercise-related acute cardiovascular events and potential deleterious adaptations following long-term exercise training: placing the risks into perspective–an update: a scientific statement from the American Heart Association. Circulation. 2020;141(13):e705-e36.
- Talbott E, Kuller LH, Detre K, Perper J. Biologic and psychosocial risk factors of sudden death from coronary disease in white women. Am J Cardiol. 1977;39(6):858-64. PubMed PMID: 871112.
- Talbott E, Kuller LH, Perper J, Murphy PA. Sudden unexpected death in women: biologic and psychosocial origins. Am J Epidemiol. 1981;114(5):671-82. PubMed PMID: 7304596.
- Chatterjee NA, Moorthy MV, Pester J, Schaecter A, Panicker GK, Narula D, et al. Sudden death in patients with coronary heart disease without severe systolic dysfunction. JAMA cardiology. 2018;3(7):591-600.
- Disertori M, Rigoni M, Pace N, Casolo G, Masè M, Gonzini L, et al. Myocardial fibrosis assessment by LGE is a powerful predictor of ventricular tachyarrhythmias in ischemic and nonischemic LV dysfunction: a meta-analysis. JACC: Cardiovascular Imaging. 2016;9(9):1046-55.
- Ganesan AN, Gunton J, Nucifora G, McGavigan AD, Selvanayagam JB. Impact of late gadolinium enhancement on mortality, sudden death and major adverse cardiovascular events in ischemic and nonischemic cardiomyopathy: a systematic review and meta-analysis. International journal of cardiology. 2018;254:230-7.
- Councils E. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. European Heart Journal. 2015;36:2793-867.
- Packer M. Nonarrhythmic sudden cardiac death in chronic heart failure—a preventable event? JAMA cardiology. 2019;4(8):721-2.
- Chen C-Y, Stevenson LW, Stewart GC, Bhatt DL, Desai M, Seeger JD, et al. Real world effectiveness of primary implantable cardioverter defibrillators implanted during hospital admissions for exacerbation of heart failure or other acute co-morbidities: cohort study of older patients with heart failure. bmj. 2015;351.
- Sabbag A, Suleiman M, Laish-Farkash A, Samania N, Kazatsker M, Goldenberg I, et al. Contemporary rates of appropriate shock therapy in patients who receive implantable device therapy in a real-world setting: From the Israeli ICD Registry. Heart rhythm. 2015;12(12):2426-33.
- Moss AJ, Hall WJ, Cannom DS, Daubert JP, Higgins SL, Klein H, et al. Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. New England Journal of Medicine. 1996;335(26):1933-40.
- Moss AJ, Zareba W, Hall WJ, Klein H, Wilber DJ, Cannom DS, et al. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. New England Journal of Medicine. 2002;346(12):877-83.
- Bardy GH, Lee KL, Mark DB, Poole JE, Packer DL, Boineau R, et al. Amiodarone or an implantable cardioverter–defibrillator for congestive heart failure. New England Journal of Medicine. 2005;352(3):225-37.
- Levine YC, Rosenberg MA, Mittleman M, Samuel M, Methachittiphan N, Link M, et al. B-type natriuretic peptide is a major predictor of ventricular tachyarrhythmias. Heart rhythm. 2014;11(7):1109-16.
- Adabag S, Langsetmo L. Sudden cardiac death risk prediction in heart failure with preserved ejection fraction. Heart Rhythm. 2020;17(3):358-64.
- Nakamura H, Niwano S, Fukaya H, Murakami M, Kishihara J, Satoh A, et al. Cardiac troponin T as a predictor of cardiac death in patients with left ventricular dysfunction. Journal of arrhythmia. 2017;33(5):463-8.
- Silverman MG, Yeri A, Moorthy MV, Camacho Garcia F, Chatterjee NA, Glinge CS, et al. Circulating miRNAs and risk of sudden death in patients with coronary heart disease. Clinical Electrophysiology. 2020;6(1):70-9.
- Stolfo D, Ceschia N, Zecchin M, De Luca A, Gobbo M, Barbati G, et al. Arrhythmic risk stratification in patients with idiopathic dilated cardiomyopathy. The American Journal of Cardiology. 2018;121(12):1601-9.
- Haugaa KH, Goebel B, Dahlslett T, Meyer K, Jung C, Lauten A, et al. Risk assessment of ventricular arrhythmias in patients with nonischemic dilated cardiomyopathy by strain echocardiography. Journal of the American Society of Echocardiography. 2012;25(6):667-73.
- Guaricci AI, Masci PG, Muscogiuri G, Guglielmo M, Baggiano A, Fusini L, et al. Cardiac magnetic resonance for prophylactic implantable-cardioverter defibrillator therapy in non-ischaemic dilated cardiomyopathy: an international registry. EP Europace. 2021;23(7):1072-83.
- Goldenberg I, Huang DT, Nielsen JC. The role of implantable cardioverter-defibrillators and sudden cardiac death prevention: indications, device selection, and outcome. European heart journal. 2020;41(21):2003-11.
- Huikuri HV, Raatikainen MP, Moerch-Joergensen R, Hartikainen J, Virtanen V, Boland J, et al. Prediction of fatal or near-fatal cardiac arrhythmia events in patients with depressed left ventricular function after an acute myocardial infarction. European heart journal. 2009;30(6):689-98.
- Kitamura H, Ohnishi Y, Okajima K, Ishida A, Galeano E, Adachi K, Yokoyama M. Onset heart rate of microvolt-level T-wave alternans provides clinical and prognostic value in nonischemic dilated cardiomyopathy. Journal of the American College of Cardiology. 2002;39(2):295-300.
- Hombach V, Merkle N, Torzewski J, Kraus JM, Kunze M, Zimmermann O, et al. Electrocardiographic and cardiac magnetic resonance imaging parameters as predictors of a worse outcome in patients with idiopathic dilated cardiomyopathy. European heart journal. 2009;30(16):2011-8.
- Bourke JP, Richards DA, Ross DL, McGuire MA, Uther JB. Does the induction of ventricular flutter or fibrillation at electrophysiologic testing after myocardial infarction have any prognostic significance? The American journal of cardiology. 1995;75(7):431-5.
- Daubert JP, Zareba W, Hall WJ, Schuger C, Corsello A, Leon AR, et al. Predictive value of ventricular arrhythmia inducibility for subsequent ventricular tachycardia or ventricular fibrillation in Multicenter Automatic Defibrillator Implantation Trial (MADIT) II patients. Journal of the American College of Cardiology. 2006;47(1):98-107.
- Ziaeian B, Fonarow GC. Epidemiology and aetiology of heart failure. Nature Reviews Cardiology. 2016;13(6):368-78.
- McNally Elizabeth M, Mestroni L. Dilated Cardiomyopathy. Circ Res. 2017;121:731-48.
- van Rijsingen IA, Arbustini E, Elliott PM, Mogensen J, Hermans-van Ast JF, van der Kooi AJ, et al. Risk factors for malignant ventricular arrhythmias in lamin A/C mutation carriers: a European cohort study. Journal of the American College of Cardiology. 2012;59(5):493-500.
- Van Berlo JH, De Voogt WG, Van Der Kooi AJ, Van Tintelen JP, Bonne G, Yaou RB, et al. Meta-analysis of clinical characteristics of 299 carriers of LMNA gene mutations: do lamin A/C mutations portend a high risk of sudden death? Journal of molecular medicine. 2005;83:79-83.
- Ortiz-Genga MF, Cuenca S, Dal Ferro M, Zorio E, Salgado-Aranda R, Climent V, et al. Truncating FLNC mutations are associated with high-risk dilated and arrhythmogenic cardiomyopathies. Journal of the American College of Cardiology. 2016;68(22):2440-51.
- Gigli M, Merlo M, Graw SL, Barbati G, Rowland TJ, Slavov DB, et al. Genetic risk of arrhythmic phenotypes in patients with dilated cardiomyopathy. Journal of the American College of Cardiology. 2019;74(11):1480-90.
- Van Der Zwaag PA, Van Rijsingen IA, Asimaki A, Jongbloed JD, Van Veldhuisen DJ, Wiesfeld AC, et al. Phospholamban R14del mutation in patients diagnosed with dilated cardiomyopathy or arrhythmogenic right ventricular cardiomyopathy: evidence supporting the concept of arrhythmogenic cardiomyopathy. European journal of heart failure. 2012;14(11):1199-207.
- van den Hoogenhof MM, Beqqali A, Amin AS, van der Made I, Aufiero S, Khan MA, et al. RBM20 mutations induce an arrhythmogenic dilated cardiomyopathy related to disturbed calcium handling. Circulation. 2018;138(13):1330-42.
- Fallavollita JA, Heavey BM, Luisi AJ, Michalek SM, Baldwa S, Mashtare TL, et al. Regional myocardial sympathetic denervation predicts the risk of sudden cardiac arrest in ischemic cardiomyopathy. Journal of the American College of Cardiology. 2014;63(2):141-9.
- Coats A, Filippatos G, Bauersachs J, Rosano G. The ESC Textbook of Heart Failure. Seferovic P, editor: Oxford University Press; 2023 01 Dec 2023.
- Goodfriend TL, Elliott ME, Catt KJ. Angiotensin receptors and their antagonists. N Engl J Med. 1996;334(25):1649-54. PubMed PMID: 8628362.
- Schrier RW, Abraham WT. Hormones and Hemodynamics in Heart Failure. New England Journal of Medicine. 1999;341(8):577-85.
- Makkar KM, Sanoski CA, Spinler SA. Role of angiotensin-converting enzyme inhibitors, angiotensin II receptor blockers, and aldosterone antagonists in the prevention of atrial and ventricular arrhythmias. Pharmacotherapy. 2009;29(1):31-48. PubMed PMID: 19113795.
- Group* CTS. Effects of enalapril on mortality in severe congestive heart failure. New England Journal of Medicine. 1987;316(23):1429-35.
- Effect of Enalapril on Survival in Patients with Reduced Left Ventricular Ejection Fractions and Congestive Heart Failure. New England Journal of Medicine. 1991;325(5):293-302.
- Pitt B, Segal R, Martinez FA, Meurers G, Cowley AJ, Thomas I, et al. Randomised trial of losartan versus captopril in patients over 65 with heart failure (Evaluation of Losartan in the Elderly Study, ELITE). Lancet. 1997;349(9054):747-52. PubMed PMID: 9074572.
- McMurray JJV, Östergren J, Swedberg K, Granger CB, Held P, Michelson EL, et al. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial. The Lancet. 2003;362(9386):767-71.
- Cohn JN, Tognoni G. A Randomized Trial of the Angiotensin-Receptor Blocker Valsartan in Chronic Heart Failure. New England Journal of Medicine. 2001;345(23):1667-75.
- AlJaroudi WA, Refaat MM, Habib RH, Al-Shaar L, Singh M, Gutmann R, et al. Effect of Angiotensin-Converting Enzyme Inhibitors and Receptor Blockers on Appropriate Implantable Cardiac Defibrillator Shock in Patients With Severe Systolic Heart Failure (from the GRADE Multicenter Study). The American Journal of Cardiology. 2015;115(7):924-31.
- Schupp T, Behnes M, Weiß C, Nienaber C, Lang S, Reiser L, et al. Prognostic Impact of Angiotensin-Converting Enzyme Inhibitors and Receptor Blockers on Recurrent Ventricular Tachyarrhythmias and Implantable Cardioverter–Defibrillator Therapies. Journal of Cardiovascular Pharmacology. 2019;73(5):272-81. PubMed PMID: 00005344-201905000-00002.
- Garg R, Yusuf S, Bussmann WD, Sleight P, Uprichard A, Massie B, et al. Overview of Randomized Trials of Angiotensin-Converting Enzyme Inhibitors on Mortality and Morbidity in Patients With Heart Failure. JAMA. 1995;273(18):1450-6.
- Flather MD, Yusuf S, Køber L, Pfeffer M, Hall A, Murray G, et al. Long-term ACE-inhibitor therapy in patients with heart failure or left-ventricular dysfunction: a systematic overview of data from individual patients. The Lancet. 2000;355(9215):1575-81.
- Tsartsalis D, Korela D, Karlsson LO, Foukarakis E, Svensson A, Anastasakis A, et al. Risk and Protective Factors for Sudden Cardiac Death: An Umbrella Review of Meta-Analyses. Frontiers in Cardiovascular Medicine. 2022;9.
- Domanski MJ, Exner DV, Borkowf CB, Geller NL, Rosenberg Y, Pfeffer MA. Effect of angiotensin converting enzyme inhibition on sudden cardiac death in patients following acute myocardial infarction: A meta-analysis of randomized clinical trials. Journal of the American College of Cardiology. 1999;33(3):598-604.
- Gu J, Noe A, Chandra P, Al‐Fayoumi S, Ligueros‐Saylan M, Sarangapani R, et al. Pharmacokinetics and pharmacodynamics of LCZ696, a novel dual‐acting angiotensin receptor—neprilysin inhibitor (ARNi). The Journal of Clinical Pharmacology. 2010;50(4):401-14.
- Chang P-C, Lin S-F, Chu Y, Wo H-T, Lee H-L, Huang Y-C, et al. LCZ696 therapy reduces ventricular tachyarrhythmia inducibility in a myocardial infarction‐induced heart failure rat model. Cardiovascular therapeutics. 2019;2019(1):6032631.
- Eiringhaus J, Wünsche CM, Tirilomis P, Herting J, Bork N, Nikolaev VO, et al. Sacubitrilat reduces pro‐arrhythmogenic sarcoplasmic reticulum Ca2+ leak in human ventricular cardiomyocytes of patients with end‐stage heart failure. ESC heart failure. 2020;7(5):2992-3002.
- Chang P-C, Wo H-T, Lee H-L, Lin S-F, Chu Y, Wen M-S, Chou C-C. Sacubitril/valsartan therapy ameliorates ventricular tachyarrhythmia inducibility in a rabbit myocardial infarction model. Journal of cardiac failure. 2020;26(6):527-37.
- D’Elia E, Iacovoni A, Vaduganathan M, Lorini FL, Perlini S, Senni M. Neprilysin inhibition in heart failure: mechanisms and substrates beyond modulating natriuretic peptides. European journal of heart failure. 2017;19(6):710-7.
- Pfau D, Thorn SL, Zhang J, Mikush N, Renaud JM, Klein R, et al. Angiotensin receptor neprilysin inhibitor attenuates myocardial remodeling and improves infarct perfusion in experimental heart failure. Scientific reports. 2019;9(1):5791.
- von Lueder TG, Wang BH, Kompa AR, Huang L, Webb R, Jordaan P, et al. Angiotensin receptor neprilysin inhibitor LCZ696 attenuates cardiac remodeling and dysfunction after myocardial infarction by reducing cardiac fibrosis and hypertrophy. Circulation: Heart Failure. 2015;8(1):71-8.
- Sung YL, Lin TT, Syu JY, Hsu HJ, Lin KY, Liu YB, Lin SF. Reverse electromechanical modelling of diastolic dysfunction in spontaneous hypertensive rat after sacubitril/valsartan therapy. ESC heart failure. 2020;7(6):4040-50.
- Zile MR, O’Meara E, Claggett B, Prescott MF, Solomon SD, Swedberg K, et al. Effects of sacubitril/valsartan on biomarkers of extracellular matrix regulation in patients with HFrEF. Journal of the American College of Cardiology. 2019;73(7):795-806.
- Martens P, Nuyens D, Rivero-Ayerza M, Van Herendael H, Vercammen J, Ceyssens W, et al. Sacubitril/valsartan reduces ventricular arrhythmias in parallel with left ventricular reverse remodeling in heart failure with reduced ejection fraction. Clinical Research in Cardiology. 2019;108:1074-82.
- de Diego C, Gonzalez-Torres L, Núñez JM, Inda RC, Martin-Langerwerf DA, Sangio AD, et al. Effects of angiotensin-neprilysin inhibition compared to angiotensin inhibition on ventricular arrhythmias in reduced ejection fraction patients under continuous remote monitoring of implantable defibrillator devices. Heart rhythm. 2018;15(3):395-402.
- Rohde LE, Chatterjee NA, Vaduganathan M, Claggett B, Packer M, Desai AS, et al. Sacubitril/valsartan and sudden cardiac death according to implantable cardioverter-defibrillator use and heart failure cause: a PARADIGM-HF analysis. Heart Failure. 2020;8(10):844-55.
- Curtain JP, Jackson AM, Shen L, Jhund PS, Docherty KF, Petrie MC, et al. Effect of sacubitril/valsartan on investigator‐reported ventricular arrhythmias in PARADIGM‐HF. European journal of heart failure. 2022;24(3):551-61.
- Liu X-H, Wang G-L, Xu Q, Zhang L, Liu H-J. Effect of sacubitril/valsartan on the occurrence of cardiac arrhythmias and the risk of sudden cardiac death in heart failure: A meta-analysis of randomized controlled trials. Frontiers in cardiovascular medicine. 2022;9:943377.
- Pozzi A, Abete R, Tavano E, Kristensen S, Rea F, Iorio A, et al. Sacubitril/valsartan and arrhythmic burden in patients with heart failure and reduced ejection fraction: a systematic review and meta-analysis. Heart Failure Reviews. 2023;28(6):1395-403.
- Fernandes AD, Fernandes GC, Ternes CM, Cardoso R, Chaparro SV, Goldberger JJ. Sacubitril/valsartan versus angiotensin inhibitors and arrhythmia endpoints in heart failure with reduced ejection fraction. Heart rhythm O2. 2021;2(6):724-32.
- Russo V, Bottino R, Rago A, Papa AA, Liccardo B, Proietti R, et al. The effect of sacubitril/valsartan on device detected arrhythmias and electrical parameters among dilated cardiomyopathy patients with reduced ejection fraction and implantable cardioverter defibrillator. Journal of Clinical Medicine. 2020;9(4):1111.
- Mujadzic H, Prousi GS, Napier R, Siddique S, Zaman N. The Impact of Angiotensin Receptor–Neprilysin Inhibitors on Arrhythmias in Patients with Heart Failure: A Systematic Review and Meta-analysis. The Journal of Innovations in Cardiac Rhythm Management. 2022;13(9):5164.
- Weber KT. Aldosterone in congestive heart failure. New England Journal of Medicine. 2001;345(23):1689-97.
- Perrier E, Kerfant B-G, Lalevee N, Bideaux P, Rossier MF, Richard S, et al. Mineralocorticoid receptor antagonism prevents the electrical remodeling that precedes cellular hypertrophy after myocardial infarction. Circulation. 2004;110(7):776-83.
- Ouvrard-Pascaud A, Sainte-Marie Y, Bénitah J-P, Perrier R, Soukaseum C, Cat AND, et al. Conditional mineralocorticoid receptor expression in the heart leads to life-threatening arrhythmias. Circulation. 2005;111(23):3025-33.
- Brilla CG. Aldosterone and myocardial fibrosis in heart failure. Herz. 2000;25:299-306.
- Brown NJ. Eplerenone: cardiovascular protection. Circulation. 2003;107(19):2512-8.
- Bauersachs J, Heck M, Fraccarollo D, Hildemann SK, Ertl G, Wehling M, Christ M. Addition of spironolactone to angiotensin-converting enzyme inhibition in heart failure improves endothelial vasomotor dysfunction: role of vascular superoxide anion formation and endothelial nitric oxide synthase expression. Journal of the American College of Cardiology. 2002;39(2):351-8.
- Pitt B, Zannad F, Remme WJ, Cody R, Castaigne A, Perez A, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. New England Journal of Medicine. 1999;341(10):709-17.
- Pitt B, Williams G, Remme W, Martinez F, Lopez-Sendon J, Zannad F, et al. The EPHESUS trial: eplerenone in patients with heart failure due to systolic dysfunction complicating acute myocardial infarction. Cardiovascular Drugs and Therapy. 2001;15:79-87.
- Al-Gobari M, Al-Aqeel S, Gueyffier F, Burnand B. Effectiveness of drug interventions to prevent sudden cardiac death in patients with heart failure and reduced ejection fraction: an overview of systematic reviews. BMJ open. 2018;8(7):e021108.
- Rossello X, Ariti C, Pocock SJ, Ferreira JP, Girerd N, McMurray JJ, et al. Impact of mineralocorticoid receptor antagonists on the risk of sudden cardiac death in patients with heart failure and left-ventricular systolic dysfunction: an individual patient-level meta-analysis of three randomized-controlled trials. Clinical research in cardiology. 2019;108:477-86.
- Bers DM. Cardiac excitation–contraction coupling. Nature. 2002;415(6868):198-205.
- Bers DM. Calcium cycling and signaling in cardiac myocytes. Annu Rev Physiol. 2008;70:23-49.
- Grandi E, Ripplinger CM. Antiarrhythmic mechanisms of beta blocker therapy. Pharmacological research. 2019;146:104274.
- Barrese V, Taglialatela M. New advances in beta-blocker therapy in heart failure. Front Physiol. 2013;4:323. Epub 20131114. PubMed PMID: 24294204; PubMed Central PMCID: PMCPMC3827547.
- The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. The Lancet. 1999;353(9146):9-13.
- Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in-Congestive Heart Failure (MERIT-HF). The Lancet. 1999;353(9169):2001-7.
- Flather MD, Shibata MC, Coats AJS, Van Veldhuisen DJ, Parkhomenko A, Borbola J, et al. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). European Heart Journal. 2005;26(3):215-25.
- Packer M, Coats AJS, Fowler MB, Katus HA, Krum H, Mohacsi P, et al. Effect of Carvedilol on Survival in Severe Chronic Heart Failure. New England Journal of Medicine. 2001;344(22):1651-8.
- Connolly SJ, Dorian P, Roberts RS, Gent M, Bailin S, Fain ES, et al. Comparison of β-Blockers, Amiodarone Plus β-Blockers, or Sotalol for Prevention of Shocks From Implantable Cardioverter DefibrillatorsThe OPTIC Study: A Randomized Trial. JAMA. 2006;295(2):165-71.
- Chatterjee S, Biondi-Zoccai G, Abbate A, D’Ascenzo F, Castagno D, Van Tassell B, et al. Benefits of β blockers in patients with heart failure and reduced ejection fraction: network meta-analysis. Bmj. 2013;346.
- Al-Gobari M, Khatib CE, Pillon F, Gueyffier F. Beta-blockers for the prevention of sudden cardiac death in heart failure patients: a meta-analysis of randomized controlled trials. BMC cardiovascular disorders. 2013;13:1-9.
- Chatzidou S, Kontogiannis C, Tsilimigras DI, Georgiopoulos G, Kosmopoulos M, Papadopoulou E, et al. Propranolol versus metoprolol for treatment of electrical storm in patients with implantable cardioverter-defibrillator. Journal of the American College of Cardiology. 2018;71(17):1897-906.
- Diamond A, Goldenberg I, Younis A, Goldenberg I, Sampath R, Kutyifa V, et al. Effect of Carvedilol vs Metoprolol on Atrial and Ventricular Arrhythmias Among Implantable Cardioverter-Defibrillator Recipients. Clinical Electrophysiology. 2023;9(10):2122-31.
- Zannad F, Ferreira JP, Pocock SJ, Anker SD, Butler J, Filippatos G, et al. SGLT2 inhibitors in patients with heart failure with reduced ejection fraction: a meta-analysis of the EMPEROR-Reduced and DAPA-HF trials. The Lancet. 2020;396(10254):819-29.
- Schönberger E, Mihaljević V, Steiner K, Šarić S, Kurevija T, Majnarić LT, et al. Immunomodulatory Effects of SGLT2 Inhibitors—Targeting Inflammation and Oxidative Stress in Aging. International journal of environmental research and public health. 2023;20(17):6671.
- Hasan R, Lasker S, Hasan A, Zerin F, Zamila M, Chowdhury FI, et al. Canagliflozin attenuates isoprenaline-induced cardiac oxidative stress by stimulating multiple antioxidant and anti-inflammatory signaling pathways. Scientific reports. 2020;10(1):14459.
- Koyani CN, Plastira I, Sourij H, Hallström S, Schmidt A, Rainer PP, et al. Empagliflozin protects heart from inflammation and energy depletion via AMPK activation. Pharmacological research. 2020;158:104870.
- Fu J, Xu H, Wu F, Tu Q, Dong X, Xie H, Cao Z. Empagliflozin inhibits macrophage inflammation through AMPK signaling pathway and plays an anti-atherosclerosis role. International Journal of Cardiology. 2022;367:56-62.
- Byrne NJ, Matsumura N, Maayah ZH, Ferdaoussi M, Takahara S, Darwesh AM, et al. Empagliflozin blunts worsening cardiac dysfunction associated with reduced NLRP3 (nucleotide-binding domain-like receptor protein 3) inflammasome activation in heart failure. Circulation: Heart Failure. 2020;13(1):e006277.
- Santos-Gallego CG, Requena-Ibanez JA, San Antonio R, Ishikawa K, Watanabe S, Picatoste B, et al. Empagliflozin ameliorates adverse left ventricular remodeling in nondiabetic heart failure by enhancing myocardial energetics. Journal of the American College of Cardiology. 2019;73(15):1931-44.
- Carluccio E, Biagioli P, Reboldi G, Mengoni A, Lauciello R, Zuchi C, et al. Left ventricular remodeling response to SGLT2 inhibitors in heart failure: an updated meta-analysis of randomized controlled studies. Cardiovascular Diabetology. 2023;22(1):235.
- Pascual‐Figal DA, Zamorano JL, Domingo M, Morillas H, Nuñez J, Cobo Marcos M, et al. Impact of dapagliflozin on cardiac remodelling in patients with chronic heart failure: The DAPA‐MODA study. European Journal of Heart Failure. 2023;25(8):1352-60.
- Wu J, Liu T, Shi S, Fan Z, Hiram R, Xiong F, et al. Dapagliflozin reduces the vulnerability of rats with pulmonary arterial hypertension-induced right heart failure to ventricular arrhythmia by restoring calcium handling. Cardiovascular Diabetology. 2022;21(1):197.
- Trum M, Riechel J, Wagner S. Cardioprotection by SGLT2 inhibitors—Does it all come down to Na+? International Journal of Molecular Sciences. 2021;22(15):7976.
- Despa S, Bers DM. Na+ transport in the normal and failing heart—remember the balance. Journal of molecular and cellular cardiology. 2013;61:2-10.
- Wichaiyo S, Saengklub N. Alterations of sodium-hydrogen exchanger 1 function in response to SGLT2 inhibitors: what is the evidence? Heart Failure Reviews. 2022;27(6):1973-90.
- Mustroph J, Wagemann O, Lücht CM, Trum M, Hammer KP, Sag CM, et al. Empagliflozin reduces Ca/calmodulin‐dependent kinase II activity in isolated ventricular cardiomyocytes. ESC heart failure. 2018;5(4):642-8.
- Nakase M, Yahagi K, Horiuchi Y, Asami M, Yuzawa H, Komiyama K, et al. Effect of dapagliflozin on ventricular repolarization in patients with heart failure with reduced ejection fraction. Heart and Vessels. 2023;38(12):1414-21.
- Xue G, Yang X, Zhan G, Wang X, Gao J, Zhao Y, et al. Sodium–Glucose cotransporter 2 inhibitor empagliflozin decreases ventricular arrhythmia susceptibility by alleviating electrophysiological remodeling post-myocardial-infarction in mice. Frontiers in Pharmacology. 2022;13:988408.
- Azam MA, Chakraborty P, Si D, Du B, Massé S, Lai PF, et al. Anti-arrhythmic and inotropic effects of empagliflozin following myocardial ischemia. Life sciences. 2021;276:119440.
- McMurray JJ, Solomon SD, Inzucchi SE, Køber L, Kosiborod MN, Martinez FA, et al. Dapagliflozin in patients with heart failure and reduced ejection fraction. New England Journal of Medicine. 2019;381(21):1995-2008.
- Packer M, Anker SD, Butler J, Filippatos G, Pocock SJ, Carson P, et al. Cardiovascular and renal outcomes with empagliflozin in heart failure. New England Journal of Medicine. 2020;383(15):1413-24.
- Curtain JP, Docherty KF, Jhund PS, Petrie MC, Inzucchi SE, Køber L, et al. Effect of dapagliflozin on ventricular arrhythmias, resuscitated cardiac arrest, or sudden death in DAPA-HF. European heart journal. 2021;42(36):3727-38.
- Oates CP, Santos‐Gallego CG, Smith A, Basyal B, Moss N, Kawamura I, et al. SGLT2 inhibitors reduce sudden cardiac death risk in heart failure: Meta‐analysis of randomized clinical trials. Journal of Cardiovascular Electrophysiology. 2023;34(5):1277-85.
- Fujiki S, Iijima K, Okabe M, Niwano S, Tsujita K, Naito S, et al. Placebo-controlled, double-blind study of empagliflozin (EMPA) and implantable cardioverter-defibrillator (EMPA-ICD) in patients with type 2 diabetes (T2DM): rationale and design. Diabetes therapy. 2020;11:2739-55.
- Fernandes GC, Fernandes A, Cardoso R, Penalver J, Knijnik L, Mitrani RD, et al. Association of SGLT2 inhibitors with arrhythmias and sudden cardiac death in patients with type 2 diabetes or heart failure: a meta-analysis of 34 randomized controlled trials. Heart Rhythm. 2021;18(7):1098-105.
- Li H-L, Lip GY, Feng Q, Fei Y, Tse Y-K, Wu M-z, et al. Sodium-glucose cotransporter 2 inhibitors (SGLT2i) and cardiac arrhythmias: a systematic review and meta-analysis. Cardiovascular Diabetology. 2021;20(1):100.
- Sfairopoulos D, Zhang N, Wang Y, Chen Z, Letsas KP, Tse G, et al. Association between sodium–glucose cotransporter-2 inhibitors and risk of sudden cardiac death or ventricular arrhythmias: a meta-analysis of randomized controlled trials. EP Europace. 2022;24(1):20-30.
- Yin Z, Zheng H, Guo Z. Effect of sodium-glucose co-transporter protein 2 inhibitors on arrhythmia in heart failure patients with or without type 2 diabetes: a meta-analysis of randomized controlled trials. Frontiers in Cardiovascular Medicine. 2022;9:902923.
- Gheorghiade M, Greene SJ, Butler J, Filippatos G, Lam CS, Maggioni AP, et al. Effect of vericiguat, a soluble guanylate cyclase stimulator, on natriuretic peptide levels in patients with worsening chronic heart failure and reduced ejection fraction: the SOCRATES-REDUCED randomized trial. Jama. 2015;314(21):2251-62.
- Hulot J-S, Trochu J-N, Donal E, Galinier M, Logeart D, De Groote P, Juilliere Y. Vericiguat for the treatment of heart failure: mechanism of action and pharmacological properties compared with other emerging therapeutic options. Expert Opinion on Pharmacotherapy. 2021;22(14):1847-55.
- Armstrong PW, Pieske B, Anstrom KJ, Ezekowitz J, Hernandez AF, Butler J, et al. Vericiguat in patients with heart failure and reduced ejection fraction. New England Journal of Medicine. 2020;382(20):1883-93.
- Chen T, Kong B, Shuai W, Gong Y, Zhang J, Huang H. Vericiguat alleviates ventricular remodeling and arrhythmias in mouse models of myocardial infarction via CaMKII signaling. Life Sciences. 2023;334:122184.
- Teerlink JR, Diaz R, Felker GM, McMurray JJV, Metra M, Solomon SD, et al. Cardiac Myosin Activation with Omecamtiv Mecarbil in Systolic Heart Failure. New England Journal of Medicine. 2021;384(2):105-16.
- Drucker DJ. The Cardiovascular Biology of Glucagon-like Peptide-1. Cell Metab. 2016;24(1):15-30. Epub 20160623. PubMed PMID: 27345422.
- Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jódar E, Leiter LA, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2016;375(19):1834-44. Epub 20160915. PubMed PMID: 27633186.
- Hernandez AF, Green JB, Janmohamed S, D’Agostino RB, Sr., Granger CB, Jones NP, et al. Albiglutide and cardiovascular outcomes in patients with type 2 diabetes and cardiovascular disease (Harmony Outcomes): a double-blind, randomised placebo-controlled trial. Lancet. 2018;392(10157):1519-29. Epub 20181002. PubMed PMID: 30291013.
- Gerstein HC, Colhoun HaM, Dagenais GR, Diaz R, Lakshmanan M, Pais P, et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet. 2019;394(10193):121-30. Epub 20190609. PubMed PMID: 31189511.
- Margulies KB, Hernandez AF, Redfield MM, Givertz MM, Oliveira GH, Cole R, et al. Effects of Liraglutide on Clinical Stability Among Patients With Advanced Heart Failure and Reduced Ejection Fraction: A Randomized Clinical Trial. Jama. 2016;316(5):500-8. PubMed PMID: 27483064; PubMed Central PMCID: PMCPMC5021525.
- Neves JS, Vasques-Nóvoa F, Borges-Canha M, Leite AR, Sharma A, Carvalho D, et al. Risk of adverse events with liraglutide in heart failure with reduced ejection fraction: A post hoc analysis of the FIGHT trial. Diabetes Obes Metab. 2023;25(1):189-97. Epub 20220921. PubMed PMID: 36082522; PubMed Central PMCID: PMCPMC9742170.
- Jorsal A, Kistorp C, Holmager P, Tougaard RS, Nielsen R, Hänselmann A, et al. Effect of liraglutide, a glucagon-like peptide-1 analogue, on left ventricular function in stable chronic heart failure patients with and without diabetes (LIVE)-a multicentre, double-blind, randomised, placebo-controlled trial. Eur J Heart Fail. 2017;19(1):69-77. Epub 20161028. PubMed PMID: 27790809.
- Wu S, Lu W, Chen Z, Dai Y, Chen K, Zhang S. Association of glucagon-like peptide-1 receptor agonists with cardiac arrhythmias in patients with type 2 diabetes or obesity: a systematic review and meta-analysis of randomized controlled trials. Diabetol Metab Syndr. 2022;14(1):195. Epub 20221226. PubMed PMID: 36572913; PubMed Central PMCID: PMCPMC9791739.
- Al-Sadawi MA, Aslam FM, Tao M, Alsaiqali M, Almasry IO, Fan R, et al. Effects of GLP-1 Agonists on mortality and arrhythmias in patients with Type II diabetes. Int J Cardiol Heart Vasc. 2023;47:101218. Epub 20230519. PubMed PMID: 37252197; PubMed Central PMCID: PMCPMC10209701.







