NGUYỄN DƯƠNG KHANG*
NGUYỄN THANH HIỀN
* Khoa Tim mạch can thiệp, BV Đại học Y Dược TP.Hồ Chí Minh
I. Mở đầu
Trong một khoảng thời gian khá dài, quản lý bệnh mạch vành mạn được dựa trên niềm tin rằng những sang thương xơ vữa tắc nghẽn gây chậm dòng đáng kể của hệ mạch vành thượng tâm mạc là nguyên nhân chính yếu của đau thắt ngực và thiếu máu cơ tim ở hầu hết các trường hợp. Các lý thuyết về sinh lý bệnh và bằng chứng thực hành hiện tại đều cho thấy các sang thương hẹp động mạch vành có thể dẫn đến thiếu máu cục bộ cơ tim, và có thể đưa đến nhồi máu cơ tim cấp. Trong bối cảnh cấp tính này, việc tái thông mạch vành có thể cải thiện dòng chảy và từ đó cải thiện sống còn [1], [2]. Với cơ sở như vậy, người ta cũng tin rằng hẹp các mạch vành thượng tâm mạc là nguyên nhân chính gây đau ngực và thiếu máu cục bộ mạn tính. Tuy vậy, tái tưới máu so với nhóm điều trị nội khoa đơn thuần trong trường hợp này lại chỉ giảm đáng kể biến cố tim mạch ở nhóm bệnh nhân nguy cơ cao (như bệnh thân chung vành trái, bệnh mạch vành 3 nhánh, và chức năng co bóp thất trái giảm). Trong phần lớn các trường hợp bệnh mạch vành mạn còn lại, việc tái thông mạch vành không làm giảm thêm bệnh suất và tử suất so với điều trị nội khoa đơn thuần [3], [4].
Xơ vữa mạch máu là dạng bệnh lý ảnh hưởng đến toàn bộ hệ thống mạch máu, bao gồm cả mạch vành thượng tâm mạc và vi mạch vành. Do đó, điều trị nội khoa tối ưu cần bao gồm cả điều chỉnh lối sống (chế độ ăn, tập luyện thể lực, ngưng hút thuốc lá), kiểm soát tích cực các yếu tố nguy cơ, và sử dụng phối hợp thuốc trong phòng ngừa thứ phát (điều trị tăng huyết áp, rối loạn mỡ máu, đái tháo đường) và kiểm soát triệu chứng đau thắt ngực. Đau thắt ngực có thể tái hồi, cũng như mảng xơ vữa có thể trở nên im lặng, việc đánh giá triệu chứng cần được theo sát kỹ lưỡng và có hệ thống. Do đó, cần một khoảng thời gian nhất định [5], [6] để sử dụng một đợt điều trị nội khoa tối ưu rồi sau đó đánh giá lại hiệu quả dùng thuốc. Trong bài này, chúng tôi sẽ điểm qua hướng tiếp cận bệnh mạch vành mạn gần đây trên thế giới, cũng như cơ chế và chẩn đoán đau thắt ngực tồn lưu sau can thiệp mạch vành.
II. Những công cụ chẩn đoán hội chứng mạch vành mạn
Hình cho thấy một sơ đồ tiếp cận đánh giá trong thực hành các nguyên nhân gây đau thắt ngực và thiếu máu cơ tim. Sơ đồ này được đúc kết từ các khuyến cáo quốc tế [7], [8], và kết quả của các nghiên cứu nền tảng [3], [9], [10]. Như chúng ta thấy, hướng tiếp cận ban đầu tập trung vào thay đổi lối sống và phòng ngừa thứ phát bằng thuốc để đạt nhiều mục tiêu điều trị về tim mạch như kiểm soát huyết áp, mỡ máu, đường máu như các khuyến cáo hiện tại. Sơ đồ cũng nhấn mạnh vai trò của các cận lâm sàng hình ảnh học trong đánh giá giải phẫu và chức năng để xác định nhóm bệnh nhân bệnh mạch vành mạn nguy cơ cao, có thể phù hợp với tái tưới máu hơn là điều trị nội khoa đơn độc.
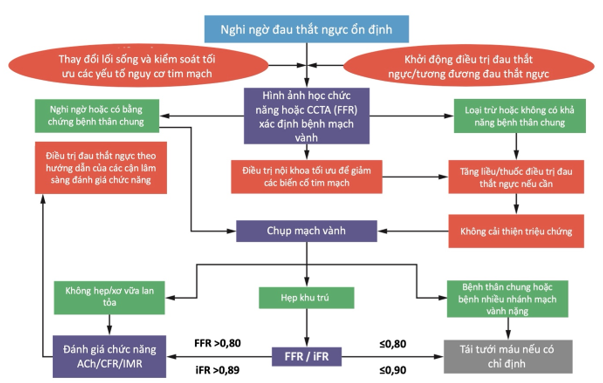
Hình 1. Tiếp cận chẩn đoán bệnh nhân đau thắt ngực ổn định [11]
Nếu các cận lâm sàng không xâm lấn xác định một ngưỡng đau thắt ngực rất thấp và/hoặc một vùng cơ tim lớn có nguy cơ thiếu máu cục bộ trong lúc làm nghiệm pháp gắng sức, thì chụp CT-scan mạch vành hoặc chụp mạch vành xâm lấn để loại trừ bệnh thân chung và/hoặc bệnh mạch vành nhiều nhánh là hợp lý. Ở tất cả các bệnh nhân đau thắt ngực ổn định mạn tính khác, bước đầu tiên quan trọng là điều trị đau thắt ngực theo kinh nghiệm và tăng liều hoặc thêm thuốc để kiểm soát triệu chứng nếu cần [6], [12]. Bệnh nhân bệnh mạch vành mạn tính ổn định còn đau thắt ngực nên được dùng ít nhất 2 nhóm thuốc chống đau thắt ngực và hiệu chỉnh trong 3 – 6 tháng trước khi được cân nhắc tái tưới máu, đặc biệt nếu triệu chứng đau thắt ngực là nhẹ hoặc không thường xuyên.
Ở những bệnh nhân có triệu chứng thiếu máu cơ tim dai dẳng hoặc tái phát dù đã điều trị triệu chứng tích cực, chúng ta có chỉ định chụp mạch vành để xác định nhóm bệnh nhân có hẹp mạch vành làm chậm dòng chảy là những bệnh nhân có thể có lợi từ việc tái tưới máu. Ở những bệnh nhân không có hẹp mạch vành, các đánh giá chức năng về tuần hoàn mạch vành, bao gồm bao gồm dùng acetylcholine đánh giá co thắt, dự trữ dòng máu mạch vành, và kháng lực vi mạch nên được cân nhắc để hướng dẫn điều trị thuốc.
Hướng tiếp cận như trên sẽ gặp trở ngại về 2 vấn đề: nhiều trung tâm không đủ phương tiện hoặc khả năng, kinh nghiệm để phân tích các kết quả; và lo ngại về kết quả của cán cân chi phí – hiệu quả. Do đó, chúng tôi đề nghị các cận lâm sàng chẩn đoán ở trên chỉ thực hiện sau khi đã loại trừ bệnh mạch vành tắc nghẽn, và chỉ khi triệu chứng không cải thiện hoặc nặng hơn dù đã điều trị chống đau ngực hợp lý với ít nhất 2 nhóm thuốc.
Trong trường hợp hệ mạch vành thượng tâm mạc không hẹp hoặc hẹp không đáng kể, bước tiếp theo cần xác định là liệu bệnh nhân có bị bệnh lý vi mạch hay không. Trước hết, cần nói đến tiêu chuẩn chẩn đoán đã được đồng thuận quốc tế trong trường hợp bệnh lý vi mạch vành. Hội thảo thường niên của tổ chức học thuật quốc tế về bệnh lý vận mạch mạch vành (Coronary Vasomotion Disorders International Study Group – COVADIS) tổ chức năm 2014 – 2015 đã đưa ra tiêu chuẩn trong Bảng 1 để hướng dẫn chẩn đoán đau ngực do vi mạch [13]:
Bảng 1. Tiêu chuẩn chẩn đoán đau ngực do vi mạch
| 1. Triệu chứng thiếu máu cơ tim:
a. Đau thắt ngực khi gắng sức và/hoặc khi nghỉ b. Triệu chứng tương đương đau thắt ngực (VD khó thở) 2. Không có bệnh mạch vành thượng tâm mạc (hẹp < 50% đường kính, hoặc FFR > 0.80) qua: a. Chụp CT-scan mạch vành b. Chụp mạch vành xâm lấn 3. Bằng chứng khách quan của thiếu máu cơ tim: a. Thay đổi trên điện tâm đồ (ĐTĐ) gợi ý thiếu máu cơ tim trong cơn đau ngực b. Đau ngực kích gợi do stress và/hoặc thay đổi trên ĐTĐ gợi ý thiếu máu cơ tim trong trường hợp có hoặc không có bất thường tưới máu cơ tim thoáng qua/phục hồi và/hoặc bất thường vận động vùng 4. Bằng chứng của suy giảm chức năng vi mạch a. Giảm phân suất dự trữ vành (tùy vào phương pháp đo mà ngưỡng cắt là ≤ 2,0 hoặc ≤ 2,5) b. Co thắt vi mạch vành, định nghĩa là tình trạng xuất hiện triệu chứng, thay đổi ĐTĐ gợi ý thiếu máu cơ tim nhưng không thấy co thắt mạch vành thượng tâm mạc trong lúc dùng acetylcholine. c. Bất thường chỉ số kháng lực hệ vi mạch vành (IMR) (VD IMR > 25) d. Tình trạng chậm dòng mạch vành, định nghĩa là số khung hình TIMI > 25 |
| FFR = fractional flow reserve, IMR = index of microcirculatory resistance, TIMI = thrombolysis in myocardial infarction. |
| * Chẩn đoán chắc chắn bệnh vi mạch: có tất cả 4 tiêu chuẩn
* Chẩn đoán nghi ngờ bệnh vi mạch: khi có tiêu chuẩn 1 và 2, kèm theo 1 trong 2 tiêu chuẩn 3 hoặc 4. |
* CT-scan mạch vành:
CT-scan mạch vành là một công cụ đánh giá bán định lượng dòng máu cơ tim và dự trữ tưới máu cơ tim. Tuy vậy còn khá ít nghiên cứu về khả năng phát hiện bệnh lý vi mạch và do vậy, CT-scan còn chưa được kiểm định. Lợi điểm đáng kể nhất của CT là khả năng kết hợp đánh giá cả giải phẫu và chức năng trong cùng một lần thực hiện. Tuy vậy, chụp CT không tránh khỏi phơi nhiễm tia X cũng như nguy cơ bệnh thận do thuốc cản quang. Thuốc cản quang có chứa iod cũng khiến đánh giá quá mức dòng máu cơ tim do tính chất dãn mạch của thuốc.
Chụp CT-scan trong trường hợp nghi ngờ bệnh vi mạch có vai trò chính để loại trừ bệnh mạch vành thượng tâm mạc tắc nghẽn. Một bệnh nhân không có tắc nghẽn hệ thượng tâm mạc sẽ có thể phân loại thành: hệ động mạch vành bình thường hoặc hẹp nhẹ (hẹp 0% đến 30%), hẹp mức độ trung bình (30 – 50%), hoặc hẹp lan tỏa hệ thượng tâm mạc. Trong một số trường hợp, bệnh nhân có bệnh mạch vành lan tỏa hoặc hẹp mức độ trung bình thì việc đo FFR để đánh giá gánh nặng của các sang thương này là cần thiết. CR-FFR là một kỹ thuật không xâm lấn có tiềm năng, tuy vậy về tính ứng dụng trên lâm sàng cũng như hiệu quả thực sự cũng cần được xem xét lại [14]. Ở những bệnh nhân bệnh mạch vành có FFR > 0.80, hoặc những người có hệ mạch vành bình thường thì việc có kèm triệu chứng thiếu máu cơ tim hoặc có các chứng cứ khách quan khác của thiếu máu cơ tim sẽ là điều kiện đủ để bác sĩ lâm sàng cân nhắc đến cơ chế gây triệu chứng là do bệnh lý vi mạch.
* Phân suất dự trữ vành (Coronary Flow Reserve – CFR)
CFR phản ánh được khả năng dãn mạch của tuần hoàn vi mạch vành. CFR được tính bằng tỉ số của tốc độ dòng máu tăng hoạt tối đa (thường kích thích bằng thuốc dãn mạch đường tĩnh mạch như adenosine), chia cho tốc độ dòng máu thông thường. CFR cho cái nhìn về tốc độ dòng máu đi qua cả hệ mạch vành thượng tâm mạc và hệ vi tuần hoàn mạch vành. Trong trường hợp không có tắc nghẽn hệ mạch vành thượng tâm mạc, CFR có thể dùng làm chỉ dấu cho bệnh vi mạch [15]. Để đo CFR, có thể dùng phương pháp đo dòng máu cơ tim không xâm lấn qua PET [16], đánh giá tưới máu cơ tim qua MRI tim [17] khi tăng dòng tối đa bằng thuốc giãn mạch, hoặc đo tốc độ dòng máu mạch vành qua siêu âm tim Doppler qua thành ngực [18].
Đa số bệnh nhân sẽ được chụp mạch vành xâm lấn, và đây cũng là cơ hội để đánh giá dự trữ vành bằng các kỹ thuật xâm lấn như đo dự trữ tốc độ dòng máu mạch vành bằng dây dẫn Doppler hoặc đo dự trữ dòng mạch vành bằng dây dẫn kết hợp giữa áp lực và pha loãng nhiệt [19], [20]. Và dù dùng phương pháp nào, thì CFR > 2,5 được xem là bình thường, và CFR < 2,0 hoặc < 2,5 tùy phương pháp đo, được xem là bất thường [13].
* Kháng lực vi mạch vành
Kháng lực vi mạch có thể đo ở một hoặc nhiều vùng chi phối mạch vành bằng một đầu nhận cảm qua guidewire và pha loãng nhiệt mạch vành, trong đó bao gồm adenosine tĩnh mạch [21] hoặc truyền liên tục nước muối vào mạch vành [22]. IMR được đo bằng cách kết hợp chỉ số về áp lực và dòng chảy. Không như CFR, kháng lực vi mạch độc lập với chức năng mạch máu thượng tâm mạc, và do vậy đặc hiệu cho hệ vi mạch. Bên cạnh đó, việc đo trở kháng vi mạch độc lập với dòng máu mạch vành lúc nghỉ.
Chỉ số kháng lực vi mạch (IMR) được đo bằng phương pháp pha loãng nhiệt với bolus nước muối sinh lý và được tính bằng cách nhân áp lực đoạn xa mạch vành lúc tăng dòng tối đa với thời gian di chuyển trung bình lúc tăng dòng [21]. IMR ≥ 25 được xem là bất thường [23].
* Hiện tượng chậm dòng
Một phương pháp gián tiếp đánh giá tình trạng chậm dòng chảy cản quang trong lòng mạch vành, thể hiện sự tăng kháng lực mạch vành đoạn xa, là hiện tượng “chậm dòng mạch vành” (slow flow). Hiện tượng này được đánh giá qua phương pháp bán định lượng: đếm số khung hình TIMI [24]. Để tính số khung hình TIMI hiệu chỉnh (CTFC), đầu tiên chúng ta đếm số khung hình ở vận tốc 15 frame/giây để cản quang đi từ đoạn gần đến đoạn xa được chuẩn hóa của động mạch xuống trước Trái. Sau đó, con số này nhân với 2 để có được số khung hình TIMI (TIMI frame count – tương đương 30 frame/giây). Cuối cùng, TFC/1,7 để hiệu chỉnh độ dài của động mạch vành xuống trước trái, chúng ta sẽ tính được chỉ số CTFC [24], [25]. Nếu không có bệnh mạch vành thượng tâm mạc, CTFC > 25 gợi ý bệnh lý vi mạch (hiện tượng slow flow). Cách làm đơn giản và chi phí thấp khiến phương pháp này trở nên thông dụng, tuy vậy độ nhạy của nó không tốt bằng các kỹ thuật khác. Một nghiên cứu gần đây thậm chí còn đề nghị loại bỏ CTFC ra khỏi tiêu chuẩn chẩn đoán bệnh lý vi mạch vì khả năng dự đoán kém của nó (diện tích dưới đường cong 0,41 [95% CI, 0.32%–0.50%] [26].
III. Điều trị tối ưu hội chứng mạch vành mạn
Tái tưới máu trong trường hợp bệnh mạch vành thượng tâm mạc giúp giảm triệu chứng đau ngực và cải thiện chất lượng cuộc sống so với chỉ điều trị nội khoa đơn thuần. Can thiệp mạch vành qua da thành công giúp giảm tái phát đau thắt ngực 20 – 30% trong 1 năm sau đó [27], và lên tới 40% trong 3 năm [28]; từ đó giúp giảm tần suất chụp mạch vành và can thiệp sau đó. Trong những trường hợp cần chụp mạch vành kiểm tra, thì không hiếm gặp những trường hợp không tái hẹp trong stent hoặc hẹp mạch vành, từ đó càng cần cân nhắc đến nguyên nhân gây đau thắt ngực không do tắc nghẽn. Như đã trình bày ở trên, nhóm bệnh nhân này gồm những trường hợp co thắt mạch vành, suy chức năng vi mạch [29].
Các nghiên cứu ngẫu nhiên có nhóm chứng trước đây cho thấy không có lợi ích về cải thiện tử vong, nhồi máu cơ tim và tái can thiệp mạch vành khi kết hợp giữa tái thông và điều trị nội khoa tối ưu. Tuy vậy, những nghiên cứu này có những điểm hạn chế, như dân số thu nhận có nguy cơ thấp, là những người có thiếu máu cơ tim mức độ nhẹ – trung bình, được can thiệp với stent trần hoặc stent phủ thuốc thế hệ đầu tiên, và thiết kế nghiên cứu không làm mù trước khi chụp mạch vành chẩn đoán, từ đó dẫn đến việc loại khỏi nghiên cứu các bệnh nhân có bệnh mạch vành tắc nghẽn nặng. Cho đến nay, nghiên cứu quan trọng nhất trong so sánh giữa điều trị nội khoa đơn thuần so với có kết hợp với tái thông mạch vành trong bệnh mạch vành mạn là nghiên cứu ISCHEMIA [9]. Nghiên cứu này thu nhận ngẫu nhiên 5.179 bệnh nhân hội chứng vành mạn có thiếu máu cơ tim trung bình – nặng dựa trên mức gắng sức, phân thành nhóm điều trị xâm lấn bằng tái thông mạch vành kèm theo điều trị nội khoa tối ưu hoặc vào nhóm điều trị nội khoa tối ưu ban đầu và chỉ tái tưới máu cho những bệnh nhân không đáp ứng với điều trị nội khoa. Trong nhóm tái thông mạch vành, 74% số bệnh nhân được PCI. Kết cục chính bao gồm tử vong do nguyên nhân tim mạch, nhồi máu cơ tim, hoặc nhập viện vì đau thắt ngực không ổn định, suy tim, hoặc ngưng tim được hồi sức. Sau 5 năm theo dõi (thời gian theo dõi trung bình 3,2 năm), tỉ lệ biến cố cộng gộp lần lượt là 16,4 và 18,2% (khác biệt 1.8%, 95% CI -4,7 – 1,0). Số trường hợp tử vong trong 2 nhóm lần lượt là 145 và 144 trường hợp (HR 1,05, 95% CI 0,83 – 1,32). Như vậy có nghĩa là tái thông mạch vành cho bệnh nhân hội chứng vành mạn không mang lại lợi ích về cải thiện tử vong so với điều trị nội khoa tối ưu. Tuy nhiên, nghiên cứu này đã loại trừ những bệnh nhân bị bệnh thân chung động mạch vành trái, những bệnh nhân có suy tim, những bệnh nhân có phân suất tống máu giảm, những bệnh nhân có đau ngực nhiều dù đã điều trị nội khoa. Nghiên cứu này từ lúc công bố kết quả đến nay đã luôn là chủ đề tranh cãi về cách áp dụng vào lâm sàng [30]. Các ý kiến có vẻ dè dặt hơn trong quyết định can thiệp mạch vành ở những trường hợp bệnh mạch vành mạn. Việc ứng dụng nghiệm pháp gắng sức ở những bệnh nhân không triệu chứng để xác định nhóm cần tái tưới máu hoặc là cận lâm sàng tầm soát thường quy có lẽ không còn hợp lý. Xu hướng hiện cân nhắc nâng cao vai trò của chụp CT-scan mạch vành để loại trừ bệnh thân chung và để giảm thiểu các cận lâm sàng hình ảnh học khác. Điều này càng nhấn mạnh vai trò của điều trị nội khoa tối ưu.
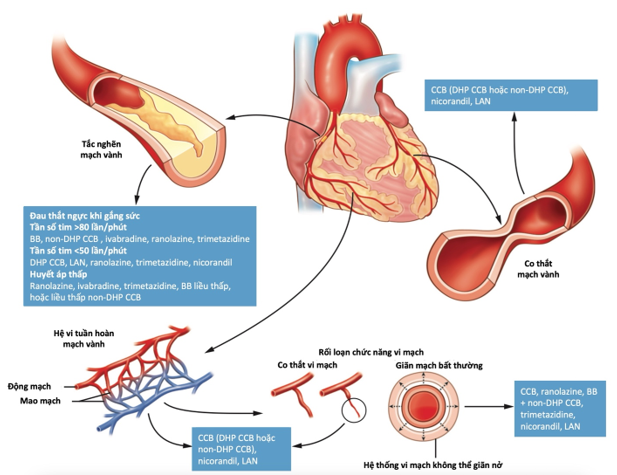
Hình 2. Điều trị nhắm đến cơ chế thiếu máu cục bộ trong đau thắt ngực
Tình trạng giảm dự trữ dòng máu mạch vành/cơ tim có thể do hẹp mạch máu thượng tâm mạc, hoặc suy chức năng vi mạch, hoặc cả 2, ngay cùng trên một bệnh nhân (Hình 2). Trong bối cảnh này, những thuốc làm giảm nhu cầu oxy cơ tim (như chẹn thụ thể beta, chẹn kênh calci non-DHP, hoặc ivabradine) và/hoặc những thuốc tối ưu sử dụng oxy cơ tim (như ranolazine hoặc trimetazidine) có vẻ là những lựa chọn tốt nhất. Trong trường hợp co thắt mạch vành, các thuốc giãn mạch (chẹn kênh calci, nitrate, hoặc nicorandil) là các thuốc phù hợp nhất. Nói chung, việc điều chỉnh thuốc phù hợp nhất có thể để tương ứng với nguyên nhân và yếu tố kích gợi tình trạng thiếu máu cơ tim là điều quan trọng nhất.
Nhưng tiêu chuẩn để chúng ta nói một bệnh nhân thất bại với điều trị nội khoa tối ưu là gì trước khi can thiệp xâm lấn? Chúng ta không thể nói bệnh nhân đã được điều trị nội khoa tối ưu nếu chưa cân nhắc đến các yếu tố: số lượng, liều và thời gian điều trị. Trong nghiên cứu COURAGE (Clinical Outcomes Utilizing Revascularization and Aggressive Drug Evaluation) , điều trị nội khoa tối ưu (OMT) bao gồm cả thay đổi lối sống tích cực và dùng tất cả các thuốc được chứng minh cải thiện kết cục lâm sàng trong các thử nghiệm có nhóm chứng . Quan trọng là OMT được thiết kế để thích ứng với sự phát triển không ngừng của các thuốc điều trị bệnh cùng các bằng chứng mới được đưa ra từ các nghiên cứu ngẫu nhiên. Do vậy, OMT là một đích đến động, phản ánh thực hành lâm sàng tốt nhất tại thời điểm đó. Có hai mục tiêu chính của OMT: cải thiện kết cục tim mạch, với cải thiện triệu chứng và chất lượng cuộc sống.
* Cải thiện kết cục tim mạch: nghiên cứu COURAGE so sánh liệu PCI kèm OMT có thêm lợi ích trên kết cục chính gồm tử vong và nhồi máu cơ tim, so với OMT đơn độc không. Nghiên cứu BARI 2D cũng đánh giá việc kết hợp các thuốc có bằng chứng (như aspirin, ức chế P2Y12, statin, ezetimibe, và ức chế men chuyển) trên tử vong và kết cục gộp tử vong, nhồi máu cơ tim và đột quỵ . Tương tự như vậy, khi nghiên cứu ISCHEMIA công bố năm 2021, những thuốc có bằng chứng từ nghiên cứu này phải được xem là một phần của OMT trong giảm biến cố tim mạch, bao gồm các thuốc giảm mỡ máu mạnh hơn (như evolocumab hay alirocumab, icosapent ethyl), thuốc giảm nguy cơ huyết khối tồn lưu (như rivaroxaban liều thấp) , và các thuốc trị đái tháo đường mới hơn (như ức chế SGLT2, đồng vận thụ thể GLP-1). Các thuốc này kết hợp với thay đổi lối sống chặt chẽ để đạt giảm mức huyết áp tối ưu, để quản lý mỡ máu, kiểm soát đường máu là các thành tố quan trọng để đạt mục tiêu cải thiện sống còn không biến cố, dù bệnh nhân có được tái thông hay không.
* Cải thiện triệu chứng đau ngực: hiện chưa có nghiên cứu nào định nghĩa rõ ràng thành công trong điều trị giảm đau ngực hay khi nào được xem là OMT thất bại trong giảm triệu chứng, bao gồm cả thời gian điều trị cần thiết để được xem là hiệu quả. Tuy vậy, có một số điểm có thể giúp thực hành trên lâm sàng. Trong nghiên cứu COURAGE, các thành tố của thang điểm Seattle Angina Questionnaire đều cải thiện rõ rệt trong các nhóm điều trị sau 6 tháng . Với nhóm bệnh nhân có tần suất đau ngực thấp hơn (như hàng tuần hay hàng tháng) thì cải thiện điểm SAQ là dưới 5 điểm, và không cải thiện rõ rệt cho đến thời điểm 6 tháng. Sự cải thiện rõ rệt triệu chứng đau thắt ngực khi dùng OMT trong tháng đầu tiên có thể thể hiện ích lợi của việc điều trị tối ưu và có thể dự báo sự cải thiện sẽ tiếp tục diễn ra trên nhóm bệnh nhân đó về sau. Trong nghiên cứu sổ bộ gồm 32691 bệnh nhân hội chứng vành mạn , chỉ có 22% có đau thắt ngực tại thời điểm ban đầu, nhưng trong đó có đến gần 40% số bệnh nhân ghi nhận cải thiện đau thắt ngực tại thời điểm 1 năm, và tiếp tục giảm đau sau đó. Chỉ có 4,5% số bệnh nhân có triệu chứng cần được tái thông mạch vành, và 84% giảm đau ngực mà không cần thêm thuốc hay biện pháp xâm lấn. Tuy vậy, tất nhiên cũng không loại trừ hiệu quả quan sát được là do hiệu ứng placebo.
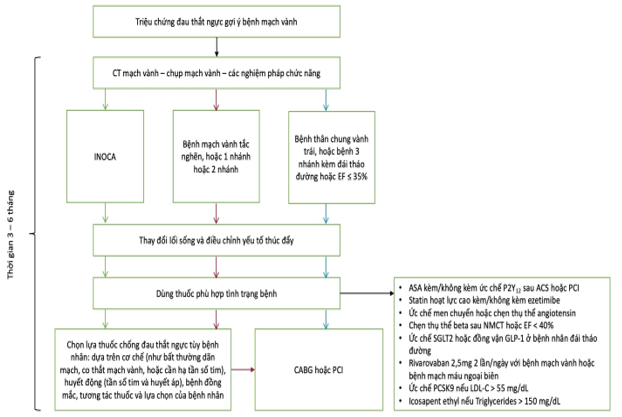
Hình 3. Lưu đồ điều trị nội khoa tối ưu đề xuất trong bệnh mạch vành mạn
Gần đây, các tác giả đã đề xuất hướng tiếp cận điều trị đau thắt ngực trên tập san LANCET [6], theo đó có các bước điều trị trước khi xác định bệnh nhân thất bại với OMT (Hình 3). Đầu tiên cần loại trừ các bệnh nhân bệnh thân chung vành trái hoặc bệnh 3 nhánh mạch vành với CT mạch vành. Cũng cần thực hiện siêu âm tim để loại trừ suy giảm chức năng thất Trái nặng, là nhóm mà điều trị nội khoa đơn thuần có thể là chưa đủ. Ở tất cả các bệnh nhân còn lại, thuốc trị đau thắt ngực nên bao gồm ít nhất 2 trong 3 nhóm: chẹn thụ thể beta, đối vận kênh calci, và nitrate; đồng thời, nên tăng liều mỗi 1-2 tháng để đạt liều tối ưu [3], [4], [9]. Bên cạnh đó, cần đánh giá cách hệ thống các bệnh lý đi kèm, chức năng thất trái, tần số tim, và huyết áp để có thể giúp hướng dẫn chọn lựa thuốc [7], [8], [31]. Việc lựa chọn thuốc chống đau thắt ngực nên được hướng dẫn bởi các cơ chế bệnh sinh, cũng như huyết áp tâm thu và tần số tim. Ở những bệnh nhân thường đau thắt ngực khi gắng sức, và những người huyết áp bình thường hoặc cao, thì việc dùng chẹn beta, đối vận kênh calci hoặc nitrate là phù hợp. Ngược lại, với những bệnh nhân có huyết áp dưới 100 – 110 mmHg, hoặc tần số tim dưới 60 lần/phút thì nên cân nhắc các lựa chọn khác (như ranolazine, ivabradine, trimetazidine, hoặc nicorandil). Một điểm quan trọng trong điều trị nữa là đáp ứng lâm sàng với các thuốc chống đau ngực nên được đánh giá thường xuyên (tối ưu là mỗi tháng) và liều thuốc nên được tăng lên hoặc thêm thuốc nếu cần thiết trước khi đưa ra quyết định là bệnh nhân có bị thất bại với điều trị hay không. Một bệnh nhân còn triệu chứng khi chỉ đang dùng 1 hoặc 2 thuốc đau thắt ngực, nhất là ở liều thấp, thường không nên xem là thất bại với OMT trừ trường hợp có các tác dụng phụ không dung nạp được, hoặc không dung nạp khi tăng liều thuốc, hoặc không thể khởi động các thuốc nhóm khác. Tóm lại, một đợt điều trị OMT kéo dài 3 – 6 tháng ở tất cả các bệnh nhân có triệu chứng là hướng tiếp cận phù hợp về lâm sàng, dựa trên bằng chứng, và có lợi ích về chi phí trong quản lý một bệnh nhân đau thắt ngực trước khi tái tưới máu chương trình . Điều quan trọng là phải đạt kiểm soát các yếu tố nguy cơ tối ưu bằng các can thiệp trên lối sống và dùng thuốc để giảm biến cố tim mạch dù bệnh nhân có được tái thông hay không.
IV. Đau thắt ngực sau can thiệp mạch vành: cơ chế và chẩn đoán
Đau thắt ngực dai dẳng hoặc tái phát sau PCI không hiếm gặp. Tình trạng này chiếm đến 20 – 40% số bệnh nhân trong thời gian theo dõi ngắn – trung hạn [32], [33], [34], ngay cả khi PCI đã được tối ưu hóa bằng các công cụ dựa trên sinh lý (như FFR) [35] và các loại stent phủ thuốc có khung tự tiêu [36]. Gánh nặng chủ yếu của tình trạng này ảnh hưởng trên kinh tế y tế. Chi phí chăm sóc y tế ở những bệnh nhân có đau thắt ngực dai dẳng hoặc tái phát có thể gấp 2 lần những bệnh nhân không còn đau ngực [37]. Trong phần này, chúng tôi sẽ điểm qua những cơ chế đã được biết của tình trạng này (Bảng 2), cũng như hướng tiếp cận chẩn đoán.
1. Cơ chế
Bảng 2. Nguyên nhân của đau thắt ngực dai dẳng hoặc tái phát sau can thiệp mạch vành qua da (59)
| Cơ chế | Tiêu chuẩn chẩn đoán |
| Hẹp mạch vành thượng tâm mạc | |
| Bệnh lý của stent | |
| Tái hẹp trong stent | Hẹp ≥ 70% đoạn chứa stent và trong vòng 5mm mỗi đầu stent. Các sang thương hẹp trung bình nên được đo FFR.
|
| Huyết khối trong stent | Có huyết khối trong lòng mạch vành xuất phát từ trong stent hoặc trong vòng 5mm mỗi đầu stent và có ít nhất 1 trong các tiêu chuẩn sau trong vòng 48 giờ:
– Khởi phát triệu chứng thiếu máu cục bộ cấp tính lúc nghỉ, – Các thay đổi mới trên ECG gợi ý thiếu máu cục bộ cấp tính – Tăng và giảm dấu ấn sinh học cơ tim điển hình |
| Tiến triển bệnh mạch vành | Tiến triển của sang thương xơ vữa mạch vành ở đoạn mạch vành khác với những đoạn đã được PCI trước đó, và hẹp ≥ 70% trên chụp mạch vành. Các sang thương hẹp trung bình (hẹp 40 – 70% đường kính) nên được đo FFR. |
| Tái tưới máu không hoàn toàn | Hẹp tồn lưu ≥ 50% ở thân chung vành trái hoặc ≥ 70% các nhánh mạch vành chính khác sau PCI. Các sang thương hẹp trung bình (hẹp 40 – 70% đường kính) nên được đo FFR. |
| Xơ vữa mạch vành lan tỏa | Xơ vữa mạch vành lan tỏa trên chụp mạch vàn mà không có hẹp đáng kể, và xác định có thiếu máu cục bộ bằng đo FFR ≤ 0,80. |
| Cầu cơ | Ghi nhận trên chụp mạch vành hình ảnh hẹp lòng thì tâm thu và nở ra hoàn toàn hoặc một phần thì tâm trương.
FFR thì tâm trương với dobutamine là một hướng tiếp cận hợp lý để đánh giá gánh nặng trên huyết động của các cầu cơ. |
| Bóc tách mạch vành tự phát | Là sự tác thành động mạch vành do tụ máu trong cơ, có thể xảy ra do nứt lớp nội mạc dẫn đến bóc tách trung mạc, hoặc thường gặp hơn là xuất huyết trong lớp trung mạc tự phát do nứt vỡ mạch máu nuôi cho mạch vành. |
| Bệnh lý vận mạch của mạch máu thượng tâm mạc và vi mạch vành | |
| Co thắt mạch vành thượng tâm mạc | Hẹp lòng mạch vành thượng tâm mạc khu trú hoặc lan tỏa ≥ 90% khi bơm Acetylcholine hoặc ergonovine nội mạch vành, so sánh với lúc giãn mạch khi dùng nitroglycerine; có liên quan với sự xuất hiện triệu chứng và dấu hiệu thiếu máu cục bộ trên ECG. |
| Co thắt vi mạch vành | Các thay đổi đoạn ST thiếu máu cục bộ điển hình và khởi phát đau thắt ngực khi dùng Acetylcholine hoặc erognovine nội mạch vành trong trường hợp koong có hẹp lòng ≥ 90% các mạch máu thượng tâm mạc. |
| Rối loạn dãn vi mạch vành | Giảm dự trữ dòng mạch vành (CFR < 2,0 – 2,5) trong tình huống không có hẹp mạch vành thượng tâm mạc. Tăng chỉ số kháng lực vi mạch (> 25) hoặc tăng kháng lực cơ tim (> 2,5 mmHg/cm/giây) |
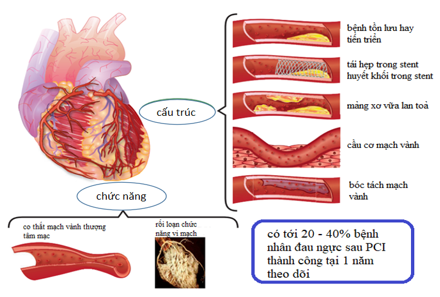
Hình 4. Thay đổi cấu trúc và chức năng tuần hoàn mạch vành trong đau ngực tái phát hay dai dẳng sau PCI (percutaneous coronary intervention) (59)
a. Hẹp mạch vành thượng tâm mạc
Huyết khối trong stent và tái hẹp trong stent là các nguyên nhân gây đau thắt ngực tái diễn không thường gặp, khi tỉ lệ huyết khối trong stent chỉ < 1% trong 1 năm sau PCI, và tăng khoảng 0,2 – 0,4% mỗi năm sau đó; và tỉ lệ tái hẹp trong stent có ý nghĩa trên lâm sàng là 5% sau 1 năm theo dõi [38]. Tỉ lệ tái phát biến cố tim mạch quan trọng do tiến triển của mạch vành là < 5% sau 1 năm sau theo dõi ở những bệnh nhân không kèm đái tháo đường [39].
Một nguyên nhân khả dĩ khác của đau thắt ngực sau PCI là xơ vữa mạch máu lan tóa gây tăng chênh lệch áp lực âm thầm trên dòng máu của mạch vành, qua chỗ bóc tách, cầu cơ, và thuyên tắc huyết khối bị bỏ sót trong lần thủ thuật đầu tiên.
b. Bệnh lý vận mạch của hệ thượng tâm mạc và vi mạch vành
Nguyên nhân chức năng của đau thắt ngực dai dẳng và tái phát sau thủ thuật PCI thành công bao gồm các bệnh lý vận mạch của hệ mạch vành thượng tâm mạc cũng như suy chức năng hệ thống vi mạch vành. Nếu chức năng vận mạch không được đánh giá kỹ lưỡng ở bệnh nhân đau thắt ngực trước khi được PCI thì không thể biết được thời điểm xuất hiện các vấn đề về chức năng này. Bản thân việc đặt stent cũng có thể gây ra hoặc làm tăng thêm suy chức năng mạch vành do làm tăng mức độ co thắt mạch vành và/hoặc suy chức năng vi mạch.
Co thắt hệ mạch vành thượng tâm mạc ở đoạn PCI hoặc ở đoạn xa là một nguyên nhân của đau thắt ngực tái phát [40]. Co thắt hệ mạch vàn thượng tâm mạc (gây hẹp > 75%) được Ong et al. [41] ghi nhận đáp ứng với acetylcholine ở liều lên đến 200 μg ở động mạch vành trái, hoặc 80 μg ở động mạch vành phải. Tình trạng co thắt này được ghi nhận ở một nửa số bệnh nhân được chụp mạch vành kiểm tra cho chỉ định đau ngực sau PCI mà không ghi nhận hẹp mạch vành gây ảnh hưởng huyết động đáng kể nào.
Suy chức năng vi mạch ở bệnh nhân đau thắt ngực sau PCI có thể do suy chức năng dãn vi mạch vành do giảm dự trữ dòng máu mạch vành (Coronary flow reserve). Trong một nghiên cứu so sánh những bệnh nhân đau thắt ngực tái diễn sau PCI với những bệnh nhân không đau ngực sau PCI, Li et al. [42] ghi nhận giảm đáng kể dòng máu mạch vành liên quan với tăng chỉ số kháng lực vi mạch khi dùng adenosine tiêm mạch (140 μg/kg/phút). Tỉ lệ suy chức năng dự trữ dòng mạch vành cũng như tăng kháng lực vi mạch còn thường gặp hơn nữa ở những bệnh nhân có kết quả nghiệm pháp gắng sức bất thường ở thời điểm theo dõi 6 tháng và 12 tháng. Một nghiên cứu của Milo et al. [43] khi so sánh với nhóm chứng cũng ghi nhận suy giảm vận tốc dòng máu mạch vành khi được kích thích ở nhánh xuống trước trái tại thời điểm 1 ngày, 3 tháng và 6 tháng sau PCI thành công. Bên cạnh đó, suy giảm càng nhiều dòng máu mạch vàh thì khả năng tái hẹp ở động mạch vành trái khi theo dõi ngày càng tăng lên [44]. Ong et al. [41] ghi nhận co thắt vi mạch vành có thể xảy ra ở khoảng 1/5 số bệnh nhân đau thắt ngực tái phát sau PCI. Cơ chế của suy chức năng vi mạch sau PCI còn chưa được hiểu rõ; tuy vậy có một số cơ chế được đề nghị như sau. Đầu tiên, khả năng thích ứng của vi mạch vành với tình trạng giảm tưới máu đoạn xa so với chỗ hẹp mạn tính có thẻ ảnh hưởng tiêu cực trên sự tái cấu trúc vi mạch và khả năng dãn nở tối đa sau khi khôi phục áp lực tưới máu sinh lý [45]. Bên cạnh đó, PCI có thể gây ra tình trạng rối loạn chức năng vi mạch do các vi huyết khối bởi các mảnh vỡ trong quá trình PCI có thể làm tắc các động mạch, tiểu động mạch và/hoặc ma mạch gây ra viêm mạch và thậm chí là tắc nghẽn mao mạch và tổn thương cơ tim [46]. Hơn nữa, tình trạng suy chức năng vi mạch có thể đã có trước khi PCI, và chỉ được bộc lộ ra sau khi PCI làm thông dòng chảy. Cuối cùng, vì tuần hoàn vi mạch vành điều hòa dòng máu cơ tim và áp lực căng thành mạch máu thượng tâm mạc, do đó sẽ dẫn đến tái cấu trúc mạch máu và hình thành mảng xơ vữa.
2. Chẩn đoán
a. Không xâm lấn
Khuyến cáo của Hội Tim châu Âu đề nghị sử dụng nghiệm pháp gắng sức khi theo dõi ở những bệnh nhân đau thắt ngực dai dẳng hoặc tái phát sau PCI, ưu tiên nghiệm pháp gắng sức có kèm với hình ảnh học [47], [7]. Do vậy, trong đa số trường hợp đau thắt ngực sau PCI, phương tiện chẩn đoán được dùng đầu tiên là các nghiệm pháp gắng sức không xâm lấn.
Nghiệm pháp gắng sức ECG được dùng để hỗ trợ chẩn đoán và tiên lượng bệnh nhân bệnh tim thiếu máu cục bộ mạn đã được chứng minh có lợi trong hướng dẫn điều trị ban đầu [7]. Tuy vậy, vai trò của nghiệm pháp gắng sức ECG đơn độc sau PCI còn nhiều tranh cãi do giá trị tiên đoán dương hẹp mạch vành có tắc nghẽn/tái hẹp chỉ ở mức trung bình cao [48]. Vấn đề chủ yếu là vì một bản gắng sức ECG dương tính có thể do bệnh lý mạch vành tắc nghẽn và do các cơ chế chức năng khác (như suy chức năng vi mạch, co mạch…). Dù vậy, trong bối cảnh nào thì bằng chứng của đau thắt ngực khi gắng sức và các biến đổi ECG tương ứng với thiếu máu cục bộ cũng cho bằng chứng khách quan để tiếp tục các bước tiếp theo.
Tính ứng dụng tương tự cũng dành cho hình ảnh tái tưới máu cơ tim khi gắng sức qua CT bức xạ đơn photon (SPECT). Chụp CT phát xạ positron (PET) là một kỹ thuật không xâm lấn, chính xác và có thể lặp lại được trong đánh giá cả dòng máu cơ tim (MBF – myocardial blood flow) toàn bộ và từng vùng (mL/g/phút) cũng như dự trữ dòng máu cơ tim. PET đo MBF bằng cánh theo dõi liên tục nồng độ phóng xạ đường tĩnh mạch trong dòng máu và trong cơ tim. Động học của chất phóng xạ được hấp thụ vào trong cơ tim được đưa vào đường cong thời gian – hoạt tính trong thất trái và trong cơ tim; khi đưa đường cong này vào công thức có sẵn sẽ ước tính được MBF (đơn vị mL/phút g-1 cơ tim). Hiện tại, việc phân biệt giữa các bất thường về cấu trúc và chức năng gây ra giảm MBF khi kích thích còn chưa thể xác định rõ với PET. Hai yếu tố này thường chồng lấp lên nhau, và chỉ có các can thiệp đặc hiệu nhắm đến đảo ngược suy giảm dòng máu và CFR mới xác định được cơ chế nào là cơ chế chính trong suy chức năng vi mạch [49], [50], [51]. Các nghiên cứu lâm sàng sử dụng PET đã cung cấp những kiến thức mới về suy chức năng vi mạch trong nhiều bối cảnh lâm sàng khác nhau. VÍ dụ, suy giảm CFR (do tăng MBF lúc nghỉ và giảm MBF lúc kích thích) được ghi nhận ở những bệnh nhân tăng huyết áp [52], [53]. Điều trị với ức chế men chuyển [53], [54] hoặc chẹn thụ thể angiotensin [55] có thể giúp cải thiện cả MBF lúc nghỉ và lúc kích thích ở các bệnh nhân này. Một số nghiên cứu gần đây gợi ý vai trò phân biệt nguyên nhân thiếu máu cục bộ ở thượng tâm mạc và vi mạch vành bằng chụp cộng hưởng từ cơ tim [17].
Siêu âm tim gắng sức (bằng thể lực hoặc bằng thuốc) có thể có ích trong phân biệt cơ chế mạch vành thượng tâm mạc hay vi mạch. Theo đó, giữa đau thắt ngực cùng thay đổi thiếu máu cục bộ trên ECG và sự không tương thích của việc không có rối loạn vận động vùng tương ứng là một biểu hiện điển hình của đau thắt ngực vi mạch vành [56], [57]. Ngược lại, những bệnh nhân có đau thắt ngực do nguyên nhân từ mạch vành thượng tâm mạc thì sẽ có các rối loạn vận động vùng trước khi có các thay đổi trên điện học, và cả 2 biểu hiện này đều có trước khi triệu chứng khởi phát [56].
Hình 5 tóm lược các bước chẩn đoán ở bệnh nhân đau thắt ngực tái phát/dai dẳng sau PCI.
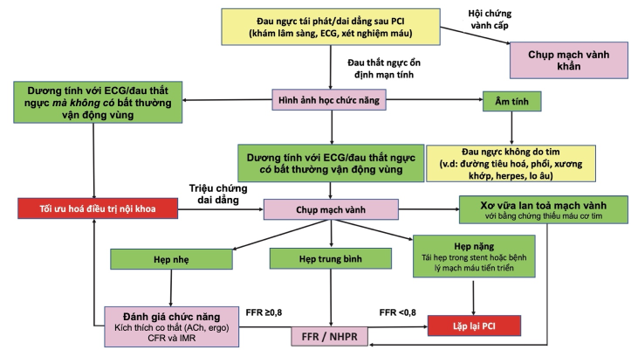
Hình 5. Lưu đồ chẩn đoán ở bệnh nhân đau thắt ngực tái phát/dai dẳng sau can thiệp mạch vành
Ach: Acetylcholine, Ergo: ergonovine maleate, CFR: coronary flow reserve, FFR: fractional flow reserve, IMR: index of microvascular resistance, NHPR: non-hyperemic pressure ratio (59)
b. Xâm lấn
Khuyến cáo Hội Tim châu Âu hiện đề nghị chụp mạch vành xâm lấn ở những bệnh nhân bệnh mạch vành mạn tính có bằng chứng thiếu máu cục bộ nguy cơ cao (> 10% cơ tim) trên hình ảnh học gắng sức (Class I, chứng cứ C) . Tuy vậy, ngưỡng này ở những bệnh nhân sau PCI nguy cơ cao có lẽ nên thấp hơn (Class IIb, chứng cứ C) . Vì giá trị tiên đoán âm của một nghiệm pháp không xâm lấn là khá thấp, hướng tiếp cận xâm lấn nên được cân nhắc một cách độc lập với kết quả của các nghiệm pháp không xâm lấn, đặc biệt trong trường hợp tiền sử bệnh nhân bị tái phát đau thắt ngực nhiều lần. Chụp mạch vành xâm lấn sẽ là cơ hội đánh giá cả bất thường cấu trúc và chức năng. Thiếu máu cục bộ nhiều vùng (cả xuyên thành và từng vùng) có thể không được phát hiện bởi các cận lâm sàng không xâm lấn [33]. Hơn nữa, các bệnh nhân đau thắt ngực dai dẳng hoặc tái phát và chưa được tái tưới máu hoàn toàn cũng cần được đánh giá lại nếu việc tái thông hoàn toàn là khả thi. Trong trường hợp hẹp trung bình, việc đo FFR hay NHPR có thể có ích để xác định sang thương hẹp có ý nghĩa về mặt huyết động.
Chụp mạch vành còn được chỉ định trong trường hợp đau thắt ngực lúc nghỉ, dù đã điều trị nội khoa tối ưu hay nghiệm pháp không xâm lấn âm tính. Tình huống này là chỉ dấu mạnh mẽ của tình trạng rối loạn chức năng mạch vành. Ở nhóm bệnh nhân này, việc chụp mạch vành có thể giúp xác định các mảng xơ vữa không ổn định, và được đánh giá thêm bằng các hình ảnh học nội mạch (như OCT, siêu âm nội mạch,…). Nếu không có các mảng xơ vữa không ổn định, việc dánh giá chức năng vận mạch của hệ mạch vành thượng tâm mạc và vi mạch vành có thể cho biết các nguyên nhân chức năng của tình trạng đau thắt ngực dai dẳng. Tức dù trong bối cảnh nào, việc chụp mạch vành cũng đều cần thiết để xác định nguyên nhân đau thắt ngực.
Đến nay, nghiên cứu CorMicA (Coronary Microvascular Angina) [58] là nghiên cứu đầu tiên chứng minh được hiệu quả trong chẩn đoán, kinh tế và y tế của thủ thuật chẩn đoán xâm lấn có kết hợp giữa một đây dẫn với một nghiệm pháp đánh giá hoạt tính vận mạch của mạch vành, từ đó giúp chẩn đoán và điều trị bệnh nhân đau thắt ngực không có bệnh mạch vành tắc nghẽn. Nghiên cứu này đánh giá kết cục chính dựa trên thang điểm Seattle Angina Questionnaire vào thời điểm 6 tháng (cải thiện trung bình 11,7 điểm tổng SAQ, 95% CI: 5,0 – 18,4; p = 0.001).
V. Kết luận
Chẩn đoán và điều trị tình trạng đau thắt ngực và thiếu máu cục bộ có một số điểm cần được nhấn mạnh. Đầu tiên, cần nghĩ đến các nguyên nhân khác trong đánh giá đau thắt ngực và thiếu máu cục bộ, không chỉ dừng lại ở bệnh mạch vành tắc nghẽn thượng tâm mạc. Các cận lâm sàng đánh giá chức năng mạch vành là công cụ hữu ích trong bức tranh toàn diện bệnh mạch vành mạn. Bên cạnh đó, điều trị nội khoa tối ưu cần dựa trên nền tảng kiểm soát các yếu tố nguy cơ chặt chẽ và thay đổi lối sống tích cực. Điều trị dùng thuốc cần được theo dõi sát và chỉnh thuốc tích cực nếu cần thiết. Cuối cùng, đau thắt ngực sau PCI hiện diện với tỉ lệ cao và ảnh hưởng đáng kể đến chất lượng cuộc sống bệnh nhân. Việc chẩn đoán xác định cơ chế gây đau ngực sau PCI là điều tối quan trọng để có được kế hoạch quản lý hiệu quả.
Tài liệu tham khảo
- Collaborators P. Primary coronary angioplasty compared with intravenous thrombolytic therapy for acute myocardial infarction: six-month follow up and analysis of individual patient data from randomized trials. Age (y). 2003;50(517):1.0.
- Kirov H, Caldonazo T, Rahouma M, Robinson NB, Demetres M, Serruys PW, et al. A systematic review and meta-analysis of percutaneous coronary intervention compared to coronary artery bypass grafting in non-ST-elevation acute coronary syndrome. Scientific Reports. 2022;12(1):5138.
- Boden WE, O’Rourke RA, Teo KK, Hartigan PM, Maron DJ, Kostuk WJ, et al. Optimal medical therapy with or without PCI for stable coronary disease. New England journal of medicine. 2007;356(15):1503-16.
- Group BDS. A randomized trial of therapies for type 2 diabetes and coronary artery disease. New England Journal of Medicine. 2009;360(24):2503-15.
- Dourado LOC, Poppi NT, Adam EL, Leite TNP, Pereira AdC, Krieger JE, et al. The effectiveness of intensive medical treatment in patients initially diagnosed with refractory angina. International Journal of Cardiology. 2015;186:29-31.
- Boden WE, Kaski JC, Al-Lamee R, Weintraub WS. What constitutes an appropriate empirical trial of antianginal therapy in patients with stable angina before referral for revascularisation? The Lancet. 2022;399(10325):691-4.
- Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes: The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). European heart journal. 2020;41(3):407-77.
- Members WC, Gulati M, Levy PD, Mukherjee D, Amsterdam E, Bhatt DL, et al. 2021 AHA/ACC/ASE/CHEST/SAEM/SCCT/SCMR guideline for the evaluation and diagnosis of chest pain: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Journal of the American College of Cardiology. 2021;78(22):e187-e285.
- Maron DJ, Hochman JS, Reynolds HR, Bangalore S, O’Brien SM, Boden WE, et al. Initial invasive or conservative strategy for stable coronary disease. New England Journal of Medicine. 2020;382(15):1395-407.
- The S. CT coronary angiography in patients with suspected angina due to coronary heart disease (SCOT-HEART): an open-label, parallel-group, multicentre trial. The Lancet. 2015;385(9985):2383-91.
- Boden WE, Marzilli M, Crea F, Mancini GJ, Weintraub WS, Taqueti VR, et al. Evolving management paradigm for stable ischemic heart disease patients: JACC Review Topic of the Week. Journal of the American College of Cardiology. 2023;81(5):505-14.
- Boden WE, Stone PH. To stent or not to stent? Treating angina after ISCHEMIA—why a conservative approach with optimal medical therapy is the preferred initial management strategy for chronic coronary syndromes: insights from the ISCHEMIA trial. European Heart Journal. 2021;42(14):1394-400.
- Ong P, Camici PG, Beltrame JF, Crea F, Shimokawa H, Sechtem U, et al. International standardization of diagnostic criteria for microvascular angina. International journal of cardiology. 2018;250:16-20.
- Hulten E, Di Carli MF. FFRCT: Solid PLATFORM or thin ice? : American College of Cardiology Foundation Washington, DC; 2015. p. 2324-8.
- Kern MJ, Lerman A, Bech J-W, De Bruyne B, Eeckhout E, Fearon WF, et al. Physiological assessment of coronary artery disease in the cardiac catheterization laboratory: a scientific statement from the American Heart Association Committee on Diagnostic and Interventional Cardiac Catheterization, Council on Clinical Cardiology. Circulation. 2006;114(12):1321-41.
- Murthy VL, Naya M, Taqueti VR, Foster CR, Gaber M, Hainer J, et al. Effects of sex on coronary microvascular dysfunction and cardiac outcomes. Circulation. 2014;129(24):2518-27.
- Thomson LE, Wei J, Agarwal M, Haft-Baradaran A, Shufelt C, Mehta PK, et al. Cardiac magnetic resonance myocardial perfusion reserve index is reduced in women with coronary microvascular dysfunction: a National Heart, Lung, and Blood Institute-sponsored study from the Women’s Ischemia Syndrome Evaluation. Circulation: Cardiovascular Imaging. 2015;8(4):e002481.
- Galiuto L, Sestito A, Barchetta S, Sgueglia GA, Infusino F, La Rosa C, et al. Noninvasive evaluation of flow reserve in the left anterior descending coronary artery in patients with cardiac syndrome X. The American journal of cardiology. 2007;99(10):1378-83.
- Barbato E, Aarnoudse W, Aengevaeren WR, Werner G, Klauss V, Bojara W, et al. Validation of coronary flow reserve measurements by thermodilution in clinical practice. European Heart Journal. 2004;25(3):219-23.
- Wei J, Mehta PK, Johnson BD, Samuels B, Kar S, Anderson RD, et al. Safety of coronary reactivity testing in women with no obstructive coronary artery disease: results from the NHLBI-sponsored WISE (Women’s Ischemia Syndrome Evaluation) study. JACC: Cardiovascular Interventions. 2012;5(6):646-53.
- Fearon WF, Balsam LB, Farouque HO, Robbins RC, Fitzgerald PJ, Yock PG, Yeung AC. Novel index for invasively assessing the coronary microcirculation. Circulation. 2003;107(25):3129-32.
- Verhoeff B-J, van de Hoef TP, Spaan JA, Piek JJ, Siebes M. Minimal effect of collateral flow on coronary microvascular resistance in the presence of intermediate and noncritical coronary stenoses. American Journal of Physiology-Heart and Circulatory Physiology. 2012;303(4):H422-H8.
- Fearon WF, Kobayashi Y. Invasive assessment of the coronary microvasculature: the index of microcirculatory resistance. Circulation: Cardiovascular Interventions. 2017;10(12):e005361.
- Gibson CM, Cannon CP, Daley WL, Dodge Jr JT, Alexander B, Marble SJ, et al. TIMI frame count: a quantitative method of assessing coronary artery flow. Circulation. 1996;93(5):879-88.
- Kunadian V, Harrigan C, Zorkun C, Palmer AM, Ogando KJ, Biller LH, et al. Use of the TIMI frame count in the assessment of coronary artery blood flow and microvascular function over the past 15 years. Journal of thrombosis and thrombolysis. 2009;27:316-28.
- Dutta U, Sinha A, Demir OM, Ellis H, Rahman H, Perera D. Coronary slow flow is not diagnostic of microvascular dysfunction in patients with angina and unobstructed coronary arteries. Journal of the American Heart Association. 2023;12(1):e027664.
- Ben‐Yehuda O, Kazi DS, Bonafede M, Wade SW, Machacz SF, Stephens LA, et al. Angina and associated healthcare costs following percutaneous coronary intervention: a real‐world analysis from a multi‐payer database. Catheterization and Cardiovascular Interventions. 2016;88(7):1017-24.
- Crea F, Bairey Merz CN, Beltrame JF, Berry C, Camici PG, Kaski JC, et al. Mechanisms and diagnostic evaluation of persistent or recurrent angina following percutaneous coronary revascularization. European heart journal. 2019;40(29):2455-62.
- Kaski J-C, Crea F, Gersh BJ, Camici PG. Reappraisal of ischemic heart disease: fundamental role of coronary microvascular dysfunction in the pathogenesis of angina pectoris. Circulation. 2018;138(14):1463-80.
- Al-Lamee R, Jacobs AK. ISCHEMIA trial: was it worth the wait? Circulation. 2020;142(6):517-9.
- Ferrari R, Camici PG, Crea F, Danchin N, Fox K, Maggioni AP, et al. A’diamond’approach to personalized treatment of angina. Nature Reviews Cardiology. 2018;15(2):120-32.
- Al-Lamee R, Thompson D, Dehbi H-M, Sen S, Tang K, Davies J, et al. Percutaneous coronary intervention in stable angina (ORBITA): a double-blind, randomised controlled trial. The Lancet. 2018;391(10115):31-40.
- Niccoli G, Montone RA, Lanza GA, Crea F. Angina after percutaneous coronary intervention: the need for precision medicine. International journal of cardiology. 2017;248:14-9.
- Gaglia Jr MA, Torguson R, Lipinski MJ, Gai J, Koifman E, Kiramijyan S, et al. Frequency of angina pectoris after percutaneous coronary intervention and the effect of metallic stent type. The American Journal of Cardiology. 2016;117(4):526-31.
- Tonino PA, De Bruyne B, Pijls NH, Siebert U, Ikeno F, vant Veer M, et al. Fractional flow reserve versus angiography for guiding percutaneous coronary intervention. New England Journal of Medicine. 2009;360(3):213-24.
- Stone GW, Ellis SG, Gori T, Metzger DC, Stein B, Erickson M, et al. Blinded outcomes and angina assessment of coronary bioresorbable scaffolds: 30-day and 1-year results from the ABSORB IV randomised trial. The Lancet. 2018;392(10157):1530-40.
- Hlatky MA, Hernandez JB. Angina and Associated Healthcare Costs Following Percutaneous Coronary Intervention: A Real-World.
- Byrne RA, Joner M, Kastrati A. Stent thrombosis and restenosis: what have we learned and where are we going? The Andreas Grüntzig Lecture ESC 2014. European heart journal. 2015;36(47):3320-31.
- Stone GW, Maehara A, Lansky AJ, De Bruyne B, Cristea E, Mintz GS, et al. A prospective natural-history study of coronary atherosclerosis. New England journal of medicine. 2011;364(3):226-35.
- Gregorini L, Fajadet J, Robert G, Cassagneau B, Bernis M, Marco J. Coronary vasoconstriction after percutaneous transluminal coronary angioplasty is attenuated by antiadrenergic agents. Circulation. 1994;90(2):895-907.
- Ong P, Athanasiadis A, Perne A, Mahrholdt H, Schäufele T, Hill S, Sechtem U. Coronary vasomotor abnormalities in patients with stable angina after successful stent implantation but without in-stent restenosis. Clinical Research in Cardiology. 2014;103:11-9.
- Li Y, Yang D, Lu L, Wu D, Yao J, Hu X, et al. Thermodilutional confirmation of coronary microvascular dysfunction in patients with recurrent angina after successful percutaneous coronary intervention. Canadian Journal of Cardiology. 2015;31(8):989-97.
- Milo M, Nerla R, Tarzia P, Infusino F, Battipaglia I, Sestito A, et al. Coronary microvascular dysfunction after elective percutaneous coronary intervention: correlation with exercise stress test results. International journal of cardiology. 2013;168(1):121-5.
- De Vita A, Milo M, Sestito A, Lamendola P, Lanza GA, Crea F. Association of coronary microvascular dysfunction with restenosis of left anterior descending coronary artery disease treated by percutaneous intervention. International journal of cardiology. 2016;219:322-5.
- Galassi AR, Tomasello SD, Crea F, Costanzo L, Campisano MB, Marzá F, Tamburino C. Transient impairment of vasomotion function after successful chronic total occlusion recanalization. Journal of the American College of Cardiology. 2012;59(8):711-8.
- Selvanayagam JB, Cheng AS, Jerosch-Herold M, Rahimi K, Porto I, Van Gaal W, et al. Effect of distal embolization on myocardial perfusion reserve after percutaneous coronary intervention: a quantitative magnetic resonance perfusion study. Circulation. 2007;116(13):1458-64.
- Members TF, Montalescot G, Sechtem U, Achenbach S, Andreotti F, Arden C, et al. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. European heart journal. 2013;34(38):2949-3003.
- Henderson RA, O’Flynn N. Management of stable angina: summary of NICE guidance. Heart. 2012;98(6):500-7.
- Kaufmann PA, Gnecchi-Ruscone T, di Terlizzi M, Schäfers KP, Lüscher TF, Camici PG. Coronary heart disease in smokers: vitamin C restores coronary microcirculatory function. Circulation. 2000;102(11):1233-8.
- Danad I, Raijmakers PG, Appelman YE, Harms HJ, de Haan S, van den Oever ML, et al. Coronary risk factors and myocardial blood flow in patients evaluated for coronary artery disease: a quantitative [15 O] H 2 O PET/CT study. European journal of nuclear medicine and molecular imaging. 2012;39:102-12.
- Recio-Mayoral A, Rimoldi OE, Camici PG, Kaski JC. Inflammation and microvascular dysfunction in cardiac syndrome X patients without conventional risk factors for coronary artery disease. JACC: Cardiovascular Imaging. 2013;6(6):660-7.
- Di Carli MF, Charytan D, McMahon GT, Ganz P, Dorbala S, Schelbert HR. Coronary circulatory function in patients with the metabolic syndrome. Journal of nuclear medicine. 2011;52(9):1369-77.
- Neglia D, Fommei E, Varela-Carver A, Mancini M, Ghione S, Lombardi M, et al. Perindopril and indapamide reverse coronary microvascular remodelling and improve flow in arterial hypertension. Journal of hypertension. 2011;29(2):364-72.
- Akinboboye OO, Chou R-L, Bergmann SR. Augmentation of myocardial blood flow in hypertensive heart disease by angiotensin antagonists: a comparison of lisinopril and losartan. Journal of the American College of Cardiology. 2002;40(4):703-9.
- Higuchi T, Abletshauser C, Nekolla SG, Schwaiger M, Bengel FM. Effect of the angiotensin receptor blocker Valsartan on coronary microvascular flow reserve in moderately hypertensive patients with stable coronary artery disease. Microcirculation. 2007;14(8):805-12.
- Maseri A, Crea F, Kaski JC, Crake T. Mechanisms of angina pectoris in syndrome X. Elsevier; 1991. p. 499-506.
- Cortigiani L, Rigo F, Gherardi S, Bovenzi F, Picano E, Sicari R. Prognostic value of Doppler echocardiographic-derived coronary flow velocity reserve of left anterior descending artery in octogenarians with stress echocardiography negative for wall motion criteria. European Heart Journal-Cardiovascular Imaging. 2015;16(6):653-60.
- Ford TJ, Stanley B, Good R, Rocchiccioli P, McEntegart M, Watkins S, et al. Stratified medical therapy using invasive coronary function testing in angina: the CorMicA trial. Journal of the American College of Cardiology. 2018;72(23 Part A):2841-55.
- Crea. F et al. Mechanisms and diagnostic evaluation of persistent or recurrent angina following percutaneous coronary revascularization. European Heart Journal (2019) 40, 2455–2462







