1. ĐẠI CƯƠNG
Bệnh tim mạch vẫn còn là nguyên nhân tử vong hàng đầu trên thế giới. Tại Hoa Kỳ, 1/3 số trường hợp tử vong là do bệnh tim mạch và ước đoán có hơn 1 triệu người nhồi máu cơ tim mỗi năm [1].
ThS.BS TRẦN CÔNG DUY
TS.BS HOÀNG VĂN SỸ
Bộ môn Nội Tổng Quát
Đại học Y Dược TP. Hồ Chí Minh
Sau nhồi máu cơ tim, gần 1/3 bệnh nhân sẽ tiến triển đến suy tim tâm thu trong vòng 5 năm [2]. Đau thắt ngực ổn định (thường được đề cập với thuật ngữ “bệnh tim thiếu máu cục bộ ổn định”) ảnh hưởng 7,8 triệu người ở Hoa Kỳ và hơn 50% số bệnh nhân đó (4,1 triệu) là phụ nữ [1]. Khoảng nửa triệu bệnh nhân đau thắt ngực mới mắc xảy ra hàng năm [1]. Ngoài bệnh suất và tử suất đáng kể, chi phí kinh tế khổng lồ liên quan với bệnh động mạch vành. Nghiên cứu WISE được thực hiện để đánh giá thiếu máu cục bộ cơ tim có triệu chứng ở phụ nữ với quan tâm đặc biệt đến những bệnh nhân đau thắt ngực nhưng không có hẹp động mạch vành thượng tâm mạc [3]. Trong nghiên cứu đoàn hệ này, 62% bệnh nhân nữ thiếu máu cục bộ cơ tim ở nghiệm pháp không xâm lấn có bệnh động mạch vành không do tắc nghẽn và trong số đó, 20% cần nhập viện vì đau ngực trong vòng 5 năm từ khi chụp mạch vành lần đầu [4]. Phụ nữ với bệnh động mạch vành không do tắc nghẽn trải qua chụp mạch vành hầu như gấp đôi bệnh nhân nữ bệnh một nhánh mạch vành và có mức độ tàn tật tương tự và gánh nặng đau thắt ngực cao hơn [4]. Chi phí y khoa suốt đời đối với bệnh nhân nữ mắc bệnh động mạch vành không do tắc nghẽn trong nghiên cứu WISE được ước tính là 770.000 đô la Mỹ [4]. Gần một nửa bệnh nhân được thông tim để đánh giá đau thắt ngực không có hoặc có ít tắc nghẽn động mạch vành [5]. Ở bệnh nhân nữ dưới 60 tuổi, tỉ lệ tăng đến gần như 80% [6]. Những bệnh nhân này là một thử thách cho việc chẩn đoán nguyên nhân và điều trị thành công đau thắt ngực.
Thuật ngữ “hội chứng X” và “đau thắt ngực do bệnh vi mạch vành” (hoặc “đau thắt ngực do vi mạch”) thường được sử dụng thay thế nhau. Thực ra, hội chứng X bao gồm tất cả bệnh nhân đau thắt ngực nhưng động mạch vành bình thường khi chụp mạch vành. Đau thắt ngực do bệnh vi mạch vành là một phân nhóm bệnh nhân chuyên biệt của hội chứng X có rối loạn chức năng vi mạch và/hoặc rối loạn chức năng nội mô. Hệ vi mạch vành gồm tiểu động mạch, tiền tiểu động mạch và mao mạch. Các mạch máu này không được thấy trực tiếp trên chụp mạch vành hoặc chụp cắt lớp điện toán. Chẩn đoán đau thắt ngực do bệnh vi mạch vành dựa vào phối hợp đau thắt ngực điển hình, chứng cứ của thiếu máu cục bộ cơ tim trên điện tâm đồ hoặc nghiệm pháp gắng sức, chụp động mạch vành bình thường, loại trừ co thắt động mạch vành thượng tâm mạc và dự trữ lưu lượng mạch vành < 2,5.
Trước đây, các bệnh nhân đau thắt ngực do bệnh vi mạch vành được nghĩ là không tăng nguy cơ tim mạch nhưng ngày nay chúng ta biết rằng đau thắt ngực ở những bệnh nhân bệnh tim thiếu máu cục bộ không có tắc nghẽn động mạch vành có tiên lượng xấu [7] như trình bày ở Hình 1. Tương tự, ở những đối tượng không có bệnh động mạch vành do tắc nghẽn khi được đánh giá không xâm lấn, những người có rối loạn chức năng vi mạch vành (được định nghĩa là dự trữ lưu lượng mạch vành (coronary flow reserve [CFR]) ước tính bằng phương pháp không xâm lấn < 2,5) có xác suất biến cố tim mạch nặng gấp đôi trong 3 năm tiếp theo [8].
2. SINH LÝ BỆNH
Ở những bệnh nhân đau ngực nhưng không có bệnh động mạch vành do tắc nghẽn, nguyên nhân bao gồm co thắt động mạch vành, bệnh vi mạch vành, đau ngực không do tim hoặc phối hợp các nguyên nhân đó. Đau thắt ngực do bệnh vi mạch vành có thể do bệnh cấu trúc, suy giảm chức năng hoặc chèn ép từ bên ngoài mạch vành.
Thiếu máu cục bộ cơ tim xảy ra khi lưu lượng máu mạch vành không thể cung cấp đầy đủ oxy nhu cầu chuyển hóa cơ tim. Bệnh động mạch vành cản trở cung cấp máu cho mô cơ tim trong những tình huống tăng nhu cầu chuyển hóa dẫn đến thiếu máu cục bộ cơ tim và đau thắt ngực [9]. Các tổn thương trong các nhánh động mạch vành lớn ảnh hưởng lưu lượng máu ở vùng được cấp máu bởi động mạch thượng tâm mạc, dẫn đến các thay đổi thiếu máu cục bộ có thể phát hiện được như thay đổi đoạn ST trên ECG, rối loạn vận động vùng trên siêu âm tim, khiếm khuyết tưới máu khi gắng sức trên MRI tim hoặc xạ hình tưới máu cơ tim và mảng xơ vữa gây tắc nghẽn trên chụp cắt lớp điện toán mạch vành. Ý nghĩa huyết động của các tổn thương mạch vành thượng tâm mạc có thể được đo bằng phân suất dự trữ lưu lượng mạch vành (fractional flow reserve [FFR]) được định nghĩa là tỉ số giữa áp lực đoạn xa và đoạn gần tổn thương, FFR bằng 1 cho thấy không có bệnh và FFR < 0,80 là bất thường có ý nghĩa [10-12]. Ngược lại, các tổn thương vi mạch vành ảnh hưởng lưu lượng máu ở các phần của vi tuần hoàn, dẫn đến các vùng cơ tim thiếu máu cục bộ nhỏ riêng biệt có thể hoặc không thể được quan sát trên các nghiệm pháp chẩn đoán truyền thống dành cho bệnh thượng tâm mạc. Do đó, các chỉ số lưu lượng khác được sử dụng để đánh giá lưu lượng máu và kháng lực vi mạch vành như CFR, chỉ số kháng lực vi tuần hoàn (index of microcirculatory resistance [IMR]) và kháng lực vi tuần hoàn tăng tưới máu (hyperemic microvascular resistance [HMR]).
Hiệu năng của vi tuần hoàn phụ thuộc vào tính toàn vẹn của nội mô cũng như dự trữ tuần hoàn bàng hệ độc lập. Cốt lõi của chức năng mạch máu bình thường là khả năng của tế bào nội mô sản xuất nitric oxide để dãn mạch trong việc đáp ứng với lưu lượng. Rối loạn chức năng nội mô được xem là con đường chung cuối cùng mà các yếu tố nguy cơ kinh điển ảnh hưởng lên hệ mạch máu trong tiến trình xơ vữa động mạch. Các tế bào nội mô đóng vai trò then chốt trong cân bằng nội mô mạch máu bằng cách tiết ra các chất không những điều hòa trương lực mạch máu, hoạt tính tiểu cầu và các yếu tố đông máu mà còn ảnh hưởng viêm mạch máu và sự di chuyển tế bào. Do đó, sự suy giảm nội mô và hệ vi mạch dẫn đến xơ vữa động mạch, gây ra các biến cố tim mạch nặng [13-15]. Bệnh co thắt mạch vành được mô tả lần đầu bởi Prinzmetal và cộng sự [16]. Các bệnh nhân đau ngực không liên quan gắng sức có chu kỳ nhưng nhìn chung dung nạp gắng sức bình thường. Ở loại “đau thắt ngực biến thái” này, sự co thắt cơ trơn dẫn đến co thắt động mạch và thiếu máu cục bộ cơ tim có ý nghĩa lâm sàng [17]. Co thắt mạch vành có thể được quan sát ở bệnh nhân rối loạn chức năng nội mô do sự co thắt động mạch nghịch lý đáp ứng lại sự tương tác acetylcholine với các thụ thể muscarinic của tế bào cơ trơn trong môi trường giảm nitric oxide khả dụng [18].
3. CHẨN ĐOÁN
Chẩn đoán đau thắt ngực do bệnh vi mạch mành là một thách thức. Chẩn đoán bệnh lý này có thể đặt ra nếu bệnh nhân đau thắt ngực khi gắng sức có động mạch vành bình thường hoặc không tắc nghẽn trên chụp mạch vành (chụp đa cắt lớp điện toán mạch vành hoặc chụp động mạch vành cản quang), nhưng có các dấu hiệu khách quan của thiếu máu cục bộ do gắng sức (ST chênh xuống trên điện tâm đồ gắng sức, thay đổi thiếu máu cục bộ trên hình ảnh tưới máu cơ tim) [71]. Siêu âm tim gắng sức Dobutamin thường không gây ra rối loạn vận động vùng. Các phương pháp chẩn đoán xâm lấn và không xâm lấn sẽ được trình bày dưới đây. Điều quan trọng là cần phân biệt đau thắt ngực do vi mạch với các nguyên nhân đau ngực không do tim. Co thắt động mạch vành lan tỏa như đoạn xa động mạch vành thượng tâm mạc có thể lan đến hệ vi mạch và được chứng minh khi tiêm acetylcholine vào mạch vành ở một số trường hợp bệnh vi mạch điển hình.
3.1 Lâm sàng
Các bệnh nhân đau ngực phải được đánh giá hội chứng mạch vành cấp và các bệnh đe dọa tính mạng khác như phình bóc tách động mạch chủ và thuyên tắc phổi. Trong khi đau thắt ngực cũng có thể được phân biệt với các nguyên nhân đau ngực không do tim khác bằng cách khai thác bệnh sử và khám thực thể cẩn thận, chẩn đoán bệnh động mạch vành có thể phức tạp do biểu hiện không điển hình. Đặc biệt phụ nữ có thể có các triệu chứng tương đương đau ngực [19] như khó thở, yếu, mệt mỏi, vã mồi hôi, choáng váng, buồn nôn và khó tiêu. Các chẩn đoán phức tạp khác là những nguyên nhân khác của bệnh mạch vành bao gồm bệnh động mạch vành do xơ vữa động mạch gây tắc nghẽn, co thắt động mạch vành và bệnh vi mạch do rối loạn chức năng vi mạch/nội mô. Dựa vào nghiên cứu Framingham Heart Study, nam giới biểu hiện bệnh động mạch vành lần đầu tiên như nhồi máu cơ tim (43% biến cố mạch vành), trong khi hơn một nửa bệnh nhân nữ có bệnh động mạch vành biểu hiện lần đầu với cơn đau thắt ngực; ở 85% bệnh nhân nữ, đau thắt ngực không biến chứng nhồi máu cơ tim [20]. Nhồi máu cơ tim có thể không được nhận biết ở nữ hơn nam (34% so với 27%) [20]. Bệnh nhân nữ mắc bệnh tim thiếu máu cục bộ ổn định trong tình huống ngoại trú có thể lớn tuổi hơn và có các tình trạng đồng mắc như đái tháo đường, tăng huyết áp và suy tim sung huyết; nam có thể đã có nhồi máu cơ tim hoặc tái thông mạch vành bằng phẫu thuật bắc cầu mạch vành hoặc can thiệp mạch vành qua da [21]. Điều này cho thấy rằng phụ nữ thường bị bỏ soát chẩn đoán hoặc sinh lý bệnh của bệnh có sự khác nhau về giới tính hoặc phối hợp cả hai lý do này. Bệnh nhân nữ cũng có thể có chất lượng cuộc sống thấp hơn [21]. Sự khác nhau về giới tính trong sinh lý bệnh được ủng hộ bởi dữ liệu từ nghiên cứu WISE. Trong nghiên cứu WISE, khi chụp động mạch vành, dưới 40% bệnh nhân nữ đau ngực và thiếu máu cục bộ cơ tim trên nghiệm pháp không xâm lấn có bệnh động mạch vành thượng tâm mạc do tắc nghẽn [22].
3.2 Cận lâm sàng
Trong khi tiêu chuẩn vàng hiện tại để đánh giá bệnh vi mạch vành tiếp tục là nghiệm pháp sinh lý mạch vành xâm lấn được thực hiện trong phòng thông tim, một số kỹ thuật không xâm lấn gồm siêu âm tim, MRI, CT và các nghiệm pháp gắng sức chức năng đã nổi lên có thể cung cấp nhiều thông tin chẩn đoán hữu ích cho các bệnh nhân bệnh vi mạch vành (Bảng 1). CFR được đo trong phòng thông tim là tỉ số giữa vận tốc đỉnh trung bình lúc tăng tưới máu so với ban đầu [24,25]. CFR < 2,5 giúp chẩn đoán bệnh vi mạch vành [26].
3.2.1 Các phương pháp chẩn đoán không xâm lấn
Siêu âm timqua thành ngực có thể đánh giá CFR thông qua đo Doppler xung. Một số nghiên cứu đã công nhận siêu âm tim Doppler qua thành ngực là một công cụ không xâm lấn để đánh giá CFR ở các bệnh nhân bệnh vi mạch vành [27-29]. Gần đây, ở 144 bệnh nhân đái tháo đường típ 2 được theo dõi trung bình 29 tháng (14 – 44 tháng), CFR ≤ 2,0 là một yếu tố tiên lượng độc lập (tỉ số nguy hại HR: 11,2; KTC 95%: 3,1 – 40,9) với tỉ lệ biến cố (tử vong và nhồi máu cơ tim) 13,9% ở bệnh nhân với CFR ≤ 2,0 so với 2,0% ở những người CFR > 2,0 [30]. Các chỉ số Doppler xung có thể ước đoán CFR không xâm lấn chính xác, tiên lượng các bệnh nhân bệnh vi mạch vành và đánh giá đáng tin cậy đáp ứng điều trị tiếp theo mà không cho bệnh nhân phơi nhiễm với bức xạ ion hóa; tuy nhiên, siêu âm tim qua thành ngực có thể có cửa sổ siêu âm đầy đủ chỉ ở 70-80% bệnh nhân.
Cộng hưởng từtim mạch tưới máu cơ tim với chất cản từ gadolinium cho phép đánh giá lưu lượng máu xuyên thành và dưới nội mạc [31]. Chỉ số dự trữ tưới máu cơ tim là tỉ số lưu lượng máu cơ tim lúc tăng tưới máu so với lúc nghỉ và được sử dụng trong MRI tim thay thế cho CFR [24,25]. Một số nghiên cứu nhỏ cho thấy rằng các bệnh nhân có khiếm khuyết tưới máu dưới nội mạc do gắng sức có thể có các nghiệm pháp chức năng vi mạch và nội mô bất thường hơn những người không có các khiếm khuyết tưới máu [31-33]. So với các khiếm khuyết tưới máu cơ tim phát hiện bởi MRI tim, nghiệm pháp gắng sức dobutamine với CFR được đo bởi Doppler xung siêu âm tim qua thành ngực cho thấy mối tương quan ý nghĩa giữa chỉ số khiếm khuyết tưới máu cơ tim và CFR (r = -0,45; p = 0,019) [32]. Trong một nghiên cứu khác, khiếm khuyết tưới máu có liên quan với đáp ứng bất thường với nghiệm pháp acetylcholine (r = +0,45; p < 0,01) [33].
CT đa lớp cắtvới chất cản quang cũng có thể ước đoán lưu lượng máu bằng cách đo các thay đổi độ loãng theo thời gian; tuy nhiên, hầu hết nghiên cứu tập trung vào ước đoán ý nghĩa huyết động của tổn thương động mạch vành thượng tâm mạc và tính FFR sử dụng mô hình vi tính 3D của giải phẫu CT (được gọi là FFRCT) [34–36]. Các tiến bộ gần đây của FFRCT đã dẫn đến được thừa nhận ở Nhật Bản như là phương pháp thay thế cho hình ảnh tưới máu cơ tim [37,38]. Tuy nhiên, công cụ chẩn đoán này hiện tại không thể đánh giá bất thường lưu lượng ở bệnh nhân không có bệnh động mạch vành thượng tâm mạc.
Các nghiệm pháp gắng sứcở bệnh nhân đau thắt ngực do bệnh vi mạch vành có thể có hoặc không bất thường; tuy nhiên, kết quả nghiệm pháp gắng sức bất thường ở các bệnh nhân với động mạch vành bình thường hoặc gần bình thường cho thấy họ có thể có bệnh vi mạch vành. Trên nghiệm pháp ECG gắng sức, đoạn ST chênh xuống có thể xảy ra ở các bệnh nhân bệnh vi mạch mành và có thể có liên quan với CFR giảm như được đánh giá bởi siêu âm tim Doppler qua thành ngực [39]. Nghiệm pháp gắng sức y học hạt nhân cũng có thể được sử dụng để đánh giá thay đổi lưu lượng máu cơ tim ở bệnh nhân bệnh vi mạch vành [40-42]; tuy nhiên, các nghiên cứu khác nên được thực hiện để xác định tính chính xác của chẩn đoán và giá trị tiên lượng của PET ở bệnh nhân đau thắt ngực do vi mạch.
Một số nghiệm pháp không xâm lấn cũng có thể được dùng để đánh giá chức năng nội mô ngoài tuần hoàn mạch vành. Siêu âm động mạch cánh tay với dãn mạch qua trung gian lưu lượng (flow-mediated dilation [FMD]) sử dụng lưu lượng như kích thích sinh lý đối với dãn mạch và là xét nghiệm không xâm lấn được sử dụng rộng rãi nhất để đánh giá chức năng nội mô; tuy nhiên có hạn chế bởi độ phân giải kém và tính biến thiên cao giữa những người siêu âm. Đo áp lực động mạch ngoại biên (peripheral arterial tonometry [PAT]) có vẻ ít phụ thuộc vào người thực hiện, nhưng bị ảnh hưởng bởi các khía cạnh cấu trúc của hệ mạch máu ngoài nội mô. Một phân tích gộp gồm 15.544 bệnh nhân ở 32 nghiên cứu FMD và 865 bệnh nhân ở 3 nghiên cứu PAT chứng minh các giá trị bất thường ở cả hai nhóm có liên quan với tăng tỉ lệ các biến cố tim mạch nặng nhưng không có nghiên cứu so sánh trực tiếp FMD với PAT [43]. Các rào cản cho việc sử dụng rộng rãi xét nghiệm chức năng nội mô không xâm lấn là sự thiếu chính xác trong đo FMD và giá trị hạn chế của PAT. Do đó, tiêu chuẩn vàng để xác định chức năng nội mô vẫn là đánh giá dãn động mạch vành đáp ứng với tiêm acetylcholine nội mạch vành trong phòng thông tim.
3.2.2 Đánh giá xâm lấn trong phòng thông tim
Hình 2 trình bày tiếp cận chẩn đoán trong phòng thông tim [23]. Việc đánh giá bắt đầu với chụp mạch vành để xác định tắc nghẽn động mạch vành thượng tâm mạc và các nguyên nhân cấu trúc khác của đau thắt ngực. Sau đó, bệnh nhân trải qua đánh giá nội mô và hệ vi mạch.
3.2.2.1 Đánh giá chức năng nội mô
Xét nghiệm chức năng nội mô cần sử dụng acetylcholine nội mạch vành và do đó nhìn chung được thực hiện ở các trung tâm chuyên nghiệp hoặc trong các đề cương nghiên cứu [44]. Acetylcholine gây ra dãn mạch ở nội mô bình thường thông qua sản xuất nitric oxide, dẫn đến tăng tín hiệu cGMP ở các tế bào cơ trơn. Ngược lại, acetylcholine không gây dãn mạch ở bệnh nhân rối loạn chức năng nội mô và thậm chí gây ra co mạch nghịch lý bởi vì tác dụng lên các thụ thể muscarinic ở cơ trơn động mạch [18]. Chỉ số dãn mạch qua trung gian nội mô đáp ứng với acetylcholine được đánh giá bằng cách sử dụng chụp mạch vành định lượng. Chức năng nội mô thượng tâm mạc được đặc trưng bởi đáp ứng mạch máu với acetylcholine nội mạch vành: đáp ứng bình thường nếu tăng đường kính, rối loạn chức năng nếu không thay đổi hoặc giảm đường kính; và co thắt mạch vành nếu giảm ≥75% đường kính đáp ứng với acetylcholine [13,18] so với ban đầu. Các bệnh nhân co thắt mạch mạch vành nặng có thể hồi phục nhanh với nitroglycerine. Rối loạn chức năng nội mô vi mạch vành cũng có thể được đánh giá. Rối loạn chức năng được xác định bởi giảm lưu lượng máu khi được xác định bởi chụp mạch vành phối hợp với dây dẫn vận tốc Doppler [13,18], và co thắt mạch vành nếu có triệu chứng hoăc thay đổi ECG thiếu máu cơ tim với giảm <75% đường kính động mạch vành đáp ứng với acetylcholine. Trong khi thiếu dãn mạch thượng tâm mạc đáp ứng với tiêm acetylcholine nội mạch vành là tiêu chuẩn chẩn đoán rối loạn chức năng nội mô, có sự khác nhau đáng kể trong mức độ rối loạn chức năng trong các nhánh động mạch vành thượng tâm mạc. Các đoạn động mạch có thể co thắt, dãn hoặc vẫn không thay đổi đáp ứng với acetylcholine ở cùng một bệnh nhân, cho thấy rằng mức độ rối loạn chức năng nội mô động mạch vành thượng tâm mạc biến thiên ở cùng một hệ động mạch vành [45,46]. Trong khi tiêu chuẩn hiện tại là đo chỉ số đường kính ở phần xa catheter 5 mm và vuông góc với đường trung tâm của động mạch, điều này sẽ có thể thay đổi khi các chỉ số phức tạp hơn có thể thực hiện bởi các chương trình chụp mạch vành định lượng bán tự động.
3.2.2.2 Đánh giá chức năng vi mạch mành
Chức năng vi mạch phụ thuộc nội mô có thể đánh giá thông qua tiêm acetylcholine nội mạch vành như đã thảo luận ở trên. Đánh giá chức năng vi mạch không phụ thuộc nội mô được thực hiện với adenosine để giảm sung huyết, dẫn đến dãn tế bào cơ trơn và dãn mạch của hệ vi mạch. Một số chỉ số được đưa ra để đánh giá chức năng vi mạch ở các bệnh nhân có hoặc không có bệnh động mạch vành thượng tâm mạc. CFR phản ánh chỉ số kết hợp của dung tích động mạch thượng tâm mạc và giường vi mạch để đạt lưu lượng máu tối đa đáp ứng với kích thích tăng tưới máu. CFR được tính là tỉ số giữa vận tốc đỉnh trung bình khi tăng tưới máu so với ban đầu và có giá trị 4-5 ở người bình thường đáp ứng với tiêm adenosine. Trong trường hợp không mắc bệnh động mạch vành thượng tâm mạc có ý nghĩa huyết động (FFR > 0,8), CFR có thể được sử dụng là chỉ số xơ vữa vi mạch vành đơn thuần, CFR < 2,5 chỉ điểm bất thường hệ vi mạch vành. Chỉ số này trong quá khứ bắt nguồn từ chụp mạch vành sử dụng số khung hình TIMI (Thrombolysis in Myocardial Infarction), chỉ số đo lưu lượng mạch vành định lượng không cần thêm catheter [47-50]. Chỉ số đó là số khung hình cần cho chất cản quang đi từ lỗ vào đến điểm xa được chuẩn hóa ở động mạch thượng tâm mạc sử dụng tốc độ phim chuẩn 30 khung hình/giây, số khung hình càng thấp cho thấy lưu lượng máu càng chậm. Khi động mạch liên thất trước dài hơn cả động mạch mũ và động mạch vành phải, số khung hình TIMI hiệu chỉnh (corrected TIMI frame count [CTFC]) được tính bằng cách chia số khung hình TIMI của động mạch liên thất trước cho 1,7 và có thể được sử dụng so sánh giữa các động mạch vành thượng tâm mạc khác nhau. Vì CTFC cũng cung cấp chỉ số thời gian, có thể tính vận tốc bằng cách chia chiều dài động mạch đích cho CTFC. Do đó, CFR có thể được tính từ số khung hình TIMI và được định nghĩa là tỉ số giữa CTFC ban đầu so với khi tăng tưới máu [49-51].
Với sự tiến bộ của các dây dẫn chuyên dụng có thể đo cả vận tốc và áp lực trong các động mạch vành, ngày nay CFR có thể được đánh giá trực tiếp bằng dây dẫn vận tốc Doppler trong phòng thông tim. Các chỉ số mới hơn bao gồm IMR và HMR. IMR có vẻ đánh giá chức năng vi mạch có thể lặp lại ở các bệnh nhân có hoặc không có hẹp động mạch thượng tâm mạc và có thể được sử dụng phối hợp với FFR để đánh giá sinh lý động mạch vành thượng tâm mạc và vi mạch với một dây dẫn áp lực; tuy nhiên, không có dữ liệu bình thường của IMR và cần nhiều dữ liệu trước khi khuyến cáo tiêu chuẩn tham khảo [23]. HMR cũng là một chỉ số hấp dẫn để đánh giá chức năng vi mạch không phụ thuộc vào hẹp động mạch vành thượng tâm mạc, nhưng phụ thuộc vào dây dẫn phối hợp áp lực và vận tốc và không tính dự trữ tuần hoàn bàng hệ [44]. Mặc dù FFR đã được thừa nhận sử dụng chủ đạo nhưng đánh giá vi mạch với IMR hoặc HMR cũng được sử dụng trong các tình huống nghiên cứu.
4. ĐIỀU TRỊ
4.1 Mục tiêu điều trị
Điều trị đau thắt ngực có hai mục tiêu. Mục tiêu thứ nhất là giảm đau ngực và các triệu chứng liên quan để tăng tối đa khả năng gắng sức và cải thiện chất lượng cuộc sống. Mục tiêu điều trị thứ hai là kéo dài sống còn không có các biến cố tim mạch nặng. Bất kỳ liệu pháp nào giảm triệu chứng và phòng ngừa các biến cố tim mạch có thể giúp giảm đáng kể chi phí chăm sóc y tế cho bệnh tim thiếu máu cục bộ ổn định bao gồm lặp lại các nghiệm pháp xâm lấn. Điểm quan trọng là cần điều trị toàn diện mỗi bệnh nhân đau thắt ngực do vi mạch. Chiến lược điều trị bao gồm quản lý các bệnh đồng mắc, điều chỉnh tích cực yếu tố nguy cơ và thay đổi lối sống bằng cách khuyến khích tập thể dục, tránh thuốc lá và sử dụng chế độ ăn lành mạnh cho tim. Tất cả các yếu tố nguy cơ tim mạch (đặc biệt hút thuốc lá và tăng huyết áp) tạo ra nồng độ oxy phản ứng gây bệnh, có tác dụng gây hại cho chức năng nội mô. Điều trị các yếu tố nguy cơ của bệnh vi mạch có cải thiện các kết cục tim mạch hay không còn chưa rõ; điều này ngược lại với các biện pháp đã được xác định điều trị các bệnh đồng mắc và cải thiện sống còn ở các bệnh nhân bệnh động mạch vành do tắc nghẽn.
4.2 Điều trị triệu chứng đau thắt ngực
Có khoảng trống các thử nghiệm đối chứng về điều trị đau thắt ngực ở các bệnh nhân rối loạn chức năng vi mạch và nhìn chung các nghiên cứu còn hạn chế với thử nghiệm nhỏ ngắn hạn; tuy nhiên, bệnh nhân đau thắt ngực do vi mạch cũng nên được điều trị các thuốc tương tự như các bệnh nhân đau thắt ngực ổn định được trình bày tóm tắt ở bảng 2. Thực ra, trong một số trường hợp, điều trị kinh nghiệm đau thắt ngực ở bệnh động mạch vành không do tắc nghẽn có thể thực hiện mà không cần xét nghiệm cao cấp để đánh giá rối loạn chức năng vi mạch. Điều trị đau thắt ngực do vi mạch là mộtthử thách và cần có kinh nghiệm.
Chứng cứ ủng hộ một nhóm thuốc chuyên biệt trong trường hợp đau thắt ngực do rối loạn chức năng vi mạch khôngsẵn có vìvẫn còn hạn chế kiến thức về các nguyên nhân của đau thắt ngực do rối loạn chức năng vi mạch và đáp ứng thay đổi đối với các thuốc khác nhau. Trong nhiều thập niên trước đây, các thuốc chống đau thắt ngực truyền thống như ức chế beta, ức chế canxi và nitrat được xem là lựa chọn duy nhất mặc dù 20-30% bệnh nhân vẫn còn triệu chứng. Tuy nhiên, theo phương pháp tiếp cận ‘kim cương’ mới nhất trong điều trị đau thắt ngực được đề xuất năm 2018 bởi nhóm chuyên gia gồm Roberto Ferrari và cộng sự, lựa chọn điều trị đau thắt ngực được ưa thích ở bệnh nhân đau thắt ngực do bệnh vi mạch vành là trimetazidine và ranolazine [72]. Các thuốc giảm đau thắt ngực khác (ức chế beta, ức chế canxi, nitrat, ivabradine và nicorandil) cũng có thể được xem xét điều trị triệu chứng.
Trimetazidine
Trimetazidine là dẫn xuất piperazine. Trimetazidine tăng dung nạp của tế bào với thiếu máu cục bộ bằng cách ức chế 3-ketoacyl-CoA thiolase ở ty thể và do đó tăng chuyển hóa glucose. Vì thế, trimetazidine tác động trực tiếp đưa pyrovate vào ty thể, dẫn đến sản xuất ít proton và acid lactic từ cơ tim thiếu máu cục bộ và nhiều ATP hơn từ bào tương trong điều kiện kỵ khí. Kết quả của tác dụng này là giảm oxy hóa acid béo và tăng sử dụng glucose bởi cơ tim thiếu máu cục bộ. Trimetazidine là thuốc tác động chuyển hóa không gây ra các ảnh hưởng huyết động. Trong một phân tích gộp, trimetazidine cải thiện có ý nghĩa dung nạp gắng sức, số cơn đau thắt ngực mỗi tuần và giảm sử dụng nitrat tác dụng ngắn so với giả dược [74]. Một thử nghiệm đối chứng với giả dược của Nalbantigil và cộng sự cho thấy trimetazidine hiệu quả ở bệnh nhân đau thắt ngực do bệnh vi mạch vành khi cải thiện thời gian xuất hiện ST chênh xuống 1 mm và tổng thời gian gắng sức [73]. Nhìn chung, tác dụng phụ liên quan điều trị nhẹ và dung nạp tốt, chủ yếu gồm rối loạn tiêu hóa như buồn nôn, nôn và đau đầu nhẹ.
Ranolazine
Ranolazine có thể giảm đau thắt ngực và cải thiện khả năng gắng sức. Thuốc này hoạt động bằng cách ức chế dòng sodium muộn vào trong tế bào cơ tim và phòng ngừa quá tải canxi trong cơ tim và do đó cải thiện chức năng tâm trương. Ranolazine hiệu quả trong giảm triệu chứng trong một số thử nghiệm bệnh nhân đau thắt ngực mạn tính [59-61]; tuy nhiên, không giảm các biến cố tim mạch nặng và tử vong ở các bệnh nhân hội chứng mạch vành cấp [62]. Trong một nghiên cứu nhỏ ở bệnh nhân nữ đau thắt ngực do vi mạch, ranolazine cải thiện triệu chứng và cũng cải thiện tưới máu cơ tim ở bệnh nhân có CFR thấp [63].
Ức chế beta
Ức chế beta là thuốc điều trị đau thắt ngực hữu ích đối với các bệnh nhân kèm theo suy tim hoặc nhồi máu cơ tim gần đây. Ức chế beta cũngđược ưa thích ở bệnh nhân tăng hoạt tính giao cảm Một nghiên cứu gần đây với nebivolol ở các bệnh nhân đau thắt ngực do vi mạch chứng minh cải thiện các nghiệm pháp gắng sức thể lực và kích thích enzyme chống oxy hóa superoxide dismutase [53]. Nebivolol cũng cải thiện chức năng nội mô, có thể thông qua tác dụng chống oxy hóa và giảm chất trung gian gây viêm CRP [54].
Ức chế canxi
Ức chế canxi cũng là thuốc chống đau thắt ngực hiệu quả. Hiệu quả của ức chế canxi như amlodipin do dãn động mạch và phòng ngừa co thắt mạch vành. Trong hệ vi mạch vành, thuốc này tác động ở mức quanh các tiểu động mạch. Verapamil và diltiazem cũng giảm tần số tim và có thể sử dụng ở các bệnh nhân không dung nạp với ức chế beta.
Nitrat
Nitrat giảm đau thắt ngực do khả năng dãn mạch (không phụ thuộc nội mô) và giảm nhu cầu oxy cơ tim. Nitrat là điều trị then chốt của đau thắt ngực ở bệnh động mạch vành do tắc nghẽn; tuy nhiên, các bệnh nhân đau thắt ngực do vi mạch ít có thể cải thiện với nitrat so với các bệnh nhân bệnh động mạch vành do tắc nghẽn [58].
Ivabradine
Ivabradine cải thiện lưu lượng tuần hoàn bàng hệ và dư trữ lưu lượng mạch vành ở bệnh nhân đau thắt ngực do vi mạch [76, 77]. Tác dụng này của ivabradine ưu thế hơn bisoprolol mặc dù mức độ giảm tần số tim tương tự [77]. Bằng cách ức chế kênh If, ivabradine giảm độ dốc pha khử cực tâm trương chậm của điện thế động ở các tế bào nút xoang, do đó giảm chọn lọc tần số tim. Ức chế If phụ thuộc vào liều sử dụng, và giảm tần số tim với ivabradin nhiều hơn khi tần số tim ban đầu cao, và thấp hơn khi tần số tim ban đầu thấp. Ivabradine không có tác dụng giảm co bóp cơ tim. Giảm tần số tim do ivabradine tương tự như ức chế beta nhưng duy trì dãn động mạch vành trong lúc gắng sức. Ngoài ra, ivabradin tăng dự trữ lưu lượng mạch vành và tưới máu tuần hoàn bàng hệ, thúc đẩy sự phát triển của tuần hoàn bàng hệ và duy trì chức năng nội mô ở các bệnh nhân đau thắt ngực ổn định [76, 77]. Tác dụng giảm đau thắt ngực của ivabradine đã được báo cáo ở một số thử nghiệm lâm sàng ngẫu nhiên so với giả dược/các hoạt chất khác và phối hợp với ức chế beta cũng như ở các nghiên cứu thế giới thực phản ánh thực hành lâm sàng hàng ngày [75],[78].
L-arginine
Rối loạn chức năng nội mô là trung tâm của đau thắt ngực do vi mạch, do đó hợp lý thừa nhận rằng cải thiện sản xuất nitric oxide có thể hồi phục chức năng mạch máu và cải thiện đau thắt ngực. l-arginine trong thuốc bổ sung dinh dưỡng là cơ chất acid amin để tổng hợp nitric oxide và là một cách điều trị để tăng sản xuất nitric oxide. Một thử nghiêm cho thấy 6 tháng điều trị l-arginine đường uống cải thiện các triệu chứng và chức năng nội mô ở các bệnh nhân đau thắt ngực không có bệnh động mạch vành tắc nghẽn [57]. Lo lắng về xuất huyết, tụt huyết áp và kết cục xấu sau nhồi máu cơ tim làm thuốc này không phải là thuốc hàng đầu điều trị đau thắt ngực.
Các thuốc khác
Ở các bệnh nhân tăng cảm nhận đau, thuốc kháng adenosine và các thuốc hiệu quả trong hội chứng đau mạn tính imipramine (thuốc chống trầm cảm ba vòng) là các lựa chọn điều trị khác.
4.3 Phòng ngừa biến cố tim mạch
Aspirin
Điều trị aspirin với tác dụng kháng kết tập tiểu cầu được sử dụng hợp lý cho các bệnh nhân đau thắt ngực do vi mạch vì các bệnh nhân này có xác suất bệnh xơ vữa động mạch và nguy cơ biến cố tim mạch tăng.
Statin
Ngoài tác dụng giảm LDL-cholesterol, statin có các tác dụng bảo vệ tim khác như lợi ích kháng viêm cũng như cải thiện CFR. Hướng dẫn của ESC 2013 khuyến cáo tất cả bệnh nhân đau thắt ngực do vi mạch cần được phòng ngừa thứ phát với aspirin và statin (mức độ khuyến cáo: I, mức độ chứng cứ: B) [71].
Ức chế men chuyển
Ức chế men chuyển như quinapril ức chế sản xuất angiotensin II, cải thiện CFR và đau ngực ở bệnh nhân nữ đau thắt ngực do vi mạch trong nghiên cứu WISE [55]. Nhóm thuốc này cải thiện tính khả dụng sinh học của nitric oxide nội mô, chức năng vi mạch, khả năng gắng sức và thời gian gắng sức ở bệnh nhân rối loạn chức năng vi mạch vành [55].
Ức chế thụ thể angiotensin II
Telmesartan và olmesartan cải thiện vi tuần hoàn ở những bệnh nhân tăng huyết áp [79]. Olmesartan có tác dụng mạnh hơn trong kiểm soát huyết áp và giảm các dấu ấn viêm.
Kháng aldosterone
Bổ sung kháng aldosterone vào ức chế men chuyển hoặc ức chế thụ thể angiotensin II không cải thiện chức năng nội mô hoặc vi mạch ở phụ nữ bệnh động mạch vành không do tắc nghẽn [56].
4.4 Điều chỉnh lối sống
Chế độ ăn và tập luyện đóng vai trò lớn trong điều trị các yếu tố nguy cơ tim mạch. ACC/AHA khuyến cáo chế độ ăn lành mạnh cho tim như chế độ ăn DASH (Dietary Approaches to Stop Hypertension) nhiều trái cây và rau củ và ít sodium, chất béo trans và chất béo bão hòa [64].
Các bệnh nhân nên được khuyến cáo hoạt động thể lực cường độ trung bình khoảng 30 phút mỗi ngày, hầu hết các ngày trong tuần để cải thiện huyết áp và LDL-cholesterol. Tập thể dục có thể mang lại lợi ích ở bệnh nhân đau thắt ngực ở nhiều phương diện khác nhau. Hoạt động thể lực cũng có thể điều chỉnh lưu lượng máu mạch vành, cải thiện chức năng nội mô, giảm stress và trầm cảm [65]. Một nghiên cứu nhỏ phát hiện 4 tuần tập luyện tăng 29% CFR ở các bệnh nhân rối loạn chức năng nội mô [66]. Tập luyện thể lực trì hoãn khởi phát đau thắt ngực trong một nghiên cứu nhỏ khác ở các bệnh nhân đau thắt ngực do vi mạch [67]. Cả đau thắt ngực và khiếm khuyết tưới máu được cải thiện bởi chương trình tập luyện trong một báo cáo ca của bệnh nhân thiếu máu cục bộ vi mạch [68]. Gắng sức và tăng hoạt động thể lực có thể khó bắt đầu ở các bệnh nhân đau thắt ngực bởi vì họ thường giảm mức hoạt động để phòng ngừa đau thắt ngực. Cách tốt nhất để bắt đầu tập luyện thể lực đối với đau thắt ngực mạn tính là tập luyện trong tình trạng kiểm soát như phục hồi chức năng tim để đảm bảo và theo dõi chức năng tim.
Hút thuốc lá là một yếu tố nguy cơ có thể thay đổi được đối với bệnh động mạch vành do xơ vữa và cũng là một yếu tố nguy cơ của co thắt mạch vành [69]. Vì mối liên quan giữa hút thuốc lá và rối loạn chức năng nội mô [70], động viên bệnh nhân ngưng hút thuốc lá là quan trọng trong điều trị bệnh nhân đau thắt ngực do vi mạch.
5. KẾT LUẬN
Nhiều bệnh nhân đau thắt ngực không có hẹp động mạch vành thượng tâm mạc nhưng có rối loạn chức năng vi mạch và/hoặc rối loạn chức năng nội mô, gây ra thiếu máu cục bộ cơ tim. Chẩn đoán đúng nhóm bệnh nhân này và điều trị tốt giảm triệu chứng lẫn phòng ngừa biến cố tim mạch nặng là một thử thách cho các bác sĩ lâm sàng. Hiện tại, thực hành tốt nhất để điều trị bệnh nhân đau thắt ngực do vi mạch bằng cách thay đổi lối sống, điều trị tích cực các bệnh đồng mắc và tối ưu hóa các thuốc chống đau thắt ngực và phòng ngừa các biến cố.
Thế kỷ XX đã chứng kiến những tiến bộ trong chẩn đoán và điều trị bệnh động mạch vành thượng tâm mạc do tắc nghẽn. Thử thách của thế kỷ XXI này là cần vượt qua quan điểm kinh điển của bệnh động mạch vành do tắc nghẽn sang hiểu biết phức tạp hơn về chẩn đoán và điều trị đầy đủ các phổ bệnh của bệnh mạch vành. Điều này cần chuẩn hóa các công cụ chẩn đoán xâm lấn và không lấn cũng như nhiều thử nghiệm ngẫu nhiên có đối chứng lớn hơn ở dân số bệnh nhân đã được chẩn đoán xác định bệnh vi mạch vành.
TÓM TẮT NHỮNG ĐIỀU QUAN TRỌNG CẦN NHỚ
Đại cương
-
Gần một nửa bệnh nhân trải qua thông tim vì đau thắt ngực không có bệnh động mạch vành thượng tâm mạch do tắc nghẽn.
-
Các bệnh nhân đau thắt ngực do rối loạn chức năng vi mạch tăng hơn 2 lần nguy cơ biến cố tim mạch nặng trong thời gian hơn 3 năm.
-
Rối loạn chức năng nội mô là trung tâm của cả bệnh động mạch vành thượng tâm mạc và vi mạch.
Chẩn đoán
-
Đau thắt ngực do vi mạch là nguyên nhân quan trọng của thiếu máu cơ tim ở cả nam và nữ, nhưng chiếm ưu thế ở nữ.
-
Phụ nữ đau thắt ngực có thể lớn tuổi hơn và có nhiều bệnh đồng mắc hơn nam đau thắt ngực; tuy nhiên, bệnh nhân nam có xác suất bệnh động mạch vành thượng tâm mạc tắc nghẽn cao hơn.
-
Chẩn đoán xác định ở các bệnh nhân đau thắt ngực do vi mạch có thể hướng dẫn thay đổi lối sống và điều trị nội khoa.
-
Những tiến bộ của các xét nghiệm không xâm lấn với siêu âm tim và MRI đã có thể đánh giá dự trữ lưu lượng mạch vành và bất thường tưới máu vi mạch.
-
Đánh giá xâm lấn bắt đầu với chụp mạch vành để phát hiện bệnh động mạch vành do tắc nghẽn; nếu bệnh mạch vành thượng tâm mạc không đáng kể, xét nghiệm thêm với acetylcholine có thể xác định và phân biệt đau thắt ngực do vi mạch với đau thắt ngực do co thắt mạch vành.
Điều trị
-
Điều trị nhằm mục tiêu giảm triệu chứng và phòng ngừa các biến cố tim mạch.
-
Điều chỉnh yếu tố nguy cơ và điều trị các bệnh đồng mắc là quan trọng cũng như thực hiện lối sống lành mạnh và tích cực.
-
Trimetazidine và ranolazine là các thuốc ưa thích được chọn lựa để giảm triệu chứng ở bệnh nhân đau thắt ngực do bệnh vi mạch vành.
-
Aspirin, statin và ức chế men chuyển/ức chế thụ thể angiotensin II có thể cải thiện chức năng vi mạch/nội mô và phòng ngừa các biến cố tim mạch.
Bảng 1. Các công cụ chẩn đoán trong đánh giá chức năng vi mạch và nội mô
|
Phương pháp |
Chỉ số đo lường |
Thuận lợi |
Hạn chế |
|
Chức năng vi mạch |
|||
|
Siêu âm qua thành ngực với Doppler xung |
Đánh giá vận tốc lưu lượng máu mạch vành có thể tính CFR |
Phương pháp không xâm lấn, không đắt tiền, tin cậy để đánh giá nhiều lần; không phơi nhiễm bức xạ ion hóa |
Chủ yếu sử dụng đối với động mạch liên thất trước; khó đo đường kính động mạch và lưu lượng mạch vành; phụ thuộc người thực hiện; phát hiện lưu lượng mạch vành ở 70-80% bệnh nhân |
|
SPECT |
Đánh giá CFR bằng cách sử dụng hình tưới máu cơ tim lúc gắng sức so với nghỉ |
Không xâm lấn |
Độ nhạy thấp; độ phân giải theo không gian và thời gian thấp; phơi nhiễm bức xạ |
|
PET |
Định lượng MBF tuyệt đối bằng mô hình động. CFR được tính là tỉ số của MBF lúc tăng tưới máu so với ban đầu |
Không xâm lấn; có thể định lượng tưới máu cơ tim |
Đắt tiền; hiếm có; phơi nhiễm bức xạ |
|
MRI tim |
MPRI được tính là tỉ số giữa lưu lượng máu cơ tim lúc tăng tưới máu so với lúc nghỉ |
Không xâm lấn; không phơi nhiễm bức xạ ion hóa |
Khó khăn về kỹ thuật; các bệnh nhân sợ không gian hẹp khó dung nạp với MRI |
|
Chỉ số vận tốc và/hoặc áp lực Doppler mạch vành |
CFR, HMR và IMR (tỉ số của áp lực và/hoặc vận tốc được đo ban đầu và lúc tăng tưới máu |
Có thể đo trực tiếp áp lực và/hoặc vận tốc; tin cậy và có giá trị tốt |
Xâm lấn; phơi nhiễm bức xạ |
|
Chức năng nội mô |
|||
|
Hình ảnh siêu âm động mạch cánh tay |
FMD |
Không xâm lấn |
Độ phân giải kém Tính biến thiên cao giữa những người thực hiện (thiếu chính xác) |
|
Đo áp lực động mạch cánh tay |
Thay đổi thể tích động mạch đáp ứng với tăng tưới máu |
Không xâm lấn Ít phụ thuộc người thực hiện hơn FMD |
Ảnh hưởng bởi các khía cạnh cấu trúc của hệ mạch máu ngoài nội mô |
|
Chỉ số vận tốc Doppler mạch vành |
Thay đổi đường kính và vận tốc lưu lượng máu mạch vành đáp ứng với tiêm nội mạch vành ergonovine hoặc acetylcholine |
Có thể đo trực tiếp vận tốc Tin cậy và có giá trị tốt |
Xâm lấn Đắt tiền Phơi nhiễm bức xạ |
|
CFR (Coronary flow reserve): dự trữ lưu lượng mạch vành; FMD (Flow-mediated dilation): dãn mạch do lưu lượng; HMR (Hyperemic microvascular resistance): kháng lực vi mạch tăng tưới máu; IMR (Index of microvascular resistance): chỉ số kháng lực vi mạch; MBF (Myocardial blood flow): lưu lượng máu cơ tim; MPRI (Myocardial perfusion reserve index): chỉ số dự trữ tưới máu cơ tim. |
|||
Bảng 2. Các thuốc thường được sử dụng ở bệnh nhân đau thắt ngực do bệnh vi mạch vành
|
Thuốc |
Cơ chế tác dụng |
Lưu ý về sử dụng |
|
Trimetazdine |
Ức chế oxy hóa axit béo tự do trong ty thể tế bào cơ tim bằng cách ức chế 3-ketoacyl coenzyme A thiolase, tăng oxy hóa pyruvate bởi pyruvate dehydrogenase, tạo nhiều ATP hơn. |
Giảm đau thắt ngực, cải thiện khả năng gắng sức, tác động chuyển hóa năng lượng ở tim, không ảnh hưởng huyết động. |
|
Ranolazine |
Ức chế dòng ion natri, ngăn ngừa quá tải canxi trong cơ tim |
Giảm triệu chứng hiệu quả nhưng không có dữ liệu về giảm tử vong hoặc biến cố tim mạch. |
|
Ức chế beta |
Giảm nhu cầu oxy cơ tim, cải thiện CFR |
Các thuốc ức chế beta chọn lọc tim gồm atenolol, bisoprolol, metoprolol và nebivolol … |
|
Ức chế canxi |
Giảm nhu cầu oxy cơ tim, có thể phòng ngừa co thắt mạch vành |
Ức chế canxi dihydropyridin có thể gây nhịp tim nhanh phản xạ. |
|
Aspirin |
Ức chế kết tập tiểu cầu thông qua ức chế cyclooxygenase |
Điều trị nguy cơ tim mạch; không phải là thuốc giảm đau thắt ngực |
|
Statin |
Cải thiện chức năng nội mô và CFR |
Có thể giảm nguy cơ tim mạch do xơ vữa động mạch |
|
Ức chế men chuyển |
Cải thiện chức năng nội mô và CFR |
Có thể giảm nguy cơ tim mạch do xơ vữa động mạch |
|
Nitrat |
Dãn mạch, giảm nhu cầu oxy cơ tim |
Chống chỉ định sử dụng đồng thời với ức chế PDE-5 như sildenafil. |
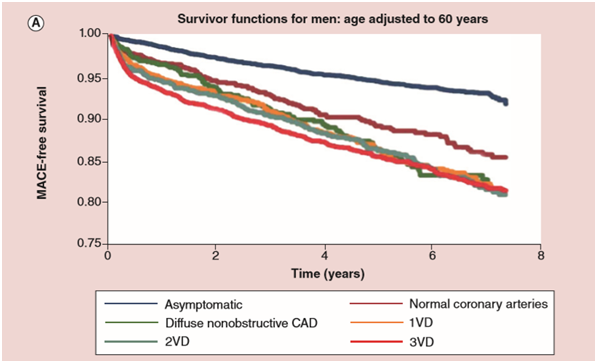
Hình 1. Tiên lượng sống còn không có biến cố tim mạch nặng (MACE-free survival) dựa vào triệu chứng đau thắt ngực và mức độ tắc nghẽn động mạch vành thượng tâm mạc.
Bệnh nhân đau thắt ngực và động mạch vành bình thường giảm sống còn ở cả nam và nữ. Mức độ tắc nghẽn động mạch vành thượng tâm mạc tương quan với các kết cục ở nam (A) và nữ (B).
Asymptomatic: không triệu chứng; Normal coronary arteries: động mạch vành bình thường; Diffuse nonobstructive CAD: bệnh động mạch vành không do tắc nghẽn lan tỏa; 1VD (1-vessel disease): bệnh 1 nhánh động mạch vành; 2VD (2-vessel disease): bệnh 2 nhánh động mạch vành; 3VD (3-vessel disease): bệnh 3 nhánh động mạch vành.
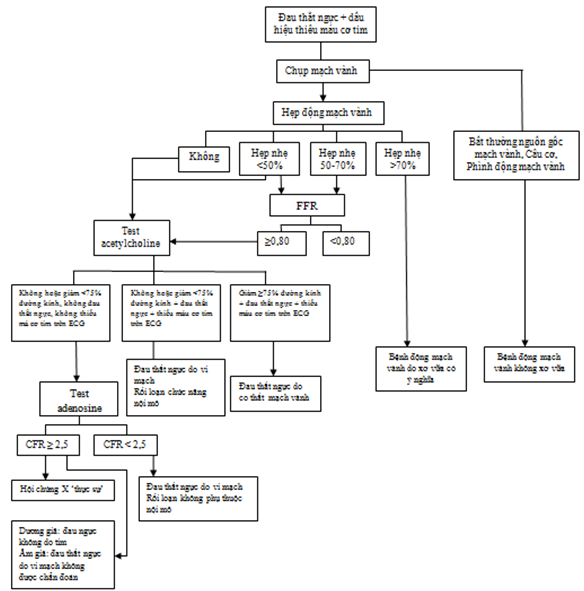
Hình 2. Lưu đồ chẩn đoán được đề xuất ở bệnh nhân đau thắt ngực khi gắng sức điển hình và có dấu hiệu thiếu máu cục bộ cơ tim [23]
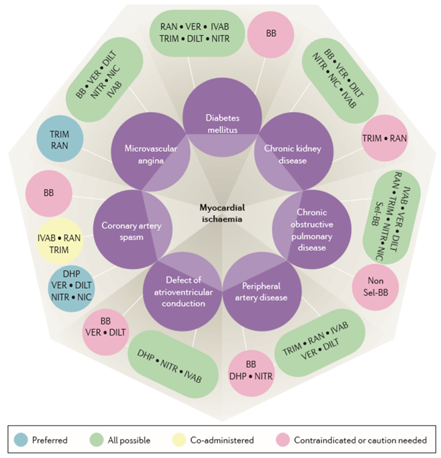
Hình 3. Các thuốc chống đau thắt ngực trong bệnh vi mạch vành và các bệnh đồng mắc khác theo tiếp cận ‘kim cương’ (Chụp từ tài liệu gốc) [72].
Preferred: ưa thích; All possible: có thể; Co-administered: điều trị phối hợp; Contraindicated or caution needed: chống chỉ định hoặc cần thận trọng. BB: ức chế beta; DHP: ức chế canxi dihydropyridine; DILT: diltiazem; IVAB: ivabradine; NIC: nicorandil; NITR: nitrat; Non Sel-BB: ức chế beta không chọn lọc; RAN: ranolazine; Sel-BB: ức chế chọn lọc β1; TRIM: trimetazidine; VER: verapamil. Diabetes mellitus: đái tháo đường; Chronic kidney disease: bệnh thận mạn; Chronic obstructive pulmonary disease: bệnh phổi tắc nghẽn mạn tính; Peripheral artery disease: bệnh động mạch ngoại biên; Defect of atrioventricular conduction: rối loạn dẫn truyền nhĩ thất; Coronary artery spasm: co thắt động mạch vành; Microvascular angina: đau thắt ngực do vi mạch.
TÀI LIỆU THAM KHẢO
1. Go AS, Mozaffarian D, Roger VL et al. Heart disease and stroke statistics – 2013 update: a report from the American Heart Association. Circulation 127(1), e6–e245 (2013).
2. Velagaleti RS, Pencina MJ, Murabito JM et al. Long-term trends in the incidence of heart failure after myocardial infarction. Circulation 118(20), 2057–2062 (2008).
3. Bairey Merz CN, Kelsey SF, Pepine CJ et al. The Womens Ischemia Syndrome Evaluation (WISE) study: protocol design, methodology and feasibility report. J. Am. Coll. Cardiol. 33(6), 1453–1461 (1999).
4. Shaw LJ, Merz CN, Pepine CJ et al. The economic burden of angina in women with suspected ischemic heart disease: results from the National Institutes of Health–National Heart, Lung, and Blood Institute-sponsored Womens Ischemia Syndrome Evaluation. Circulation 114(9), 894–904 (2006).
5. Ong P, Athanasiadis A, Borgulya G, Mahrholdt H, Kaski JC, Sechtem U. High prevalence of a pathological response to acetylcholine testing in patients with stable angina pectoris and unobstructed coronary arteries. The ACOVA study (Abnormal COronary VAsomotion in patients with stable angina and unobstructed coronary arteries). J. Am. Coll. Cardiol. 59(7), 655–662 (2012).
6. Shaw LJ, Shaw RE, Merz CN et al. Impact of ethnicity and gender differences on angiographic coronary artery disease prevalence and in-hospital mortality in the American College of Cardiology–National Cardiovascular Data Registry. Circulation 117(14), 1787–1801 (2008).
7. Jespersen L, Hvelplund A, Abildstrom SZ et al. Stable angina pectoris with no obstructive coronary artery disease is associated with increased risks of major adverse cardiovascular events. Eur. Heart J. 33(6), 734–744 (2012).
8. Murthy VL, Naya M, Taqueti VR et al. Effects of gender on coronary microvascular dysfunction and cardiac outcomes. Circulation 129(24), 2518–2527 (2014).
9. Lanza GA, Crea F. Primary coronary microvascular dysfunction: clinical presentation, pathophysiology, and management. Circulation 121(21), 2317–2325 (2010).
10. Kern MJ, Lerman A, Bech JW et al. Physiological assessment of coronary artery disease in the cardiac catheterization laboratory: a scientific statement from the American Heart Association Committee on Diagnostic and Interventional Cardiac Catheterization , Council on Clinical Cardiology. Circulation 114(12), 1321–1341 (2006).
11. Kern MJ, Samady H. Current concepts of integrated coronary physiology in the catheterization laboratory. J. Am. Coll. Cardiol. 55(3), 173–185 (2010).
12. Lotfi A, Jeremias A, Fearon WF et al. Expert consensus statement on the use of fractional flow reserve, intravascular ultrasound, and optical coherence tomography: a consensus statement of the society of cardiovascular angiography and interventions. Catheter. Cardiovasc. Interv. 83(4), 509–518 (2014).
13. Halcox JP, Schenke WH, Zalos G et al. Prognostic value of coronary vascular endothelial dysfunction. Circulation 106(6), 653–658 (2002).
14. Johnson BD, Shaw LJ, Buchthal SD et al. Prognosis in women with myocardial ischemia in the absence of obstructive coronary disease: results from the National Institutes of Health–National Heart, Lung, and Blood Institute-sponsored Womens Ischemia Syndrome Evaluation (WISE). Circulation 109(24), 2993–2999 (2004).
15. Lamendola P, Lanza GA, Spinelli A et al. Long-term prognosis of patients with cardiac syndrome X. Int. J. Cardiol. 140(2), 197–199 (2010).
16. Prinzmetal M, Kennamer R, Merliss R, Wada T, Bor N. Angina pectoris. I. A variant form of angina pectoris; preliminary report. Am. J. Med. 27, 375–388 (1959).
17. Ohba K, Sugiyama S, Sumida H et al. Microvascular coronary artery spasm presents distinctive clinical features with endothelial dysfunction as nonobstructive coronary artery disease. J. Am. Heart Assoc. 1(5), e002485 (2012).
18. Flammer AJ, Anderson T, Celermajer DS et al. The assessment of endothelial function: from research into clinical practice. Circulation 126(6), 753–767 (2012).
19. Wenger NK. Angina in women. Curr. Cardiol. Rep. 12(4), 307–314 (2010).
20. Lerner DJ, Kannel WB. Patterns of coronary heart disease morbidity and mortality in the sexes: a 26-year follow-up of the Framingham population. Am. Heart J. 111(2), 383–390 (1986).
21. Pepine CJ, Abrams J, Marks RG, Morris JJ, Scheidt SS, Handberg E. Characteristics of a contemporary population with angina pectoris. TIDES Investigators. Am. J. Cardiol. 74(3), 226–231 (1994).
22. Johnson BD, Shaw LJ, Pepine CJ et al. Persistent chest pain predicts cardiovascular events in women without obstructive coronary artery disease: results from the NIH–NHLBI–sponsored Womens Ischaemia Syndrome Evaluation (WISE) study. Eur. Heart J. 27(12), 1408–1415 (2006).
23. Radico F, Cicchitti V, Zimarino M, De Caterina R. Angina pectoris and myocardial ischemia in the absence of obstructive coronary artery disease: practical considerations for diagnostic tests. JACC Cardiovasc. Interv. 7(5), 453–463 (2014).
24. Kurita T, Sakuma H, Onishi K et al. Regional myocardial perfusion reserve determined using myocardial perfusion magnetic resonance imaging showed a direct correlation with coronary flow velocity reserve by Doppler flow wire. Eur. Heart J. 30(4), 444–452 (2009).
25. Shufelt CL, Thomson LE, Goykhman P et al. Cardiac magnetic resonance imaging myocardial perfusion reserve index assessment in women with microvascular coronary dysfunction and reference controls. Cardiovasc. Diagn. Ther. 3(3), 153–160 (2013).
26. Task Force Members; Montalescot G, Sechtem U,Achenbach S , 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur. Heart J. 34(38), 2949–3003 (2013).
27. Galiuto L, Sestito A, Barchetta S et al. Noninvasive evaluation of flow reserve in the left anterior descending coronary artery in patients with cardiac syndrome X. Am. J. Cardiol. 99(10), 1378–1383 (2007).
28. Voci P, Testa G, Plaustro G. Imaging of the distal left anterior descending coronary artery by transthoracic color-Doppler echocardiography. Am. J. Cardiol. 81(12A), 74G–78G (1998).
29. Vogel R, Indermuhle A, Reinhardt J et al. The quantification of absolute myocardial perfusion in humans by contrast echocardiography: algorithm and validation. J. Am. Coll. Cardiol. 45(5), 754–762 (2005).
30. Cortigiani L, Rigo F, Gherardi S, Galderisi M, Bovenzi F, Sicari R. Prognostic meaning of coronary microvascular disease in Type 2 diabetes mellitus: a transthoracic Doppler echocardiographic study. J. Am. Soc. Echocardiol. 27(7), 742–748 (2014).
31. Panting JR, Gatehouse PD, Yang GZ et al. Abnormal subendocardial perfusion in cardiac syndrome X detected by cardiovascular magnetic resonance imaging. N. Engl. J. Med. 346(25), 1948–1953 (2002).
32. Lanza GA, Buffon A, Sestito A et al. Relation between stress-induced myocardial perfusion defects on cardiovascular magnetic resonance and coronary microvascular dysfunction in patients with cardiac syndrome X. J. Am. Coll. Cardiol. 51(4), 466–472 (2008).
33. Yilmaz A, Athanasiadis A, Mahrholdt H et al. Diagnostic value of perfusion cardiovascular magnetic resonance in patients with angina pectoris but normal coronary angiograms assessed by intracoronary acetylcholine testing. Heart 96(5), 372–379 (2010).
34. Koo BK, Erglis A, Doh JH et al. Diagnosis of ischemia-causing coronary stenoses by noninvasive fractional flow reserve computed from coronary computed tomographic angiograms. Results from the prospective multicenter DISCOVER-FLOW (Diagnosis of Ischemia-Causing Stenoses Obtained Via Noninvasive Fractional Flow Reserve) study. J. Am. Coll. Cardiol. 58(19), 1989–1997 (2011).
35. Min JK, Leipsic J, Pencina MJ et al. Diagnostic accuracy of fractional flow reserve from anatomic CT angiography. JAMA 308(12), 1237–1245 (2012).
36. Norgaard BL, Leipsic J, Gaur S et al. Diagnostic performance of noninvasive fractional flow reserve derived from coronary computed tomography angiography in suspected coronary artery disease: the NXT trial (Analysis of Coronary Blood Flow Using CT Angiography: Next Steps). J. Am. Coll. Cardiol. 63(12), 1145–1155 (2014).
37. Inohara T, Kohsaka S, Miyata H et al. Appropriateness ratings of percutaneous coronary intervention in Japan and its association with the trend of noninvasive testing. JACC Cardiovasc. Interv. 7(9), 1000–1009 (2014).
38. Kimura T, Shiomi H, Kuribayashi S et al. Cost analysis of non-invasive fractional flow reserve derived from coronary computed tomographic angiography in Japan. Cardiovasc. Interv. Ther. doi:10.1007/ s12928-014-0285-1 (2014) (Epub ahead of print)
39. Di Franco A, Lanza GA, Di Monaco A et al. Coronary microvascular function and cortical pain processing in patients with silent positive exercise testing and normal coronary arteries. Am. J. Cardiol. 109(12), 1705–1710 (2012).
40. Bottcher M, Botker HE, Sonne H, Nielsen TT, Czernin J. Endothelium-dependent and -independent perfusion reserve and the effect of L-arginine on myocardial perfusion in patients with syndrome X. Circulation 99(14), 1795–1801 (1999).
41. Inobe Y, Kugiyama K, Morita E et al. Role of adenosine in pathogenesis of syndrome X: assessment with coronary hemodynamic measurements and thallium-201 myocardial single-photon emission computed tomography. J. Am. Coll. Cardiol. 28(4), 890–896 (1996).
42. Kaufmann PA, Camici PG. Myocardial blood flow measurement by PET: technical aspects and clinical applications. J. Nucl. Med. 46(1), 75–88 (2005).
43. Xu Y, Arora RC, Hiebert BM et al. Noninvasive endothelial function testing and the risk of adverse outcomes: a systematic review and meta-analysis. Eur. Heart J. Cardiovasc. Imaging 15(7), 736–746 (2014).
44. Eshtehardi P, Luke J, Mcdaniel MC, Samady H. Intravascular imaging tools in the cardiac catheterization laboratory: comprehensive assessment of anatomy and physiology. J. Cardiovasc. Transl. Res. 4(4), 393–403 (2011).
45. Ludmer PL, Selwyn AP, Shook TL et al. Paradoxical vasoconstriction induced by acetylcholine in atherosclerotic coronary arteries. N. Engl. J. Med. 315(17), 1046–1051 (1986).
46. Penny WF, Rockman H, Long J et al. Heterogeneity of vasomotor response to acetylcholine along the human coronary artery. J. Am. Coll. Caridol. 25(5), 1046–1055 (1995).
47. Gibson CM, Cannon CP, Daley WL et al. TIMI frame count: a quantitative method of assessing coronary artery flow. Circulation 93(5), 879–888 (1996).
48. Goel PK, Gupta SK, Agarwal A, Kapoor A. Slow coronary flow: a distinct angiographic subgroup in syndrome X. Angiology 52(8), 507–514 (2001).
49. Hong HC, Lee DH, Lee SH, Joo SB. TIMI frame count versus thermodilution: diagnosing microvascular angina in cardiac syndrome X. Int. J. Cardiol. 157(1), 137–139 (2012).
50. Tanedo JS, Kelly RF, Marquez M et al. Assessing coronary blood flow dynamics with the TIMI frame count method: comparison with simultaneous intracoronary Doppler and ultrasound. Catheter. Cardiovasc. Interv. 53(4), 459–463 (2001).
51. Manginas A, Gatzov P, Chasikidis C, Voudris V, Pavlides G, Cokkinos DV. Estimation of coronary flow reserve using the Thrombolysis In Myocardial Infarction (TIMI) frame count method. Am. J. Cardiol. 83(11), 1562–1565, A1567 (1999).
52. Duvernoy CS. Evolving strategies for the treatment of microvascular angina in women. Expert Rev. Cardiovasc. Ther. 10(11), 1413–1419 (2012).
53. Erdamar H, Sen N, Tavil Y et al. The effect of nebivolol treatment on oxidative stress and antioxidant status in patients with cardiac syndrome-X. Coron. Artery Dis. 20(3), 238–244 (2009).
54. 54 Kayaalti F, Kalay N, Basar E et al. Effects of nebivolol therapy on endothelial functions in cardiac syndrome X. Heart Vessels 25(2), 92–96 (2010).
55. Pauly DF, Johnson BD, Anderson RD et al. In women with symptoms of cardiac ischemia, nonobstructive coronary arteries, and microvascular dysfunction, angiotensinconverting enzyme inhibition is associated with improved microvascular function: a double-blind randomized study from the National Heart, Lung and Blood Institute Womens Ischemia Syndrome Evaluation (WISE). Am. Heart J. 162(4), 678–684 (2011).
56. Bavry AA, Handberg EM, Huo T et al. Aldosterone inhibition and coronary endothelial function in women without obstructive coronary artery disease: an ancillary study of the National Heart, Lung, and Blood Institute-sponsored Womens Ischemia Syndrome Evaluation. Am. Heart J. 167(6), 826–832 (2014).
57. Lerman A, Burnett JC Jr, Higano ST, McKinley LJ, Holmes DR Jr. Long-term L-arginine supplementation improves small-vessel coronary endothelial function in humans. Circulation 97(21), 2123–2128 (1998).
58. Russo G, Di Franco A, Lamendola P et al. Lack of effect of nitrates on exercise stress test results in patients with microvascular angina. Cardiovasc. Drugs Ther. 27(3), 229–234 (2013).
59. Chaitman BR, Pepine CJ, Parker JO et al. Effects of ranolazine with atenolol, amlodipine, or diltiazem on exercise tolerance and angina frequency in patients with severe chronic angina: a randomized controlled trial. JAMA 291(3), 309–316 (2004).
60. Chaitman BR, Skettino SL, Parker JO et al. Anti-ischemic effects and long-term survival during ranolazine monotherapy in patients with chronic severe angina. J. Am. Coll. Cardiol. 43(8), 1375–1382 (2004).
61. Stone PH, Gratsiansky NA, Blokhin A, Huang IZ, Meng L, Investigators E. Antianginal efficacy of ranolazine when added to treatment with amlodipine: the ERICA (Efficacy of Ranolazine in Chronic Angina) trial. J. Am. Coll. Cardiol. 48(3), 566–575 (2006).
62. Morrow DA, Scirica BM, KarwatowskaProkopczuk E et al. Effects of ranolazine on recurrent cardiovascular events in patients with non-ST-elevation acute coronary syndromes: the MERLIN-TIMI 36 randomized trial. JAMA 297(16), 1775–1783 (2007).
63. Mehta PK, Goykhman P, Thomson LE et al. Ranolazine improves angina in women with evidence of myocardial ischemia but no obstructive coronary artery disease. JACC Cardiovasc. Imaging 4(5), 514–522 (2011).
64. Eckel RH, Jakicic JM, Ard JD et al. 2013 AHA/ACC guideline on lifestyle management to reduce cardiovascular risk: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 129(25 Suppl. 2), S76–S99 (2014).
65. Boden WE, Franklin B, Berra K et al. Exercise as a therapeutic intervention in patients with stable ischemic heart disease: an underfilled prescription (narrative review). Am. J. Med. 127(10), 905–911 (2014).
66. Hambrecht R, Wolf A, Gielen S et al. Effect of exercise on coronary endothelial function in patients with coronary artery disease. N. Engl. J. Med. 342(7), 454–460 (2000).
67. Eriksson BE, Tyni-Lenne R, Svedenhag J et al. Physical training in syndrome X: physical training counteracts deconditioning and pain in syndrome X. J. Am. Coll. Cardiol. 36(5), 1619–1625 (2000).
68. Carvalho EE, Crescencio JC, Elias J Jr, Brito LB, Gallo L Jr, Simoes MV. Improved endothelial function and reversal of myocardial perfusion defects after aerobic physical training in a patient with microvascular myocardial ischemia. Am. J. Phys. Med. Rehabil. 90(1), 59–64 (2011).
69. Sugiishi M, Takatsu F. Cigarette smoking is a major risk factor for coronary spasm. Circulation 87(1), 76–79 (1993).
70. Puranik R, Celermajer DS. Smoking and endothelial function. Prog. Cardiovasc. Dis. 45(6), 443–458 (2003).
71. Montalescot G, et al. 2013 ESC guidelines on the management of stable coronary artery disease; European Heart Journal (2013);34: 2949-3003.
72. Ferrari R, et al. Expert consensus document: A ‘diamond’ approach to personalized treatment of angina. Nature Reviews Cardiology. 15,120–132 (2018).
73. Nalbantigil S, et al. The effect of trimetazidine in the treatment of microvascular angina. Int J Angiol 1999;80:40-3.
74. Peng S., etal. The efficacy of trimetazidine on stable angina pectoris: a meta-analysis of randomized clinical trials. Int. J.Cardiol. 177, 780–785 (2014).
75. Tardif,J.C. etal. Efficacy of the If current inhibitor ivabradine in patients with chronic stable angina receiving beta-blocker therapy: a 4-month, randomized, placebo-controlled trial. Eur. Heart J. 30, 540–548 (2009).
76. Gloekler S., etal. The effect of heart rate reduction byivabradine on collateral function in patients with chronic stable coronary artery disease. Heart 100, 160–166 (2014).
77. Tagliamonte E., etal. Ivabradine and bisoprolol on doppler-derived coronary flow velocity reserve in patients with stable coronary artery disease: beyond the heart rate. Adv. Ther. 32, 757–767 (2015).
78. WerdanK., etal. Effectiveness of ivabradine treatment in different subpopulations with stable angina in clinical practice: a pooled analysis of observational studies. Cardiology 135, 141–150 (2016).
79. Hinoi T, et al. Telmisartan, an angiotensin II type 1 receptor blocker, improves coronary microcirculation and insulin resistance among essential hypertensive patients without left ventricular hypertrophy. Hypertens Res 2008;31:615-22.







