BS.CKII. ThS. BS. CHÂU THỊ NGỌC ÁNH
ThS. BS. NGUYỄN THỊ NGỌC HÂN
TS. NGUYỄN THỊ MỸ HẠNH
Bệnh viện Đa Khoa Tâm Anh, TP. Hồ Chí Minh
I. GIỚI THIỆU
Trong các phương tiện chẩn đoán hình ảnh, siêu âm là phương tiện đầu tay phát hiện các khối choán chỗ ở tim. Cộng hưởng từ (Magnetic resonance imaging – MRI) được chỉ định để phân biệt u ác tính, lành tính dựa vào các đặc điểm trên các chuỗi xung T1W, T2W, sự tưới máu khối u, T1map, hình ảnh bắt thuốc tương phản. Đánh giá sâu hơn các khối choán chỗ ở tim giúp đặc tính hóa khối u trước phẫu thuật. Đặc tính khối u khác nhau sẽ dẫn đến có thời gian hồi phục T1, T2 khác nhau. Cộng hưởng từ sử dụng nguyên tắc này để phân biệt giữa các loại mô khác nhau. Thông thường, các tế bào khối u đủ lớn, phù nề và có liên quan đến phản ứng viêm. Hàm lượng nước tự do cao hơn trong tế bào tân sinh và những thay đổi khác trong thành phần mô dẫn đến thời gian thư giãn T1/T2 kéo dài và do đó tồn tại sự tương phản giữa khối u và mô bình thường. Nhìn chung, những thay đổi sinh hóa này tạo ra một môi trường trong đó các khối tim bản chất khác nhau tạo ra cường độ tín hiệu khác nhau trên hình ảnh T1W và T2W, giúp phân biệt giữa chúng. Trong bài viết này, chúng tôi mô tả chi tiết về protocol chụp cộng hưởng từ tim khảo sát u. Chúng tôi cũng thảo luận về các đặc điểm cơ bản của khối u tim lành tính cũng như vai trò của cộng hưởng từ trong việc đánh giá và mô tả thêm đặc tính mô của các khối u này.
Chụp cộng hưởng từ tim (Cardiac magnetic resonance – CMR) đã trở thành một kỹ thuật không xâm lấn có giá trị cao trong chẩn đoán khối u tim nguyên phát và thứ phát. Hình ảnh CMR cung cấp chính xác sự hiện diện của khối tim do trường nhìn rộng hơn, độ phân giải tương phản tốt hơn và khả năng duy nhất mà các kỹ thuật khác không thực hiện được đó là phân biệt tổn thương dựa trên đặc điểm mô. Nó cũng giúp xác định vị trí, mức độ liên quan cũng như hậu quả chức năng của một tổn thương cụ thể. Sự phát triển gần đây về độ mạnh từ trường, các kênh cuộn dây bề mặt, lấy mẫu không gian k nhanh (rapid k-space sampling) các phương pháp xử lý sau và kỹ thuật mô tả đặc tính mô đã cho phép CMR nổi lên như một phương thức hình ảnh cực kỳ hữu ích trong việc đánh giá các tình trạng tim phức tạp như khối u tim. Thông tin được cung cấp bởi MRI tim là cực kỳ quan trọng không chỉ để chẩn đoán xác định mà còn để xác định tiên lượng và lập kế hoạch cho chiến lược quản lý bệnh (1). Trong phần này, chúng tôi sẽ cung cấp mô tả chi tiết về quy trình MRI cốt lõi để đánh giá khối lượng tim cũng như minh họa các đặc điểm hình ảnh khác nhau của khối u trên CMR (bảng 1)
Bảng 1: Đặc điểm CHT của khối u lành tính nguyên phát, khối u ác tính và khối u di căn thứ phát
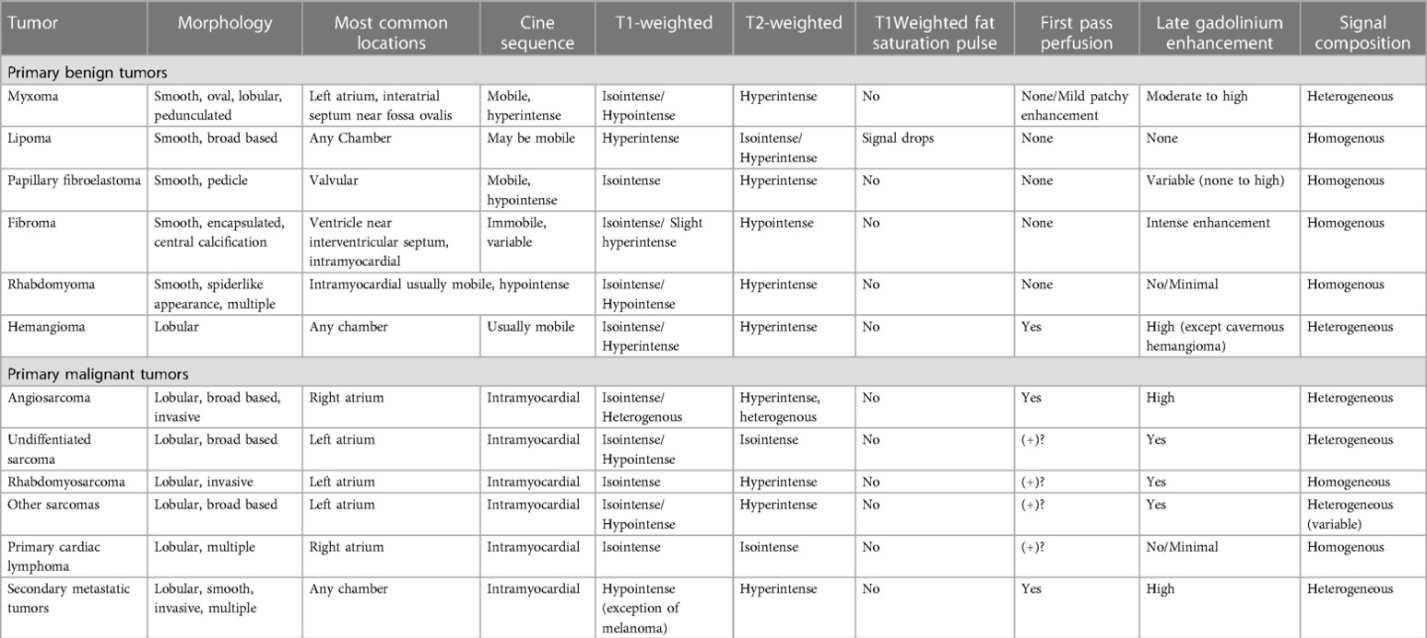
“Hyperintense: tăng tín hiệu. Isointense: đồng tín hiệu. Hypointense: giảm tín hiệu. Heterogenous: không đồng nhất, Homogenous: đồng nhất”
Các khối u tim nguyên phát là tình trạng hiếm gặp với tỷ lệ ước tính là 0,002%–0,3% trên mỗi dữ liệu khám nghiệm tử thi và 0,15% trong loạt siêu âm tim (2). Mặc dù các khối u tim là hiếm gặp, nhưng không thể bỏ qua ý nghĩa lâm sàng của chúng vì ngay cả các khối u tim lành tính cũng có thể gây ra hậu quả nghiêm trọng về huyết động và có thể là nền tảng cho các biến cố huyết khối tắc mạch và rối loạn nhịp tim (3).
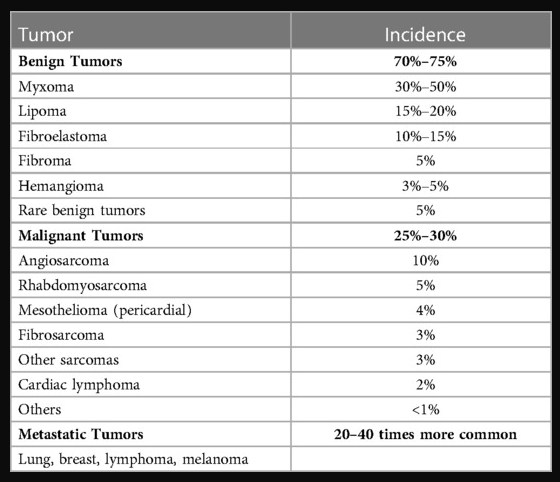
Các khối u tim lành tính chiếm gần 70%–75% các khối u tim nguyên phát (Bảng 2). Ba khối u hàng đầu ở người lớn là u nhầy (30%–50%), u nguyên bào sợi nhú (15%–20%) và u mỡ (10%–15%) (4). Ở trẻ em, u cơ vân là loại khối u phổ biến nhất. Các khối u ác tính chiếm khoảng 25%–30% tổng số các khối u tim nguyên phát. Ở người lớn phổ biến nhất là angiosarcomas (10%), trong khi ở trẻ em phổ biến nhất là rhabdomyosarcomas (5%–6%) (5). Các khối u tim di căn phổ biến hơn 20–40 lần so với các khối u tim nguyên phát và thường liên quan đến màng ngoài tim (6).
Bảng 2: Tỷ lệ (gần đúng) khối u lành tính nguyên phát, khối u ác tính và khối u di căn thứ phát
Các khối u giả hoặc tình trạng “giống khối u” (Pseudo-tumors or tumors-like) được coi là loại khối u ở tim phổ biến nhất và bao gồm huyết khối trong tim, u nang màng ngoài tim hoặc các biến thể giải phẫu bình thường (7). Do đó, việc đánh giá chi tiết khối lượng nghi ngờ ở tim bằng hình ảnh CMR là rất quan trọng để thiết lập chẩn đoán chính xác cũng như hướng dẫn xác định giai đoạn, tiên lượng và chiến lược quản lý. Dựa trên thông tin cung cấp mô tả rõ đặc điểm khối u bởi hình ảnh CMR, có thể tránh được phẫu thuật không cần thiết nếu không có chỉ định
Biểu hiện lâm sàng của khối u tim rất khác nhau, phần lớn phụ thuộc vào kích thước khối u, vị trí và biến chứng của chúng. Một số khối u vẫn im lặng về mặt lâm sàng và được chẩn đoán tình cờ trên siêu âm tim định kỳ, trong khi những khối u khác có thể biểu hiện các triệu chứng liên quan đến tắc nghẽn trong tim, thuyên tắc hệ thống và/hoặc rối loạn nhịp tim. Nói chung, các khối u lành tính nhỏ, không có triệu chứng không cần can thiệp phẫu thuật và có thể được kiểm soát bằng cách theo dõi cẩn thận. Các tổn thương lành tính kích thước lớn, có triệu chứng thường được phẫu thuật cắt bỏ hoàn toàn và hầu hết là tiên lượng tốt sau hậu phẫu. Nhìn chung, bệnh nhân có khối u lành tính có khả năng sống sót gần như tương đương với dân số nói chung. Mặt khác, các khối u ác tính thường có tiên lượng nặng; tuy nhiên, những phát triển mới nhất trong lĩnh vực kỹ thuật hình ảnh CMR đã giúp phát hiện sớm và cải thiện việc quản lý các khối u ác tính (8).
II. CÁC PHƯƠNG THỨC HÌNH ẢNH ĐÁNH GIÁ U TIM
Siêu âm tim qua thành ngực (Transthoracic echocardiography – TTE) thường là xét nghiệm chẩn đoán đầu tiên và phổ biến nhất được thực hiện để đánh giá nghi ngờ u tim (Bảng 3). TTE minh họa các đặc điểm giải phẫu và chức năng đặc trưng, giúp dễ dàng chẩn đoán phân biệt khối lượng tim. Mặc dù siêu âm tim được phổ biến rộng rãi là một lợi thế lớn, nhưng cũng có một số hạn chế được mô tả rõ ràng của kỹ thuật này bao gồm: sự phụ thuộc của người thực hiện, đặc tính mô kém và hạn chế cửa sổ thu nhận (đặc biệt ở những bệnh nhân mắc bệnh phổi mãn tính hoặc có thể trạng cơ thể lớn).
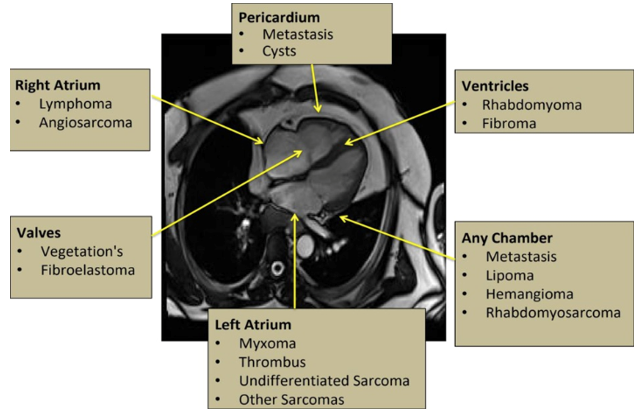
Bảng 3: Các vị trí thường gặp nhất của u tim
Các phương thức hình ảnh khác như siêu âm tim qua thực quản (TEE), siêu âm tim 3 chiều và siêu âm tim tương phản có thể cải thiện một số hạn chế này. Chúng cung cấp tốt hơn về kích thước, hình dạng, khả năng di chuyển và tác động của khối u với mô lân cận. Mặc dù TEE có thể cung cấp các mặt phẳng hình ảnh bổ sung nhưng vai trò của nó đối với việc mô tả đặc điểm của khối u vẫn còn hạn chế.
Một số tiến bộ trong chụp cắt lớp vi tính (Computed tomography – CT) bao gồm đa dãy detector, số hàng detector tăng lên, thuật toán xử lý hình sau quét và điện tâm đồ (Electrocardiographic – EKG) đã cho phép kỹ thuật này thay thế cho MRI trong chẩn đoán u tim (9). Ngoài ra, CT cũng có thể cung cấp thông tin liên quan đến mạch máu của khối (với sự tăng cường độ tương phản), sự hiện diện của mỡ và sự hiện diện của vôi hóa. Hạn chế của CT bao gồm tiếp xúc với bức xạ ion hóa (8–14 m Sv), độ phân giải thời gian thấp hơn so với siêu âm tim hoặc CMR và độ phân giải tương phản mô mềm thấp hơn so với CMR (10).
Chụp cắt lớp phát xạ Positron (Positron emission tomography – PET) cũng có thể hữu ích để mô tả khối lượng tim, nhưng tính khả dụng của nó vẫn còn hạn chế. Hơn nữa, PET cũng có độ phân giải không gian hạn chế và nó chỉ có thể là một công cụ có giá trị khi kết hợp với thông tin giải phẫu do CT cung cấp. Với sự kết hợp này, PET đã khẳng định vai trò của mình trong các tình trạng ung thư khác nhau cũng như phân biệt các tổn thương lành tính và ác tính (11).
Dựa trên một số tuyên bố đồng thuận, CMR hiện được coi là phương thức hình ảnh “Tiêu chuẩn Vàng” để đánh giá các khối u tim (12). CMR có độ phân giải tốt và đặc tính mô vượt trội so với các phương thức khác được mô tả ở trên. Ngoài ra, không có nguy cơ tiếp xúc với bức xạ. Việc đánh giá kết hợp vị trí (bảng 3), hình thái, thành phần, tưới máu và độ hấp thu độ tương phản trên hình ảnh tăng cường gadolinium muộn (Late gadolinium enhancement – LGE) khiến nó trở thành xét nghiệm chẩn đoán được lựa chọn trong đánh giá khối ở tim. Tuy nhiên, CMR vẫn còn ít khả dụng hơn các phương thức hình ảnh khác ở hầu hết các cơ sở.
Trước đây, CMR được coi là chống chỉ định ở những bệnh nhân có máy tạo nhịp và máy khử rung tim; tuy nhiên, hiện nay, hầu hết những bệnh nhân này vẫn có thể chụp MRI nếu có các biện pháp phòng ngừa thích hợp (13). Hơn nữa, hiện nay trên thị trường có một số thiết bị cấy ghép tương thích với MRI (14).
Những hạn chế khác của CMR là cần EKG và cổng hô hấp. Việc đo điện tâm đồ có thể là một vấn đề ở bệnh nhân rối loạn nhịp tim và có thể gây ra các ảnh giả đáng kể trong quá trình thu nhận hình ảnh (15). Kiểm soát nhịp thở có thể là một vấn đề khó ở những bệnh nhân nặng vì họ không thể nín thở trong khi hầu hết các chuỗi CMR đều yêu cầu nín thở để đạt được chất lượng hình ảnh tốt. Với những tiến bộ trong lĩnh vực CMR, giờ đây các phương pháp theo dõi hô hấp có thể được sử dụng để thu hình chất lượng tốt khi người bệnh thở tự do.
1. Protocol đánh giá u tim
U tim có biểu hiện khác nhau đáng kể; do đó, protocol cơ bản và được sửa đổi tùy theo tổn thương cụ thể. Lý tưởng nhất là cần có một phương pháp tiếp cận theo nhóm bao gồm bác sĩ X quang, bác sĩ tim mạch và kỹ thuật viên giàu kinh nghiệm để có được mặt phẳng và trình tự hình ảnh tối ưu cũng như mô tả đầy đủ đặc điểm của tổn thương. Nhìn chung, quy trình chụp ảnh khối u tim có thể được hoàn thành trong khoảng 45–60 phút. Giám sát trực tiếp thông qua cách tiếp cận nhóm có lợi thế tiềm năng là giảm thời gian chụp ảnh vì có thể đưa ra quyết định bỏ qua một số phần của quy trình tùy theo tính chất của một khối lượng cụ thể tại máy quét.
Trong quá trình tạo ảnh điện ảnh sử dụng các chuỗi xung steady state free precession (SSFP), u tim phải được xác định ở ít nhất hai mặt phẳng. Để hình dung rõ hơn, cần mô tả rõ hơn bằng cách thu thập chuỗi xung khác nhau bằng các mặt phẳng hiển thị rõ nhất tổn thương.
Bảng 4: Protocol tiêu chuẩn để đánh giá u tim.
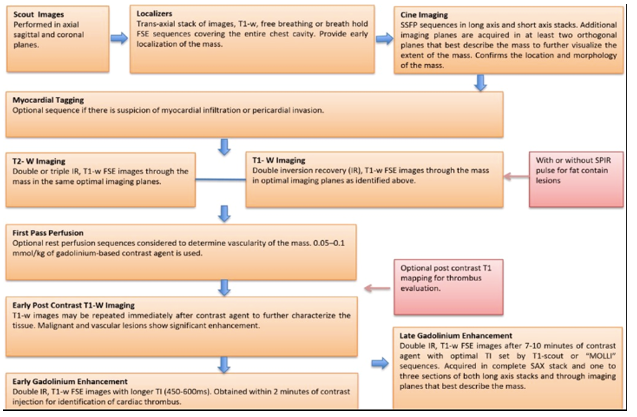
a. Scout images
Hình nảy được cắt mặt phẳng trục dọc, trục ngang. Lát cắt trục dọc hữu ích để xác định vị trí chính xác của tim ở trung tâm bề mặt coil.
b. Định vị
T1W trục ngang phủ toàn bộ lồng ngực để xác định vị trí khối tim trong khoang ngực. Đây là một chuỗi hình ảnh cực kỳ hữu ích để đánh giá vị trí u, giúp định hướng các lát cắt tiếp theo.
c. Hình Cine
Xác định vị trí khối u, khả năng vận động, đánh giá suy chức năng thất nếu có tắc nghẽn buồng tống. Cắt mặt cắt trục dọc và trục ngang toàn bộ thất và nhĩ tùy vị trí khối u. Các hình Cine qua u nên có độ dày lát cắt 4-6mm, không gap để hình có độ phân giải cao hơn. Kỹ thuật này rất hữu ích để đánh giá các tổn thương nhỏ và di động cao.
d. Myocardial tissue tagging
Thực hiện xung này nếu có nghi ngờ thâm nhiễm cơ tim hoặc xâm lấn màng ngoài tim vào khối tim. Nó có thể hữu ích để phát hiện các khu vực giảm khả năng co bóp tinh vi hơn. Thường được sử dụng để đánh giá các khối u ác tính ở tim có liên quan hoặc xâm lấn màng ngoài tim.
2. Đặc tính mô
U tim được nghi ngờ trên TTE và CMR mục đích để phân biệt khối u với các khối u giả và đồng thời để mô tả thêm đặc điểm của khối tim dựa trên các chuỗi xung ảnh T1W/T2W, phát hiện tưới máu và chứng minh sự bắt thuốc tương phản gadolinium trên hình LGE. Các mô tim khác nhau có thời gian thư giãn T1 và T2 khác nhau, chủ yếu là do môi trường sinh hóa bên trong khác nhau xung quanh các proton; do đó, trong CMR, cường độ tín hiệu từ một mô cụ thể phụ thuộc vào thời gian thư giãn T1 và T2 cũng như mật độ proton của nó. Dựa trên nguyên tắc này, CMR có thể mô tả sự khác biệt về cường độ tín hiệu để phân biệt giữa các loại mô. Thông thường, các tế bào khối u lớn, dễ phù nề, có liên quan đến phản ứng viêm và tăng dịch kẽ. Hàm lượng nước tự do cao hơn trong tế bào có tân sinh và những thay đổi khác trong thành phần mô dẫn đến thời gian thư giãn của T1/T2 kéo dài và do đó nó có sự tương phản giữa khối u và mô bình thường (18). Nhìn chung, những thay đổi sinh hóa này dẫn đến cường độ tín hiệu khác nhau trên hình ảnh T1 và T2, giúp phân biệt giữa các u tim khác nhau.
2.1 T1W
Thực hiện các lát cắt T1W qua khối u tim, T1FS xác định tổn thương u chứa mỡ. T1W 15 giây sau tiêm thuốc tương phản giúp khẳng định tính chất bắt thuốc khối u. Các tổn thương ác tính và có nhiều mạch máu (ví dụ, u mạch máu) cho thấy sự ngấm thuốc đáng kể sau khi tiêm thuốc cản quang.
2.2 T2W
Thực hiện các mặt cắt cùng vị trí với T1W. Hình ảnh FSE T2W rất hữu ích cho việc phát hiện các vùng phù nề hoặc hoại tử trong lỏng trong khối u, có tín hiệu cao. Trong khi các vùng hoại tử đông máu có tín hiệu thấp trên những hình ảnh này (19).
2.3 First – pass perfusion (FPP)
Chuỗi xung này để đánh giá tưới máu đến khối u. Thông thường dùng 0,05–0,1 mmol/kg thuốc tương phản. Các khối u mạch máu (ví dụ, angiosarcoma) thường biểu hiện ngấm thuốc đáng kể trong giai đoạn động mạch, trong khi các khối không phải mạch máu (ví dụ, huyết khối) không ngấm thuốc. Các chuỗi xung này cũng hữu ích để mô tả các vùng bắt thuốc không đồng nhất do sự phân bố hệ thống mạch máu khác nhau của u.
2.4 Early gadolinium enhancement (EGE)
Đây là các chuỗi hình ảnh FSE IR, T1W, thu được để xác định huyết khối tim và lý tưởng nhất là nên thực hiện ở những mặt phẳng hình ảnh nơi khối u được nhìn thấy rõ nhất. Thông thường, hình ảnh EGE được thực hiện trong vòng 2 phút đầu tiên tiêm chất tương phản gadolinium 0,1–0,2 mmol/kg. Do đó, có thể cần một liều bolus “bổ sung thêm” nếu có thực hiện chuỗi xung tưới máu.
Huyết khối không bắt thuốc tương phản nên thể hiện màu đen trên hình EGE trong khi máu và cơ tim có thể hiển thị tín hiệu trung gian trên những hình ảnh này. Trong một số trường hợp hiếm, quá trình tân mạch của huyết khối gây ra hình ảnh bắt quang dạng lưới trên hình ảnh EGE.
2.5 Late gadolinium enhancement (LGE)
Xác định TI trên từng bệnh nhân. Tối ưu hóa TI giúp cho hình ảnh lý tưởng chẩn đoán. Nếu cơ tim không được vô hiệu hóa đúng cách vì thời gian đảo ngược quá ngắn thì cơ tim sẽ xuất hiện sọc hoặc loang lổ. Nếu thời gian đảo ngược quá dài, cơ tim sẽ có màu xám và khó phân biệt giữa khối lượng và cơ tim.
TI bình thường thường vào khoảng 300 m giây, phần lớn phụ thuộc vào cung lượng tim của bệnh nhân và thời gian sau khi tiêm chất cản quang. TI yêu cầu điều chỉnh liên tục trong quá trình chụp để cho phép loại bỏ thuốc tương phản khỏi cơ tim bình thường; Mức thay đổi TI tăng dần 10 ms mỗi 1–3 lát thường là phù hợp. Các phương pháp phục hồi đảo ngược nhạy pha (PSIR) cũng được thực hiện mà không cần thực hiện T1 scout
Hình ảnh này thu được 7–10 phút sau khi tiêm chất tương phản. Liều tiêm thuốc tương phản 0,15 mmol/kg, có thể bổ sung nếu thời gian khảo sát kéo dài. Các mặt cắt toàn bộ khối u theo trục ngắn và trục dài. Trong lịch sử, kỹ thuật này đã được sử dụng để phát hiện cơ tim còn sống sau nhồi máu cơ tim (MI). Nguyên tắc cơ bản là chất tương phản sẽ bị rửa trôi khỏi cơ tim bình thường theo thời gian nhưng thuốc tương phản vẫn tồn tại ở các khoảng kẽ nếu khoảng này bị giãn nở. Nguyên nhân có thể do tình trạng viêm cấp tính (viêm cơ tim), xơ hóa và MI (20). Hoặc mô hình sinh lý bệnh khác là sự phân hủy tế bào xảy ra trong nhồi máu cơ tim cấp tính hoặc sự xâm lấn trực tiếp của khối u cho phép gadolinium xâm nhập vào nội bào và do đó nồng độ của nó tăng lên trong cơ tim hoại tử. Sự kết hợp của các yếu tố trên rất có thể giải thích cho việc chứng minh sự tăng cường gadolinium muộn của khối tim trên CMR. Các khối u ở tim thường có các thành phần hoại tử và xơ hóa khác nhau; các kiểu bắt thuốc tương phản khác nhau.
T1 mapping
Lập bản đồ T1 là một kỹ thuật CMR mới đã cho thấy tính hữu ích tuyệt vời trong các bệnh lý tim khác nhau, đặc biệt là xơ hóa cơ tim.
Bảng 5: Giá trị T1 map của khối u và mô cơ tim
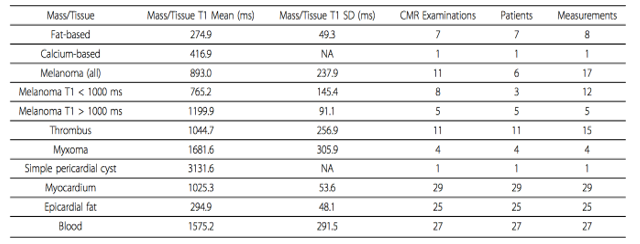
Saba, S. G., et al. (2015). Characterization of cardiac masses with T1 mapping. Journal of Cardiovascular Magnetic Resonance, 17(S1), Q32–Q32.
Chưa có nhiều nghiên cứu trong việc mô tả đặc điểm mô của khối tim. Mặc dù số lượng thấp (N = 30), T1 sau tiêm đã cho thấy kết quả đầy hứa hẹn trong việc phân biệt huyết khối với khối u trong một nghiên cứu gần đây của Lopez và cộng sự. (21). Họ đã chứng minh sự gia tăng thời gian T1 sau tiêm thuốc tương phản với huyết khối so với các khối u (477 ± 139 so với 383 ± 84). Mặt khác, thời gian T1 sau tiêm không khác biệt đáng kể giữa các khối u lành tính và ác tính (370 ± 63 so với 386 ± 91). Sự vắng mặt tương đối của hàm lượng chất xơ và chất nền ngoại bào trong mô huyết khối so với mô u tân sinh chỉ có thể giải thích những phát hiện này. Tuy nhiên, điều này có thể là thách thức đối với huyết khối có tổ chức mạn tính, có thể có một số chất xơ và có vẻ như sẽ có ít sự khác biệt hơn về thời gian T1 của huyết khối và khối u trong trường hợp này. Do đó, cần có những nghiên cứu lớn hơn để xác nhận thêm tác động của kỹ thuật mới này trong việc mô tả đặc tính mô của khối tim.
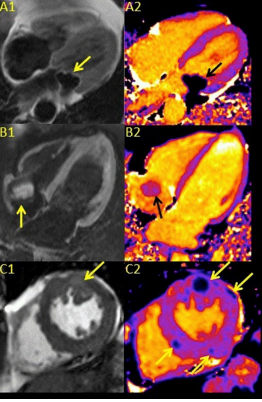
Hình 1: A1. Hình ảnh DIR TSE cho thấy mỡ ở rãnh nhĩ thất cũng như khối không phải mỡ ở vòng van hai lá.
A2. Bản đồ T1 tương ứng cho thấy một khối có giá trị T1 tương đối thấp (417 ms) phù hợp với tình trạng vôi hóa hình khuyên hai lá.
B1. Hình ảnh DIR TSE SPAIR cho thấy huyết khối liên quan đến tâm nhĩ phải.
B2. Bản đồ T1 hiển thị khối lượng có thời gian T1 trung gian (1114 ms).
C1. Hình ảnh SSFP ở bệnh nhân có khối u ác tính di căn cho thấy một vùng có cường độ tín hiệu sáng ở đoạn cơ tim trước.
C2. Giá trị T1 tương đối thấp (~700 ms) của các ổ di căn giàu melanin trên bản đồ T1 tương ứng tạo điều kiện thuận lợi cho việc xác định cơ tim có khối u.
(Vui lòng xem tiếp trong kỳ sau)
TÀI LIỆU THAM KHẢO
- Sparrow PJ, Kurian JB, Jones TR, et al. MR Imaging of cardiac tumors. Radiographic. (2005) 25:1255–76. doi: 10.1148/rg.255045721
- Sütsch G, Jenni R, von Segesser L, Schneider J. Heart tumors: incidence, distribution, diagnosis exemplified by 20,305 echocardiographies. Schweiz Med Wochenschr. (1991) 121:621–29. PMID: 2047823
- Bruce CJ. Cardiac tumors: diagnosis and management. Heart. (2011) 97:151–60. doi: 10.1136/hrt.2009.186320
- Elbardissi AW, Dearani JA, Daly RC, et al. Survival after resection of primary cardiac tumors: a 48-year experience. Circulation. (2008) 118:S7–15. doi: 10.1161/CIRCULATIONAHA.107.783126
- Roberts WC. Primary and secondary neoplasms of the heart. Am J Cardiol. (1997) 80:671–82. doi: 10.1016/S0002-9149(97)00587-0
- Butany J, Nair V, Naseemuddin A, Nair GM, Catton C, Yau T. Cardiac tumors: diagnosis and management. Lancet Oncol. (2005) 6:219–28. doi: 10.1016/S1470-2045(05)70093-0
- Gupta S, Plein S, Greenwood JP. The coumadin ridge: an important example of a left atrial pseudotumour demonstrated by cardiovascular magnetic resonance imaging. J Radiol Case Rep. (2009) 3:1–5. doi: 10.3941/jrcr.v3i9.210
- Araoz PA, Mulvagh SL, Tazelaar HD, Julsrud PR, Breen JF. CT And MR imaging of benign primary cardiac neoplasms with echocardiographic correlation. Radio Graphics. (2000) 20:1303–19. doi: 10.1148/radiographics.20.5.g00se121303
- Mandegar MH, Rayatzadeh H, Roshanali F. Left atrial myxoma: the role of multislice computed tomography. J Thorac Cardiovasc Surg. (2007) 134:795. doi: 10.1016/j.jtcvs.2007.05.034
- O’Donnell DH, Abbara S, Chaithiraphan V, et al. Cardiac tumors: optimal cardiac MR sequences and spectrum of imaging appearances. Am J Roentgenol. (2009) 193:377–87. doi: 10.2214/AJR.08.1895
- Delbeke D, Coleman RE, Guiberteau MJ, et al. Procedure guideline for tumor imaging with 18F-FDG PET/CT 1.0. J Nucl Med. (2006) 47:885–95. PMID: 1664476016644760
- Bluemke DA, Achenbach S, Budoff M, et al. Non- invasive coronary artery imaging: magnetic resonance angiography and multi-detector computed tomography angiography. A scientific statement from the American heart association committee on cardiovascular imaging and intervention of the council on cardiovascular radiology and intervention, and the councils on clinical cardiology and cardiovascular disease in the young. Circulation. (2008) 118:586–06. doi: 10.1161/CIRCULATIONAHA.108.189695
- Naehle CP, Strach K, Thomas D, et al. Magnetic resonance imaging at 1.5-T in patients with implantable cardioverter-defibrillators. J Am Coll Cardiol. (2009) 54:549–55. doi: 10.1016/j.jacc.2009.04.050
- Sutton R, Kanal E, Wilkoff BL, et al. Safety of magnetic resonance imaging of patients with a new Medtronic EnRhythm MRI SureScan pacing system: clinical study design. Trials. (2008) 9:68. doi: 10.1186/1745-6215-9-68
- Spuentrup E, Mahnken AH, Kühl HP, et al. Fast interactive real time magnetic resonance imaging of cardiac masses using spiral gradient echo and radial steady state free precession sequences. Invest Radiol. (2003) 38:288–92. doi: 10.1097/01.RLI.0000064784.68316.34
- Stehling MK, Holzknecht NG, Laub G, Böhm D, von Smekal A, Reiser M. Single- shot T1- and T2-weighted magnetic resonance imaging of the heart with black blood: preliminary experience. MAGMA. (1996) 4:231–40. doi: 10.1007/BF01772011
- Kramer CM, Barkhausen J, Flamm SD, Kim RJ, Nagel E. Society for cardiovascular magnetic resonance board of trustees task force on standardized protocols. Standardized cardiovascular magnetic resonance imaging (CMR) protocols, society for cardiovascular magnetic resonance: board of trustees task force on standardized protocols. J Cardiovasc Magn Reson. (2008) 10:35. doi: 10.1186/1532-429X-10-35
- Mitchell DG, Burk DL Jr, Vinitski S, Rifkin MD. The biophysical basis of tissue contrast in extracranial MR imaging. Am J Roentgenol. (1987) 149:831–7. doi: 10.2214/ajr.149.4.831
- Simonetti OP, Finn JP, White RD, Laub G, Henry DA. “Black blood” T2-weighted in- version-recovery MR imaging of the heart. Radiology. (1996) 199:49–57. doi: 10.1148/radiology.199.1.8633172
- Kim RJ, Wu E, Rafael A, et al. The use of contrast enhanced magnetic resonance imaging to identify reversible myocardial dysfunction. N Engl J Med. (2000) 343:1445–53. doi: 10.1056/NEJM200011163432003
- Pazos-López P, Pozo E, Siqueira ME, et al. Value of CMR for the differential diagnosis of cardiac masses. JACC Cardiovasc Imaging. (2014) 7:896–05. doi: 10.1016/j.jcmg.2014.05.009
- Restrepo CS, Largoza A, Lemos DF, et al. CT And MR imaging findings of benign cardiac tumors. Curr Probl Diagn Radiol. (2005) 34:12–21. doi: 10.1067/j.cpradiol.2004.10.002
- Grebenc ML, Rosado de Christenson ML, Burke AP, et al. Primary cardiac and pericardial neoplasms: radiologic–pathologic correlation. Radiographics. (2000) 20:107303. doi: 10.1148/radiographics.20.4.g00jl081073
- . Grebenc ML, Rosado-de-Christenson ML, Green CE, et al. From the archives of the AFIP: cardiac myxoma: imaging features in 83 patients. RadioGraphics. (2002) 22:673–89. doi: 10.1148/radiographics.22.3.g02ma02673
- El Bardissi AW, Dearani JA, Daly RC, et al. Survival after resection of primary cardiac tumors: a 48-year experience. Circulation. (2008) 118:S7–S15. doi: 10.1161/CIRCULATIONAHA.107.783126
- Donsbeck AV, Ranchere D, Coindre JM, et al. Primary cardiac sarcomas: an immunehistochemical and grading study with long-term follow-up of 24 cases. Histopathology. (1999) 34:295–04. doi: 10.1046/j.1365-2559.1999.00636.x
- . Luna A, Ribes R, Caro P, et al. Evaluation of cardiac tumors with magnetic resonance imaging. Eur Radiol. (2005) 15:1446–55. doi: 10.1007/s00330-004-2603-y
- . Schvartzman PR, White RD. Imaging of cardiac and paracardiac masses. J Thorac Imaging. (2000) 15:265–73. doi: 10.1097/00005382-200010000-00006
- Matsuoka H, Hamada M, Honda T, et al. Morphologic and histologic characterization of cardiac myxomas by magnetic resonance imaging. Angiology. (1996) 47:693–8. doi: 10.1177/000331979604700709
- Basso C, Valente M, Poletti A, Casarotto D, Thiene G. Surgical pathology of primary cardiac and pericardial tumors. Eur J Cardiothorac Surg. (1997) 12:730–7. doi: 10.1016/S1010-7940(97)00246-7
- Patel A, Au E, Donegan K, et al. Multi-detector row computed tomography for identification of left atrial appendage filling defects in patients undergoing pulmonary vein isolation for treatment of atrial fibrillation; comparison with transesophageal echocardiography. Heart Rhythm. 2008;5:253–60.
- Scheffel H, Baumueller S, Stolzmann P, et al. Atrial myxomas and thrombi: comparison of imaging features on CT. Am J Roentgenol. 2009;192:639–45.
- Della Roca DG, Forleo GB, Stazi CA, et al. Massive Left Ventricular Pseudoaneurysm 20 Years After Acute Myocardial Infarction. J Am Coll Cardiol. 2013;62:e523
- Patel J, Park C, Michaels J, et al. Pericardial Cyst: Case reports and a literature review. Echocardiography. 2004;21:269–72.
- Yared K, Baggish A, Picard M, et al. Multimodality imaging of pericardial diseases. J Am Coll Cardiol Img. 2010;3:650–60.
- Feuchtner GM, Stolzmann P, Dichtl W, et al. Multislice Computed Tomography in Infective Endocarditis: Comparison With Transesophageal Echocardiography and Intraoperative Findings. J Am Coll Cardiol. 2009;53:436–44.
- Ketelsen D, Fishman EK, Claussen CD, et al. Computed tomography evaluation of cardiac valves: a review. Radiol Clin N Am. 2010;48:783–97.
38. https://www.frontiersin.org/articles/10.3389/fcvm.2023.1009411/full#F10







