PGS. TS. HỒ HUỲNH QUANG TRÍ
Viện Tim TP. Hồ Chí Minh
MỞ ĐẦU
Kể từ khi Watson và Crick mô tả cấu trúc chuỗi xoắn kép của DNA (deoxyribonucleic acid) vào năm 1953, nhiều nhà khoa học đã nghĩ đến việc thay đổi sự biểu thị gene nhằm mục đích chữa bệnh. Kết quả của nhiều nghiên cứu là sự ra đời của một số tiếp cận điều trị tác động lên những giai đoạn khác nhau của sự biểu thị gene, ảnh hưởng đến sự tổng hợp của protein tương ứng. Năm 1961 Brenner và cộng sự nhận diện mRNA (messenger ribonucleic acid) chính là phân tử chịu trách nhiệm về việc vận chuyển thông tin di truyền từ DNA trong nhân tế bào đến bộ máy tổng hợp protein ở tế bào chất [1]. Từ phát hiện này, các nhà khoa học đã nghĩ đến việc phá hủy các “bản sao mã di truyền”, tức là mRNA, này để ngăn sự tổng hợp của protein tương ứng nhằm mục đích trị liệu. Ứng dụng can thiệp RNA (RNA interference) là một phương pháp để đạt mục đích này.
CAN THIỆP RNA
Năm 2006 hai nhà khoa học Andrew Fire và Craig Mello đã được trao giải Nobel Sinh lý học và Y học nhờ phát hiện ra hiện tượng can thiệp RNA. Can thiệp RNA là một quá trình tự nhiên diễn ra trong tế bào giúp kiểm soát hoạt động của các gene [2,3]. Quá trình này bắt đầu khi chuỗi RNA kép (double-stranded RNA) được đưa vào tế bào chất từ nguồn ngoại sinh (ví dụ nhiễm virus) hoặc nội sinh. Dưới tác dụng của một enzym ribonuclease hiện diện trong tế bào chất mang tên Dicer, chuỗi RNA kép bị cắt ra thành những đoạn RNA kép ngắn chứa 21-25 cặp base và mang 2 nucleotide lồi ra ở đầu 3’ của mỗi sợi [2,3]. Các đoạn RNA kép ngắn này được gọi là RNA can thiệp ngắn (short interfering RNA) hay RNA can thiệp kích thước nhỏ (small interfering RNA, viết tắt là siRNA). Sau khi hình thành, siRNA (gồm 2 sợi là sợi dẫn đường và sợi khách) kết hợp với một phức hợp ribonucleoprotein có tên là phức hợp gây im lặng được kích ứng bởi RNA (RNA-induced silencing complex – RISC) [4]. Argonaute-2 là một thành phần của RISC tách sợi khách ra khỏi phức hợp. Sợi dẫn đường hướng dẫn RISC đến gặp mục tiêu là phân tử mRNA, phân tử chịu trách nhiệm về việc chuyển thông tin di truyền từ nhân tế bào đến ribosome để tổng hợp protein. Dưới tác dụng của RISC, mRNA bị phân hủy và kết quả là sự tổng hợp của protein ở ribosome bị ức chế (hình 1).
Cơ sở của liệu pháp can thiệp RNA chính là việc dùng siRNA nhân tạo để ức chế sự tổng hợp của protein đích (protein mà sự tổng hợp của nó cần bị ức chế để đạt mục đích trị liệu). Các nhà nghiên cứu phải khắc phục 4 trở ngại quan trọng để ứng dụng liệu pháp can thiệp RNA vào lâm sàng [1]. Trở ngại thứ nhất là vấn đề hấp thu. siRNA bị phá hủy trong ống tiêu hóa, do đó cách dùng được chấp nhận hiện nay là truyền tĩnh mạch hoặc tiêm dưới da và trong một số trường hợp là nhỏ mắt hoặc tiêm vào sang thương da. Trở ngại thứ 2 là vấn đề phân phối. Sau khi được hấp thu, siRNA phải xâm nhập qua nội mô mao mạch thì mới đến được tế bào. Các mao mạch xoang ở gan và mao mạch trong các khối u có tính thấm cao nên siRNA dễ xâm nhập ở các vị trí này. Bước kế tiếp là xâm nhập qua màng tế bào, được thực hiện qua nhập bào. Các nghiên cứu cho thấy chỉ có 1-2% siRNA đi vào trong tế bào thoát khỏi thể endosome để kết hợp với RISC [1,2]. Trở ngại thứ 3 là vấn đề chuyển hóa và loại thải. siRNA nguyên thủy được loại thải nhanh (thời gian bán loại thải 5-10 phút) qua lọc ở cầu thận và thoái giáng bởi các enzym exonuclease và endonuclease trong huyết tương, mô và tế bào chất. Để bảo vệ siRNA khỏi bị loại thải nhanh, các nhà nghiên cứu thay đổi cấu trúc hóa học của siRNA (gốc đường, phosphate, base, các đầu cuối hoặc cấu trúc duplex) và/hoặc kết hợp với một phối tử (cholesterol, kháng thể, peptide/protein hoặc glycoprotein) hoặc bọc bên ngoài bởi một bao liposome và phần tử nano [5]. Trở ngại cuối cùng là sự kích hoạt miễn dịch và tác động ngoài mục tiêu (tác động lên gene không phải gene mục tiêu, có thể dẫn đến những hậu quả nghiêm trọng). Thay đổi cấu trúc hóa học của siRNA và kết hợp với phối tử giúp khắc phục trở ngại này.
Ứng dụng lâm sàng đầu tiên của can thiệp RNA được US FDA (Food and Drug Administration – Cơ quan quản lý thực phẩm và thuốc Hoa Kỳ) cấp phép năm 2018 là patisiran, một siRNA nhân tạo có tác dụng ức chế tổng hợp transthyretin ở gan, được dùng đường tĩnh mạch để điều trị tổn thương đa dây thần kinh ở người bệnh amyloidosis liên quan transthyretin di truyền [6]. Năm 2021 US FDA tiếp tục cấp phép cho givosiran trong chỉ định điều trị porphyria gan cấp và lumasiran trong chỉ định điều trị tăng oxalate niệu nguyên phát típ 1 [1]. Đến cuối năm 2021 US FDA cấp phép cho inclisiran trong chỉ định điều trị tăng cholesterol [7].
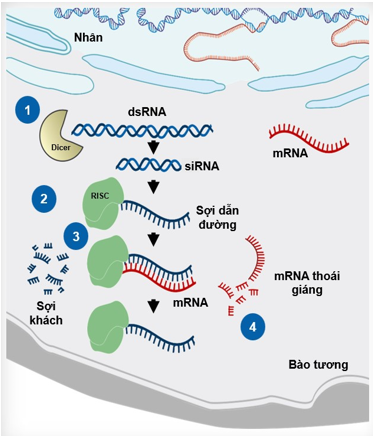
Hình 1: Quá trình can thiệp RNA. Chuỗi RNA kép (dsRNA) bị enzym Dicer cắt thành siRNA. Sau khi kết hợp với RISC, sợi khách của siRNA được tách ra, sợi dẫn đường hướng dẫn phức hợp RISC đến gắn với mRNA đích và gây thoái giáng mRNA đích.
INCLISIRAN – ỨNG DỤNG CAN THIỆP RNA VÀO ĐIỀU TRỊ HẠ CHOLESTEROL
PCSK9 (proprotein convertase subtilisin kexin 9) là một protein được gan tổng hợp. Sau khi được tiết vào huyết tương, PCSK9 gắn vào các thụ thể LDL trên bề mặt tế bào gan, qua đó tăng cường sự thoái giáng các thụ thể LDL trong endosome/lysosome và ngăn sự tái sử dụng các thụ thể này. Kết quả là số lượng thụ thể LDL giảm dẫn đến giảm bắt giữ LDL-cholesterol từ huyết tương [8]. Từ cơ chế tác động của PCSK9 có thể suy ra là ức chế tổng hợp protein này sẽ dẫn đến tăng số lượng các thụ thể LDL và giảm nồng độ LDL-C trong huyết tương.
Inclisiran là một siRNA gây thoái giáng mRNA chịu trách nhiệm về sự tổng hợp PCSK9. Hai sợi RNA của inclisiran (sợi dẫn đường và sợi khách) được gắn với liên hợp N-acetylgalactosamine (GalNAc) ở một đầu (hình 2). GalNAc là một glycoprotein có ái lực cao với các thụ thể asialoglycoprotein (ASGPR) hiện diện với số lượng nhiều và đặc hiệu trên màng tế bào gan. Liên hợp GalNAc giúp inclisiran xâm nhập chọn lọc vào tế bào gan là nơi tổng hợp PCSK9 [1].

Hình 2: Cấu trúc của inclisiran gồm sợi dẫn đường chứa 23 base, sợi khách chứa 21 base và liên hợp GalNAc ở đầu.
Inclisiran được dùng đường tiêm dưới da (284 mg tiêm dưới da, nhắc lại sau 3 tháng và sau đó mỗi 6 tháng). Hiệu quả hạ LDL-C của inclisiran được chứng minh một cách thuyết phục qua chuỗi nghiên cứu ORION (bảng 1). Tổng hợp số liệu của 3 nghiên cứu ORION-9, ORION-10 và ORION-11 cho thấy inclisiran hạ LDL-C 50,5% (KTC 95% từ 48,9% đến 52,1%; p <0,0001) vào ngày thứ 510 so với ban đầu [11]. Tính an toàn của inclisiran tương đương placebo. Các biến cố ngoại ý tại chỗ tiêm thường gặp hơn ở nhóm inclisiran so với ở nhóm placebo (5,0% so với 0,7%) nhưng hầu hết là nhẹ, không có trường hợp nào nặng hoặc kéo dài dai dẳng [11]. Ở người châu Á (Trung Quốc, Hàn Quốc, Singapore, Đài Loan), nghiên cứu ORION-18 chứng tỏ inclisiran có hiệu quả hạ LDL-C mạnh (mức giảm trung bình vào ngày 330 là 57,2%, p <0,001) và an toàn tương đương placebo [12].
Văn kiện đồng thuận của các chuyên gia Trường Môn Tim Hoa Kỳ (American College of Cardiology) về vai trò của các liệu pháp hạ LDL-C ngoài statin khuyến cáo phối hợp thêm inclisiran cho người có bệnh tim mạch xơ vữa có LDL-C ≥55-70 mg/dL dù đã dùng statin với liều tối đa dung nạp được [13]. Hướng dẫn của Trường Môn Tim và Hiệp hội Tim Hoa Kỳ về điều trị bệnh mạch vành mạn cũng khuyến cáo phối hợp thêm inclisiran cho người bệnh có LDL-C ≥70 mg/dL dù đã dùng statin với liều tối đa dung nạp được [14].
Bảng 1: Chuỗi nghiên cứu ORION đánh giá hiệu quả hạ LDL-C của inclisiran.
| Nghiên cứu | Đối tượng | Mức hạ LDL-C vào ngày 510 so với ban đầu |
| ORION-9 [9] | 482 người tăng cholesterol gia đình dị hợp tử, LDL-C trung bình ban đầu 153 mg/dL | 39,7% (KTC 95% từ 35,7% đến 43,7%) |
| ORION-10 [10] | 1561 người có bệnh tim mạch xơ vữa, LDL-C trung bình ban đầu 104,7 ± 38,3 mg/dL | 52,3% (KTC 95% từ 48,8% đến 55,7%) |
| ORION-11 [10] | 1617 người có bệnh tim mạch xơ vữa, đái tháo đường típ 2, tăng cholesterol gia đình hoặc nguy cơ biến cố 10 năm ≥20% theo thang điểm Framingham | 49,9% (KTC 95% từ 46,6% đến 53,1%) |
CAN THIỆP RNA TRONG PHÒNG NGỪA VÀ ĐIỀU TRỊ BỆNH TIM MẠCH
Can thiệp RNA cũng đang được nghiên cứu trong điều trị tăng lipid máu hỗn hợp, tăng lipoprotein(a) và tăng huyết áp. Bảng 2 tóm tắt kết quả của các nghiên cứu pha 1 và pha 2 đánh giá hiệu quả của một số liệu pháp can thiệp RNA trong phòng ngừa và điều trị bệnh tim mạch.
Bảng 2: Nghiên cứu về can thiệp RNA trong phòng ngừa và điều trị bệnh tim mạch.
| Thuốc | Protein đích | Đối tượng | Kết quả nghiên cứu |
| Plozasiran (tiêm dưới da) | APOC3 | 353 người tăng lipid máu hỗn hợp (TG 244 mg/dL, non-HDL-C 151 mg/dL) | Liều 10-50 mg hạ TG 50-62%, đồng thời hạ cả non-HDL-C và tăng HDL-C [15] |
| Zodasiran (tiêm dưới da) | ANGPTL3 | 204 người tăng lipid máu hỗn hợp (TG 246 mg/dL, non-HDL-C 146 mg/dL) | Liều 50-200 mg hạ TG 51-63%, hạ non-HDL-C 29-36%, hạ LDL-C 16-20% [16] |
| Olpasiran (tiêm dưới da) | Lipoprotein(a) | 281 người có bệnh tim mạch xơ vữa và nồng độ lipoprotein(a) >150 nmol/L | Liều 10-75 mg/12 tuần và 225 mg/12-24 tuần hạ lipoprotein(a) 70-100% sau 36 tuần [17] |
| Zerlasiran (tiêm dưới da) | Lipoprotein(a) | 178 người có bệnh tim mạch xơ vữa và nồng độ lipoprotein(a) >125 nmol/L | Liều 450 mg/24 tuần và 300 mg/16-24 tuần hạ lipoprotein(a) 90-96,4% sau 36 tuần [18] |
| Zilebesiran (tiêm dưới da) | Angiotensinogen | 107 bệnh nhân tăng huyết áp, tuổi trung bình 53,5, nam giới 62% | Liều 200-800 mg hạ huyết áp tâm thu 12,5-22,5 mmHg và huyết áp tâm trương 5,7-10,8 mmHg sau 24 tuần [19] |
| 394 bệnh nhân tăng huyết áp, tuổi trung bình 56,8, nam giới 55,7% | Liều 150-600 mg hạ huyết áp tâm thu 7,3-10 mmHg sau 3 tháng [20] |
KẾT LUẬN
Nhờ những tiến bộ của công nghệ sinh học, can thiệp RNA từ một hiện tượng tự nhiên đã được biến thành một liệu pháp điều trị một số bệnh di truyền hiếm và bệnh mạn tính không lây như rối loạn lipid máu, tăng huyết áp, ung thư. Trong lĩnh vực tim mạch học có 3 vấn đề cần được giải quyết để liệu pháp can thiệp RNA chiếm được một vị trí vững chắc. Hai vấn đề đầu là chứng cứ về ảnh hưởng của liệu pháp này trên các biến cố “cứng” (tử vong và biến cố tim mạch nặng) và dữ liệu an toàn về dài hạn. Có nhiều khả năng 2 vấn đề này sẽ được giải quyết trong một tương lai gần. Vấn đề thứ 3 là chi phí của liệu pháp, nếu vẫn ở mức cao như hiện nay thì sẽ gây trở ngại cho việc áp dụng thực hành. Tuy nhiên bất chấp những vấn đề còn tồn tại nói trên, không thể phủ nhận liệu pháp can thiệp RNA là một đột phá quan trọng và đang mở ra một triển vọng mới trong dự phòng và điều trị bệnh tim mạch xơ vữa.
TÀI LIỆU THAM KHẢO
1) Ranasinghe P, Addison ML, Dear W, Webb DJ. Small interfering RNA: Discovery, pharmacology and clinical development – An introductory review. Br J Pharmacol 2023;180:2697-2720.
2) Dana H, Chalbatani GM, Mahmoodzadeh H, et al. Molecular mechanisms and biological functions of siRNA. Int J Biomed Sci 2017;13:48-57.
3) Zhang J, Chen B, Gan C, et al. A comprehensive review of small interfering RNAs (siRNAs): Mechanism, therapeutic targets, and delivery strategies for cancer therapy. Int J Nanomed 2023;18:9605-7635.
4) Svoboda P. Key mechanistic principles and considerations concerning RNA interference. Fronters in Plant Science 2020;11:1237.
5) Zhang MM, Bahal R, Rasmussen TP, et al. The growth of siRNA-based therapeutics: Updated clinical studies. Biochem Pharmacol 2021;189:114432.
6) Adams D, Gonzalez-Duarte A, O’Riordan WD, et al. Patisiran, an RNAi therapeutic, for hereditary transthyretin amyloidosis. N Engl J Med 2018;379:11-21.
7) FDA approves Novartis Leqvio (inclisiran), first-in-class siRNA to lower cholesterol and keep it low with two doses a year. Novartis (Press release). 22 December 2021.
8) Seidah NG, Awan Z, Chretien M, Mbikay M. PCSK9: a key modulator of cardiovascular health. Circ Res 2014;114:1022-1036.
9) Raal FJ, Kallend D, Ray KK, et al, for the ORION-9 Investigators. Inclisiran for the treatment of heterozygous familial hypercholesterolemia. N Engl J Med 2020;382:1520-1530.
10) Ray KK, Wright SC, Kallend D, et al, for the ORION-10 and the ORION-11 Invstigators. Two phase III trials of inclisiran in patients with elevated LDL cholesterol. N Engl J Med 2020;382:1507-1519/
11) Wright RS, Ray KK, Raal FJ, et al, ORION Phase III Investigators. Pooled patient-level analysis of inclisiran trials in patients with familial hypercholesterolemia or atherosclerosis. J Am Coll Cardiol 2021;77:1182-1193.
12) Huo Y, Lesogor A, Lee CW, et al. Efficacy and safety of inclisiran in Asian patients: Results from ORION-18. JACC Asia 2024;4:123-134.
13) Lloyd-Jones DM, Morris PB, Ballantyne CM et al. 2022 Expert Consensus Decision Pathway on the role of nonstatin therapies for LDL-cholesterol lowering in the management of atherosclerotic cardiovascular disease risk. J Am Coll Cardiol. https://doi.org/10.1016/j.jacc.2022.07.006
14) Virani SS, Newby LK, Arnold SV, et al. 2023 AHA/ACC/ACCP/ASPC/NLA/PCNA Guideline for the management of patients with chronic coronary disease: A report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation 2023. DOI:10.1161/CIR.0000000000001168.
15) Ballantyne CM, Vasas S, Azizad M, et al. Plozasiran, an RNA interference agent targeting APOC3, for mixed hyperlipidemia. N Engl J Med 2024;391:899-912.
16) Rosenson SS, Gaudet D, Hegele RA, et al, for the ARCHES-2 Trial Team. Zodasiran, an RNAi therapeutic targeting ANGPTL3, for mixed hyperlipidemia. N Engl J Med 2024;391:913-925.
17) O’Donoghue ML, Rosenson RS, Gencer B, et al, for the OCEAN(a)-DOSE Trial Investigators. Small interfering RNA to reduce lipoprotein(a) in cardiovascular disease. N Engl J Med 2022;387:1855-1864.
18) Nissen SE, Wang Q, Nicholls SJ, et al. Zerlasiran – a small interfering RNA targeting lipoprotein(a): A phase 2 randomized clinical trial. JAMA 2024;332:1992-2002.
19) Desai AS, Webb DJ, Taubel J, et al. Zilebesiran, an RNA interference therapeutic agent for hypertension. N Engl J Med 2023;389:228-238.
20) Bakris GL, Saxena M, Gupta A, et al, for the KARDIA-1 Study Group. RNA interference with zilebesiran for mild to moderate hypertension: The KARDIA-1 randomized clinical trial. JAMA 2024;331:740-749.







