BS. NGUYỄN XUÂN VINH
BS. NGUYỄN THANH HIỀN
1. MỞ ĐẦU
Bệnh mạch vành (CAD – coronary artery disease) là bệnh tim mạch phổ biến nhất, gây tử vong lên đến 380,000 người trên thế giới năm 2020 [1]. Điều trị CAD bao gồm thay đổi lối sống, điều chỉnh các yếu tố nguy cơ, thuốc và các phương thức xâm lấn (phẫu thuật hay qua da), tùy thuộc vào triệu chứng, mức độ, hoặc biểu hiện lâm sàng của bệnh (cấp hay mạn). Gần đây đã có nhiều tiến bộ trong kỹ thuật chẩn đoán và điều trị bệnh mạch vành. Những kỹ thuật này bao gồm các đánh giá về mặt sinh lý của CAD, bổ sung vào các đánh giá về giải phẫu; các dấu ấn sinh học; và microRNAs giúp phát hiện CAD. Các loại thuốc mới giúp giảm biến cố tim mạch và những tiến bộ trong điều trị xâm lấn. Bên cạnh đó, sự hỗ trợ của robot, kỹ thuật nano, tế bào gốc, và in 3D cũng có ích trong quan sát rõ mức độ hẹp mạch vành. Trong bài này, chúng tôi sẽ tóm lược y văn về những tiến bộ gần đây trong chiến lược chẩn đoán CAD. Bài tiếp theo sẽ là những tiến bộ trong điều trị CAD mạn.
2. CÁC TIẾN BỘ TRONG CHẨN ĐOÁN BỆNH MẠCH VÀNH
CAD được đánh giá qua giải phẫu và qua chức năng. Đánh giá qua giải phẫu dựa trên việc quan sát mạch vành và phát hiện các điểm tắc nghẽn cơ học. Cách thức đánh giá này dựa trên chụp mạch vành, giúp quan sát rõ bờ mạch máu bằng cản quang và tia xạ. Cũng cùng cơ chế tương tự nhưng không xâm lấn là chụp cắt lớp vi tính (CT – computed tomography). CT ngày càng được sử dụng nhiều trong thực hành, với lợi ích không chỉ cho biết cấu trúc mạch máu mà còn mức độ hẹp, thang điểm vôi hóa mạch vành (CAC – coronary artery calcium). Bên cạnh đó, các phương tiện hình ảnh học nội mạch cũng có bước tiến đáng kể, bao gồm siêu âm trong lòng mạch (IVUS) và chụp cắt lớp quang học mạch máu (OCT). Mới đây, một kỹ thuật đánh giá mảng xơ vữa đã được phát triển, là chụp quang phổ cận hồng ngoại (NIRS) (Bảng 1).
Tuy vậy, chụp mạch vành đơn thuần chưa đánh giá chính xác ảnh hưởng trên chức năng của các sang thương hẹp; đôi khi, các vị trí hẹp nặng trên chụp mạch vành không đồng nghĩa với làm chậm dòng máu chảy lúc bình thường hay lúc kích thích tối đa. Các đánh giá sinh lý của CAD sẽ giúp giải quyết hạn chế này. Phương pháp đánh giá sinh lý được sử dụng rộng rãi nhất là điện tâm đồ gắng sức. ECG lúc nghỉ có thể có những gợi ý CAD, tuy vậy ở những bệnh nhân ổn định, những thay đổi trên ECG khi nghỉ không thường xuất hiện nếu không có tăng nhu cầu chuyển hóa cơ bản, bởi vì các tắc nghẽn mạch vành trong bối cảnh mạn tính là cố định. Các phương tiện hnhf ảnh, như siêu âm tim gắng sức, chụp cắt lớp vi tính đơn photon (SPECT), chụp cộng hưởng từ tim (CMR) hay cắt lớp xạ hình (PET) là các phương tiện đánh giá thiếu máu cục bộ chính xác hơn. Tất cả những phương tiện này đều có độ chính xác trong phát hiện thiếu máu cục bộ hơn 80% [2]. SPECT và CMR là các phương tiện đang được áp dụng nhiều trên thế giới để xác định rõ vùng thiếu máu cơ tim cục bộ, đặc biệt ở những người nghi ngờ CAD với xác xuất tiền nghiệm trung bình. Bên cạnh đó, các phương tiện đánh giá chức năng xâm lấn cũng được áp dụng nhiều hơn trước, bao gồm đo phân suất dự trữ dòng (FFR), chỉ số sóng tự do tức thời (iFR), dự trữ lưu lượng vành (CFR), và chỉ số định định lượng dòng (QFR).
Cuối cùng, các dấu ấn sinh học là các tiến bộ gần nhất để phát hiện CAD. Các microRNAs trong máu được xem là các mục tiêu tiềm năng cho mục đích này. Bên cạnh đó, sự tích tụ mỡ quanh thành mạch cũng được nghiên cứu và cho thấy có mối liên quan với hoạt tính phản ứng viêm – miễn dịch tại chỗ, và có liên hệ với sự mất ổn định của mảng xơ vữa [3]. Bảng 1 và 2 liệt kê các phương thức trên cụ thể hơn.
Bảng 1. Đặc điểm của các phương thức đánh giá giải phẫu trong bệnh mạch vành [4]
| IVUS | OCT | NIRS | |
| Độ phân giải | + | ++ | – |
| PCI (kích thước, độ nở stent) | ++ | ++ | – |
| Lõi hoại tử | + | + | ++ |
| Mảng xơ vữa nắp mỏng | ± | ++ | – |
| Huyết khối | ± | + | – |
| Độ che phủ mô của stent | + | ++ | – |
| Vôi hóa | + | ++ | – |
| Tái cấu trúc | ++ | – | – |
| Tăng sản nội mạc | + | ++ | – |
| Cần khung hình không có máu | Không | Có | Không |
Bảng 2. Đặc điểm của các phương thức đánh giá sinh lý trong bệnh mạch vành [5]
| Phương thức | Ưu điểm | Nhược điểm |
| FFR | Có các nghiên cứu tiên lượng | Dây dẫn: chi phí, biến chứng
Kích thích tối đa: chi phí, tác dụng phụ adenosine Tăng thời gian thủ thuật |
| iFR | Đã kiểm định qua các nghiên cứu không thua kém so với FFR
Độc lập với kích thích tối đa Nhanh hơn FFR |
Dây dẫn: chi phí, biến chứng
Kích thích tối đa: chi phí, tác dụng phụ adenosine Cần phần mềm chuyên biệt |
| QFR | Độc lập với kích thích tối đa
Không dây dẫn áp lực |
Cần phần mềm chuyên biệt
|
| CCTA-FFR | Không xâm lấn
Tăng ứng dụng của CCTA |
Chi phí
Phân tích ngoại tuyến |
| CFR | Khảo sát toàn bộ cây mạch vành
Khả năng tiên lượng Đánh giá toàn diện (vi và đại tuần hoàn) |
Tính dao động: nội tại kèm tình trạng dao động khi nghỉ
Dây dẫn: chi phí, biến chứng Kích thích tối đa: chi phí, tác dụng phụ adenosine Tăng thời gian thủ thuật |
| IMR | Phân tích vi tuần hoàn | Dây dẫn: chi phí, biến chứng
Kích thích tối đa: chi phí, tác dụng phụ adenosine Tăng thời gian thủ thuật |
| HMR | Phân tích vi tuần hoàn | Dây dẫn: chi phí, biến chứng
Kích thích tối đa: chi phí, tác dụng phụ adenosine Tăng thời gian thủ thuật Doppler: chi phí; tín hiệu Dopper không phân tích được ở 30% bệnh nhân Không có ngưỡng cắt |
2.1. Các phương tiện đánh giá giải phẫu
2.1.1. Siêu âm trong lòng mạch (IVUS)
IVUS đóng vai trò quan trọng trong sự phát triển của can thiệp nội mạch. IVUS không chỉ giúp đánh giá giải phẫu về độ nặng sang thương, hình thái mảng xơ vữa mà còn giúp đặt stent tối ưu hơn và đánh giá tắc nghẽn trong stent [6]. Hơn nữa, IVUS còn là một công cụ quan trọng trong đánh giá những bệnh nhân nhồi máu cơ tim không có tắc nghẽn động mạch vành (MINOCA).
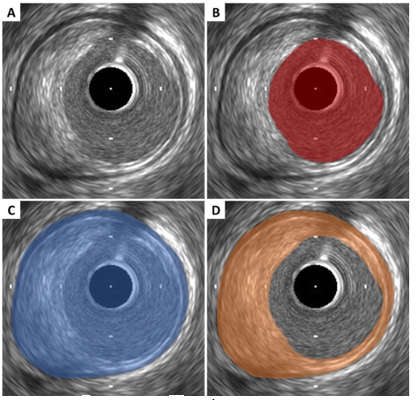
Hình 1. Hình ảnh IVUS một mạch vành xơ vữa [7]
A: Hình ảnh cắt ngang mạch vành có mảng xơ vữa; B: diện tích lòng mạch được đo từ bờ của lớp nội mạc; C: Diện tích màng chun ngoài được đo từ bờ giữa lớp trung và ngoại mạc; D: diện tích mảng xơ vữa được tính bằng (C – B)
Kỹ thuật IVUS dựa trên sự thu hình ảnh nội mạch với sự hỗ trợ của bộ chuyển đổi đặt ở đầu ống thông trong lúc chụp mạch vành, từ đó thu được hình ảnh cắt ngang lòng mạch máu. Sóng của IVUS đi xuyên qua máu và từng lớp mạch máu: nội mạc (phản hồi một phần các sóng này, tạo hình ảnh sáng), trung mạc (thường tối), và ngoại mạc (cũng sáng) [8]. Đặc tính cắt ngang này của mạch máu cho phép hiểu rõ hơn về giải phẫu của mảng xơ vữa so với chụp mạch vành thông thường. Sự hiện diện và mức độ nặng của vôi hóa trong một sang thương cũng có thể được đánh giá kỹ hơn. IVUS đặc biệt có ích trong việc phát hiện các bóc tách và mảng xơ vữa đồng tâm không quan sát được trên chụp mạch vành thông thường, mà chính những sang thương này có thể là nguyên nhân của MINOCA. Hiện nay đã có nhiều nghiên cứu lâm sàng đánh giá sự hữu ích của IVUS trong thực hành [9], [10]. Diện tích lòng mạch tối thiểu (MLA – minimal lumen area) qua IVUS là một thành tố để đánh giá thiếu máu cục bộ [11], [11]. Park và cộng sự ghi nhận ở những bệnh nhân có hẹp lỗ thân chung đơn độc và hẹp trung bình thân chung vành trái, MLA trên IVUS ≤ 4,5 mm2 là một chỉ số hữu ích tương đương với FFR ≤ 0,08 [11]. Tuy vậy, con số này cũng thay đổi dựa trên vị trí của sang thương, do đó gây ra hạn chế trong sử dụng thường ngày.
Nghiên cứu PROSPECT (Providing Regional Observations to Study Predictors of Events in the Coronary Tree) [12] đánh giá ứng dụng của IVUS trong dự đoán biến cố sau hội chứng vành cấp (ACS). Tần suất cộng gộp sau 3 năm biến cố tim mạch chính (MACEs) là 20,4%. Gần một nửa trong số này là ở các sang thương không phải thủ phạm, và các yếu tố nguy cơ liên quan mảng xơ vữa bao gồm gánh nặng xơ vữa ≥ 70% (HR 5,03) và MLA ≤ 4 mm2 (HR 3,21). Bên cạnh đó, các tác giả cũng phân tích dựa trên tần số sóng để ước đoán thành phần mảng xơ vữa, và kết luận rằng mảng xơ vữa nắp mỏng cũng là dạng có nguy cơ cao hơn (HR 3,35). PCI dựa trên IVUS cũng đã được chứng minh tính ưu việt trong giảm MACEs [13] và thất bại mạch đích [14].
2.1.2. Quang phổ cận hồng ngoại (NIRS)
NIRS cho phép ghi nhận hình ảnh xuyên máu và mô để phát hiện mảng xơ vữa có chứa lõi lipid. Kỹ thuật này dựa trên phân tích phổ của mảng xơ vữa với các dụng cụ dựa trên ống thông. Ý tưởng của quang phổ dựa trên việc các vật liệu khác nhau sẽ có tương tác khác nhau với ánh sáng, tức có thể bị hấp thụ hoặc phản chiếu trong mô đó [15], [16]. Những tương tác khác nhau này dẫn tới những đặc điểm điển hình trên quang phổ, cho phép người phân tích đánh giá thành phần của các vật liệu này. Kỹ thuật này được sử dụng rộng rãi trong các lĩnh vực khoa học khác, ví dụ như có thể cho phép xác định các vật thể không gian xa trong thiên văn học.
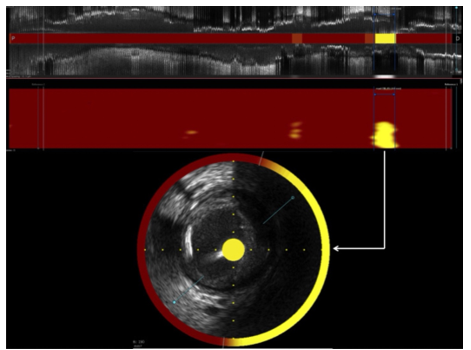
Hình 2. Hình ảnh học kết hợp NIRS-IVUS trên bệnh mạch vành [17]
Hình ảnh IVUS ở trên cho thấy mảng xơ vữa vôi hóa trải khắp mạch máu. Hình ảnh NIRS ở dưới cho thấy mảng xơ vữa giàu lipid lớn (chấm vàng) ở đầu tận
Phổ sóng cộng hưởng bao gồm dải các bước sóng khác nhau, từ dài tới ngắn: sóng radio, vi sóng, hồng ngoại, ánh sáng nhìn thấy được, tia cực tím, tia X, và tia gamma. Mắt thường chỉ thu nhận được bước sóng của ánh sáng nhìn thấy được, còn các dụng cụ có thể đánh giá các bước sóng khác [18]. Đây là cơ sở ứng dụng của NIRS.
Kỹ thuật NIRS đã được đánh giá trong một số nghiên cứu [19], [20]. Nghiên cứu PROSPECT đánh giá thành phần mảng xơ vữa với phân tích bằng tần số sóng, cũng tương tự với NIRS [12]. Nghiên cứu PROSPECT II (Providing Regional Observations to Study Predictors of Events in the Coronary Tree II) nghiên cứu khả năng của IVUS và NIRS trong phát hiện các mảng xơ vữa không ổn định trong mạch vành [21]. Nghiên cứu này thu nhận những bệnh nhân nhồi máu cơ tim giai đoạn cấp/bán cấp (lên tới 4 tuần). Sau khi điều trị thành công tất cả các sang thương có gây hạn chế dòng chảy ở những bệnh nhân này, hình ảnh học nội mạch được sử dụng ở 6-10 cm đoạn gần tất cả 3 nhánh mạch vành chính bằng IVUS kết hợp NIRS. Các tác giả ghi nhận nguy cơ MACE cao hơn ở những bệnh nhân có những sang thương giàu lipid (OR hiệu chỉnh 2,27; 95% CI 1,25 – 4,13) và gánh nặng sơ vữa cao. Những bệnh nhân có sang thương gồm cả 2 yếu tố trên có tần suất MACEs 4 năm là 7%, trong khi người có gánh nặng xơ vữa cao mà không có dấu hiệu giàu lipid thì tần suất là 2,2%.
2.1.3 Chụp cắt lớp quang học (OCT)
OCT là một phương thức hình ảnh học nội mạch khác có cơ chế dựa trên sự phản hồi ánh sáng để tạo nên các hình ảnh cắt ngang mạch máu. So với IVUS, OCT có cả ưu điểm và nhược điểm.
Một ưu điểm dễ nhận biết nhất của OCT là độ phân giải hình ảnh cao hơn IVUS, do đó OCT có thể có đánh giá chính xác hơn về mảng xơ vữa nắp mỏng, độ áp của stent, bóc tách mạch vành, và tăng sinh nội mạc, và những điểm khác [10], [21]. Hơn nữa, OCT cũng có thể được sử dụng để đánh giá các mảng xơ vữa vôi hóa và huyết khối vì IVUS cũng có giới hạn trong các trường hợp này [22], [8], [23]. OCT còn một ưu điểm nữa là có thể dựng hình 3D mạch máu tốt hơn khi cần [22], [23].
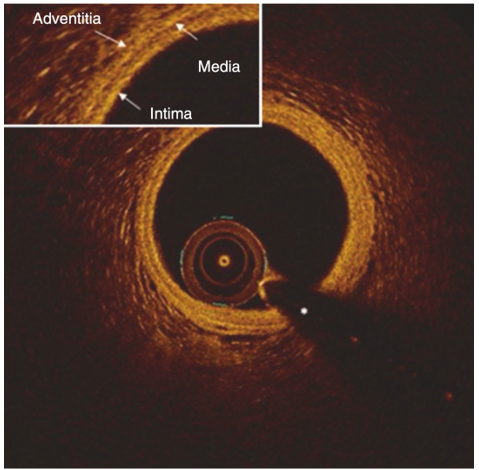
Hình 3. Hình ảnh OCT mạch vành bình thường [24]
Tuy vậy, OCT đòi hỏi bơm cản quang vào vùng không có máu vì máu có thể làm tín hiệu ánh sáng bị nhiễu, do vậy có thể cần một lượng cản quang nhiều hơn IVUS [8], [23]. Một nhược điểm khác của việc cần khoảng không không có máu đó là các sang thương ở vị trí lỗ xuất phát có thể không được đánh giá đầy đủ. MLA đo qua OCT có ngưỡng tuyệt đối thấp hơn IVUS và có giá trị tiên đoán dương (PPV) tốt và giá trị tiên đoán âm thấp (NPV) với các sang thương có ý nghĩa trên FFR [8], [23].
2.2. Các phương tiện đánh giá chức năng
2.2.1. Phân suất dự trữ dòng (FFR)
FFR là một chỉ số xâm lấn dánh giá mức độ hẹp về mặt chức năng dựa trên đo lường về áp lực dòng máu trong lúc chụp mạch vành [25]. Kỹ thuật này được dùng để đánh giá dòng máu đầu xa tối đa đến cơ tim từ một mạch máu bị hẹp, biểu hiện bằng tỉ lệ so với dòng máu tối đa lúc bình thường. Công thức này dựa trên 2 thành phần, đầu tiên là vị trí của dây dẫn đo áp lực đầu xa so với sang thương và thứ hai là cần sử dụng chất dãn mạch để đạt kích thích tối đa. Áp lực đầu xa sang thương sau đó được so với tham chiếu thông thường, mà thường là áp lực tại gốc động mạch chủ. Ở những tình huống thông thường, tỉ số tại một điểm bất kỳ tại mạch máu thượng tâm mạc so với tham chiếu chuẩn là một. Điều này cũng có nghĩa dòng máu không bị hạn chế có ý nghĩa. Pijls và cộng sự ghi nhận FFR < 0,75 sẽ phân biệt tốt những vị trí hẹp mạch vành có liên quan với thiếu máu cục bộ hay là không [26]. Trong một nghiên cứu khác, Pijls và cộng sự so sánh FFR với những công cụ không xâm lấn khác (nghiệm pháp gắng sức với xe đạp, xạ hình với thalium, siêu âm tim gắng sức với dobutamine, và chụp mạch vành định lượng) [27]. Tất cả những bệnh nhân có FFR < 0,75 có ít nhất 1 trong các kết quả này dương tính với thiếu máu cục bộ. Bằng chứng này ủng hộ mạnh mẽ rằng FFR là một công cụ chính xác trong phát hiện thiếu máu cục bộ. Tuy vậy, ứng dụng lâm sàng của các kết quả này là còn chưa rõ.
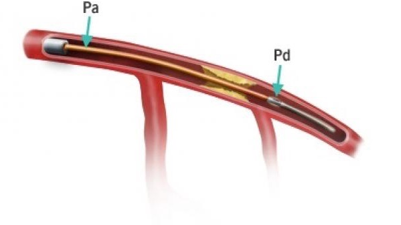
Hình 4. Hình ảnh mô phỏng phương thức đo FFR ở sang thương hẹp trung bình lòng động mạch vành
Nghiên cứu FAME (Fractional Flow Reserve Versus Angiography for Multivessel Evaluation) [28] là nghiên cứu đầu tiên đánh giá ứng dụng lâm sàng của FFR. Kết quả từ nghiên cứu cho thấy PCI dựa trên FFR có liên quan với tỉ lệ MACEs (cộng gộp của tử vong, nhồi máu cơ tim, hoặc bất kỳ tái thông lại nào) thấp hơn có ý nghĩa so với PCI với chụp mạch vành đơn thuần ở những bệnh nhân có bệnh nhiều nhánh mạch vành mà không làm tăng đáng kể thời gian thủ thuật cũng như chi phí thấp hơn và thay đổi nhân sự không đáng kể.
Nghiên cứu FAME 2 (Fractional Flow Reserve versus Angiography for Multivessel Evaluation 2) đánh giá liệu PCI với FFR kèm với điều trị nội khoa tối ưu có vượt trội hơn chỉ điều trị nội khoa tối ưu trong giảm MACEs ở những bệnh nhân CAD ổn định hay không [29]. PCI chỉ được tiến hành ở những bệnh nhân có FFR ≤ 0,08. Việc tuyển lựa bệnh nhân phải dừng sớm vì sự khác biệt đáng kể trong tỉ lệ biến cố kết cục chính giữa 2 nhóm. Tuy vậy, quy trình nghiên cứu không được làm mù liên quan đến sang thương nào được xem là có ý nghĩa về huyết động, và phần lớn các biến cố là tái thông dựa trên triệu chứng xảy ra chủ yếu trong nửa đầu của nghiên cứu.
Nghiên cứu FAME 3 (Fractional Flow Reserve versus Angiography for Multivessel Evaluation 3) so sánh phẫu thuật bắc cầu mạch vành (CABG) với PCI có hướng dẫn FFR cho CAD 3 nhánh mạch vành [30]. Kết quả cho thấy PCI sử dụng FFR với DES thế hệ hiện tại không đạt tiêu chí không thua kém so với CAGE sau 1 năm theo dõi (HR 1,5; 95% CI 1,10 – 2,20; p = 0,35 cho không thua kém). Tuy vậy, thời gian theo dõi ngắn (1 năm) có thể đã đánh giá thấp lợi ích của CABG khi trong các nghiên cứu khác, lợi ích này thường cộng gộp sau nhiều năm theo dõi.
Tóm lại, FFR có vẻ là một phương tiện an toàn để xác định liệu sang thương nào không cần điều trị thêm nữa. Tuy vậy, giá trị của FFR trên lâm sàng là còn bàn cãi.
2.2.2. FFR trên CT (CCTA-FFR)
Dù còn một số tranh cãi, FFR đã được áp dụng vào thực hành lâm sàng trong đánh giá CAD mạn tính. Tuy vậy, bản chất xâm lấn của FFR còn làm hạn chế tính ứng dụng của nó.
Chụp cắt lớp vi tính mạch vành (CCTA) là một phương pháp không xâm lấn được sử dụng ngày càng nhiều ở những bệnh nhân đau ngực. Phương pháp này cho kết quả chấp nhận được về giải phẫu, nhưng hạn chế về chức năng. Do đó, FFR dựa trên CCTA nổi lên là một phương pháp thay thế, có thể kết hợp đánh giá cả giải phẫu và chức năng qua một phương thức không xâm lấn. FFR ban đầu dựa trên đo trực tiếp áp lực đầu gần và đầu xa, thì CCTA-FFR dựa trên động học dòng chảy để tính toán [31].
Min và cộng sự so sánh 252 bệnh nhân được dùng CCTA, CCTA-FFR, ICA và FFR để xác định thiếu máu cục bộ [32]. So với ICA và FFR thì CT và CCTA-FFR có độ chính xác trong chẩn đoán là 73%, độ nhạy 90%, độ đặc hiệu 54%, PPV 67% và NPV 84%. CCTA-FFR so với CT đơn thuần có cải thiện được diện tích dưới đường cong (AUC) (0,81 so với 0,68). Cũng cần lưu ý là nghiên cứu này báo cáo cần khoảng 6 giờ cho mỗi ca sử dụng CCTA-FFR. Hơn nữa, 46,5% số bệnh nhân có CAD tắc nghẽn trên ICA thì con số này là 53,2% với CT. Trong số này, 37,1% có FFR < 0,80 và 53,3% có CCTA-FFR < 0,80. Tương tự như vậy nghiên cứu DISCOVER-FLOW (Diagnosis of Ischemia-Causing Stenosis Obtained via Noninvasive Fractional Flow Reserve) so sánh CCTA-FFR với ICA và FFR ghi nhận độ chính xác trong chẩn đoán là 84,3%, độ nhạy 87,9%, độ đặc hiệu 82,2%, PPV 73,9% và NPV 92,2% [33].
Một lưu đồ ứng dụng khác của CCTA-FFR được thử nghiệm đối đầu với chụp mạch vành kèm FFR ở 251 bệnh nhân nghi ngờ CAD trong nghiên cứu NXT (Analysis of Coronary Blood Flow Using CT Angiography: Next Steps) [34]. Nghiên cứu này báo cáo độ chính xác trong chẩn đoán, độ nhạy, độ đặc hiệu, PPV và NPV của CCTA-FFR lần lượt là 81%, 86%, 79%, 65% và 93%.
Trong nghiên cứu PLATFORM (Prospective Longitudinal Trial of FFRCT: Outcome and Resource Impacts), CCTA-FFR được đưa vào thực hành hàng ngày, và những bệnh nhân đau ngực có kế hoạch thực hiện nghiệm pháp không xâm lấn hoặc chụp mạch vành xâm lấn được chia thành các nhóm: nhóm vẫn thực hiện theo kế hoạch đã có, hoặc nhóm CCTA-FFR trước [35]. Từ đó có 4 nhóm được hình thành: (1) nghiệm pháp không xâm lấn tieu chuẩn, (2) ICA; (3) CCTA-FFR trước cho những bệnh nhân có kế hoạch ban đầu là nghiệm pháp không xâm lấn, và (4) CCTA-FFR trước cho những bệnh nhân có kế hoạch ban đầu là ICA. Khi so sánh giữa các nhóm, các nhà nghiên cứu thấy 73,3% số bệnh nhân nhóm ICA có chụp mạch vành không ghi nhận CAD tăc nghẽn, trong khi chỉ có 12,4% số bệnh nhân thực hiện CCTA-FFR từ đầu và cần ICA sau đó có kết quả chụp mạch vành là không có CAD tắc nghẽn. MACEs (tử vong, nhồi máu cơ tim hoặc tái thông không có kế hoạch) là thấp giữa các nhóm và không có khác biệt đáng kể. Tỉ lệ tái thông là tương tự nhau giữa các nhóm. Kết quả này gợi ý rằng hoãn ICA dựa trên CCTA-FFR là an toàn và có thể ngăn ngừa cho bệnh nhân các thủ thuật xâm lấn hơn.
Nghiên cứu FORECAST (Fractional Flow Reserve Derived from Computed Tomography Coronary Angiography in the Assessment and Management of Stable Chest Pain) cho thấy khi so sánh với điều trị chuẩn, việc dùng CCTA-FFR làm giảm nhu cầu chụp mạch vành xâm lấn nhưng không làm giảm chi phí hay MACEs [36].
Tóm lại, CCTA-FFR có vẻ có độ chính xác cao khi FFR được dùng như tiêu chuẩn vàng, bổ sung khả năng phân loại cho CT thông thường và làm giảm các kết quả dương giả thông qua kết hợp đánh giá chức năng trông một công cụ ghi nhận giải phẫu mạch vành.
2.2.3. Chỉ số sóng tự do tức thời (iFR)
Sau khi FFR được kiểm định lâm sàng, các kỹ thuật mới đã được phát triển trong nỗ lực tìm kiếm một phương tiện kết hợp đánh giá sinh lý cùng một thủ thuật đơn giản hơn. iFR là một trong các phương tiện như vậy khi sử dụng một chất tăng lưu lượng là adenosine. iFR được tính toán bằng việc đo chênh áp lúc nghỉ qua một sang thương mạch vành thời kỳ tâm trương khi kháng lực vi mạch là thấp và ổn định [21], [37].
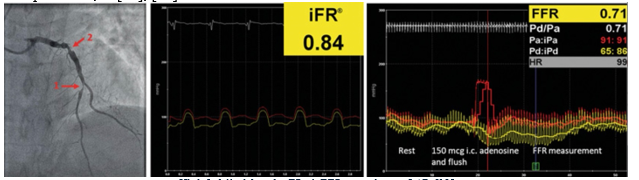
Hình 5. Mô phỏng đo iFR và FFR sang thương LAD [38]
Việc dùng một chất tăng lưu lượng trong FFR là cần thiết vì việc phân tích dòng chảy lấy từ việc đo áp lực trực tiếp, và vì các thông số này liên hệ tuyến tính với nhau nên kháng lực mạch vành phải thấp và ổn định. Các nhà nghiên cứu đã lấy kỹ thuật này trong giai đoạn tâm trương (khi cơ tim (và hệ thống vi mạch) đang thư giãn), khi kháng lực mạch vành đang thấp và ổn định một cách tự nhiên [37]. Khi theo dõi kháng lực, việc phân tích cường độ sóng trong khoảng thời gian này là một khoảng không có sóng, nghĩa là một môi trường được kiểm soát tốt để đánh giá ý nghĩa về mặt chức năng của một sang thương hẹp nhất định. Việc đo lường chênh áp trong giai đoạn này tương tự với đo lường khhi sử dụng chất tăng lưu lượng như adenosine [39].
Götberg và cộng sự đã so sánh iFR với FFR ở những bệnh nhân CAD ổn định và ACS [21]. Chiến lược tái thông dựa trên iFR được ghi nhận là không thua kém chiến lược tái thông dựa trên FFR xét về tần suất MACEs tại thời điểm 12 tháng. Nhóm FFR có nhiều sang thương có ý nghĩa hơn và được đặt nhiều stent hơn. Hơn nữa, nhóm FFR có tỉ lệ đau ngực cao hơn trong quá trình thủ thuật (68,3% so với 3%), bao gồm đau ngực mức độ trung bình và nhiều. Khi sử dụng FFR là tiêu chuẩn tham chiếu, iFR đạt độ chính xác khoảng 80% [39], [40]. Dù vậy, iFR vẫn có một số ưu điểm so với FFR, như không cần sử dụng các chất tăng lưu lượng (mà có thể làm bệnh nhân khó chịu hơn), và giảm thời gian thủ thuật cũng như giảm chi phí.
2.2.4. Dự trữ dòng mạch vành (CFR)
CFR là một tỉ số tương đương với dòng máu dự trữ mà tuần hoàn mạch vành có thể cung cấp trong trường hợp có tăng nhu cầu, như trong stress hay giãn mạch [41], [42], [43]. CFR đặc biệt hữu ích trong trường hợp chẩn đoán CAD vi mạch bởi vì các đánh giá hình ảnh thông thường ở các mạch máu nhỏ là không thể, do vậy chỉ còn lựa chọn đánh giá về chức năng. Bên cạnh tính ứng dụng riêng biệt này, CFR còn có thể dự đoán MACEs và tử vong do mọi nguyên nhân [41]. Hiện còn thiếu các thử nghiệm lâm sàng đánh giá điều trị dựa trên CFR, nhưng một số bằng chứng cho thấy CFR có thể bổ sung thêm thông tin tiên lượng so với FFR đơn thuần [43], [44].
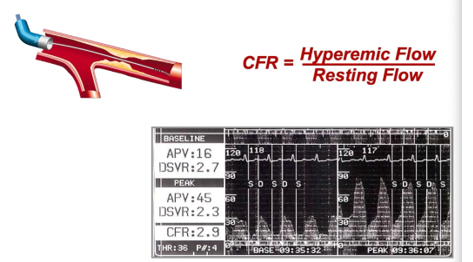
Hình 6. Mô phỏng cách tính toán CFR trên mạch vành xơ vữa
CFR có thể được đo xâm lấn hoặc không xâm lấn với hỗ trợ của PET, CMR hay thậm chí là siêu âm tim gắng sức. Với các phương pháp không xâm lấn, đầu tiên là PET-CT: một đầu dò (thường là rubidium-82 hoặc nitrogen-13-ammonia) được dùng để thu được hình ảnh động (khi nghỉ và khi có giãn mạch) và đánh giá dòng máu cơ tim khi nghỉ và khi tăng lưu lượng, từ đó sẽ tính được CFR [45]. CMR sẽ đo CFR bằng cách đo dòng chảy lúc nghỉ và tại đỉnh stress ở xoang vành [46]. Để đo CFR với siêu âm tim gắng sức, người siêu âm tim sẽ đánh giá dòng máu ở đoạn giữa LAD tại thời điểm nền và thời điểm đỉnh stress với dipyridamole [47].
2.2.5. Tỉ số lưu lượng định lượng (QFR)
QFR là một hình thức bán tự động mới: kỹ thuật đánh giá chức năng mà có thể ứng dụng nhanh chóng trong lúc ICA bằng hai màn chiếu và một phần mềm máy tính. QFR cần tăng lưu lượng bằng adenosine và có dây dẫn đo áp lực. Phần mềm sẽ tạo ra mô hình 3D từ 2 màn chiếu ICA à sử dụng động học dịch để đánh giá dòng chảy bằng cách đếm số khung hình cần thiết để cản quang đi vào và đi ra đoạn mạch cần khảo sát [48], [49].
QFR đã được thử nghiệm lâm sàng đối đầu với FFR trong nghiên cứu WIFI II (WireFree Functional Imaging II) [50]. Khi so sánh với tiêu chuẩn vàng là FFR, ngưỡng cắt QFR ≤ 0,80 có AUD 0,86 (95% CI, 0,81 – 0,91), độ nhạy 77%, độ đặc hiệu 86%, PPV 87%, và NPV 75%. Chiến lược phối hợp QFR-FFR cho phép không cần dùng adenosine cũng như dây dẫn trong 68% số trường hợp.
Nghiên cứu DEFINE-FLAIR (Functional Lesion Assessment of Intermediate Stenosis to Guide Revascularization) [51] và nghiên cứu iFR-SWEDEHEART (Instantaneous Wave-free Ratio versus Fractional Flow Reserve in Patients with Stable Angina Pectoris or Acute Coronary Syndrome) [21] cũng cho kết quả iFR tương đương với FFR xét về tần suất MACEs ở những bệnh nhân đau ngực hoặc nhồi máu cơ tim. Các nghiên cứu này cũng cho thấy iFR làm giảm đáng kể số bệnh nhân đau ngực và giảm số biến cố liên quan thủ thuật so với FFR.
Nghiên cứu iLITRO-EPIC07 (Concordance Between FFR and iFR for the Assessment of Intermediate Lesions in the Left Main Coronary Artery: A Prospective Validation of a Default Value for iFR) [52] cho thấy có mối tương đồng mức độ trung bình (80%) giữa FFR và iFR ở những bệnh nhân có hẹp thân chung vành trái trung bình. Trong những trường hợp không tương đồng, IVUS có vẻ tương tự với FFR về phân loại mức độ ảnh hưởng của sang thương . Do đó, cách tiếp cận dựa trên kết hợp IVUS và đánh giá sinh lý ở những sang thương thân chung vành trái trung bình có vẻ xác định được khi nào không cần tái thông mạch vành.
2.2.6. Chỉ số kháng lực vi mạch (IMR)
IMR được giới thiệu lần đầu bởi Fearon và cộng sự và được tính toán bằng cách ước lượng dòng máu mạch vành đoạn xa tối đa trong lúc tăng lưu lượng và áp lực [53] (Hình 7). Ng và cộng sự ghi nhận [54] IMR vượt trội hơn CRF trong đánh giá tuần hoàn vi mạch vành thông qua việc dễ tái thực hiện hơn và ít phụ thuộc vào huyết động hơn CFR vì không phụ thuộc vào các giá trị khi nghỉ. Hơn nữa, IMR không bị ảnh hưởng bởi độ nặng của hẹp mạch máu thượng tâm mạc [55]. IMR ≥ 25 đơn vị tương ứng bất thường chức năng vi mạch vành.
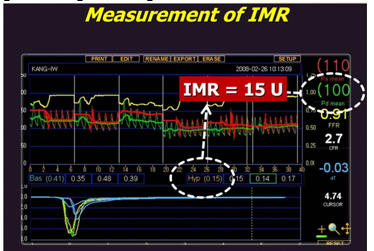
Hình 7. Minh họa cách tính CFR và IMR [56]
2.2.7. Kháng lực vi mạch khi kích thích (HMR – Doppler wire-derived hyperemiamicrocascular resistance)
HMR định nghĩa là tỉ số giữa áp lực mạch vành đoạn xa (Pd) và vận tốc dòng máu mạch vành tối đa trong lúc kích thích (thường dùng bằng thuốc adenosin). Chỉ số HMR > 1,9 mmHg/cm/giây là tiêu chuẩn chẩn đoán suy chức năng vi mạch [57]. Williams và cộng sự ghi nhận HMR có độ chính xác trong chẩn đoán cao hơn IMR trong dự đoán dự trữ dòng mạch vành (AUC 0,82 so với 0,58, p < 0,001; độ nhạy và độ đặc hiệu lần lượt là 77% và 77% so với 51% và 71%), trong chỉ số dự trữ tưới máu cơ tim (AUC 0,85 so với 0,72, p = 0 ,19; độ nhạy và độ đặc hiệu lần lượt là 82% và 80% so với 64% và 75%) [58]. So với IMR, HMR dựa trên ứng dụng của luật Ohm (kháng lực = áp lực/dòng chảy), chỉ thay thế dòng pha loãng nhiệt bằng vận tốc dòng từ Doppler [59]. Bảng 3 tóm lược các điểm khác nhau chính giữa các phương thức không xâm lấn đánh giá tuần hoàn vi mạch vành.
Bảng 3. Các thông số huyết động học xâm lấn trong đánh giá tuần hoàn vi mạch vành.
HMR: hyperemic microvascular resistance – kháng lực vi mạch tăng lưu lượng; IMR: index of microcirculatory resistance – chỉ số kháng lực vi mạch vành; Pd: distal mean coronary pressure – áp lực mạch vành trung bình đoạn xa; T: mean transit time – thời gian vận chuyển trung bình; V: coronary flow velocity – vận tốc dòng mạch vành
| IMR | HMR | |
| Cơ chế | Pha loãng nhiệt | Doppler |
| Công thức | Ttăng lưu lượng x Pd | Pd/Vtăng lưu lượng |
| Ngưỡng bất thường | ≥ 25 đơn vị | > 1,9 mmHg/cm/giây |
| Hạn chế | T: đại diện cho dòng máu
Cần tăng lưu lượng |
V: đại diện cho dòng máu
Cần tăng lưu lượng |
Các phương pháp đánh giá chức năng tuần hoàn vi mạch vành xâm lấn khác bao gồm đo kháng lực vi mạch tối thiểu (MMR), sử dụng phương pháp Doppler, và tỉ số sức cản dự trữ (RRR), sử dụng phương pháp pha loãng nhiệt.
De Waard và cộng sự ghi nhận MMR cho phép đánh giá suy chức năng vi mạch vành bất kể dòng máu thượng tâm mạc [60]. Vì lí do này, MMR được đề nghị là một công cụ đo lường bệnh lý vi mạch trên lâm sàng cho cả bệnh cơ tim thiếu máu cục bộ và không thiếu máu cục bộ. Hơn nữa, Lee và cộng sự cũng cho thấy rằng RRR có ứng dụng tiên lượng gia tăng ở những bệnh nhân CAD và PCI chương trình [61].
2.2.8. Các tỉ số áp lực không tăng lưu lượng lúc nghỉ mới
Gần đây hơn, có một số tỉ số áp lực không tăng lưu lượng đo bằng dây dẫn (NHPRs) mới được đề xuất. Những thông số mới này đo lường tỉ số áp lực động mạch vành đoạn xa (pd) so với áp lực động mạch chủ (Pa) nhưng khác nhau về thời điểm đo trong chu chuyển tim (Bảng 2). Cách chung nhất, độ chính xác trong chẩn đoán của những phương pháp mới này là gần như tương đương iFR. Bên cạnh đó, những nghiên cứu hồi cứu cũng cho thấy giá trị tiên lượng tương đương giữa NHPR và iFR [62], [63]. Những kết quả này gợi ý rằng NHPRs và iFR có thể được áp dụng cùng bối cảnh lâm sàng.
Bảng 4. Những đặc tính của các tỉ số áp lực không tăng lưu lượng khi nghỉ mới
DFR: diastolic hyperemia-free ratio: tỉ số không tăng lưu lượng thì tâm trương; dPR: diastolic pressure ratio – tỉ số áp lực thì tâm trương; FFR: fractional flow reserve – phân suất dự trữ dòng mạch vành; iFR: chỉ số sóng tự do tức thời; RFR: resting full-cycle ratio: tỉ số toàn chu kỳ khi nghỉ
| Chỉ số áp lực | Tăng lưu lượng | Ngưỡng cắt | Cách tính |
| FFR | Cần thiết | ≤ 0,80 | Pd/Pa trung bình trong suốt chu chuyển tăng lưu lượng (thường trung bình trong 3 nhát bóp) |
| Pd/Pa khi nghỉ | Không | ≤ 0,91 | Pd/Pa trung bình khi nghỉ (thường trung bình trong 3 nhát bóp) |
| RFR | Không | ≤ 0,89 | Chỉ số Pd/Pa thấp nhất trong suốt chu chuyển tim (trong 5 nhịp) |
| iFR | Không | ≤ 0,89 | Pd/Pa trung bình trong giai đoạn không có sóng (trong 5 nhịp) |
| DFR | Không | ≤ 0,89 | Pd/Pa trung bình trong giai đoạn giữa lúc Pa < Pa trung bình và Pa đoạn xuống (trong 5 nhịp) |
| dPR | Không | ≤ 0,89 | Pd/Pa trung bình trong suốt thì tâm trương (trong 5 nhịp) |
2.2.9. Chụp cộng hưởng từ tim
CMR là một phương tiện chẩn đoán được sử dụng rộng rãi trong phân tích chi tiết các cấu trúc bệnh lý tim cả về giải phẫu và chức năng. Độ phân giải cao của CMR cho phép xác định pha gắng sức-tưới máu trong thiếu máu cục bộ cơ tim, ngay cả khi vùng thiếu máu là nhỏ, với độ chính xác 94% [2]. CMR cho phép phân loại những bệnh nhân nghi ngờ CAD thành những phân tầng nguy cơ tử vong và nhồi máu cơ tim phù hợp hơn, và CMR cũng là một phương tiện chẩn đoán quan trọng trong đánh giá những bệnh nhân MINOCA.
Trong những tiến bộ gần đây của kỹ thuật CMR định lượng, T1 mapping được dùng để đánh giá phù mô kẽ và thay đổi chất nền ngoại bào, từ đó có thể xác định chính xác nhồi máu cơ tim mà không cần bơm cản từ [64].
2.3. Các dấu ấn sinh học
2.3.1. Chỉ số hấp thụ mỡ quanh mạch vành (FAI)
Việc xác định các dấu ấn liên quan tính không ổn định mảng xơ vữa có thể có ích trong cải thiện phân tầng nguy cơ mạch vành ngay cả trong trường hợp phòng ngừa thứ phát. Đánh giá lớp mỡ quanh mạch vành có thể giúp xác định các mảng xơ vữa dễ nứt vỡ có liên quan với tăng nguy cơ biến cố tim mạch [50] bằng cách phân biệt thành phần lipid trong mô quanh mạch máu có và không có hoạt tính viêm.
Antonopoulos và cộng sự đã phát triển một phương thức đánh giá sự hấp thụ mỡ qua CT là chỉ số FAI [65]. FAI là trung bình của sự hấp thụ mỡ, nơi nào thành phần lipid càng cao và kích thước mô mỡ càng lớn thì sự hấp thụ càng nhỏ và do vậy FAI thường âm hơn. Chỉ số này có tương quan tốt với thành phần lipid trên mô học, các dấu ấn viêm tại chỗ, và đáp ứng viêm mạch máu đánh giá qua PET-CT với 18F-fluorodeoxyglucose. Trong một phân tích hậu nghiệm 2 nghiên cứu đoàn hệ của nghiên cứu CRISP-CT (Cardiovascular RISk Prediction using Computed Tomography), FAI quanh mạch máu cải thiện tiên lượng nguy cơ so với các thủ thuật thông thường [66]. Trong phân tích này, giá trị của FAI xung quanh động mạch vành phải (RCA) và nhánh xuống trước trái (LAD) dự đoán tử vong do tim mạch và do mọi nguyên nhân. Từ đó, các tác giả gợi ý rằng việc dùng FAI quanh RCA có thể là một yếu tố đánh giá đáp ứng viêm mạch vành toàn bộ. Ngưỡng cắt tốt nhất được các tác giả đưa ra là FAI quanh mạch máu ≥ -70,1 đơn vị Hounsfield (HU) (độ hấp thụ mỡ quanh mạch máu thường từ khoảng -190 HU ở mô mỡ cho đến -30 HU ở mô dịch), tương ứng với HR 5,62 cho tử vong tim và HR 3,69 cho tử vong do mọi nguyên nhân trong dân số kiểm định.
Sun và cộng sự [3] ghi nhận giá trị FAI quanh mạch vành tăng trên CT mạch vành có liên quan với thành phần không ổn định ở những bệnh nhân hội chứng vành cấp không ST chênh lên.
2.3.2. MicroRNAs
MicroRNAs (miRNA) là các mảnh nhỏ chứa nucleotide (18-25) mà không tạo ra protein nhưng có vai trò trong điều hòa các quá trình sinh học thông qua quá trình tắt gen [67]. Ảnh hưởng của tăng hay giảm điều hòa miRNA trên tiến triển của bệnh tật là một chủ đề đang được quan tâm. Nhiều miRNA có liên quan với bệnh lý tim mạch, cụ thể là phì đại thất trái, bệnh tim thiếu máu cục bộ, suy tim, tăng huyết áp, và rối loạn nhịp [68], [69], [70].
Những biểu hiện hình thái khác nhau của miRNA đã được ghi nhận ở những bệnh nhân có hoặc không có CAD. Ví dụ, một số dạng miRNA đã được ghi nhận ở các tế bào cơ trơn mạch máu bình thường và nguyên bào sợi cơ. Một số miRNA khác được ghi nhận có liên quan với sang thương xơ vữa mạch vành tại nội mạc, đáp ứng viêm, và chuyển hóa mỡ; mà tất cả các quá trình này đều có vai trò quan trọng trong CAD [69].
Trong bối cảnh hội chứng vành cấp, Li và cộng sự đã ghi nhận nồng độ trong máu của miRNA-1 có tương quan với nồng độ troponin T với độ chính xác tương đồng (AUC 0,85, 95% CI 0,81 – 0,89) [71]. Các dấu ấn sinh học khác có độ chính xác cao trong nhồi máu cơ tim là miRNA-208a và miRNA-499 [72], [72].
miRNA có thể là nguyên nhân/yếu tố thúc đẩy của bệnh, hoặc cũng có thể là sản phẩm của quá trình bệnh lý. Việc xác định miRNA ở một bệnh nhân có thể giúp chẩn đoán sớ hay thậ chí là phân loại nguy cơ tốt hơn. Tuy vậy, còn nhiều câu hỏi chưa được trả lời, và cần có cái nhìn sâu hơn về việc miRNA phân bổ như thế nào trong các chủng tộc, độ tuổi, giới tính khác nhau; xác định cách thức thu mẫu và đánh giá các mẫu cách đồng nhất; cũng như tính lợi ích về kinh tế-hiệu quả cũng là một điểm quan trọng của lĩnh vực mới này.
2.3.3. Thang điểm nguy cơ đa gen của CAD
Gen trong tim mạch cũng là một chủ đề đang được quan tâm. Xét về phòng ngừa, việc phát hiện đa hình gen liên quan với tăng nguy cơ CAD là một mục tiêu của phân tầng nguy cơ tim mạch tốt hơn. Các thang điểm nguy cơ hiện tại bao gồm các biến số như tuổi, giới, huyết áp và cholesterol. Những bệnh nhân trẻ hơn có thể có nguy cơ 10 năm thấp hơn nhưng nguy cơ suốt đời cao. Thang điểm nguy cơ đa gen (PRS) có thể giúp hiểu rõ nguy cơ suốt đời của một bệnh nhân và bổ sung vào quá trình đánh giá nguy cơ ở những bệnh nhân này. Những thang điểm này được phát triển từ các nghiên cứu liên quan với bộ gen người, trong đó có dữ liệu về các biển thể gen đã được thử nghiệm độ liên quan với các kiểu hình nhất định, như CAD [73]. Các nghiên cứu này đòi hỏi kinh nghiệm và có thể sẽ phức tạp về thuật toán; nhưng những thang điểm này là một lãnh vực có nhiều tiềm năng trong tương lai.
Nhiều biến thể gen đã được xác định là làm tăng nguy cơ, và đại đa số có vẻ không phải làm tăng nguy cơ qua việc tác động lên các yếu tố nguy cơ đã biết, như LDL hay huyết áp. PRS được phân tích trong dân số nghiên cứu FOURNIER (Further Cardiovascular Outcomes Research with PCSK9 Inhibition in Subjects with Elevated Risk) [74] và nghiên cứu ODYSSEY OUTCOMES (Evaluation of Cardiovascular Outcomes After an Acute Coronary Syndrome During Treatment with Alirocumab) [75] về thuốc ức chế PCSK9. Trong dân số gồm 14,298 bệnh nhân của nghiên cứu FOURNIER, một PRS gồm 27 đa hình gen chứa nucleotide đơn được dùng để phân loại bệnh nhân thành các nhóm để đánh giá nguy cơ di truyền [76]. Nguy cơ trên lâm sàng được đánh giá qua trung bình của các biến số định lượng như LDL cao, tăng huyết áp, hút thuốc lá, và đái tháo đường. Trong phân tích này, điểm PRS càng cao càng có liên quan với tăng biến cố lâm sàng. Nghiên cứu này gợi ý rằng việc thêm đánh giá nguy cơ qua gen có thể giúp cải thiện việc chọn mẫu dân số sử dụng PCSK9i. Vì kết quả cho thấy độ giảm tương đối và tuyệt đối biến cố lần lượt là 13% và 1,4% ở nhóm chỉ dùng phân nhóm nguy cơ lâm sàng cao; và lần lượt là 31% và 4% cho phân nhóm nguy cơ di truyền cao bất kể nguy cơ lâm sàng là gì. Phân tích hậu nghiệm của nghiên cứu ODYSSEY OUTCOMEs [77] đã đánh giá PRS chứa 7 triệu biến thể gen trong mối liên quan với nguy cơ MACE và hiệu quả điều trị với những phân tầng nguy cơ khác nhau. Những bệnh nhân trong nhóm chứng và > 90th percentile về PRS có nguy cơ MACE cao hơn nhóm bệnh nhân ở < 90th percentile (17% so với 11,4%). Khi phân tích hiệu quả điều trị, alirocumab làm giảm nguy cơ ở nhóm bệnh nhân > 90th percentile (6% nguy cơ tuyệt đối và 37% nguy cơ tương đối) so với nhóm < 90th percentile (1,5% nguy cơ tuyệt đối và 13% nguy cơ tương đối).
Mặc dù là một chủ đề nghiên cứu được quan tâm, vẫn chưa đủ dữ liệu tiến cứu để khuyến cáo những thang điểm này trong thực hành hàng ngày. Hơn nữa, các dấu ấn sinh học mới vẫn nên được so sánh với các dấu ấn sinh học có sẵn và đã được chứng minh lợi ích trong tiên lượng như troponin và CRP siêu nhạy (hsCRP) trong các nghiên cứu lớn hơn để xác định rõ vai trò chẩn đoán và tiên lượng của chúng.
5. KẾT LUẬN
Dù đã có các tiến bộ làm giảm tử vong thông qua tiến bộ trong dự phòng, chẩn đoán và điều trị bằng thuốc và kỹ thuật tái thông mạch máu thì CAD vẫn là một trong các nguyên nhân tử vong và bệnh tật hàng đầu trên thế giới. Từ đầu những năm 2010, một số kỹ thuật chẩn đoán mới đã cải thiện sự hiểu biết và hướng chẩn đoánCAD. Việc xác định các phương thức và mục tiêu chẩn đoán là cần thiết để phát triển các kỹ thuật và chiến lược chẩn đoán mới trong CAD. Tuy vậy, vẫn còn cần những bằng chứng lâm sàng rõ ràng hơn. Các nghiên cứu trong tương lai trong lĩnh vực này nên tập trung vào quy trình và các công cụ chẩn đoán mới.
TÀI LIỆU THAM KHẢO
- Tsao CW, Aday AW, Almarzooq ZI, Alonso A, Beaton AZ, Bittencourt MS, et al. Heart Disease and Stroke Statistics-2022 Update: A Report From the American Heart Association. Circulation. 2022;145(8):e153-e639. Epub 20220126.
- Takx RA, Blomberg BA, El Aidi H, Habets J, de Jong PA, Nagel E, et al. Diagnostic accuracy of stress myocardial perfusion imaging compared to invasive coronary angiography with fractional flow reserve meta-analysis. Circ Cardiovasc Imaging. 2015;8(1).
- Sun JT, Sheng XC, Feng Q, Yin Y, Li Z, Ding S, Pu J. Pericoronary Fat Attenuation Index Is Associated With Vulnerable Plaque Components and Local Immune‐Inflammatory Activation in Patients With Non‐ST Elevation Acute Coronary Syndrome. Journal of the American Heart Association. 2022;11(2):e022879.
- Maehara A, Mintz GS, Weissman NJ. Advances in Intravascular Imaging. Circulation: Cardiovascular Interventions. 2009;2(5):482-90.
- Maitre-Ballesteros L, Riou L, Marliere S, Canu M, Vautrin E, Piliero N, et al. Coronary Physiology: Delivering Precision Medicine? RCM. 2022;23(5).
- Yock PG, Linker DT, Angelsen BAJ, Tech. Two-Dimensional Intravascular Ultrasound: Technical Development and Initial Clinical Experience. Journal of the American Society of Echocardiography. 1989;2(4):296-304.
- Saito Y, Kobayashi Y, Fujii K, Sonoda S, Tsujita K, Hibi K, et al. Clinical expert consensus document on intravascular ultrasound from the Japanese Association of Cardiovascular Intervention and Therapeutics (2021). Cardiovascular Intervention and Therapeutics. 2022:1-12.
- Ono M, Kawashima H, Hara H, Gao C, Wang R, Kogame N, et al. Advances in IVUS/OCT and Future Clinical Perspective of Novel Hybrid Catheter System in Coronary Imaging. Frontiers in Cardiovascular Medicine. 2020;7.
- Fitzgerald PJ, Oshima A, Hayase M, Metz JA, Bailey SR, Baim DS, et al. Final Results of the Can Routine Ultrasound Influence Stent Expansion (CRUISE) Study. Circulation. 2000;102(5):523-30.
- Oemrawsingh PV, Mintz GS, Schalij MJ, Zwinderman AH, Jukema JW, Wall EEvd. Intravascular Ultrasound Guidance Improves Angiographic and Clinical Outcome of Stent Implantation for Long Coronary Artery Stenoses. Circulation. 2003;107(1):62-7.
- Ahn J-M, Kang S-J, Mintz GS, Oh J-H, Kim W-J, Lee J-Y, et al. Validation of Minimal Luminal Area Measured by Intravascular Ultrasound for Assessment of Functionally Significant Coronary Stenosis: Comparison With Myocardial Perfusion Imaging. JACC: Cardiovascular Interventions. 2011;4(6):665-71.
- Stone Gregg W, Maehara A, Lansky Alexandra J, de Bruyne B, Cristea E, Mintz Gary S, et al. A Prospective Natural-History Study of Coronary Atherosclerosis. New England Journal of Medicine.364(3):226-35.
- Hong S-J, Mintz GS, Ahn C-M, Kim J-S, Kim B-K, Ko Y-G, et al. Effect of Intravascular Ultrasound–Guided Drug-Eluting Stent Implantation: 5-Year Follow-Up of the IVUS-XPL Randomized Trial. JACC: Cardiovascular Interventions. 2020;13(1):62-71.
- Gao X-F, Ge Z, Kong X-Q, Kan J, Han L, Lu S, et al. 3-year outcomes of the ULTIMATE trial comparing intravascular ultrasound versus angiography-guided drug-eluting stent implantation. Cardiovascular Interventions. 2021;14(3):247-57.
- Ferrari M, Mottola L, Quaresima V. Principles, Techniques, and Limitations of Near Infrared Spectroscopy. Canadian Journal of Applied Physiology. 2004;29(4):463-87.
- Price WG. Spectroscopy in Science and Technology. Nature. 1963;197(4868):633-.
- Wilkinson SE, Madder RD. Intracoronary near-infrared spectroscopy—role and clinical applications. Cardiovascular Diagnosis and Therapy. 2020;10(5):1508-16.
- Luthria DL, Mukhopadhyay S, Lin L-Z, Harnly JM. A comparison of analytical and data preprocessing methods for spectral fingerprinting. Applied spectroscopy. 2011;65(3):250-9.
- Waksman R, Di Mario C, Torguson R, Ali ZA, Singh V, Skinner WH, et al. Identification of patients and plaques vulnerable to future coronary events with near-infrared spectroscopy intravascular ultrasound imaging: a prospective, cohort study. Lancet. 2019;394(10209):1629-37. Epub 20190927.
- Oemrawsingh RM, Cheng JM, García-García HM, van Geuns RJ, de Boer SP, Simsek C, et al. Near-infrared spectroscopy predicts cardiovascular outcome in patients with coronary artery disease. J Am Coll Cardiol. 2014;64(23):2510-8.
- Götberg M, Christiansen Evald H, Gudmundsdottir Ingibjörg J, Sandhall L, Danielewicz M, Jakobsen L, et al. Instantaneous Wave-free Ratio versus Fractional Flow Reserve to Guide PCI. New England Journal of Medicine.376(19):1813-23.
- Erlinge D, Maehara A, Ben-Yehuda O, Bøtker HE, Maeng M, Kjøller-Hansen L, et al. Identification of vulnerable plaques and patients by intracoronary near-infrared spectroscopy and ultrasound (PROSPECT II): a prospective natural history study. The Lancet. 2021;397(10278):985-95.
- Ali ZA, Karimi Galougahi K, Maehara A, Shlofmitz RA, Ben-Yehuda O, Mintz GS, Stone GW. Intracoronary Optical Coherence Tomography 2018: Current Status and Future Directions. JACC: Cardiovascular Interventions. 2017;10(24):2473-87.
- Kini A, Narula J, Vengrenyuk Y, Sharma S. Atlas of coronary intravascular optical coherence tomography: Springer; 2018.
- Bech GJW, De Bruyne B, Pijls NHJ, de Muinck ED, Hoorntje JCA, Escaned J, et al. Fractional Flow Reserve to Determine the Appropriateness of Angioplasty in Moderate Coronary Stenosis. Circulation. 2001;103(24):2928-34.
- Pijls NHJ, Van Gelder B, Van der Voort P, Peels K, Bracke FALE, Bonnier HJRM, El Gamal MIH. Fractional Flow Reserve. Circulation. 1995;92(11):3183-93.
- Pijls Nico HJ, de Bruyne B, Peels K, van der Voort Pepijn H, Bonnier Hans JRM, Bartunek J, Koolen Jacques J. Measurement of Fractional Flow Reserve to Assess the Functional Severity of Coronary-Artery Stenoses. New England Journal of Medicine.334(26):1703-8.
- Tonino Pim AL, De Bruyne B, Pijls Nico HJ, Siebert U, Ikeno F, van `t Veer M, et al. Fractional Flow Reserve versus Angiography for Guiding Percutaneous Coronary Intervention. New England Journal of Medicine.360(3):213-24.
- De Bruyne B, Pijls Nico HJ, Kalesan B, Barbato E, Tonino Pim AL, Piroth Z, et al. Fractional Flow Reserve–Guided PCI versus Medical Therapy in Stable Coronary Disease. New England Journal of Medicine.367(11):991-1001.
- Fearon William F, Zimmermann Frederik M, De Bruyne B, Piroth Z, van Straten Albert HM, Szekely L, et al. Fractional Flow Reserve–Guided PCI as Compared with Coronary Bypass Surgery. New England Journal of Medicine. 2022;386(2):128-37.
- Lee JH, Hartaigh Bó, Han D, Rizvi A, Lin FY, Min JK. Fractional Flow Reserve Measurement by Computed Tomography: An Alternative to the Stress Test. Interventional Cardiology Review 2016;11(2):105–9. 2016.
- Min JK, Leipsic J, Pencina MJ, Berman DS, Koo B-K, van Mieghem C, et al. Diagnostic Accuracy of Fractional Flow Reserve From Anatomic CT Angiography. JAMA. 2012;308(12):1237-45.
- Koo B-K, Erglis A, Doh J-H, Daniels DV, Jegere S, Kim H-S, et al. Diagnosis of ischemia-causing coronary stenoses by noninvasive fractional flow reserve computed from coronary computed tomographic angiograms: results from the prospective multicenter DISCOVER-FLOW (Diagnosis of Ischemia-Causing Stenoses Obtained Via Noninvasive Fractional Flow Reserve) study. Journal of the American College of Cardiology. 2011;58(19):1989-97.
- Nørgaard BL, Leipsic J, Gaur S, Seneviratne S, Ko BS, Ito H, et al. Diagnostic Performance of Noninvasive Fractional Flow Reserve Derived From Coronary Computed Tomography Angiography in Suspected Coronary Artery Disease: The NXT Trial (Analysis of Coronary Blood Flow Using CT Angiography: Next Steps). Journal of the American College of Cardiology. 2014;63(12):1145-55.
- Douglas PS, De Bruyne B, Pontone G, Patel MR, Norgaard BL, Byrne RA, et al. 1-year outcomes of FFRCT-guided care in patients with suspected coronary disease: the PLATFORM study. Journal of the American College of Cardiology. 2016;68(5):435-45.
- Curzen N, Nicholas Z, Stuart B, Wilding S, Hill K, Shambrook J, et al. Fractional flow reserve derived from computed tomography coronary angiography in the assessment and management of stable chest pain: the FORECAST randomized trial. European heart journal. 2021;42(37):3844-52.
- Sen S, Escaned J, Malik IS, Mikhail GW, Foale RA, Mila R, et al. Development and Validation of a New Adenosine-Independent Index of Stenosis Severity From Coronary Wave–Intensity Analysis: Results of the ADVISE (ADenosine Vasodilator Independent Stenosis Evaluation) Study. Journal of the American College of Cardiology. 2012;59(15):1392-402.
- de Waard GA, Di Mario C, Lerman A, Serruys PW, van Royen N. Instantaneous wave-free ratio to guide coronary revascularisation: physiological framework, validation and differences from fractional flow reserve. EuroIntervention. 2017;13(4):450-8.
- Johnson NP, Jeremias A, Zimmermann FM, Adjedj J, Witt N, Hennigan B, et al. Continuum of Vasodilator Stress From Rest to Contrast Medium to Adenosine Hyperemia for Fractional Flow Reserve Assessment. JACC: Cardiovascular Interventions. 2016;9(8):757-67.
- Sen S, Asrress KN, Nijjer S, Petraco R, Malik IS, Foale RA, et al. Diagnostic classification of the instantaneous wave-free ratio is equivalent to fractional flow reserve and is not improved with adenosine administration: results of CLARIFY (Classification Accuracy of Pressure-Only Ratios Against Indices Using Flow Study). Journal of the American College of Cardiology. 2013;61(13):1409-20.
- Kelshiker MA, Seligman H, Howard JP, Rahman H, Foley M, Nowbar AN, et al. Coronary flow reserve and cardiovascular outcomes: a systematic review and meta-analysis. Eur Heart J. 2022;43(16):1582-93.
- Gould KL, Lipscomb K, Hamilton GW. Physiologic basis for assessing critical coronary stenosis. Instantaneous flow response and regional distribution during coronary hyperemia as measures of coronary flow reserve. Am J Cardiol. 1974;33(1):87-94.
- Miller DD, Donohue TJ, Younis LT, Bach RG, Aguirre FV, Wittry MD, et al. Correlation of pharmacological 99mTc-sestamibi myocardial perfusion imaging with poststenotic coronary flow reserve in patients with angiographically intermediate coronary artery stenoses. Circulation. 1994;89(5):2150-60.
- Johnson NP, Gould KL, Di Carli MF, Taqueti VR. Invasive FFR and Noninvasive CFR in the Evaluation of Ischemia: What Is the Future? Journal of the American College of Cardiology. 2016;67(23):2772-88.
- Nakazato R, Heo R, Leipsic J, Min JK. CFR and FFR Assessment with PET and CTA: Strengths and Limitations. Current Cardiology Reports. 2014;16(5):484.
- Indorkar R, Kwong RY, Romano S, White BE, Chia RC, Trybula M, et al. Global Coronary Flow Reserve Measured During Stress Cardiac Magnetic Resonance Imaging Is an Independent Predictor of Adverse Cardiovascular Events. JACC: Cardiovascular Imaging. 2019;12(8, Part 2):1686-95.
- Cortigiani L, Rigo F, Gherardi S, Bovenzi F, Molinaro S, Picano E, Sicari R. Coronary Flow Reserve During Dipyridamole Stress Echocardiography Predicts Mortality. JACC: Cardiovascular Imaging. 2012;5(11):1079-85.
- Albaghdadi M, Jaffer FA. Wire-Free and Adenosine-Free Fractional Flow Reserve Derived From the Angiogram. Circulation: Cardiovascular Imaging. 2018;11(3):e007594.
- Tanigaki T, Emori H, Kawase Y, Kubo T, Omori H, Shiono Y, et al. QFR Versus FFR Derived From Computed Tomography for Functional Assessment of Coronary Artery Stenosis. JACC: Cardiovascular Interventions. 2019;12(20):2050-9.
- Westra J, Tu S, Winther S, Nissen L, Vestergaard M-B, Andersen BK, et al. Evaluation of Coronary Artery Stenosis by Quantitative Flow Ratio During Invasive Coronary Angiography. Circulation: Cardiovascular Imaging. 2018;11(3):e007107.
- Davies Justin E, Sen S, Dehbi H-M, Al-Lamee R, Petraco R, Nijjer Sukhjinder S, et al. Use of the Instantaneous Wave-free Ratio or Fractional Flow Reserve in PCI. New England Journal of Medicine.376(19):1824-34.
- Rodriguez-Leor O, de la Torre Hernández JM, García-Camarero T, García del Blanco B, López-Palop R, Fernández-Nofrerías E, et al. Instantaneous Wave-Free Ratio for the Assessment of Intermediate Left Main Coronary Artery Stenosis: Correlations With Fractional Flow Reserve/Intravascular Ultrasound and Prognostic Implications: The iLITRO-EPIC07 Study. Circulation: Cardiovascular Interventions. 2022;15(11):861-71.
- Fearon WF, Balsam LB, Farouque HMO, Robbins RC, Fitzgerald PJ, Yock PG, Yeung AC. Novel Index for Invasively Assessing the Coronary Microcirculation. Circulation. 2003;107(25):3129-32.
- Ng MKC, Yeung AC, Fearon WF. Invasive Assessment of the Coronary Microcirculation. Circulation. 2006;113(17):2054-61.
- Aarnoudse W, Fearon WF, Manoharan G, Geven M, van de Vosse F, Rutten M, et al. Epicardial Stenosis Severity Does Not Affect Minimal Microcirculatory Resistance. Circulation. 2004;110(15):2137-42.
- Nguyễn Thanh Hiền, Nguyễn T Lệ Trang, Vũ Hoàng Vũ. Đau ngực vi mạch do bệnh mạch vành không tắc nghẽn: Sinh lý bệnh, chẩn đoán và điều trị. Chuyên đề Tim mạch học. 2019.
- Kunadian V, Chieffo A, Camici PG, Berry C, Escaned J, Maas AH, et al. An EAPCI expert consensus document on ischaemia with non-obstructive coronary arteries in collaboration with European Society of Cardiology Working Group on Coronary Pathophysiology & Microcirculation Endorsed by Coronary Vasomotor Disorders International Study Group. European heart journal. 2020;41(37):3504-20.
- Williams RP, de Waard GA, De Silva K, Lumley M, Asrress K, Arri S, et al. Doppler Versus Thermodilution-Derived Coronary Microvascular Resistance to Predict Coronary Microvascular Dysfunction in Patients With Acute Myocardial Infarction or Stable Angina Pectoris. American Journal of Cardiology. 2018;121(1):1-8.
- Amier RP, Teunissen PFA, Marques KM, Knaapen P, van Royen N. Invasive measurement of coronary microvascular resistance in patients with acute myocardial infarction treated by primary PCI. Heart. 2014;100(1):13.
- de Waard GA, Nijjer SS, van Lavieren MA, van der Hoeven NW, Petraco R, van de Hoef TP, et al. Invasive minimal Microvascular Resistance Is a New Index to Assess Microcirculatory Function Independent of Obstructive Coronary Artery Disease. J Am Heart Assoc. 2016;5(12). Epub 20161222.
- Lee SH, Lee JM, Park J, Choi KH, Hwang D, Doh JH, et al. Prognostic Implications of Resistive Reserve Ratio in Patients With Coronary Artery Disease. J Am Heart Assoc. 2020;9(8):e015846. Epub 20200418.
- Johnson NP, Li W, Chen X, Hennigan B, Watkins S, Berry C, et al. Diastolic pressure ratio: new approach and validation vs. the instantaneous wave-free ratio. Eur Heart J. 2019;40(31):2585-94.
- van’t Veer M, Pijls NHJ, Hennigan B, Watkins S, Ali ZA, De Bruyne B, et al. Comparison of Different Diastolic Resting Indexes to iFR: Are They All Equal? Journal of the American College of Cardiology. 2017;70(25):3088-96.
- Ferreira VM, Piechnik SK, Dall’Armellina E, Karamitsos TD, Francis JM, Choudhury RP, et al. Non-contrast T1-mapping detects acute myocardial edema with high diagnostic accuracy: a comparison to T2-weighted cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 2012;14(1):53.
- Antonopoulos AS, Sanna F, Sabharwal N, Thomas S, Oikonomou EK, Herdman L, et al. Detecting human coronary inflammation by imaging perivascular fat. Science Translational Medicine. 2017;9(398):eaal2658.
- Oikonomou EK, Marwan M, Desai MY, Mancio J, Alashi A, Hutt Centeno E, et al. Non-invasive detection of coronary inflammation using computed tomography and prediction of residual cardiovascular risk (the CRISP CT study): a post-hoc analysis of prospective outcome data. The Lancet. 2018;392(10151):929-39.
- Kang K, Peng X, Luo J, Gou D. Identification of circulating miRNA biomarkers based on global quantitative real-time PCR profiling. Journal of Animal Science and Biotechnology. 2012;3(1):4.
- Ying S-Y, Chang DC, Lin S-L. The MicroRNA (miRNA): Overview of the RNA Genes that Modulate Gene Function. Molecular Biotechnology. 2008;38(3):257-68.
- Ghafouri-Fard S, Gholipour M, Taheri M. Role of MicroRNAs in the Pathogenesis of Coronary Artery Disease. Frontiers in Cardiovascular Medicine. 2021;8.
- Fazmin IT, Achercouk Z, Edling CE, Said A, Jeevaratnam K. Circulating microRNA as a Biomarker for Coronary Artery Disease. Biomolecules. 2020;10(10):1354.
- Liu J-m, Li L-m, Ye Q, Cai W-b, Liao X-x, Li X. Comparison of plasma microRNA-1 and cardiac troponin T in early diagnosis of patients with acute myocardial infarction. World Journal of Emergency Medicine. 2014;5(3):182-6.
- Corsten MF, Dennert R, Jochems S, Kuznetsova T, Devaux Y, Hofstra L, et al. Circulating MicroRNA-208b and MicroRNA-499 Reflect Myocardial Damage in Cardiovascular Disease. Circulation: Cardiovascular Genetics. 2010;3(6):499-506.
- Bartel DP. MicroRNAs: Genomics, Biogenesis, Mechanism, and Function. Cell. 2004;116(2):281-97.
- Sabatine Marc S, Giugliano Robert P, Keech Anthony C, Honarpour N, Wiviott Stephen D, Murphy Sabina A, et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. New England Journal of Medicine.376(18):1713-22.
- Schwartz Gregory G, Steg PG, Szarek M, Bhatt Deepak L, Bittner Vera A, Diaz R, et al. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. New England Journal of Medicine. 2018;379(22):2097-107.
- Marston NA, Kamanu FK, Nordio F, Gurmu Y, Roselli C, Sever PS, et al. Predicting Benefit From Evolocumab Therapy in Patients With Atherosclerotic Disease Using a Genetic Risk Score. Circulation. 2020;141(8):616-23.
- Damask A, Steg PG, Schwartz GG, Szarek M, Hagström E, Badimon L, et al. Patients With High Genome-Wide Polygenic Risk Scores for Coronary Artery Disease May Receive Greater Clinical Benefit From Alirocumab Treatment in the ODYSSEY OUTCOMES Trial. Circulation. 2020;141(8):624-36. Epub 20191111.







