CKII. BÙI THẾ HOÀ *
BS. LÊ CAO PHƯƠNG DUY **
* Phó trưởng khoa Tim mạch can thiệp
** Phó Giám đốc BV Nguyễn Tri Phương
Abstract
Shock-resistant ventricular arrhythmia is generally defined as ventricular tachycardia or ventricular fibrillation that persists or recurs after a defibrillation attempt. However, the management of shock-refractory ventricular fibrillation is not mention in detail in the guidelines for advanced CPR despite the evidence to suggest a treatment strategy regarding this issue. The first class of drugs is vasopressors such as epinephrine, followed by antiarrhythmic drugs when vasopressors alone are not effective. Currently, the most studied antiarrhythmic agents are amiodarone, lidocaine, magnesium sulfate, and, more recently, esmolol. Other strategies include antiarrhythmic agents combination, change vector defibrillation, dual sequential defibrillation, and extracorporeal membrane oxygenation (ECMO).
In a case of successful resuscitation of shock-refractory ventricular fibrillation with lidocaine after amiodarone administration, we re-evaluate recommended and ongoing options for the management of refractory ventricular tachycardia/ventricular fibrillation.
Trường hợp lâm sàng:
Một nam nhân viên văn phòng, 44 tuổi, được đưa vào phòng cấp cứu do đau ngực khi đang ăn tối với bạn. Cơn đau đột ngột, dữ dội, sau xương ức, lan lên vai trái và sau lưng, kèm cảm giác khó thở. Khi vào viện, bệnh nhân bứt rứt, vã mồ hôi, chi ấm, mạch 100 l/p, HA 120/80 mmHg, nhịp thở 22 l/p, ngay sau khi lấy sinh hiệu, gắn monitor, bệnh nhân gồng người, điện tim biểu hiện nhanh thất, qui trình hồi sức tim được tiến hành với nhấn tim ngoài lồng ngực, sốc điện chuyển nhịp 200J (hai pha), tiếp tục nhấn tim, bóp bóng qua mask, monitor vẫn nhanh thất, sốc điện chuyển nhịp lần hai 270J, tiếp tục nhấn tim, tiêm mạch adrenalin 1mg. Sau một chu kỳ nhấn tim và bóp bóng, điện tim lúc này nhanh thất, tiếp tục các lần sốc điện 270J xen kẻ hồi sức, thêm cordaron 300 mg TM, sau đó 150 mg TM, đánh giá các yếu tố có thể điều chỉnh được như: điện giải, toan kiềm.. tình trạng rung thất vẫn kéo dài, qui trình hồi sức tiếp tục với sốc điện, adrenalin TM mỗi 3-5 phút, đặt nội khí quản hổ trợ hô hấp.
Tình trạng rung thất vẫn còn sau hơn 8 lần sốc điện, bệnh nhân được tiêm mạch (xen giữa các chu kỳ hồi sức và sốc điện) magne sulphat 1,5 g, sau đó lidocain hydroclorid 80 mg, lập lại 40 mg. Sau tiêm lập lại lidocain và 2 chu kỳ nhấn tim kèm sốc điện, điện tim chuyển sang nhịp bộ nối sau đó về nhịp xoang 60 l/p, HA 90 mmHg. Chụp mạch vành được thực hiện ngay sau đó với hình ảnh tắc hoàn toàn đoạn gần nhánh RCA, được can thiệp thành công với một stent phủ thuốc.
Rối loạn nhịp thất kháng trị với sốc điện thường được định nghĩa là nhịp nhanh thất hoặc rung thất vẫn tồn tại hay tái phát sau một lần thử khử rung tim[1]. Xử trí rung thất kháng trị với sốc điện không được đề cập một cách chi tiết trong các hướng dẩn hồi sức tim phổi nâng cao.
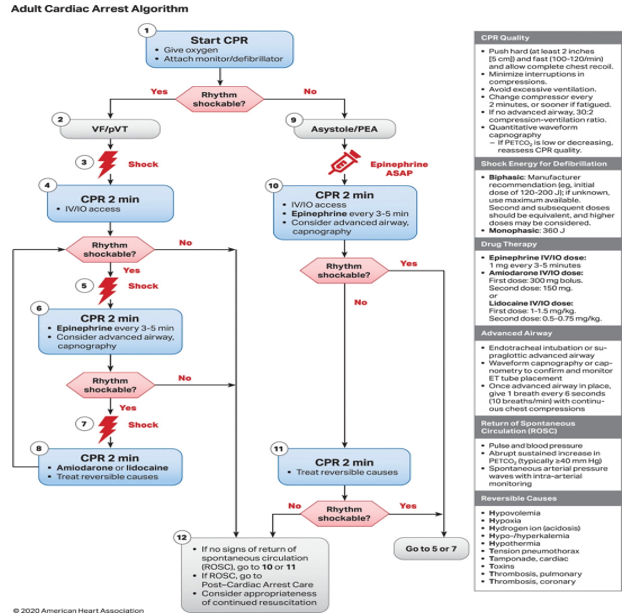
Hình 1: Phác đồ xử trí ngưng tim ở người lớn của Hội tim mạch Hoa kỳ về hồi sức tim phổi và chăm sóc tim khẩn cấp (AHA/CPR-ECC 2020[2])
Tuy nhiên, có đủ các bằng chứng để đưa ra chiến lược điều trị liên quan đến vấn đề này. Nhóm thuốc đầu tay là thuốc vận mạch như epinephrine, kế đến là sử dụng thuốc chống loạn nhịp tim khi thuốc vận mạch đơn thuần không hiệu quả. Việc sử dụng thuốc chống loạn nhịp được cho là để tạo thuận lợi cho các nỗ lực khử rung tim tiếp theo hơn là tác động trực tiếp chuyển nhịp nhanh thất. Hiện nay, các thuốc chống loạn nhịp được nghiên cứu nhiều nhất là amiodarone, lidocaine, magnesium sulfate, và gần đây hơn là esmolol. Có một số bằng chứng sơ bộ từ Vương quốc Anh cho thấy procainamide có thể vào nhóm điều trị loạn nhịp thất kháng trị, nó được chứng minh là vượt trội so với amiodarone (trong bệnh viện) để chuyển nhịp nhanh thất[3], nhưng hiệu quả của nó không được chứng minh đối với các trường hợp rung thất dai dẳng.
Các chiến lược khác bao gồm thay đổi véc tơ, khử rung tim tuần tự kép và oxy hóa qua màng ngoài cơ thể (ECMO).
Adrenaline đã được sử dụng chính trong hồi sức nâng cao trong thời gian dài. Cơ chế tác động là kích thích thụ thể α1 ở cơ trơn mạch máu gây co mạch, làm tăng áp suất tâm trương trong động mạch chủ, tăng áp lực tưới máu mạch vành và áp lực tưới máu não. Áp lực tưới máu mạch vành có liên quan chặt chẽ với sự hồi phục tuần hoàn tự nhiên.
Trong một nghiên cứu trên 100 bệnh nhân, để có thể theo dõi áp lực liên tục, đường đo áp lực xâm lấn được đặt vào tâm nhĩ phải qua tĩnh mạch dưới đòn và vào cung động mạch chủ qua động mạch đùi[4], 24 bệnh nhân hồi phục tuần hoàn tự nhiên. Áp lực tưới máu mạch vành tối đa cao hơn nhiều ở những bệnh nhân hồi phục tuần hoàn tự nhiên và không có bệnh nhân nào có áp lực tưới máu mạch vành tối đa dưới 15 mmHg.
Một nghiên cứu quan sát về oxy hóa não vùng (regional cerebral oxygenation-rSO2) được đo bằng phương pháp quang phổ cận hồng ngoại (near-infrared spectroscopy-NIRS) ở 36 bệnh nhân ngừng tim trong bệnh viện, ghi nhận rSO2 trong 5 phút trước và sau 89 liều adrenaline[5]. Đáng chú ý, 66,7% bệnh nhân chỉ được tiêm một liều adrenaline duy nhất. Giá trị rSO2 trung bình tăng 1,4% trong 5 phút sau khi dùng liều adrenaline so với 5 phút trước đó (khoảng tin cậy 95% (CI) 0,41–2,40%, p = 0,006). Tuy nhiên, giá trị rSO2 đã tăng 0,88%/phút trước khi tiêm adrenaline và xu hướng này không bị thay đổi đáng kể bởi adrenaline (p = 0,583).
Bệnh nhân ngừng tim có thể chuyển từ nhịp này sang nhịp khác, ví dụ từ hoạt động điện vô mạch sang rung thất, điều này có thể mang lại cơ hội hồi phục tuần hoàn tự nhiên cao hơn. Trong một nghiên cứu ở Oslo trên 174 bệnh nhân bị ngừng tim ngoài bệnh việnvới nhịp ban đầu là hoạt động điện vô mạch, bệnh nhân được sử dụng adrenaline có nhiều khả năng chuyển sang nhịp khác hơn (tỷ lệ tỷ lệ = 1,6, p < 0,001)[6]. Mặc dù tốc độ chuyển từ hoạt động điện vô mạch sang hồi phục tuần hoàn tự nhiên tăng rõ rệt ở nhóm adrenaline, tốc độ chuyển từ hồi phục tuần hoàn tự nhiên sang nhanh thất/rung thất cũng tăng (tham số hồi quy = 0,3, p < 0,01), cũng như từ hồi phục tuần hoàn tự nhiên sang hoạt động điện vô mạch (tham số hồi quy = 1,07, p < 0,01).
Không có thử nghiệm lâm sàng đối chứng ngẫu nhiên nào so sánh đầy đủ epinephrine với giả dược trong điều trị và dự hậu liên quan đến ngừng tim ngoài bệnh viện. Một nghiên cứu hồi cứu[7],đã so sánh epinephrine với khôngepinephrine trong rung thất và hoạt động điện vô mạch/vô tâm thu kéo dài, nhận thấy hồi phục tuần hoàn tự nhiên được cải thiện với epinephrine nhưng không có sự khác biệt về tỷ lệ sống còn giữa các nhóm điều trị. Một phân tích gộp[8]cho thấy cải thiện hồi phục tuần hoàn tự nhiên, nhưng không có nghiên cứu nào chứng minh được lợi ích sống còn của epinephrine liều cao so với epinephrine liều tiêu chuẩn trong ngừng tim.
Tóm lại, adrenaline làm tăng áp lực tưới máu mạch vành và điều này có liên quan đến tỷ lệ hồi phục tuần hoàn tự nhiên cao hơn. Tuy nhiên, adrenaline cũng làm tăng sự mất ổn định, khiến bệnh nhân dễ bị rối loạn nhịp tim hơn, bao gồm cả rung thất. Mặc dù lưu lượng máu toàn bộ não và mạch vành được tăng lên nhờ adrenaline, nhưng lưu lượng vi tuần hoàn có thể bị giảm. Giá trị và tính an toàn của tác dụng beta-adrenergic của epinephrine còn gây tranh cãi vì chúng có thể làm tăng công của cơ tim và giảm tưới máu dưới nội tâm mạc.
Theo AHA/CPR-ECC 2020, trong xử trí ngừng tim với nhịp có thể sốc điện, khuyến cáo sử dụng epinephrine sau khi các nỗ lực khử rung tim ban đầu không thành công (2b, C-LD). Cân nhắc sử dụng liều 1 mg epinephrine IV/IO cứ sau 3 đến 5 phút trong khi ngừng tim ở người lớn (2b, A). Liều cao hơn có thể được chỉ định để điều trị các vấn đề cụ thể như quá liều thuốc chẹn beta hoặc thuốc chẹn kênh canxi. Nếu đường tiêm mạch bị trì hoãn hoặckhông lập được đường truyền, epinephrine có thể được đưa vào nội khí quản với liều từ 2-2,5 mg.
Amiodarone là một trong những thuốc chống loạn nhịp phổ biến được sử dụng trong thời gian chuyển bệnh nhânvào viện. Amiodarone được nghiên cứu trong công thức trộn với chất pha loãng polysorbate hoặc cyclodextrin. Công thức chứa polysorbate, thường được gọi là “Cordarone®,” vẫn được sử dụng rộng rãi trong các hướng dẩn cho bệnh nhân trước khi nhập viện. Cordarone có tác dụng vận mạch, đôi khi dẫn đến hạ huyết áp, đây là điều quan trọng cần cân nhắc khi dùng thuốc này. Hai thử nghiệm mang tính bước ngoặc (thử nghiệm ARREST năm 1999 và thử nghiệm ALIVE năm 2002) đã chứng minh amiodarone trong polysorbate là một phương pháp điều trị hiệu quả cho rối loạn nhịp thất kháng sốc với những cải thiện về khả năng sống còn khi so sánh với giả dược và lidocaine[9], [10]. Những thử nghiệm ngẫu nhiên này ban đầu đã xác định amiodarone là lựa chọn ưu tiên của Hội Tim Mạch Hoa Kỳ (AHA) cho loạn nhịp nhanh kháng trị. Tuy nhiên, với nghiên cứu sâu hơn trong những năm gần đây, AHA đã thêm lidocaine như một lựa chọn tương đương có thể được sử dụng hợp lý thay cho amiodarone[1]. Dù vậy, hướng dẫn CPR/ECC của AHA năm 2020 vẫn chỉ đưa ra khuyến nghị cấp độ 2b đối với amiodarone[2].
Các thử nghiệm ngẫu nhiên hỗ trợ liều amiodarone tiêm mạch ban đầu là 300 mg, sau đó lặp lại liều 150 mg khi cần, thử nghiệm ROC-ALPS (Resuscitation Outcomes amiodarone Consortium–Amiodarone, Lidocaine or Placebo Study) là một thử nghiệm trước nhập viện lớn, tiến cứu, ngẫu nhiên có chứng, năm 2016[11].Nghiên cứu này đã báo cáo không có sự khác biệt về tỷ lệ sống còn khi xuất viện hoặc dự hậu thần kinh giữa amiodarone khi so sánh với lidocaine và giả dược. Trong thử nghiệm ALPS, một phân tích phân nhóm bệnh nhân ngưng tim được hồi sức tim phổi ngoại việngợi ý rằng amiodarone và lidocaine đều liên quan đến cải thiện tỷ lệ sống còn khi xuất viện so với giả dược. Nhưng phân tích phân nhóm này được thực hiện trong bối cảnh có sự khác biệt không đáng kể đối với phân tích tổng thể, do đó hạn chế khả năng ứng dụng của nó. Một số báo cáo cho thấy ít bằng chứng về cải thiện dự hậu lâu dài với amiodarone hoặc lidocaine. Hầu hết các bằng chứng chỉ ra hiệu quả cải thiện ngắn hạn với amiodarone và lidocaine so với giả dược.
Lidocaine là một loại thuốc quen thuộc với các chuyên gia dịch vụ y tế khẩn cấp và là một thuốc chống loạn nhịp thường được sử dụng. Liều lượng khuyến cáo cho lidocain là 1,0-1,5 mg/kg, tiêm mạch, lặp lại liều 0,5-0,75 mg/kg nếu cần[11]. Thử nghiệm ROC- ALPS, đã đề cập ở trên, sự hồi phục tuần hoàn tự nhiênđược cải thiện khi dùng lidocaine so với giả dược. Khả năng sống sót khi nhập viện cũng được cải thiện đáng kể với cả lidocaine và amiodarone so với giả dược. Thật không may, không có sự cải thiện đáng kể nào về tỷ lệ sống còn sau khi xuất viện và kết quả thần kinh không được đánh giá. Phân tích tổng hợp của Khan và cộng sự. vào năm 2017 cũng cho thấy lidocaine vượt trội hoặc tương đương với amiodarone trong tỷ lệ sống còn sau khi xuất viện, (cả hai đều vượt trội so với MgSO4 và giả dược)[12]. Tuy nhiên 2 nghiên cứu ngẫu nhiên có chứng được đưa vào phân tích tổng hợp này không đủ mạnh về mặt thống kê. Cả hai đều không thể hiện sự cải thiện một cách độc lập trong kết quả lâu dài như tỷ lệ sống còn khi xuất viện hoặc dự hậu thần kinh tốt giữa lidocaine, amiodarone, MgSO4 và giả dược.
Thuốc chẹn beta, đặc biệt là esmolol, đã được nghiên cứu ngày càng nhiều trong vài năm qua, bằng chứng sơ bộ cho thấy esmolol có thể có hiệu quả chuyển nhịp trong nhanh thất/rung thất kháng trị[13]. Thuốc chẹn beta có thể làm giảm sự gia tăng catecholamine, tác nhân làm kéo dài rung thất mặc dù đã cố gắng khử rung tim. Epinephrine góp phần trực tiếp làm tăng nồng độ catecholamine, có thể làm giảm khả năng khử rung tim. Do đó, việc tiếp tục sử dụng epinephrine trong khi sử dụng thuốc chẹn beta trong rung thất kháng trị có thể phản tác dụng. Một số nghiên cứu bao gồm thử nghiệm PARAMEDIC-2 cho thấy liều lượng epinephrine tiêu chuẩn và tần suất lập lại có thể làm tăng catecholamine quá mức trong quá trình hồi sức kéo dài[14]. Với khía cạnh này, một số nghiên cứu ủng hộ việc sử dụng esmolol trong rung thất kháng trị. Có nhiều trường hợp nghiên cứu hỗ trợ giả thuyết này với bằng chứng yếu. Tuy nhiên, không có nghiên cứu tiến cứu ngẫu nhiên, chắc chắn, đầy đủ thông tin nào để hỗ trợ việc sử dụng esmolol trong xử trí rung thất kháng trị.
Miraglia và cộng sự. đã báo cáo vào năm 2020 một phân tích gộp cho thấy bằng chứng thấp về cải thiện khả năng sống sót khi xuất viện và kết quả thần kinh tốt hơn ở bệnh nhân rung thất kháng trị được điều trị bằng esmolol[15]. Bằng chứng tương tự cho thấy sự cải thiện với esmolol cho cả hồi phục tuần hoàn tự nhiên và khả năng sống sót khi nhập viện. Thật không may, phân tích thống kê cho thấy điều này là không thuyết phục và cần phải xem xét thêm để làm rõ vai trò có thể có của esmolol. Nói chung, đối với bệnh nhân ngừng tim, liều nạp 500 mcg/kg trong hơn một phút đã được sử dụng trước khi truyền liều duy trì 1–100 mg/kg/phút. Esmolol có thể được cân nhắc sử dụng trước khi nhập viện trong rối loạn nhịp thất kháng sốc sau khi sử dụng lidocaine hoặc amiodarone không hiệu quả, nhưng cần phải nghiên cứu kỹ lưỡng trước khi chiến lược này trở thành tiêu chuẩn thực hành.
Phối hợp amiodaron và lidocain, các hướng dẫn gần đây về điều trị rung thất và nhịp nhanh thất nhấn mạnh xử dụng amiodarone hoặc lidocain, nhưng một số rối loạn nhịp tim kháng với các thuốc này và sốc điện vẫn xảy ra trong thực hành lâm sàng. Khả năng của một chiến lược điều trị mới liên quan đến liệu pháp phối hợp amiodarone và lidocain đã được đánh giá.
Một nghiên cứu trên 42 bệnh nhân rối loạn nhịp thất kháng trị[16],đánh giá khả năng chuyển nhịp nhanh thất/rung thất ở những bệnh nhân dùng lidocaine sau khi dùng amiodaron và cả bệnh nhân không có dùng amiodarone trước đó để đánh giá hiệu quả thực tế của lidocaine. Nghiên cứu hồi cứu này gợi ý rằng liệu pháp phối hợp lidocain và amiodarone có thể chấm dứt các rối loạn nhịp thất kháng trị.
Các trường hợp lâm sàng được báo cáo phối hợp amiodarone và lidocaine để điều trị bão điện thế nhanh thất trên bệnh nhân bệnh cơ tim giãn và suy chức nặng thất trái nặng.
Dữ liệu nghiên cứu chứng minh trong ống nghiệm, với nồng độ cao amiodarone có thể ức chế cạnh tranh chuyển hóa lidocain và ngược lại.Cơ chế tương tác có thể xảy ra giữa amiodarone và lidocaine có thể là sự ức chế các CYP ở gan (ví dụ, CYP3A4) bởi amiodarone, như đã được chứng minh trong các thí nghiệm in vitro. Về mặt lý thuyết, sự ức chế có thể không chỉ do tương tác trực tiếp lẫn nhau giữa các gốc thuốc (lidocaine/amiodarone), mà còn do tương tác giữa chất chuyển hóa của chúng như lidocaine-DEA, amiodarone-MEGEX.
Trong thực hành lâm sàng, như trong xử trí nhanh thất, một bệnh nhân được điều trị bằng amiodarone cũng có thể được dùng lidocaine. Do tương tác thuốc, nồng độ lidocaine trong huyết tương có thể tăng đến mức gây độc, ngay cả với liều truyền tĩnh mạch lidocaine tiêu chuẩn, sự tương tác có thể trở nên rõ rệt khi lidocaine tích tụ ở những bệnh nhân bị suy tim sung huyết hoặc rối loạn chức năng gan. Tuy nhiên, với một liều liều tiêm mạch lidocaine 1 mg/kg trọng lượng cơ thể và lập lại 0,5 mg/kg thì tương tác này không có ý nghĩa lâm sàng lớn.
Magnesium sulfate
Magnesium đã được nghiên cứu để điều trị rối loạn nhịp thất từ những năm 1960, và MgSO4 từ lâu đã là một thành phần chính trong điều trị xoắn đỉnh. Cũng có nhiều trường hợp báo cáo gợi ý chuyển loạn nhịp thất kháng sốc sau khi dùng magnesium .
Tuy nhiên, một số nghiên cứu gần đây cho thấy không có lợi khi sử dụng MgSO4 cho chỉ định này. Năm 2001, Allegra và cộng sự đã công bố một thử nghiệm trước nhập viện, mù đôi, có đối chứng MgSO4 với giả dược[17].Các trường hợp người lớn bị ngừng tim ngoại viện và rối loạn nhịp thất kháng với ba lần khử rung tim được chọn ngẫu nhiên để dùng hai gram MgSO4 hoặc giả dược. MgSO4 cho thấy không có lợi ích so với giả dược về kết quả ngắn hạn (hồi phục tuần hoàn tự nhiên và tỷ lệ sống sót khi nhập viện) hoặc kết quả lâu dài (sống sót đến khi xuất viện).
Nghiên cứu năm 2002 của Hassan và cộng sự, cũng so sánh MgSO4 với giả dược[18].Nghiên cứu này là một thử nghiệm ngẫu nhiên, mù đôi, có đối chứng so sánh hai gramvà bốn gram MgSO4 với giả dược ở bệnh nhân trưởng thành ngưng tim ngoại viện với rung thất kháng trị. Nghiên cứu này cũng cho thấy không có sự cải thiện nào ở các nhóm được điều trị bằng MgSO4 đối với tỷ lệ hồi phục tuần hoàn tự nhiên hoặc tỷ lệ sống sót khi xuất viện. Thật không may, tất cả các nghiên cứu này đều không đủ chứng cứ để đánh giá dự hậu lâu dài, lấy bệnh nhân làm trung tâm. Một số người cho rằng sử dụng MgSO4có thể tối ưu hóa môi trường nội mạch, đặc biệt ở những bệnh nhân chạy thận nhân tạo, bệnh nhân nghiện rượu hoặc ở những bệnh nhân mắc các bệnh đi kèm khác thường làm thay đổi nồng độ kali hoặc magiê tuần hoàn. Tuy nhiên, không có nghiên cứu tiến cứu nào cho đến nay chỉ ra lợi ích của magiê khi được sử dụng như một chất chống loạn nhịp trong rung thất kháng trị.
Khuyến cáo CPR/ECC của AHA năm 2020 không khuyến nghị sử dụng magie sulfat trong trường hợp ngừng tim.
Thay đổi véc tơ sốc điện khử rung và khử rung tim tuần tự kép
Thay đổi véc tơ sốc điện khử rung đơn giản là thay đổi vị trí của bảng điện nếu rối loạn nhịp thất không đáp ứng với khử rung tim với vị trí bảng điện ban đầu (thường là hướng trước-bên)[19].Khử rung tim tuần tự kép (Double sequential defibrillation-DSD) là việc sử dụng hai máy khử rung tim với hai bộ bảng điện để cung cấp hai lần khử rung tim liên tiếp[20], với vị trí đặt bảng điện như Hình 2.
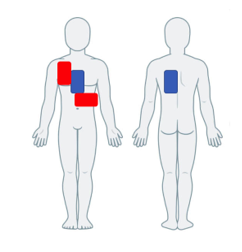
Hình 2: Vị trí bảng điện khử rung tim tuần tự kép. Vị trí trước-bên tiêu chuẩn được thể hiện bằng màu đỏ với bộ bảng điện thứ hai ở vị trí trước-sau có màu xanh[20]
Chiến lược này đã được chứng minh là khả thi và an toàn. Tuy nhiên, vẫn còn tranh cãi và một số máy khử rung tim bị hư hỏng bởi kỷ thuật này. Một số giả thuyết về cách thức hoạt động của khử rung tim tuần tự kép:
- Năng lượng tăng lên từ hai cú sốc cho phép khử rung một lượng cơ tim lớn hơn, hiệu quả hơn để vượt qua sự đề kháng của rung thất.
- Cú sốc đầu tiên làm giảm ngưỡng khử rung tim, cải thiện hiệu quả của cú sốc thứ hai.
- Nhiều vectơ đồng thời cho phép năng lượng tiếp cận các khu vực của cơ tim hiệu quả hơn là một vector trước-bên.
Thời gian dường như là một trong những yếu tố quan trọng đối với hiệu quả của DSD. Bằng chứng gợi ý rằng DSD có hiệu quả hơn trong các cú sốc từ bốn đến tám hơn là sau nỗ lực khử rung tim lần thứ tám[20].
DSD dường như cũng không hiệu quả ở những bệnh nhân đã nhận được một số lượng lớn các cú sốc. Một số nghiên cứu về DSD cho thấy nó an toàn và có thể cải thiện ít nhất là dự hậu ngắn hạn. Các nghiên cứu khác chỉ trích việc sử dụng DSD, cho thấy hỗ trợ cho việc sử dụng nó còn yếu và rủi ro vẫn có thể lớn hơn lợi ích.Hướng dẫn của AHA/CPR-ECC 2020 hiện đưa ra khuyến nghị 2b cho DSD, đây không phải là khuyến cáo được hỗ trợ mạnh.
Oxy hóa qua màng ngoài cơ thể (Extracorporeal Membrane Oxygenation – ECMO)
ECMO là một chiến lược tái tưới máu nâng cao cho thấy nhiều hứa hẹn trong việc cải thiện dự hậu lâu dài trong rung thất kháng trị. ECMO cung cấp oxy và lưu thông máu tuần hoàn ngoại biên. Điều này cho phép giải quyết nguyên nhân cơ bản của rung thất kháng trị trong khi bệnh nhân được duy trì bằng hỗ trợ bên ngoài. Một số hệ thống chăm sóc y tế khẩn cấp đã thành lập các đội can thiệp ECMO trước vào viện, nhưng hầu hết các nơi có khả năng ECMO được tiến hành trong bệnh viện. Thử nghiệm ARREST vào năm 2020 cho thấy cải thiện đáng kể về tỷ lệ sống còn khi xuất viện đối với những bệnh nhân đáp ứng tiêu chí ECMO, khi so sánh với phác đồ tiêu chuẩn hồi sức tim nâng cao[21]. Có một số nghiên cứu khác hỗ trợ việc sử dụng ECMO trong rung thất kháng trị[22]. Những nghiên cứu này gợi ý rằng ECMO là một lựa chọn tốt cho những bệnh nhân rung thất kháng trị trước nhập viện và cho thấy tác động tích cực đến dự hậu sống còn dài hạn. Tuy nhiên, thiết lập một hệ thống can thiệp ECMO tốn nhiều thời gian và nguồn lực.
Bệnh nhân đề cập ở trên được rút ống nội khí quản sau một ngày, tri giác tốt, huyết động ổn định. ECG nhịp xoang, sóng Q, đoạn ST đẳng điện và P (-) ở các chuyển đạo thành dưới. Siêu âm tim EF 60 %, không ghi nhận rối loạn vận động vùng. Bệnh nhân được xuất viện sau 10 ngày do phải truyền kháng sinh điều trị viêm phổi liên quan thở. Tiếp tục điều trị sau xuất viện với valsartan 80 mg/ngày, bisoprolol 5 mg/ngày, atorvastatin 40 mg/ngày, brilinta 90 mg x 2/ngày, aspirin 81 mg/ngày.
Có thể nói, tình trạng rung thất kháng sốc của bệnh nhân đã được hồi sức thành công (hồi phục tuần hoàn tự nhiên và không tổn thương thần kinh) khi dùng lidocaine sau qui trình hồi sức tiêu chuẩn với sốc điện khử rung, adrenalin và amiodarone thất bại.
Tóm lại
Thiếu bằng chứng hỗ trợ cho việc sử dụng Magiê sulfat trong loạn nhịp thất kháng trị và hiện nay không được khuyến cáo sử dụng thường qui. Tuy nhiên, trong trường hợp không có bằng chứng chắc chắn cho thấy nó có hại, magie sulfat có thể được sử dụng một cách hợp lý trong những nỗ lực cuối cùng khi các liệu pháp khác không thành công hoặc nếu nghi ngờ xoắn đỉnh. Tuy nhiên, nó không nên được ưu tiên hơn các thuốc vận mạch, lidocaine, amiodarone hoặc thay đổi véc tơ trong quá trình khử rung tim.
Lidocaine và amiodarone đã được chứng minh là hiệu quả hơn MgSO4 và giả dược để đạt được giải pháp ngắn hạn đối với rung thất kháng trị, nhưng mức độ bằng chứng không mạnh và chúng chỉ được khuyến cáo mức 2b của AHA vào năm 2020. Không có bằng chứng nhất quán hỗ trợ việc sử dụng một trong hai thuốc này so với thuốc kia, đặc biệt là về kết quả có ý nghĩa lâm sàng.
Trong thực hành lâm sàng, một số trường hợp điều trị bằng amiodarone cũng có thể dùng lidocaine, nghiên cứu cho thấy sự phối hợp này có thể chấm dứt các rối loạn nhịp thất kháng trị. Cần lưu ý tương tác thuốc dẫn đến tích tụ lidocaine trong huyết tương gây độc nếu truyền tĩnh mạch kéo dài, tuy nhiên điều này không ý nghĩa lâm sàng với liều lidocaine tiêm mạch tiêu chuẩn.
Esmolol có thể có hiệu quả khi amiodarone hoặc lidocaine không hiệu quả đối với rung thất kháng trị. Mặc dù một số cơ sở dịch vụ y tế khẩn cấp đã áp dụng trong xử trí cho bệnh nhân rối loạn nhịp thất kháng trị, tuy nhiên cần có bằng chứng mạnh mẽ hơn từ các nghiên cứu nghiêm ngặt.
Thay đổi véc tơ khử rung tim và các biện pháp khác để tăng hiệu quả khử rung tim là một lựa chọn cho rối loạn nhịp thất kháng trị. Những điều chỉnh này là khả thi, an toàn và không cần máy khử rung tim thứ hai. Nếu thay đổi véc tơ và thuốc chống loạn nhịp không hiệu quả, khử rung tim tuần tự kép có thể được xem xét, mặc dù chưa có dữ liệu chắc chắn từ các thử nghiệm lâm sàng nghiêm ngặt. Khử rung tim tuần tự kép hiện không phải là tiêu chuẩn xử trí rối loạn nhịp thất kháng trị và rủi ro đối với máy khử rung tim nên được cân nhắc.
ECMO được thực hiện trên bệnh nhân rung thất kháng trị trước khi vào viện kết hợp với hồi sức tim phổi, làmột lựa chọn tuyệt vời nếu đáp ứng các tiêu chí đặt ECMO. Tuy nhiên tính khả dụng của ECMO chưa phổ biến, nó sẽ không phải là một lựa chọn hàng đầu đối với các cơ sở y tế hiện nay do các hạn chế về chi phí, đào tạo…
Tài liệu tham khảo
- Panchal AR, Berg KM, Kudenchuk PJ, Del Rios M, Hirsch KG, Link MS, Kurz MC, Chan PS, Cabañas JG, Morley PT, Hazinski MF, Donnino MW. 2018 American Heart Association focused update on advanced cardiovascular life support use of antiarrhythmic drugs during and immediately after cardiac arrest: an update to the American Heart Association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation. 2018;138:e740–e749. DOI: 10.1161/CIR.0000000000000613
- Lavonas E, Magid D, et al. 2020 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation | Volume 142, Issue 16_suppl_2: S336, Oct 21, 2020, https://doi.org/10.1161/CIR.0000000000000929.
- Ortiz M, Martín A, Arribas F, Coll-Vinent B, Del Arco C, Peinado R, Almendral J; PROCAMIO Study Investigators. Randomized comparison of intravenous procainamide vs. intravenous amiodarone for the acute treatment of tolerated wide QRS tachycardia: the PROCAMIO study. Eur Heart J. 2017 May 1;38(17):1329-1335. doi: 10.1093/eurheartj/ehw230. PMID: 27354046; PMCID: PMC5410924
- Paradis NA, Martin GB, Rivers EP, et al. Coronary perfusion pressure and the return of spontaneous circulation in human cardiopulmonary resuscitation. JAMA. 1990;263:1106–13.
- Deakin CD, Yang J, Nguyen R, et al. Effects of epinephrine on cerebral oxygenation during cardiopulmonary resuscitation: a prospective cohort study. Resuscitation. 2016;109:138–44.
- Nordseth T, Olasveengen TM, Kvaloy JT, Wik L, Steen PA, Skogvoll E. Dynamic effects of adrenaline (epinephrine) in out-of-hospital cardiac arrest with initial pulseless electrical activity (PEA). Resuscitation. 2012;83:946–52.
- Herlitz J, Ekstrom L, Wennerblom B, Axelsson A, Bang A, Holmberg S. Adrenaline in out-of-hospital ventricular fibrillation. Does it make any difference?Resuscitation. 1995; 29:195–201.
- Vandycke C, Martens P. High dose versus standard dose epinephrine in cardiac arrest—a meta-analysis
- Kudenchuk PJ, Cobb LA, Copass MK, Cummins RO, Doherty AM, Fahrenbruch CE, Hallstrom AP, Murray WA, Olsufka M, Walsh T. Amiodarone for resuscitation after out-of-hospital cardiac arrest due to ventricular fibrillation.N Engl J Med. 1999; 341:871–878. doi: 10.1056/NEJM199909163411203
- Dorian P, Cass D, Schwartz B, Cooper R, Gelaznikas R, Barr A. Amiodarone as compared with lidocaine for shock-resistant ventricular fibrillation. N Engl J Med. 2002; 346:884–890. doi: 10.1056/NEJMoa013029
- Kudenchuk PJ, Brown SP, Daya M, Rea T, Nichol G, Morrison LJ, Leroux B, Vaillancourt C, Wittwer L, Callaway CW, Christenson J, Egan D, Ornato JP, Weisfeldt ML, Stiell IG, Idris AH, Aufderheide TP, Dunford JV, Colella MR, Vilke GM, Brienza AM, Desvigne-Nickens P, Gray PC, Gray R, Seals N, Straight R, Dorian P; on behalf of the Resuscitation Outcomes Consortium Investigators. Amiodarone, lidocaine, or placebo in out-of-hospital cardiac arrest. N Engl J Med. 2016; 374:1711–1722. doi: 10.1056/NEJMoa1514204
- Khan SU, Winnicka L, Saleem MA, Rahman H, Rehman N. Amiodarone, lidocaine, magnesium or placebo in shock refractory ventricular arrhythmia: A Bayesian network meta-analysis. Heart Lung. 2017 Nov-Dec;46(6):417-424. doi: 10.1016/j.hrtlng.2017.09.001. Epub 2017 Sep 27.PMID: 28958592
- Miraglia D, Miguel LA, Alonso W. The Evolving Role of Esmolol in Management of Pre-Hospital Refractory Ventricular Fibrillation; a Scoping Review. Arch Acad Emerg Med. 2020 Feb 25;8(1):e15. eCollection 2020.PMID: 32259114
- Perkins GD, Ji C, Achana F, Black JJ, Charlton K, Crawford J, de Paeztron A, Deakin C, Docherty M, Finn J, Fothergill RT, Gates S, Gunson I, Han K, Hennings S, Horton J, Khan K, Lamb S, Long J, Miller J, Moore F, Nolan J, O’Shea L, Petrou S, Pocock H, Quinn T, Rees N, Regan S, Rosser A, Scomparin C, Slowther A, Lall R. Adrenaline to improve survival in out-of-hospital cardiac arrest: the PARAMEDIC2 RCT. Health Technol Assess. 2021 Apr;25(25):1-166. doi: 10.3310/hta25250.PMID: 33861194
- Miraglia D, Miguel LA, Alonso W. Esmolol in the management of pre-hospital refractory ventricular fibrillation: A systematic review and meta-analysis. Am J Emerg Med. 2020 Sep;38(9):1921-1934. doi: 10.1016/j.ajem.2020.05.083. Epub 2020 May 29.PMID: 3277766.
- Koji Yoshie, Takeshi Tomita, Takahiro Takeuchi, Ayako Okada, Takashi Miura, Hirohiko Motoki, Uichi Ikeda. Renewed impact of lidocaine on refractory ventricular arrhythmias in the amiodarone era, Int J Cardiol. 2014 Oct 20;176(3):936-40. doi: 10.1016/j.ijcard.2014.08.090. Epub 2014 Aug 27
- Allegra J, Lavery R, Cody R, Birnbaum G, Brennan J, Hartman A, Horowitz M, Nashed A, Yablonski M. Magnesium sulfate in the treatment of refractory ventricular fibrillation in the prehospital setting. Resuscitation. 2001; 49:245–249. doi: 10.1016/S0300-9572(00)00375-0
- Hassan TB, Jagger C, Barnett DB. A randomised trial to investigate the efficacy of magnesium sulphate for refractory ventricular fibrillation. Emerg Med J. 2002; 19:57–62. doi: 10.1136/emj.19.1.57
- Davis, A. Schappert, K. Van Aarsen, J. Loosley, S.L. McLeod, S. Cheskes. A descriptive analysis of defibrillation vector change for prehospital refractory ventricular fibrillation. CJEM, 20 (2018), p. S67
- Cheskes S. Dorian P. Feldman M. et al. Double sequential external defibrillation for refractory ventricular fibrillation: the DOSE VF pilot randomized controlled trial [published online ahead of print, 2020 Feb 19]. Resuscitation. 2020; (S0300-9572(20)30074-30075).
- Kumar V, Yamane D, Aljohani B, Alsabban A, Pourmand A. Double sequential external defibrillation. 2020 Jul;152:212-213. doi: 10.1016/j. Resuscitation.2020.05.015. Epub 2020 May 19.PMID: 32442675
- Bartos JA, Frascone RJ, Conterato M, Wesley K, Lick C, Sipprell K, Vuljaj N, Burnett A, Peterson BK, Simpson N, Ham K, Bruen C, Woster C, Haley KB, Moore J, Trigger B, Hodgson L, Harkins K, Kosmopoulos M, Aufderheide TP, Tolar J, Yannopoulos D. The Minnesota mobile extracorporeal cardiopulmonary resuscitation consortium for treatment of out-of-hospital refractory ventricular fibrillation: Program description, performance, and outcomes. E Clinical Medicine. 2020 Nov 13;29-30:100632. doi: 10.1016/j.eclinm.2020.100632. eCollection 2020 Dec.PMID: 33437949







