ThS. BS. LÊ THỊ LAN HƯƠNG
BS.CK1. TRẦN CÔNG TRÌNH
PGS. TS. BS. PHẠM NGUYỄN VINH
TÓM TẮT
Tổng quan: Viêm cơ tim là tình trạng viêm kèm rối loạn chức năng các tế bào cơ tim, và được phân loại là một dạng bệnh cơ tim đặc biệt. Theo y văn, viêm cơ tim là một trong những nguyên nhân hàng đầu dẫn đến bệnh tật và tử vong, khoảng 12 – 25% bệnh nhân nhanh chóng diễn tiến xấu thành bệnh cơ tim dãn nở hoặc thậm chí tử vong. Bệnh cảnh lâm sàng viêm cơ tim rất đa dạng, tuy nhiên các cận lâm sàng tiêu chuẩn khác như điện tâm đồ hoặc siêu âm tim lại không đặc hiệu trong chẩn đoán. Trong thực hành lâm sàng, cộng hưởng từ tim (CMR) là công cụ chẩn đoán hình ảnh không xâm lấn duy nhất có thể đánh giá mô cơ tim, không chỉ góp phần quan trọng trong chẩn đoán mà còn trong theo dõi bệnh.
Báo cáo ca lâm sàng: Chúng tôi minh họa bằng 4 ca lâm sàng chẩn đoán viêm cơ tim cấp và mạn tính, với nhiều biểu hiện lâm sàng khác nhau: từ đau ngực kiểu hội chứng vành cấp, suy tim đến loạn nhịp nguy hiểm. Chúng tôi đã loại trừ bệnh động mạch vành bằng chụp mạch vành xâm lấn và khẳng định chẩn đoán bằng CMR
Kết luận: Trong toàn bộ các trường hợp, CMR đóng vai trò quan trọng trong chẩn đoán. Ưu việt lớn nhất của cộng hưởng từ là phương pháp hình ảnh không xâm lấn duy nhất có thể đánh giá bản chất mô cơ tim, đồng thời khảo sát các thông số thay đổi trong thể tích dịch ngoại bào để hình dung quá trình diễn tiến viêm từ giai đoạn cấp đến mạn tính.
Từ khóa: Cộng hưởng từ tim, Viêm cơ tim
DANH MỤC CÁC TỪ VIẾT TẮT
| Từ viết tắt | Diễn giải |
| CMR | Cộng hưởng từ tim |
| GLS | Độ biến dạng cơ tim trục dọc toàn thể |
| LGE | Tổn thương ngấm Gadolinium thì muộn |
| BN | Bệnh nhân |
1. Các trường hợp lâm sàng:
Chúng tôi xin minh họa các trường hợp viêm cơ tim với các biểu hiện lâm sàng khác nhau:
1.1. Trường hợp lâm sàng 1:
Bệnh nhân (BN) nữ, 73 tuổi, nhập bệnh viện đa khoa Tâm Anh vì sốt cao lạnh run, nôn ói. Bệnh nhân có tiền sử bệnh mạch vành đã đặt 2 stent LAD tại bệnh viện Nhân dân 115, viêm khớp đang điều trị với Tocilizumab 400mg. BN đã nhiễm Covid – 19 hơn 6 tháng và đã tiêm 4 mũi vắc – xin, mũi 4 Pfizer cách 4 ngày. Trước khi nhập viện, bệnh nhân đã nhập cấp cứu tại bệnh viện Đại học y dược trong tình trang sốt cao 39 độ, sinh hiệu: huyết áp 80/50mmHg, nhịp tim: 92 lần/ phút, nhịp thở 19 lần/ phút, SpO2 93%/ khí trời, BN không ho, không đau ngực, không đau bụng, tiêu tiểu bình thường, được chẩn đoán: Sốc nhiễm trùng chưa rõ ngõ vào và điều trị Noradrenalin 10mg/50ml BTĐ 2ml/h + Meronem 1g. Bệnh nhân xin chuyển bệnh viện đa khoa Tâm Anh điều trị tiếp.
Tình trạng lúc nhập viện:Bệnh nhân tỉnh táo, sinh hiệu: mạch 72 lần/phút, HA = 80/47 mmHg, nhịp thở 20 lần/ phút, nhiệt độ 37.6 độ, SpO2 93%. BN than buồn nôn, không khó thở, không đau ngực. Khám ghi nhận tim không đều, phổi không ran, bụng mềm. BN tiếp tục chẩn đoán sốc nhiễm trùng không rõ đường vào – bệnh động mạch vành mạn đặt 2 stent LAD, được chuyển khoa Hồi sức tích cực và điều trị Noradrenalin 0.3 ug/kg/phút, Meropenem 1gram x 3 lần/ ngày,
Zyvox 0.6g x 2 lần/ngày.
Bảng 1.1 Diễn biến cận lâm sàng
| Nhập viện | Sau 4 tiếng | 2/8 | 5/8 | 10/8 | |
| WBC | 25 k/ul | 18k/uL | 7.5k/uL | 5.1 k/ uL | |
| NEU | 22 K/uL | 14 k/uL | 5 k/uL | 2.7 k/uL | |
| CRP | 69 | ||||
| Troponin T – hs | 160 ng/L | 1501 ng/L | 475 ng/L | 35 | |
| NT-pro BNP | 1972 | 2064 pg/ml |
Sau nhập viện 4 tiếng, BN than đau ngực, khó thở. Men tim Troponin T – hs tăng động học 160 – 1501 pg/mL, kèm biến đổi ECG: ST chênh lên 1mm ở D1 – aVL (Hình 1.1). Siêu âm tim ghi nhận: Giảm động vùng mỏm vách liên thất, vùng giữa thành trước vách, vùng đáy – giữa thành dưới, chức năng tâm thu thất trái giảm nặng với LVEF 35%, hở van 2 lá và 3 lá nhẹ.
Bệnh nhân được chẩn đoán: Nhồi máu cơ tim ST chênh lên – Viêm phổi – Sốc nhiễm trùng, và tiếp tục được theo dõi và điều trị tại khoa Hồi sức tích cực với kháng sinh và vận mạch như trên, bổ sung thêm: Lovenox 0.4ml/ ống 1 ống x 2 lần, Duoplavin 100/75 mg/ngày, Lipitor 20mg/ngày. Do tình trạng nhiễm trùng nặng nên trì hoãn chụp mạch vành. Bệnh nhân điều trị tại khoa hồi sức 9 ngày, lâm sàng ổn định. BN hết sốt, không đau ngực, không khó thở. Xét nghiệm cận lâm sàng cải thiện tốt: bilan nhiễm trùng cải thiện, Troponin T -hs giảm, ECG: ST bớt chênh ở D1 và aVL, QS ở V1 – V2 (Hình 1.1)
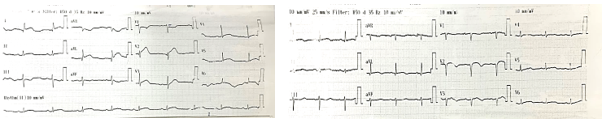
Hình 1.1 Biến đổi ECG trong quá trình nằm viện
Bệnh nhân được chuyển về điều trị tại khoa tim mạch, và được chụp mạch vành vào ngày thứ 11 của bệnh. Kết quả chụp mạch vành ghi nhận: stent LAD I – Diagonal I thông tốt, hẹp 30 – 40% RCA I – II, 30 – 40% PL. Kết quả chụp mạch vành loại trừ nguyên nhân nhồi máu cơ tim cấp do tắc nghẽn mạch vành (Hình 1.2)
Bệnh nhân tiếp tục được chụp cộng hưởng từ tim để tiếp tục đánh giá nguyên nhân bệnh. Cộng hưởng từ tim ghi nhận: giảm động vùng đáy – giữa thành trước, vùng giữa – mỏm thành dưới và dưới bên không theo phân vùng chi phối mạch vành. Trên chuỗi xung T2 STIR ghi nhận tăng tín hiệu cơ tim tập trung nổi bật ở thành trước, thành bên và thành dưới. Tỉ lệ tín hiệu cơ tim/ cơ vân lân cận ≥ 2 (Hình 1.3). Trên hình EGE, ghi nhận hình ảnh sung huyết cơ tim với tỉ lệ tín hiệu cơ tim/ cơ vân ≥ 4 (Hình 1.4). Đặc biệt, trên hình LGE ghi nhận tăng tín hiệu muộn dạng mid-wall vùng giữa vách liên thất, dạng sub-epicardial vùng giữa, mỏm thành dưới và dưới bên
(Hình 1.5). Ngoài ra còn ghi nhận tràn dịch màng ngoài tim toàn thể lượng ít. Các đặc điểm trên thỏa tiêu chuẩn Lake Loiuse trong chẩn đoán viêm cơ tim. Bệnh nhân sau đó được xuất viện và điều trị ngoại trú. Siêu âm tim kiểm tra lại sau 3 tháng ghi nhận hồi phục hoàn toàn vận động vùng, chức năng co bóp thất trái tốt, không tràn dịch màng ngoài tim.
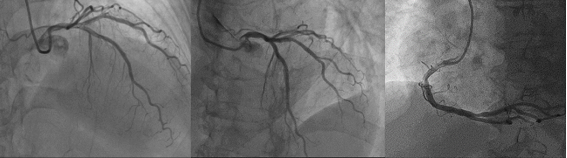
Hình 1.2 Kết quả chụp mạch vành qua da: stent LAD I-Diagonal I thông tốt, hẹp 30 – 40% RCA I – II, 30 – 40% PL
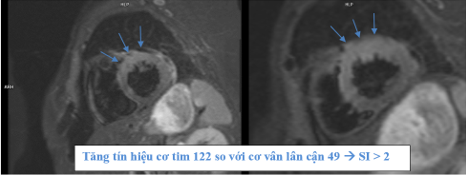
Hình 1.3 Phù cơ tim trên hình T2 STIR
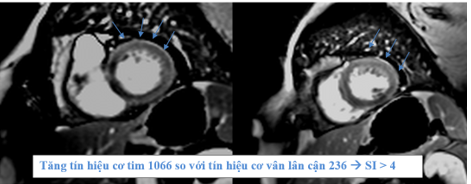
Hình 1.4 Sung huyết cơ tim trên hình ngấm thuốc Gadolinium sớm (EGE)
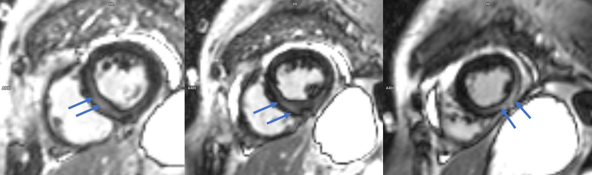
Hình 1.5 Tổn thương ngấm thuốc Gadolinium thì muộn dạng giữa thành (mid-wall) và dạng dưới thượng mạc (sub-epicardial) vùng giữa – mỏm vách liên thất và thành dưới
1.2. Trường hợp lâm sàng 2:
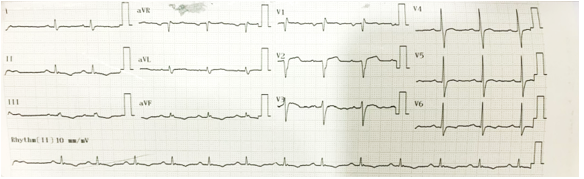
BN nam 50 tuổi với tiền căn tăng huyết áp, nhập viện đau ngực khi gắng sức. Bệnh khoảng 3 ngày, BN sốt khoảng 38 – 38.5 độ, kèm đau cơ, mệt, đau ngực khi gắng sức, bệnh nhân không ho, không rối loạn tiêu hóa kèm theo. Bệnh nhân điều trị ngoại trú với thuốc không rõ loại nhưng không giảm. Ngày thứ ba, bệnh nhân mệt nhiều, khám bệnh viện Becamex Bình Dương ghi nhận nhịp chậm à xử trí truyền Dopamin và chuyển Bệnh viện Tâm Anh. Tình trạng lúc nhập viện: mạch 44 lần/phút, HA 92/57mmHg, nhiệt độ 37.6 độ, nhịp thở 20 lần/phút, còn đau ngực từng lúc, và tiếp tục duy trì Dopamin BTĐ. Điện tâm đồ lúc nhập viện ghi nhận Blốc nhĩ thất độ III (Hình 1.6).
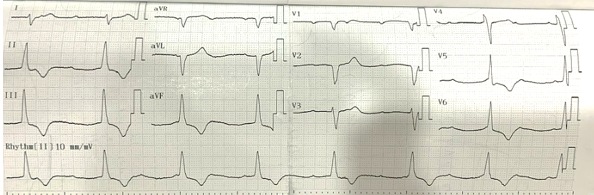
Hình 1.6 Điện tâm đồ lúc nhập viện
Siêu âm tim ghi nhận: Dãn thất trái với LVEDD = 64mm, giảm động vùng giữa – mỏm thành dưới và thành bên thất trái. Chức năng tâm thu thất trái giảm với LVEF # 45% và hở van hai lá mức độ nặng (Hình 1.7).
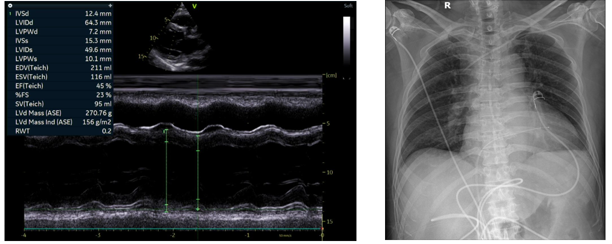
Hình 1.7 Siêu âm tim và XQ sau đặt máy tạo nhịp tạm thời
Bệnh nhân được đặt máy tạo nhịp tạm thời buồng thất phải (Hình 1.7) và tiến hành chụp mạch vành cấp cứu: không ghi nhận hẹp các nhánh mạch vành. (Hình 1.8).
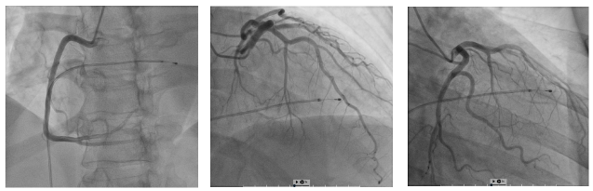
Hình 1.8 Kết quả chụp mạch vành bình thường
Tại thời điểm nhập viện xét nghiệm ghi nhận men tim tăng cao 5433 pg/ml và diễn tiến động học, không ghi nhận dấu hiệu nhiễm trùng, các xét nghiệm sinh hóa khác trong giới hạn bình thường (Bảng 1.2).
Bảng 1.2 Diễn biến cận lâm sàng (ca lâm sàng 2)
| Nhập viện | Sau 4 tiếng | N2 | N3 | N4 | N9 | N6 | |
| WBC | 6.4 k/ul | 7.61 k/uL | 7.34 k/ uL | ||||
| NEU | 4.2 K/uL | 5.41 k/uL | 4.99 k/uL | ||||
| Pro-calcitonin | 0.5 ng/mL | ||||||
| Troponin T – hs | 5433 ng/L | 4248 ng/L | 2552 ng/L | 1240 ng/L | 744 ng/L | 31 ng/L | 18.2 ng/L |
| NT-pro BNP | 1972 | 8118 pg/ml | 3505 pg/ml | 487 pg/mL |
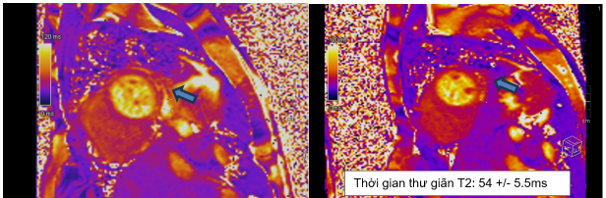
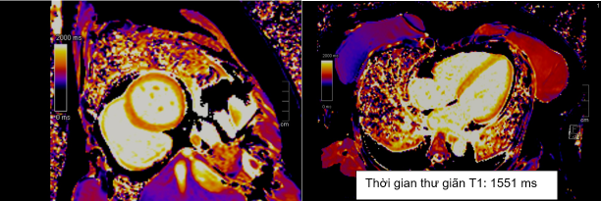
Cộng hưởng từ tim chụp vào ngày 7 của bệnh, ghi nhận: tăng thể tích thất trái với LVEDVi = 155ml/m2. Giảm động thành bên thất trái, chức năng tâm thu thất trái cải thiện so với lúc nhập viện với LVEF 55%. Trên hình T2-STIR ghi nhận phù cơ tim với tín hiêu mô cơ tim so với tín hiệu mô cơ vân lân cận lớn hơn 2 (chỉ số tín hiệu SI # 162/72) (Hình 1.9). Trên bản đồ thời gian thư giãn cơ tim ghi nhận tăng thời gian thư giãn T1 và T2 (Hình 1.9 và Hình 1.10). Không ghi nhận tổn thương trên hình LGE (Hình 1.11). Kết quả này phù hợp tiêu chuẩn Lake Louise 2018 trong chẩn đoán viêm cơ tim.
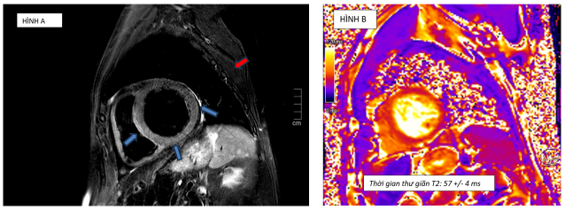
Hình 1.9 A: Hình T2-STIR đánh giá phù cơ tim: vùng cơ tim bị phù (vị trí mũi tên xanh) sáng hơn so với cơ vân lân cận (mũi tên đỏ). B: tăng thời gian thư giãn cơ tim trên chuỗi xung T2-mapping thỏa tiêu chuẩn phù cơ tim
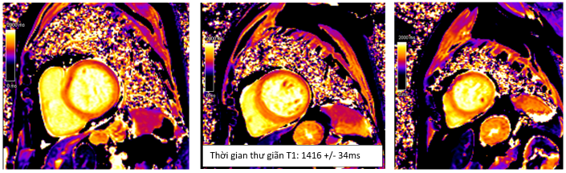
Hình 1.10 Hình T1 mapping ghi nhận tăng thời gian thư giãn cơ tim
Hình 1.11 Không ghi nhận tổn thương bắt thuốc Gadolinium thì muộn trên hình LGE
Điều trị suy tim gồm: Furosemid, Valsartan, Spironolactone, Empaglifozin, Colchicin. Bệnh nhân được điều trị 1 tuần, sinh hiệu ổn định, hồi phục nhịp xoang và rút máy tạo nhịp (Hình 1.12).
Hình 1.12 ECG sau 1 tuần điều trị: Nhịp xoang + Blốc nhánh phải hoàn toàn
1.3. Trường hợp lâm sàng 3:
Bệnh nhân nữ, 41 tuổi, nhập viện vì khó thở. Tiền căn không ghi nhận bệnh lý tim mạch. Bệnh sử cấp tính 3 ngày, bệnh nhân sốt, đau cơ, hồi hộp và khó thở tăng dần. Bệnh nhân đi khám phòng khám tư xét nghiệm men tim tăng cao, và chuyển bệnh viện Tâm Anh điều trị. Tình trạng lúc nhập viện: nhiệt độ 36.8 độ, mạch 120 lần/ phút, huyết áp 96/65 mmHg, BN khó thở nhiều.
Điện tâm đồ lúc nhập viện ghi nhận nhịp nhanh xoang 128 lần/ phút, QS từ V1-V3 và ST chênh lên # 1mm từ V1 – V3 (Hình 1.13).
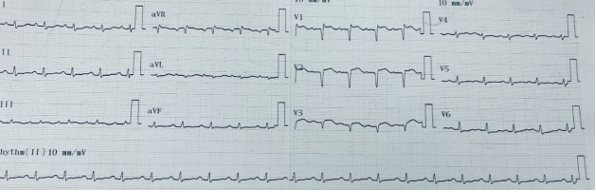
Hình 1.13 Điện tâm đồ lúc nhập viện (trường hợp lâm sàng 3)
XQ ghi nhận: bóng tim to (chỉ số tim- lồng ngưc > 0.5), kèm tổn thương mô kẽ lan lỏa thùy dưới hai phổi và dấu hiệu đường Kerley B (Hình 1.14)
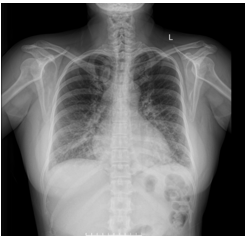
Hình 1.14 XQ ghi nhận tổn thương mô kẽ lan tỏa hai phổi và bóng tim to
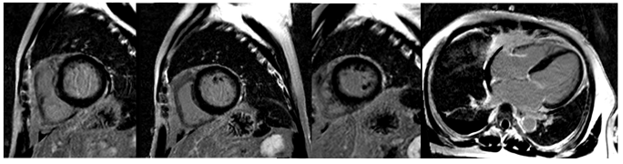
Siêu âm tim thời điểm nhập viện ghi nhận không dày dãn các buồng tim, giảm động các thành thất trái, chức năng tâm thu thất trái giảm LVEF 44%, không ghi nhận tràn dịch màng tim và tổn thương hở van tim có ý nghĩa (Hình 1.15). Bệnh nhân được chụp mạch vành cho kết quả các nhánh mạch vành không hẹp (Hình 1.16).
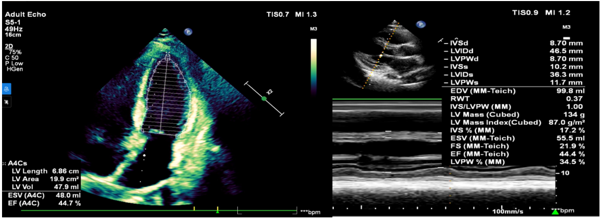
Hình 1.15 Kết quả siêu âm tim lúc nhập viện ghi nhận LVEF giảm 44%
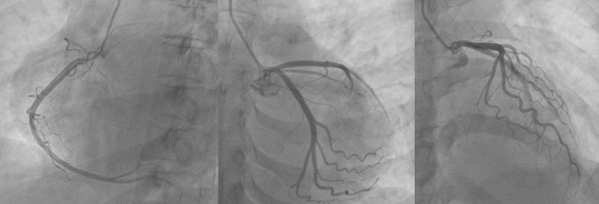
Hình 1.16 Kết quả chụp mạch vành bình thường (trường hợp lâm sàng 3)
Cộng hưởng từ tim thực hiện vào ngày thứ 5 của bệnh, ghi nhận kết quả như sau: thể tích thất trái bình thường với LVEDVi = 83ml/m2, giảm động đồng đều các thành thất trái, chức năng tâm thu thất trái giảm LVEF 29%. Ghi nhận phù cơ tim trên hình T2STIR và T2 mapping (Hình 1.17 và Hình 1.18). Tổn thương cơ tim với tăng thời gian thư giãn cơ tim trên T1 mapping và tăng thể tích ngoại bào (ECV 39%) (Hình 1.19). Thất phải có thể tích bình thường, giảm động vùng giữa – mỏm thành bên thất phải, chức năng tâm thu thất phải giảm với RVEF 35%. Không ghi nhận tổn thương xơ hóa cơ tim trên hình LGE (Hình 1.20). Ngoài ra còn ghi nhận tràn dịch màng ngoài tim lượng ít và tràn dịch màng phổi hai bên. Chúng tôi đánh giá độ biến dạng cơ tim trên cộng hưởng từ cho thấy độ biến dạng cơ tim thất trái giảm (Hình 1.21). Kết quả cộng hưởng từ khẳng định chẩn đoán viêm cơ tim thỏa tiêu chuẩn Lake Loiuse cải tiến 2018.
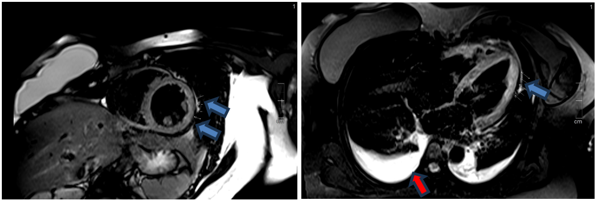
Hình 1.17 T2-STIR: tăng tín hiệu mô cơ tim (mũi tên xanh) so với cơ vân lân cận (chỉ số tín hiệu SI # 211/102 >2) kèm tràn dịch màng phổi hai bên (mũi tên đỏ).
Hình 1.18 Tăng tín hiệu cơ tim trên hình T2 mapping
Hình 1.19 Tăng thời gian thư giãn cơ tim trên T1 mapping
Hình 1.20 Không ghi nhận bất thường cơ tim trên hình LGE, tràn dịch màng tim lượng ít ở thành bên thất trái (mũi tên trắng)

Hình 1.21 Kỹ thuật feature-tracking trong đánh giá độ biến dạng cơ tim: giảm biến dạng toàn bộ cơ tim thất trái: GLS – 7.8%, GCS -6.6%, GRS 10.1%
1.4. Trường hợp lâm sàng 4:
Trường hợp thứ 4 là bệnh nhân nam 37 tuổi, không triệu chứng và không ghi nhận tiền căn bệnh lý tim mạch. Bệnh nhân mắc Covid – 19 mức độ nhẹ một năm trước. Khám sức khỏe định kỳ ECG ghi nhận block nhánh phải hoàn toàn (Hình 1.22). Bệnh nhân tiếp tục được kiểm tra tim mạch chuyên sâu tại bênh viện Đa khoa tâm anh. Siêu âm tim qua thành ngực ghi nhận: các buồng tim không dày dãn, không rối loạn vận động vùng, chức năng tâm thu hai thất tốt nhưng độ biến dạng cơ tim theo trục dọc toàn thể giảm nhẹ: GLS = -17%. Bệnh nhân được làm trắc nghiệm siêu âm gắng sức Dobutamin âm tính. Bệnh nhân tiếp tục được chụp cộng hưởng từ tim để đánh giá thêm. Kết quả cộng hưởng từ tim ghi nhận viêm cơ tim với biểu hiện như sau: phù cơ tim trên hình T2 STIR và T2 mapping (Hình 1.23), tổn thương cơ tim trên hình T1 mapping (Hình 1.24) và tăng tín hiệu muộn lan tỏa dạng dưới thượng mạc (sub-epicardial) ở thành bên, dạng giữa thành (mid-wall) ở thành trước và vách liên thất trên hình LGE
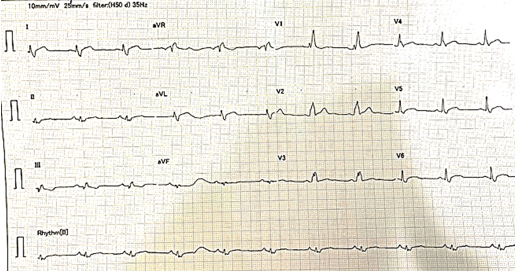
Hình 1.22 ECG ghi nhận blốc nhánh phải hoàn toàn
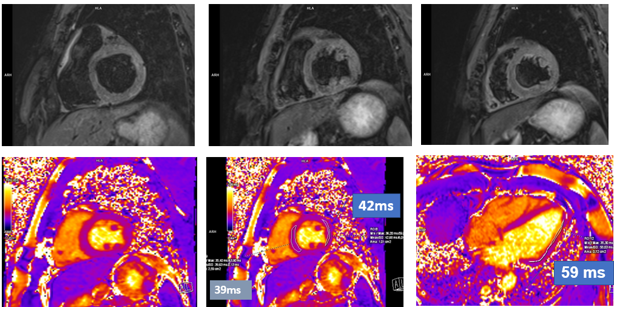
Hình 1.23 Phù cơ tim trên hình T2-STIR và T2 mapping
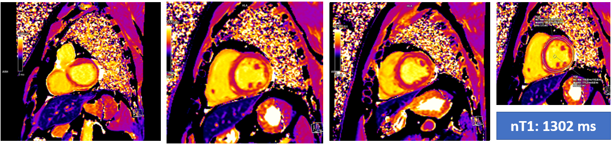
Hình 1.24 Tăng tín hiệu cơ tim trên hình T1 mapping
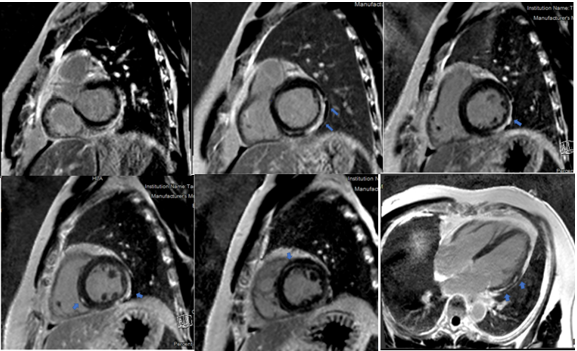
Hình 1.25 Tăng tín hiệu muộn lan tỏa dạng dưới thượng mạc (sub-epicardial) ở thành bên, dạng giữa thành (mid-wall) ở thành trước và vách liên thất (mũi tên xanh) trên hình LGE
2. Tổng quan:
Viêm cơ tim là tình trạng viêm kèm rối loạn chức năng các tế bào cơ tim, và được phân loại là một dạng bệnh cơ tim đặc biệt. Tỉ lệ hiện mắc của viêm cơ tim đến nay vẫn chưa rõ ràng. Theo nghiên cứu về gánh nặng bệnh tật toàn cầu năm 2013 (GBD 2013), tỷ lệ mắc mới hàng năm của viêm cơ tim cấp tính ước tính là 22 /1.000.000 người-năm [1] và năm 2019 ghi nhận tỷ lệ hiện mắc viêm cơ tim trong độ tuổi 35–39 là 6,1/ 100.000 người đối với nam và 4,4/100.000 người đối với nữ, và tăng theo độ tuổi lên đến 63/100.000 ở nam giới từ 80–84 tuổi [2]. Trong những năm gần đây, do tiến bộ kỹ thuật giúp gia tăng chính xác trong chẩn đoán, tỷ lệ mới mắc viêm cơ tim cấp tính đã tăng từ 95 lên 144/1.000.000 người [3] Tại các quốc gia Châu Á và đặc biệt ở Nhật Bản, thống kê các trường hợp khám nghiệm tử thi bệnh lý hàng năm, thấy tần suất viêm cơ tim chiếm khoảng 115/100.000 trường hợp tử thiết [4]. Mặc dù tần suất viêm cơ tim tối cấp ở bệnh nhân trưởng thành bị viêm cơ tim cấp tính vẫn chưa rõ ràng, viêm cơ tim đã được tìm thấy ở 6-10% các trường hợp khám nghiệm tử thi đột tử ở trẻ [5]. Ngoài ra, do sự chồng lắp bệnh cơ tim và viêm cơ tim, nhiều nghiên cứu cho thấy tình trạng viêm cơ tim hoạt động và viêm cơ tim giáp biên (borderline myocarditis) lần lượt ở 14% và 33% ở bệnh nhân mắc bệnh cơ tim giãn [6].
Đặc biệt, từ năm 2019 với đại dịch COVID-19, tình trạng viêm cơ tim liên quan đến virút corona đã trở thành một vấn đề toàn cầu kể. Viêm cơ tim có thể do virút hoặc do vắc-xin COVID-19. Theo TriNetx (mạng lưới nghiên cứu Covid-19), tỷ lệ viêm cơ tim liên quan đến COVID-19 chiếm khoảng 0,01% (256/171.481 người). Trong một phân tích tổng hợp của một số loại vắc-xin COVID-19, bao gồm cả vắc-xin RNA, cho thấy tần suất xuất hiện viêm cơ tim/viêm màng ngoài tim do vắc-xin là 2-3 trường hợp/1.000.000 lần tiêm chủng [7].
Hiện nay chẩn đoán viêm cơ tim vẫn còn là một thách thức với các bác sĩ lâm sàng do biểu hiện rất đa dạng: từ không triệu chứng, triệu chứng nhẹ, đến triệu chứng nguy hiểm như suy tim, rối loạn nhịp, thậm chí tử vong. Sinh thiết mô cơ tim (EMB) vẫn là tiêu chuẩn vàng trong chẩn đoán viêm cơ tim. Tuy nhiên, đây là một kĩ thuật xâm lấn, do đó không thực hiện rộng rãi, chỉ định trong những trường hợp nặng, đe dọa tính mạng như rối loạn nhịp nguy hiểm. Các cận lâm sàng tiêu chuẩn khác như điện tâm đồ hoặc siêu âm tim lại không đặc hiệu trong chẩn đoán.
(Vui long xem tiếp trong kỳ sau)
TÀI LIỆU THAM KHẢO:
- Pesudovs, K., Y.A. Melaku, and G.B.o.D.S.C.J. Lancet, Global, regional, and national incidence, prevalence, and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990–2013 diseases and injuries in 188 countries, 1990-2013: A systematic analysis for the Global Burden of Disease Study 2013. 2015. 386(9995): p. 743-800.
- Roth, G., et al., NHLBI-JACC Global Burden of Cardiovascular Diseases Writing Group. 2020. 1990. 2019: p. 2982-3021.
- Pahuja, M., et al., Trends in the incidence of in-hospital mortality, cardiogenic shock, and utilization of mechanical circulatory support devices in myocarditis (analysis of national inpatient sample data, 2005–2014). 2019. 25(6): p. 457-467.
- OKADA, R., S. KAWAI, and H.J.J.C.J. KASYUYA, Nonspecific Myocarditis: A Statistical and Clinicopathological Study of Autopsy Cases: SYMPOSIUM ON SEVERAL ASPECTS OF MYOCARDITIS. 1989. 53(1): p. 40-48.
- Ammirati, E., et al., Management of acute myocarditis and chronic inflammatory cardiomyopathy: an expert consensus document. 2020. 13(11): p. e007405.
- Tsukada, B., et al., High prevalence of chronic myocarditis in dilated cardiomyopathy referred for left ventriculoplasty: expression of tenascin C as a possible marker for inflammation. 2009. 40(7): p. 1015-1022.
- Cai, C., et al., A comprehensive analysis of the efficacy and safety of COVID-19 vaccines. 2021. 29(9): p. 2794-2805.
- Caforio, A.L.P., et al., Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. European Heart Journal, 2013. 34(33): p. 2636-2648.
- Basso, C., et al., Classification and histological, immunohistochemical, and molecular diagnosis of inflammatory myocardial disease. 2013. 18: p. 673-681.
- Aretz, H.T.J.H.p., Myocarditis: the Dallas criteria. 1987. 18(6): p. 619-624.
- Leone, O., et al., 2011 consensus statement on endomyocardial biopsy from the Association for European Cardiovascular Pathology and the Society for Cardiovascular Pathology. 2012. 21(4): p. 245-274.
- Lampejo, T., et al., Acute myocarditis: aetiology, diagnosis and management. 2021. 21(5): p. e505.
- Nagai, T., et al., JCS 2023 Guideline on the Diagnosis and Treatment of Myocarditis. 2023. 87(5): p. 674-754.
- Journal, J.J.W.G.J.C., Guidelines for Diagnosis and Treatment of Myocarditis (JCS 2009)–Digest Version–. 2011. 75(3): p. 734-743.
- Adeboye, A., et al., A review of the role of imaging modalities in the evaluation of viral myocarditis with a special focus on COVID-19-related myocarditis. 2022. 12(2): p. 549.
- Lasica, R., et al., Update on Myocarditis: From Etiology and Clinical Picture to Modern Diagnostics and Methods of Treatment. 2023. 13(19): p. 3073.
- Meindl, C., et al., Patients with acute myocarditis and preserved systolic left ventricular function: comparison of global and regional longitudinal strain imaging by echocardiography with quantification of late gadolinium enhancement by CMR. 2021. 110(11): p. 1792-1800.
- Tünnemann-Tarr, A., et al., Speckle tracking echocardiography in a patient with viral myocarditis and acute myocardial infarction. 2020. 22(4): p. 184-191.
- Hsiao, J.-F., et al., Speckle tracking echocardiography in acute myocarditis. 2013. 29: p. 275-284.
- Nensa, F., et al., Feasibility of FDG-PET in myocarditis: comparison to CMR using integrated PET/MRI. 2018. 25: p. 785-794.
- Bami, K., et al., Noninvasive imaging in acute myocarditis. 2016. 31(2): p. 217-223.
- McDonagh, T.A., et al., 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. European Heart Journal, 2021. 42(36): p. 3599-3726.
- Tschöpe, C., et al., Management of myocarditis-related cardiomyopathy in adults. 2019. 124(11): p. 1568-1583.
- Friedrich, M.G., et al., Cardiovascular magnetic resonance in myocarditis: a JACC white paper. 2009. 53(17): p. 1475-1487.
- Ferreira, V.M., et al., Cardiovascular magnetic resonance in nonischemic myocardial inflammation: expert recommendations. 2018. 72(24): p. 3158-3176.
- Lagan, J., M. Schmitt, and C.A.J.T.I.J.o.C.I. Miller, Clinical applications of multi-parametric CMR in myocarditis and systemic inflammatory diseases. 2018. 34: p. 35-54.
- Kotanidis, C.P., et al., Diagnostic accuracy of cardiovascular magnetic resonance in acute myocarditis: a systematic review and meta-analysis. 2018. 11(11): p. 1583-1590.
- Polte, C.L., et al., Cardiovascular magnetic resonance in myocarditis. 2022. 12(2): p. 399.
- Rapezzi, C., et al., Diagnostic work-up in cardiomyopathies: bridging the gap between clinical phenotypes and final diagnosis. A position statement from the ESC Working Group on Myocardial and Pericardial Diseases. 2013. 34(19): p. 1448-1458.
- McDonagh, T.A., et al., 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. 2021. 42(36): p. 3599-3726.
- Berg, J., et al., Non-steroidal anti-inflammatory drug use in acute myopericarditis: 12-month clinical follow-up. 2019. 6(1): p. e000990.
- Mirna, M., et al., Treatment with non-steroidal anti-inflammatory drugs (NSAIDs) does not affect outcome in patients with acute myocarditis or myopericarditis. 2022. 9(2): p. 32.
- Maron, B.J., et al., Council on Clinical Cardiology. p. 1807-1816.
- Zeppenfeld, K., et al., 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: Developed by the task force for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death of the European Society of Cardiology (ESC) Endorsed by the Association for European Paediatric and Congenital Cardiology (AEPC). 2022. 43(40): p. 3997-4126.
- Bang, V., et al., Management of patients with giant cell myocarditis: JACC review topic of the week. 2021. 77(8): p. 1122-1134.
- Wang, D., et al., C. Section of Precision Medicine Group of Chinese Society of, C. Editorial Board of Chinese Journal of, M. Working Group of Adult Fulminant Chinese society of cardiology expert consensus statement on the diagnosis and treatment of adult fulminant myocarditis. 2019. 62(2): p. 187-202.
- Maury, P., et al., Complete atrioventricular block persisting after regression of infectious myocarditis. 2008. 41(6): p. 665-667.
- Pelargonio, G., et al., Long-term arrhythmic risk assessment in biopsy-proven myocarditis. 2020. 6(5): p. 574-582.
- Bardy, G.H.J.N.E.J.M., Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT) Investigators. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. 2005. 352: p. 225-237.
- Pelliccia, A., et al., Recommendations for participation in competitive and leisure time sport in athletes with cardiomyopathies, myocarditis, and pericarditis: position statement of the Sport Cardiology Section of the European Association of Preventive Cardiology (EAPC). 2019. 40(1): p. 19-33.
- Grün, S., et al., Long-term follow-up of biopsy-proven viral myocarditis: predictors of mortality and incomplete recovery. 2012. 59(18): p. 1604-1615.
- Schumm, J., et al., Cardiovascular magnetic resonance risk stratification in patients with clinically suspected myocarditis. 2014. 16(1): p. 1-12.
- Georgiopoulos, G., et al., Prognostic impact of late gadolinium enhancement by cardiovascular magnetic resonance in myocarditis: a systematic review and meta-analysis. 2021. 14(1): p. e011492.







