Phòng ngừa các biến cốmạch vành (CAD) là một mụctiêu quan trọng trong điều trị tăng huyết áp.Một loạt các phân tích gộp hiện nayđã cung cấp bằng chứng vềsựkhác biệt rõ rệt trongkhả năngbảo vệtimmạch của hai nhóm thuốc hạ huyết áp được kê đơnrộng rãi nhất:
AR. Ferrari
Trung tâm tim mạch, bệnh viện Đại học Ferrara -Salvatore Maugeri Foundation, Lumezzane, Italy
G.M. Rosano
Khoa y học bằng chứng, San Raffaele Roma, Rome, Italy
Người dịch: BS. Trần Tiến Anh
Bác sĩ Nội trú khoá 39, Viện tim mạch Quốc gia.
Ức chếmen chuyển (ACE inhibitors) và Ức chếthụthểangiotensin II (ARBs). Hai nhóm thuốc này đôi khi được cho là có thểthay thếcho nhau vì ức chếthụthểcũng thường được thửnghiệm ởnhữngbệnh nhân tăng huyết áp trong các nghiên cứucó cùng tiêu chí với Ức chếmen chuyển. Tuy nhiên, các nghiên cứu trên bệnh nhân suy tim không hềchứng minh đượcỨc chếthụ thể tốt hơnso với Ức chếmen chuyển, và hiện nay chỉcó một nghiên cứu kiểm địnhvề lợi điểmgiữa ramipril và telmisartan [1]. Gầnđây hơn, Ức chếthụthểđược thử nghiệm trong các nghiên cứu đối chứng với giả dượcđã cho thấy không có lợi ích trong việc làm giảm các biến cốtim mạchso với giả dượcvà trong một số trường hợpcòn làm giatăng lo ngại về độan toàn khiđiều trị lâu dài với Ức chếthụthể.
Một sốphân tíchgộp đã so sánh hiệu quảcủa các thuốc Ức chếmen chuyển và Ức chếthụthể,gần như tất cảkết luận rằng: các thuốc Ức chếmen chuyểnngăn ngừabiến cốmạch vành từ đógiảm tỷlệmắc bệnh và tỷlệtửvong tim mạch nói chung, còn Ức chếthụthểcó hiệu quảtốt trong việc ngăn ngừa đột quỵ. Trong một phân tích gộpgần 160.000 bệnh nhân tăng huyết áp, điều trị bằng thuốc Ức chếmen chuyển giúp giảm có ý nghĩa 10% tỷlệtửvong do mọi nguyên nhân (tỷsuất chênh [HR] 0.90, 95% khoảng tin cậy [CI] 0.84-0.97, p = 0.004), trong khi Ức chếthụthểkhông làm giảm tỷlệtửvong (HR = 0.99, 95% CI, 0.94-1.04, p = 0.68) [2]. Trong cùng bộdữliệu, có một xu hướng nhất quán rõ ràng đối với việc giảm đáng kể tỷ lệ tử vong tim mạch với các thuốc Ức chếmen chuyển (HR = 0.88, 95% CI, 0.77-1.00, p = 0.051), nhưng không thấy hiệu quả này vớiỨc chếthụthể(CI HR = 0.96, 95%, 0.90-1.01, p = 0.14). Bằng chứng tương tự đã được báo cáo trong một cỡmẫulớn hơn ở nhóm bệnh nhânnguy cơ, tỷlệtửvong chung được giảm đáng kể bằng các thuốcỨc chếmen chuyển, chứkhông phải bằng các thuốc Ức chếthụthể[3].
Bằng chứng trên không chỉgiới hạn với bệnh nhântănghuyết áp, mà còn mởrộng ra toàn bộmảng bệnh lý tim mạch bởi kết quảcác phân tích gộp vềtăng huyết áp, cũng như nhồi máu cơ tim vàsuy tim [2-7]. Điều này gần đây đã được khẳng định bằng cách so sánh trực tiếp các thuốc Ức chếmen chuyển và Ức chếthụthểởbệnh nhân tăng huyết áp cao tuổi[8]. Vì vậy, tuy không còn nghi ngờgì vềtác dụng hạáp của cảhai nhóm thuốc này, nhưng Ức chếmen chuyểnđược coilàtốt hơn so với Ức chếthụthểtrong phòng ngừa bệnh mạch vành và giảm tỷlệtửvong chung. Đây là điều đángquan tâm bởi nếu cộng đồng y tế không thay đổi thói quen này, và tiếp tục bỏqua các bằng chứng và chỉ địnhỨc chếthụthểcho bệnh nhân tăng huyết áp – vớicải thiện tiên lượng ít hơn- thì bệnh nhân sẽkhông có cơ hội hưởng những lợi ích của Ức chếmen chuyển, với các bằng chứng mạnh mẽvềbảo vệtim mạch. Ngoài ra, Ức chếthụthểlại thường được ưu tiên chỉ định ở bệnh nhân đái tháo đường mặc dù các bằng chứng gần đây cho thấy nhóm thuốc nàytăng nguy cơ biến cốtim mạch gây tửvong [9,10]. Điều này thậm chí có thể được xem làmộtvấn đề quan trọng trong an toàn sức khỏe cộng đồng.
Ngoài phép tính và những con sốcủa các thửnghiệm lâm sàng và phân tích gộp, kết luận tương tự có thểthấyđược bằng cách xem xét các cơ chế hoạt động của hai nhóm thuốc này (Hình 1).
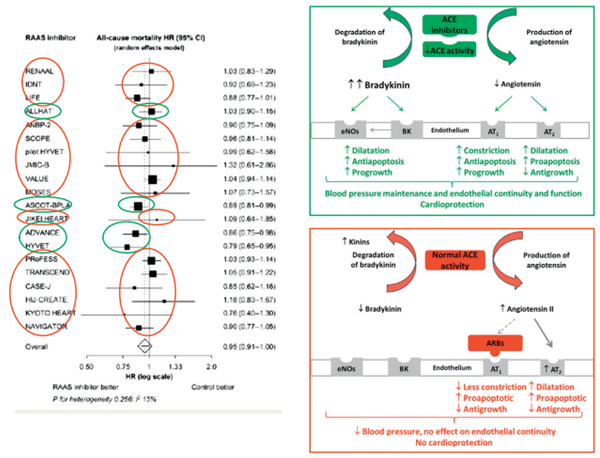
Hình 1.Cơ chế hoạt động của thuốc Ức chếmen chuyển (màu xanh lá) và thuốc ức chếthụ thể (màu đỏ) giải thích kết quả của các phân tích gộp tương ứng được khoanh tròn xanh hoặc đỏ.
Các thuốc Ức chếmen chuyển hoặc Ức chếthụthểkhông ảnh hưởng đến nhịp tim hoặc sựco bópcơ tim và tạo ra tác dụng hạáp có thểso sánh. Tuy nhiên, chỉcó thuốc Ức chếmen chuyển cải thiện kết quảbệnh mạch vành. Thuốc Ức chếmen chuyển, không phải Ức chếthụthể, làm giảm sự tiến triển xơ vữa động mạch và xuất hiện huyết khối động mạch vành. Tác dụng có lợi của thuốc Ức chếmen chuyển không chỉ đơn giản là hiệu quảgiảm huyết áp (Ức chếthụthểcũng có), mà còn là phức hợp hoạt động trên thành động mạch vành vàđáng chú ý nhất là tại các tếbào nội mô. Cảhai thuốc đều làm giảm tác động của angiotensin II trên thành mạch, mặc dù bằng phương thức khác nhau, với một loạt các tác động có lợi liên quan, bao gồm cảphòng chống sựco mạch, giảm mức độkết dính phân tử, các yếu tố tăng trưởng, stress oxy hóa, và làm chậmtế bào chết theo chương trình [11,12]. Thêm vào đó, các thuốc Ức chếmen chuyển ngăn chặn sựphân hủy của bradykinin, làm mấtnhững tác động tiêu cực của angiotensin II và mang lại tác động lợi ích trực tiếp. Bradykinin tăng điều hòa quá trình tổng hợp nitric oxid với sựhình thành chất giãn mạch là nitric oxid (NO) và các yếu tốgiảm stress, như prostaglandin, prostacyclin, và yếu tốsiêu phân cực có nguồn gốc từtếbào nội mô. Bradykinin cũng tạo ra tác động mạnh mẽ trên tế bào nội môchống lại sự chết theo chương trình, góp phần vào việc duy trì tính toàn vẹn và chức năng của lớp nội mô [13,14]. Huyết thanh lấy từbệnh nhân bệnh mạch vànhđượcphòng ngừa thứphát với thuốc chất Ức chếmen chuyển đã làm giảm nồng độyếu tốVon Willebrand, một chỉsố của rối loạn chức năng tế bào nội mô, và tạo ra tác dụng chống quá trìnhchết theo chương trình qua trung gian bradykinin trên các tếbàonội mô của những người bệnh này[13]. Bằng chứng thêm nữa vềsựđóng góp quan trọng của bradykinin trong bảo vệtim mạch tạo ra bởi các thuốc Ức chếmen chuyển đến từdữliệu thực nghiệm cho thấy rằng khi thuốc Ức chếmen chuyển kết hợp với chất đối kháng thụthểbradykinin B2, tất cảcác tác dụng bảo vệtim không còn nữa [15].
Tuy nhiên, tác dụng thực chất trên bradykinin (tăng lên bởi các thuốc Ức chếmen chuyển và không phải bởi Ức chếthụthể) không phải là lý do duy nhất cho sựkhác biệtđượcchứng minh trong các phân tích gộp. Các tác động chọn lọc của Ức chếthụthểtrên các thụthểAT1cho phép các thụthểangiotensin tựdo khác bịangiotensin II gắn vào, quá trình nàykhông bị ảnh hưởng bởi các Ức chếmen chuyển. Điều này dẫnđến một sựthay đổi với giảm AT1và tăng cường hoạt động AT2. Đáng chú ý, các thụthểAT2gây quá trình tiền chết tếbào theo chương trình và tác động chống phát triểntếbào nội mô [16].
Hiệu ứng trên quá trình tếbào nội mô chết theo chương trình – đượcgiảm đi bởi bradykinin và tăng bởi thụthểAT2- dường như là một trong những sựkhác biệt chính giữa các thuốc Ức chếmen chuyển và Ức chếthụthể. Trong bối cảnh này, các nghiên cứu tại phòng thí nghiệm cho thấy rằng các thuốc Ức chếmen chuyểnlàm tăng tốc độhình thành của tếbào nội mô đầu dòng từ tủy xương và giảm tếbào nội mô chết theo chương trình với một tác động tích cực trên cảsựbắt đầu và kết thúc vòng đời của tếbào nội mô. Bởi vậy, thuốc Ức chếmen chuyển duy trì tính liền lạc của tếbào nội mô và làm giảm sựtiến triển xơ vữa động mạch. Các thí nghiệm tương tự với Ức chếthụthểkhông phát hiện ra tác động trên quá trình tếbào nội mô chết theo chương trình hoặc hình thành các tếbào nội mô đầu dòng [17].
Mặc dù rấtkhó khăn để liên kếtgiữa thực nghiệm với dữliệu lâm sàng, mức giảm tỷlệtửvong đáng kểnhất trong các thửnghiệm vềtăng huyết áp đã được quan sát thấy ởnhững nghiên cứu dùng hoạt chất perindopril [2] (Hình. 1). Điều thú vịlà, các nghiên cứu cũng đã chỉrõ hoạt chất perindopril có ái lực mạnh mẽnhất với vịtrí gắn bradykinin dẫn đến giảm mạnh sựphân hủy bradykinin và tếbào nội mô chết theo chương trình [18,19].
Tuy nhiên, có một số nhược điểm cũng nên thừa nhận trong cơ chế hoạt động kép của thuốc Ức chếmen chuyển: angiotensin II không chỉ đượctạo ra duy nhất bởi các enzym ACE, mà còn có thểthoát khỏi tác động của các thuốc Ức chếmen chuyển; nồng độbradykinin tăng là giảthuyết liên quan đến ho. Mặt khác, ho có thểcó vai trò bảo vệkhí quản, phếquản [20]. Ho cải thiện việc nuốt bằng cách tránh tiếp xúc hệhô hấp với dịch tiết từvùng hầu họng [21,22]. Một tổng kết gần đây cho thấy điều trịthuốc Ức chếmen chuyểnliên quan đến sựgiảm đáng kể nguy cơ viêm phổi so với nhómchứng và Ức chếthụthể[23]. Ởnhững bệnh nhân châu Á có một tỷlệbịhocao hơn. Tuy nhiên, tỷ lệ mắc ho dẫn đếnngừng các thuốc Ức chếmen chuyển trong các thửnghiệm lâm sàng ngẫu nhiên khoảng 4đến 5%. Hơn nữa, natri cromoglycate được biết đến có thể giảm ho gây ra bởi thuốc Ức chếmen chuyển đến 60% [24-27]. Do đó, người ta có thểxem xét việc bệnh nhân dùng thuốc Ức chếmen chuyển gây ra hovẫn tốt hơnchuyển sang dùng Ức chếthụthểvới xác suấtgây ho thấp hơn 50% nhưng tác dụng bảo vệ tim mạch chưa được khẳng định, hoặc ưu tiêntiếp tục dùng Ức chếmen chuyển và thêm natri cromoglycate (chi phí ít không đáng kể).
Kết luận, kết quảtừcác phân tích gộp lớn cho thấy vai trò quan trọng của các thuốc Ức chếmen chuyển, chứkhông phải Ức chếthụthể, trong việc làm giảm tỷlệtửvong bệnh tim mạchvà nguy cơ viêm phổi. Dữ liệu từ các nghiên cứu cơ bản cũng dự đoán và ủng hộmột kết luận tương tự. Tính chính xác trên lâm sàng của những phát hiện này là hết sức quan trọng: việc sửdụng rộng rãi Ức chếthụthểđểđiều trịtăng huyết áp đem lại lợi ích vềtiên lượng thấp hơn,việc sửdụng Ức chếmen chuyển với mục đích phòng ngừa ởcác bệnh nhân đó sẽgiảm tỷlệtửvong tim mạch do mọi nguyên nhân, với các bằng chứng phong phú. Những dữliệu này cũng có thểgiúp hạn chếviệc không dùng các thuốc Ức chếmen chuyển ởbệnh nhân có thể chịu được các tác dụng phụcủa thuốc (hay gặpnhư ho)là những người có nguy cơ cao của bệnh mạch vànhvà viêm phổi.
Tài liệu tham khảo:
[1] Yusuf S, Teo KK, Pogue J, et al. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med 2008; 358:1547–59.
[2] Van Vark LC, Bertrand M, Akkerhuis KM, et al. Angiotensin-converting enzyme inhibitors reduce mortality in hypertension — a meta-analysis of randomized clinical trials of renin–angiotensin–aldosterone-system inhibitors involving 158,998 patients. Eur Heart J 2012;33:2088–97.
[3] Savarese G, Costanzo P, Cleland JG, Vasallo E, Rosano G, Perrone-Fliardi P. Effects of angiotensin converting enzyme inhibitors and angiotensin receptor blockers on mortality and cardiovascular events in patients without heart failure. A metaanalysis of randomized clinical trials in 108,233 patients. Abstract 9641. Circulation 2012;126:A9641.
[4] Turnbull F, Neal B, Pfeffer M, et al. Blood pressure-dependent and independent effects of agents that inhibit the renin–angiotensin system. J Hypertens 2007;25: 951–8.
[5] Strauss MH, Hall AS. Angiotensin receptor blockers may increase risk of myocardial infarction: unraveling the ARB-MI paradox. Circulation 2006;114:838–54.
[6] Bangalore S, Kumar S, Wetterslev J, Messerli FH. Angiotensin receptor blockers and risk of myocardial infarction: meta-analyses and trial sequential analyses of 147 020 patients from randomised trials. BMJ 2011;342:d2234.
[7] Ferrari R, Boersma E. The impact of ACE inhibition on all-cause and cardiovascular mortality in contemporary hypertension trials: a review. Expert Rev Cardiovasc. Ther submitted for publication.
[8] Ma C, Cao J, Lu XC, et al. Cardiovascular and cerebrovascular outcomes in elderly hypertensive patients treated with either ARB or ACEI. J Geriatr Cardiol 2012;9: 252–7.
[9] Haller H, Ito S, Izzo Jr JL, et al. Olmesartan for the delay or prevention of microalbuminuria in type 2 diabetes. N Engl J Med 2011;364:907–17.
[10] Imai E, Chan JC, Ito S, et al. Effects of olmesartan on renal and cardiovascular outcomes in type 2 diabetes with overt nephropathy: a multicentre, randomised, placebo-controlled study. Diabetologia 2011;54:2978–86.
[11] Dimmeler S, Rippmann V, Weiland U, Haendeler J, Zeiher AM. Angiotensin II induces apoptosis of human endothelial cells. Protective effect of nitric oxide. Circ Res 1997;81:970–6.
[12] Probstfield JL, O’Brien KD. Progression of cardiovascular damage: the role of renin–angiotensin system blockade. Am J Cardiol 2010;105:10A–20A.
[13] Ceconi C, Fox KM, Remme WJ, et al. ACE inhibition with perindopril and endothelial dysfunction. Results of a substudy of the EUROPA study: PERTINENT. Cardiovasc Res 2007;73:237–46.
[14] Ferrari R, Fox K. Insight into the mode of action of ACE inhibition in coronary artery disease: the ultimate EUROPA story. Drugs 2009;69:265–77.
[15] Cargnoni A, Comini L, Bernocchi P, et al. Role of bradykinin and eNOS in the anti-ischaemic effect of trandolapril. Br J Pharmacol 2001;133:145–53.
[16] Unger T. Pharmacological properties of angiotensin II antagonists: examining all the therapeutic implications. J Renin Angiotensin Aldosterone Syst 2001;2(Suppl. 2): S4–7.
[17] Cangiano E, Cavazza C, Campo G, et al. ACE inhibition modulation of endothelial apoptosis and renewal via endothelial progenitor cells in patients with acute coronary syndromes. Am J Cardiovasc Drugs 2011;11:189–98.
[18] Ceconi C, Francolini G, Olivares A, Comini L, Bachetti T, Ferrari R. Angiotensinconverting enzyme (ACE) inhibitors have different selectivity for bradykinin binding sites of human somatic ACE. Eur J Pharmacol 2007;577:1–6.
[19] Ceconi C, Francolini G, Bastianon D, Gitti GL, Comini L, Ferrari R. Differences in the effect of angiotensin-converting enzyme inhibitors on the rate of endothelial cell apoptosis: in vitro and in vivo studies. Cardiovasc Drugs Ther 2007;21:423–9.
[20] Sekizawa K, Ujiie Y, Itabashi S, Sasaki H, Takishima T. Lack of cough reflex in aspiration pneumonia. Lancet 1990;335:1228–9.
[21] Morice AH, Lowry R, Brown MJ, Higenbottam T. Angiotensin-converting enzyme and the cough reflex. Lancet 1987;2:1116–8.
[22] Nakayama K, Sekizawa K, Sasaki H. ACE inhibitor and swallowing reflex. Chest 1998;113:1425.
[23] Caldeira D, Alarcao J, Vaz-Carneiro A, Costa J. Risk of pneumonia associated with use of angiotensin converting enzyme inhibitors and angiotensin receptor blockers: systematic review and meta-analysis. BMJ 2012;345:e4260.
[24] Hargreaves MR, Benson MK. Inhaled sodium cromoglycate in angiotensin-converting enzyme inhibitor cough. Lancet 1995; 345:13–6.
[25] Hargreaves M. Sodium cromoglycate: a remedy for ACE inhibitor-induced cough. Br J Clin Pract 1993;47:319–20.
[26] Keogh A. Sodium cromoglycate prophylaxis for angiotensin-converting enzyme inhibitor cough. Lancet 1993;341:560.
[27] Allen TL, Gora-Harper ML. Cromolyn sodium for ACE inhibitor-induced cough. Ann Pharmacother 1997;31:773–5.







