Nghiên cứu TRENDY
(Telmisartan versus Ramipril on Renal Endothelium Function in Type 2 Diabetes)
1Khoa thận và THA, ĐH Erlangen-Nurnberg, Đức
2 Khoa Y, ĐH Monpellier, Pháp.
3 Khoa Thận và THA, BV E Herriot, Lyon, Pháp.
4 Đơn vị THA, BV 12 tháng 10, Madrid, Tây Ban Nha.
Diabetes Care In Press, published online March 2, 2007
Biên dịch: ThS.BS. Nguyễn Xuân Tuấn Anh
Khoa Tim Mạch – BV Chợ Rẫy
Bộ môn Nội – Trường ĐHYD, TP.HCM
TÓM LƯỢC
Tổng quan:
Một trong những dấu hiệu sớm nhất về thay đổi tại mạch máu là rối loạn chức năng nội mạc, chính những thay đổi này cũng có thể gây nên albumin niệu và giúp dự đoán tiên lượng bệnh lý tim mạch. Nghiên cứu này nhằm mục đích phân tích tác động của sự ức chế lên hệ renin-angiotensin (RAS) đối với chức năng nội mạc tại thận.
Phương pháp:
Nghiên cứu đa trung tâm, tiền cứu, mù đôi, ngẫu nhiên trên 96 bệnh nhân bị đái tháo đường type 2, tăng huyết áp, có độ lọc vi cầu lớn hơn 80ml/phút, albumin niệu vi thể hoặc bình thường. Các bệnh nhân được điều trị 1 lần/ngày với telmisartan 40/80mg hoặc ramipril 5/10mg trong 9 tuần.
Kết quả:
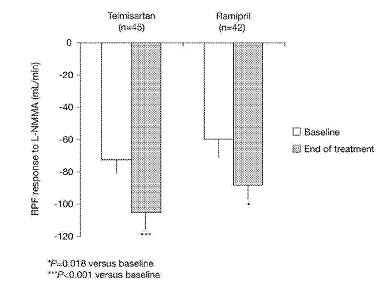
Mức giảm trung bình ± độ lệch chuẩn(SE) đối với lưu lượng máu tưới thận (renal plasma flow – RPF) sau khi truyền tĩnh mạch NG-monomethy-L-arginine(L-NMMA), phản ánh hoạt tính của nitric oxide (NO), gia tăng với telmisartan từ 71.9 ± 9.0 ml/phút trước khi điều trị lên 105.2 ± 9.7 ml/phút và cuối giai đoạn điều trị (p<0.001). Đối với ramipril, đáp ứng của RPF với L-NMMA gia tăng từ 60.1 ± 12.2 ml/phút lên 87.8 ± 9.2 ml/phút (p=0.018). Sự khác biệt về trị số trung bình có hiệu chỉnh giữa hai phương pháp điều trị là -17.1 ± 13.7 ml/phút (p=0.24). Tương tự, telmisartan gia tăng RPF khi nghỉ ngơi (nghĩa là không dùng L-NMMA) từ 652.0 ± 27.0 ml/phút lên 696.1 ±31.0 ml/phút (p=0.047), trong khi đó ramipril không gây thay đổi đáng kể về RPF. Hoạt tính của NO cơ bản càng cải thiện nhiều chừng nào, hiệu quả giãn mạch trên hệ mạch máu thận càng lớn chừng ấy (r=0.47, p<0.001).
Kết luận:
Trên những bệnh nhân đái tháo đường type 2, cả telmisartan và ramipril đều làm tăng hoạt tính NO của tế bào nội mạc thận một cách đáng kể, điều này có thể giúp ích cho việc bảo vệ chức năng tim mạch và thận.
Mối liên hệ chặt chẽ giữa những thay đổi về thận và tim mạch do các yếu tố nguy cơ tim mạch như THA và ĐTĐ gây nên, ngày càng được quan tâm (1-3). Albumin niệu và giảm chức năng thận trước kia được xem là yếu tố tiên lượng diễn tiến của bệnh thận, ngày nay được xem như là những yếu tố tiên lượng rất tốt về tỉ lệ bệnh tật và tỉ lệ tử vong trong tim mạch (2-4). Điều đáng ngạc nhiên nhất năng lực tiên đoán của chúng vượt qua các yếu tố tiên lượng nguy cơ kinh điển về bệnh lý tim mạch và xơ vữa (5). Albumin niệu có liên quan tới áp suất thủy tĩnh bên trong thận, chức năng của các tế bào có chân, sự tích điện và gia tăng tính thấm gây nên rối loạn chức năng nội mạc (6). Các nghiên cứu đã cho thấy giá trị tiên lượng của rối loạn chức năng nội mạc đối với các biến cố gây tử vong do tim mạch khi đánh giá trên hệ tuần hoàn động mạch vành và ngoại biên (7-9) và có nhiều khả năng, mặc dù chưa được chứng minh, ở hệ tuần hoàn thận.
Lớp nội mạc là yếu tố điều hòa chính sự hằng định nội môi tại mạch máu mà tại đó sự toàn vẹn về chức năng là tối cần thiết để duy trì lưu lượng máu và hoạt tính kháng đông (10). Nitric oxide (NO), hình thành từ L-arginine khi có sự hiện diện của NO synthase, được phóng thích bởi các tế bào nội mạc mạch máu và gây nên sự giãn mạch và ức chế sự kết tập tiểu cầu (11). Sự rối loạn chức năng nội mạc xảy ra do hậu quả của rối loạn tổng hợp NO hoặc tăng thoái giáng NO, đã được tìm thấy ở những bệnh nhân bị THA, bệnh lý tắc động mạch ngoại biên và suy thận mãn (12-15). Agiotensin II có vai trò quan trọng trong rối loạn chức năng nội mạc, tăng stress oxy hóa, gây nên kích thích sự phân hủy NO (16). Về lâu dài, rối loạn chức năng nội mạc gây nên xơ vữa đông mạch và tổn thương cơ quan đích, gây nên các bệnh lý tim mạch và bệnh lý thận mãn tính (9). Các nghiên cứu về mạch máu ở cẳng tay trên bệnh nhân THA cho thấy rằng sự gia tăng HA tương quan sự giảm hoạt tính NO và đưa HA về bình thường làm tăng hoạt tính NO (18).
Khi xem xét về mặt sinh lý bệnh của sự mất cân bằng giữa angiotensin II và NO trên tổn thương cơ quan đích, việc tiếp cận tới hệ remin-angiotensin là hợp lý. Các thuốc ức chế men chuyển ngăn chặn sự hình thành angiotensin II từ angiotensin I, trong khi đó các thuốc ức chế thụ thể angiotensin II ngăn chặn sự kết hợp của angiotensin II lên các thụ thể type 1 (15). Mỗi loại thuốc hạ áp sử dụng trong nghiên cứu này đã được chứng tỏ có thể bảo vệ cơ quan đích (16-19), nhưng tính chất dược lý của chúng có khác nhau. Thuốc ức chế men chuyển làm tích tụ bradykinin, giúp cải thiện chức năng nội mạc, trong khi đó, các thuốc ức chế thụ thể angiotensin II kích thích các thụ thể AT2 và điều hòa các thụ thể PPARã. Hiệu quả lâm sàng của những tác động này còn chưa rõ. Từ trước tới giờ hiệu quả của thuốc ức chế men chuyển và thuốc ức chế thụ thể angiotensin II được nghiên cứu chủ yếu ở hệ tuần hoàn ngoại biên. Mặc dù có cỡ mẫu nhỏ, nghiên cứu hiện tại đã cho thấy sự cải thiện về chức năng nội mạc đối với cả hai loại thuốc. Ramipril làm cải thiện đáng kể chức năng nội mạc (20) ở người đái tháo đường type 1 có huyết áp bình thường và albumin niệu bình thường và telmisartan gia tăng chức năng nội mạc ở những bệnh nhân THA chưa điều trị (21).Tuy nhiên, cho đến nay vẫn chưa có nghiên cứu nào so sánh đối đầu nào khảo sát tác động của việc ức chế hệ RA đối với chức năng nội mạc thận ở các bệnh nhân đái tháo đường type 2 và THA, những bệnh nhân có nguy cơ rất cao về bệnh lý tim mạch và bệnh lý thận(22,23)
PHƯƠNG PHÁP
Dân số nghiên cứu
Người lớn, tuổi từ 30 đến 80 bị đái tháo đường không phụ thuộc insulin. Các tiêu chuẩn khác là albumin niệu bình thường hoặc albumin niệu vi thể, độ lọc vi cầu (GFR) >80 ml/phút và THA.
Tiêu chuẩn loại trừ: glycosylated hemoglobin >9%, đang dùng thiazolidinediones và / hoặc statin trong vòng 4 tuần, bệnh võng mạc tăng sinh, bệnh tim mạch có triệu chứng, THA thứ phát, rối loạn chức năng gan, hẹp động mạch thận, rối loạn điện giải, không dung nạp với thuốc ức chế men chuyển hoặc thuốc ức chế thụ thể angiotensin II.
Thiết kế nghiên cứu
Chia ngẫu nhiên và mù đôi các bệnh nhân thành hai nhóm sử dụng telmisartan hoặc ramipril. Sai hai tuần sủ dụng placebo, các bệnh nhân được dùng thuống như sau : trong 3 tuần đầu, sử dụng liều thấp telmisartan 40mg hoặc ramipril 5mg, trong 6 tuần tiếp theo, sử dụng liều telmisartan 80mg hoặc ramipril 10mg. HA mục tiêu <130/80mmHg.
Đánh giá chức năng nội mạc thận
Sự thay đổi của lưu lượng máu tưới thận (renal plasma flow-RPF) đối với NG-monomethy-L-arginine (L-NMMA) giúp đo lường hoạt tính NO cơ bản tại tuần hoàn thận (25,27). Mức độ co mạch do ức chế tổng hợp NO phản ánh hiệu quả giãn mạch do NO tại thời điểm ban đầu ở tế bào nội mạc thận. Do đó, đáp ứng co mạch càng nhiều sau khi dùng L-NMMA chứng tỏ sự ức chế NO càng lớn. Mục tiêu chính của nghiên cứu là: đánh giá sự thay đổi về đáp ứng này vào cuối giai đoạn placebo và cuối 9 tuần điều trị.
Các chỉ số huyết động của thận được đo lường qua độ thanh lọc inulin và p-aminohippurate để đo GFR và RPF (25). Theo dõi HA bằng dao động ký Dinamap.
L-NMMA được tuyền tĩnh mạch với tổng liều là 5 mg/kg (26). Sau đó truyền tiếp L-arginine với liều 100 mg/kg trong 45 phút.
Lấy các mẫu máu theo từng thời điểm để đo nồng độ inulin, p-aminihippurate và angiotensin II.
Thống kê:
Chọn cỡ mẫu N= 50 cho mỗi nhóm, thu thập các biến số, đưa về trung tâm sử lý thống kê. Số liệu trình bày dạng trung bình ± SE.
KẾT QUẢ
Đặc điểm cơ bản:
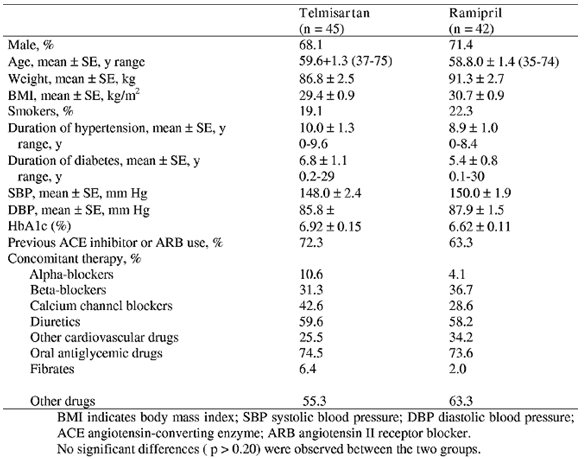
Có 96 bệnh nhân tham gia nghiên cứu. Các đặc điểm được trình bày trong bảng 1. Kết thúc nghiên cứu có 45 bệnh nhân được điều trị với telmisartan và 42 bệnh nhân với ramipril.
Kết quả tiêu chí chính:
Ở cuối giai đoạn placebo, RPF giảm khi truyền L-NMMA là 71.9 ± 9.0 ml/phút ở nhóm telmisartan và 60.1 ± 12.2 ml/phút ở nhóm ramipril. Sau 9 tuần điều trị, RPF giảm khi truyền L-NMMA là 105.2 ± 9.7 ml/phút ở nhóm telmisartan và 87.8 ± 9.2 ml/phút ở nhóm ramipril, không có sự khác biệt quan trọng giữa hai nhóm. Trong nhóm telmisartan, mức thay đổi trung bình giữa giai đoạn placebo và giai đoạn điều trị khi truyền L-NMMA là -43.2 ± 10.7 ml/phút là có ý nghĩa (p<0.001; hình 1). Tương tự nhóm ramipril có mức thay đổi là -26.1 ± 10.8 ml/phút (p=0.018). Sự khác biệt giữa hai nhóm là -17.1 ± 13.7 ml/phút. Sự khác biệt giữa hai nhóm là không đáng kể. Không có mối liên hệ rõ ràng giữa mức độ hạ áp hoặc đường huyết (HbA1c) và hiệu quả điều trị đối với hoạt tính của NO.
Kết quả về tiêu chí thứ phát:
Trước khi điều trị, RPF ở cả hai nhóm là tương đương nhau (bảng 2). Sau 9 tuần điều trị RPF trước khi truyền L-NMMA gia tăng đáng kể (52.1 ± 25.8 ml/phút) ở nhóm telmisartan (p=0.047). Trong khi đó, ở nhóm ramipril, sự gia tăng này là không đáng kể (31.0 ± 25.1 ml/phút, p=0.221). HA trung bình giảm đáng kể ở cả hai nhóm telmisartan và ramipril (telmisartan:-6.02 ± 9.3 mmHg và ramipril:-4.75 ± 8.2 mmHg, p<0.001) so với trước khi điều trị). Không có tương quan về mức độ thay đổi HA với đáp ứng với L-NMMA.
Độ lọc vi cầu không thay đổi đáng kể sau 9 tuần điều trị và các số liệu tương đương giữa hai nhóm (bảng 2). Do sự gia tăng RPF, kháng lực mạch máu thận giảm ở nhóm telmisartan (bảng 2). Phân suất lọc (Filtration Fraction) cũng giảm đáng kể ở nhóm telmisartan nhưng không thay đổi ở nhóm ramipril.
Sự gia tăng RPF lúc nghỉ sau 9 tuần điều trị với telmisartan có tương quan với hoạt tính NO được cải thiện (r=0.47, p<0.001). Mối tương quan dương giữa thay đổi PRF và hoạt tính NO được thấy trong suốt tiến trình nghiên cứu ở cả hai nhóm bệnh nhân cho thấy sự cải thiện về NO kéo theo các thay đổi về chức năng.
Sau 9 tuần điều trị, RPF gia tăng đáng kể khi truyền L-arginine ở nhóm telmisartan 22.0 ± 22.8 ml/phút (p=0.024). Trong khi nhóm ramipril tăng không đáng kể (12.3 ± 23.8 ml/phút, p=0.075).
Mức độ thải albumin giảm từ 9.0 còn 7.2 mg/24h vào tuần lễ thứ 9 ở nhóm telmisartan (p=0.022) và thay đổi từ 11.7 còn 10.7 mg/24h ở nhóm ramipril (p=0.961), không có sự khác biệt rõ ràng giữa hai nhóm (p=0.074).
Nồng độ angiotensin II trong huyết thanh tương tự nhau ở cả hai nhóm sau giai đoạn placebo. Sau khi điều trị, nhóm telmisartan có nồng độ angiotensin II gia tăng đáng kể lên 7.0pg/ml (p<0.001), trong khi đó nhóm ramipril có nồng độ angiotensin II giảm phân nửa so với trị số ban đầu 1.6pg/ml (p<0.001). Các kết quả này xác nhận cơ chế tác động của hai nhóm thuốc.
Tác dụng phụ không mong muốn được báo cáo ở 12 bệnh nhân (25.5%) ở nhóm telmisartan và 12 bệnh nhân (24,5% ) ở nhóm ramipril. Đa số các biến cố có mức độ nhẹ (9 b/n ở nhóm telmisartan và 7 ở nhóm ramipril). Các tác dụng phụ liên quan tới thuốc là : nhức đầu, ho và chóng mặt được ghi nhận ở 4 bệnh nhân điều trị với ramipril. Không có tác dụng phụ liên quan tới thuốc ở nhóm dùng telmisartan.
BÀN LUẬN
Tác động của việc ức chế hệ ramipril đối với chức năng nội mạc đã được nghiên cứu trên những bệnh nhân tăng HA. Thuốc ức chế men chuyển và thuốc ức chế thụ thể angiotensin II làm cải thiện chức năng nội mạc qua cơ chế giãn mạch (33,34). Sự cải thiện chức năng nội mạc làm cải thiện tiên lượng bệnh lý tim mạch (35,36). Tương tự, sự giảm albumin niệu liên quan tới sự toàn vẹn của lớp nội mạc cũng giúp cải thiện tiên lượng về thận và tim mạch (37,38). Tuy nhiên, các nghiên cứu chủ yếu là trên hệ tuần hoàn ngoại biên (7,13,17,39) và không có nghiên cứu đối đầu giữa hai nhóm thuốc ức chế men chuyển và thuốc ức chế thụ thể angiotensin II đối với chức năng nội mạc. Đây là nghiên cứu đầu tiên phân tích hoạt tính của NO trên hệ tuần hoàn thận ở các bênh nhân đái tháo đường type 2 và so sánh trực tiếp tác động của hai nhóm thuốc ức chế hệ RA. Chức năng nội mạc được khảo sát thông qua tác động của NO lên sự tưới máu thận ở các b/n đái tháo đường type 2 có THA.
Khi nghỉ ngơi, RPF gia tăng đáng kể ở nhóm telmisartan nhưng không tăng ở nhóm ramipril cho thấy sự cải thiện đáng kể của hoạt tính NO trong việc làm tăng tưới máu thận.Vì tác động của L-NMMA lên HA trung bình không thay đổi đáng kể ở cả hai nhóm thuốc và vì sự giảm HA sau khi điều trị không liên quan tới đáp ứng của RPF với L-NMMA, sự thay đổi về áp lực tưới máu thận không giải thích được kết quả trên.
Kết quả của chúng tôi trên những bệnh nhân đái tháo đường type 2 và THA phù hợp với các nghiên cứu trước đó về hiệu quả của enalaprill, eprosartan và valsartan trên bệnh nhân tăng huyết áp (31-40). Trái lại, amlodipine có tác động ngược lại trên người, liên quan tới giảm hoạt tính NO tại các mạch máu thận (27). Ức chế NO tại thận làm tăng sự xơ hóa vi cầu, xơ hóa mô kẽ ông thận, thâm nhiễm đại thực bào, và tiểu đạm (41,42). NO được xem như một chất chống xơ vữa lý tưởng và sự gia tăng hoạt tính NO có tác dụng chống lại xơ hóa, viêm và tăng sinh trong toàn bộ hệ thống mach máu. Do đó, sự gia tăng hoạt tính NO ở lớp nội mạc hiện đã được ghi nhận trên bênh nhân đái tháo đường type 2 có thể làm giảm sự phát triển các biến chứng tim mạch.
Truyền L-arginine sau khi ức chế NO synthase bằng L- NMMA làm đảo ngược tác động của L-NMMA trên RPF. Mối liên hệ giữa L-arginine và sự phóng thích NO đã được chứng minh bởi Schlaich và cs (43). Phân tích đáp ứng với L-arginine cho thấy vào cuối đợt điều trị, hiệu quả giãn mạch vượt quá tác động co mạch của L-NMMA. Điều này chứng tỏ khả năng sản xuất NO của hệ mạch máu thận đối với các kích thích được cải thiện khi tác động lên hệ RA. Telmisartan cải thiên đáp ứng của thận khi truyền L-arginine (tăng RPF) trong khi ramipril thì không.
Tiểu albumin vi thể, một dấu hiệu của rối loạn chức năng nội mạc thường gặp ở các bênh nhân đái tháo đường type 2 (15,18,45). Cả hai thuốc sử dụng trong nghiên cứu này đều hiệu quả trong việc làm giảm đào thải albumin trên những bệnh nhân có albumin niệu mức độ thấp vốn là yếu tố tiên lượng các biến cố tim mạch trong Framingham Heart Study (4). Những nghiên cứu trước đó cho thấy thuốc ức chế men chuyển và thuốc ức chế thụ thể angiotensin II làm giảm sự đào thải albumin ở nhưng bệnh nhân có albumin niệu vi thể (36,38). Những nghiên cứu này cũng cho thấy sự giảm albumin niệu có liên quan với sự giảm nguy cơ tim mạch (37,46).
KẾT LUẬN:
Tác động lên hệ renin-angiotensin ở những bệnh nhân đái tháo đường type 2 và THA với thuốc ức chế men chuyển và thuốc ức chế thụ thể angiotensin II cho thấy hiệu quả tương đương đối với chức năng nội mạc của thận, điều này thể hiện qua sự gia tăng hoạt tính của NO.
Bảng 1: Các đặc điểm cơ bản
Bảng 2: Tác động của telmisartan 80 mg và ramipril 10 mg trên các tiêu chí thứ phát và HA trung bình (giá trị trung bình ±SE)
|
Thông số* |
Telmisartan Trước điều trị |
Sau điều trị |
Giá trị p |
Ramipril Trước điều trị |
Sau điều trị |
Giá trị p |
|
Lưu lượng tưới máu thận (ml/p) |
652 ± 27.0 |
696 ± 3.1 |
0.047 |
631 ± 27.3 |
658 ± 28.2 |
0.221 |
|
Tốc độ lọc cầu thận (ml/p) |
136.3 ± 3.1 |
136.4 ± 3.4 |
0.212 |
134.3 ± 3.7 |
133.7 ± 3.8 |
0.558 |
|
Phân suất lọc (%) |
22.0 ± 0.8 |
20.6 ± 0.7 |
0.020 |
22.2 ± 0.7 |
21.4 ± 0.7 |
0.154 |
|
HA động mạch trung bình (mmHg) |
100 ± 10.4 |
93.3 ± 10.8 |
<0.001 |
100.1 ± 9.2 |
95.4 ± 11.0 |
0.009 |
|
Kháng lực mạch máu thận (RU) |
96.2 ± 4.2 |
87.1 ± 4.2 |
0.010 |
99.3 ± 4.7 |
93.7 ± 5.1 |
0.119 |
*Không có sự khác nhau đáng kể giữa điều trị bằng ramipril và telmisartan
Hình 1 : Hiệu quả của telmisartan 40/80 mg và ramipril 5/10 mg lên lưu lượng máu tưới thận (RPF) (mean ±SE) sau khi truyền NG– monomethyl- L- arginine (L-NMMA) 5 mg/kg so với trước khi truyền