ThS. BS. LÊ THỊ LAN HƯƠNG
PGS.TS.BS. PHẠM NGUYỄN VINH
Bệnh viện đa khoa Tâm Anh TP. Hồ Chí Minh
(…)
PHẨN 2: TỔNG QUAN Y VĂN
2.1 Định nghĩa và tổng quan
Viêm động mạch chủ (Aortitis) là thuật ngữ chỉ tình trạng viêm thành động mạch chủ1. Về mặt lâm sàng, viêm động mạch chủ có thể được phân thành hai nhóm chính: viêm động mạch chủ do nhiễm trùng và viêm động mạch chủ không do nhiễm trùng (Bảng 2.1)1,2. Viêm động mạch chủ do vi khuẩn Salmonella và Staphylococcus aureus là dạng viêm động mạch chủ do nhiễm trùng phổ biến nhất. Trong khi đó, viêm mạch máu lớn, chẳng hạn như viêm động mạch Takayasu (TA) và viêm động mạch tế bào khổng lồ (GCA), là những dạng viêm động mạch chủ không do nhiễm trùng phổ biến.
Bảng 2.1: Các nguyên nhân gây viêm động mạch chủ
| Tác nhân nhiễm trùng | Tác nhân không do nhiễm trùng |
| Vi khuẩn (Salmonella hoặc Staphylococus)
Lao Giang mai Nhóm vi khuẩn không điển hình Virút (thường gặp là HIV) Mycotic aneurysm Nhiễm trùng stent graft |
§ Bệnh lý do thấp (Rheumatic diseases)
Viêm động mạch Takayasu Viêm động mạch tế bào khổng lồ Viêm cột sống dính khớp Hội chứng Cogan Viêm sụn tái phát Viêm khớp dạng thấp Bệnh Behcet Lupus ban đỏ hệ thống § Các tình trạng vô căn Viêm động mạch chủ vô căn Phình động mạch chủ do viêm Xơ hóa sau phúc mạc và viêm xơ trung thất Viêm động mạch chủ do tia xạ |
Các loại viêm động mạch chủ đều có cơ chế bệnh sinh, đặc điểm hình ảnh, diễn tiến lâm sàng và tiên lượng khác nhau. Tuy nhiên, viêm động mạch chủ do nhiễm trùng thường có diễn tiến nhanh chóng, nguy cơ tử vong và biến chứng cao nếu không được điều trị kịp thời. Ngược lại, nhóm viêm động mạch chủ không do nhiễm trùng thường có quá trình tiến triển kéo dài, dẫn đến hẹp động mạch chủ hoặc phình động mạch chủ.
Các đặc điểm lâm sàng của viêm động mạch chủ rất đa dạng, và chẩn đoán chủ yếu dựa vào hình ảnh y học. Các phương pháp chẩn đoán hình ảnh cắt lớp ngang như chụp cắt lớp vi tính mạch máu (CTA), chụp cộng hưởng từ (MRI) và chụp mạch cộng hưởng từ (MRA) đóng vai trò quan trọng trong chẩn đoán ban đầu, đánh giá mức độ hoạt động của bệnh và theo dõi sau điều trị.
Các phương pháp chẩn đoán y học hạt nhân như chụp cắt lớp phát xạ positron (PET) sử dụng 18-fluorine fluorodeoxyglucose (FDG) và chụp gallium-67 (67Ga) cũng có ích trong việc đánh giá hoạt động của viêm động mạch chủ.
2.2 Vai trò của phương thức hình ảnh trong chẩn đoán viêm động mạch chủ3
Lâm sàng nghi ngờ viêm động mạch chủ, đánh giá toàn bộ động mạch chủ bằng các phương thức hình ảnh rất quan trọng cho chẩn đoán và quản lý bệnh. Mục tiêu của các phương thức hình ảnh bao gồm: đánh giá sự thay đổi thành động mạch chủ, thay đổi lòng mạch và mức độ lan rộng cũng như tiến triển của bệnh. Ngoài ra, hình ảnh cũng hữu ích trong việc theo dõi hoạt động bệnh và hướng dẫn sinh thiết qua da ở một số trường hợp
Hiện nay, các phương thức hình ảnh trong chẩn đoán viêm động mạch chủ bao gồm: chụp cắt lớp vi tính mạch máu (CTA), cộng hưởng từ (MRI) và chụp mạch cộng hưởng từ (MRA). Siêu âm (US) cũng có ích trong việc đánh giá thành động mạch chủ và các động mạch lớn khác4. Siêu âm được sử dụng để chẩn đoán và theo dõi bệnh nhân viêm động mạch Takayasu (TA) và viêm động mạch tế bào khổng lồ (GCA)4.
CTA là phương pháp thường được lựa chọn để đánh giá bệnh lý động mạch chủ. Các ưu điểm chính của CTA bao gồm khả năng tái tạo đa mặt phẳng, dựng hình ba chiều và độ phân giải không gian ưu việt. CTA gần như đã thay thế chụp mạch máu xóa nền qua da (digital subtraction angiography) trong chẩn đoán viêm mạch máu lớn. Dấu hiệu phổ biến trên CT của viêm động mạch chủ bao gồm: dày không đều thành động mạch chủ và thâm nhiễm mỡ quanh động mạch chủ Nhược điểm chính của CT bao gồm: phơi nhiễm bức xạ và cần sử dụng thuốc cản quang chứa iod. Mặc dù vậy, CT rất hữu ích trong việc loại trừ nhanh chóng các bệnh lý động mạch chủ khác có thể nhầm với viêm động mạch chủ như: bóc tách động mạch chủ, tụ máu thành động mạch (IMH) và loét xuyên thành động mạch chủ (PAU). Ngoài ra, CT đóng vai trò quan trọng trong theo dõi dài hạn bệnh nhân sau điều trị, đánh giá sự phát triển của phình động mạch và vôi hóa thành động mạch chủ. Tuy nhiên, CT ít nhạy hơn trong đánh giá tình trạng viêm quanh động mạch cũng như tiến triển hoạt động của bệnh1.
Chụp mạch cộng hưởng từ có tiêm gadolinium (MRA) cũng là một phương pháp chẩn đoán không xâm lấn ưu tiên trong đánh giá viêm động mạch chủ, đặc biệt là các dạng liên quan đến viêm mạch máu lớn như bệnh Takayasu và GCA5. Những ưu điểm chính của MRA bao gồm không phơi nhiễm bức xạ ion hóa và không cần dùng thuốc cản quang chứa iod. MRA có thể đánh giá cả thành động mạch lẫn lòng mạch, đồng thời cung cấp hình ảnh chính xác về thành mạch với các chuỗi xung MRI chuyên biệt như: chuỗi xung đánh giá phù (edema-weighted sequences)6. Ngoài ra, MRA cũng có thể đánh giá hoạt động của bệnh, mức độ phình động mạch và mức độ hẹp động mạch
2.3 Viêm động mạch chủ do nhiễm trùng
Viêm động mạch chủ do nhiễm trùng là một quá trình nhiễm trùng và viêm liên quan đến thành động mạch chủ do sự xâm nhập của các vi sinh vật3. Bình thường lớp nội mạc động mạch chủ có khả năng chống nhiễm trùng cao. Tuy nhiên, một số bệnh nhân có các tình trạng như: xơ vữa động mạch, phình động mạch chủ, ống ghép động mạch chủ (graft), tiền sử phẫu thuật động mạch chủ, tiền sử chấn thương và suy giảm miễn dịch (đái tháo đường, dùng thuốc ức chế miễn dịch, ung thư) có thể gây suy yếu cấu trúc thành động mạch chủ và làm tăng nguy cơ viêm động mạch chủ. Đa phần bệnh thường gặp ở nam, lớn tuổi. Ngoài ra, những bệnh nhân mắc viêm nội tâm mạc nhiễm trùng cũng có nguy cơ cao bị viêm động mạch chủ7.
Các vi sinh vật có thể xâm nhập vào động mạch chủ qua bốn cơ chế chính2,7: (1) qua đường máu: đây là con đường phổi biến nhất, các vi khuẩn trong máu có thể bám vào vết tổn thương nội mạc hoặc mảng xơ vữa động mạch có sẵn, (2) do thuyên tắc nhiễm trùng (sepsis emboli) vào mạch máu vasa vasorum của động mạch chủ, thường gặp ở bệnh nhân bị viêm nội tâm mạc nhiễm trùng, (3) lan trực tiếp từ một ổ nhiễm trùng lân cận sang thành động mạch chủ, (4) xâm nhập trực tiếp trong quá trình phẫu thuật hoặc chấn thương xuyên thấu.
Hai tác nhân vi khuẩn gây bệnh phổ biến nhất là Staphylococcus aureus và Salmonella chiếm đến 40% các trường hợp bệnh. Ngoài ra, các vi sinh vật khác như Streptococcus pneumoniae, Enterococcus, Listeria, Bacteroides fragilis, Clostridium septicum, HIV, Mycobacterium tuberculosis và Treponema pallidum cũng có thể gây viêm động mạch chủ. Trong đó, Streptococcus pneumoniae và Enterococcus thường liên quan đến viêm động mạch chủ ngực, còn Salmonella thường gây viêm động mạch chủ bụng.
2.4 Triệu chứng lâm sàng, chẩn đoán và điều trị
- Triệu chứng lâm sàng
Biểu hiện lâm sàng của viêm động mạch chủ không đặc hiệu, phụ thuộc vào vị trí nhiễm trùng và sự hiện diện của phình động mạch. Các triệu chứng thường gặp bao gồm: đau bụng, đau ngực, đau lưng, sốt và ớn lạnh. Bệnh nhân viêm động mạch chủ kèm phình động mạch thường có triệu chứng rõ ràng hơn so với bệnh nhân không có phình động mạch. Do triệu chứng không đặc hiệu, chẩn đoán hình ảnh đóng vai trò quan trọng trong việc phát hiện sớm viêm động mạch chủ do nhiễm trùng.
Các yếu tố tiên lượng xấu bao gồm: lớn tuổi, chẩn đoán trễ, tổn thương ở động mạch chủ ngực, cơ địa suy giảm miễn dịch, nhiễm vi khuẩn gram âm, các trường hợp phức tạp/ biến chứng như vỡ động mạch chủ, hoặc nhiễm trùng lan rộng.
- Phương pháp chẩn đoán hình ảnh
Chụp CT mạch máu có thuốc tương phản (CTA) là phương pháp được lựa chọn hàng đầu đối với do tính phổ biến và khả năng dựng hình đa mặt phẳng. Các dấu hiệu hình ảnh của viêm động mạch chủ do nhiễm trùng bao gồm: dày thành động mạch chủ, có thể có hoặc tăng bắt thuốc tương phản khối mô mềm quanh động mạch chủ, tích tụ dịch quanh động mạch chủ, thâm nhiễm mỡ quanh động mạch chủ, phình động mạch chủ tiến triển nhanh, hình ảnh khí trong thành động mạch chủ2,8 (Hình 2.1).
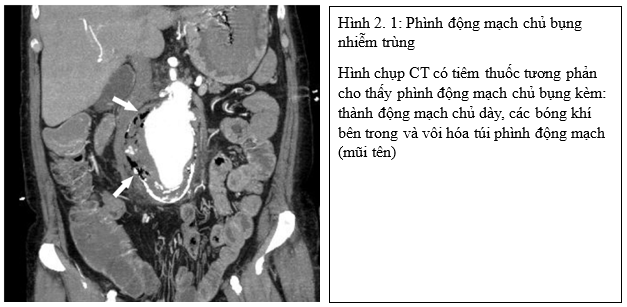
- Tiên lượng và điều trị
Nếu không được điều trị thích hợp, viêm động mạch chủ do nhiễm trùng tiến triển nhanh chóng, dẫn đến phình động mạch nhiễm trùng (mycotic aneurysm) và vỡ động mạch chủ. Một số trường hợp có thể vỡ động mạch chủ ngay cả khi chưa hình thành phình mạch.
Viêm động mạch chủ do nhiễm trùng gần như luôn gây tử vong nếu không được điều trị. Tuy nhiên, việc kết hợp điều trị nội khoa và phẫu thuật có thể giúp cải thiện tỷ lệ sống lên đến 75%-100% trước khi phình động mạch hình thành.
- Viêm động mạch chủ do Salmonella
Các tác nhân vi khuẩn phổ biến liên quan đến viêm động mạch chủ nhiễm trùng bao gồm: Salmonella spp, Clostridium, Streptococcus pneumoniae và Staphylococcus. Trong đó, Salmonella là tac nhân phổ biến nhất, thường gây viêm động mạch chủ nguyên phát9.
Ở những bệnh nhân lớn tuổi, khởi phát triệu chứng sốt đột ngột kèm đau bụng/ngực, kết hợp với cấy máu dương tính với Salmonella, cần nghi ngờ viêm động mạch chủ do nhiễm trùng, và đánh giá kịp thời. Một số nghiên cứu đã ghi nhận mối liên quan giữa viêm đốt sống – đĩa đệm do Salmonella (Salmonella spondylodiscitis) với phình động mạch nhiễm trùng (mycotic aneurysm) và áp xe cạnh cột sống ( Hình 2.2).
Con đường lây lan phổ biến nhất của Salmonella là qua đường máu vào lớp nội mạc bị tổn thương do xơ vữa động mạch hoặc vào huyết khối bám trong túi phình động mạch, con đường lây truyền trực tiếp từ một ổ nhiễm trùng lân cận thường ít gặp hơn. Mặc dù hiếm gặp (<1% các trường hợp), viêm động mạch chủ do Salmonella có thể dẫn đến các biến chứng nghiêm trọng như: áp xe nội tâm mạc, phình động mạch nhiễm trùng (mycotic aneurysm) , vỡ động mạch chủ, rò động mạch chủ – ruột (aortoenteric fistula). Chẩn đoán sớm bằng các phương tiện chẩn đoán hình ảnh, cấy máu, kết hợp điều trị kháng sinh và can thiệp phẫu thuật kịp thời, đóng vai trò quan trọng trong việc điều trị những bệnh nhân viêm động mạch chủ nhiễm trùng.
- Viêm động mạch chủ do phế cầu (Pneumococcal Aortitis)
Viêm động mạch chủ do Streptococcus pneumoniae cực kỳ hiếm, với khoảng 50 trường hợp được ghi nhận trong y văn. Động mạch chủ bụng là vị trí phổ biến nhất, tiếp theo là động mạch chủ ngực đoạn xuống. Con đường lây nhiễm chính là qua đường máu, vi khuẩn xâm nhập vào lớp nội mạc bị tổn thương do mảng xơ vữa, chiếm 60% số ca bệnh. Các ổ nhiễm trùng nguyên phát có thể xuất phát từ: nội tâm mạc, viêm phổi, viêm tủy xương, viêm mô tế bào, nhiễm trùng đường tiết niệu. Do hình ảnh chẩn đoán không đặc hiệu, viêm động mạch chủ do phế cầu khó phân biệt với các dạng viêm động mạch chủ do nhiễm trùng khác. Điều trị chủ yếu dựa vào phẫu thuật loại bỏ mô nhiễm trùng, kết hợp với kháng sinh liều cao. Can thiệp phẫu thuật sớm là yếu tố quan trọng giúp cải thiện tiên lượng bệnh nhân.
- Viêm động mạch chủ do Clostridium septicum
Nhiễm trùng động mạch chủ do Clostridium septicum rất hiếm gặp, với chỉ khoảng 25 trường hợp được báo cáo trong y văn. Động mạch chủ bụng là vị trí nhiễm trùng phổ biến nhất. Theo y văn, nhiễm trùng C. septicum có mối liên hệ chặt chẽ với ung thư đại tràng.Viêm động mạch chủ do C. septicum có xu hướng nhanh chóng tiến triển thành phình động mạch và vỡ động mạch chủ, đòi hỏi điều trị kháng sinh ngay lập tức và can thiệp phẫu thuật khẩn cấp.
- Viêm động mạch chủ do lao
Viêm động mạch chủ do lao (Mycobacterium tuberculosis) là một bệnh hiếm gặp, với khoảng 100 trường hợp phình động mạch do lao đã được báo cáo.Vi khuẩn lao thường xâm nhập vào thành động mạch chủ chủ yếu là lan trực tiếp từ hạch bạch huyết lân cận, tổn thương xương hoặc áp xe cạnh cột sống (chiếm 75% số ca)10. Vi khuẩn lao gây hoại tử bã đậu, dẫn đến tổn thương dai dẳng và suy yếu thành động mạch chủ gây phình. Viêm động mạch chủ do lao thường ảnh hưởng đến đoạn xa của quai động mạch chủ và động mạch chủ ngực xuống, biểu hiện bằng một túi phình giả do hoại tử bã đậu của thành động mạch11. Trên hình ảnh cắt lớp vi tính (CT), viêm động mạch chủ do lao thường xuất hiện dưới dạng túi phình hoặc giả phình dạng túi khu trú, với nhiều túi phình nhỏ, đa cung và dày thành động mạch chủ không đều12 (Hình 2.3). Đôi khi, có thể kèm theo bóc tách động mạch chủ hoặc khối mô quanh động mạch chủ mà không có giãn phình. Nếu có tình trạng áp-xe lạnh (cold abscess) tiếp giáp với tui giả phình sẽ làm tăng nguy cơ vỡ động mạch chủ. Các biến chứng của lao động mạch chủ bao gồm: thủng động mạch chủ vào các cấu trúc lân cận như thực quản, cây phế quản, khoang phúc mạc và ruột non13. Tiên lượng chung của viêm động mạch chủ do lao rất xấu, với tỷ lệ tử vong lên đến 60%, mặc dù đã được điều trị kháng lao và phẫu thuật phù hợp13.
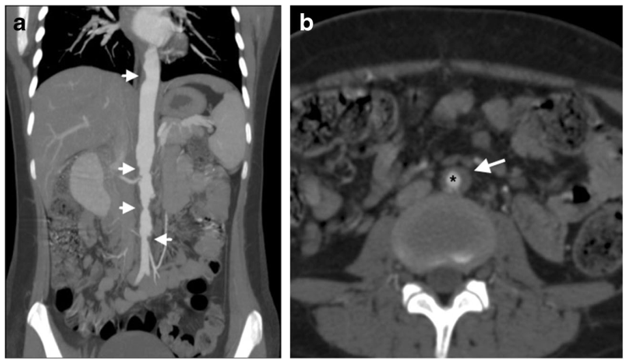
Hình 2.3: Lao động mạch chủ (Mycobacterium tuberculosis)14
Bệnh nhân nữ – 15 tuổi, triệu chứng đổ mồ hôi ban đêm và đau lưng. (a) Hình chụp CT mạch máu bụng có thuốc tương phản, tái tạo theo mặt phẳng vành (coronal) cho thấy hẹp nhiều vị trí đoạn động mạch chủ bụng trên và dưới thận (đầu mũi tên). (b) Hình chụp CT lát cắt ngang động mạch chủ bụng ( axial) cho thấy hẹp nặng lòng mạch (*) của động mạch chủ bụng dưới thận, kèm theo khối mô viêm quanh toàn bộ chu vi động mạch chủ(mũi tên). Cấy đàm của bệnh nhân dương tính với Mycobacterium tuberculosis, và hình ảnh động mạch chủ phù hợp với viêm động mạch chủ do lao.
- Viêm động mạch chủ do giang mai (Syphilitic Aortitis)
Bệnh nhân bị giang mai, các tổn thương tim mạch chủ yếu xảy ra trong giai đoạn giang mai muộn (giang mai thời kỳ ba), và thường đi kèm với sự hiện diện của củ giang mai (gummas) và tổn thương thần kinh. Bệnh tim do giang mai biểu hiện dưới nhiều dạng, bao gồm: (1) viêm động mạch chủ, (2) phình động mạch chủ, (3) viêm tại van động mạch chủ gây hở van và (4) hẹp các động mạch vành. Tác nhân gây bệnh giang mai là do xoắn khuẩn Treponema pallidum. Cơ chế bệnh sinh trong tổn thương mạch máu khởi đầu của giang mai là do viêm nội mạc động mạch (endarteritis obliterans) của mạch máu vasa vasorum trong lớp trung mạc do sự xâm nhập của vi khuẩn làm thiếu máu cục bộ thành động mạch chủ, tiến triển dần gây viêm mạn tính và hoại tử thành, kết quả thành động mạch chủ bị suy yếu và hình thành phình động mạch. Các đặc điểm đại thể và vi thể của tổn thương viêm động mạch chủ do giang mai gồm: bề mặt nội mạc động mạch chủ nhăn nheo giống vỏ cây (“tree barking”), mô bệnh học cho thấy xơ hóa lan tỏa và viêm trong lớp áo giữa động mạch, cùng với viêm nội mạc động mạch bít tắc trong lớp áo ngoài. Động mạch chủ lên là vị trí tổn thương phổ biến của giang mai, ngoài ra còn tổn thương thương ở vị trí cung động mạch chủ và động mạch chủ ngực xuống.
Hình ảnh học của viêm động mạch chủ do giang mai gồm nhiều đặc điểm sau: dày lan tỏa thành động mạch chủ, tổn thương gồm một hoặc nhiều túi phình động mạch kèm có/không huyết khối bám thành (Hình 2.4). Chụp CT có cản quang thì muộn có thể thấy hình ảnh “bờ đôi” (double-ring) của dày thành động mạch chủ ngực dày, giống hình ảnh viêm động mạch Takayasu. Phình động mạch chủ lên do giang mai có thể ăn mòn xương ức, đặc biệt là một nửa trong của cán ức và đầu trong của xương đòn.
Viêm động mạch chủ do giang mai thường có nhiều biến chứng và đa phần tiên lượng xấu. Các biến cố chính gây tử vong trong viêm động mạch chủ do giang mai bao gồm: vỡ phình động mạch chủ, hở van động mạch chủ nặng, hẹp lỗ xuất phát động mạch vành. Nghiên cứu tử thiết của tác giả Roberts và cs cho thấy bệnh tim mạch do giang mai vẫn chưa được loại trừ hoàn toàn, các tác giả đưa ra khuyến nghị15: xét nghiệm huyết thanh giang mai cho tất cả bệnh nhân có động mạch chủ lên giãn, dù có hay không có hở van động mạch chủ. Điều trị kháng sinh sớm có thể có lợi ngay cả khi bệnh nhân không có kết quả huyết thanh dương tính, miễn là có các đặc điểm hình thái đặc trưng của viêm động mạch chủ do giang mai.
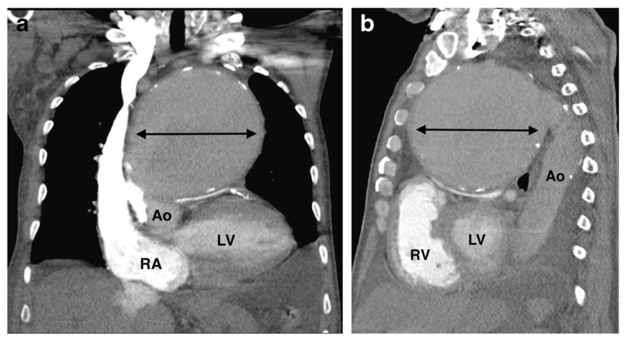
Hình 2.4: Tổn thương động mạch chủ do giang mai14
Bệnh nhân nam, 70 tuổi bị đau ngực và khó thở khi gắng sức đã được chụp cắt lớp vi tính động mạch phổi (CTPA) do nghi ngờ thuyên tắc phổi. Hình ảnh tái tạo đa mặt phẳng (MPR) theo mặt phẳng đứng ngang (coronal) (a) và mặt phẳng đứng dọc (saggital) (b) cho thấy phình động mạch chủ lên rất lớn, dạng hình thoi, có vôi hóa ngoại vi gây chèn ép nghiêm trọng thân chung động mạch phổi ở phía dưới và tiếp giáp với xương ức ở phía trước. Bệnh nhân đã được phẫu thuật sửa chữa, với kết quả mô bệnh học cho thấy hình ảnh điển hình của viêm động mạch chủ do giang mai.
- Phình động mạch chủ nhiễm trùng (Mycotic Aortic Aneurysm)
Thuật ngữ “phình động mạch nhiễm trùng” (mycotic aneurysm) đôi có thể gây nhầm lẫn, vì nó dùng để chỉ tất cả trường hợp phình động mạch chủ do nhiễm trùng, bất kể vi sinh vật gây bệnh. Đây là những trường hợp hiếm gặp, chỉ chiếm khoảng 0,7–2,6% trong tổng số các túi phình động mạch chủ16. Thông thường, phình động mạch nhiễm trùng là hậu quả của viêm động mạch chủ nhiễm trùng, làm suy yếu thành mạch, dẫn đến vỡ động mạch chủ khu trú hoặc hình thành túi giả phình. Tiến trình tổn thương thành động mạch diễn ra tương đối chậm, cho phép cơ thể hình thành phản ứng viêm tại vùng quanh động mạch. Phình động mạch chủ nhiễm trùng do nhiều tác nhân gây bệnh. Trong đó, Salmonella là vi khuẩn phổ biến nhất gây phình động mạch nhiễm trùng, một số tác nhân vi khuẩn khác bao gồm: Staphylococcus, Streptococcus, Klebsiella, Pseudomonas, Mycobacterium và nấm Candida16,17. Vị trí tổn thương thường gặp nhất là động mạch chủ bụng đoạn dưới thận16,17. Các yếu tố nguy cơ dẫn đến phình động mạch chủ nhiễm trùng bao gồm: xơ vữa động mạc, đái tháo đường, suy giảm miễn dịch (HIV, sử dụng thuốc ức chế miễn dịch, ung thư, ghép tạng), tiền căn có ống ghép động mạch chủ trước đó, đặt catheter nội mạch, lạm dụng rượu2. Có nhiều phương tiện hình ảnh học để đánh giá phình động mạch chủ nhiễm trùng. Trên siêu âm, phình động mạch nhiễm trùng xuất hiện dưới dạng phình túi kèm theo dày thành động mạch18. Trên hình ảnh CT/MRI, phình động mạch nhiễm trùng thường xuất hiện là phình động mạch dạng túi, bờ không đều (thường đa thùy), kèm theo thâm nhiễm mô mềm quanh động mạch chủ, phù nề hoặc dịch tụ, và đôi khi tiến triển nhanh chóng trong thời gian ngắn (thường trong vài tuần)2,3,16,18 (Hình ). Một số biểu hiện khác gồm huyết khối trong túi phình động mạch và gián đoạn vôi hóa quanh thành động mạch.
Dấu hiệu hình ảnh phổ biến nhất của phình động mạch nhiễm trùng là thâm thêm nhiễm mỡ và xuất hiện khối mô quanh động mạch chủ, xuất hiện ở khoảng 48% trường hợp 16, Đây là biểu hiện nhiễm trùng sớm trước khi hình thành phình động mạch17 (Hình 2.5). Trong hki đó, vôi hóa thành động mạch chủ và huyết khối bám thành không phải là đặc điểm điển hình của phình động mạch nhiễm trùng16,18.
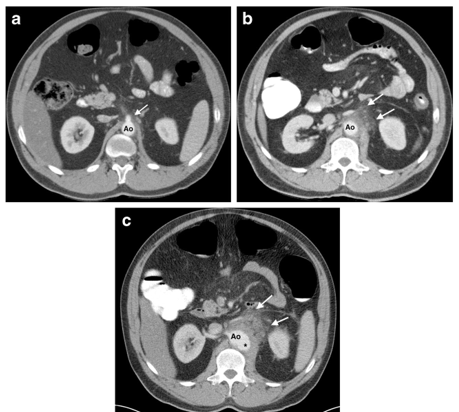
Hình 2.5: Phình động mạch chủ nhiễm trùng
Bệnh nhân nam, 46 tuổi, không ghi nhận tiền sử bệnh lý tim mạch, không đái tháo đường, nhập viện với đau bụng và sốt nhẹ.
(a) Hình ảnh CT bụng có thuốc tương phản cho thấy thâm nhiễm mỡ không rõ ràng (mũi tên) bao quanh đoạn gần của động mạch chủ bụng tại vị trí xuất phát của động mạch thân tạng. (b) Hình ảnh CT bụng sau 3 ngày, do tình trạng đau bụng trầm trọng hơn, cho thấy mức độ thâm nhiễm mỡ quanh động mạch chủ gia tăng đáng kể (mũi tên). (c) Hình ảnh CT bụng sau 1 tuần tiếp theo cho thấy tiến triển thành túi phình động mạch chủ bụng(*) kèm theo tình trạng thâm nhiễm mỡ quanh động mạch chủ ngày càng nghiêm trọng (mũi tên).
Bệnh nhân được chẩn đoán phình động mạch chủ nhiễm trùng, phẫu thuật cắt bỏ túi phình động mạch và thay thế bằng cầu nối mạch máu. Mô bệnh cho thấy viêm động mạch chủ do Staphylococcus aureus. Mặc dù đã can thiệp phẫu thuật, bệnh nhân vẫn tử vong trong giai đoạn hậu phẫu sớm.
Các dấu hiệu hình ảnh khác có thể bao gồm khí quanh động mạch chủ, phá hủy thân đốt sống, hình thành áp-xe cơ thắt lưng và nhồi máu thận2. Phình động mạch nhiễm trùng biểu hiện trên 18F-FDG PET-CT với sự gia tăng hấp thu chất đánh dấu ở cả thành động mạch và mô mềm xung quanh so với các phình động mạch không nhiễm trùng, giúp phân biệt trong các trường hợp không rõ ràng (Hình 2.6).
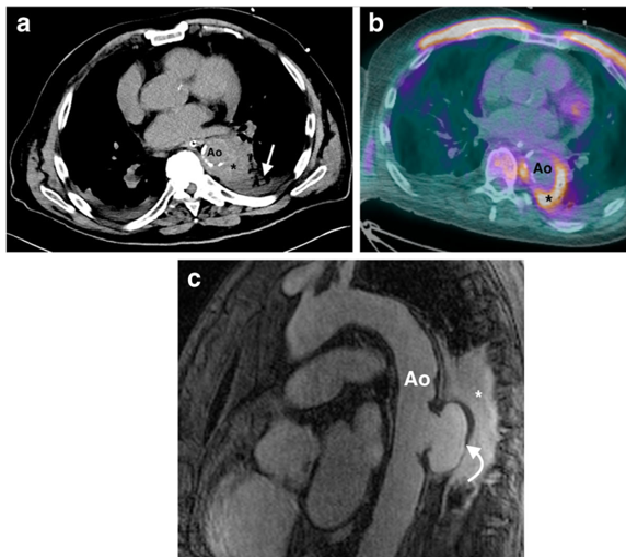
Hình 2.6: Phình động mạch chủ nhiễm trùng do Staphylococcus aureus.
Bệnh nhân nam, 78 tuổi nhập viện với đau ngực, sốt và cấy máu ghi nhận tình trạng nhiễm trùng huyết do Staphylococcus aureus.
(a) Hình ảnh CT ngực cắt ngang không thuốc tương phản cho thấy tăng tỷ trọng ở thành động mạch chủ ngực xuống (*), kèm theo vùng đông đặc phổi lân cận ở thùy dưới phổi trái (mũi tên). (b) Hình ảnh PET/CT với 18F-FDG cho thấy tăng hấp thu FDG tương ứng tại thành động mạch chủ (*). (c) Hình ảnh MRI sagittal T1 sau tiêm thuốc đối quang từ cho thấy túi giả phình lớn (mũi tên cong), kèm theo mô viêm tồn tại lân cận (*). Bệnh nhân được chẩn đoán phình động mạch chủ nhiễm trùng, điều trị kháng sinh liều cao và phẫu thuật sau đó.
Phình động mạch nhiễm trùng là tình trạng nguy hiểm tính mạng, với tỷ lệ tử vong lên đến 75%. Trong đó, nguyên nhân tử vong phổ biến nhất là vỡ phình động mạch chủ (chiếm 53%-75% số ca), nhiễm trùng huyết không kiểm soát được. Hình ảnh học CT/MRI giúp xác định phạm vi tổn thương, từ đó hướng dẫn quyết định điều trị. Điều trị các trường hợp này bao gồm: kháng sinh tĩnh mạch liều cao và phẫu thuật (cắt bỏ động mạch bị tổn thương và tái tạo mạch máu).
- Nhiễm trùng ống ghép động mạch chủ
Phẫu thuật tái tạo động mạch chủ bằng ống ghép nhân tạo và đặt stent graft trong điều trị phình động mạch chủ bằng kỹ thuật nội mạch (EVAR) là các thủ thuật phổ biến để điều trị phình động mạch chủ. Nhiễm trùng ống ghép là một biến chứng hiếm gặp, xảy ra ở khoảng 1.3% – 6% số ca, nhưng có tỷ lệ tử vong cao (25 – 75%)19. Nguy cơ nhiễm trùng thấp hơn ở EVAR so với phẫu thuật mở, do thành động mạch chủ nguyên vẹn bảo vệ mảnh ghép khỏi khoang phúc mạc, chiếm khoảng 1% các trường hợp20. Tác nhân thường gặp trong vòng 3 tháng đầu sau phẫu thuật sửa chữa mạch máu là Staphylococcus aureus21. Trong khi đó, vi khuẩn Staphylococcus coagulase âm tính thường gặp hơn trong các nhiễm trùng muộn. Staphylococcus và Streptococcus là các tác nhân được phân lập thường gặp nhất trong nhiễm trùng sau can thiệp nội mạch (EVAR)22.
CT là phương pháp hình ảnh được sử dụng phổ biến nhất để đánh giá nhiễm trùng ống ghép động mạch chủ. Các dấu hiệu nhiễm trùng trên CT bao gồm: (1) dày mô mềm quanh ống ghép kéo dài hoặc tiến triển, (2) tụ dịch quanh ống ghép và (3) hiện diện của khí quanh ống ghép ở giai đoạn hậu phẫu19,23 (Hình 2.7)
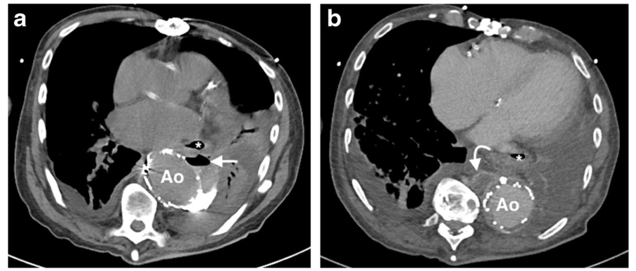
Hình 2.7: Nhiễm trùng ống ghép nội mạch động mạch chủ ngực
Bệnh nhân nam, 65 tuổi nhập viện vì sốt và ho ra máu. Tiền căn phẫu thuật đặt ống ghép nội mạch động mạch chủ ngực (TEVAR) cách 6 tháng.
(a) Hình ảnh CT ngực cắt ngang không cản quang cho thấy sự xuất hiện mới của khí bên trong túi phình (mũi tên), ngay phía sau thực quản (*). Có vùng đông đặc phổi thùy dưới trái lân cận, kèm theo tràn dịch màng phổi.
(b) Hình ảnh CT ngực cắt ngang có thuốc tương phản (thì tĩnh mạch 70 giây) cho thấy một khối dịch quanh động mạch chủ có tăng quang ngoại vi (mũi tên cong) ở phần dưới của mảnh ghép stent, phù hợp với một ổ áp-xe.
Trên CT, nếu tồn tại của khối mô mềm tăng tỷ trọng và dịch quanh ống ghép sau hơn 3 tháng kể từ khi phẫu thuật mở sửa chữa động mạch chủ gợi ý nhiễm trùng ống ghép. Hiện diện của khí quanh ống ghép động mạch chủ bụng sau giai đoạn hậu phẫu ban đầu (1 tháng) gợi ý nghi ngờ dò động mạch chủ – ruột (aortoenteric fistula), tuy nhiên đây không phải là dấu hiệu đặc trưng24. Kết hợp giữa khí lạc chỗ, dày khu trú thành ruột và/hoặc dính các quai ruột vào vị trí ống ghép là dấu hiệu gợi ý mạnh mẽ của lỗ rò động mạch chủ – ruột24. Và trong một số ít trường hợp, CT có thể cho thấy sự thoát thuốc cản quang từ động mạch chủ vào quai ruột bị tổn thương (Hình 2.8).
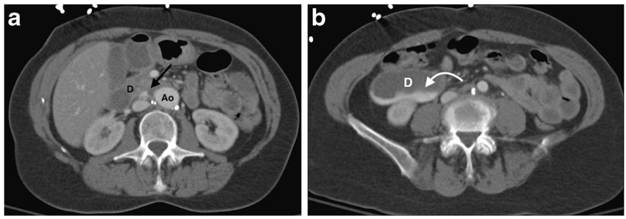
Hình 2.8 : Dò động mạch chủ – ruột sau phẫu thuật đặt ống ghép động mạch chủ
Bệnh nhân nữ, 62 tuổi, tiền sử phẫu thuật đặt ống ghép động mạch chủ bụng để điều trị phình động mạch. Bệnh nhân nhập viện với đau bụng và nôn ra dịch nâu. Bệnh nhân được chỉ định chụp CT mạch máu. Hình ảnh CT bụng cắt ngang (thì muộn sau tiêm cản quang 70 giây) cho thấy một lỗ dò (mũi tên) giữa động mạch chủ (Ao) và tá tràng (d), với sự lắng đọng của chất có tỷ trọng cao trong tá tràng (mũi tên cong). Bệnh nhân đã được phẫu thuật cấp cứu nhưng tử vong. Cấy mô từ mảnh ghép động mạch chủ bụng phát hiện vi khuẩn gram âm Escherichia coli.
Một trong những thách thức lớn là xác định bệnh nhân bị nhiễm trùng mảnh ghép đó là các phương tiện hình ảnh như CT không có giá trị chẩn đoán quá cao, nhất là trường hợp tình trạng nhiễm trùng diễn tiến chậm. Đối với CT, độ nhạy và độ đặc hiệu được báo cáo của CT trong những trường hợp này lần lượt là 55–64% và 86–100%25. Để khắc phục một số hạn chế của CT trong chẩn đoán nhiễm trùng mảnh ghép động mạch chủ, đặc biệt là nhiễm trùng mức độ thấp, 18F-FDG PET/C là công cụ hỗ trợ hữu ích. Các nghiên cứu ghi nhận độ nhạy và độ đặc hiệu của phương pháp này lần lượt là 89–100% và 86–100%26,27. Tuy nhiên, đôi khi có tình trạng dương tính giả do viêm mạn tính trên bề mặt mảnh ghép, biểu hiện dưới dạng tăng hấp thu FDG lan tỏa với mức độ thấp đến trung bình, đặc biệt trong giai đoạn hậu phẫu sớm (3 tháng đầu)28.
Biến chứng của nhiễm trùng ống ghép bao gồm: giả phình động mạch chủ, gây thận ứ nước (hydronephrosis) và viêm xương tủy (osteomyelitis). Hình thành giả phình là một biến chứng nghiêm trọng của nhiễm trùng ống ghép, đặc biệt gặp trong các trường hợp nhiễm trùng ống ghép sau can thiệp nội mạch [88, 89]. Điều trị chính bao gồm: dẫn lưu qua da dịch quanh mảnh ghép là phương pháp điều trị ban đầu và phẫu thuật sau khi dẫn lưu qua da an toàn hơn so với chỉ phẫu thuật đơn thuần.
3. KẾT LUẬN
Viêm động mạch chủ là tình trạng viêm của thành động mạch chủ, có thể do nhiều nguyên nhân nhiễm trùng và không nhiễm trùng. Trong đó, viêm động mạch chủ do nhiễm trùng, có tiên lượng xấu với tỷ lệ tử vong và biến chứng cao nếu không được điều trị sớm. Do các triệu chứng lâm sàng không đặc hiệu và mơ hồ, hình ảnh học đóng vai trò quan trọng trong chẩn đoán kịp thời và quản lý bệnh nhân. Các kỹ thuật hình ảnh cắt lớp, bao gồm chụp cắt lớp vi tính mạch (CTA), cộng hưởng từ (MRI), chụp mạch cộng hưởng từ (MRA) và chụp PET, có vai trò thiết yếu trong chẩn đoán ban đầu, đánh giá mức độ hoạt động của bệnh và theo dõi sau điều trị. Trên thực tế, theo hướng dẫn của Hiệp hội Tim mạch Châu Âu (ESC) trong chẩn đoán và quản lý bệnh lý động mạch chủ, CT hoặc MRI là phương pháp hình ảnh đầu tay trong các trường hợp nghi ngờ nhiễm trùng động mạch chủ. Chụp 18F-FDG PET-CT được dành cho các tình huống lâm sàng đặc biệt như nghi ngờ nhiễm trùng ống ghép động mạch chủ.
TÀI LIỆU THAM KHẢO
- Gornik HL, Creager MA. Aortitis. Circulation. 2008;117(23):3039-3051.
- Restrepo CS, Ocazionez D, Suri R, Vargas D. Aortitis: imaging spectrum of the infectious and inflammatory conditions of the aorta. Radiographics. 2011;31(2):435-451.
- Katabathina VS, Restrepo CS. Infectious and noninfectious aortitis: cross-sectional imaging findings. Elsevier; 2012:207-221.
- Schmidt WA, Blockmans D. Use of ultrasonography and positron emission tomography in the diagnosis and assessment of large-vessel vasculitis. Current opinion in rheumatology. 2005;17(1):9-15.
- Flamm SD, White RD, Hoffman GS. The clinical application ofedema-weighted’magnetic resonance imaging in the assessment of Takayasu’s arteritis. International journal of cardiology. 1998;66:S151-S159.
- Bley T. Imaging studies in the diagnosis of large vessel vasculitis. Clin Exp Rheumatol. 2007;25(1 Suppl 44):S60-1.
- Lopes R, Almeida J, Dias P, Pinho P, Maciel MJCCAII. Infectious thoracic aortitis: a literature review. Clinical Cardiology. 2009;32(9):488-490.
- Cartery C, Astudillo L, Deelchand A, et al. Abdominal infectious aortitis caused by Streptococcus pneumoniae: a case report and literature review. Annals of vascular surgery. 2011;25(2):266. e9-266. e16.
- Guerrero MLF, Aguado JM, Arribas A, Lumbreras C, de Gorgolas M. The spectrum of cardiovascular infections due to Salmonella enterica: a review of clinical features and factors determining outcome. Medicine. 2004;83(2):123-138.
- Lin M-M, Cheng H-M. Images in cardiovascular medicine: tuberculous aortitis. Internal Medicine. 2012;51(15):1983-1985.
- Pierret C, Tourtier J-P, Grand B, Boddaert G, Laurian C, de Kerangal X. Multiple tuberculous aneurysms of the aorta. Journal of vascular surgery. 2011;53(6):1720-1722.
- Long R, Guzman R, Greenberg H, Safneck J, Hershfield E. Tuberculous mycotic aneurysm of the aorta: review of published medical and surgical experience. Chest. 1999;115(2):522-531.
- Allins AD, Wagner WH, Cossman DV, Gold RN, Hiatt JR. Tuberculous infection of the descending thoracic and abdominal aorta: case report and literature review. Annals of vascular surgery. 1999;13(4):439-444.
- Murphy DJ, Keraliya A, Agrawal MD, Aghayev A, Steigner ML. Cross-sectional imaging of aortic infections. Insights into Imaging. 2016;7:801-818.
- Roberts WC, Ko JM, Vowels TJ. Natural history of syphilitic aortitis. The American journal of cardiology. 2009;104(11):1578-1587.
- Macedo TA, Stanson AW, Oderich GS, Johnson CM, Panneton JM, Tie ML. Infected aortic aneurysms: imaging findings. Radiology. 2004;231(1):250-257.
- Azizi L, Henon A, Belkacem A, Monnier-Cholley L, Tubiana J-M, Arrivé L. Infected aortic aneurysms: CT features. Abdominal imaging. 2004;29:716-720.
- Lee W-K, Mossop PJ, Little AF, et al. Infected (mycotic) aneurysms: spectrum of imaging appearances and management. Radiographics. 2008;28(7):1853-1868.
- Bruggink JL, Slart RH, Pol JA, Reijnen MM, Zeebregts CJ. Current role of imaging in diagnosing aortic graft infections; 2011:182-190.
- Cernohorsky P, Reijnen MM, Tielliu IF, Van Sterkenburg SM, Van Den Dungen JJ, Zeebregts CJ. The relevance of aortic endograft prosthetic infection. Journal of vascular surgery. 2011;54(2):327-333.
- Chambers S. Diagnosis and management of staphylococcal infections of vascular grafts and stents. Abdominal imaging 2005;
- Murphy EH, Szeto WY, Herdrich BJ, et al. The management of endograft infections following endovascular thoracic and abdominal aneurysm repair. Journal of Vascular surgery. 2013;58(5):1179-1185.
- Orton DF, LeVeen RF, Saigh JA, et al. Aortic prosthetic graft infections: radiologic manifestations and implications for management. Radiographics. 2000;20(4):977-993.
- Raman SP, Kamaya A, Federle M, Fishman EK. Aortoenteric fistulas: spectrum of CT findings. Abdominal imaging. 2013;38:367-375.
- Fukuchi K, Ishida Y, Higashi M, et al. Detection of aortic graft infection by fluorodeoxyglucose positron emission tomography: comparison with computed tomographic findings. Journal of vascular surgery. 2005;42(5):919-925.
- Guenther SP, Cyran CC, Rominger A, et al. The relevance of 18F-fluorodeoxyglucose positron emission tomography/computed tomography imaging in diagnosing prosthetic graft infections post cardiac and proximal thoracic aortic surgery. Interactive cardiovascular thoracic surgery. 2015;21(4):450-458.
- Sah B-R, Husmann L, Mayer D, et al. Diagnostic performance of 18F-FDG-PET/CT in vascular graft infections. European Journal of Vascular Endovascular Surgery. 2015;49(4):455-464.
- Ahmed FZ, James J, Memmott MJ, Arumugam P. Radionuclide imaging of cardiovascular infection. J Cardiology Clinics. 2016;34(1):149-165.







