ThS. BS. LÊ THỊ LAN HƯƠNG
BS. CKI. TRẦN CÔNG TRÌNH
PGS.TS.BS. PHẠM NGUYỄN VINH
Bệnh viện đa khoa Tâm Anh TP. Hồ Chí Minh
TÓM TẮT
Mỡ thượng tâm mạc là mô mỡ nội tạng bao quanh mạch vành và cơ tim. Do vị trí giải phẫu chặt chẽ giữa mỡ thượng tâm mạc và động mạch vành, lớp mỡ này có thể đóng một vai trò trong sinh bệnh học, thông qua nhiều cơ chế nội tiết và cận tiết. Các nghiên cứu gần đây chứng minh mỡ thượng tâm mạc là yếu tố nguy cơ tiềm ẩn cho sự phát triển cũng như tiến triển của bệnh động mạch vành. Do đó, mỡ thượng tâm mạc có thể đóng vai trò là dấu ấn sinh học hình ảnh hữu ích trong phân loại nguy cơ xơ vữa động mạch vành. Trong bài trình bày này, chúng tôi cung cấp những hiểu biết về cơ chế bệnh sinh của mỡ thượng tâm mạc trong xơ vữa động mạch vành.
Từ khóa: mỡ thượng tâm mạc, xơ vữa động mạch vành.
NỘI DUNG
1. Đặt vấn đề
Hiện nay, bệnh động mạch vành do xơ vữa (CAD) là một trong những nguyên nhân gây tử vong cũng như tàn tật hàng đầu trên thế giới, ở cả các nước có thu nhập thấp, trung bình và cả các nước có thu nhập cao1. Năm 2018, bệnh mạch vành gây ra 365.744 trường hợp tử vong ( chiếm 42.1%) và là nguyên nhân hàng đầu tử vong tim mạch tại Hoa Kỳ2. Tại Châu Á, theo dữ liệu phân tích gộp về tình hình dịch tễ bệnh tật năm 2019, bệnh tim mạch cũng là nguyên nhân tử vong hàng đầu tại các quốc gia này, trong đó thường gặp nhất là bệnh tim thiếu máu cục bộ và đột quị 3. Mặc dù chất lượng y tế ngày càng được cải thiện, tử vong do bệnh động mạch vành gây ra đã giảm trong 3 thập kỷ qua, tuy nhiên tần suất mắc bệnh vẫn cao, và bệnh nhân vẫn có nguy cơ đối mặt với nhiều vấn đề sức khỏe trong tương lai, bao gồm: tái nhồi máu cơ tim, suy tim, đột quị và tử vong4. Do đó, việc xác định các yếu tố nguy cơ tim mạch rất quan trọng đặc biệt ở giai đoạn sớm của CAD. Và các nghiên cứu liên tục tìm kiếm các yếu tố mới có thể làm gia tăng độ nhạy trong phân tầng nguy cơ, với mục tiêu phòng ngừa và điều trị sớm bệnh lý động mạch vành. Hơn một thập kỷ qua, có nhiều công trình khoa học nghiên cứu về mỡ nội tạng vì vai trò phức tạp trong sinh bệnh học liên quan các bệnh lý tim mạch5. Mô mỡ thượng tâm mạc (EAT) là khoang lipid nội tạng giữa cơ tim và lá tạng màng ngoài tim, tiếp xúc trực tiếp với cơ tim và mạch vành6. Mô mỡ thượng tâm mạc có nhiều vai trò quan trọng, không chỉ là nguồn cung cấp năng lượng chất béo và điều chỉnh nhiệt độ cho tim, mà chất béo biểu mô của màng ngoài tim có tác dụng bảo vệ cao vì nó giải phóng rất nhiều phân tử chống viêm7. Tuy nhiên, khi có tình trạng bệnh lý, mô mỡ thượng tâm mạc tim gia tăng thúc đẩy xơ vữa động mạch vành theo nhiều cách khác nhau8. Các giả thuyết thực nghiệm cho rằng quá trình đầu tiên của tổn thương xơ vữa động mạch là tiến trình viêm và kích hoạt EAT sản xuất các cytokine làm gia tăng tình trạng viêm mạch máu, gây rối loạn quá trình điều hòa và thúc đẩy xơ vữa động mạch vành 9-13. Nhiều nghiên cứu cho thấy ước tính chính xác độ dày và thể tích mỡ thượng mạc tim được xem như một phương pháp phát hiện sớm và phòng ngừa bệnh động mạch vành do xơ vữa (CAD) trong tương lai 14.
2. Mỡ thượng tâm mạc
2.1 Tổng quan mô mỡ trong cơ thể
Mô mỡ (Adipose Tissue) đóng một số vai trò khác nhau trong cơ thể con người, là nơi lưu trữ năng lượng, tác dụng cách nhiệt và bảo vệ cơ thể khỏi chấn thương. Từ khi phát hiện ra hormone leptin vào những năm 1990, mô mỡ được xem là nơi sản xuất lượng lớn các cystokine gọi là adipokine, thực hiện nhiều tác dụng nội tiết và cận tiết15.
Mô mỡ được phân loại dựa vào hình thái, sinh lý, nguồn gốc mô phôi. Hiện nay, mô mỡ được phân thành hai nhóm: mô mỡ trắng và mô mỡ nâu. Mỡ trắng có nguồn gốc tế bào trung bì và có vai trò là nguồn năng lượng dự trữ. Dựa và phân bố giải phẫu, mỡ trắng chia làm mô mỡ dưới da và mô mỡ nội tạng. Mỡ nội tạng nằm ở các cơ quan thành bụng, bao phủ các cơ quan nội tạng, trong khi mỡ dưới da nằm ở các mô dưới da, đặc biệt là hạ bì. Mô mỡ nâu có nguồn gốc từ các tế bào tiền thân ở da cơ, và có điểm tương tự với các tế bào cơ vân vì chúng phát triển từ những con đường tín hiệu tương tự nhau. Mô mỡ nâu thương là nơi dự trữ nhỏ, có nhiều phân bố thần kính, mạch máu. Mỡ nâu cũng chuyển hóa mỡ, sinh nhiệt và góp phần tăng chuyển hóa chung của cơ thể16.
Từ những năm 2010, các nghiên cứu đã cho thấy béo phì và dư thừa mỡ liên quan chặt chẽ với bệnh mạch vành (CAD) và nhồi máu cơ tim và cũng là yếu tố liên quan độc lập đến xơ vữa động mạch 17. Các cơ chế có thể giải thích tình trạng này, bao gồm: thay đổi huyết áp, điều hòa đường huyết, chuyển hóa lipid và quá trình viêm hệ thống 18. Ngoài ra còn cơ chế khác, mô mỡ còn tiết ra nhiều yếu tố ngoại tiết và cận tiết có thể ảnh hưởng trực tiếp đến cân bằng nội môi thành mạch bằng cách thay đổi chức năng của các tế bào nội mô, tế bào cơ trơn động mạch và đại thực bào, do đó có thể dẫn đến sự phát triển của các mảng xơ vữa động mạch trong thành mạch 19.
2.2 Giải phẫu mô mỡ quanh tim
Trước đây, nhiều thuật ngữ mô tả lớp mỡ quanh tim hoặc trong trung thất, bao gồm: mỡ thượng tâm mạc (epicardial), mỡ màng ngoài tim (pericardial), mỡ cạnh tim (paracardial) và mỡ trong lồng ngực (intra-thoracic). Việc sử dụng nhiều thuật ngữ này dễ gây nhầm lẫn, vì có sự thay đổi lớn và không nhất quán với việc sử dụng chúng trong các tài liệu. Nhầm lẫn thường gặp là thuật ngữ “mỡ màng ngoài tim”, tuy nhiên được tìm thấy giữa thành ngoài của cơ tim và lá tạng của màng ngoài tim, do đó lớp mỡ này hoàn toàn được bao bọc trong màng ngoài tim20.
- Mỡ thượng tâm mạc (EAT): nằm giữa cơ tim và lá tạng của màng ngoài tim. Phần mỡ này tiếp xúc trực tiếp với các động mạch vành, đại diện cho mô mỡ quanh vành (PCAT). Cụ thể PCAT đã được định nghĩa là lớp mỡ đo từ thành ngoài mạch máu bằng đường kính của mạch vành liền kề 14. Đối với các mạch máu lớn, PCAT liên tục lớp ngoại mạc mạch máu, trong khi ở các mạch máu nhỏ và vi mạch tế bào mỡ PCAT là một phần không thể thiếu của thành mạch máu 13.
- Mô mỡ màng ngoài tim (PAT): nằm giữa lớp lá thành và lá tạng của khoang màng ngoài tim, và ở vùng mỏm màng ngoài tim.
- Mô mỡ cạnh màng tim : là mô mỡ nằm ngoài màng ngoài tim, trong trung thất
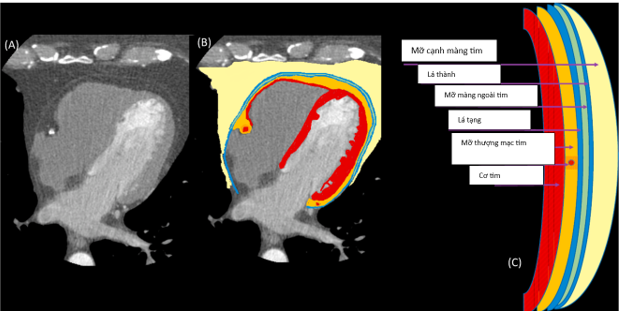
Hình 1: Giải phẫu các thành phần mỡ quanh tim21
Trong điều kiện sinh lý, mỡ thượng tâm mạc bao phủ 80% bề mặt trái tim và chiếm từ 20-50% khối lượng tim22. Bình thường, EAT phân bố không đồng đều, tập trung nhiều ở vùng đáy tim, quanh rãnh nhĩ thất, và xung quanh các mạch vành thượng mạc23. Ngoài ra một lượng ít mỡ thượng mạc bao bọc quanh tâm nhĩ, trên thành tự do thất phải và vùng mỏm thất trái 8.
2.3 Mô học lớp mỡ quanh tim
Về mặt mô học, EAT bắt nguồn từ trung bì màng phổi 24 và bao gồm các tế bào mỡ có kích thước nhỏ hơn đáng kể so với các tế bào được tìm thấy trong mỡ mạc nối và lớp mỡ dưới da 25. Ở giai đoạn đầu đời, lớp EAT có kiểu hình mỡ nâu. Tuy nhiên, ở giai đoạn trung niên EAT thể hiện các đặc điểm của chất béo ‘màu be’, gồm tế bào mỡ trắng trộn với tế bào mỡ màu nâu . Lớp mỡ EAT còn bao gồm tế bào viêm, tế bào sinh dưỡng và tế bào miễn dịch, cũng như mô thần kinh và mô nút26. Phân tích mô học lớp mỡ thượng tâm mạc cho thấy hỗn hợp nhiều tế bào gồm: tế bào viêm như lymphocytes (CD3+), các đại thực bào, tế bào sinh dưỡng (mastocyte), tế bào miễn dịch. Ngoài ra, lớp mỡ này còn chứa các mô hạch, mô thần kinh sản xuất các yếu tố tăng trưởng.
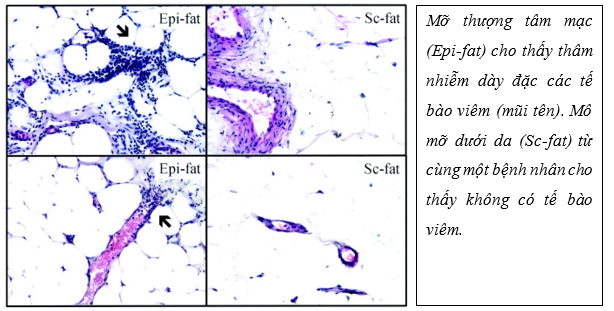
Hình 2: Đặc điểm mô bệnh học của mỡ thượng tâm mạc và mỡ dưới da trên nhuộm Hematoxylin và eosin, độ phóng đại x 1026
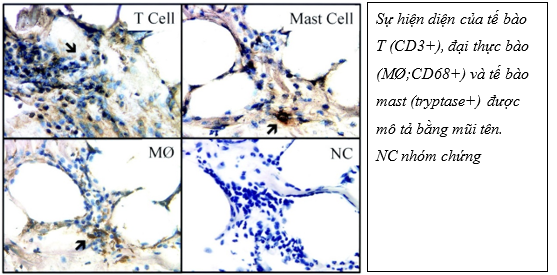
Hình 3: Đặc điểm của thâm nhiễm tế bào trong mỡ thượng tâm mạc với nhuộm hóa mô miễn dịch (Độ phóng đại x 40)26
Mô mỡ cận tim (PAT) liên quan đến lớp mỡ ở phía ngoài màng ngoài tim. Về nguồn gốc mô học khác với EAT, PAT bắt nguồn từ trung tâm ngực nguyên thủy, tách ra để tạo thành lá thành màng ngoài tim và thành ngực ngoài 8,24. PAT không được tưới máu bởi các động mạch vành mà được cung cấp bởi các nhánh của động mạch vú trong như động mạch màng ngoài tim 8,24. EAT và PAT là hai nguồn chất béo khác nhau, và khác về mặt chức năng, do đó cần phải phân biệt giữa chúng.
2.4 Sinh lý học mỡ thượng tâm mạc
Ở trạng thái bình thường, EAT có nhiều chức năng nhất định. EAT là lớp bảo vệ cho tim, đặc biệt giúp các động mạch vành chống lại sự xoắn gây ra bởi xung động sóng mạch và co thắt cơ tim trong quá trình co bóp cơ tim27. Hơn nữa, lớp mỡ này tạo ra hàng rào chống lại mầm bệnh bằng cách bao quanh các cấu trúc tim bên dưới với hoạt động miễn dịch.
EAT bao gồm các tế bào mỡ có đặc điểm màu nâu hoặc màu be, liên quan đến quá trình sinh nhiệt để đáp ứng với tình trạng nhiệt độ thấp, do đó bảo vệ tim chống lại quá trình hạ thân nhiệt 28. Hơn nữa, do hoạt động chuyển hóa lipolytic và lypogenic cao, EAT có thể cung cấp năng lượng cục bộ bằng cách nhanh chóng cung cấp axit béo cho cơ tim khi nhu cầu trao đổi chất cao. Axit béo là nguồn năng lượng chính cho chức năng co bóp trong một trái tim khỏe mạnh, và quá trình oxy hóa axit béo cung cấp khoảng 50-70% năng lượng của tim 6. Trong mỡ thượng tâm mạc, các axit béo bão hòa bao gồm: axit myristic, axit palmitic, axit stearic và các axit không bão hòa, bao gồm axit palmitoleic, axit oleic, axit linoleic. Khả năng chuyển hóa các axit béo tự do để tạo năng lượng ở mỡ thượng tâm mạc cao hơn sơ mô mỡ nội tạng khác trong cơ thể. Trong khi đó, mỡ thượng tâm mạc có khả năng sử dụng glucose rất thấp, và chứa nhiều protein hơn, trong khi hàm lượng ty thể gần như tương tự 24. Tóm lại, nghiên cứu chứng minh răng cho rằng EAT có thể hoạt động như một bộ đệm giữa cơ tim và mạch máu, sử dụng hiệu quả các axit béo dư thừa (FFA ) và do đó bảo vệ tim khỏi độc tính mỡ15.
Ngoài ra, hiện nay người ta đã xác định rằng EAT là một cơ quan nội tiết. EAT tạo ra lượng lớn các chất như: cytokine, các yếu tố tăng trưởng, yếu tố vận mạch và các phân tử hoạt tính sinh học khác, được gọi chung là adipokine. Adipokine có thể tác dụng cận tiết trực tiếp lên cơ tim và động mạch vành liền kề hoặc tác dụng vận mạch thông qua hệ thống tuần hoàn cục bộ 29. Ở trạng thái khỏe mạnh, adipokine bảo vệ mạch máu thúc đẩy quá trình vận mạch và phát huy tác dụng chống viêm, chống xơ hóa và chống oxy hóa 30.
2.5 Sinh lý bệnh của lớp mỡ thượng tâm mạc
♦ Ảnh hưởng mỡ thượng mạc lên động mạch vành qua cơ chế cận tiết và cơ chế nội tiết – mạch máu
EAT ảnh hưởng trực tiếp đến quá trình xơ vữa động mạch vành do vị trí giải phẫu tiếp xúc gần nhau, dẫn đến kích hoạt các con đường viêm thông qua tác dụng cận tiết và cơ chế nội tiết – mạch máu (vasocrine) 31. Quá trình này gây ra rối loạn chức năng nội mô, làm giảm sản xuất oxit nitric, tăng đông máu và tăng sinh tế bào cơ trơn mạch máu 23. Sự hiện diện của quá trình viêm lớp EAT đã được chứng minh khi sinh thiết những bệnh nhân bệnh động mạch vành đã phẫu thuật bắc cầu mạch vành. Ở những bệnh nhân này, khi sinh thiết lớp EAT ghi nhận gia tăng đáng kể của yếu tố điều hòa IL-1, IL-6, MCP-1, yếu tố hoại tử khối u (TNF-α), tế bào lympho T, tế bào mast, và đại thực bào được quan sát thấy trong EAT so với lớp mỡ dưới da26.
Hơn nữa, sự thay đổi chức năng cận tiết của EAT, tăng sản xuất các adipokine gây viêm như leptin, resistin, protein hóa học monophage-1 và IL-8, thúc đẩy sự di chuyển và kích hoạt bạch cầu đơn nhân vào các đại thực bào, từ đó giải phóng thêm cytokine làm gia tăng tình trạng viêm32. Liên quan giữa mô mỡ và hệ thống tim mạch là hai chiều, với các tín hiệu mạch máu ảnh hưởng trực tiếp đến sinh bệnh học mô mỡ 33 (Hình 4)
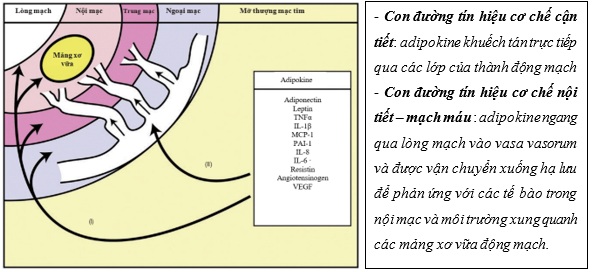
Hình 4: Cơ chế lớp EAT tiết adipokine liên quan xơ vữa động mạch vành8
♦ Ảnh hưởng của mỡ thượng tâm mạc và tiến trình viêm và xơ vữa động mạch
Ở điều kiện sinh lý bình thường, mỡ thượng tâm mạc có nhiều vai trò quan trọng. Tuy nhiên, khi tình trạng bệnh lý, như trong bệnh béo phì, làm tăng lượng mỡ thượng tâm mạc, nhiều thay đổi xảy ra. Những thay đổi này thường được đặc trưng bởi phì đại mô mỡ, giảm lưu trữ chất béo, tăng lipolysis và viêm 34. Khi gia tăng mỡ thượng tâm mạc, lớp này trở nên thiếu oxy và gây rối loạn chức năng , làm tăng tâm nhập đại thực bào và tế bào lympho T, dẫn đến rối loạn trao đổi chất. Kết quả là tăng tiết các cytokine gây viêm như TNF-α, MCP-1, IL-1β, IL-6 và nhiều loại khác góp phần vào quá trình viêm đặc trưng của xơ vữa động mạch 35, cũng như giảm bài tiết các adipokine chống xơ vữa động mạch như adiponectin 36. Trong những trường hợp này, tác dụng có lợi của EAT bị mất, những thay đổi làm rối loạn chức năng đóng vai trò gây ra tình trạng viêm cục bộ, ảnh hưởng đến sự phát triển và tiến triển của mảng xơ vữa động mạch vành. Ngoài ra, dựa trên chụp cắt lớp phát xạ positron sử dụng 18F-FDG (fluorodeoxyucose) cũng chứng minh quá trình viêm lớp EAT. Mức độ hấp thu FDG của tế bào có liên quan đến tốc độ trao đổi chất của tế bào và số lượng chất vận chuyển glucose37. Các tế bào viêm làm gia tăng các chất vận chuyển glucose. Trong một nghiên cứu bệnh chứng, giữa 35 bệnh nhân không đái tháo đường có bệnh mạch vành và nhóm chứng gồm 35 bệnh nhận không mắc bệnh mạch vành. Hai nhóm được chụp PET-CT với 18F-FDG (fluorodeoxyucose). Ở nhóm CAD, mỡ thượng mạc hấp thu nhiều 18F-FDG hơn so với ngưỡng bình thường và cao hơn so với mỡ biểu mô vị trí khác. Đồng thời mỡ thượng mạc ở nhóm bệnh mạch vành hấp thu 18F-FDG nhiều hơn ở nhóm chứng và mức độ hấp thu 18F-FDG tương quan với mức độ nặng CAD 38.
Theo cơ sở sinh lý bệnh cổ điển “từ trong ra ngoài”, xơ vữa động mạch là kết quả của một tổn thương đối với các tế bào nội mô nội mô do sự tích tụ hậu quả của các tế bào viêm ở lớp dưới nội mạc39. Tuy nhiên, EAT có thể góp phần gây xơ vữa động mạch đã dẫn đến giả thuyết “từ ngoài vào trong” về cơ chế viêm mạch máu, theo đó quá trình này bắt đầu lớp EAT sau đó lan truyền vào bên trong mạch máu 40. Theo giả thuyết này, các tình trạng căng thẳng, chẳng hạn như dư thừa năng lượng quá mức, đề kháng insulin và bệnh đái tháo đường có thể gây ra những thay đổi kiểu hình của lớp EAT như: phì đại mô mỡ, giảm dự trữ triglyceride, tăng lipolysis và giải phóng các axit béo tự do, và hình thành quá trình viêm 34 (Hình 5). Tiến trình viêm liên quan đến tất cả các giai đoạn CAD, từ xơ vữa động mạch sớm đến sự tiến triển của tổn thương xơ vữa động mạch, và cuối cùng là vỡ mảng bám và huyết khối xơ vữa động mạch 41.
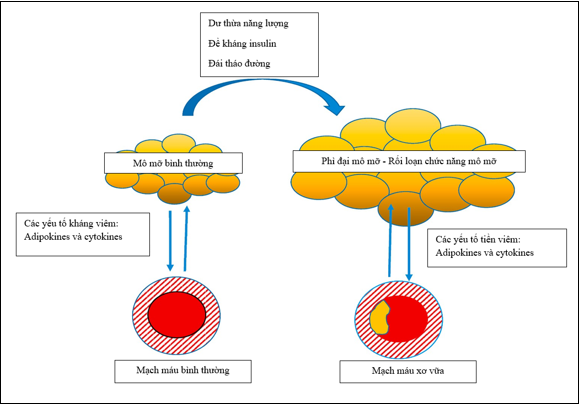
Hình 5: Liên quan giữa EAT/PCAT và xơ vữa động mạch21
3. Hình ảnh đa phương thức đánh giá mỡ thượng tâm mạc
3.1 Siêu âm tim:
Siêu âm tim qua lồng ngực là một kỹ thuật đơn giản, giá thành thấp, dễ tiếp cận và sẵn có để đo lường lớp mỡ thượng mạc. Trên siêu âm tim có thể phân biệt giữa mỡ thượng mạc và mỡ màng ngoài tim (Hình 6). Mỡ thượng mạc tim được xác định là khoảng giảm hồi âm giữa thành ngoài của cơ tim và lá tạng màng ngoài tim. Ngược lại, mỡ màng ngoài tim là khoang hồi âm kém trước lớp mỡ thượng mạc và lá thành màng ngoài tim. Mỡ màng ngoài tim không thay đổi bề dày đáng kể trong chu chuyển tim, tuy nhiên, thay đổi về độ dày không phải là một tiêu chuẩn tốt để phân biệt giữa hai lớp này15.
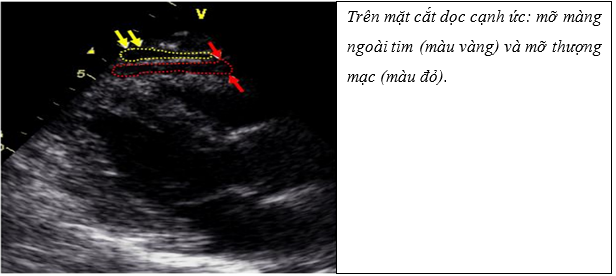
Hình 6: Mỡ thượng mạc và mỡ màng ngoài tim trên siêu âm15
Độ dày EAT thường được đo theo góc nhìn trục dọc cạnh ức, vuông góc dọc theo thành tự do của thất phải ở cuối thì tâm thu, trung bình qua 3 chu chuyển tim(Hình 7) 15. Hiện nay, chưa có ngưỡng tham chiếu cụ thể của bề dày lớp mỡ thượng mạc trên siêu âm. Bề dày lớp này thay đổi từ 1mm đến tối đa gần 23 mm và có mối liên quan giữa bề dày mỡ thượng mạc với phân bố mỡ nội tạng bụng42.
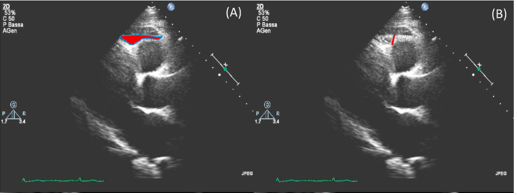
Hình 7: Phương pháp đo bề dày lớp mỡ màng ngoài tim trên siêu âm21
Theo nghiên cứu của tác giả Iacobellis và cộng sự, thực hiện siêu âm tim qua thành ngực ghi nhận độ dày lớp mỡ biểu mô trung bình là 7 mm ở nam giới và 6,5 mm15. Tương tự, nghiên cứu của tác giả Natale và cộng sự trên 50 tình nguyện viên khỏe mạnh cùng đề xuất ngưỡng giới hạn trên cho bề dày lớp EAT là 7 mm43. Độ dày EAT trên siêu âm tim cũng liên quan với mức độ nghiêm trọng của bệnh mạch vành cũng như hiện diện của mảng xơ vữa nguy cơ cao 44,45. Tuy nhiên, siêu âm tim 2D không đánh giá được thể tích EAT và hình ảnh siêu âm tim phần lớn phụ thuộc vào cửa sổ khảo sát, có thể không tối ưu ở bệnh nhân béo phì 36.
3.2 Cộng hưởng từ tim
Cộng hưởng từ tim (CMR) là một trong phương tiện tốt để khảo sát tổng lượng mỡ cơ thể, đặc biệt là mỡ thượng mạc tim. Dựa vào sự tương phản giữa lớp mỡ thượng tâm mạc, mỡ màng ngoài tim so với cơ tim và các cấu trúc xung quanh trên cộng hưởng từ, do đó cho phép dễ dàng đánh giá và định lượng thể tích của EAT 46. Hơn nữa, ưu điểm của cộng hưởng từ không gây ra phơi nhiễm bức xạ và không cần sử dụng thuốc tương phản. Tuy nhiên, hạn chế của cộng hưởng từ là không sẵn có và chi phí cao. Hơn nữa, cộng hưởng từ cũng không phù hợp ở những bệnh nhân sợ hội chứng lồng kín và mang thiết bị cấy ghép.
CMR sử dụng các chuỗi xung khác nhau có thể được sử dụng để đánh giá mỡ thượng tâm mạc. Các nghiên cứu cho thấy chuỗi xung máu đen T1 spin-echo là phương pháp tin cậy để định lượng mỡ thượng tâm mạc 47. CMR thường sử dụng để đánh giá thể tích và chức năng thất, và còn đánh giá chính xác và có thể định lượng mỡ thượng tâm mạc48. Có nhiều phương pháp định lượng mỡ màng tim trên CMR. Năm 2007, tác giả S. Flüchter và cộng sự nghiên cứu cách tính thể tích mỡ thượng tâm mạc trên cộng hưởng từ. Khối lượng EAT được tính trên CMR bằng cách vẽ đường viền lớp mỡ thượng tâm mạc ở cuối thì tâm trương ở các lát trục ngắn; sau đó được nhân với độ dày lát cắt để tính tổng thể tích và khối lượng EAT 49. Gần đây, tác giả Cristobal-Huerta đề xuất phương pháp tự động đánh giá thể tích EAT từ hình ảnh CMR không sử dụng thuốc tương phản50.
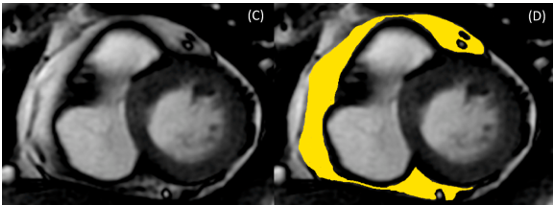
Hình 8: Định lượng mỡ thượng tâm mạc trên cộng hưởng từ tim48
3.3. Chụp cắt lớp vi tính mạch vành
Chụp cắt lớp vi tính mạch vành (CCTA) hiện là phương pháp được ưu tiên để đánh giá mỡ thượng mạc tim so với các phương thức hình ảnh khác như siêu âm tim hoặc cộng hưởng từ. Bởi vì CCTA có độ phân giải không gian cao và cho phép khảo sát ba chiều và dễ tiếp cận, chi phí hợp lý51.
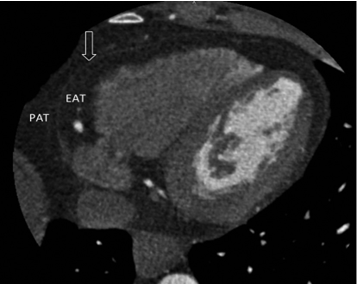
Hình 9: Hình ảnh mỡ quanh tim trên chụp cắt lớp vi tính20
(EAT: mỡ thượng tâm mạc. PAT: mỡ cạnh tim)
Chụp cắt lớp vi tính không sử dụng chất tương phản thường được sử dụng để tính điểm vôi hóa mạch vành ở bệnh nhân không có triệu chứng và nguy cơ tim mạch thấp – trung bình. Trong khi đó, theo các khuyến cáo của Trường môn tim mạch Hoa Kỳ và Hiệp Hội tim Châu Âu, chụp cắt lớp vi tính động mạch vành tim (CCTA) có tiêm thuốc tương phản là phương tiện hình ảnh đầu tay để chẩn đoán bệnh mạch vành. CCTA không chỉ đánh giá mức độ hẹp mạch vành, mà còn đánh giá được đặc điểm mảng xơ vữa động mạch và xác định được mảng xơ vữa nguy cơ cao. Ngoài ra, CCTA đánh giá được hình ảnh cây động mạch vành và lớp mỡ bao quanh, cho thấy mối liên quan giữa xơ vữa động mạch và mỡ quanh mạch vành (Hình 9). Nhược điểm chính của CTTA là tiếp xúc với bức xạ ion hóa và nguy cơ tổn thương thận của chất tương phản iốt. Tuy nhiên, với sự phát triển về cấu hình máy, hiện nay đã giảm đáng kể phơi nhiễm bức xạ liên quan đến CCTA trong hơn thập kỷ qua. Định lượng mỡ thượng mạc tim qua chụp cắt lớp vi tính mạch vành với ngưỡng Houfield từ – 190 đến -30 HU. Với ngưỡng HU này, chúng ta sẽ nhận diện được mỡ màng tim gồm: mỡ thượng mạc tim và mỡ màng ngoài tim. Hiện nay, các nghiên cứu cho thấy đánh giá mỡ thượng mạc tim được thực hiện bán tự động52. Phần mềm máy tính sẽ tự động xác định tổng khối lượng EAT của tất cả các lát cắt, và người đọc sẽ đánh giá và hiệu chỉnh lại lần 2 sau đó53 (Hình 10).
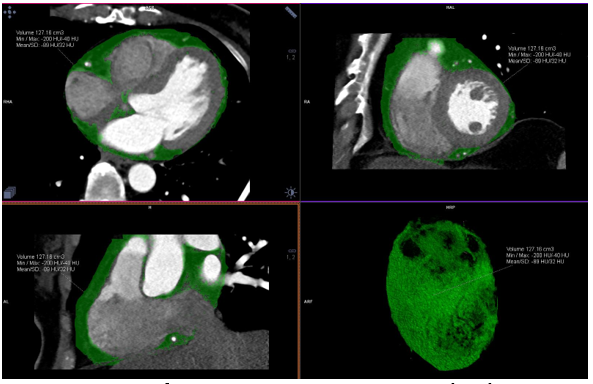
Hình 10: Đo lường thể tích mỡ thượng tâm mạc dựa trên phần mềm Syngo.via (thực hiện tại bệnh viện đa khoa Tâm Anh)
Vì việc đo EAT thông thường bằng các phương pháp bán tự động khá tốn thời gian, một số giải pháp phần mềm đã được phát triển để đo lường tự động, đặc biệt là đo lường lớp mỡ quanh mạch vành (PCAT) (Hình 11). Các nghiên cứu chứng minh rằng trong sự hiện diện của viêm mạch máu, các cytokine tiền viêm khuếch tán vào mô mỡ quanh mạch vành và ức chế sự biệt hóa của tế bào tiền mỡ (pre-adipocyte). Điều này dẫn đến các tế bào mỡ nhỏ hơn, kèm hàm lượng lipid thấp và hàm lượng nước cao hơn. Ngoài ra, sự hiện diện của nước trong không gian ngoại bào làm gia tăng chất lỏng trong PCAT . Những thay đổi hình thái này trong PCAT dẫn đến giảm đậm độ mô mỡ quanh mạch vành trên CT, có thể được định lượng được36.
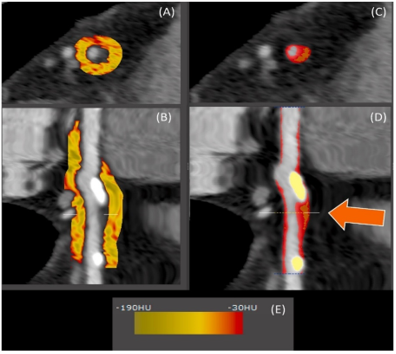
Hình 11: Phương pháp định lượng tự động PCAT và xơ vữa vôi hóa ở đoạn gần LAD21
Tóm lại, siêu âm tim, cộng hưởng từ tim (CMR) và chụp vi tính mạch vành có thể được sử dụng để đánh giá lớp mỡ thượng tâm mạc. Những ưu điểm và nhược điểm của từng phương tiện được tóm tắt trong (Bảng 1).
Bảng 1: So sánh các phương pháp hình ảnh học trong đánh giá mỡ thượng tâm mạc21
| Ưu điểm/ Nhược điểm | Siêu âm tim | MRI tim | CT mạch vành |
| Dễ tiếp cận | +++ | + | ++ |
| Đánh giá được độ dày lớp mỡ thượng tâm mạc | + | ++ | ++ |
| Đánh giá được thể tích lớp mỡ thượng tâm mạc | 0 | +++ | ++ |
| Đánh giá động mạch vành và mô mỡ quanh vành | 0 | 0 | +++ |
| Ảnh hưởng tia xạ | 0 | 0 | + |
| Giá thành | + | +++ | ++ |
4. Mối liên quan giữa thể tích mỡ thượng mạc tim và mức độ hẹp mạch vành
Một số nghiên cứu đã ghi nhận mối tương quan thuận giữa thể tích mỡ thượng tâm mạc với bệnh động mạch vành.
Năm 2013, nghiên cứu của tác giả Ronak Rajani54 khảo sát mối tương quan giữa thể tích mỡ thượng mạc với mức độ hẹp mạch vành và mảng xơ vữa nguy cơ cao. Nghiên cứu thực hiện trên 402 bệnh nhân không có tiền sử bệnh động mạch vành, được chụp cắt lớp vi tính mạch vành. Tác giả đo thể tích mỡ thượng tâm mạc (EFV) bằng phần mềm bán tự động. Mảng xơ vữa được đánh giá: xơ vữa vôi hóa, xơ vữa không vôi, xơ vữa vôi hóa một phần , xơ vữa nguy cơ cao và cuối cùng đánh giá mức độ hẹp mạch vành. Kết quả ghi nhận, thể tích mỡ thượng tâm mạc cao hơn ở nhóm có xơ vữa cao so với nhóm không có xơ vữa, thể tích lần lượt là: 108 ± 53 cm3 và 89 ± 41 cm3 (p <0.001). Khi phân tích EFV ở từng đặc điểm mảng xơ vữa ghi nhận kết quả tương tự: nhóm xơ vữa vôi hóa ( EFV 112 ± 55 cm3 so với nhóm không vôi hóa 89 ± 39 cm3), xơ vữa vôi hóa một phần (EFV 110 ± 57 cm3 so với không xơ vữa 98 ± 45 cm3 ) và nhóm xơ vữa không vôi (EFV 115 ± 44 cm3 so với nhóm không xơ vữa 100 ± 52 cm3). Tác giả phân tích hồi qui đa biến trên 192 bệnh nhân có xơ vữa, sau khi điều chỉnh các yếu tố nguy cơ tim mạch, EFV là yếu tố nguy cơ tiên lượng độc lập về hẹp nặng ≥ 70% đường kính động mạch vành (OR = 3.0, CI 95% 1,3–6.6, p = 0.008). Thể tích mỡ thượng mạc cũng liên quan đến mảng xơ vữa nguy cơ cao (OR 1.7, CI 95% 0.9–3.4, p = 0.04).
Năm 2015, tác giả James V Spearman, thực hiện phân tích gộp trên 9 nghiên cứu, với mục đích đánh giá thể tích mỡ thượng tâm mạc trong tiên lượng bệnh mạch vành55. Kết quả ghi nhận thể tích mỡ thượng tâm mạc liên quan biến cố lâm sàng, và có giá trị tiên lượng tốt hơn điểm vôi hóa mach vành. Nghiên cứu chỉ ra ngưỡng thể tích mỡ thượng mạc 125cm3 có giá trị dự đoán lớn nhất các biến cố tim mạch trong tương lai.
Năm 2018, tác giả Rishabh Khurana thực hiện nghiên cứu cắt ngang trên 950 bệnh nhân nghi ngờ mắc bệnh động mạch vành tại Ấn Độ. Mục đich nghiên cứu tìm ra mối tương quan giữa thể tích mỡ thượng tâm mạc và bệnh mạch vành. Thể tích mỡ thượng mạc được định lượng bằng kỹ thuật bán tự động trên chụp CT mạch vành đa dãy. Ngoài ra, trên CCTA đánh giá sự hiện diện của các mảng xơ vữa động mạch và mức độ hẹp mạch vành. Kết qủa nghiên cứu ghi nhận thể tích mỡ thượng tâm mạc cao hơn ở nhóm bệnh nhân hẹp động mạch vành. Thể tích mỡ thượng tâm mạc ở nhóm có bệnh mạch vành và bệnh mạch vành tắc nghẽn lần lượt là 49,75 và 67,69 mL với diện tích dưới đường cong, độ nhạy, độ đặc hiệu, giá trị tiên đoán dương, giá trị tiên đoán âm và độ chính xác chẩn đoán lần lượt là: 0,68, 81%, 45,9%, 58,24%, 72,2% và 62,84% và 0,709, 64,9%, 66,4%, 35,84%, 86,55% và 66%. Thể tích mỡ thượng tâm mạc tương quan với tuổi, cân nặng và chỉ số khối cơ thể (BMI). Ngoài ra, phân tích đa biến cho thấy thể tích mỡ thượng tâm mạc là một yếu tố nguy cơ độc lập của bệnh động mạch vành.
Năm 2020, tác giả Evann Eisenberg và cộng sự56, thực hiện nghiên cứu trên 2068 bệnh nhân không có triệu chứng (tuổi trung bình 56±9, 59% nam) được lấy từ thử nghiệm EISNER (xác định sớm xơ vữa động mạch bằng nghiên cứu hình ảnh không xâm lấn) đánh giá thể tích mỡ thượng tâm mạc và điểm vôi hóa mạch vành trong tiên lượng biến cố tim mạch. Bệnh nhân được chụp vi tính lồng ngực không tiêm thuốc tương phản. Thể tích mỡ thượng mạc được đánh giá tự động bằng phần mềm deep – learning. Biến cố tim mạch chính (MACE) được định nghĩa là nhồi máu cơ tim, tái tưới máu muộn (>180 ngày) và tử vong do tim. Thể tích mỡ thượng tâm mạc được so sánh điểm vôi hóa mạch vành và nguy cơ xơ vữa động mạch để dự đoán MACE. Kết quả ghi nhận, 223 bệnh nhân (10.7%) xuất hiện biến cố chính. Kết quả ghi nhận: nguy cơ xơ vữa động mạch, điểm vôi hóa mạch vành và thể tích mỡ thượng tâm mạc đều làm tăng nguy cơ mắc MACE lần lượt là OR = 1.03; 95% CI[1.01–1.04]; OR = 1.25; (95% CI[1.19–1.30]; và OR = 1.35 [1.07–1.68], p<0.01). Nguy cơ MACE tăng khi thể tích EAT ≥113 cm3 và điểm vôi hóa mạch vành ≥100 AU và cao nhất ở những đối tượng có cả hai (p<0.02). Phân tích dưới nhóm với 1317 bệnh nhân ghi nhận thể tích EAT có tương quan với các dấu ấn sinh học gây viêm như CRP, myeloperoxidase và giảm adiponectin.
5. Kết luận:
Bình thường, mỡ thượng tâm mạc có nhiều vai trò quan trọng, và có tác dụng bảo vệ cao vì nó giải phóng rất nhiều phân tử chống viêm. Tuy nhiên, ở tình trạng bệnh lý, mỡ thượng tâm mạc bị rối loạn chức năng và tiết ra các adipokine gây viêm, góp phần trong tiến trình xơ vữa mạch vành. Có nhiều phương thức chẩn đoán hình ảnh không xâm lấn giúp định lượng mỡ thượng tâm mạc. Trong đó, chụp cắt lớp vi tính là một trong những phương pháp giúp định lượng mỡ thượng mạc với độ chính xác và tính lặp lại cao. Thể tích mỡ thượng tâm mạc cơ thể xem như một dấu ấn sinh học độc lập trong đánh giá nguy cơ của xơ vữa mạch vành. Tuy nhiên, còn cần nhiều nghiên cứu trong tương lai nhằm tìm giá trị ngưỡng, thống nhất giữa các phần mềm tính toán tự động của các hãng khác nhau với mục tiêu chính phòng ngừa và điều trị sớm bệnh lý xơ vữa mạch vành.
TÀI LIỆU THAM KHẢO
- Finegold JA, Asaria P, Francis DP. Mortality from ischaemic heart disease by country, region, and age: statistics from World Health Organisation and United Nations. International journal of cardiology. 2013;168(2):934-945.
- Virani SS, Alonso A, Aparicio HJ, et al. Heart disease and stroke statistics-2021 update: a report from the American Heart Association. Circulation. 2021;
- Zhao D. Epidemiological features of cardiovascular disease in Asia. JACC: Asia. 2021;1(1):1-13.
- Torabi A, Cleland JG, Rigby AS, Sherwi N. Development and course of heart failure after a myocardial infarction in younger and older people. Journal of geriatric cardiology: JGC. 2014;11(1):1.
- Verhagen SN, Visseren FL. Perivascular adipose tissue as a cause of atherosclerosis. Atherosclerosis. 2011;214(1):3-10.
- Gaborit B, Sengenes C, Ancel P, Jacquier A, Dutour-Meyer A. Role of epicardial adipose tissue in health and disease: a matter of fat? Comprehensive physiology. 2017;7(3):317 p.
- Schoettl T, Fischer IP, Ussar S. Heterogeneity of adipose tissue in development and metabolic function. Journal of Experimental Biology. 2018;221(Suppl_1):jeb162958.
- Sacks HS, Fain JN. Human epicardial adipose tissue: a review. American heart journal. 2007;153(6):907-917.
- Mahabadi AA, Massaro JM, Rosito GA, et al. Association of pericardial fat, intrathoracic fat, and visceral abdominal fat with cardiovascular disease burden: the Framingham Heart Study. European heart journal. 2009;30(7):850-856.
- Tamarappoo B, Dey D, Shmilovich H, et al. Increased pericardial fat volume measured from noncontrast CT predicts myocardial ischemia by SPECT. JACC: Cardiovascular Imaging. 2010;3(11):1104-1112.
- Xu Y, Cheng X, Hong K, Huang C, Wan L. How to interpret epicardial adipose tissue as a cause of coronary artery disease: a meta-analysis. Coronary artery disease. 2012;23(4):227-233.
- Bos D, Shahzad R, van Walsum T, et al. Epicardial fat volume is related to atherosclerotic calcification in multiple vessel beds. European Heart Journal-Cardiovascular Imaging
2015;16(11):1264-1269.
- Goeller M, Achenbach S, Cadet S, et al. Pericoronary adipose tissue computed tomography attenuation and high-risk plaque characteristics in acute coronary syndrome compared with stable coronary artery disease. JAMA cardiology. 2018;3(9):858-863.
- Antonopoulos AS, Antoniades C. The role of epicardial adipose tissue in cardiac biology: classic concepts and emerging roles. The Journal of physiology. 2017;595(12):3907-3917.
- Iacobellis G, Willens HJ. Echocardiographic epicardial fat: a review of research and clinical applications. Journal of the American Society of Echocardiography. 2009;22(12):1311-1319.
- Salazar J, Luzardo E, Mejías JC, et al. Epicardial fat: physiological, pathological, and therapeutic implications. Cardiology research
practice. 2016;2016(1):1291537.
- Calle EE, Thun MJ, Petrelli JM, Rodriguez C, Heath Jr CW. Body-mass index and mortality in a prospective cohort of US adults. J New England Journal of Medicine. 1999;341(15):1097-1105.
- Van Gaal LF, Mertens IL, De Block CE. Mechanisms linking obesity with cardiovascular disease. Nature clinical practice Cardiovascular medicine. 2006;444(7121):875-880.
- Fantuzzi G, Mazzone T. Adipose tissue and atherosclerosis: exploring the connection. Arteriosclerosis, thrombosis,
vascular biology. 2007;27(5):996-1003.
- Talman AH, Psaltis PJ, Cameron JD, Meredith IT, Seneviratne SK, Wong DT. Epicardial adipose tissue: far more than a fat depot. Cardiovascular diagnosis
therapy. 2014;4(6):416.
- Guglielmo M, Lin A, Dey D, et al. Epicardial fat and coronary artery disease: Role of cardiac imaging. Atherosclerosis. 2021;321:30-38.
- Corradi D, Maestri R, Callegari S, et al. The ventricular epicardial fat is related to the myocardial mass in normal, ischemic and hypertrophic hearts. Cardiovascular Pathology. 2004;13(6):313-316.
- Shirani J, Berezowski K, Roberts WC. Quantitative measurement of normal and excessive (cor adiposum) subepicardial adipose tissue, its clinical significance, and its effect on electrocardiographic QRS voltage. The American journal of cardiology
1995;76(5):414-418.
- Iacobellis G, Corradi D, Sharma AM. Epicardial adipose tissue: anatomic, biomolecular and clinical relationships with the heart. Nature clinical practice Cardiovascular medicine. 2005;2(10):536-543.
- Bambace C, Telesca M, Zoico E, et al. Adiponectin gene expression and adipocyte diameter: a comparison between epicardial and subcutaneous adipose tissue in men. Cardiovascular Pathology. 2011;20(5):e153-e156.
- Mazurek T, Zhang L, Zalewski A, et al. Human epicardial adipose tissue is a source of inflammatory mediators. Circulation. 2003;108(20):2460-2466.
- Rabkin S. Epicardial fat: properties, function and relationship to obesity. Obesity reviews. 2007;8(3):253-261.
- Chechi K, Richard D. Thermogenic potential and physiological relevance of human epicardial adipose tissue. International journal of obesity supplements. 2015;5(1):S28-S34.
- Iacobellis G. Epicardial adipose tissue in endocrine and metabolic diseases. Endocrine. 2014;46:8-15.
- Lin A, Dey D, Wong DT, Nerlekar N. Perivascular adipose tissue and coronary atherosclerosis: from biology to imaging phenotyping. Current atherosclerosis reports. 2019;21:1-12.
- Mancio J, Azevedo D, Saraiva F, et al. Epicardial adipose tissue volume assessed by computed tomography and coronary artery disease: a systematic review and meta-analysis. European Heart Journal-Cardiovascular Imaging. 2018;19(5):490-497.
- Knudson JD, Dick GM, Tune JD. Adipokines and coronary vasomotor dysfunction. Experimental biology
medicine. 2007;232(6):727-736.
- Oikonomou EK, Antoniades C. The role of adipose tissue in cardiovascular health and disease. Nature Reviews Cardiology. 2019;16(2):83-99.
- Ansaldo AM, Montecucco F, Sahebkar A, Dallegri F, Carbone F. Epicardial adipose tissue and cardiovascular diseases. International journal of Cardiology. 2019;278:254-260.
- Mazurek T, Zhang L, Zalewski A, et al. Human epicardial adipose tissue is a source of inflammatory mediators. 2003;108(20):2460-2466.
- Antonini-Canterin F, Pellegrinet M, Marinigh R, Favretto G. Role of cardiovascular ultrasound in the evaluation of obese subjects. Journal of cardiovascular echography. 2014;24(3):67-71.
- Love C, Tomas MB, Tronco GG, Palestro CJ. FDG PET of infection and inflammation. Radiographics. 2005;25(5):1357-1368.
- Mazurek T, Kobylecka M, Zielenkiewicz M, et al. PET/CT evaluation of 18F-FDG uptake in pericoronary adipose tissue in patients with stable coronary artery disease: independent predictor of atherosclerotic lesions’ formation? Journal of Nuclear Cardiology. 2017;24(3):1075-1084.
- Kawabe J-i, Hasebe N. Role of the vasa vasorum and vascular resident stem cells in atherosclerosis. BioMed research international. 2014;2014
- Britton K, Fox C. Perivascular adipose tissue and vascular disease. Clinical lipidology. 2011;6(1):79-91.
- Libby P, Ridker PM, Maseri A. Inflammation and atherosclerosis. Circulation. 2002;105(9):1135-1143.
- Sade LE, Eroglu S, Bozbaş H, et al. Relation between epicardial fat thickness and coronary flow reserve in women with chest pain and angiographically normal coronary arteries. 2009;204(2):580-585.
- Natale F, Tedesco MA, Mocerino R, et al. Visceral adiposity and arterial stiffness: echocardiographic epicardial fat thickness reflects, better than waist circumference, carotid arterial stiffness in a large population of hypertensives. European Journal of Echocardiography. 2009;10(4):549-555.
- Ahn S-G, Lim H-S, Joe D-Y, et al. Relationship of epicardial adipose tissue by echocardiography to coronary artery disease. 2008;94(3):e7-e7.
- Le Jemtel TH, Samson R, Ayinapudi K, Singh T, Oparil S. Epicardial adipose tissue and cardiovascular disease. Current hypertension reports. 2019;21:1-11.
- Bogaert J, Francone M. Cardiovascular magnetic resonance in pericardial diseases. Journal of Cardiovascular Magnetic Resonance. 2009;11(1):14.
- Ng AC, Strudwick M, van der Geest RJ, et al. Impact of epicardial adipose tissue, left ventricular myocardial fat content, and interstitial fibrosis on myocardial contractile function. Circulation: Cardiovascular Imaging. 2018;11(8):e007372.
- Nelson MR, Mookadam F, Thota V, et al. Epicardial fat: an additional measurement for subclinical atherosclerosis and cardiovascular risk stratification? Journal of the American Society of Echocardiography. 2011;24(3):339-345.
- Flüchter S, Haghi D, Dinter D, et al. Volumetric assessment of epicardial adipose tissue with cardiovascular magnetic resonance imaging. Obesity reviews. 2007;15(4):870-878.
- Cristobal-Huerta A, Torrado-Carvajal A, Malpica N, Luaces M, Hernandez-Tamames JA. Automated quantification of epicardial adipose tissue in cardiac magnetic resonance imaging. IEEE; 2015:7308-7311.
- Marwan M, Koenig S, Schreiber K, et al. Quantification of epicardial adipose tissue by cardiac CT: Influence of acquisition parameters and contrast enhancement. European journal of radiology. 2019;121:108732.
- Nerlekar N, Baey Y-W, Brown AJ, et al. Poor correlation, reproducibility, and agreement between volumetric versus linear epicardial adipose tissue measurement: a 3D computed tomography versus 2D echocardiography comparison. JACC: Cardiovascular Imaging. 2018;11(7):1035-1036.
- Hell MM, Achenbach S, Schuhbaeck A, Klinghammer L, May MS, Marwan M. CT-based analysis of pericoronary adipose tissue density: Relation to cardiovascular risk factors and epicardial adipose tissue volume. Journal of cardiovascular computed tomography. 2016;10(1):52-60.
- Rajani R, Shmilovich H, Nakazato R, et al. Relationship of epicardial fat volume to coronary plaque, severe coronary stenosis, and high-risk coronary plaque features assessed by coronary CT angiography. Journal of cardiovascular computed tomography. 2013;7(2):125-132.
- Spearman JV, Renker M, Schoepf UJ, et al. Prognostic value of epicardial fat volume measurements by computed tomography: a systematic review of the literature. European radiology. 2015;25:3372-3381.
- Eisenberg E, McElhinney PA, Commandeur F, et al. Deep learning–based quantification of epicardial adipose tissue volume and attenuation predicts major adverse cardiovascular events in asymptomatic subjects. Circulation: Cardiovascular Imaging. 2020;13(2):e009829.







