Viện Tim TP HCM
Thử nghiệm lâm sàng thường được xem là xương sống của y học chứng cứ. Nếu được thực hiện đúng phương pháp, thử nghiệm lâm sàng phân nhóm ngẫu nhiên có chứng (randomized controlled trial) cung cấp chứng cứ đáng tin cậy nhất về hiệu quả và lợi ích của một thuốc hay liệu pháp mới 1,2. Tuy nhiên trên thực tế không phải thử nghiệm lâm sàng nào, ngay cả thử nghiệm lâm sàng có kết quả được đăng trên các báo uy tín, cũng được thực hiện đúng phương pháp. Ngoài ra, kết quả của thử nghiệm lâm sàng đôi khi được diễn giải không đúng. Trong bài này, người viết trình bày một số sai lệch đã xảy ra trên thực tế trong thiết kế, báo cáo và diễn giải kết quả của thử nghiệm lâm sàng.
CHỌN CHUẨN SO SÁNH KHÔNG PHÙ HỢP
Năm 2001, Richter và cộng sự công bố một nghiên cứu trên báo “The American Journal of Gastroenterology” so sánh hiệu quả làm lành tổn thương viêm thực quản và giảm triệu chứng của esomeprazole và omeprazole trong bệnh trào ngược dạ dày-thực quản 3. Thử nghiệm lâm sàng này cho thấy esomeprazole có hiệu quả làm lành tổn thương viêm thực quản cao hơn có ý nghĩa so với omeprazole (tỉ lệ lành 93,7% so với 84,2%, p < 0,001). Kết quả này đã đóng góp nhiều vào thành công về mặt thương mại của esomeprazole. Điều này không có gì đáng bàn nếu như trong nghiên cứu này liều dùng của 2 thuốc tương đương. Tuy nhiên trong nghiên cứu này liều esomeprazole là 40 mg/ngày trong khi liều omeprazole chỉ là 20 mg/ngày. Có thể xem đây là một ví dụ điển hình về việc chọn chuẩn so sánh không phù hợp.
Một ví dụ khác là thử nghiệm lâm sàng COMET (Carvedilol Or Metoprolol European Trial) so sánh hiệu quả cải thiện dự hậu của carvedilol và metoprolol ở bệnh nhân suy tim mạn 4. COMET cho thấy carvedilol giảm có ý nghĩa tử vong so với metoprolol (34% so với 40%, p = 0,0017). Tuy nhiên trong nghiên cứu này carvedilol được dùng với liều đích 25 mg x 2/ngày là liều đã được chứng minh là giảm tử vong của bệnh nhân suy tim mạn 5. Trong khi đó, metoprolol được dùng là metoprolol tartrate (dạng tác dụng ngắn) với liều đích 50 mg x 2/ngày, hoàn toàn khác với dạng và liều đích được dùng trong MERIT-HF (Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure) là nghiên cứu đã chứng minh metoprolol giảm tử vong của bệnh nhân suy tim mạn (Trong MERIT-HF dạng metoprolol được dùng là metoprolol succinate tác dụng kéo dài và liều đích là 200 mg/ngày 6).
KHÔNG TUÂN THỦ NGUYÊN TẮC “MÙ”
Một thử nghiệm lâm sàng mà trong quá trình tiến hành cả bác sĩ điều trị lẫn bệnh nhân đều không biết bệnh nhân đang dùng thuốc nghiên cứu hay dùng placebo được gọi là thử nghiệm lâm sàng “mù đôi” (double-blind). Biện pháp “mù đôi” giúp tránh được những nhận định thiên vị của bác sĩ điều trị lẫn bệnh nhân về thuốc nghiên cứu, do đó được xem là một trong những nguyên tắc chính phải tuân thủ khi tiến hành thử nghiệm lâm sàng. Vi phạm nguyên tắc này có thể làm cho kết quả của thử nghiệm lâm sàng bị sai lệch mà trường hợp sau đây là một ví dụ.
Rosiglitazone là một thuốc hạ đường huyết nhóm thiazolidinedione, có một thời được dùng rất phổ biến để điều trị bệnh đái tháo đường týp 2. Tháng 5/2007 hai nhà nghiên cứu Steven Nissen và Kathy Wolski công bố một phân tích gộp trên báo “The New England Journal of Medicine” cho thấy rosiglitazone làm tăng nguy cơ nhồi máu cơ tim (OR = 1,43, p = 0,03) và nguy cơ chết do nguyên nhân tim mạch (OR = 1,64, p = 0,06) 7. Tháng 7/2007 ủy ban chuyên viên của FDA (Food and Drug Administration – Cơ quan quản lý thực phẩm và thuốc Hoa Kỳ) họp và kết luận rosiglitazone có liên quan với tăng nguy cơ thiếu máu cục bộ tim, tuy nhiên ủy ban quyết định vẫn duy trì rosiglitazone trên thị trường 8. Ủy ban cũng cho biết sẽ chờ để có thêm thông tin về tính an toàn tim mạch của rosiglitazone từ những nghiên cứu đang tiến hành mà quan trọng nhất trong số đó là RECORD (Rosiglitazone Evaluated for Cardiac Outcomes and Regulation of Glycemia in Diabetes). Sau đó ít lâu, FDA đã buộc nhà sản xuất phải thêm phần cảnh báo về tác dụng phụ gây thiếu máu cục bộ tim (black box warning) trên nhãn hộp thuốc.
Tháng 6/2009 RECORD được công bố trên báo “The Lancet”, cho thấy rosiglitazone không tăng nguy cơ chết do nguyên nhân tim mạch (HR = 0,84, KTC 95% 0,59-1,18) cũng như nguy cơ nhồi máu cơ tim (HR = 1,14, KTC 95% 0,80-1,63) 9. RECORD là một thử nghiệm lâm sàng phân nhóm ngẫu nhiên đa trung tâm có cỡ mẫu lớn (n = 4447) nhưng được tiến hành theo kiểu nhãn mở (open-label) tức là hoàn toàn không có “mù”, do đó người của GSK (công ty tài trợ nghiên cứu) lẫn Quintiles (công ty theo dõi và điều phối việc thu thập số liệu) đều nắm được mã hồ sơ của bệnh nhân. Dựa vào kết quả RECORD, GSK đã đề nghị FDA cho gỡ bỏ phần cảnh báo trên nhãn hộp thuốc. FDA giao cho một chuyên viên là BS Thomas Marciniak xem lại toàn bộ dữ liệu của nghiên cứu RECORD. Qua điều tra, BS Marciniak phát hiện có 15 trường hợp nhồi máu cơ tim (10 trường hợp ở nhóm rosiglitazone và 5 trường hợp ở nhóm chứng) đã bị ban chỉ đạo nghiên cứu (steering committee) gạt ra khi thống kê số liệu. BS Marciniak cho rằng “RECORD được thiết kế và tiến hành không phù hợp với mục tiêu là chứng minh tính an toàn tim mạch của rosiglitazone” và “Kết quả RECORD gợi ý rosiglitazone làm tăng nguy cơ nhồi máu cơ tim” 10. Phần cuối của câu chuyện về rosiglitazone thì mọi người chúng ta đã biết. Bài học quan trọng rút ra từ trường hợp này là nếu như RECORD được tiến hành theo đúng nguyên tắc “mù đôi” thì có lẽ nguy cơ tim mạch của rosiglitazone đã được khẳng định sớm hơn và các cơ quan quản lý dược đã không phải chờ đến gần đây mới cấm lưu hành thuốc này.
KHÔNG TUÂN THỦ NGUYÊN TẮC “ITT”
Rofecoxib là một thuốc ức chế chọn lọc cyclooxygenase-2 đã từng được dùng rất phổ biến để điều trị kháng viêm và giảm đau. Năm 2000 kết quả nghiên cứu VIGOR (VIoxx Gastrointestinal Outcomes Research) so sánh hiệu quả của rofecoxib và naproxen trên bệnh nhân viêm khớp dạng thấp được công bố, cho thấy tần suất nhồi máu cơ tim ở nhóm rofecoxib cao hơn có ý nghĩa so với nhóm naproxen (0,4% so với 0,1%) 11. Để giải thích điều này, các tác giả VIGOR cho rằng naproxen có tác dụng bảo vệ tim tương tự aspirin (ức chế 95% sự sinh thromboxane và ức chế 88% sự kết tập tiểu cầu) chứ không phải rofecoxib làm tăng nguy cơ nhồi máu cơ tim 11. Thử nghiệm lâm sàng APPROVe (Adenomatous Polyp PRevention On Vioxx) là một cơ hội tốt để đánh giá ảnh hưởng tim mạch của rofecoxib vì nghiên cứu này so sánh hiệu quả của rofecoxib với placebo trong việc ngừa tái phát u adenoma đại trực tràng. Kết quả APPROVe công bố năm 2005 cho thấy rofecoxib tăng có ý nghĩa nguy cơ bị các biến cố huyết khối tim mạch (nhồi máu cơ tim, đau thắt ngực không ổn định, đột tử do nguyên nhân tim, đột quị, cơn thiếu máu não thoáng qua, huyết khối động mạch ngoại vi, huyết khối tĩnh mạch và thuyên tắc phổi) so với placebo 12. Trên hình 1 là các đường Kaplan-Meier biểu diễn tần suất dồn các biến cố huyết khối tim mạch ở 2 nhóm rofecoxib và placebo theo báo cáo của nhóm nghiên cứu APPROVe. Trong 18 tháng đầu 2 đường biểu diễn trùng nhau, kể từ tháng thứ 18 2 đường mới tách rời nhau. Dựa vào kết quả này, có ý kiến cho rằng rofecoxib chỉ làm tăng nguy cơ tim mạch nếu được dùng kéo dài, còn nếu dùng không quá 18 tháng thì nguy cơ tim mạch không tăng. Có một điểm đáng lưu ý là khi phân tích kết quả ở nhóm dùng rofecoxib, các nhà nghiên cứu đã loại những biến cố huyết khối tim mạch xảy ra hơn 14 ngày sau khi ngưng thuốc.
GS Steven Nissen chỉ ra rằng cách thống kê này vi phạm nguyên tắc ITT (viết tắt của “Intention-to-treat analysis”) của thử nghiệm lâm sàng. Theo nguyên tắc ITT, nếu từ đầu bệnh nhân được phân vào một nhóm thì khi phân tích kết quả bệnh nhân vẫn được giữ nguyên ở nhóm đó, biến cố kết cục được tính bất kể bệnh nhân có dùng thuốc nghiên cứu hay không 2. GS Nissen đã phân tích lại số liệu APPROVe theo nguyên tắc ITT 13. Kết quả phân tích được biểu diễn trên hình 2: Hai đường Kaplan-Meier biểu diễn tần suất dồn các biến cố huyết khối tim mạch tách rời nhau rất sớm, chứng tỏ nguy cơ tim mạch liên quan với dùng rofecoxib xuất hiện từ rất sớm chứ không phải đợi đến tháng thứ 18.
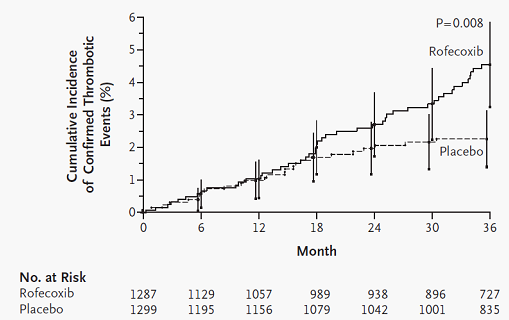
Hình 1: Tần suất dồn các biến cố huyết khối tim mạch theo báo cáo của nhóm nghiên cứu APPROVe.
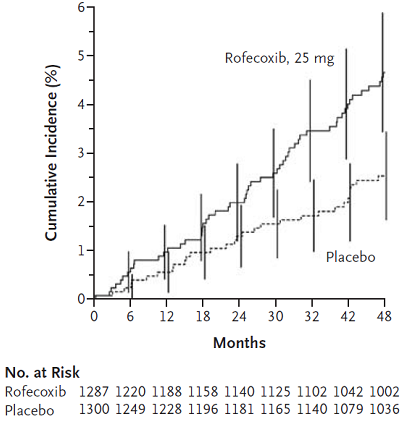
Hình 2: Tần suất dồn các biến cố huyết khối tim mạch theo tính toán của Nissen.
DÙNG TIÊU CHÍ ĐÁNH GIÁ PHỐI HỢP KHÔNG THÍCH HỢP
Trong nhiều thử nghiệm lâm sàng, nếu chỉ lấy biến cố chết làm tiêu chí đánh giá chính thì cỡ mẫu phải rất lớn và/hoặc thời gian theo dõi phải rất dài, dẫn đến tăng chi phí một cách đáng kể. Để giảm bớt chi phí, nhiều nhà nghiên cứu sử dụng tiêu chí đánh giá phối hợp (composite end points) là phối hợp biến cố chết với một số biến cố khác. Ví dụ, trong các nghiên cứu trên bệnh nhân mạch vành, tiêu chí đánh giá phối hợp thường được dùng là chết + nhồi máu cơ tim + đột quị, còn trong các nghiên cứu trên bệnh nhân suy tim, tiêu chí đánh giá phối hợp thường được dùng là chết + nhập viện vì suy tim tăng nặng. Tiêu chí đánh giá phối hợp lý tưởng phải thỏa các tiêu chuẩn sau: (1) các thành phần có tầm quan trọng ngang nhau; (2) các thành phần xảy ra với một tần suất tương tự nhau; (3) các thành phần đều chịu ảnh hưởng như nhau từ thuốc (liệu pháp) được nghiên cứu 14. Trên thực tế, hiếm khi cả 3 tiêu chuẩn này được thỏa mãn. Dưới đây là một số ví dụ minh họa.
Thử nghiệm lâm sàng TYPHOON (Trial to Assess the Use of the Cypher Stent in Acute Myocardial Infarction Treated with Balloon Angioplasty) được thiết kế nhằm so sánh hiệu quả của stent phủ sirolimus và stent không phủ thuốc trong can thiệp mạch vành qua da tiên phát ở bệnh nhân nhồi máu cơ tim cấp với ST chênh lên 15. Tiêu chí đánh giá chính là phối hợp các biến cố chết, nhồi máu cơ tim tái phát và tái tưới máu mạch vành đích sau 1 năm. Kết quả TYPHOON cho thấy tần suất các biến cố thuộc tiêu chí đánh giá chính của nhóm stent phủ sirolimus thấp hơn có ý nghĩa so với nhóm stent không phủ thuốc (7,3% so với 14,3%, p = 0,004). Tuy nhiên khi phân tích từng thành phần của tiêu chí đánh giá chính (xem bảng 1), ta có thể ghi nhận 2 điểm sau: (1) Tái tưới máu mạch vành đích là biến cố xảy ra với tần suất cao nhất ở cả 2 nhóm; (2) Tiêu chí đánh giá chính giảm ở nhóm stent phủ sirolimus chủ yếu là do giảm số biến cố tái tưới máu mạch vành đích ở nhóm này, trong khi số biến cố chết và nhồi máu cơ tim tái phát ở 2 nhóm tương đương. Xét về tầm quan trọng lâm sàng, tái tưới máu mạch vành đích không thể xếp ngang hàng với chết và nhồi máu cơ tim tái phát. Nghiên cứu TYPHOON là một ví dụ về việc dùng tiêu chí đánh giá phối hợp không thích hợp do gom những thành phần có tầm quan trọng lâm sàng khác nhau và cơ chế bệnh sinh khác nhau (tái tưới máu mạch vành đích thường là do tái hẹp, mà tái hẹp thì rất hiếm khi dẫn đến chết).
Bảng 1: Các biến cố lâm sàng trong nghiên cứu TYPHOON.
|
|
Stent phủ sirolimus (n = 355) |
Stent không thuốc (n = 357) |
Trị số p |
|
Phối hợp các biến cố |
26 (7,3%) |
51 (14,3%) |
0,004 |
|
Chết |
8 (2,3%) |
8 (2,2%) |
1,00 |
|
Nhồi máu cơ tim tái phát |
4 (1,1%) |
5 (1,4%) |
1,00 |
|
Tái tưới máu mạch vành đích |
20 (5,6%) |
48 (13,4%) |
< 0,001 |
Một ví dụ khác là nghiên cứu CREST (Carotid Revascularization Endarterectomy vs Stenting Trial). CREST được thiết kế nhằm so sánh hiệu quả của đặt stent động mạch cảnh và phẫu thuật bóc lớp áo trong động mạch cảnh ở bệnh nhân hẹp động mạch cảnh có triệu chứng hoặc không 16. Tiêu chí đánh giá chính là phối hợp các biến cố chết, đột quị và nhồi máu cơ tim quanh thủ thuật/phẫu thuật. Kết quả CREST cho thấy: (1) Tần suất các biến cố thuộc tiêu chí đánh giá chính của 2 nhóm không khác biệt; (2) Nhóm đặt stent có tần suất đột quị cao hơn và tần suất nhồi máu cơ tim thấp hơn có ý nghĩa so với nhóm phẫu thuật (xem bảng 2). Nếu dựa vào kết quả này để kết luận đặt stent và phẫu thuật mang lại lợi ích ngang nhau (kiểu “bù qua sớt lại”) thì sẽ không đúng vì 2 biến cố đột quị và nhồi máu cơ tim trong nghiên cứu này có tầm quan trọng lâm sàng khác nhau. Đột quị là biến cố để lại di chứng rất nặng nề, trong khi nhồi máu cơ tim được xác định chủ yếu dựa vào tăng CK-MB hoặc troponin ít nhất 2 lần giới hạn trên kèm với đau ngực hoặc thay đổi điện tim (nhiều bệnh nhân được chẩn đoán nhồi máu cơ tim theo tiêu chuẩn này chỉ có một vùng nhồi máu nhỏ không để lại hậu quả đáng kể về mặt lâm sàng).
Bảng 2: Các biến cố lâm sàng trong nghiên cứu CREST.
|
|
Đặt stent (n = 1262) |
Phẫu thuật (n = 1240) |
Trị số p |
|
Phối hợp các biến cố |
66 (5,2%) |
56 (4,5%) |
0,38 |
|
Chết |
9 (0,7%) |
4 (0,3%) |
0,18 |
|
Đột quị |
52 (4,1%) |
29 (2,3%) |
0,01 |
|
Nhồi máu cơ tim |
14 (1,1%) |
28 (2,3%) |
0,03 |
DIỄN GIẢI KHÔNG ĐÚNG KẾT QUẢ CỦA PHÂN TÍCH PHÂN NHÓM
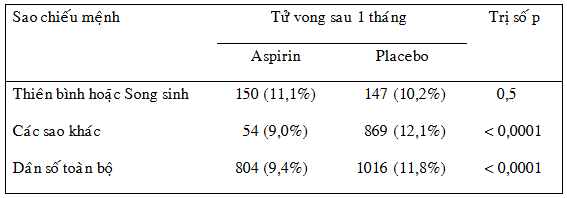
Khi phân tích kết quả của một thử nghiệm lâm sàng, đôi khi nhà nghiên cứu thực hiện những phân tích phân nhóm (subgroup analysis) để đánh giá hiệu quả của liệu pháp nghiên cứu ở những phân nhóm khác nhau xét theo giới (hiệu quả của liệu pháp ở nam và nữ có giống nhau hay không), tuổi (hiệu quả của liệu pháp ở người lớn tuổi và người trẻ có giống nhau hay không), mức độ nặng của bệnh (ví dụ hiệu quả của liệu pháp ở bệnh nhân suy tim NYHA III-IV và bệnh nhân suy tim NYHA I-II có giống nhau hay không) v.v… Cần thận trọng khi diễn giải kết quả của phân tích phân nhóm, nhất là khi phân tích cho thấy liệu pháp nghiên cứu có lợi ở một phân nhóm nhưng không có lợi ở một phân nhóm khác. Khi dân số nghiên cứu bị chia thành càng nhiều phân nhóm, việc diễn giải kết quả càng dễ bị sai lệch. Ví dụ sau đây minh họa điều này: ISIS-2 (Second International Study of Infarct Survival) là một thử nghiệm lâm sàng đánh giá hiệu quả của aspirin trong nhồi máu cơ tim cấp. Kết quả ISIS-2 cho thấy aspirin giảm có ý nghĩa tử vong tim mạch của bệnh nhân nhồi máu cơ tim cấp (804 ca chết trong số 8587 người được phân cho dùng aspirin so với 1016 ca chết trong số 8600 người được phân cho dùng placebo, p < 0,0001)17. Nếu chia dân số những bệnh nhân tham gia ISIS-2 thành 12 phân nhóm dựa vào sao chiếu mệnh theo cung Hoàng Đạo (Zodiac) của từng người và thực hiện phân tích kết quả theo từng phân nhóm, ta sẽ có được kết quả như trên bảng 3, tức là aspirin giảm tử vong ở mọi phân nhóm trừ 2 phân nhóm có sao chiếu mệnh Thiên bình (Libra) và Song sinh (Gemini) 2. Không cần bàn sâu hơn ta cũng thấy thật là phi lý nếu kết luận rằng aspirin có lợi đối với bệnh nhân nhồi máu cơ tim cấp trừ những người có sao chiếu mệnh Thiên bình hoặc Song sinh.
Bảng 3: Phân tích kết quả của nghiên cứu ISIS-2 theo 12 phân nhóm có sao chiếu mệnh khác nhau.
Trên thực tế, việc diễn giải không đúng kết quả của phân tích phân nhóm không phải là hiếm gặp. Ví dụ mới đây nhất là việc FDA chậm thông qua chỉ định dùng ticagrelor trong hội chứng mạch vành cấp. Ticagrelor là một thuốc kháng tiểu cầu mới dạng uống, có tác dụng ức chế trực tiếp thụ thể P2Y12 của tiểu cầu và không thuộc nhóm thienopyridine. Trong thử nghiệm lâm sàng PLATO (Study of Platelet Inhibition and Patient Outcomes), hiệu quả của ticagrelor được so sánh với clopidogrel trên 18.624 bệnh nhân nhập viện vì hội chứng mạch vành cấp 18. Kết quả PLATO cho thấy ticagrelor giảm có ý nghĩa các biến cố chết, nhồi máu cơ tim và đột quị so với clopidogrel. Dựa vào kết quả PLATO, tháng 12/2010 EMA (European Medicines Agency – Cơ quan quản lý dược phẩm Châu Âu) đã chấp thuận việc dùng ticagrelor cho bệnh nhân hội chứng mạch vành cấp 19. Tuy nhiên cùng thời điểm này FDA đã không thông qua chỉ định dùng ticagrelor cho bệnh nhân hội chứng mạch vành cấp. Lý do được đưa ra là ở phân nhóm bệnh nhân người Mỹ tham gia PLATO (khoảng 1400 người), ticagrelor cho kết quả xấu hơn clopidogrel (trong khi những bệnh nhân còn lại thuộc Châu Âu, Châu Á, Nam Mỹ, Úc và Nam Phi đều hưởng lợi từ ticagrelor). Mãi đến gần đây (tháng 7/2011) FDA mới chấp thuận việc dùng ticagrelor cho bệnh nhân hội chứng mạch vành cấp. Giải thích quyết định này, ủy ban chuyên viên của FDA nhìn nhận rằng kết quả ở phân nhóm bệnh nhân người Mỹ có nhiều khả năng là do yếu tố ngẫu nhiên 20.
Có một số hướng dẫn được các chuyên gia về phương pháp học đưa ra để đánh giá và diễn giải kết quả của phân tích phân nhóm 14,21. Các hướng dẫn này được tóm tắt trên bảng 4.
Bảng 4: Hướng dẫn cách đánh giá và diễn giải kết quả của phân tích phân nhóm.
|
– Các phân nhóm có được xác định ngay từ đầu hay không? Giá trị của phân tích phân nhóm giảm nếu các phân nhóm không được xác định ngay từ đầu lúc phân ngẫu nhiên mà được xác định sau khi nghiên cứu đã hoàn tất. – Việc chia phân nhóm có một cơ sở sinh học hay sinh lý bệnh học hay không? – Nếu phân tích phân nhóm cho thấy liệu pháp nghiên cứu có lợi ở một phân nhóm nhưng không có lợi ở một phân nhóm khác, xem trị số p của phép kiểm tương tác (interaction). – Nếu phân tích phân nhóm cho thấy liệu pháp nghiên cứu có lợi ở một phân nhóm nào đó, không vội kết luận là liệu pháp có lợi ở những đối tượng có đặc tính của phân nhóm đó. |
Nói tóm lại, những thông tin trình bày ở trên cho thấy nhiều thử nghiệm lâm sàng, kể cả những thử nghiệm lâm sàng có kết quả đăng trên các báo lớn nhiều uy tín, có những sai lệch trong thiết kế và báo cáo kết quả và việc diễn giải kết quả của thử nghiệm lâm sàng không phải bao giờ cũng đúng. Điều này đặt ra cho các cơ quan quản lý dược phẩm trách nhiệm giám sát chặt chẽ việc thiết kế và tiến hành các thử nghiệm lâm sàng đánh giá hiệu quả của thuốc mới, bao gồm kiểm tra các số liệu gốc trong trường hợp có nghi ngờ về độ tin cậy của kết quả. Về phía bác sĩ thực hành, việc nắm vững kỹ năng đọc và phân tích bài báo rất cần để chắt lọc được những thông tin đáng tin cậy và thực sự hữu ích từ khối lượng rất lớn những thông tin xuất hiện ngày càng nhiều trong y văn.
TÀI LIỆU THAM KHẢO
1) Califf RM. Considerations in the design, conduct, and interpretation of quantitative clinical evidence. In: Textbook of cardiovascular medicine, ed. Topol EJ. Lippincott-Raven Publishers, Philadelphia, 1998:1063-1081.
2) Collins R, MacMahon S. Reliable assessment of the effects of treatment on mortality and major morbidity, I: clinical trials. Lancet 2001;357:373-380.
3) Richter JE, Kahrilas PJ, Johanson J, et al. Efficacy and safety of esomeprazole compared with omeprazole in GERD patients with erosive esophagitis: a randomized, controlled trial. Am J Gastroenterol 2001; 96: 656-65.
4) Poole-Wilson PA, Swedberg K, Cleland JG, et al. Comparison of carvedilol and metoprolol on clinical outcomes in patients with chronic heart failure in the Carvedilol Or Metoprolol European Trial (COMET): randomised controlled trial. Lancet 2003;362:7-13.
5) Packer M, Bristow MR, Chon JN, et al, for the US Carvedilol Heart Failure Study Group. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. N Engl J Med 1996;334:13491355.
6) MERIT-HF Study Group. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet 1999;353:2001-2007.
7) Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med 2007;356:2457-2471.
8) Rosen CJ. The rosiglitazone story – lessons from an FDA Advisory Committee meeting. N Engl J Med 2007;357:844-846.
9) Home PD, Pocock SJ, Beck-Nielsen H, et al, for the RECORD Study Team. Rosiglitazone evaluated for cardiovascular outcomes in oral agent combination therapy for type 2 diabetes (RECORD): a multicentre, randomised, open-label trial. Lancet 2009;373:2125-2135.
10) Marciniak TA. Cardiovascular events in the RECORD trial. www.fda.gov/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/EndocrinologicandMetabolicDrugsAdvisoryCommittee/ucm218481.htm
11) Bombardier C, Laine L, Reicin A, et al, for the VIGOR Study Group. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. N Engl J Med 2000; 343: 1520-1528.
12) Bresalier RS, Sandler RS, Quan H, et al, for the APPROVe Trial Investigators. Cardiovascular events associated with rofecoxib in a colorectal adenoma chemoprevention trial. N Engl J Med 2005;352:1092-1102.
13) Nissen SE. Adverse cardiovascular effects of rofecoxib. N Engl J Med 2006;355:203-204.
14) Kaul S, Diamond GA. Trial and error: How to avoid commonly encountered limitations of published clinical trials. J Am Coll Cardiol 2010;55:415-427.
15) Spaulding C, Henry P, Teiger E, et al, for the TYPHOON Investigators. Sirolimus-eluting versus uncoated stents in acute myocardial infarction. N Engl J Med 2006;355:1093-1104.
16) Brott TG, Hobson RW, Howard G, et al, for the CREST Investigators. Stenting versus endarterectomy for treatment of carotid-artery stenosis. N Engl J Med 2010;363:11-23.
17) ISIS-2 (Second International Study of Infarct Survival) Collaborative Group. Randomised trial of intravenous streptokinase, oral aspirin, both, or neither among 17.187 cases of suspected acute myocardial infarction: ISIS-2. Lancet 1988;2:349-360.
18) Wallentin L, Becker RC, Budaj A, et al, for the PLATO Investigators. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009;361:1045-1057.
19) Ticagrelor approved in Europe for ACS patients. www.theheart.org/article/1160179.do
20) Ticagrelor: The view from the FDA. www.medscape.com/viewarticle/747175
21) Freemantle N. Interpreting the results of secondary end points and subgroup analyses in clinical trials: Should we lock the crazy aunt in the attic? BMJ 2001;322:989-991.







