TS. PHẠM HỮU VĂN
(…)
Chương 2: ICD dự phòng nguyên phát
2.1. Bệnh động mạch vành (CAD)
Giả định và Cân nhắc
Trong trường hợp không có VT dai dẳng/VF hoặc ngất, việc cấy ICD phòng ngừa tiên phát có thể được xem xét trong nhiều tình huống khác nhau để giảm tỷ lệ tử vong liên quan đến rối loạn nhịp thất dai dẳng có khả năng đe dọa tính mạng. Các khoảng thời gian cụ thể để cấy ICD phòng ngừa tiên phát (ví dụ: 40 ngày sau nhồi máu cơ tim cấp, 3 tháng sau tái thông mạch và 3 tháng sau chẩn đoán khởi đầu về bệnh cơ tim) được mô tả. Các khoảng thời gian này được lựa chọn cho tài liệu hướng dẫn sử dụng phù hợp này dựa trên các thử nghiệm lâm sàng trước đây, các tài liệu hướng dẫn, [4] tuyên bố đồng thuận [7] hoặc thực tiễn đương đại. Một “giai đoạn chờ đợi” sau nhồi máu cơ tim được hỗ trợ bằng thử nghiệm IRIS (Immediate Risk-Stratification Improves Survival: Sống sót cải thiện ngay khi phân tầng nguy cơ) và DINAMIT (Defibrillator IN Acute Myocardial Infarction Trial: Khử rung tim trong nghiên cứu nhồi máu cơ tim cấp), cho thấy không có lợi ích về tỷ lệ sống sót tổng thể nào từ liệu pháp ICD khi các thiết bị được cấy rất sớm (trong vòng 30 hoặc 40 ngày) sau nhồi máu cơ tim. [41,51,52] Các kịch bản trong phần này cũng được điều chỉnh bằng LVEF, phân loại chức năng NYHA, thời điểm sau nhồi máu cơ tim và/hoặc thời gian điều trị nội khoa (Bảng 2.1.1 đến 2.1.6, Hình 9 và 10).
Bảng 2.1.1 Sau MI cấp (≤ 40 Days) LVEF ≤30%
| Các chỉ định | Điểm sử dụng phù hợp (1-9 | |
| Tài tuần hoàn sau nhồi máu cơ tim cấp | ||
| 74 | ■ không NST | R(2) |
| 75 | ■ NSVT không triệu chứng (≥ 4 ngày sau MI)
■ Không thực hiện EPS |
R(3) |
| 76 | ■ NSVT không triệu chứng (≥ 4 ngày sau MI)
■ EPS với VT kéo dài có thể gây ra (EPS được thực hiện sau tái tuần hoàn, trong vòng 40 ngày sau MI) |
A (7) |
| 77 | ■ NSVT không triệu chứng (≥ 4 ngày sau nhồi máu cơ tim)
■ EPS không có VT có thể gây ra (EPS được thực hiện sau khi tái thông mạch, trong vòng 40 ngày sau nhồi máu cơ tim) |
R(3) |
| 78 | ■ NSVT không triệu chứng (<4 ngày sau nhồi máu cơ tim) | R (3) |
| Không được tái thông mạch vành
Bệnh động mạch vành tắc nghẽn có giải phẫu mạch vành không thể tái thông mạch vành |
||
| 79 | ■ Không có NSVT | R(2) |
| 80 | ■ NSVT không triệu chứng (4 ngày sau nhồi máu cơ tim)
■ Không thực hiện EPS |
M(4) |
| 81 | ■ NSVT không triệu chứng (4 ngày sau nhồi máu cơ tim)
■ EPS có VT kéo dài có thể gây ra (EPS được thực hiện trong vòng 40 ngày sau nhồi máu cơ tim) |
A(8) |
| 82 | ■ NSVT không triệu chứng (4 ngày sau nhồi máu cơ tim)
■ EPS không có VT có thể gây ra (EPS được thực hiện trong vòng 40 ngày sau nhồi máu cơ tim) |
M(4) |
| 83 | ■ NSVT không triệu chứng (<4 ngày sau nhồi máu | R(3) |
A = Phù hợp; CAD = bệnh động mạch vành; EPS = thăm dò điện sinh lý; LVEF = phân suất tống máu thất trái; M = Có thể phù hợp; MI = nhồi máu cơ tim; NSVT = nhịp nhanh thất không kéo dài; R = Hiếm khi phù hợp; VT = nhịp nhanh thất.
Bảng 2.1.2 Sau MI cấp (≤ 40 Days) LVEF 31% to 40%
| Các chỉ định | Điểm sử dụng phù hợp (1-9) | |
| Tái thông mạch máu cho bệnh nhồi máu cơ tim cấp tính | ||
| 84 | ■ Không có NSVT | R(2) |
| 85 | ■ NSVT không triệu chứng (4 ngày sau nhồi máu cơ tim)
■ Không thực hiện EPS |
R(3) |
| 86 | ■ NSVT không triệu chứng (4 ngày sau nhồi máu cơ tim)
■ EPS có VT kéo dài có thể gây ra (EPS được thực hiện sau khi tái thông mạch, trong vòng 40 ngày sau nhồi máu cơ tim) |
A(7) |
| 87 | ■ NSVT không triệu chứng (4 ngày sau nhồi máu cơ tim)
■ EPS không có VT có thể gây ra (EPS được thực hiện sau khi tái thông mạch, trong vòng 40 ngày sau nhồi máu cơ tim) |
R(3) |
| 89 | 88. n NSVT không triệu chứng (<4 ngày sau nhồi máu cơ tim) | R(3) |
A = Phù hợp; EPS = thăm dò điện sinh lý; LVEF = phân suất tống máu thất trái; MI = nhồi máu cơ tim; NSVT = nhịp nhanh thất không kéo dài; R = Hiếm khi phù hợp; VT = nhịp nhanh thất.
Thời điểm sau nhồi máu cơ tim hoặc tái thông mạch và xét nghiệm EP
Các thử nghiệm ICD phòng ngừa tiên phát ban đầu đã sử dụng xét nghiệm EP trong phân tầng nguy cơ. Nhiều kịch bản trong Bảng 2.1.1 đến 2.1.4 xem xét một số khoảng thời gian ngắn hơn sau nhồi máu cơ tim (≤40 ngày) khi dữ liệu thử nghiệm có sẵn còn hạn chế. Định nghĩa về nhồi máu cơ tim đã phát triển trong những năm gần đây. [37,38,53] Đối với thực hành hiện đại, chẩn đoán nhồi máu cơ tim nên được thực hiện theo tuyên bố mới nhất, và các thử nghiệm trong tương lai nên xác định chính xác nhồi máu cơ tim và các chẩn đoán khác quan trọng đối với các tiêu chí ban đầu chính. Việc thiếu lợi ích về tỷ lệ tử vong từ ICD đã được thấy trong DINAMIT, MUSTT đã tuyển chọn bệnh nhân bệnh mạch vành, LVEF ≤ 40% và VT tạm thời không triệu chứng, [51] và các yếu tố liên quan đến rối loạn nhịp tim cần điều trị bằng ICD cũng liên quan đến nguy cơ tử vong cao không phải đột tử, làm mất đi lợi ích của ICD rất sớm sau nhồi máu cơ tim. [51] MUSTT (Multicenter Unsustained Tachycardia Trial: Thử nghiệm nhịp nhanh tạm thời đa trung tâm) đã tuyển chọn bệnh nhân bệnh mạch vành, LVEF ≤ 40% và nhịp nhanh thất tạm thời không triệu chứng. [54] Rối loạn nhịp tim đủ điều kiện phải xảy ra ≤ 6 tháng trước khi tham gia và ≥ 4 ngày sau cơn nhồi máu cơ tim gần đây nhất hoặc thủ thuật tái thông mạch. Thử nghiệm cho thấy liệu pháp hướng dẫn bằng điện sinh lý với ICD, nhưng không phải với thuốc chống loạn nhịp, đã làm giảm nguy cơ đột tử; tuy nhiên, > 80% bệnh nhân được chọn ngẫu nhiên đã trải qua cơn nhồi máu cơ tim gần đây nhất >1 tháng trước khi tham gia. Do đó, vì có ít bệnh nhân được tuyển chọn trong tháng đầu tiên sau nhồi máu cơ tim, nên tính hữu ích của nghiên cứu điện sinh lý trong giai đoạn đó là không chắc chắn.
Bảng 2.1.3 Sau nhồi máu cơ tim cấp tính (≤40 ngày) và bệnh cơ tim mãn tính có từ trước (≥3 tháng)
| Các chỉ định | Điểm sử dụng phù hợp (1-9) | |
| 89 | ■ LVEF #30% do nhồi máu cơ tim cũ
■ NYHA class I A (7) |
A(7) |
| 90 | ■ LVEF ≤35% do nhồi máu cơ tim cũ
■ NYHA class II-III |
A(8) |
| 91 | ■ LVEF #35% do nguyên nhân không do thiếu máu cục bộ
■ NYHA class II-III |
A(8) |
A = Phù hợp; LVEF = phân suất tống máu thất trái; MI = nhồi máu cơ tim; NYHA = Hiệp hội Tim New York.
Những kịch bản này cũng được sửa đổi bằng sự hiện diện hoặc không có tái thông mạch. Để đủ điều kiện tham gia, MADIT II (Multicenter Automatic Defibrillator Implantation Trial II: Thử nghiệm cấy máy khử rung tim tự động đa trung tâm II) yêu cầu thời gian chờ đợi ≥ 3 tháng sau khi tái thông mạch vành. [55] Ngược lại, bệnh nhân đủ điều kiện tham gia MUSTT ≥ 4 ngày sau khi tái thông mạch, và 56% bệnh nhân tham gia thử nghiệm này đã trải qua phẫu thuật bắc cầu động mạch vành (CABG) trước đó tại một thời điểm nào đó [54]; tuy nhiên, phân tích hậu kiểm của MUSTT cho thấy sự xuất hiện của NSVT sau phẫu thuật, đặc biệt là trong vòng 10 ngày sau CABG, báo hiệu kết quả tốt hơn nhiều so với khi nó xảy ra trong bối cảnh không phải sau phẫu thuật. [56] Vì có dữ liệu hạn chế liên quan đến test EP rất sớm sau các thủ thuật tái thông mạch, và dữ liệu hiện có cho thấy NSVT (nhịp nhanh thất tạm thời) trong giai đoạn sớm này có thể đại diện cho một yếu tố nguy cơ ít đặc hiệu hơn đối với các sự kiện trong tương lai, nên các quyết định liên quan đến thời điểm test EP nên được cá thể hóa. Cũng như các phần khác trong tài liệu AUC này, các thành viên hội đồng được yêu cầu đánh giá các trường hợp có các khoảng trống trong hướng dẫn và cần tiến hành điều tra thêm.
Bệnh cơ tim (CM) có từ trước hoặc cần đặt máy tạo nhịp (PM) vĩnh viễn
Mặc dù có bệnh cơ tim tồn tại từ trước với LVEF ≤ 35% trong ≥ 3 tháng trước khi nhồi máu cơ tim cấp tính, kết quả của IRIS và DINAMIT không ủng hộ việc cấy ICD thường quy trong vòng 40 ngày sau nhồi máu cơ tim. Tương tự, bệnh cơ tim tồn tại từ trước với LVEF ≤ 35% trong ≥ 3 tháng trước khi tái thông mạch cũng không chỉ ra việc cấy ICD thường quy trong vòng 3 tháng sau khi tái thông mạch, bất kể nguyên nhân là gì. Tiêu chí loại trừ đối với MADIT II yêu cầu thời gian chờ 3 tháng sau khi tái thông mạch vành, [55] và LVEF có thể cải thiện sau khi tái thông mạch; tuy nhiên, khi LVEF giảm nghiêm trọng (≤ 35%) và bệnh nhân cần cấy máy tạo nhịp tim vĩnh viễn sớm (≤ 40 ngày) sau nhồi máu cơ tim hoặc (≤3 tháng) sau khi tái thông mạch, liệu pháp ICD được ưu tiên hơn so với cấy máy tạo nhịp tim (Bảng 2.1.4). Mặc dù những trường hợp này không được đề cập cụ thể trong các thử nghiệm lâm sàng, nhưng đây là một quyết định hợp lý từ quan điểm về chi phí và an toàn cho bệnh nhân. Nếu dự kiến chức năng LV sẽ không cải thiện nhiều hoặc không cải thiện, việc cần thực hiện thủ thuật thứ hai trong vòng 3 tháng sẽ khiến bệnh nhân gặp nguy cơ không cần thiết. Khi bệnh nhân cần cấy máy tạo nhịp sớm (≤ 40 ngày) sau nhồi máu cơ tim, việc cấy cũng được biện minh để tránh chi phí và rủi ro khi cấy ghép máy tạo nhịp tim sau đó thay thế bằng cấy máy khử rung tim sau khoảng thời gian 40 ngày. Trong đăng ký REPLACE, tỷ lệ biến chứng cao là 15,3% đã được quan sát thấy ở những bệnh nhân trải qua việc bổ sung dây dẫn qua tĩnh mạch theo kế hoạch để thay thế hoặc nâng cấp thiết bị có khả năng thực hiện các liệu pháp bổ sung. [57] Những tình huống này được đề cập trong “Tuyên bố đồng thuận của chuyên gia HRS/ACC/AHA năm 2014 về việc sử dụng liệu pháp cấy máy khử rung tim ở những bệnh nhân không được đưa vào hoặc không được đại diện tốt trong các thử nghiệm lâm sàng.”[58]
Bảng 2.1.4 Sau MI (#40 ngày) và nhu cầu điều trị đặt máy tạo nhịp tim theo hướng dẫn Sau MI (ví dụ: SSS, CHB hoặc các chỉ định khác cho máy tạo nhịp tim vĩnh viễn)
| Các chỉ định | Điểm sử dụng phù hợp (1-9) | |
| 92 | ■ LVEF ≤35% A (7) | A(9) |
| 93 | ■ LVEF 36%-40% M (6) | M(6) |
A = Phù hợp; CHB = block tim hoàn toàn; LVEF = phân suất tống máu thất trái; M = Có thể phù hợp; MI = nhồi máu cơ tim; SSS = hội chứng nút xoang bệnh lý.
Bảng 2.1.5 Sau MI (>40 ngày) có bệnh cơ tim thiếu máu cục bộ
| Các chỉ định | Điểm sử dụng phù hợp (1-9) | ||
| Không có PCI hoặc CABG gần đây (≤ tháng) | |||
| NYHA Class | I | II-III | |
| 94 | ■ LVEF ≤30% | A(8) | A(9) |
| 95 | ■ LVEF 31%-35% A (7) A (9) | A(7) | A(9) |
| 96 | ■ LVEF 36%-40%
■ NSVT không triệu chứng ■ Không có EPS M (4) M (4) |
R(3) | M(4) |
| 97 | ■ LVEF 36%-40%
■ NSVT không triệu chứng ■ EPS không có VT/VF gây ra |
||
| 09 | ■ LVEF 36%-40%
■ NSVT không triệu chứng ■ EPS có VT/VF kéo dài gây ra |
A(7) | A(8) |
| PCI hoặc CABG gần đây (≤3 tháng) | Điểm sử dụng phù hợp | ||
| 99 | ■ Không có bệnh cơ tim có trước
■ LVEF ≤35% |
M(4) |
|
| 100 | ■ Bệnh cơ tim có trước
■ LVEF #35% đang điều trị nội khoa theo hướng dẫn trong $ 3 tháng trước khi PCI/CABG |
A(7) |
|
| 101 | ■ LVEF ≤35%
■ Cần phải PPM sau tái thông mạch vành sau khi tái thông (ví dụ: SSS, CHB, hoặc các chỉ định PPM theo hướng dẫn khác) |
A(8) |
|
| 102 | ■ LVEF 36%-40%
■ Cần PPM sau tái thông mạch vành (ví dụ: SSS, CHB, hoặc các chỉ định PPM theo hướng dẫn khác) |
M(6) |
|
A = Phù hợp; CABG = phẫu thuật bắc cầu động mạch vành; CHB = block tim hoàn toàn; EPS = nghiên cứu điện sinh lý; LVEF = phân suất tống máu thất trái; M = Có thể phù hợp; MI = nhồi máu cơ tim; NYHA = Hội Tim New York; NSVT = nhịp nhanh thất tạm thời; PCI = can thiệp động mạch vành qua da; PPM = máy tạo nhịp vĩnh viễn; R = Hiếm khi phù hợp; SSS = hội chứng nút xoang bệnh lý; VF = rung thất; VT = nhịp nhanh thất.
Khoảng thời gian điều trị nội khoa theo hướng dẫn (GDMT)
Nhìn chung, người ta khuyến cáo bệnh nhân nên nhận được khoảng thời gian điều trị nội theo hướng dẫn tiếp sau chẩn đoán mới bệnh cơ tim do thiếu máu hoặc không do thiều máu với hy vọng chức năng LV sẽ được cải thiện. Thử nghiệm SCD-HeFT (Sudden Cardiac Death in Heart Failure Trial: Nghiên cứu đột tử trong suy tim), trong đó bệnh nhân bệnh cơ tim do thiếu máu cục bộ và không do thiếu máu cục bộ với phân độ chức năng NYHA II đến III và LVEF ≤ 35% được phân ngẫu nhiên vào nhóm dùng amiodarone, giả dược hoặc cấy ICD, yêu cầu điều trị nội khoa suy tim trong ≥ 3 tháng trước khi tham gia.[59,60] Các trường hợp ngoại lệ cho việc cấy ICD sớm hơn ở bệnh cơ tim do thiếu máu cục bộ có thể bao gồm NSVT ≥ 4 ngày sau nhồi máu cơ tim với test EP cho thấy VT dai dẳng có thể gây ra (như trong MUSTT) hoặc cần đặt máy tạo nhịp vĩnh viễn sớm sau khi tái thông mạch và LVEF ≤ 35%. Vì các nghiên cứu trước đây không bao gồm ức chế thụ thể SGLT2 và MRAs, nên GDMT trong thời đại hiện nay có thể thậm chí còn hiệu quả hơn trong việc cải thiện cả LVEF và tỷ lệ sống sót.
Bảng 2.1.6 Thời gian điều trị nội khoa theo hướng dẫn (<3 tháng so với ≥ tháng) cho Bệnh cơ tim thiếu máu cục bộ không có nhồi máu cơ tim gần đây (Không chỉ định tái thông mạch vành)
| Các chỉ định | Điểm sử dụng phù hợp (1-9) | |
| 103 | ■ LVEF ≤ 35%
■ Đang điều trị nội khoa theo hướng dẫn trong <3 tháng |
M (5)
|
| 104 | ■ LVEF ≤ 35%
■ Đang điều trị nội khoa theo hướng dẫn trong <3 tháng ■ NSVT ■ EPS có thể gây ra VT dai dẳng |
A (8) |
| 105 | ■ LVEF ≤35%
n Đang điều trị nội khoa theo hướng dẫn trong <3 tháng ■ NSVT ■ EPS không gây ra VT dai dẳng |
M (4) |
| 106 | ■ LVEF ≤35%
n Đang điều trị nội khoa theo hướng dẫn trong ≥ 3 tháng |
A (9) |
A = Phù hợp; EP = thăm dò điện sinh lý; LVEF = phân suất tống máu thất trái; M = Có thể phù hợp; MI = nhồi máu cơ tim; NSVT = nhịp nhanh thất tạm thời; VT = nhịp nhanh thất.
2.2. Bệnh cơ tim không do thiếu máu cục bộ
Các giả định và xem xét
■ Nếu chụp cộng hưởng từ (MRI) được thực hiện như một phần của bối cảnh, người ta giả định được thực hiện tại một trung tâm MRI chuyên nghiệp với các chuyên gia hình ảnh giàu kinh nghiệm.
■ Đối với những người đã trải qua MRI và có hiện tượng tăng cường gadolinium muộn (LGE), nó được phân loại là “có” hoặc “không” (và không được định lượng là trên hoặc dưới một tỷ lệ ngưỡng cụ thể).
■ Giả định đây không phải là bệnh cơ tim mới được chẩn đoán (tức là trong vòng 3 tháng) trừ khi có quy định khác. Nếu thuộc phân loại chức năng NYHA II và blốc nhánh trái (LBBB), giả định bệnh nhân cũng sẽ là ứng cử viên cho CRT nếu phù hợp với tình trạng.
■ Các bối cảnh giả định có bệnh cơ tim nguyên phát không do thiếu máu cục bộ .
■ Đối với GDMT, giả định điều này gồm thuốc chẹn beta, thuốc đối kháng aldosterone (khi có thể), thuốc ức chế men chuyển angiotensin hoặc thuốc chẹn thụ thể angiotensin, hoặc sacubitril-valsartan khi được chỉ định, trừ khi các quyết định khác.
Theo Hướng dẫn năm 2017 của AHA/ACC/HRS về Quản lý Bệnh nhân Rối loạn Nhịp thất và Phòng ngừa Đột Tử Tim, các khuyến cáo về cấy ghép ICD cho bệnh nhân CM không do thiếu máu cục bộ không phụ thuộc vào tuổi. [4] Mặt khác, tuổi ảnh hưởng đến kết quả do các nguyên nhân tử vong đan xen và ảnh hưởng đến các lựa chọn trong việc ra quyết định chung. [61,62] Trong nghiên cứu DANISH (Danish Study to Assess the Efficacy of ICDs in Patients with Non-Ischemic Systolic Heart Failure on Mortality: Nghiên cứu Đan Mạch để Đánh giá Hiệu quả của ICD ở Bệnh nhân Suy tim Tâm thu Không do Thiếu máu cục bộ đối với Tỷ lệ Tử vong), nghiên cứu này không cho thấy lợi ích của liệu pháp ICD vượt trội so với liệu pháp điều trị nội khoa tối ưu, một nghiên cứu phụ cần được diễn giải trong bối cảnh tiêu chí chính là âm tính cho thấy lợi ích đối với bệnh nhân trẻ hơn (≤ 70 tuổi) so với bệnh nhân lớn tuổi hơn. [63,64] Hơn nữa, liệu pháp tối ưu trong nghiên cứu DANISH không gồm sacubitril/valsartan, loại thuốc làm giảm tỷ lệ tử vong thêm 20% so với điều trị bằng thuốc ức chế men chuyển angiotensin. [65] Tương tự, vì các nghiên cứu trước đây không gồm SGLT2I và MRAs, GDMT trong thời đại hiện nay sử dụng các loại thuốc này có thể cải thiện hơn nữa LVEF và tỷ lệ sống sót. Trước những thách thức trong việc xác định những bệnh nhân có nhiều khả năng được hưởng lợi từ liệu pháp ICD, MRI tim đã được sử dụng để phân tầng nguy cơ. Bệnh nhân có LGE có nguy cơ tử vong cao hơn so với những người không có, nhưng thiếu dữ liệu nghiên cứu lâm sàng ngẫu nhiên cho thấy lợi ích của ICD đối với họ. Trong khi các nghiên cứu riêng lẻ [66,67] và phân tích tổng hợp [68] cho thấy LGE xác định những bệnh nhân được hưởng lợi từ liệu pháp ICD, một nghiên cứu phụ của thử nghiệm DANISH chỉ ra bệnh nhân có LGE trên MRI tim có tỷ lệ sống sót giảm so với những người không có LGE, trong khi liệu pháp ICD không cải thiện tỷ lệ sống sót ở bệnh nhân có LGE.[69]
Bệnh cơ tim không do thiếu máu được chẩn đoán mới
Việc quản lý CM mới được chẩn đoán phụ thuộc vào mức độ nghiêm trọng của tình trạng mất bù. Đối với những người ổn định về huyết động, không có dữ liệu nào hỗ trợ lợi ích của việc cấy ghép ICD sớm. [59,69-71] Ví dụ, trong thử nghiệm SCD-HeFT, yêu cầu 3 tháng điều trị nội khoa tối ưu trước khi phân nhóm ngẫu nhiên để nhận ICD, không có sự khác biệt về tỷ lệ sống sót trong năm đầu tiên ở những người được điều trị bằng ICD so với chỉ điều trị nội khoa tối ưu. Khi viêm cơ tim là một nguyên nhân gây ra CM mới được chẩn đoán, có hướng dẫn về cách quản lý [72] nhưng không có dữ liệu thử nghiệm ngẫu nhiên có đối chứng nào liên quan đến việc cấy ghép ICD. Đặc biệt đối với viêm cơ tim tế bào khổng lồ, rối loạn nhịp thất thường gặp và có thể xem xét cấy ICD, [4] nhưng đối với các nguyên nhân khác ngoài bệnh sarcoidosis và bệnh Chagas, các hướng dẫn không đề cập đến, đặc biệt khi không có rối loạn nhịp thất. Khi đã được điều trị nội khoa tối ưu trong 3 tháng, việc cấy ICD được khuyến nghị nếu LVEF vẫn ≤35%. Hiện chưa có thử nghiệm ngẫu nhiên nào nghiên cứu vai trò của liệu pháp ICD ở bệnh nhân ghép tim.
Bệnh cơ tim (CM) không do thiếu máu cần tạo nhịp
Về việc đặt máy tạo nhịp tim trong bệnh cơ tim không do thiếu máu cục bộ, các chỉ định tiêu chuẩn vẫn có hiệu lực. [7] Điều này đặc biệt quan trọng liên quan đến thử nghiệm DANISH, trong đó 58% bệnh nhân ở cả nhóm ICD và nhóm đối chứng đều được thực hiện CRT theo các chỉ định phù hợp. Thực tế, một phần lý do giải thích tỷ lệ tử vong thấp ở cả hai nhóm là CRT chỉ là một thành phần của liệu pháp tối ưu và khi được cung cấp cùng với liệu pháp thuốc tối ưu, kết quả được cải thiện đáng kể, khiến việc bổ sung ICD ít có khả năng mang lại lợi ích hơn nữa.
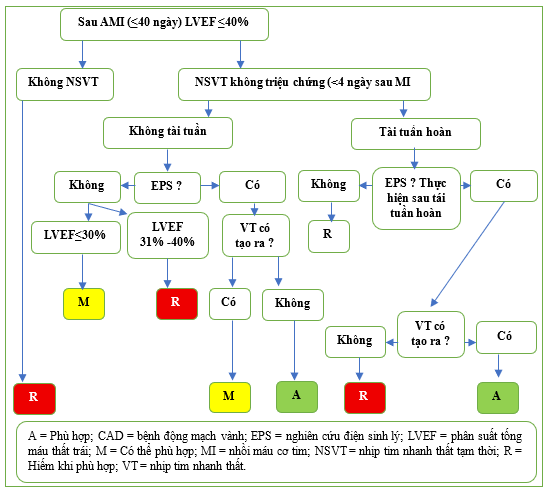 Hình 9 Tóm tắt Bảng 2.1.1 và 2.1.2, Phòng ngừa tiền phát, CAD
Hình 9 Tóm tắt Bảng 2.1.1 và 2.1.2, Phòng ngừa tiền phát, CAD
Bệnh cơ tim (CM) không do thiếu máu, Các Căn nguyên đặc biệt và các điều kiện di truyền
Như đã đề cập trong phần phòng ngừa thứ phát, bệnh cơ tim không do thiếu máu cục bộ không phải là một bệnh duy nhất và có thể có nhiều nguyên nhân. Tính chất mạn tính và khả năng hồi phục cũng như tiên lượng dài hạn có thể khác nhau tùy thuộc vào nguyên nhân cụ thể. Ví dụ, điều trị nội khoa có thể dẫn đến sự hồi phục gần như hoàn toàn với sự tái cấu trúc ngược tâm thất ở bệnh nhân mắc bệnh cơ tim chu sinh hoặc bệnh cơ tim do nhịp tim nhanh, trong khi tiên lượng có thể kém đối với những bệnh nhân mắc một số dạng bệnh cơ tim thâm nhiễm. Các bệnh lý di truyền liên quan đến bệnh cơ tim có thể khác nhau về tiên lượng. Bệnh cơ tim gây loạn nhịp được định nghĩa là một rối loạn gây loạn nhịp của cơ tim không phải thứ phát do bệnh tim thiếu máu cục bộ, tăng huyết áp hoặc bệnh van tim, và gồm một loạt các rối loạn bao gồm – nhưng không giới hạn – bệnh cơ tim thất phải gây loạn nhịp, bệnh amyloidosis tim, bệnh sarcoidosis, bệnh Chagas và bệnh cơ tim thất trái không đông đặc (noncompaction). [73] Tài liệu đồng thuận chuyên gia HRS năm 2019 mô tả việc đánh giá, phân tầng nguy cơ và quản lý CM gây loạn nhịp tim.[73]
Bảng 2.2.1 đến 2.4 và Hình 11 đến 14 mô tả các chỉ định cấy ICD phòng ngừa tiên phát ở bệnh nhân bệnh cơ tim không do thiếu máu cục bộ, được điều chỉnh theo LVEF, phân loại chức năng NYHA, tuổi, thời gian điều trị và nhu cầu cấy máy tạo nhịp, cũng như các tình trạng di truyền cụ thể có hoặc không kèm theo bệnh tim cấu trúc.
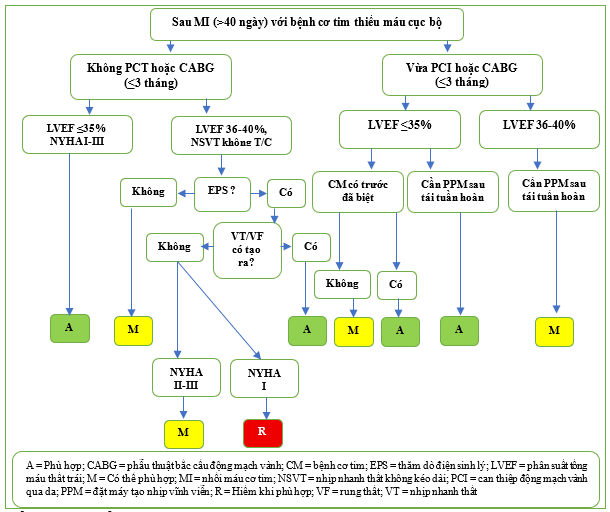
Hình 10 Tóm tắt Bảng 2.1.3 và 2.1.5, Phòng ngừa tiên phát, CAD
Phần 2 Các kết quả và thảo luận
Việc cấy ICD để phòng ngừa tiên phát có thể được xem xét trong nhiều trường hợp khác nhau nhằm giảm tỷ lệ tử vong liên quan đến rối loạn nhịp thất dai dẳng có khả năng đe dọa tính mạng ở những bệnh nhân không có tiền sử rung thất/nhịp nhanh thất dai dẳng hoặc ngất. Các khoảng thời gian cụ thể để cấy ICD phòng ngừa tiên phát (ví dụ: 40 ngày sau nhồi máu cơ tim cấp, 3 tháng sau tái thông mạch và 3 tháng sau chẩn đoán ban đầu bệnh cơ tim) được mô tả trong các trường hợp khác nhau (Bảng 2.1.1 đến 2.1.6, Hình 9 và 10). Các khoảng thời gian này được lựa chọn cho tài liệu hướng dẫn sử dụng phù hợp này dựa trên các thử nghiệm lâm sàng trước đây, các tài liệu hướng dẫn hoặc thực tiễn hiện hành. “Thời gian chờ đợi” sau nhồi máu cơ tim được hỗ trợ bằng thử nghiệm IRIS và DINAMIT, cho thấy không có lợi ích sống sót tổng thể nào từ liệu pháp ICD khi thiết bị được cấy rất sớm (trong vòng 30 hoặc 40 ngày) sau nhồi máu cơ tim. [51,52] Các bối cảnh trong phần này cũng được sửa đổi theo loại bệnh tim, LVEF, phân loại chức năng NYHA và/hoặc thời gian GDMT (Bảng 2.1 đến 2.2, Hình 9 đến 13).
Thời điểm sau nhồi máu cơ tim hoặc tái thông mạch và test EP
Các thử nghiệm ICD phòng ngừa tiên phát đã sử dụng test EP trong phân tầng nguy cơ. Nhiều bối cảnh trong Bảng 2.1.1 đến 2.1.2 mô tả một số khoảng thời gian ngắn hơn sau nhồi máu cơ tim (≤40 ngày) khi dữ liệu thử nghiệm có sẵn bị hạn chế. MUSTT đã tuyển chọn bệnh nhân bệnh mạch vành, LVEF ≤40% và nhịp nhanh thất tạm thời, không triệu chứng. [54] Rối loạn nhịp tim đủ điều kiện phải xảy ra trong vòng 6 tháng trước khi đăng ký và ≥ 4 ngày sau nhồi máu cơ tim hoặc thủ thuật tái thông mạch gần đây nhất. Nghiên cứu cho thấy liệu pháp hướng dẫn bằng EP với ICD, nhưng không phải với thuốc chống loạn nhịp, đã làm giảm nguy cơ đột tử; tuy nhiên, hầu hết (>80%) bệnh nhân được chọn ngẫu nhiên đã bị nhồi máu cơ tim gần đây nhất >1 tháng trước khi đăng ký. Do đó, vì ít bệnh nhân được đăng ký trong tháng đầu tiên sau nhồi máu cơ tim, nên tính hữu ích của test EP trong khoảng thời gian đó là không chắc chắn. Tuy nhiên, việc cấy ICD được coi là phù hợp nếu ở những bệnh nhân trong giai đoạn sớm sau nhồi máu cơ tim (≤40 ngày) trong bối cảnh nhịp nhanh thất không triệu chứng xảy ra ≤4 ngày sau nhồi máu cơ tim nếu nhịp nhanh thất dai dẳng có thể gây ra được bằng nghiên cứu điện sinh lý ở những bệnh nhân có LVEF ≤ 40% (Bảng 2.1.1 đến 2.1.2, Hình 9). Điều này phù hợp với kết quả từ thử nghiệm MUSTT.
Hình 11 Tóm tắt Bảng 2.2.1, Phòng ngừa tiên phát: Bệnh cơ tim không do thiếu máu cục bộ và khoảng thời gian điều trị
Một số bối cảnh cũng được sửa đổi bằng sự hiện diện hoặc không có tái thông mạch. Để đủ điều kiện tham gia, thử nghiệm MADIT II yêu cầu thời gian chờ ≥3 tháng sau khi tái thông mạch vành. [55] Ngược lại, bệnh nhân đủ điều kiện tham gia thử nghiệm MUSTT ≥ 4 ngày sau khi tái thông mạch, và 56% bệnh nhân tham gia thử nghiệm này đã trải qua CABG trước đó tại một thời điểm nào đó. [54] Tuy nhiên, phân tích hậu kiểm của thử nghiệm MUSTT cho thấy sự xuất hiện của NSVT sau phẫu thuật, đặc biệt là trong vòng 10 ngày sau CABG, báo hiệu kết quả tốt hơn nhiều so với khi nó xảy ra trong các trường hợp không phải sau phẫu thuật. [56] Tuy nhiên, việc cấy ghép ICD được coi là phù hợp sau khi tái thông mạch sau nhồi máu cơ tim cấp (≤ 40 ngày) trong trường hợp NSVT không triệu chứng (>4 ngày sau nhồi máu cơ tim) nếu VT dai dẳng có thể gây ra bằng test EP ở bệnh nhân có LVEF ≤ 40% (Bảng 2.1.1 đến 2.1.2, Hình 9). Do dữ liệu liên quan đến test điện sinh lý (EP) trong giai đoạn rất sớm sau khi tái thông mạch còn hạn chế, và dữ liệu hiện có cho thấy nhịp nhanh thất tạm thời (NSVT) trong giai đoạn sớm này có thể là một yếu tố nguy cơ ít đặc hiệu hơn đối với các biến cố trong tương lai, nên các quyết định liên quan đến thời điểm thực hiện xét nghiệm EP cần được cá thể hóa.
Bệnh cơ tim (CM) hoặc máy tạo nhịp vĩnh viễn tồn tại từ trước
Cần thiết Khi bệnh cơ tim mạn tính (CM) có từ trước (≥3 tháng) với LVEF ≤ 35% đã tồn tại ≥ 3 tháng, bất kể nguyên nhân là gì, việc cấy ICD được đánh giá là Phù hợp ngay cả trong vòng 40 ngày sau nhồi máu cơ tim cấp tính (Bảng 2.1.3, Hình 10). Lý do cho trường hợp này là CM là một tình trạng có từ trước không phải do nhồi máu cơ tim cấp tính gây ra và do đó, LVEF khó có thể phục hồi. Khi đã thực hiện tái thông mạch gần đây (≥3 tháng), hội đồng đánh giá xác định việc cấy ICD là Phù hợp khi có CM có từ trước với LVEF ≤ 35% đang điều trị bằng GDMT trong ≥ 3 tháng trước khi can thiệp mạch vành qua da/phẫu thuật bắc cầu động mạch vành (CABG) (Bảng 2.1.5, Hình 10). Ngoài ra, khi LVEF giảm nghiêm trọng (≤ 35%) và bệnh nhân cần cấy máy tạo nhịp tim vĩnh viễn sớm (≤40 ngày) sau nhồi máu cơ tim hoặc < 3 tháng sau tái thông mạch, liệu pháp ICD được đánh giá là Phù hợp (Bảng 2.1.4 đến 2.1.5, Hình 10). Mặc dù những trường hợp này không được đề cập cụ thể trong các thử nghiệm lâm sàng, nhưng đây là một quyết định hợp lý từ quan điểm chi phí và an toàn cho bệnh nhân. Nếu dự kiến ít hoặc không có sự cải thiện chức năng LV sau tái thông mạch, việc cần thực hiện thủ thuật thứ hai trong vòng 3 tháng sẽ khiến bệnh nhân gặp nguy cơ không cần thiết. Khi bệnh nhân cần đặt máy tạo nhịp sớm (≤ 40 ngày) sau nhồi máu cơ tim, việc cấy cũng được biện minh để tránh chi phí và nguy cơ khi cấy máy tạo nhịp tim rồi thay thế bằng ICD sau khoảng thời gian 40 ngày. Trong Sổ đăng ký REPLACE, tỷ lệ biến chứng cao là 15,3% đã được quan sát thấy ở những bệnh nhân trải qua việc bổ sung dây dẫn qua tĩnh mạch theo kế hoạch để thay thế hoặc nâng cấp thiết bị. [57] Cấy ghép ICD sớm hơn sẽ tránh được những nguy cơ bổ sung liên quan đến việc phẫu thuật lại sớm.
Khoảng thời gian của điều trị nội theo hướng dẫn ( GDMT)
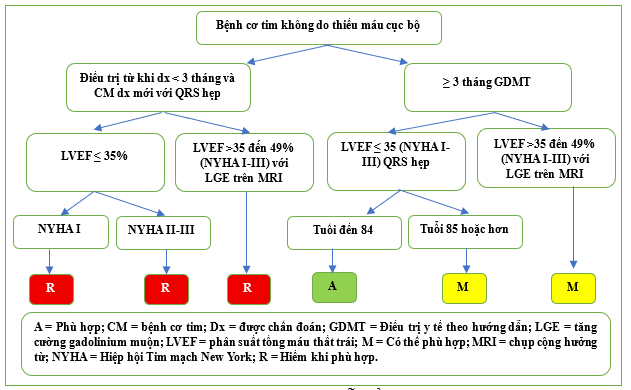
Khi bệnh nhân bệnh cơ tim không do thiếu máu cục bộ đã được điều trị bằng GDMT trong ≥3 tháng, việc cấy ICD được đánh giá là Phù hợp nếu LVEF ≤ 35%, QRS hẹp và các triệu chứng thuộc phân loại chức năng NYHA IIII nếu < 85 tuổi và được đánh giá là Có thể Phù hợp nếu từ 85 tuổi trở lên (Bảng 2.2.1, Hình 11). Nhìn chung, người ta khuyến cáo bệnh nhân nên được điều trị bằng GDMT trong một thời gian sau khi được chẩn đoán mắc bệnh cơ tim không do thiếu máu cục bộ với hy vọng chức năng thất trái sẽ được cải thiện. Việc cấy ICD trong vòng 3 tháng sau khi được chẩn đoán mắc bệnh cơ tim (LVEF ≤ 35%) được coi là Hiếm khi Phù hợp trong hầu hết các trường hợp (Bảng 2.2.1, Hình 11). Tương tự, trong trường hợp bệnh cơ tim do thiếu máu cục bộ không có nhồi máu cơ tim gần đây, việc cấy ICD chỉ được coi là Phù hợp sau khi bệnh nhân đã được điều trị bằng GDMT trong ≥3 tháng, trừ khi có nhịp nhanh thất tạm thời (NSVT) và test điện sinh lý cho thấy có thể gây ra nhịp nhanh thất dai dẳng/rung thất(Bảng 2.1.6).
Một trường hợp ngoại lệ tiềm năng khác đối với thời gian chờ 3 tháng khi cần cấy máy tạo nhịp tim sau phẫu thuật van tim gần đây có kèm theo bắc cầu động mạch vành tự thân, và chức năng thất trái nghiêm trọng (LVEF ≤ 35%) khó có khả năng cải thiện (Bảng 2.2.2, Hình 12).
Ngoài ra, các trường hợp ngoại lệ tiềm tàng khác đối với quy tắc 3 tháng cũng có thể áp dụng cho các nguyên nhân cụ thể gây ra bệnh cơ tim không do thiếu máu cục bộ như đã nêu trong Bảng 2.2.3, vì không dự kiến có sự cải thiện đáng kể về chức năng thất trái hoặc nền tảng rối loạn nhịp mặc dù đã điều trị bằng GDMT. Ví dụ, việc cấy ICD được hội đồng đánh giá coi là phù hợp đối với bệnh nhân mắc bệnh tim do sarcoid, loạn dưỡng cơ, bệnh Chagas và viêm cơ tim tế bào khổng lồ nếu LVEF <35% khi điều trị bằng GDMT trong <3 tháng vì các hội chứng này có liên quan đến nguy cơ rối loạn nhịp cao (Bảng 2.2.3, Hình 13).
Thêm vào đó, điều trị bằng thuốc có thể không đóng vai trò quan trọng trong việc cải thiện rối loạn chức năng thất hoặc giảm rối loạn nhịp trong bệnh cơ tim loạn nhịp di truyền. Ví dụ, cấy ICD để phòng ngừa tiên phát được coi là phù hợp trong trường hợp cơ tim phì đại với yếu tố nguy cơ >1, cơ tim thất phải gây loạn nhịp không có triệu chứng và bệnh tim cấu trúc với đột biến Lamin A/C hoặc cơ tim gây loạn nhịp di truyền khác ngay cả khi LVEF >35% và 35% (Bảng 2.3, Hình 14). Các tình trạng di truyền khác không có bệnh tim cấu trúc, chẳng hạn như hội chứng QT dài bẩm sinh không triệu chứng, nhịp nhanh thất đa hình do catecholamine với nhịp nhanh thất tạm thời, hoặc hội chứng Brugada được phát hiện tình cờ (mẫu điện tâm đồ type 1), được đánh giá ở các mức độ phù hợp khác nhau có thể được điều chỉnh bằng liệu pháp điều trị hoặc kết quả xét nghiệm khác (Bảng 2.4, Hình 14).
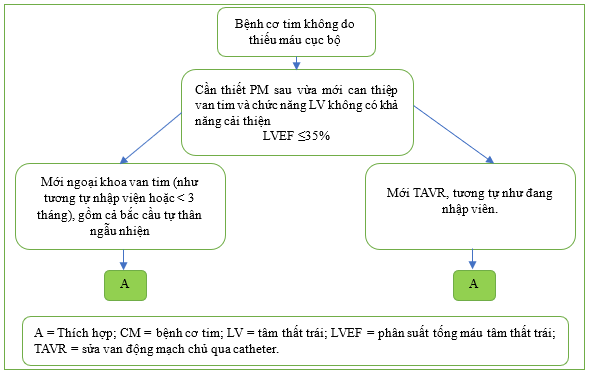
Hình 12 Tóm tắt Bảng 2.2.2, Phòng tiên phát: Bệnh cơ tim không do thiếu máu cục bộ và nhu cầu tạo nhịp tim sau can thiệp van tim
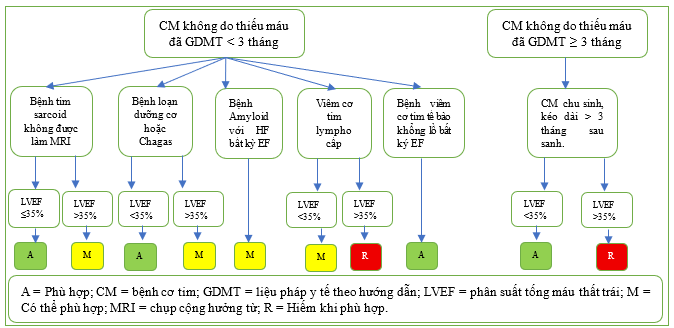
Hình 13 Tóm tắt Bảng 2.2.3, CM không do thiếu máu cục bộ, Nguyên nhân cụ thể
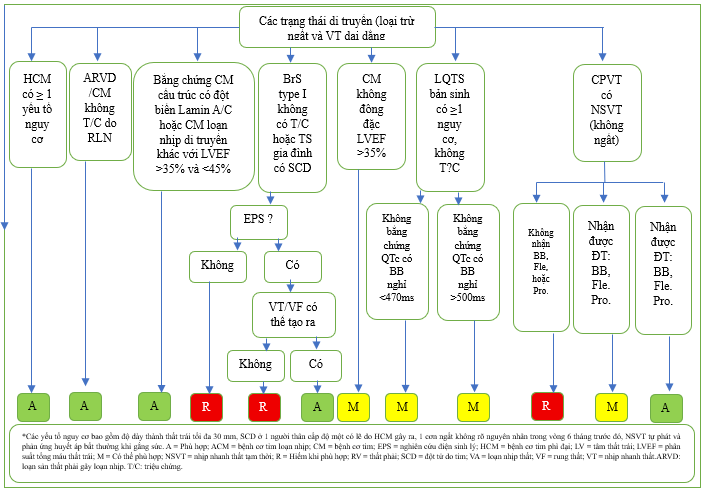
Hình 14 Tóm tắt Bảng 2.3, Phòng ngừa tiên phát: Các tình trạng di truyền có bệnh tim cấu trúc
(Còn nữa)
Tài liệu thăm khảo
- Al-Khatib SM, Stevenson WG, Ackerman MJ, et al. 2017 AHA/ACC/HRS guideline for management of patients With ventricular arrhythmias and the prevention of sudden cardiac death: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol. 2018;72:e91–e220.
- Epstein AE, DiMarco JP, Ellenbogen KA, et al. ACC/ AHA/HRS 2008 guidelines for device-based therapy of cardiac rhythm abnormalities: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the ACC/AHA/NASPE 2002 Guideline Update for Implantation of Cardiac Pacemakers and Antiarrhythmia Devices) developed in collaboration with the American Association for Thoracic Surgery and Society of Thoracic Surgeons. J Am Coll Cardiol. 2008;51:e1– e62.
- Epstein AE, DiMarco JP, Ellenbogen KA, et al. 2012 ACCF/AHA/HRS focused update incorporated into the ACCF/AHA/HRS 2008 guidelines for device-based therapy of cardiac rhythm abnormalities: a report of the American College of Cardiology Foundation/ American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol. 2013;61:e6–e75.
- Kusumoto FM, Schoenfeld MH, Barrett C, et al. 2018 ACC/AHA/HRS guideline on the evaluation and management of patients with bradycardia and cardiac conduction delay: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol. 2019;74:e51–e156.
- Glikson M, Nielsen JC, Kronborg MB, et al. 2021 ESC guidelines on cardiac pacing and cardiac resynchronization therapy. Eur Heart J. 2021;42:3427–3520.
- Levine GN, Bates ER, Bittl JA, et al. 2016 ACC/AHA guideline focused update on duration of dual antiplatelet therapy in patients with coronary artery disease: a report of the American College of Cardiology/ American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2016;68:1082– 1115.
- Fihn SD, Blankenship JC, Alexander KP, et al. 2014 ACC/ AHA/ AATS/ PCNA/ SCAI/STS focused update of the guideline for the diagnosis and management of patients with stable ischemic heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines, and the American Association for Thoracic Surgery, Preventive Cardiovascular Nurses Association, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol. 2014;64:1929– 1949.
- Fihn SD, Gardin JM, Abrams J, et al. 2012 ACCF/ AHA /ACP/ AATS/ PCNA/ SCAI / STS guideline for the diagnosis and management of patients with stable ischemic heart disease: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, and the American College of Physicians, American Association for Thoracic Surgery, Preventive Cardiovascular Nurses Association, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol. 2012;60:e44–e164.
- Yancy CW, Jessup M, Bozkurt B, et al. 2017 ACC/ AHA/HFSA focused update of the 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. J Am Coll Cardiol. 2017;70:776–803.
- Yancy CW, Jessup M, Bozkurt B, et al. 2013 ACCF/ AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2013;62:e147– e239.
- National coverage determination (NCD) for implantable automatic defibrillators (20.4). Accessed July 31, 2020. https://www.cms.gov/medicare-coveragedatabase/details/ncd-details.aspx?NCDId =110&ver = 3
- Hayes DL, Boehmer JP, Day JD, et al. Cardiac resynchronization therapy and the relationship of percent biventricular pacing to symptoms and survival. Heart Rhythm. 2011;8:1469–1475.
- Wilkoff BL, Fauchier L, Stiles MK, et al. 2015 HRS/ EHRA /APHRS / SOLAECE expert consensus statement on optimal implantable cardioverter-defibrillator programming and testing. Heart Rhythm. 2016;13:e50– e86.
- Barsheshet A, Moss AJ, McNitt S, et al. Long-term implications of cumulative right ventricular pacing among patients with an implantable cardioverter defibrillator. Heart Rhythm. 2011;8:212–218.
- Wilkoff BL, Cook JR, Epstein AE, et al. Dualchamber pacing or ventricular backup pacing in patients with an implantable defibrillator: the dual chamber and VVI implantable defibrillator (DAVID) trial. JAMA. 2002;288:3115–3123.
- Sweeney MO, Hellkamp AS, Ellenbogen KA, et al. Adverse effect of ventricular pacing on heart failure and atrial fibrillation among patients with normal baseline QRS duration in a clinical trial of pacemaker therapy for sinus node dysfunction. Circulation. 2003;107:2932–2937.
- Sharma AD, Rizo-Patron C, Hallstrom AP, et al. Percent right ventricular pacing predicts outcomes in the DAVID trial. Heart Rhythm. 2005;2:830–834.
- Steinberg JS, Fischer A, Wang P, et al. The clinical implications of cumulative right ventricular pacing in the multicenter automatic defibrillator trial II. J Cardiovasc Electrophysiol. 2005;16:359–365.
- Gillis AM, Russo AM, Ellenbogen KA, et al. HRS/ ACCF expert consensus statement on pacemaker device and mode selection. Developed in partnership between the Heart Rhythm Society (HRS) and the American College of Cardiology Foundation (ACCF) and in collaboration with the Society of Thoracic Surgeons. Heart Rhythm. 2012;9:1344–1365.
- Theuns DA, Rivero-Ayerza M, Boersma E, et al. Prevention of inappropriate therapy in implantable defibrillators: A meta-analysis of clinical trials comparing single-chamber and dual-chamber arrhythmia discrimination algorithms. Int J Cardiol. 2008;125:352–357.
- Hu ZY, Zhang J, Xu ZT, et al. Efficiencies and complications of dual chamber versus single chamber implantable cardioverter defibrillators in secondary sudden cardiac death Prevention: a meta-analysis. Heart Lung Circ. 2016;25:148–154.
- Dewland TA, Pellegrini CN, Wang Y, et al. Dualchamber implantable cardioverter-defibrillator selection is associated with increased complication rates and mortality among patients enrolled in the NCDR implantable cardioverter-defibrillator registry. J Am Coll Cardiol. 2011;58:1007–1013.
- Friedman PA, Bradley D, Koestler C, et al. A prospective randomized trial of single- or dualchamber implantable cardioverter-defibrillators to minimize inappropriate shock risk in primary sudden cardiac death prevention. Europace. 2014;16:1460–1468.
- Peterson PN, Varosy PD, Heidenreich PA, et al. Association of single- vs dual-chamber ICDs with mortality, readmissions, and complications among patients receiving an ICD for primary prevention. JAMA. 2013;309:2025–2034.
- Bilchick KC, Wang Y, Cheng A, et al. Seattle heart failure and proportional risk models predict benefit from implantable cardioverter-defibrillators. J Am Coll Cardiol. 2017;69:2606–2618.
- Kristensen SL, Levy WC, Shadman R, et al. Risk models for prediction of implantable cardioverterdefibrillator benefit: insights from the DANISH trial. JACC Heart Fail. 2019;7:717–724.
- Patton KK, Fisher JD, Lindsay B, et al. COCATS 4, the 2015 CCEP advanced training statement, and the transition from 12 to 24 required months of electrophysiology training:rationale, status, and implications for the future. JACC Clin Electrophysiol. 2016;2:120– 123.
- Kremers MS, Hammill SC, Berul CI, et al. The national ICD registry report: version 2.1 including leads and pediatrics for years 2010 and 2011. Heart Rhythm. 2013;10:e59–e65.
- Patel SM, Kang YM, Im K, et al. Sodium-glucose cotransporter-2 inhibitors and major adverse cardiovascular outcomes: A SMART-C collaborative metaanalysis. Circulation. 2024;149:1789–1801.
- Heidenreich PA, Bozkurt B, Aguilar D, et al. 2022 AHA/ACC/HFSA guideline for the management of heart failure: a report of the American College of Cardiology/ American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022;145:e895– e1032.
- Bozkurt B, Coats AJ, Tsutsui H, et al. Universal definition and classification of heart failure: a report of the Heart Failure Society of America, Heart Failure Association of the European Society of Cardiology, Japanese Heart Failure Society and Writing Committee of the Universal Definition of Heart Failure. J Card Fail. 2021;27:387–413.
- Hunt SA, Abraham WT, Chin MH, et al. 2009 Focused update incorporated into the ACC/AHA 2005 guidelines for the diagnosis and management of heart failure in adults: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines Developed in Collaboration With the International Society for Heart and Lung Transplantation. J Am Coll Cardiol. 2009;53: e1–e90.
- Yancy CW, Januzzi JL Jr, Allen LA, et al. 2017 ACC expert consensus decision pathway for optimization of heart failure treatment: answers to 10 pivotal issues about heart failure with reduced ejection fraction: a report of the American College of Cardiology Task Force on Expert Consensus Decision Pathways. J Am Coll Cardiol. 2018;71:201–230.
- Thygesen K, Alpert JS, Jaffe AS, et al. Fourth universal definition of myocardial infarction (2018). J Am Coll Cardiol. 2018;72:2231–2264.
- Thygesen K, Alpert JS, Jaffe AS, et al. Third universal definition of myocardial infarction. J Am Coll Cardiol. 2012;60:1581–1598.
- Agewall S, Giannitsis E, Jernberg T, et al. Troponin elevation in coronary vs. non-coronary disease. Eur Heart J. 2011;32:404–411. 40. Fye WB. Troponin trumps common sense. J Am Coll Cardiol. 2006;48:2357–2358. author reply 2358- 2359.
- Hohnloser SH, Kuck KH, Dorian P, et al. Prophylactic use of an implantable cardioverter-defibrillator after acute myocardial infarction. N Engl J Med. 2004;351:2481–2488.
- A comparison of antiarrhythmic-drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. N Engl J Med. 1997;337:1576–1583.
- Connolly SJ, Gent M, Roberts RS, et al. Canadian implantable defibrillator study (CIDS) : a randomized trial of the implantable cardioverter defibrillator against amiodarone. Circulation. 2000;101:1297–1302.
- Kuck K-H, Cappato R, Siebels J, et al. Randomized comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from cardiac arrest. Circulation. 2000;102:748–754.
- Connolly SJ, Hallstrom AP, Cappato R, et al. Metaanalysis of the implantable cardioverter defibrillator secondary prevention trials. AVID, CASH and CIDS studies. Antiarrhythmics vs Implantable Defibrillator study. Cardiac Arrest Study Hamburg . Canadian Implantable Defibrillator Study. Eur Heart J. 2000;21: 2071–2078.
- Chan PS, Hayward RA. Mortality reduction by implantable cardioverter-defibrillators in high-risk patients with heart failure, ischemic heart disease, and new-onset ventricular arrhythmia: an effectiveness study. J Am Coll Cardiol. 2005;45:1474–1481.
- Katz DF, Peterson P, Borne RT, et al. Survival after secondary prevention implantable cardioverterdefibrillator placement: an analysis from the NCDR ICD registry. JACC Clin Electrophysiol. 2017;3:20–28.
- Schaer B, Kühne M, Reichlin T, et al. Incidence of and predictors for appropriate implantable cardioverter-defibrillator therapy in patients with a secondary preventive implantable cardioverterdefibrillator indication. Europace. 2016;18:227–231.
- Priori SG, Blomström-Lundqvist C, Mazzanti A, et al. 2015 ESC guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: the Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J. 2015;36:2793–2867.
- Wyse DG, Friedman PL, Brodsky MA, et al. Lifethreatening ventricular arrhythmias due to transient or correctable causes: high risk for death in follow-up. J Am Coll Cardiol. 2001;38:1718–1724.
- Dorian P, Hohnloser SH, Thorpe KE, et al. Mechanisms underlying the lack of effect of implantable cardioverter-defibrillator therapy on mortality in highrisk patients with recent myocardial infarction: insights from the defibrillation in acute myocardial infarction trial (DINAMIT). Circulation. 2010;122:2645–2652.
- Steinbeck G, Andresen D, Seidl K, et al. Defibrillator implantation early after myocardial infarction. N Engl J Med. 2009;361:1427–1436.
- Thygesen K, Alpert JS, White HD. Universal definition of myocardial infarction. J Am Coll Cardiol. 2007;50:2173–2195.
- Buxton AE, Lee KL, Fisher JD, et al. A Randomized study of the prevention of sudden death in patients with coronary artery disease. N Engl J Med. 1999;341: 1882–1890.
- Moss AJ, Zareba W, Hall WJ, et al. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med. 2002;346:877–883.
- Pires LA, Hafley GE, Lee KL, et al. Prognostic significance of nonsustained ventricular tachycardia identified postoperatively after coronary artery bypass surgery in patients with left ventricular dysfunction. J Cardiovasc Electrophysiol. 2002;13:757–763.
- Poole JE, Gleva MJ, Mela T, et al. Complication rates associated with pacemaker or implantable cardioverter-defibrillator generator replacements and upgrade procedures: results from the REPLACE registry. Circulation. 2010;122:1553–1561.







