NGUYỄN DƯƠNG KHANG*
NGUYỄN THANH HIỀN
* Khoa Tim mạch can thiệp, BV Đại học Y Dược TP. Hồ Chí Minh
I. MỞ ĐẦU
Hội chứng vành cấp vẫn là nguyên nhân gây bệnh tật và tử vong đáng kể trên thế giới [1]. Tuy vậy, số liệu tại Hoa Kỳ từ năm 1998 đến năm 2008 ghi nhận tần suất mới mắc nhồi máu cơ tim cấp có ST chênh lên (STEMI) trên 100.000 người-năm có giảm xuống và tần suất mới mắc chung nhồi máu cơ tim cũng có giảm [2]. Đi cùng tần suất mới mắc giảm, thì tỉ lệ tử vong nội viện và sau 1 năm cũng giảm theo, nhờ vào những tiến bộ trong điều trị dùng thuốc, tái tưới máu hợp lý và tăng cường khả năng phát hiện bệnh qua các mẫu troponin siêu nhạy [3,4]. Tái thông dòng máu mạch vành thông qua tiêu sợi huyết hoặc can thiệp mạch vành qua da tiên phát đã được chứng minh là làm giảm kích thước vùng nhồi máu và cải thiện sống còn [5]. Vấn đề đặt ra tiếp theo trong quản lý bệnh nhân hội chứng vành cấp là cải thiện hơn nữa kết cục tim mạch trong và sau giai đoạn cấp tính.
Phân tích gộp từ 10 nghiên cứu ngẫu nhiên có nhóm chứng về mối liên quan giữa kich thước vùng nhồi máu 1 tháng sau can thiệp mạch vành qua da (PCI) tiên phát trong STEMI với tử vong, tái nhồi máu và tái nhập viện vì suy tim cho thấy mối liên hệ độc lập trong 1 năm theo dõi [6]. Nghiên cứu này cũng nhận thấy kích thước vùng nhồi máu, ghi nhận 1 tháng sau PCI tiên phát, là một chỉ dấu độc lập nhập viện vì suy tim sau 1 năm. Với mỗi 5% tăng lên về kích thước vùng nhồi máu, sẽ có 19% tăng lên trong tử vong do mọi nguyên nhân sau 1 năm và 20% tăng lên trong tái nhập viện vì suy tim sau 1 năm [6]. Phân tích gộp các nghiên cứu trong Bảng 1 chỉ ra rằng giảm kích thước vùng nhồi máu có thể làm giảm đáng kể tỉ lệ nhập viện vì suy tim. Trong một nghiên cứu đoàn hệ tiến cứu đánh giá các bệnh nhân STEMI lần đầu được PCI tiên phát, các nhà nghiên cứu đã ghi nhận mối tương quan nghịch trực tiếp giữa kích thước vùng nhồi máu > 15% và phân suất tống máu thất trái [7]. Chúng ta đã biết suy chức năng tâm thu sau STEMI có liên quan với kết cục xấu cả ngắn hạn và dài hạn, thì hiện nay cũng có nhiều bằng chứng ủng hộ việc điều trị nhắm đến giảm kích thước vùng nhồi máu để cải thiện tỉ lệ suy tim mới mắc sau STEMI.
Bảng 1. Các nghiên cứu lâm sàng đánh giá sự thay đổi về kích thước vùng nhồi máu của các phương pháp can thiệp khác nhau
| Nghiên cứu | Số bệnh nhân | CLS đánh giá kích thước vùng nhồi máu | Can thiệp chính | Kết cục chính | Kết quả chính |
| EMERALD [8] | 501 | SPECT | PCI với bóng và hệ thống bảo vệ vi mạch vành đầu tận vs. Can thiệp không bảo vệ | Giảm chênh đoạn ST sau PCI và giảm vùng nhồi máu 5-14 ngày sau can thiệp | Không cải thiện tỉ lệ thành công tái tưới máu, giảm kích thước vùng nhồi máu hay tăng khả năng sống còn không biến cố |
| AMIHOT-II [9] | 301 | SPECT | Bơm oxy siêu bão hòa nội mạch vành 90 phút vs. Thông thường | Vùng nhồi máu và biến cố chính 30 ngày sau can thiệp | Ở BN STEMI thành trước, bơm oxy siêu bão hòa làm giảm đáng kể kích thước vùng nhồi máu |
| IMMEDIATE [10] | 54 | SPECT | TTM glucose, insulin và Kali ở BN ACS vs. Nhóm chứng | Nghiên cứu phụ: suy tim sau 30 ngày, kích thước vùng nhồi máu, chức năng thất trái, và nồng độ BNP | Ở những BN STEMI, kích thước vùng nhồi máu thấp hơn nhóm chứng |
| APEX-AMI [10][11] | 99 | CMR | Pexelizumab vs. Nhóm chứng ở BN PCI tiên phát NMCT lần đầu | Nghiên cứu phụ: đánh giá vùng nhồi máu và LVEF | Những BN dùng pexelizumab có kích thước vùng nhồi máu nhỏ hơn và LVEF cao hơn |
| LIPSIA-ABCIXIMAB [12] | 154 | CMR | Abciximab nội mạch vành vs. Abciximab tĩnh mạch ở BN PCI tiên phát | Kích thước vùng nhồi máu và mức độ tắc vi mạch | Đường dùng nội mạch vành tốt hơn tĩnh mạch nếu xét về kích thước vùng nhồi máu và mức độ tắc nghẽn vi mạch |
| LIPSIA-N-ACC [13] | 251 | CMR | N-acetylcysteine vs. Nhóm chứng ở BN STEMI PCI tiên phát | Thay đổi nồng độ creatinine và giảm tổn thương do tái tưới máu qua chỉ số bảo tồn cơ tim | N-acetylcysterin giảm áp lực oxy hóa nhưng không có lợi thêm về bệnh thận do cản quang hay tổn thương cơ tim do tái tưới máu |
| LIPSIA-STEMI [14] | 162 | CMR | Tenecteplase trước NV với PCI tiên phát vs. PCI tiên phát với kháng huyết khối ở BN STEMI vận chuyển đường xa | Kích thước vùng nhồi máu | Không khác biệt về kích thước vùng nhồi máu |
| CRISP-AMI [15] | 337 | CMR | IABP ở STEMI thành trước trước khi PCI tiên phát kéo dài đến 12 tiếng vs. PCI tiên phát thông thường | Kích thước vùng nhồi máu 3-5 ngày sau PCI | Không khác biệt về kích thước vùng nhồi máu |
| AIDA STEMI [16] | 795 | CMR | Abciximab nội mạch vành vs. Abciximab tĩnh mạch trong STEMI | Kích thước vùng nhồi máu | Không khác biệt về tổn thương cơ tim |
| INFUSE AMI [17] | 452 | CMR | Abciximab nội mạch vành vs. Hút huyết khối thường quy hoặc cả 2 ở BN STEMI | Kích thước vùng nhồi máu sau 30 ngày | Ở BN PCI với bivalirudin, abciximab nội mạch vành làm giảm kích thước vùng nhồi máu |
| BN: bệnh nhân; CMR: cộng hưởng từ tim; LVEF: phân suất tống máu thất trái; NMCT: nhồi máu cơ tim; STEMI: nhồi máu cơ tim cấp có ST chênh lên; SPECT: chụp cắt lớp vi tính đơn photon; PCI; can thiệp mạch vành qua da; IABP: bóng đối xung động mạch chủ. | |||||
II. TỔN THƯƠNG CƠ TIM SAU TÁI TƯỚI MÁU
Giảm kích thước vùng nhồi máu thường tập trung vào giảm thời gian cửa-bóng để tái tưới máu cơ tim sớm nhất có thể [18]. Mặc dù tái tưới máu đúng lúc làm giảm tỉ lệ tử vong 30 ngày trong STEMI thì các bằng chứng gợi ý rằng nếu vượt qua một ngưỡng thời gian cụ thể thì việc giảm thời gian cửa-bóng sẽ có lợi ích thêm vào tối thiểu [19]. Mặc dù đã có nhiều cải thiện trong việc đạt thời gian cửa-bóng thì tần suất mới mắc suy tim sau nhồi máu cơ tim vẫn tiếp tục tăng lên [20]. Xu hướng này đã đưa đến việc chuyển hướng tập trung vào giảm thiểu tổn thương cơ tim sau tái tưới máu. Đây là một yếu tố quan trọng trong tiến trình tái tưới máu. Bốn cơ chế chính dẫn đến tổn thương sau tái tưới máu, có thể hồi phục được hoặc không, bao gồm: rối loạn nhịp do tái tưới máu, cơ tim choáng váng, tắc nghẽn hệ vi mạch, và tổn thương tái tưới máu cơ tim nguy hiểm [21]. Tổn thương tái tưới máu cơ tim nguy hiểm được định nghĩa là tổn thương do tái tưới máu ảnh hưởng đến vùng cơ tim thiếu máu cục bộ còn sống trước đó, nhấn mạnh việc đạt được thời gian cửa-bóng tối ưu không phải lúc nào cũng đồng nghĩa với giảm nhập viện vì suy tim [22].
Các yếu tố như gánh nặng oxy hóa [23], quá tải calcium nội bào [22], thu hút bạch cầu tại vùng nhồi máu [24], và mở kênh PTP ti thể dẫn tới phá hủy tế bào là các yếu tố đã được xác định là dẫn tới tổn thương tái tưới máu cơ tim nguy hiểm. Các liệu pháp liên quan đến gen ở động vật có hiệu quả trên các tác động bất lợi của loại tổn thương này. Ví dụ, việc dùng simvastatin ở chuột bị tắc nhánh liên thất trước dẫn đến giảm các dấu ấn sinh học liên quan gánh nặng oxy hóa cơ tim [25]. Liệu pháp dùng thuốc và cơ học nhắm đến con đường kinase tái sau tổn thương tái tưới máu (RISK), bao gồm một chuỗi các protein được hoạt hóa trong quá trình tái tưới máu để giảm bớt tổn thương, đã chứng minh được hiệu quả trong giảm kích thước vùng nhồi máu [26]. Tuy vậy, quá trình áp dụng các kết quả từ động vật vào con người vẫn là một thử thách, chủ yếu do khó khăn trong áp dụng điều trị trong thực hành.
III. RỐI LOẠN HỆ VI MẠCH VÀNH
Mặc dù dòng chảy TIMI < 3 là dấu hiệu nhận biết kém tưới máu hệ vi mạch và là yếu tố tiên lượng biến cố sau PCI tiên phát [27] thì việc tỉ lệ no-reflow chỉ dưới 5% là không tương ứng với các kết quả của các thử nghiệm thực nghiệm và lâm sàng khi có bằng chứng ghi nhận giảm tưới máu vi mạch (CMD) có thể gặp ở một nửa số bệnh nhân STEMI có dòng chảy TIMI 3 [28][29]. Do vậy, việc dùng phân loại TIMI để mô tả dòng chảy thượng tâm mạc có thể phần nào đánh giá CMD trong phòng lab nhưng sẽ đưa ra con số khá thấp so với thực tế. Một chỉ số khác hiện được sử dụng thay thế trong đánh giá tưới máu vi mạch là thang điểm Myocardial Blush (MBG), dựa trên đánh giá đậm độ cản quang vùng chi phối ở ngoại biên của các mạch máu thượng tâm mạc. MBG đã được chứng minh có khả năng tiên lượng tử vong sau PCI tiên phát độc lập với dòng chảy TIMI [30]. Mặc dù MBG tương ứng với tắc nghẽn vi tuần hoàn mạch vành (MVO) trên MRI tim ở một mức độ nhất định thì cũng như dòng TIMI, MBG không phát hiện được suy chức năng vi mạch ở số đông bệnh nhân [29][31]. Bên cạnh các dấu hiệu trên chụp mạch vành, chúng ta có các phương pháp xâm lấn có thể giúp đánh giá hệ vi mạch vành. Tăng áp lực mạch vành bít (CWP > 38 mmHg), đo bằng một vi dây dẫn đưa đến đầu tận của chỗ hẹp và trước khi thông dòng vị trí thủ phạm, có tương quan với tái cấu trúc thất trái 60 tháng theo dõi sau STEMI [32]. Đánh giá lưu lượng dòng bằng dây dẫn với Doppler hoặc pha loãng nhiệt sau khi đã tái lập được dòng máu thượng tâm mạc là phương pháp được chứng minh có tương quan tốt với việc phát hiện tổn thương vi mạch qua MRI tim. Về lý thuyết, các phương pháp dựa trên dây dẫn sẽ có khả năng đo được áp lực động mạch vành đoạn xa cũng như dòng chảy, thông qua phổ Doppler hoặc thời gian trung bình qua pha loãng nhiệt, ở tình trạng không hoặc kích thích tối đa. Kết hợp các phép đo áp lực và dòng chảy đồng thời này, chúng ta sẽ đưa ra được một số chỉ số liên quan đến chức năng vi mạch (Hình 1) như dự trữ dòng mạch vành (CFR), chỉ số kháng lực vi mạch (IMR), kháng lực vi mạch khi kích thích (HMR), đường cong vận tốc dòng-áp lực tâm trương tức thời (IHDPS) và áp lực tại dòng zero (PzF).
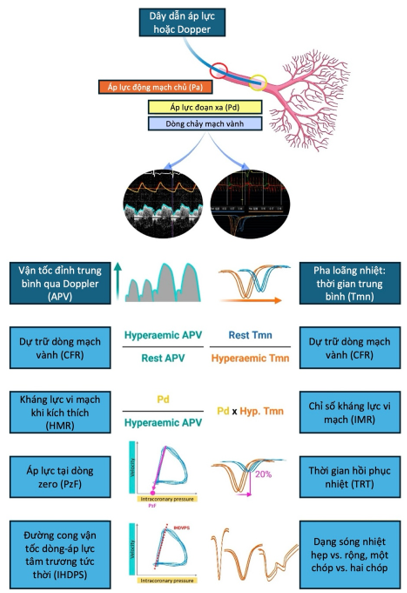
Hình 1. Các hướng tiếp cận xâm lấn đánh giá suy chức năng vi mạch vành tại phòng thông tim [33]
Đa số các nghiên cứu mối liên quan giữa suy chức năng vi mạch (CMD) với tăng nguy cơ tử vong và suy tim sau STEMI đều sử dụng chỉ số IMR qua pha loãng nhiệt. Do vậy, IMR cũng được dùng để hướng dẫn phát triển các phương pháp điều trị sau PCI tiên phát, vừa là công cụ chẩn đoán-điều trị trúng đích, và phương thức đánh giá đáp ứng điều trị [34]. Ít nhất 4 phương thức tiếp cận điều trị khác nhau nhắm đến CMD sau PCI tiên phát, hoặc là một phần của hướng tiếp cận tổn thương sau tái tưới máu và no-reflow, đã được phát triển từ đây. Đầu tiên, tiêu sợi huyết nội mạch vành và các thuốc kháng huyết khối khác đã được thử nghiệm trong trường hợp tắc mạch do huyết khối đoạn xa và nút vi mạch. Những nghiên cứu ban đầu đã ghi nhận giảm CFR và IMR vào ngày 2 sau PCI tiên phát ở những bệnh nhân sử dụng streptokinase nội mạch vành liều thấp [35]. Tuy vậy, nghiên cứu T-TIME phân nhóm ngẫu nhiên 440 bệnh nhân STEMI vào nhóm truyền nội mạch vành trong 5-10 phút alteplase liều 20mg vs. 10mg vs. nhóm chứng ngay sau khi thông dòng và trước đặt stent [36] đã không ghi nhận khác biệt nào về kết cục chính liên quan mức độ tắc vi mạch vành, biểu hiện qua % với khối cơ thất trái; cũng như không có lợi ích nào về kết cục lâm sàng. Hơn nữa, ở những bệnh nhân có thời gian thiếu máu cục bộ > 4 giờ, việc dùng alteplase nội mạch vành còn liên quan với MVO rộng hơn so với nhóm chứng, từ đó gợi ý có thể có hại ở phân nhóm bệnh nhân này [37]. Bên cạnh đó, một số nghiên cứu cho thấy việc đặt stent ngay lập tức ở nhánh thủ phạm không mang lại cải thiện hệ vi mạch trong ít nhất 1/3 số trường hợp [38], và có vẻ tái thông mạch đích có kiểm soát bằng việc đặt stent trì hoãn sẽ mang lại kết quả chức năng vi mạch vành tốt hơn [38]. Tuy vậy, cũng cần thận trọng với chiến lược đặt stent trì hoãn, vì nghiên cứu lớn SALVAGE đã phải ngừng sớm sau khi thu nhận 629 bệnh nhận vì các lo ngại về tính an toàn (NCT03581513). Mặt khác, các thuốc giãn mạch cũng đã được sử dụng để đối đầu với cơ chế co vi mạch, cũng là một nguyên nhân khả dĩ khác của tình trạng CMD trong STEMI. Nicorandil khi dùng nội mạch vành đã mang lại kết quả giảm IMR hơn đáng kể so với nỉoglycerine sau PCI tiên phát [39]. Gần đây, nghiên cứu CHANGE phân nhóm ngẫu nhiên 238 bệnh nhân thành nhóm nicorandil truyền tĩnh mạch khởi động trước PCI tiên phát và kéo dài 24 giờ so với nhóm chứng đã được tiến hành [40]. Nhóm nicorandil mang lại giảm kích thước vùng nhồi máu qua MRI tim tại thời điểm 6 tháng đáng kể (22,1 ± 11,4% vs. 27,1 ± 13,4%, p = 0,005). Kết quả này còn được củng cố bằng ghi nhận ít trường hợp no-reflow và giảm MVO trên MRI tim tại thời điểm 5-7 ngày ở bệnh nhân dùng nicorandil [40]. Mặc dù kết quả tương tự với các nghiên cứu ngẫu nhiên nhỏ trước đó [41], thì việc ưu tiên nicorandil cần được thận trọng trong bối cảnh nghiên cứu lớn J-WIND trước đó cho kết quả âm tính [42]. Một số thuốc giãn mạch khác như adenosine và sodium nitroprusside không chứng minh được lợi ích giảm kích thước vùng nhồi máu và MVO khi so với nhóm chứng trong một nghiên cứu ngẫu nhiên gồm 247 bệnh nhân STEMI [42].
Cuối cùng, chúng ta có phương pháp tắc xoang vành gián đoạn. Tưới máu vi mạch không tối ưu sau can thiệp nhồi máu cơ tim cấp có liên quan với tăng kích thước vùng nhồi máu, với mỗi 5% tăng lên trong kích thước vùng nhồi máu sẽ liên quan với 20% tăng lên trong tử vong hoặc nhập viện vì suy tim trong 1 năm [6]. Để cải thiện tưới máu vi mạch và giảm kích thước vùng nhồi máu, tắc xoang vành gián đoạn có kiểm soát áp lực (PiCSO) đã được thử nghiệm [43]. Đây là một hệ thống dựa trên dây dẫn có thể bơm căng lên và xẹp xuống theo chu kỳ, từ đó tạo ra sự thay đổi áp lực thoáng qua trong xoang vành, từ đó tái phân bố dòng máu từ ngoại vị đến cơ tim bị thiếu máu cục bộ. Nghiên cứu PiCSO-AMI-I là một nghiên cứu ngẫu nhiên ở những bệnh nhân STEMI thành trước được PCI thông thường so với nhóm can thiệp qua da có hỗ trợ PiCSO [42]. Kết quả ghi nhận 145 bệnh nhân nhóm PiCSO không đạt kết cục chính là giảm kích thước vùng nhồi máu sau 5 ngày, đo trên cộng hưởng từ tim (MRI). Nghiên cứu cũng không đạt được bất kỳ kết cục nào tại thời điểm 6 tháng. Có đến 30% số trường hợp tắc xoang vành không làm giảm đáng kể áp lực xoang vành. Đối nghịch với nghiên cứu PiCSO-AMI-I, nghiên cứu OxAMI (Oxford Acute Myocardial Infarction)-PiCSO cho thấy cải thiện chức năng vi mạch và giảm kích thước thiếu máu cục bộ tại thời điểm 6 tháng ở những bệnh nhân có kháng lực vi mạch trước thủ thuật > 40 đơn vị [44]. Để so sánh thì những bệnh nhân có kháng lực vi mạch trước PCI < 40 đơn vị có kích thước vùng nhồi máu nhỏ hơn với PCI thông thường. Điều này gợi ý rằng, phương pháp tắc xoang vành gián đoạn có thể là một kỹ thuật dành cho những bệnh nhân có tăng kháng lực vi mạch vành trước thủ thuật [44].
IV.GIẢM TẢI THẤT TRÁI TRONG LÚC CAN THIỆP
1. Tổng quan
Giảm tải thất trái có thể định nghĩa là nỗ lực giảm nhu cầu oxy cơ tim và hỗ trợ các vấn đề về huyết động học liên quan đến giảm tái cấu trúc thất và vùng nhồi máu. Các chỉ số huyết động học thất trái bị ảnh hưởng rõ rệt trong và sau nhồi máu cơ tim cấp. Sau tổn thương cơ tim, sự co bóp và tính đàn hồi thất bị tác động nghiêm trọng. Mối tương quan áp lực-thể tích cuối tâm thu, cũng tương đồng với sự co bóp cơ tim, cũng sẽ giảm nặng. Từ đó sẽ dẫn đến giảm khả năng tăng áp lực và làm giảm thể tích nhát bóp. Mối liên quan áp lực-thể tích cuối tâm trương, tương đồng với tính đàn hồi thất, cũng có những thay đổi. Đường cong đàn hồi bị lệch, với kết quả là thất trái trở nên cứng hơn và kém đàn hồi hơn. Từ đó sẽ dẫn đến giảm công nhát bóp, và giảm công cơ học tim toàn thể, cuối cùng là giảm tưới máu cơ quan đích nếu tình trạng kéo dài.
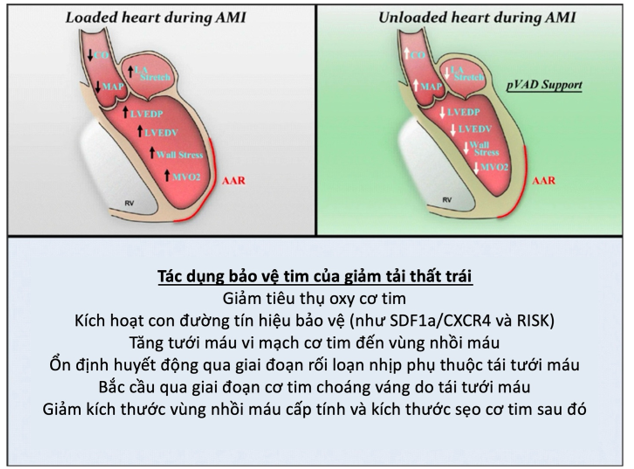
Hình 2. Tác dụng bảo vệ tim của giảm tải thất trái [45]
Tóm lại, bởi vì nhồi máu cơ tim cấp có thể dẫn đến sụt giảm tiêu thụ oxy cơ tim, nếu giảm tải thất trái thì có thể làm giảm tối thiểu tình trạng bất lợi này (Hình 2) [45], từ đó cải thiện chỉ số huyết động thất trái. Các thiết bị hỗ trợ dòng xuyên van trên thị trường đã được chứng minh là cải thiện các chỉ số huyết động thất trái. Các thiết bị này có thể giúp giảm tải thất trái với chế độ dòng thay đổi từ 2,5 – 5,5 L/phút. Đánh giá huyết động mạch vành qua chỗ hẹp có ý nghĩa trên chụp mạch vành bằng dây dẫn áp lực sau đặt Impella CP (Abiomed, Inc.) và Impella 5.0 tại thời điểm hỗ trợ giảm tải thất trái tối thiểu và tối đa đã ghi nhận sự cải thiện áp lực tưới máu vành ở các sang thương hẹp mạch vành đáng kể [46]. Nhiều nghiên cứu đã cho thấy việc sử dụng Impella đưa đến giảm áp lực cuối tâm trương thất trái và giảm áp lực thành thất trái, cũng như giảm kháng lực vi mạch vành [46][47]. Hỗ trợ tối đa cũng được chứng minh làm cải thiện huyết áp tâm thu, huyết áp tâm trương và huyết áp trung bình [46].
Nhờ những tác động trên huyết động này, việc sử dụng Impella trong quản lý sốc tim sau nhồi máu cơ tim đã được nghiên cứu rộng rãi [48][49]. Số liệu từ sổ bộ Uspella 2014, bao gồm mô tả việc sử dụng Impella 2.5 trong nhồi máu cơ tim cấp có sốc tim (AMICS), đã cho thấy rằng việc sử dụng hỗ trợ huyết động từ sớm trước khi PCI có tiềm năng cải thiện kết cục thông qua việc ổn định huyết động trong lúc can thiệp [48]. Một phân tích gộp so sánh việc dùng Impella sớm so với muộn ở AMICS cho thấy giảm tỉ lệ tử vong nội viện và 30 ngày gần 50% trong trường hợp sử dụng sớm [49]. Một nghiên cứu ngẫu nhiên có nhóm chứng tiến cứu cũng xem việc dùng Impella là một chỉ định lâm sàng có tiềm năng trong PCI ở trường hợp bệnh nhân có giảm phân suất tống máu [50]. Một phân tích ghép cặp hơn 28.000 bệnh nhân AMICS đánh giá kết cục những người được PCI có hỗ trợ cơ học cho thấy chỉ 6% số bệnh nhân được dùng các dụng cụ hỗ trợ dòng thất trái so với 30% được dùng bóng đối xung động mạch chủ [51]. Kết quả của nghiên cứu này ghi nhận việc dùng dụng cụ hỗ trợ thất trái trong giai đoạn này liên quan với tăng tỉ lệ tử vong nội viện và biên chứng chảy máu có hiệu chỉnh so với những bệnh nhân dùng bóng đối xung động mạch chủ [51].
2. Những nghiên cứu chủ chốt
Nghiên cứu DanGer Shock
Hiện tại, bằng chứng về việc sử dụng bơm hỗ trợ dòng thường quy trong trường hợp AMICS còn chưa thống nhất. Do đó, nghiên cứu đa trung tâm, đa quốc gia, nhãn mở đã được các nghiên cứu viên Danish-German Cardiogenic Shock tiến hành để đánh giá liệu việc dùng Impella CP (Abiomed Inc.) thêm vào thực hành thông thường có giúp làm giảm tử vong ở bệnh nhân STEMI có sốc tim hay không [52]. Nghiên cứu thu nhận các bệnh nhân tụt huyết áp với huyết áp tâm thu < 100 mmHg, có suy chức năng cơ quan đích với nồng độ acid lactic > 2.5 mmol/L và LVEF < 45%. Những bệnh nhân này được phân nhóm ngẫu nhiên 1:1 khi được chẩn đoán sốc tim và được PCI với Impella duy trì trong 48 giờ hoặc PCI với thuộc vận mạch hoặc tăng co bóp cơ tim. 355 bệnh nhân tham gia nghiên cứu được theo dõi kết cục chính là tử vong do mọi nguyên nhân đến 180 ngày. Các đặc điểm cơ bản của nhóm dân số nghiên cứu gồm: tuổi trung vị 67 tuổi, LVEF trung vị 25%, nồng độ lactate trung vị là 4,5 mmol/L, và phân nhóm sốc tim theo SCAI D hoặc E chiếm 45%. Kết quả ghi nhận tại thời điểm 180 ngày sau phân nhóm, việc dùng Impella thêm vào điều trị chuẩn có tương quan với tỉ lệ tử vong do mọi nguyên nhân thấp hơn điều trị chuẩn đơn thuần (HR 0,74; 95% CI, 0,55-0,99; P=0,04). Các biến cố phụ ghi nhận trong nhóm Impella được ghi nhận là tăng tỉ lệ chảy máu trung bình hoặc nặng, thiếu máu cục bộ chi, điều trị thay thế thận, và nhiễm trùng huyết (24% vs. 6,2%; RR 4,7; 95% CI, 2,36-9,55).
Kết quả nghiên cứu ghi nhận việc dùng thường quy Impella ở nhóm bệnh nhân AMICS do STEMI với những đặc điểm cụ thể như nhóm dân số tham gia nghiên cứu sẽ giúp giảm tử vong do mọi nguyên nhân. Tuy vậy, điều này cũng dẫn đến tỉ lệ biến cố phụ tăng lên. Từ nghiên cứu lâm sàng này đã đưa đến một cơ hội tiềm năng cho một nhóm bệnh nhân cụ thể có thể được hưởng lợi từ việc sử dụng bơm hỗ trợ dòng máu thất trái. Nghiên cứu này cũng nhấn mạnh rằng nhóm dùng Impella vẫn chịu tỉ lệ tử vong tại thời điểm 180 ngày lên đến 45%. Điều này đồng nghĩa với việc cần có thêm nhiều nghiên cứu ở nhóm bệnh nhân này.
Nghiên cứu STEMI-DTU
Giảm tải thất trái đi kèm với trì hoãn tái tưới máu trong 30 phút làm kích hoạt cơ chế bảo vệ tim, dẫn đến giảm thiểu tổn thương tái tưới máu nguy hiểm và giúp phục hồi cơ tim 30 ngày sau nhồi máu cơ tim cấp [53]. Trong nỗ lực xác định thời điểm giảm tải thất trái tối ưu để đạt được hiệu quả bảo vệ tim tốt nhất, các nghiên cứu trên thiên nga vùng Yorkshire ghi nhận tái tưới máu 30 phút sau khi khởi động bơm qua van sẽ đạt được giảm kích thước vùng nhồi máu đáng kể so với tái tưới máu đơn thuần [53]. Từ những kết quả tiền lâm sàng này, nghiên cứu STEMI Door-To-Unload (STEMI-DTU) đã được tiến hành để đánh giá an toàn và hiệu quả của giảm tải thất trái trước tái tưới máu trong trường hợp STEMI không có sốc tim [54].
Đây là nghiên cứu lâm sàng ngẫu nhiên đa trung tâm tiến cứu, được thực hiện tại 14 trung tâm tại Hoa Kỳ. 50 bệnh nhân STEMI thành trước được phân ngẫu nhiên vào nhóm giảm tải thất trái với tái tưới máu ngay lập tức hoặc nhóm giảm tải thất trái trong 30 phút rồi mới tái tưới máu (Hình 3). Mục tiêu của nghiên cứu này là để đánh giá an toàn của giảm tải cơ tim thất trái trong 30 phút trước tái tưới máu với PCI. Kết cục an toàn chính của nghiên cứu là kết cục gộp của biến cố tim mạch hoặc mạch não chính tại thời điểm 30 ngày cùng với các chỉ số an toàn khác. Kết cục hiệu quả chính gồm kích thước vùng nhồi máu so với tổng khối cơ tim thất trái thông qua MRI tim tại thời điểm 30 ngày sau nhồi máu cơ tim.
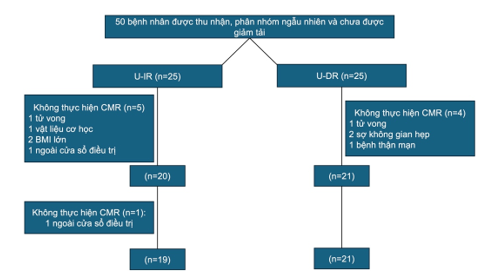
Hình 3. Thiết kế và lưu đồ nghiên cứu DTU-STEMI Pilot
BMI: chỉ số khối cơ thể; CMR: cộng hưởng từ tim; U-DR: trì hoãn tái tưới máu sau 30 phút giảm tải thất trái với Impella CP; U-IR: tái tưới máu ngay lập sau khi đặt Impella CP
Kết quả không ghi nhận khác biệt đáng kể về kết cục hiệu quả chính. Kích thước vùng nhồi máu hiệu chỉnh với vùng nguy cơ trong cả hai nhóm không ghi nhận khác biệt có ý nghĩa thống kê. Kết cục an toàn chính cũng không cho thấy khác biệt giữa hai nhóm. Nghiên cứu này cho thấy giảm tải thất trái với kế hoạch trì hoãn thời gian cửa-bóng 30 phút là an toàn và có thể thực hiện được, với tác dụng phụ không thay đổi đáng kể. Nghiên cứu mở đầu này đã cho thấy thử nghiệm đầu tiên của chiến lược cửa-giảm tải thất trái trên người.
Từ kết quả của nghiên cứu khởi đầu nói trên, nghiên cứu STEMI DTU dài hơi hơn đang được tiến hành [55]. Đây cũng là nghiên cứu đa trung tâm, ngẫu nhiên, tiến cứu so sánh giảm tải thất trái với Impella CP trong 30 phút trước tái tưới máu với khuyến cáo PCI tiên phát hiện hành. Kết cục chính của nghiên cứu là so sánh phần trăm kích thước vùng nhồi máu so với khối lượng cơ thất trái giữa hai nhóm: cửa-giảm tải thất trái và nhóm PCI tiên phát. Kết cục phụ gồm cộng gộp tỉ lệ tử vong do tim mạch sau 1 năm, sốc tim hơn 24 giờ sau PCI, sử dụng dụng cụ hỗ trợ thất trái qua phẫu thuật, hoặc ghép tim, suy tim, khử rung trong tim hoặc dụng cụ tái đồng bộ mạn tính, và kích thước vùng nhồi máu 3-5 ngày sau PCI. Tổng cộng 668 bệnh nhân dự kiến phân nhóm ngẫu nhiên 1:1 và được theo dõi 5 năm. MRI tim được thực hiện tại thời điểm 3-5 ngày và 6 tháng. Mục tiêu của nghiên cứu là để đánh gía liệu giảm tải thất trái bằng dụng cụ hỗ trợ xuyên van qua da trong 30 phút trước PCI tiên phát có làm giảm kích thước vùng nhồi máu và tỉ lệ kết cục lâm sàng liên quan suy tim hay không.
V. KẾT LUẬN
Bài viết này đã lược qua những dữ kiện cơ bản, các công trình nghiên cứu đã công bố gần đây, cũng như thiết kế nghiên cứu đang được tiến hành liên quan đến sự chuyển dịch tiềm năng trong xu hướng quản lý hội chứng vành cấp. Kích thước vùng nhồi máu sau nhồi máu cơ tim là một thành tố quan trọng liên quan đến tỉ lệ nhập viện mới do suy tim mà bệnh nhân có thể gánh chịu sau tái tưới máu. Tái tưới máu có thể kích hoạt những con đường sinh hóa liên quan tới kích thước vùng nhồi máu và việc giảm tải thất trái có tiềm năng cải thiện những tổn thương liên quan đến tái tưới máu này. Nghiên cứu lâm sàng được công bố gần đây đã cho thấy tiềm năng cải thiện tỉ lệ tử vong của phương thức giảm tải thất trái ở bệnh nhân STEMI có sốc tim. Chúng ta cần thêm các thử nghiệm lâm sàng để đánh giá thêm việc dùng thường quy phương pháp này ở tình huống STEMI nhưng không đi kèm sốc tim.
TÀI LIỆU THAM KHẢO
[1] Benjamin EJ, Muntner P, Alonso A, et al. Heart Disease and Stroke Statistics—2019 Update: A Report From the American Heart Association. Circulation. 2019;139(10):e56–e528.
[2] Yeh RW, Sidney S, Chandra M, et al. Population Trends in the Incidence and Outcomes of Acute Myocardial Infarction. New England Journal of Medicine. 2010;362(23):2155–2165.
[3] Nabel EG, Braunwald E. A Tale of Coronary Artery Disease and Myocardial Infarction. New England Journal of Medicine. 2012;366(1):54–63.
[4] Fox KAA, Steg PG, Eagle KA, et al. Decline in Rates of Death and Heart Failure in Acute Coronary Syndromes, 1999-2006. JAMA. 2007;297(17):1892–1900.
[5] Keeley EC, Boura JA, Grines CL. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction: a quantitative review of 23 randomised trials. The Lancet. 2003;361(9351):13–20.
[6] Stone GW, Selker HP, Thiele H, et al. Relationship Between Infarct Size and Outcomes Following Primary PCI: Patient-Level Analysis From 10 Randomized Trials. Journal of the American College of Cardiology. 2016;67(14):1674–1683.
[7] Pride YB, Giuseffi JL, Mohanavelu S, et al. Relation Between Infarct Size in ST-Segment Elevation Myocardial Infarction Treated Successfully by Percutaneous Coronary Intervention and Left Ventricular Ejection Fraction Three Months After the Infarct. American Journal of Cardiology. 2010;106(5):635–640.
[8] Stone GW, Webb J, Cox DA, et al. Distal Microcirculatory Protection During Percutaneous Coronary Intervention in Acute ST-Segment Elevation Myocardial InfarctionA Randomized Controlled Trial. JAMA. 2005;293(9):1063–1072.
[9] Effect of Supersaturated Oxygen Delivery on Infarct Size After Percutaneous Coronary Intervention in Acute Myocardial Infarction | Circulation: Cardiovascular Interventions [Internet]. [cited 2024 Oct 31]. Available from: https://www.ahajournals.org/doi/10.1161/ CIRCINTERVENTIONS.108.840066.
[10] Selker HP, Beshansky JR, Sheehan PR, et al. Out-of-Hospital Administration of Intravenous Glucose-Insulin-Potassium in Patients With Suspected Acute Coronary Syndromes: The IMMEDIATE Randomized Controlled Trial. JAMA. 2012;307(18):1925–1933.
[11] Patel MR, Worthley SG, Stebbins A, et al. Pexelizumab and Infarct Size in Patients With Acute Myocardial Infarction Undergoing Primary Percutaneous Coronary Intervention: A Delayed Enhancement Cardiac Magnetic Resonance Substudy From the APEX-AMI Trial. JACC: Cardiovascular Imaging. 2010;3(1):52–60.
[12] Thiele H, Schindler K, Friedenberger J, et al. Intracoronary Compared With Intravenous Bolus Abciximab Application in Patients With ST-Elevation Myocardial Infarction Undergoing Primary Percutaneous Coronary Intervention. Circulation. 2008;118(1):49–57.
[13] Thiele H, Hildebrand L, Schirdewahn C, et al. Impact of High-Dose N-Acetylcysteine Versus Placebo on Contrast-Induced Nephropathy and Myocardial Reperfusion Injury in Unselected Patients With ST-Segment Elevation Myocardial Infarction Undergoing Primary Percutaneous Coronary Intervention. Journal of the American College of Cardiology. 2010;55(20):2201–2209.
[14] Thiele H, Eitel I, Meinberg C, et al. Randomized Comparison of Pre-Hospital–Initiated Facilitated Percutaneous Coronary Intervention Versus Primary Percutaneous Coronary Intervention in Acute Myocardial Infarction Very Early After Symptom Onset: The LIPSIA-STEMI Trial (Leipzig Immediate Prehospital Facilitated Angioplasty in ST-Segment Myocardial Infarction). JACC: Cardiovascular Interventions. 2011;4(6):605–614.
[15] Patel MR, Smalling RW, Thiele H, et al. Intra-aortic Balloon Counterpulsation and Infarct Size in Patients With Acute Anterior Myocardial Infarction Without Shock: The CRISP AMI Randomized Trial. JAMA. 2011;306(12):1329–1337.
[16] Eitel I, Wöhrle J, Suenkel H, et al. Intracoronary Compared With Intravenous Bolus Abciximab Application During Primary Percutaneous Coronary Intervention in ST-Segment Elevation Myocardial Infarction: Cardiac Magnetic Resonance Substudy of the AIDA STEMI Trial. Journal of the American College of Cardiology. 2013;61(13):1447–1454.
[17] Stone GW, Maehara A, Witzenbichler B, et al. Intracoronary Abciximab and Aspiration Thrombectomy in Patients With Large Anterior Myocardial Infarction: The INFUSE-AMI Randomized Trial. JAMA. 2012;307(17):1817–1826.
[18] Nallamothu BK, Krumholz HM, Peterson ED, et al. Door-to-Balloon Times in Hospitals Within the Get-With-The-Guidelines Registry After Initiation of the Door-to-Balloon (D2B) Alliance. American Journal of Cardiology. 2009;103(8):1051–1055.
[19] Menees DS, Peterson ED, Wang Y, et al. Door-to-Balloon Time and Mortality among Patients Undergoing Primary PCI. New England Journal of Medicine. 2013;369(10):901–909.
[20] Ezekowitz JA, Kaul P, Bakal JA, et al. Declining In-Hospital Mortality and Increasing Heart Failure Incidence in Elderly Patients With First Myocardial Infarction. Journal of the American College of Cardiology. 2009;53(1):13–20.
[21] JCI – Myocardial ischemia-reperfusion injury: a neglected therapeutic target [Internet]. [cited 2024 Oct 31]. Available from: https://www.jci.org/articles/view/62874.
[22] fresh look at reperfusion injury1 | Cardiovascular Research | Oxford Academic [Internet]. [cited 2024 Oct 31]. Available from: https://academic.oup.com/cardiovascres/article/38/2/291/298922.
[23] Abrupt reoxygenation of the anoxic potassium-arrested perfused rat heart: A study of myocardial enzyme release – Journal of Molecular and Cellular Cardiology [Internet]. [cited 2024 Oct 31]. Available from: https://www.jmcc-online.com/article/0022-2828(73)90030-8/abstract.
[24] Involvement of neutrophils in the pathogenesis of lethal myocardial reperfusion injury | Cardiovascular Research | Oxford Academic [Internet]. [cited 2024 Oct 31]. Available from: https://academic.oup.com/cardiovascres/article/61/3/481/404101.
[25] Feng L, Lai Q-M, Zhou G-M, et al. Simvastatin relieves myocardial ischemia/reperfusion injury in rats through hedgehog signaling pathway. Eur Rev Med Pharmacol Sci. 2020;24(11):6400–6408.
[26] Hausenloy DJ, Tsang A, Yellon DM. The Reperfusion Injury Salvage Kinase Pathway: A Common Target for Both Ischemic Preconditioning and Postconditioning. Trends in Cardiovascular Medicine. 2005;15(2):69–75.
[27] Caixeta A, Lansky AJ, Mehran R, et al. Predictors of suboptimal TIMI flow after primary angioplasty for acute myocardial infarction: results from the HORIZONS-AMI trial [Internet]. [cited 2024 Oct 31]. Available from: https://eurointervention.pcronline.com/article/predictors-of-suboptimal-timi-flow-after-primary-angioplasty-for-acute-myocardial-infarction-results-from-the-horizons-ami-trial.
[28] van Kranenburg M, Magro M, Thiele H, et al. Prognostic Value of Microvascular Obstruction and Infarct Size, as Measured by CMR in STEMI Patients. JACC: Cardiovascular Imaging. 2014;7(9):930–939.
[29] Nijveldt R, Beek AM, Hirsch A, et al. Functional Recovery After Acute Myocardial Infarction: Comparison Between Angiography, Electrocardiography, and Cardiovascular Magnetic Resonance Measures of Microvascular Injury. Journal of the American College of Cardiology. 2008;52(3):181–189.
[30] van ’t Hof AW, Liem A, Suryapranata H, et al. Angiographic assessment of myocardial reperfusion in patients treated with primary angioplasty for acute myocardial infarction: myocardial blush grade. Zwolle Myocardial Infarction Study Group. Circulation. 1998;97(23):2302–2306.
[31] Marra MP, Corbetti F, Cacciavillani L, et al. Relationship between myocardial blush grades, staining, and severe microvascular damage after primary percutaneous coronary intervention a study performed with contrast-enhanced magnetic resonance in a large consecutive series of patients. Am Heart J. 2010;159(6):1124–1132.
[32] Marc MC, Iancu AC, Ober CD, et al. Pre-revascularization coronary wedge pressure as marker of adverse long-term left ventricular remodelling in patients with acute ST-segment elevation myocardial infarction. Sci Rep. 2018;8(1):1897.
[33] Milasinovic D, Nedeljkovic O, Maksimovic R, et al. Coronary Microcirculation: The Next Frontier in the Management of STEMI. J Clin Med. 2023;12(4):1602.
[34] Maznyczka AM, Oldroyd KG, McCartney P, et al. The Potential Use of the Index of Microcirculatory Resistance to Guide Stratification of Patients for Adjunctive Therapy in Acute Myocardial Infarction. JACC: Cardiovascular Interventions. 2019;12(10):951–966.
[35] Sezer M, Oflaz H, Gören T, et al. Intracoronary Streptokinase after Primary Percutaneous Coronary Intervention. New England Journal of Medicine. 2007;356(18):1823–1834.
[36] McCartney PJ, Eteiba H, Maznyczka AM, et al. Effect of Low-Dose Intracoronary Alteplase During Primary Percutaneous Coronary Intervention on Microvascular Obstruction in Patients With Acute Myocardial Infarction: A Randomized Clinical Trial. JAMA. 2019;321(1):56–68.
[37] McCartney PJ, Maznyczka AM, Eteiba H, et al. Low-Dose Alteplase During Primary Percutaneous Coronary Intervention According to Ischemic Time. Journal of the American College of Cardiology. 2020;75(12):1406–1421.
[38] Sezer M, Escaned J, Broyd CJ, et al. Gradual Versus Abrupt Reperfusion During Primary Percutaneous Coronary Interventions in ST-Segment-Elevation Myocardial Infarction (GUARD). J Am Heart Assoc. 2022;11(10):e024172.
[39] Ito N, Nanto S, Doi Y, et al. Beneficial effects of intracoronary nicorandil on microvascular dysfunction after primary percutaneous coronary intervention: demonstration of its superiority to nitroglycerin in a cross-over study. Cardiovasc Drugs Ther. 2013;27(4):279–287.
[40] Qian G, Zhang Y, Dong W, et al. Effects of Nicorandil Administration on Infarct Size in Patients With ST-Segment-Elevation Myocardial Infarction Undergoing Primary Percutaneous Coronary Intervention: The CHANGE Trial. J Am Heart Assoc. 2022;11(18):e026232.
[41] Impact of a Single Intravenous Administration of Nicorandil Before Reperfusion in Patients With ST-Segment–Elevation Myocardial Infarction | Circulation [Internet]. [cited 2024 Oct 31]. Available from: https://www.ahajournals.org/doi/10.1161/ CIRCULATIONAHA.104.530329.
[42] Nazir SA, McCann GP, Greenwood JP, et al. Strategies to attenuate micro-vascular obstruction during P-PCI: the randomized reperfusion facilitated by local adjunctive therapy in ST-elevation myocardial infarction trial. European Heart Journal. 2016;37(24):1910–1919.
[43] De Maria GL, Greenwood JP, Zaman AG, et al. Pressure-Controlled Intermittent Coronary Sinus Occlusion (PiCSO) in Acute Myocardial Infarction: The PiCSO-AMI-I Trial. Circulation: Cardiovascular Interventions. 2024;17(4):e013675.
[44] Shanmuganathan M, Masi A, Burrage MK, et al. Acute Response in the Noninfarcted Myocardium Predicts Long-Term Major Adverse Cardiac Events After STEMI. JACC: Cardiovascular Imaging. 2023;16(1):46–59.
[45] Curran J, Burkhoff D, Kloner RA. Beyond Reperfusion: Acute Ventricular Unloading and Cardioprotection During Myocardial Infarction. J of Cardiovasc Trans Res. 2019;12(2):95–106.
[46] Alqarqaz M, Basir M, Alaswad K, et al. Effects of Impella on Coronary Perfusion in Patients With Critical Coronary Artery Stenosis. Circulation: Cardiovascular Interventions. 2018;11(4):e005870.
[47] Remmelink M, Sjauw KD, Henriques JPS, et al. Effects of mechanical left ventricular unloading by impella on left ventricular dynamics in high-risk and primary percutaneous coronary intervention patients. Catheterization and Cardiovascular Interventions. 2010;75(2):187–194.
[48] O’neill WW, Schreiber T, Wohns DHW, et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 2014;27(1):1–11.
[49] Flaherty MP, Khan AR, O’Neill WW. Early Initiation of Impella in Acute Myocardial Infarction Complicated by Cardiogenic Shock Improves Survival: A Meta-Analysis. JACC: Cardiovascular Interventions. 2017;10(17):1805–1806.
[50] O’Neill WW, Kleiman NS, Moses J, et al. A Prospective, Randomized Clinical Trial of Hemodynamic Support With Impella 2.5 Versus Intra-Aortic Balloon Pump in Patients Undergoing High-Risk Percutaneous Coronary Intervention. Circulation. 2012;126(14):1717–1727.
[51] Dhruva SS, Ross JS, Mortazavi BJ, et al. Association of Use of an Intravascular Microaxial Left Ventricular Assist Device vs Intra-aortic Balloon Pump With In-Hospital Mortality and Major Bleeding Among Patients With Acute Myocardial Infarction Complicated by Cardiogenic Shock. JAMA. 2020;323(8):734–745.
[52] Møller JE, Engstrøm T, Jensen LO, et al. Microaxial Flow Pump or Standard Care in Infarct-Related Cardiogenic Shock. New England Journal of Medicine. 2024;390(15):1382–1393.
[53] Esposito ML, Zhang Y, Qiao X, et al. Left Ventricular Unloading Before Reperfusion Promotes Functional Recovery After Acute Myocardial Infarction. Journal of the American College of Cardiology. 2018;72(5):501–514.
[54] Kapur NK, Alkhouli MA, DeMartini TJ, et al. Unloading the Left Ventricle Before Reperfusion in Patients With Anterior ST-Segment–Elevation Myocardial Infarction. Circulation. 2019;139(3):337–346.
[55] Kapur NK, Kim RJ, Moses JW, et al. Primary left ventricular unloading with delayed reperfusion in patients with anterior ST-elevation myocardial infarction: Rationale and design of the STEMI-DTU randomized pivotal trial. American Heart Journal. 2022;254:122–132.







