NGUYỄN LÊ HIỆP1, LÊ THANH MINH PHƯƠNG1
TRẦN QUỐC BẢO2, VÕ TAM3, TRƯƠNG MINH TÚ4
NGUYỄN THỊ THU HOÀI4 VÀ KIỀU THỊ TUYẾT MAI1,*
1Khoa Quản lý và Kinh tế Dược, Trường Đại học Dược Hà Nội
2Cục Y tế dự phòng, Bộ Y tế
3Hội Tiết niệu – Thận học Việt Nam
4Công ty Trách nhiệm hữu hạn AstraZeneca Việt Nam
TÓM TẮT
Nghiên cứu nhằm tổng quan gánh nặng bệnh thận mạn (CKD) trên toàn cầu và tại Việt Nam, tập trung vào tỷ lệ hiện mắc, mắc mới và tử vong. Sàng lọc các nghiên cứu xuất bản trong khoảng thời gian từ 2015-2025, chúng tôi tổng quan 299 nghiên cứu báo cáo tỷ lệ hiện mắc, 105 báo cáo mắc mới và 31 báo cáo tử vong được phân tích. Kết quả cho thấy tỷ lệ hiện mắc BTM trong cộng đồng dao động từ 1,9–32,3%, tỷ suất mắc mới 1,6–86,7 ca/1000 người-năm và tỷ suất tử vong 4,7–47,7 ca/1000 người-năm, với sự khác biệt lớn được ghi nhận giữa các quốc gia. Nguyên nhân chủ yếu cho sự khác biệt là do tiêu chuẩn chẩn đoán không đồng nhất và đặc điểm dân số khác nhau. ĐTĐ và THA được xác định là yếu tố nguy cơ hàng đầu trên toàn cầu. Dữ liệu tổng quan cho thấy CKD là gánh nặng y tế lớn, biến thiên nhiều theo khu vực, cần có chiến lược kiểm soát và quản lý đồng bộ nhằm giảm tác động bệnh.
Từ khoá: bệnh thận mạn, hiện mắc, mắc mới, tử vong, yếu tố nguy cơ
I. ĐẶT VẤN ĐỀ
Bệnh thận mạn (chronic kidney disease-CKD) đã và đang là gánh nặng y tế toàn cầu, với mức độ ảnh hưởng ngày càng mở rộng. Ước tính năm 2023, tổng số ca mắc bệnh thận mạn toàn cầu là 850 triệu ca, tương đương khoảng 10% dân số thế giới [1,2]. Tử vong do CKD, bao gồm tử vong trực tiếp và gián tiếp qua các biến chứng liên quan, tiếp tục gia tăng bất chấp các tiến bộ trong điều trị và quản lý bệnh [3–5]. Số ca tử vong liên quan đến CKD đã tăng hơn gấp đôi, từ 0,6 triệu năm 1990 lên 1,43 triệu năm 2019, đứng hàng thứ 10 trên toàn cầu [6]. Tới năm 2040, CKD được dự đoán trở thành nguyên nhân đứng thứ 5 gây ra số năm sống bị mất (Years of Life Lost – YLLs) [7].
Dữ liệu về dịch tễ học CKD khác nhau đáng kể giữa các quốc gia và khu vực. Một phân tích từ 161 quốc gia ghi nhận tỷ lệ mắc CKD cao nhất ở Đông và Trung Âu (12,81%) và thấp nhất tại châu Phi (4,19%). Các quốc gia thu nhập cao có xu hướng ghi nhận tỷ lệ hiện mắc cao hơn (11,14%) so với nhóm thu nhập trung bình cao (10,73%), trung bình thấp (7,48%) và thấp (3,58%) [2]. Một số yếu tố nguy cơ quan trọng được chỉ ra trong các nghiên cứu bao gồm tuổi và các yếu tố bệnh lý như tăng huyết áp (THA), đái tháo đường (ĐTĐ), béo phì [8–10]. Tuy vậy, các nghiên cứu thường khác nhau về thời điểm, địa điểm, dân số khảo sát và thiết kế nghiên cứu, gây khó khăn trong việc so sánh và tổng hợp bằng chứng một cách hệ thống.
Tại Việt Nam, các dữ liệu dịch tễ học về bệnh thận mạn chưa đầy đủ. Phần lớn các báo cáo mới chỉ dừng lại ở quy mô khu vực hoặc nhóm đối tượng riêng lẻ, dẫn đến thiếu hụt cái nhìn toàn diện về tình hình CKD trên phạm vi quốc gia. Điều này gây khó khăn cho việc định hướng xây dựng chính sách và lập kế hoạch can thiệp y tế công cộng phù hợp dẫn đến việc chậm trễ trong phòng ngừa, phát hiện sớm và quản lý bệnh, làm tăng gánh nặng cho hệ thống y tế và xã hội. Xuất phát từ thực tế đó, việc thực hiện một tổng quan hệ thống nhằm tổng hợp các bằng chứng hiện có về dịch tễ bệnh thận mạn bao gồm tỷ lệ hiện mắc, tỷ suất mắc mới và tỷ suất tử vong trong dân số người trưởng thành là cần thiết. Kết quả từ tổng quan này sẽ góp phần cung cấp một bức tranh toàn cảnh về sự phân bố và gánh nặng của bệnh thận mạn ở cả phạm vi toàn cầu và tại Việt Nam, làm cơ sở cho việc đánh giá tình hình thực tế và xây dựng các ưu tiên y tế trong phòng ngừa, quản lý và kiểm soát bệnh thận mạn trong cộng đồng.
II. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP
II.1. Thiết kế nghiên cứu
Nghiên cứu tổng quan hệ thống được thực hiện theo Hướng dẫn Mục đánh giá ưu tiên cho tổng quan hệ thống và phân tích meta (Preferred Reporting Items for Systematic Reviews and Meta-Analyses – PRISMA [11].
II.2. Chiến lược tìm kiếm bài báo
Cơ sở dữ liệu
Nghiên cứu lựa chọn hai cơ sở dữ liệu chính để thu thập tài liệu là PubMed và Embase (dữ liệu tính đến ngày 20/6/2025).
Từ khóa tìm kiếm
Chiến lược tìm kiếm gồm hai nhóm từ khóa chính: bệnh (chronic kidney disease) và dịch tễ học (prevalence, incidence, death) cùng các từ đồng nghĩa, kết hợp bằng toán tử OR và AND tùy theo cú pháp của từng cơ sở dữ liệu. Ngoài ra, tài liệu tham khảo và luận văn, luận án trong khối ngành sức khỏe tại Việt Nam cũng được rà soát để bổ sung kết quả.
Lựa chọn nghiên cứu phù hợp
Các nghiên cứu được lựa chọn đưa vào tổng quan thỏa mãn các tiêu chí sau:
- Nghiên cứu quan sát (thuần tập, cắt ngang)
- Báo cáo ít nhất một trong các chỉ số: tỷ lệ hiện mắc, tỷ suất mắc mới, hoặc tỷ suất tử vong.
- Công bố từ năm 2015 đến năm 2025.
Các bài báo/bản ghi sẽ bị loại khỏi nghiên cứu nếu:
- Không phải nghiên cứu gốc
- Nghiên cứu trên người dưới 18 tuổi
- Thử nghiệm lâm sàng ngẫu nhiên có đối chứng
- Nghiên cứu bệnh chứng
- Tổng quan hệ thống
- Báo cáo ca và báo cáo loạt ca
- Cỡ mẫu < 200
- Không có sẵn bản đầy đủ bằng Tiếng Anh hoặc Tiếng Việt
II.3. Trích xuất và quản lý dữ liệu
Quá trình lựa chọn nghiên cứu được hai nghiên cứu viên thực hiện độc lập, rà soát tiêu đề và tóm tắt các bài sau khi loại trừ trùng lặp theo tiêu chuẩn đã thống nhất. Bất đồng được thảo luận hoặc tham khảo ý kiến nghiên cứu viên cấp cao để thống nhất. Các nghiên cứu đạt tiêu chuẩn sẽ được đọc toàn văn (nếu khả thi) và trích xuất dữ liệu qua biểu mẫu chuẩn hóa, bao gồm đặc điểm và kết quả nghiên cứu.
III. KẾT QUẢ
III.1. Kết quả tìm kiếm
Từ 7911 bài báo được sàng lọc tiêu đề/tóm tắt, chúng tôi chọn ra 1519 bài báo để sàng lọc toàn văn. Sau cùng, chúng tôi phân tích 299 bài báo đánh giá tỷ lệ hiện mắc CKD, 105 bài báo cáo tỷ suất mắc mới, và 31 bài phù hợp cho báo cáo tỷ suất tử vong, trên hai nhóm đối tượng nghiên cứu lớn là nhóm quần thể chung và nhóm quần thể nguy cơ. Có 4 nghiên cứu báo cáo 2 trong 3 chỉ số, được phân vào các nhóm bài tương ứng với chỉ số. Các bước sàng lọc bài báo cho tổng quan được trình bày tại Hình 1.
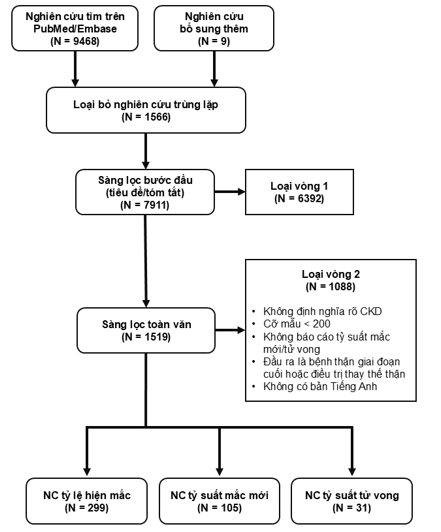
Hình 1. Quá trình lựa chọn nghiên cứu cho tổng quan hệ thống
Dữ liệu về tỷ lệ hiện mắc được báo cáo trong 291 nghiên cứu tại 68 quốc gia trên tất cả các châu lục và trong 8 nghiên cứu đa quốc gia. Trong đó, Trung Quốc (56;19,2%) và Hoa Kỳ (54;18,6%) là hai quốc gia có số lượng nghiên cứu nhiều nhất. 100% các nghiên cứu về tỷ lệ hiện mắc là nghiên cứu mô tả cắt ngang hoặc thực hiện trên dữ liệu thứ cấp từ các nguồn dữ liệu nghiên cứu thuần tập. 160 nghiên cứu (55,0%) báo cáo tỷ lệ hiện mắc trên quần thể dân số chung; các quần thể nguy cơ cao được nghiên cứu phổ biến gồm bệnh nhân ĐTĐ (55;18,9%), bệnh nhân mắc bệnh tim mạch (21;7,2%) và THA (12;4,1%) và bệnh nhân HIV (14;4,8%). Về tỷ lệ mắc mới, chúng tôi ghi nhận 97 nghiên cứu tại 22 quốc gia và 8 nghiên cứu đa quốc gia; các nghiên cứu được thực hiện nhiều nhất tại Hoa Kỳ (17;17,5%) và Hàn Quốc (14;14,4%). Có 56 nghiên cứu (53,3%) báo cáo tỷ suất mắc mới trên quần thể dân số chung, 14 nghiên cứu (13,3%) báo cáo tỷ suất mắc mới CKD trên nền bệnh nhân ĐTĐ, trong khi chỉ có 2 nghiên cứu (1,9%) được thực hiện trên đối tượng bệnh nhân THA. Chúng tôi ghi nhận được 31 nghiên cứu báo cáo tỷ suất tử vong trên bệnh nhân CKD, chủ yếu thực hiện tại Bắc Mỹ (14;45,2%) và Châu Âu (11;35,5%). THA là bệnh đồng mắc phổ biến nhất trong các nghiên cứu có đầu ra tử vong, với tỷ lệ mắc trong quần thể CKD dao động từ 12,8% tới 93,9% và lên tới 99,4% ở bệnh nhân đồng mắc suy tim và ĐTĐ. ĐTĐ cũng là một bệnh đồng mắc được quan tâm, với tỷ lệ mắc từ 16,8% tới 48,0% trong các nghiên cứu.
III.2. Chẩn đoán CKD
Trong các nghiên cứu, CKD được chẩn đoán dựa trên dấu hiệu suy giảm chức năng thận (giảm eGFR), dấu hiệu tổn thương thận (protein/albumin niệu), kết hợp cả hai dấu hiệu trên, hoặc dựa trên dữ liệu chẩn đoán đã được ghi nhận sẵn qua mã ICD (N18x). Dựa trên eGFR, CKD thường được xác định khi eGFR dưới 60 ml/phút/1,73m2, tương đương với giai đoạn G3-G5 theo KDIGO.[16] CKD-EPI (bản 2009 và 2021) và MDRD là hai công thức được dùng phổ biến nhất để tính toán eGFR; kết quả từ hai công thức có thể khác biệt nhỏ, chẳng hạn như một số nghiên cứu ghi nhận tỷ lệ hiện mắc khi dùng công thức CKD-EPI thấp hơn từ 0,6-3,0% so với khi dùng công thức MDRD trên cùng một quần thể [17,18]. Dấu hiệu tổn thương thận thường được xác định khi tỷ số albumin trên creatinin trong nước tiểu (uACR) ≥ 30mg/g, hoặc protein niệu ≥ 1+. Các tiêu chuẩn chẩn đoán CKD chính được tổng hợp trong Bảng 1.
Bảng 1. Tiêu chí xác định bệnh thận mạn trong các nghiên cứu
| Tiêu chí | Tỷ lệ hiện mắc
(N = 299) |
Tỷ suất mắc mới
(N = 105) |
Tỷ suất tử vong
(N = 31) |
| eGFR, một thời điểm | 108 (36,1%) | 32 (30,5%) | 15 (58,4%) |
| eGFR, ≥ 2 thời điểm
(60-90 ngày) |
17 (5,7%) | 25 (23,8%) | 0 (0,0%) |
| eGFR + protein niệu,
một thời điểm |
131 (43,8%) | 16 (15,2%) | 7 (22,6%) |
| eGFR + protein niệu,
≥ 2 thời điểm (60-90 ngày) |
31 (10,4%) | 13 (12,4%) | 1 (3,2%) |
| Mã ICD 9, ICD 10 | 8 (2,7%) | 16 (15,2%) | 7 (22,6%) |
| Khác | 4 (1,3%) | 3 (2,9%) | 1 (3,2%) |
III.3. CKD trên quần thể chung
Tỷ lệ hiện mắc, tỷ suất mắc mới và tử vong do CKD trong quần thể dân số chung, tại một số quốc gia đại diện cho các khu vực trên thế giới được trình bày ở Bảng 2.
Bảng 2. Dữ liệu CKD từ một số quốc gia trên thế giới
| Tỷ lệ hiện mắc | Tỷ suất mắc mới
(ca/1000 người-năm) |
Tỷ suất tử vong
(ca/1000 người-năm) |
|
| Châu Á – Thái Bình Dương | |||
| Trung Quốc | 2,2% – 18,1% [19,20] | 9,9 – 25,2 [21,22] | 13,8 [4] |
| Nhật Bản | 4,6% – 17,2% [23,24] | 11,4 – 86,7 [25,26] | 4,7 – 21,5 [27] |
| Hàn Quốc | 5,5% – 10,2% [28,29] | 4,0 – 22,4 [30,31] | 134 [32] |
| Úc | 4,0% – 8,8% [33,34] | – | – |
| Việt Nam | 3,3% – 13,1% [35,36] | – | 26,4$ [37] |
| Singapore | 11,4% – 14,0% [38,39] | – | |
| Ấn Độ | 4,3% – 32,2% [40,41] | – | – |
| Bắc Mỹ | |||
| Hoa Kỳ | 3,9% – 18,1% [42,43] | 1,6 – 21,4 [44,45] | 15,4 – 47,7 [46,47] |
| Châu Âu | |||
| Anh Quốc | 2,3% – 13,9% [18,48] | 1,6 – 4,7 [49,50] | 29,9 – 47,0 [12,51] |
| Đức | 5,6% [52] | – | 22,4 [14] |
| Tây Ban Nha | 2,2% – 14,4% [53,54] | 2,1 [55] | 12,1 [55] |
| Bắc Âu | 4,6% – 11,0% [56,57] | 2,9 – 10,7 [58,59] | 7,0 – 22,9 [13] |
| Trung Đông & Bắc Phi | |||
| Ả Rập Saudi | 4,8% [60] | – | – |
| Iran | 5,1% – 30,9% [61,62] | 3,2 – 50,1 [63,64] | – |
| Châu Phi hạ Sahara | |||
| Nigeria | 1,9% – 11,8% [65,66] | – | – |
| Nam Phi | 3,4% – 17,2% [67,68] | – | – |
| Mỹ Latin | |||
| Một số quốc gia Trung, Nam Mỹ | 7,0% – 20,1% [69,70] | – | – |
$ Nghiên cứu trên quần thể bệnh nhân cao tuổi tại Đông Nam Á, có phẫu thuật xương hông
Tỷ lệ hiện mắc trên quần thể chung dao động từ 1,9%-40,4%, chủ yếu tập trung trong khoảng từ 10-dưới 20%. Ở khu vực châu Á – Thái Bình Dương, tỷ lệ hiện mắc CKD qua các nghiên cứu từ 1,9%-32,2%, trong đó cao nhất tại Ấn Độ (4,3%-32,2%), Singapore (11,4%-40,4%) và Trung Quốc (2,2%-18,1%). Hai quốc gia có dân số già là Nhật Bản và Hàn Quốc lại ghi nhận tỷ lệ hiện mắc thấp hơn, lần lượt 4,6%-17,2% và 5,5%-10,2%. Tại Việt Nam, tỷ lệ hiện mắc dao động từ 3,3%-13,1%. Tại châu Mỹ, Hoa Kỳ có tỷ lệ hiện mắc từ 3,9%-18,1%. Các nghiên cứu tại châu Âu ghi nhận sự tương đồng cao hơn: Bắc Âu (Thuỵ Điển, Đan Mạch, Na Uy, Iceland) là 4,6%-11,0%, Anh Quốc 2,3%-19,3%, Tây Ban Nha 2,2%-14,4% và Đức 5,6%. Khu vực Trung Đông và châu Phi có số liệu hạn chế: các nghiên cứu tại Iran ghi nhận tỷ lệ từ 5,1%-30,9%, còn Nigeria từ 1,9%-11,8%. Chúng tôi ghi nhận một số nghiên cứu theo dõi sự thay đổi tỷ lệ hiện mắc theo thời gian. Đáng chú ý là chỉ một nghiên cứu tại Cộng hoà Séc cho thấy tỷ lệ hiện mắc CKD giảm, từ 6,8% ở nam và 7,6% ở nữ năm 2009 xuống lần lượt 3,6% và 4,8% năm 2018 [71]. Một nghiên cứu dọc tại Mỹ cho thấy tỷ lệ hiện mắc lên xuống nhẹ và thay đổi rất ít (13,1%-14,0%) từ 2006-2018 [72]; các nghiên cứu khác ghi nhận xu hướng tăng đáng kể, ước tính tăng 1,5-1,6 lần trong các nghiên cứu tại Đan Mạch và Úc [59,73].
Tỷ suất mắc mới và tỷ suất tử vong cũng thể hiện sự chênh lệch rõ rệt. Tỷ suất mắc mới được báo cáo dao động trong khoảng 1,6-86,7 ca/1000 người-năm, thấp nhất được ghi nhận ở Anh Quốc (1,6/1000 người-năm) và cao nhất 86,7/1000 người-năm tại Nhật Bản. Nghiên cứu trên dân số Trung Quốc cho thấy tỷ lệ mắc mới CKD tại quốc gia này là từ 9,9–25,2 ca/1000 người-năm, còn tại Hàn Quốc là 4,0-22,4 ca/1000 người-năm. Tại Đông Nam Á, một nghiên cứu trên bệnh nhân cao tuổi cho kết quả tỷ suất mắc mới 26,4 ca/1000 người-năm. Tỷ suất tử vong ghi nhận từ 4,7-134,0 ca/1.000 người-năm, thấp nhất trong một nghiên cứu tại Nhật Bản (4,7) và cao nhất ghi nhận tại Hàn Quốc (134,0), cho thấy sự khác biệt rõ rệt giữa các quốc gia về gánh nặng tử vong liên quan đến CKD. Một số quốc gia cũng ghi nhận tỷ suất tử vong cao là Hoa Kỳ (15,4–47,7 ca/1000 người-năm) và Anh Quốc (29,9–47,0 ca/1000 người-năm).
III.4. CKD trên quần thể nguy cơ
ĐTĐ là yếu tố nguy cơ được nghiên cứu nhiều nhất, chủ yếu là ĐTĐ típ 2. Tỷ lệ hiện mắc CKD trên nền ĐTĐ được ghi nhận từ 8,7%-40,3%, thấp nhất 8,7% tại Saudi Arabia và cao nhất 40,3% tại Trung Quốc. Tỷ lệ hiện mắc và tỷ lệ mắc mới CKD trên ĐTĐ típ 1 thường thấp hơn so với nhóm ĐTĐ típ 2 do tuổi trung bình trẻ hơn, dao động từ 3,0%-25,2% [74,75]. Trên bệnh nhân ĐTĐ típ 2, các nghiên cứu tại Hoa Kỳ cho thấy tỷ lệ hiện mắc CKD từ 10,4%-37,9% [76,77], còn tại Tây Ban Nha là 24,3%-28,3% [78,79]. Tại Châu Á, một nghiên cứu tại Nhật Bản cho thấy có thể có tới 56,7% bệnh nhân ĐTĐ típ 2 mắc CKD [80], Trung Quốc là 25,6%-49,3% [81,82], Hàn Quốc 24,4%-36,0% [83,84], và Thái Lan 25,4% [85]. Kết quả tại Việt Nam không quá khác biệt với các nước lân cận, ở mức 23,8%-41,7% [86,87]. Tỷ suất mắc mới CKD dao động từ 13,2-43,8 ca/1000 người-năm với các nghiên cứu chẩn đoán theo eGFR, và cao hơn ở mức 42,4-149,3 ca/1000 người-năm ở các nghiên cứu kết hợp tiêu chí protein niệu [88–91]. Nghiên cứu của Mai Trọng Trí trên 219 bệnh nhân ĐTĐ típ 2 tại Việt Nam cho kết quả tỷ suất mắc mới 53,2 ca/1000 người-năm, cao hơn mức 29,6 trong một nghiên cứu tại Đài Loan [92,93]. Một nghiên cứu tại Hoa Kỳ cho thấy tỷ lệ CKD trên bệnh nhân ĐTĐ có xu hướng giảm theo thời gian nhờ những tiến bộ trong điều trị làm giảm nguy cơ tiến triển CKD, tuy nhiên kết quả này cần được đánh giá thêm [94].
THA cũng là một nguyên nhân phổ biến của bệnh thận mạn. Tỷ lệ hiện mắc CKD trên nền THA nhìn chung ít dao động hơn, chủ yếu ở mức 17,6%-33,5% [95,96], trong đó có một nghiên cứu tại Việt Nam cho kết quả 18,1% [97]. Tỷ lệ hiện mắc CKD cao nhất được ghi nhận trong nghiên cứu tại Ai Cập năm 2022 (33,5%) và thấp nhất tại Nigeria năm 2021 (3,5%) trên nhóm phụ nữ sau sinh 1 năm. Tỷ suất mắc mới CKD trên nền THA được báo cáo từ 31,7-46,6 ca/1000 người-năm [98,99]. Một số nghiên cứu ghi nhận tỷ lệ đồng mắc CKD và THA, hoặc đang sử dụng thuốc hạ áp có thể lên tới hơn 90%, và tỷ suất tử vong trong nhóm này dao động từ 22,4-134 ca/1000 người-năm [14,32].
IV. BÀN LUẬN
Nghiên cứu đã tổng hợp dữ liệu được báo cáo tại hơn 70 quốc gia trên tất cả các châu lục (trừ Châu Nam Cực), bao phủ hơn 90% dân số toàn cầu. Nhìn chung, các số liệu trên cho thấy bức tranh dịch tễ học của bệnh thận mạn rất đa dạng giữa các khu vực và nhóm dân số. Trong đó, sự đa dạng và thiếu dữ liệu tại Việt Nam nhấn mạnh tầm quan trọng của việc xây dựng một hệ thống giám sát CKD chuẩn hóa tại nước ta để có được dữ liệu chính xác và đáng tin cậy cũng như có những căn cứ cho việc xây dựng chính sách can thiệp giảm gánh nặng của CKD.
Các dữ liệu cập nhật gần đây nhất cho thấy tỷ lệ hiện mắc CKD ước tính có thể lên đến 10-13,4% dân số thế giới [7,100], và kết quả từ các nghiên cứu được tổng hợp rất dao động so với ước tính này. Với tiêu chí mắc mới và tử vong liên quan CKD, chúng tôi chỉ áp dụng chỉ số tỷ suất để loại bỏ ảnh hưởng của việc các nghiên cứu theo dõi các quần thể khác nhau trong những khung thời gian khác nhau. Dù chưa có dữ liệu chuẩn hoá đáng tin cậy cho tỷ suất mắc mới và tỷ suất tử vong toàn cầu, kết quả chúng tôi tổng hợp được cũng cho thấy sự đa dạng. Việc xác định tỷ suất mắc mới và tỷ suất tử vong đòi hỏi theo dõi bệnh nhân trong một khoảng thời gian đủ dài, nên thiết kết của các nghiên cứu này cũng thường chặt chẽ hơn và các yếu tố ảnh hưởng cũng được kiểm soát tốt hơn so với các nghiên cứu xác định tỷ lệ hiện mắc, thường chỉ là các nghiên cứu mô tả cắt ngang. Do đó, tỷ suất mắc mới và tử vong ít dao động hơn so với tỷ lệ hiện mắc, đặc biệt khi so sánh trong cùng một quốc gia hay cùng một khu vực. Dù vẫn có một số giá trị trội, nhưng hầu hết có thể được giải thích dựa vào đặc điểm quần thể. Ví dụ như tỷ suất tử vong cao nhất được ghi nhận trong một nghiên cứu tại Hàn Quốc (134/1000 người-năm), khi quần thể nghiên cứu có tới 90,6% mắc THA và 56,0% mắc ĐTĐ, đi kèm với 25,6% có tiền sử tim mạch [32]; tỷ suất mắc mới cao được ghi nhận ở một quần thể nhỏ người dân Nhật Bản phải chịu ảnh hưởng của trận sóng thần 2011 [26]. Tỷ lệ mắc CKD ở phụ nữ cao hơn nam giới khoảng 30%, nên các nghiên cứu tại Iran trên quần thể chủ yếu là nữ cho kết quả tỷ suất mắc mới cao hơn mặt bằng chung [63,101].
Nguyên nhân trước nhất cho sự khác biệt giữa các nghiên cứu là việc có nhiều tiêu chí chẩn đoán CKD được áp dụng, chẳng hạn như việc chỉ dựa trên một giá trị eGFR cho ra số ca mắc cao hơn đáng kể so với việc đo lặp lại, hay việc kết hợp thêm chỉ số protein niệu cũng làm số ca được xác định tăng thêm. Một nghiên cứu tại Đan Mạch chỉ ra số ca CKD có thể giảm 44,3% nếu đo lặp lại eGFR, thậm chí giảm tới 90,7% khi sử dụng tiêu chí là mã ICD [102]. Trong nghiên cứu của chúng tôi, mã ICD được sử dụng hạn chế, chủ yếu trong trường hợp bệnh nhân mắc bệnh thận mạn đồng thời cùng nhiều bệnh mạn tính khác, chỉ một nghiên cứu trên quần thể dân số chung cho kết quả tỷ lệ hiện mắc CKD thấp ở mức 1,0% [103]. Như vậy, tiêu chí xác định CKD là một yếu tố rất quan trọng quyết định đến kết quả nghiên cứu và luôn cần được bàn luận kỹ lưỡng để phiên giải kết quả phù hợp nhất.
Ngoài ra, sự khác nhau về lứa tuổi, chẳng hạn nghiên cứu trên người từ 18 tuổi và nghiên cứu trên người từ 40 tuổi cũng cho sự khác biệt, do ảnh hưởng của tuổi tác và các bệnh lý nền. ĐTĐ và THA là hai yếu tố nguy cơ quan trọng của CKD, nên tỷ lệ hiện mắc, tỷ suất mắc mới và cả tỷ suất tử vong có xu hướng tăng cùng với tỷ lệ mắc hai bệnh lý này trong quần thể nghiên cứu [67,104–107]. Hơn nữa, CKD có liên quan chặt chẽ tới nguy cơ biến cố tim mạch, gây ra chuỗi bệnh lý liên quan làm nặng thêm tình trạng sức khỏe tổng thể. Sự chồng lấp giữa các yếu tố nguy cơ như tuổi cao, béo phì, rối loạn lipid máu, và lối sống không lành mạnh càng làm tăng nguy cơ tiến triển CKD, cũng như nguy cơ trong nhóm bệnh nhân ĐTĐ và THA [13,108–110]. Do đó, việc kiểm soát tốt đường huyết, huyết áp và quản lý tốt các bệnh này cũng đóng vai trò quan trọng trong giảm thiểu nguy cơ mắc và ngăn chặn tiến triển xấu của tình trạng suy thận mạn.
Nghiên cứu của chúng tôi có một số hạn chế. Thứ nhất, dữ liệu nghiên cứu quá đa dạng do sự khác biệt về thiết kế nghiên cứu, đặc điểm quần thể nghiên cứu khiến cho việc kết luận về gánh nặng bệnh thận mạn khó có thể thực hiện được. Bên cạnh đó, việc so sánh tình hình bệnh giữa các quốc gia, các khu vực cũng không hợp lý trong trường hợp này. Thứ hai, nhiều nghiên cứu không được thiết kế để đo lường tỷ lệ mắc, tỷ suất mắc hay tỷ suất tử vong do CKD mà chỉ coi đây là đầu ra thứ phát. Điều này có thể dẫn đến nguy cơ sai lệch do quần thể nghiên cứu không đại diện cho quần thể chung, đặc biệt với các nghiên cứu có nhóm đối chứng; và để khắc phục, chúng tôi đã loại đi các nghiên cứu sử dụng kỹ thuật ghép cặp mà loại đi những người không được ghép. Thứ ba, việc định nghĩa quần thể chung và quần thể nguy cơ có thể chưa rõ ràng, vì các nghiên cứu có thể tuyển bệnh nhân ở ngưỡng tuổi đầu vào khác nhau, dẫn đến đặc điểm bệnh tật ban đầu là không thống nhất giữa các quần thể được coi là chung (general). Bên cạnh đó, có những yếu tố tiềm ẩn như yếu tố gene, chế độ ăn mà chúng tôi không thể kiểm soát được, dẫn tới việc gánh nặng bệnh có thể được ước tính cao hơn thực tế. Tuy vậy, kết quả nghiên cứu của chúng tôi vẫn đảm bảo cung cấp thông tin một cách đa dạng, toàn diện về gánh nặng bệnh thận mạn trên phạm vi toàn cầu, góp phần định hướng cho chiến lược quản lý bệnh trong tương lai.
V. KẾT LUẬN
Các nghiên cứu trên thế giới rất khác nhau về đối tượng nghiên cứu cũng như tiêu chí xác định CKD, dẫn tới mô tả thực trạng bệnh rất khác nhau. Tuy nhiên, vẫn có thể nhận thấy gánh nặng lớn của bệnh thận mạn trên quy mô toàn cầu cũng như tại Việt Nam trên cả phương diện tỷ lệ hiện mắc, tỷ suất mắc mới và tỷ suất tử vong. Do đó, cần có những chiến lược y tế toàn diện trong tương lai để giảm thiểu những gánh nặng này trong tương lai.
TÀI LIỆU THAM KHẢO
1. Bello AK, Okpechi IG, Levin A, Ye F, Saad S, Zaidi D, Houston G, Damster S, Arruebo S, Abu-Alfa A, Ashuntantang G, Caskey FJ, Cho Y, Coppo R, Davids R, Davison S, Gaipov A, Htay H, Jindal K, Lalji R, Madero M, Osman MA, Parekh R, See E, Shah DS, Sozio S, Suzuki Y, Tesar V, Tonelli M, Wainstein M, Wong M, Yeung E, Johnson DW. ISN–Global Kidney Health Atlas: A Report by the International Society of Nephrology: An Assessment of Global Kidney Health Care Status Focussing on Capacity, Availability, Accessibility, Affordability and Outcomes of Kidney Disease.; 2023.
2. Bello AK, Okpechi IG, Levin A, et al. An update on the global disparities in kidney disease burden and care across world countries and regions. The Lancet Global Health. 2024;12(3):e382-e395. doi:10.1016/S2214-109X(23)00570-3
3. Bikbov B, Purcell CA, Levey AS, et al. Global, regional, and national burden of chronic kidney disease, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017. The Lancet. 2020;395(10225):709-733. doi:10.1016/S0140-6736(20)30045-3
4. Li Y, Ning Y, Shen B, et al. Temporal trends in prevalence and mortality for chronic kidney disease in China from 1990 to 2019: an analysis of the Global Burden of Disease Study 2019. Clinical Kidney Journal. 2023;16(2):312-321. doi:10.1093/ckj/sfac218
5. Shahbazi F, Doosti-Irani A, Soltanian A, Poorolajal J. Global forecasting of chronic kidney disease mortality rates and numbers with the generalized additive model. BMC Nephrol. 2024;25(1):286. doi:10.1186/s12882-024-03720-w
6. Feng X, Hou N, Chen Z, et al. Secular trends of epidemiologic patterns of chronic kidney disease over three decades: an updated analysis of the Global Burden of Disease Study 2019. BMJ Open. 2023;13(3):e064540. doi:10.1136/bmjopen-2022-064540
7. Kovesdy CP. Epidemiology of chronic kidney disease: an update 2022. Kidney Int Suppl (2011). 2022;12(1):7-11. doi:10.1016/j.kisu.2021.11.003
8. Fox CS. Predictors of New-Onset Kidney Disease in a Community-Based Population. JAMA. 2004;291(7):844. doi:10.1001/jama.291.7.844
9. Kampmann JD, Heaf JG, Mogensen CB, Mickley H, Wolff DL, Brandt F. Prevalence and incidence of chronic kidney disease stage 3–5 – results from KidDiCo. BMC Nephrol. 2023;24(1):17. doi:10.1186/s12882-023-03056-x
10. Van Blijderveen JC, Straus SM, Zietse R, Stricker BH, Sturkenboom MC, Verhamme KM. A population-based study on the prevalence and incidence of chronic kidney disease in the Netherlands. Int Urol Nephrol. 2014;46(3):583-592. doi:10.1007/s11255-013-0563-3
11. Page MJ, McKenzie JE, Bossuyt PM, et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ. Published online March 29, 2021:n71. doi:10.1136/bmj.n71
12. Raman M, Green D, Middleton RJ, Kalra PA. Comparing the impact of older age on outcome in chronic kidney disease of different etiologies: a prospective cohort study. J Nephrol. 2018;31(6):931-939. doi:10.1007/s40620-018-0529-8
13. Österman J, Al‐Sodany E, Haugen Löfman I, Barany P, Evans M. Heart failure: the grim reaper of the cardio‐renal‐metabolic triad. ESC Heart Failure. 2024;11(4):2334-2343. doi:10.1002/ehf2.14810
14. Steinbrenner I, Kotsis F, Kosch R, et al. Interactive exploration of adverse events and multimorbidity in CKD. Nephrology Dialysis Transplantation. 2024;39(12):2016-2024. doi:10.1093/ndt/gfae092
15. He J, Mills KT, Appel LJ, et al. Urinary Sodium and Potassium Excretion and CKD Progression. Journal of the American Society of Nephrology. 2016;27(4):1202-1212. doi:10.1681/ASN.2015010022
16. Levey AS, De Jong PE, Coresh J, et al. The definition, classification, and prognosis of chronic kidney disease: a KDIGO Controversies Conference report. Kidney International. 2011;80(1):17-28. doi:10.1038/ki.2010.483
17. Alemu H, Hailu W, Adane A. Prevalence of Chronic Kidney Disease and Associated Factors among Patients with Diabetes in Northwest Ethiopia: A Hospital-Based Cross-Sectional Study. Current Therapeutic Research. 2020;92:100578. doi:10.1016/j.curtheres.2020.100578
18. Fraser SDS, Aitken G, Taal MW, et al. Exploration of Chronic Kidney Disease Prevalence Estimates Using New Measures of Kidney Function in the Health Survey for England. Zanetta DMT, ed. PLoS ONE. 2015;10(2):e0118676. doi:10.1371/journal.pone.0118676
19. Duan JY, Liu DW, Pan SK, Zhao ZH, Liu ZS. [Prevalence and risk factors of chronic kidney disease in diabetic population aged over 40 years in Henan province]. Zhonghua Yi Xue Za Zhi. 2023;103(6):442-448. doi:10.3760/cma.j.cn112137-20220914-01939
20. Dai D, Chang Y, Chen Y, et al. Visceral Adiposity Index and Lipid Accumulation Product Index: Two Alternate Body Indices to Identify Chronic Kidney Disease among the Rural Population in Northeast China. IJERPH. 2016;13(12):1231. doi:10.3390/ijerph13121231
21. Jiang B, Tang D, Dai N, et al. Association of Self-Reported Nighttime Sleep Duration with Chronic Kidney Disease: China Health and Retirement Longitudinal Study. Am J Nephrol. 2023;54(7-8):249-257. doi:10.1159/000531261
22. Heda R, Yazawa M, Shi M, et al. Non-alcoholic fatty liver and chronic kidney disease: Retrospect, introspect, and prospect. World J Gastroenterol. 2021;27(17):1864-1882. doi:10.3748/wjg.v27.i17.1864
23. Kiuchi Y, Tsutsumimoto K, Nishimoto K, et al. Association between dietary diversity and chronic kidney disease in community-dwelling older adults. Eur Geriatr Med. 2024;15(2):545-552. doi:10.1007/s41999-023-00927-2
24. Kobayashi A, Hirano K, Okuda T, Ikenoue T, Yokoo T, Fukuma S. Estimating the prevalence of chronic kidney disease in the older population using health screening data in Japan. Clin Exp Nephrol. 2025;29(3):276-282. doi:10.1007/s10157-024-02570-y
25. Kubo S, Imano H, Muraki I, et al. Total protein intake and subsequent risk of chronic kidney disease: the Circulatory Risk in Communities Study. Environ Health Prev Med. 2023;28:32. doi:10.1265/ehpm.22-00247
26. Hayashi Y, Nagai M, Ohira T, et al. The impact of evacuation on the incidence of chronic kidney disease after the Great East Japan Earthquake: The Fukushima Health Management Survey. Clin Exp Nephrol. 2017;21(6):995-1002. doi:10.1007/s10157-017-1395-8
27. Iseki K, Kinjo K, Iseki C, Takishita S. Relationship between predicted creatinine clearance and proteinuria and the risk of developing ESRD in Okinawa, Japan. Am J Kidney Dis. 2004;44(5):806-814.
28. Fang Y, Lee H, Son S, et al. Association between Consumption of Dietary Supplements and Chronic Kidney Disease Prevalence: Results of the Korean Nationwide Population-Based Survey. Nutrients. 2023;15(4):822. doi:10.3390/nu15040822
29. Noh JH, Koo H. Older menarche age and short reproductive period linked to chronic kidney disease risk. Medicine. 2019;98(18):e15511. doi:10.1097/MD.0000000000015511
30. Chang Y, Ryu S, Choi Y, et al. Metabolically Healthy Obesity and Development of Chronic Kidney Disease: A Cohort Study. Ann Intern Med. 2016;164(5):305-312. doi:10.7326/M15-1323
31. Zhang HS, An S, Ahn C, Park SK, Park B. Obesity measures at baseline, their trajectories over time, and the incidence of chronic kidney disease: A 14 year cohort study among Korean adults. Nutrition, Metabolism and Cardiovascular Diseases. 2021;31(3):782-792. doi:10.1016/j.numecd.2020.10.021
32. Kim KM, Oh HJ, Choi HY, Lee H, Ryu DR. Impact of chronic kidney disease on mortality: A nationwide cohort study. Kidney Res Clin Pract. 2019;38(3):382-390. doi:10.23876/j.krcp.18.0128
33. Castelino RL, Saunder T, Kitsos A, et al. Quality use of medicines in patients with chronic kidney disease. BMC Nephrol. 2020;21(1):216. doi:10.1186/s12882-020-01862-1
34. Jose MD, Cuthbertson L, Burgess J, et al. Island medicine longitudinal cohort study: Rapid rise in chronic kidney disease in rural and remote communities. Nephrology. 2024;29(7):429-437. doi:10.1111/nep.14296
35. Võ HN, Nguyễn NN, Mai HNT, Nguyễn TB, Lâm PT. TỶ LỆ VÀ CÁC YẾU TỐ NGUY CƠ BỆNH THẬN MẠN TẠI THÀNH PHỐ CẦN THƠ NĂM 2022-2023. ctump. 2024;(72):171-179. doi:10.58490/ctump.2024i72.2351
36. Vo NH, Pham BV, Nguyen NN, Nguyen BT. A Predictive Nomogram for Selective Screening of Chronic Kidney Disease: A Population-Based Study. Can J Kidney Health Dis. 2025;12:20543581241309979. doi:10.1177/20543581241309979
37. Roy D, Pande S, Thalanki S, et al. Hip fractures in elderly patients with non-dialysis dependent chronic kidney disease: Outcomes in a Southeast Asian population. Medicine. 2021;100(27):e26625. doi:10.1097/MD.0000000000026625
38. Nusinovici S, Li H, Chong C, et al. Blood biomarkers improve the prediction of prevalent and incident severe chronic kidney disease. J Nephrol. 2024;37(4):1007-1016. doi:10.1007/s40620-023-01872-w
39. Lim CC, Teo BW, Ong PG, et al. Chronic kidney disease, cardiovascular disease and mortality: A prospective cohort study in a multi-ethnic Asian population. Eur J Prev Cardiolog. 2015;22(8):1018-1026. doi:10.1177/2047487314536873
40. Farag YMK, Karai Subramanian K, Singh VA, Tatapudi RR, Singh AK. Occupational risk factors for chronic kidney disease in Andhra Pradesh: ‘Uddanam Nephropathy.’ Renal Failure. 2020;42(1):1032-1041. doi:10.1080/0886022X.2020.1824924
41. Singh PS, Sharma H, Zafar KS, et al. Prevalence of type 2 diabetes mellitus in rural population of India- a study from Western Uttar Pradesh. Int J Res Med Sci. 2017;5(4):1363. doi:10.18203/2320-6012.ijrms20171227
42. Kuo PF, Huang YT, Chuang MH, Jiang MY. Association of low-level heavy metal exposure with risk of chronic kidney disease and long-term mortality. Yang J, ed. PLoS ONE. 2024;19(12):e0315688. doi:10.1371/journal.pone.0315688
43. Kibria GMA, Crispen R. Prevalence and trends of chronic kidney disease and its risk factors among US adults: An analysis of NHANES 2003-18. Preventive Medicine Reports. 2020;20:101193. doi:10.1016/j.pmedr.2020.101193
44. Paluch AE, Pool LR, Isakova T, et al. Association of Fitness With Racial Differences in Chronic Kidney Disease. American Journal of Preventive Medicine. 2019;57(1):68-76. doi:10.1016/j.amepre.2019.02.016
45. Kokkinos P, Faselis C, Myers J, et al. Exercise Capacity and Risk of Chronic Kidney Disease in US Veterans: A Cohort Study. Mayo Clinic Proceedings. 2015;90(4):461-468. doi:10.1016/j.mayocp.2015.01.013
46. Yan LJ, Zhang FR, Zeng YR, Zheng Y. Serum Folate and All-Cause Mortality is of Non-Linear Relationship Among Population with Chronic Kidney Disease: A Retrospective Cohort Study. IJGM. 2021;Volume 14:2695-2702. doi:10.2147/IJGM.S314904
47. Beddhu S, Wei G, Marcus RL, Chonchol M, Greene T. Light-Intensity Physical Activities and Mortality in the United States General Population and CKD Subpopulation. Clinical Journal of the American Society of Nephrology. 2015;10(7):1145-1153. doi:10.2215/CJN.08410814
48. Hirst JA, Hill N, O’Callaghan CA, et al. Prevalence of chronic kidney disease in the community using data from OxRen: a UK population-based cohort study. Br J Gen Pract. 2020;70(693):e285-e293. doi:10.3399/bjgp20X708245
49. He Y, Wang J, Zhang W, et al. Device‐Measured Physical Activity, Sedentary Behaviour and Risk of Chronic Kidney Diseases Across Levels of Grip Strength. J cachexia sarcopenia muscle. 2025;16(1):e13726. doi:10.1002/jcsm.13726
50. Zhang H, Wang B, Chen C, et al. Sleep Patterns, Genetic Susceptibility, and Incident Chronic Kidney Disease: A Prospective Study of 370 671 Participants. Front Neurosci. 2022;16:725478. doi:10.3389/fnins.2022.725478
51. Furuland H, McEwan P, Evans M, et al. Serum potassium as a predictor of adverse clinical outcomes in patients with chronic kidney disease: new risk equations using the UK clinical practice research datalink. BMC Nephrol. 2018;19(1):211. doi:10.1186/s12882-018-1007-1
52. Zhang R, Ren S, Mi H, et al. Fatty liver index as an independent predictor of all-cause and disease-specific mortality. European Journal of Gastroenterology & Hepatology. 2024;36(12):1453-1463. doi:10.1097/MEG.0000000000002865
53. Perez-Monteoliva NRR, Felix FJ, Lozano L, Miranda I, Fernandez-Berges D, Macías JF. The H.U.G.E. formula (hematocrit, urea, sex) for screening chronic kidney disease (CKD) in an age-stratified general population. The Journal of nutrition, health and aging. 2015;19(6):688-692. doi:10.1007/s12603-015-0504-1
54. Llisterri JL, Micó-Pérez RM, Velilla-Zancada S, et al. Prevalencia de la enfermedad renal crónica y factores asociados en la población asistida en atención primaria de España: resultados del estudio IBERICAN. Medicina Clínica. 2021;156(4):157-165. doi:10.1016/j.medcli.2020.03.005
55. Escobar C, Aranda U, Palacios B, et al. Epidemiology, clinical profile, management, and two-year risk complications among patients with chronic kidney disease in Spain. Nefrología. 2021;41(6):670-688. doi:10.1016/j.nefro.2021.03.006
56. Cook S, Solbu MD, Eggen AE, et al. Comparing prevalence of chronic kidney disease and its risk factors between population-based surveys in Russia and Norway. BMC Nephrol. 2022;23(1):145. doi:10.1186/s12882-022-02738-2
57. Perregaard H, Damholt MB, Solgaard S, Petersen MB. Renal function after elective total hip replacement: Incidence of acute kidney injury and prevalence of chronic kidney disease. Acta Orthopaedica. 2016;87(3):235-238. doi:10.3109/17453674.2016.1155130
58. Xu H, Kuja-Halkola R, Chen X, Magnusson PKE, Svensson P, Carrero JJ. Higher body mass index is associated with incident diabetes and chronic kidney disease independent of genetic confounding. Kidney International. 2019;95(5):1225-1233. doi:10.1016/j.kint.2018.12.019
59. Vestergaard AHS, Jensen SK, Heide-Jørgensen U, Ladefoged SA, Birn H, Christiansen CF. Sex-specific temporal trends in incidence and prevalence of chronic kidney disease: a Danish population-based cohort study. Clinical Kidney Journal. 2025;18(1):sfae351. doi:10.1093/ckj/sfae351
60. Alshehri MA, Alkhlady HY, Awan ZA, et al. Prevalence of chronic kidney disease in Saudi Arabia: an epidemiological population-based study. BMC Nephrol. 2025;26(1):37. doi:10.1186/s12882-025-03954-2
61. Naghibi M, Mojahedi MJ, Jarrahi L, et al. Prevalence of chronic kidney disease and its risk factors in Gonabad, Iran. Iran J Kidney Dis. 2015;9(6):449-453.
62. Saber A, Naghibzadeh Tahami A, Najafipour H, Azmandian J. Assessment of Prevalence of Chronic Kidney Disease and Its Predisposing Factors in Kerman City. Nephrourol Mon. 2017;9(2). doi:10.5812/numonthly.41794
63. Farahmand M, Ramezani Tehrani F, Khalili D, Cheraghi L, Azizi F. Endogenous estrogen exposure and chronic kidney disease; a 15-year prospective cohort study. BMC Endocr Disord. 2021;21(1):155. doi:10.1186/s12902-021-00817-3
64. Mirmiran P, Yuzbashian E, Rahbarinejad P, Asghari G, Azizi F. Dietary intakes of total polyphenol and its subclasses in association with the incidence of chronic kidney diseases: a prospective population-based cohort study. BMC Nephrol. 2021;22(1):84. doi:10.1186/s12882-021-02286-1
65. the Ilorin Renal Study Group, Olanrewaju TO, Aderibigbe A, et al. Prevalence of chronic kidney disease and risk factors in North-Central Nigeria: a population-based survey. BMC Nephrol. 2020;21(1):467. doi:10.1186/s12882-020-02126-8
66. Wachukwu CM, Emem-Chioma PC, Wokoma FS, Oko-Jaja RI. Pattern and outcome of renal admissions at the University of Port Harcourt Teaching Hospital, Nigeria: A 4 years review. Ann Afr Med. 2016;15(2):63-68. doi:10.4103/1596-3519.172559
67. Rosales Gonzalez E, Yogeswaran P, Chandia J, Pulido Estrada GA, Adeniyi OV. Kidney damage and associated risk factors in the rural Eastern Cape, South Africa: A cross-sectional study. Bello IS, ed. PLoS ONE. 2024;19(9):e0292416. doi:10.1371/journal.pone.0292416
68. Peer N, George J, Lombard C, Steyn K, Levitt N, Kengne AP. Prevalence, concordance and associations of chronic kidney disease by five estimators in South Africa. BMC Nephrol. 2020;21(1):372. doi:10.1186/s12882-020-02018-x
69. Garcia-Garcia G, Gutiérrez-Padilla A, Perez-Gomez HR, et al. Chronic kidney disease of unknown cause in Mexico: The case of Poncitlan, Jalisco. CN. 2020;93(1):42-48. doi:10.5414/CNP92S107
70. Eguiguren-Jiménez L, Miles J, Ocampo J, Andrade JM. Prevalence and associated risk factors of chronic kidney disease: A case study within SIME clinics in Quito, Ecuador 2019–2021. Front Med. 2022;9:908551. doi:10.3389/fmed.2022.908551
71. Krajčoviechová A, Wohlfahrt P, Bruthans J, et al. Longitudinal trends in the prevalence of hyperuricaemia and chronic kidney disease in hypertensive and normotensive adults. Blood Press. 2020;29(5):308-318. doi:10.1080/08037051.2020.1763158
72. Al Kibria GM, Hasan MdZ. Income disparities in prevalence and trends of chronic kidney disease among US adults, 2003–18. J Public Health (Berl). 2022;30(9):2181-2189. doi:10.1007/s10389-021-01505-1
73. Mehta K, Randall S, Lee CMY, et al. Prevalence of chronic kidney disease in Western Australia, 2010–2020. BMJ Open. 2025;15(1):e092320. doi:10.1136/bmjopen-2024-092320
74. Gomes MB, Negrato CA. Type 1 diabetes in Brazil: a narrative overview of the Brazilian Type 1 Diabetes Study Group. Diabetol Metab Syndr. 2025;17(1):166. doi:10.1186/s13098-025-01708-6
75. Thorn LM, Gordin D, Harjutsalo V, et al. The Presence and Consequence of Nonalbuminuric Chronic Kidney Disease in Patients With Type 1 Diabetes. Diabetes Care. 2015;38(11):2128-2133. doi:10.2337/dc15-0641
76. Luo Y, Bai R. Analysis of correlation between dietary fiber intake and risk of diabetic kidney disease in adults with type 2 diabetes mellitus: results from the United States National Health and Nutrition Examination Surveys 2009–2018. Renal Failure. 2025;47(1):2479573. doi:10.1080/0886022X.2025.2479573
77. Pathak RD, Schroeder EB, Seaquist ER, et al. Severe Hypoglycemia Requiring Medical Intervention in a Large Cohort of Adults With Diabetes Receiving Care in U.S. Integrated Health Care Delivery Systems: 2005–2011. Diabetes Care. 2016;39(3):363-370. doi:10.2337/dc15-0858
78. Salinero-Fort MÁ, San Andrés-Rebollo FJ, de Burgos-Lunar C, Arrieta-Blanco FJ, Gómez-Campelo P, MADIABETES Group. Four-year incidence of diabetic retinopathy in a Spanish cohort: the MADIABETES study. PLoS One. 2013;8(10):e76417. doi:10.1371/journal.pone.0076417
79. Calvo-Hueros JI, Martín-Hidalgo-Barquero MV, Morales-Gabardino JA, Buitrago F. Chronic kidney disease prevalence and cardiovascular risk in a cohort of patients with type 2 diabetes followed for 10 years in Badajoz (Spain). An observational study. Prim Care Diabetes. 2021;15(2):391-396. doi:10.1016/j.pcd.2020.11.015
80. Izumihara R, Nomoto H, Kito K, et al. Switching from Conventional Fibrates to Pemafibrate Has Beneficial Effects on the Renal Function of Diabetic Subjects with Chronic Kidney Disease. Diabetes Metab J. 2024;48(3):473-481. doi:10.4093/dmj.2023.0370
81. Zhang Z, Cui T, Cui M, Kong X. High prevalence of chronic kidney disease among patients with diabetic foot: A cross‐sectional study at a tertiary hospital in China. Nephrology. 2020;25(2):150-155. doi:10.1111/nep.13596
82. Chen MY, Wang AP, Wang JW, et al. Coexistence of hyper-uricaemia and low urinary uric acid excretion further increases risk of chronic kidney disease in type 2 diabetes. Diabetes & Metabolism. 2019;45(6):557-563. doi:10.1016/j.diabet.2019.03.001
83. Yun J ‐S., Ahn Y ‐B., Song K ‐H., et al. Lipoprotein(a) predicts a new onset of chronic kidney disease in people with Type 2 diabetes mellitus. Diabet Med. 2016;33(5):639-643. doi:10.1111/dme.12862
84. Hong YS, Kim H, Zhao D, Cho A. Chronic Kidney Disease on Health-Related Quality of Life in Patients with Diabetes Mellitus: A National Representative Study. JCM. 2021;10(20):4639. doi:10.3390/jcm10204639
85. Zaman SB, Gupta RD, Pramual P, et al. The burden of chronic kidney disease among people with diabetes by insurance schemes: Findings from a primary referral hospital in Thailand. Diabetes Epidemiology and Management. 2021;4:100026. doi:10.1016/j.deman.2021.100026
86. Phan Thanh Sơn. Khảo Sát Nguy Cơ Tiến Triển Bệnh Thận Mạn Tính Giai Đoạn Cuối Của Bệnh Nhân Đái Tháo Đường Typ 2 Theo KDIGO 2012. ĐH Y Hà Nội; 2020.
87. Nguyễn Kim Chi. Đặc Điểm Lâm Sàng, Cận Lâm Sàng và Một Số Yếu Tố Liên Quan Bệnh Thận Mạn ở Bệnh Nhân Đái Tháo Đường Típ 2. ĐH Y Dược Tp Hồ Chí Minh; 2020.
88. Moazzeni SS, Arani RH, Hasheminia M, Tohidi M, Azizi F, Hadaegh F. High Incidence of Chronic Kidney Disease among Iranian Diabetic Adults: Using CKD-EPI and MDRD Equations for Estimated Glomerular Filtration Rate. Diabetes Metab J. 2021;45(5):684-697. doi:10.4093/dmj.2020.0109
89. Gurudas S, Nugawela M, Prevost AT, et al. Development and validation of resource-driven risk prediction models for incident chronic kidney disease in type 2 diabetes. Sci Rep. 2021;11(1):13654. doi:10.1038/s41598-021-93096-w
90. Hansen AL, Christiansen CF, Brøns C, et al. Birthweight and risk of chronic kidney disease after a type 2 diabetes diagnosis in the DD2 cohort. Diabetologia. 2025;68(4):778-791. doi:10.1007/s00125-024-06357-4
91. Yu MK, Katon W, Young BA. Associations between sex and incident chronic kidney disease in a prospective diabetic cohort. Nephrology (Carlton). 2015;20(7):451-458. doi:10.1111/nep.12468
92. Mai Trọng Trí. Khảo Sát Tỉ Lệ Mới Mắc và Mối Tương Quan Giữa Bệnh Thận Mạn và Bệnh Võng Mạc Trên Bệnh Nhân Đái Tháo Đường Típ 2. ĐH Y Dược Tp Hồ Chí Minh; 2023.
93. Li PI, Wang JN, Guo HR. Long-term quality-of-care score predicts incident chronic kidney disease in patients with type 2 diabetes. Nephrology Dialysis Transplantation. 2018;33(11):2012-2019. doi:10.1093/ndt/gfx375
94. Vijayakumar P, Hoyer A, Nelson RG, Brinks R, Pavkov ME. Estimation of chronic kidney disease incidence from prevalence and mortality data in American Indians with type 2 diabetes. PLoS One. 2017;12(2):e0171027. doi:10.1371/journal.pone.0171027
95. Nagib SN, Abdelwahab S, Amin GEED, Allam MF. What is the prevalence of chronic kidney disease among hypertensive non-diabetic Egyptian patients attending primary healthcare? Clinical and Experimental Hypertension. 2023;45(1):2203411. doi:10.1080/10641963.2023.2203411
96. Hunegnaw A, Mekonnen HS, Techane MA, Agegnehu CD. Prevalence and Associated Factors of Chronic Kidney Disease among Adult Hypertensive Patients at Northwest Amhara Referral Hospitals, Northwest Ethiopia, 2020. Int J Hypertens. 2021;2021:5515832. doi:10.1155/2021/5515832
97. Nguyễn NN, Phạm VB, Võ HN, Nguyễn TB, Mai HNT, Ngô ĐD. TÌNH HÌNH BỆNH THẬN MẠN VÀ KẾT QUẢ BƯỚC ĐẦU ĐIỀU TRỊ Ở BỆNH NHÂN TĂNG HUYẾT ÁP TẠI THÀNH PHỐ CẦN THƠ: NGHIÊN CỨU THỰC HIỆN TRONG CỘNG ĐỒNG. VMJ. 2024;542(2). doi:10.51298/vmj.v542i2.11123
98. Naderinejad N, Ejtahed HS, Asghari G, Mirmiran P, Azizi F. Dietary Patterns and Risk of Chronic Kidney Disease Among Tehranian Adults with High Blood Pressure. Int J Endocrinol Metab. 2020;18(1):e89709. doi:10.5812/ijem.89709
99. Wang M, Li J, Li Y, et al. The effects of hypertension and diabetes on new-onset chronic kidney disease: A prospective cohort study. J Clin Hypertens (Greenwich). 2020;22(1):39-46. doi:10.1111/jch.13768
100. Hill NR, Fatoba ST, Oke JL, et al. Global Prevalence of Chronic Kidney Disease – A Systematic Review and Meta-Analysis. PLoS One. 2016;11(7):e0158765. doi:10.1371/journal.pone.0158765
101. Bello AK, Levin A, Tonelli M, et al. Assessment of Global Kidney Health Care Status. JAMA. 2017;317(18):1864-1881. doi:10.1001/jama.2017.4046
102. Vestergaard SV, Christiansen CF, Thomsen RW, Birn H, Heide-Jørgensen U. Identification of Patients with CKD in Medical Databases: A Comparison of Different Algorithms. CJASN. 2021;16(4):543-551. doi:10.2215/CJN.15691020
103. Zhakhina G, Mussina K, Yerdessov S, et al. Analysis of chronic kidney disease epidemiology in Kazakhstan using nationwide data for 2014-2020 and forecasting future trends of prevalence and mortality for 2030. Ren Fail. 2024;46(1):2326312. doi:10.1080/0886022X.2024.2326312
104. Anupama YJ, Hegde SN, Uma G, Patil M. Hypertension is an important risk determinant for chronic kidney disease: results from a cross-sectional, observational study from a rural population in South India. J Hum Hypertens. 2017;31(5):327-332. doi:10.1038/jhh.2016.81
105. Tannor EK, Sarfo FS, Mobula LM, Sarfo‐Kantanka O, Adu‐Gyamfi R, Plange‐Rhule J. Prevalence and predictors of chronic kidney disease among Ghanaian patients with hypertension and diabetes mellitus: A multicenter cross‐sectional study. J of Clinical Hypertension. 2019;21(10):1542-1550. doi:10.1111/jch.13672
106. Hapca S, Siddiqui MK, Kwan RSY, et al. The Relationship between AKI and CKD in Patients with Type 2 Diabetes: An Observational Cohort Study. J Am Soc Nephrol. 2021;32(1):138-150. doi:10.1681/ASN.2020030323
107. Tokoroyama T, Ando M, Setoguchi K, Tsuchiya K, Nitta K. Prevalence, incidence and prognosis of chronic kidney disease classified according to current guidelines: a large retrospective cohort study of rheumatoid arthritis patients. Nephrol Dial Transplant. 2017;32(12):2035-2042. doi:10.1093/ndt/gfw315
108. Heo NJ, Rhee SY, Waalen J, Steinhubl S. Chronic kidney disease and undiagnosed atrial fibrillation in individuals with diabetes. Cardiovasc Diabetol. 2020;19(1):157. doi:10.1186/s12933-020-01128-y
109. Wang WH, Chen LW, Lee CC, et al. Association between Parathyroid Hormone, 25 (OH) Vitamin D, and Chronic Kidney Disease: A Population-Based Study. BioMed Research International. 2017;2017:1-9. doi:10.1155/2017/7435657
110. Siebenhofer A, Loder C, Avian A, et al. Prevalence of undetected chronic kidney disease in high-risk middle-aged patients in primary care: a cross-sectional study. Front Med. 2024;11:1412689. doi:10.3389/fmed.2024.1412689







